第三章 官能团的导入、除去、互换及保护
有机合成中有机物官能团的引入消除和转化方法

有机合成中有机物官能团的引入消除和转化方法Document number【SA80SAB-SAA9SYT-SAATC-SA6UT-SA18】有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1)通过加成反应消除不饱和键。
(2)通过消去反应、氧化反应或酯化反应消除羟基(—OH)。
(3)通过加成反应或氧化反应消除醛基(—CHO)。
(4)通过消去反应或水解反应消除卤素原子。
3.官能团的转化 (1)利用衍变关系引入官能团,如卤代烃水解取代伯醇(RCH 2OH)氧化还原醛――→氧化羧酸。
(2)通过不同的反应途径增加官能团的个数,如(3)通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1)有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2)成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1)与HCN 的加成反应(2)加聚或缩聚反应,如n CH 2(3)酯化反应,如CH 3CH 2OH +CH 3COOH 浓 CH 3COOCH 2CH 3+H 2O 。
3.碳链的减短(1)脱羧反应:R —COONa +NaOH ――→CaO△R —H +Na 2CO 3。
(3)水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4)烃的裂化或裂解反应:C 16H 34――→高温C 8H 18+C 8H 16; C 8H 18――→高温C 4H 10+C 4H 8。
合成路线的选择1.中学常见的有机合成路线(2)一元合成路线R —CH=CH 2――→HX 卤代烃――→NaOH 水溶液△一元醇――→氧化一元醛――→氧化一元羧酸―→酯(3)二元合成路线CH 2=CH 2――→X 2CH 2X-CH 2X ――→NaOH 水溶液△二元醇――→氧化二元醛――→氧化二元羧酸→⎩⎪⎨⎪⎧ 链酯环酯高聚酯(3)芳香化合物合成路线:2.有机合成中常见官能团的保护(1)酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH 反应,把—OH 变为—ONa(或—OCH 3)将其保护起来,待氧化后再酸化将其转变为—OH 。
有机合成——官能团的引入转化消除及保护课件高二化学人教版选择性必修3

氧化
CH3-CHO
CH3-COOH
五、官能团的转化(种类、数目和位置的变化)
2、官能团数目变化
原创:WJ化学研究院
CH3CH2-OH 消去
CH2=CH2
加Br2
水解 CH2Br-CH2Br
HO-CH2CH2-OH
3、官能团位置变化
消去
CH3CH2CH2-Br
CH3CH=CH2
加HBr CH3CH-CH3 Br
卤素原子 烯烃(炔烃)的加成 烷烃(苯及苯的同系物)的取代 醇(酚)的取代
羟基 烯烃与水的加成 酯的水解 卤代烃的水解 醛、酮的加氢
醛基 炔烃水化 烯烃氧化 伯醇的催化氧化 糖类水解
羧基 烯炔烃、苯的同系物、醛、醇的氧化 酯、酰胺、R-CN的水解
酯基
酯化反应、酰氯醇解
八、练习
原创:WJ化学研究院
1.由苯酚制取
①醇的催化氧化引入碳氧双键
2RCH2OH+O2
催化剂 △
2RCHO+2H2O
2RCH(OH)R'+O2 催化△ 剂2R—C—R+2H2O
O
②某些烯烃被氧化
2CH2=CH2+O2 一定条件 2CH3CHO
①O3
②Zn/H2O OHCCH2CH2CH2CH2CHO
三、引入官能团--碳氧双键
2、引入碳氧双键
4、醛基的保护
醛基可被弱氧化剂氧化,为避免在反应过程中受到影响,保护一般是把 醛基制成缩醛,最后再将缩醛水解得到醛基(常用乙二醇)
缩醛 也可以先生成醇,然后再氧化恢复
四、官能团的保护--氨基的保护
5、氨基(-NH2)的保护
胺基易被O2、O3、H2O2等氧化,一般采用下列方法保护
官能团保护工作,转换和引入

羟基的保护基
• 最常用的醋酸酯保护基一般在温和 的 碱 性 条 件 下 就 可 以 除 去,常 用 的 碱 为 K2CO3、 NH3、 肼、 guanidine、 KCN、 Et3N 或 iPr2NEt 等。 在 水 或 醇 的 体 系 中 ,醋酸酯在酸催化下也能发生水解 或 酯 交 换 除 去, 但 在 无 质 子 性 物 质 参 与 时, 醋 酸 酯 一 般 是 比 较 稳 定 的。
官能团保护工作,转换和引入
羟基的保护基
• 酯类保护基 • 酯 类 保 护 基 的 生 成 (Formation):酯 类
保护基生成方法一般由醇和相应的 酸 酐、 酰 氯 在 吡 啶 或 三 乙 胺 存 在 下, 0-20oC 下 反 应 获 得。 如 果 反 应 过 慢, 可 加 入 催 化 量 4-dimethylaminopyridine (DMA可 以 用 含 氟 试 剂 除 去, 如
通 等
常
用
的
HF/CH3CN、TBAF/THF、HF-Py/CH3CN
官能团保护工作,转换和引入
羟 基 的 保 护 基(硅醚)
•生成反应:通常在二氯甲烷或DMF中,使 用R3SiCl or R3SiOTf为试剂,在三乙胺、吡啶 或咪唑等弱碱存在下生成硅醚保护基。 •TES 可 以 用 来 保 护 - 羟 基 醛、 酮 和 酯, 而 不 会 发 生 消 除 反 应。
官能团保护工作,转换和引入
羟 基 的 保 护 基(硅醚)
• 硅、tBu醚tPBhu2保MSie护(2TSBi基D(TPB主SDoM要r BSP有oSr):T等BMS。)e、3SiiP(Tr3MSiS()T、IPSE)t、3Si (TES) • 对 酸 水 解 的 相 对 稳 定 次 序 为: TMS (1) < TES
第3章 官能团的导入、除去、互换及保护

300 ~ 500oC
CC
+ RCO2H
Applications: Synthesis of terminal alkenes from primary acetates
CH3CH2CH2CH2OCOCH3
500oC N2
CH3CH2CH=CH2
Disadvantages: High reaction temperature
Ph3P-CHR
Stereoselectivity
Stability increase
R = alkyl,EDG R = alkenyl or alkynyl R = EWG
Z- (major) Z / E ( mixture)
E- (major)
• Influence of solvent on the selectivity
第3章 官能团的导入、除去、互换及保护 §3.1 官能团的导入
3.1.1 饱和碳原子上官能团的导入
1. 饱和烃的卤代反应
氢原子的活性为:叔氢>仲氢>伯氢;卤素活性为:F2>Cl2>Br2>I2, 卤素活性越大,其选择性越差。因此,在饱和烃卤代反应中溴代反应最 为常见。
Br2 / hv
r,t.~105℃
• General Scheme
O
R"'
R C R'(H) + X CH +
R"
Ph3P
R C
R' (H)
R"' C
R"
▪ Features
Mild reaction conditions;
The position of the double bond is unambiguous.
有机合成中有机物官能团的引入、消除和转化方法.

有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1通过加成反应消除不饱和键。
(2通过消去反应、氧化反应或酯化反应消除羟基(—OH。
(3通过加成反应或氧化反应消除醛基(—CHO。
(4通过消去反应或水解反应消除卤素原子。
3.官能团的转化(1利用衍变关系引入官能团,如卤代烃伯醇(RCH2OH醛羧酸。
(2通过不同的反应途径增加官能团的个数,如(3通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1与HCN的加成反应(2加聚或缩聚反应,如n CH2(3酯化反应,如CH3CH2OH+CH3COOH浓CH3COOCH2CH3+H2O。
3.碳链的减短(1脱羧反应:R—COONa+NaOHR—H+Na2CO3。
(3水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4烃的裂化或裂解反应:C16H34C8H18+C8H16;C8H18C4H10+C4H8。
合成路线的选择1.中学常见的有机合成路线(1一元合成路线:卤代烃一元醇―→一元醛―→一元羧酸―→酯(2二元合成路线:二元醇―→二元醛―→二元羧酸―→(3芳香化合物合成路线:2.有机合成中常见官能团的保护(1酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH 变为—ONa(或—OCH3将其保护起来,待氧化后再酸化将其转变为—OH。
(2碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
(3氨基(—NH2的保护:如在对硝基甲苯对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2。
chapt3 官能团的保护

第三章 官能团的保护一. 官能团保护的意义及对保护基的要求1. 意义.是对复杂化合物而言的,简单化合物不用保护,复杂化合物由于官能团多(包括种类多,部位多)若要在一个部位选择性的完成一个化学反应,则必须对其他反应部位加以保护封闭,否则反应可能在多部位进行。
关于官能团的保护,前面的内容已部分涉及到。
例:CO 2EtOOH OHOO2Et2MeMgI OOOH+2OOH保护的目的是为了更好地反应,不是为了保护而保护,保护只是手段,保护不该反应的部位,以便在该反应的部位发生反应。
CO 2EtOOH OH O O+2O-CO 2Et 1.2.1.NaNH 23OOHCl 2 存在问题:由于官能团的保护和去保护,实际上使整个反应多了两步,不但费时费力,而且整个收率降低,所以设计合成路线时尽量避免保护基的引入,特别是工业生产。
所以应满足以下要求:<1>容易引入——选择性好、收率高、试剂廉价、专一性 <2>引入保护基后的分子结构能经受往下多反应的条件<3>容易解除保护,不提高分子其它部位、条件温和,不重排异构化、副反应,脱出保护基后的产物易于保护基及附带生成的副产物分离。
本章主要介绍以下几种官能团的保护:羟基、羰基、羧基、氨基 二.羟基的保护——利用成醚、酯加以保护(一)形成醚——甲醚、苄醚、三苯甲醚、四氢吡喃醚、特丁基二甲基硅醚、甲氧基乙氧基甲醚1.甲醚——成醚条件:1)Me 2SO 4/NaOH,Bu 4N +I -2)CH 2N 2/硅酸 0-10℃3)CH 2N 2/HBF 4,CH 2Cl 2,Et 3N,25℃4)CH 3I/固体KOH,DMSO 20℃5)(MeO)2POH/催化剂TSOH,90-100℃ 12h 6)MeO +BF 4-7)CH 3I-Ag 2O醚化条件例:OH+Me 2SO 4NaOHMeOSO 3Na+OCH3CH 2N 2+RCH 2OH RO -RCH 2OCH 3R 2CN 2ArOHR 2CHOAr CH 2N 2ROHHBF 4ROCH 3+++N 2特别是酚羟基一般用MeO -醚保护,反应容易,解脱也容易,醇羟基形成甲醚较稳定,不以脱掉,故少用,在糖类化合物中羟基的保护勿用形成醚。
[化学]有机合成 官能团引入转换和保护
![[化学]有机合成 官能团引入转换和保护](https://img.taocdn.com/s3/m/87b5e5fdce2f0066f53322d8.png)
• 乙炔及末端炔烃中的炔氢较活泼,它 可以与活泼金属`强碱`强氧化剂及有机金 属化合物反应。 • 常用的炔氢保护基为三甲硅基。将炔 烃转变为格氏试剂后同三甲基氯硅烷作用 。即可引入三甲硅基。该保护基对于金属 有机试剂`氧化剂很稳定。可在使用这类 试剂的场合保护炔基。
2.羟基的保护
• 羟基是一个活性基团,它能够分解格氏试 剂和其他有机金属化合物,本身易被氧化, 叔醇还容易脱水,并可以发生烃基化和酰基 化反应。所以在进行某些反应时,若要保留 羟基,就必须将它保护起来。 醇羟基常用的保护方法有3类:
1. NBS
2. NMe3
3. OH -
CH2NMe3 OH
+
O
+ CH2 NMe3 ¶ þ ¼ × ± ½ 二甲苯
OH
-
O
2. 裂解反应:
X R O H :B R O
X = leaving group, e.g. : -OSO2C6H4CH3-p , -OSO2CH3
例:
OTos H H H OTos H
3.氨基的保护
伯胺和仲胺很容易被氧化,且易发生烃 基化,酰基化以及与醛酮羰基的亲核加成反 应。在合成中常采用: (1)氨基质子化 (2)变为酰基衍生物 (3)变为烃基衍生物等方法将氨基保护起 来
3.1
质子化
此方法仅用于防止氨基的氧化,因为理论上说 采用氨基质子化,即占据氮尚未共用电子对,以阻 止取代反应的发生。这是对氨基保护最简单的法。
6.5 卤素
6.6 硝基与氰基
6.7 羰基
6.8 羧基
参考文献: 1、有机合成化学及近代技术,徐家业著,西安石油学院出版社. 2、有机合成,黄宪编,高等教育出版社,1992年第一版. 3、有机合成讲义,许杏祥编,中科院上海有机所,1998年. 4、现代有机合成化学,吴毓林等编,科学出版社,2001年. 5、现代杂环化学选论,史真著,陕西科技出版社,1998年.
第三节官能团的保护

一个合适的保护基应具备下列要求: 1。引入时反应简单、产率高、无 毒(低毒) 2。能经受必要的和尽可能多的试 剂作用。 3。除去时反应简单、产率高,其 它官能团应不受影响。 4。对不同的官能团能选择性保护
R CH CH2OH NH2 KMNO4 H2SO4 R CH COOH NH2
螯合与质子化类似,过渡金属,例如 铜有d空轨道和氮孤对电子形成螯合物 最后用H2S处理除去。 3-2-2酰化 将氨基酰化成酰胺然后再水解。
NH2 O + CH3C Cl OH O NH C CH3
O RN C C O
OH
需要保护的官能团 有:
O C
OH
COOH
NH2
C H
C C
本节主要介绍羟基、羰基、氨基的保护
3-1 羟基的保护(醇、二醇、酚的羟基) 醇的活性较大,与金属反应放出氢气,容 易被氧化、取代、烷化、酰化,叔醇易脱 水,所以保护醇羟基很重要。保护醇羟基 时,可以制成醚、酯、缩醛、缩酮等。 醚在酸性中不稳定,在碱性中稳定;缩 醛、缩酮也是在酸性水溶液中不稳定, 而在碱性中稳定;而酯在碱中不稳定, 在酸中稳定。
H2O H
脱落
3-2 氨基的保护 氨基不稳定,较易氧化、酰化、烃化等 反应,因此在一些合成反应中,常常需 要将氨基加以保护。
3-2-1质子化及螯合 从理论上讲,氨基最简单的保护法是使氨 基完全质子化,即占据氮上的未共用电子 对以阻止亲核反应的发生。但是实际上能 在使氨基完全质子化所需的酸性条件下可 以进行的合成反应是很少的。因此,这种 方法仅用于防止氨基的氧化。
官能团保护及去保护
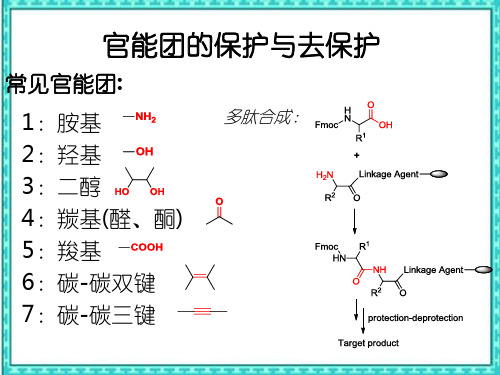
常见官能团:
1:胺基 2:羟基 3:二醇 4:羰基(醛、酮) 5:羧基 6:碳-碳双键 7:碳-碳三键
多肽合成:
官能团保护及去保护
选择保护基的原则:
(1) 保护基的供应来源(容易得到、价格便宜); (2) 保护基不能引入其它可参与目标反应的官能团; (3) 保护基的引入对化合物的结构论证不致增加过量的
官能团保护及去保护
硅醚保护基
三甲基硅醚 (TMSOR叔)丁基二甲基硅醚 (TBDMS-OR or TBS-OR) 叔丁基二苯基硅醚 (TBDPS-OR )
苄醚保护基 烷氧基甲基醚或烷氧基取代甲基醚 2.4 酰化成酯保护
官能团保护及去保护
笏甲氧羰基(Fmoc)的引入与去除 笏甲氧羰基的特点: √ 对酸极其稳定,在它的存在下,Boc和苄基可去保护;
√ 较易由简单的胺不通过水解去保护,被保护的胺以游离 碱释出;
√ 一般而言,Fmoc对氢化稳定,但某些情况下,它可用 H2/Pd-C在AcOH和MeOH中脱去。Fmoc保护基可与酸
和K2CO3、DIPEA、NaH、Et3N 和n-BuLi在有机溶剂
(如DMF、二氯甲烷和乙腈等)中反应来引入,或 C6H4CHO/ NaBH4、NaBH3CN或NaBH(OAc)3还原胺 化。
官能团保护及去保护
实例:
官能团保护及去保护
去保1)护常方用法催:化氢解脱去,如H2/Pd-C、H2/PdCl2、 Pd/HCOOH或Pd-C/HCOOH、Pd-C/HCOONH4、或 Pd-C/环已烯作氢源转移氢化;注:在用催化氢化(H2, Pd/C)脱苄时, 胺对钯催化剂的慢性毒化使得反应较慢通 常较慢,甚至反应不彻底.一般加酸或Boc2O促进Bn的离 去。
第三章官能团的保护

其他 氨基 羟基 羰基
目 录 返 回 上一页 下一页 退 出
特点: 乙二醇适用于醛或位阻小的酮(选择性)!
H
O O
H
m-ClC6H4CO O O H C H2C l2
COOH H
其他
HO H
氨基 羟基
HO
H
HO
O
TsOH, C6H6 O
O
H
70%
CHO
H
氢化二(2-甲基丙基)铝
O
O
O O
HO H
氨基 羟基 羰基
C C SiMe3 1. AgNO3 , OH-
C CH
2. H2O , H+
COOH
目录 返回
上一页
COOH
返回
下一页 退 出
试一试 说题
1. O
2.
BrCH2CH2CHO
CH2 CH CHO 3.
OH OH
O 4.
CHO
合成
HO O
合成
CH2CH2CHO
O 合成
CHO
5. BrCH2CH2CH2CHO
EtMgBr THF
O O CH2C CMgBr
其他 氨基 羟基 羰基
目 录 返 回 上一页 下一页 退 出
(二)形成缩醛或缩酮
丙酮或苯甲醛 与顺式邻二醇形成缩醛或缩酮 保护顺式邻二醇 H2O / H+或Lewis 酸下脱保护
其他 氨基 羟基 羰基
目 录 返 回 上一页 下一页 退 出
9
CO2H
其他 氨基 羟基 羰基
目录
返回
返回
上一页 下一页 退 出
Br
其他 氨基 羟基 羰基
有机合成中有机物官能团地引入、消除和转化方法

有机合成中有机物官能团的引入、消除和转化方法1.官能团的引入2.官能团的消去(1)通过加成反应消除不饱和键。
(2)通过消去反应、氧化反应或酯化反应消除羟基(—OH)。
(3)通过加成反应或氧化反应消除醛基(—CHO)。
(4)通过消去反应或水解反应消除卤素原子。
3.官能团的转化(1)利用衍变关系引入官能团,如卤代烃水解取代伯醇(RCH2OH)氧化还原醛――→氧化羧酸。
(2)通过不同的反应途径增加官能团的个数,如(3)通过不同的反应,改变官能团的位置,如有机合成中碳架的构建1.有机成环反应(1)有机成环:一种是通过加成反应、聚合反应来实现的;另一种是通过至少含有两个相同或不同官能团的有机物脱去小分子物质来实现的。
如多元醇、羟基酸、氨基酸通过分子内或分子间脱去小分子水等而成环。
(2)成环反应生成的五元环或六元环比较稳定。
2.碳链的增长有机合成题中碳链的增长,一般会以信息形式给出,常见的方式如下所示。
(1)与HCN的加成反应(2)加聚或缩聚反应,如n CH 2(3)酯化反应,如CH 3CH 2OH +CH 3COOH 浓 CH 3COOCH 2CH 3+H 2O 。
3.碳链的减短(1)脱羧反应:R —COONa +NaOH ――→CaO△R —H +Na 2CO 3。
(3)水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
(4)烃的裂化或裂解反应:C 16H 34――→高温C 8H 18+C 8H 16; C 8H 18――→高温C 4H 10+C 4H 8。
合成路线的选择1.中学常见的有机合成路线 (2)一元合成路线R —CH=CH 2――→HX 卤代烃――→NaOH 水溶液△一元醇――→氧化一元醛――→氧化一元羧酸―→酯(3)二元合成路线CH 2=CH 2――→X 2CH 2X-CH 2X ――→NaOH 水溶液△二元醇――→氧化二元醛――→氧化二元羧酸→⎩⎪⎨⎪⎧链酯环酯高聚酯(3)芳香化合物合成路线:2.有机合成中常见官能团的保护(1)酚羟基的保护:因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH 反应,把—OH 变为—ONa(或—OCH 3)将其保护起来,待氧化后再酸化将其转变为—OH 。
第三章 有机药物官能团的引入 转换和保护

SH RCH 2 CHR' CN RCH 2 CHR' OOCR'
NH3 LiAIH 4 H 2 / Pd Zn/ HCI NaSR'
RCH 2 CHR' NH 2 RCH 2 CHR'
RCH 2 CH 2 R'
_ NaC= CR'
SR' RCH 2 CHR' C _ CR' = RCH 2 CHR' I RCH 2 CHR' R'
后三种卤代试剂均好的选择性。
例如:
O S O
Cl
+
HO
SO 2 CI 2
hv
+
CH3
(i - Pr) 2 NCI
or H 2 SO 4 / H 2 O
HO Cl
+
[(CH 3 ) 2 CH 2 ] 2
(2)烯丙基化合物和烷基芳烃α―卤代
烯丙基化合物的α―卤代是合成不饱和卤 代烃的重要方法。 此反应也属于自由基历程。 使用的溴化剂为N―溴代丁二酰亚胺 (NBS)。
NaOH /(Me) 2 SO 4 (CH 3 ) 3 SiI
ROH
DMF
ROCH 3
ROH
CHCI 3
②叔丁醚ROC(CH3)3 :
将醇的二氯甲烷溶液或悬浮液在H2SO4或 BF3-H3PO4复合物中,在室温与过量的异 丁烯作用可得到叔丁醚。 脱保护基通常用无水CF3COOH或HBr– CH3COOH溶液。 当分子中存在对酸敏感的基团时不适用。
+
C
C
[O] RCOOH RCHO
[O] RCH 2 OH C [O] RCOR' OH C
合成任务二官能团的引入消除转化和保护+高二下学期化学人教版(2019)选择性必修3

(3)炔烃与H2、HX、X2的不完全加成(限制物质的量)
(一)官能团的引入
2.引入碳卤键 (1)烃与卤素单质的取代反应
+Br2 催化剂
—Br+HBr
(一)官能团的引入
2.引入碳卤键
(2)不饱和烃与卤素单质、卤化氢等的加成反应
CH2=CH—CH3+HBr
CH3—CHBr—CH3
(2)某些烯烃的氧化
(一)官能团的引入
5.引入羧基
(1)醛的氧化反应
催化剂 △
CH3CHO+2Cu(OH)2+NaOH △
H+
CH3COONa
CH3COOH
CH3COONa+Cu2O↓+3H2O
(2)酯、酰胺的水解反应
稀硫酸
CH3COOC2H5+H2O △ CH3COOH+C2H5OH
(一)官能团的引入
HOCH 2COONa + HCl ==HOCH2COOH+NaCl,故反应类型:氧化——氧化——取代——水解。
达标检测
3.以HOCH2-CH=CH-CH2OH为原料合成HOOC-CH=CH-COOH 的路线为:
HOCH2-CH=CH-CH2OH
HOCH2-CHCl-CH2-CH2OH
HOOC-CH=CH-COOH
COOH
COOH
KMnO4/H+
Fe/H+ 还原
NO2
NH2
达标检测
1.有机合成的关键是构建官能团和碳骨架,下列反应不能引
D 入—OH的是(
)
A.醛还原反应
B.酯类水解反应
C.卤代烃水解
D.烷烃取代反应
达标检测
2.由石油裂解产物乙烯制取HOCH2COOH,需要经历的反应类 型有( )
第三章 官能团的导入、除去、互换及保护

常用的溴代试剂:N-溴代丁二酰亚胺(NBS), N-溴代乙酰 胺(NBA),N-溴代邻苯二甲酰亚胺(NBP), N-溴代二苯酮 亚胺(Ph2C=NBr),三氯甲烷磺酰溴(Cl3CSO2Br)等。
反应机理:
反应规律:
a. 直链或支链只在烯丙位发生溴代反应
环烯烃与1同,也可能发生加成或消除生成芳烃。
炔烃在用碱处理时,会发生碳碳三键的位置异构。
邻二卤代烷脱卤化氢时,不受 分子中-OR、-NO2、NR2等 官能团的影响。
乙烯式卤代烃脱卤化氢需要在强碱存在下方可生成炔烃。
(2)通过烃化反应引入碳碳三键 利用炔化物(炔钠、炔锂、缺铜、炔铝)与卤代烃反应,
是合成增长碳链炔烃的重要方法。
a. 炔钠与卤代烃的反应
2、取代芳烃的官能团化 邻对位定位基 活化苯环 钝化苯环
(−H) −CH2Cl −F −Cl −Br −I
-
间定位基 (钝化苯环)
强 -NH3 钝 ﹢ 化 -N(CH3)3
-NO2 -CN -SO3H -CHO -COCH3 -COOH -COOR -CONH2 -CH2NO2 -CX3
常 见 取 代 基 的 定 位 作 用
(3)芳烃的Friedel-Crafts烷基化 催化剂可以是Lewis酸,也可以是质子酸。活性顺序为:
AlCl3 > FeCl3 > SbCl5 > SnCl4 > BF3 > TiCl4 > ZnCl2
HF > H2SO4 > P2O5 > H3PO4
(4)芳烃的Friedel-Crafts酰基化 催化剂可以是Lewis酸,活性顺序为: AlCl3 > BF3 > SnCl4 > ZnCl2。 也可以是质子酸,如:硫酸,氢氟酸,磷酸,多聚磷 酸(PPA)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C6H5 H Br CH3 H C6H5
赤式异构体 -HBr
苏式异构体
-HBr
CH3 C=C
H C6H5
CH3 C=C
C6H5
C6H5
C6H5
H
顺式(Z构型)
反式(E构型)
C6H5 Br H Br H CH3 H CH3 C6H5 H C6H5
(赤式)
Br C6H5 C6H5 H
C6H5 C6H5
CH(CH3)2
转环
H
H H3C
H -HCl H
Cl
E2
H3C
CH(CH3)2
H
H H3 C H H
H
H H3C H H Cl
CH(CH3)2 Cl
CH(CH3)2 H
-HCl E2
H3C CH(CH3)2 + H
75%
H3C H
25%
H CH(CH3)2
■ 强碱作用下才以消除反应为主 例 外 ■ 某些含活泼β-H化合物以消除反应为主 如: CH CH Br NaOH
c 缩合反应—wittig(维狄希)反应
烯烃的官能团化
三、炔键的导入与官能团化
1、炔键的导入 (1)通过消除反应导入碳碳叁键
a. 二卤代烷脱卤化氢 二卤代烷包括:邻二卤代烷(RCHXCHXR`),同碳二卤代烷 (RCX2CH2R),乙烯基卤代物。 常用的碱:NaOH(KOH)/EtOH, RONa(ROK)/EtOH, NaNH2/NH3等。
强 活 化
-O -NR2 -NH2 -OH −OR −NHCOR −CH3 −CH(CH3)2 −C(CH3)3 −Ar −CH=CH2 (−H)
(3)芳烃的Friedel-Crafts烷基化 催化剂可以是Lewis酸,也可以是质子酸。活性顺序为:
AlCl3 > FeCl3 > SbCl5 > SnCl4 > BF3 > TiCl4 > ZnCl2
HF > H2SO4 > P2O5 > H3PO4
(4)芳烃的Friedel-Crafts酰基化 催化剂可以是Lewis酸,活性顺序为: AlCl3 > BF3 > SnCl4 > ZnCl2。 也可以是质子酸,如:硫酸,氢氟酸,磷酸,多聚磷 酸(PPA)。
反应机理:
b. 碱催化卤代
醛、酮的α-H易被卤素取代生成α-卤代醛、酮,特别 是在碱溶液中,反应能很顺利的进行。
反应机理:
(1) 醛的α-卤化反应 醛在酸碱催化下易自身缩合,若将醛先转化成烯醇的三甲基 硅醚,再进行卤化,则可得到ɑ-卤代醛,且产率较高。
(2) 酮的α-卤化反应 对于不对称的酮的α-卤代主要发生在容易烯醇化的α-位上。
C=C
反式消除
如:C H CH CH C H C H OH C H CH=C C H 6 5 2 5 6 5 6 5 6 5 Br CH CH
3
*
*
NaOH
反应物有二个手性碳原子,因此有二对对映异构体:
3
C6H5 Br H CH3 H C6H5
C6H5 H Br H CH3 C6H5
C6H5 Br H H CH3 C6H5
反应活性与规律: 2o、3o RX脱卤化氢时,遵守扎依采夫
例如:
(Sayzeff) 规则-即主要产物是生成双键碳上连接烃基最多的烯烃。
特例:
消除反应的立体化学
E1——没有明显规律,在立体化学上没有空间定向性 E2——主要为反式(共平面)消除
L C C
顺式共平面
H C =C
顺式消除
L
C C H
反式共平面
若用硫酸二甲酯或二乙酯,则可导入甲基或乙基。
b. 炔锂与卤代烃的反应
末端炔的合成常用乙炔锂先与乙二胺反应生成稳定的络合物, 再与溴代烷在DMSO或DMF反应得到高产率末端炔烃。
当分子中有-OH、-SH、-NHR等基团时,该反应仍可顺利进行。
(3)偶联反应 a. 炔烃的氧化偶联反应—Glaser Reaction 乙炔亚铜在空气中发生氧化偶联生成1,3-丁二炔类化 合物,合成对称二炔的重要方法。
2、取代芳烃的官能团化 邻对位定位基 活化苯环 钝化苯环
(−H) −CH2Cl −F −Cl −Br −I
-
间定位基 (钝化苯环)
强 -NH3 钝 ﹢ 化 -N(CH3)3
-NO2 -CN -SO3H -CHO -COCH3 -COOH -COOR -CONH2 -CH2NO2 -CX3
常 见 取 代 基 的 定 位 作 用
常用的溴代试剂:N-溴代丁二酰亚胺(NBS), N-溴代乙酰 胺(NBA),N-溴代邻苯二甲酰亚胺(NBP), N-溴代二苯酮 亚胺(Ph2C=NBr),三氯甲烷磺酰溴(Cl3CSO2Br)等。
反应机理:
反应规律:
a. 直链或支链只在烯丙位发生溴代反应
环烯烃与1同,也可能发生加成或消除生成芳烃。
优点:热解温度较低(100-200 oC),无异构化和重排产物生成; 缺点:多步合成黄原酸酯,热解时掺杂含硫杂质。
3)氧化叔胺的热解 — Cope 反应 叔胺经H2O2氧化生成的氧化叔胺受热分解称为Cope反应。 反应温度较低(120-150 oC),主产物为hofmann烯烃。
此反应操作简便,无异构化产物。脂环族氧化胺热解反 应专一,五元环、七元环形成环内双键,而六元环形成环外 双键。
CH3 O H Ph C O Ph H D
CH3 O D Ph Ph C O H H Ph
△
△
D Ph
Ph
(主)
H
D Ph
赤型
O
PhCHCHOCCH3
H
(痕量)
Ph
H
2)磺原酸酯的的热消除——楚加耶夫反应
此反应与羧酸酯的热解相似,也为顺式消除,通常首先 制备黄原酸酯,然后将其直接或在惰性溶剂中加热。
e 其它的消除反应 邻二卤化物在金属Mg或Zn在醋酸或乙醇中作用,烃脱去 X2,生成烯烃。
用二价钛或二价铬亦可脱卤素。
硝基甲烷的共轭碱同样是脱卤素的有效试剂。
β-卤代醇消除次卤酸
β-卤代醇与二价锡、二价钛化合物、Zn-醋酸作用,脱去 次卤酸生成烯烃,其中以β-碘代醇效果最好。
选择适当的β-碘代醇可以合成具有一定构型的立体选 择性烯烃。
在一定条件下(如高温、高压、光照、催化剂),烷烃也能 起一些化学反应。
卤素的相对反应活性: 氟 > 氯 > 溴 > 碘。
氢的相对活性为:3oH >2oH >1oH 溴代反应的选择性好,在有机合成中比氯带更有用。
有良好选择性的氯代试剂:硫酰氯,亚硫酰氯,N-氯化物等, 例如:
2、烯烃、烷基芳烃的α-卤代反应 (1)α-H(烯丙氢)的反应 α-H由于受C=C的影响,αC-H键离解能减弱,故α- H比其它 类型的氢易起反应,反应条件为高温或光照。 其活性顺序为: α- H(烯丙氢)> 3oH > 2oH > 1oH > 乙烯H
β-C上连有支链时消除倾向增大
取代
C H Br
2 5
消除
1%
99%
2
CH CH CH Br
3 2
91% 40%
9%
60%
CH CHCH Br 2 3 CH
3
b.醇脱水
常用的脱水剂有酸(硫酸,磷酸,草酸等)、酸性氧化物
(P2O5等)、碱(如KOH)、盐(如KHSO4, NaHSO4 )。
反应是通过游离基进行的:
在亚铜盐催化下,炔基三甲基硅烷能发生脱硅基偶联。
b. 炔烃与卤代烃的偶联
在碱及亚铜盐的存在下,末端炔烃可与1-卤-1-炔烃发 生交叉偶联,以较好产率生成不对称二炔烃。
机理:经过炔铜,偶联后放出亚铜
2、炔烃的官能团化
四、芳烃及其衍生物官能团化
1、芳烃的官能团化
(1)芳烃的卤代 在三氟过氧乙酸存在下,四氯化钛可作为温和的氯化试剂。
醇的脱水反应活性: 3o R-OH > 2o R-OH > 1o R-OH
醇脱水反应的特点: 1)主要生成札依采夫烯,例如:
2)用硫酸催化脱水时,有重排产物生成。
CH CH
3
3
CH CH CH
A l2 O 3
3
3
C CH
3
气 相
CH
3
C CH
3
CH
= CH 2
+
H 2O
OH
(主 要 产 物 )
c.季铵盐及其碱的热解
第三章 官能团的导入、除去、 互换及保护
本章主要内容
• 1.官能团的导入、除去、互换及保护
• 2.官能团的转换 • 3.官能团的保护
第一节
官能团的导入、除去及互变
一、饱和碳原子上的官能团的导入
1、饱和烃的卤代反应
烷烃的化学性质 化学性质稳定 原因: (1)其共价键都为σ键,键能大 C-H 390~435KJ/mol C-C 345.6KJ/mol (2)分子中的共价键不易极化 (电负性差别小C2.5, H2.2)
炔烃在用碱处理时,会发生碳碳三键的位置异构。
邻二卤代烷脱卤化氢时,不受 分子中-OR、-NO2、NR2等 官能团的影响。
乙烯式卤代烃脱卤化氢需要在强碱存在下方可生成炔烃。
(2)通过烃化反应引入碳碳三键 利用炔化物(炔钠、炔锂、缺铜、炔铝)与卤代烃反应,
是合成增长碳链炔烃的重要方法。
a. 炔钠与卤代烃的反应
卤化剂除卤素外,还有N-卤代酰胺、次卤酸酯、硫酰卤化物等。
与醛相似的应用
4、羧酸及其衍生物的 α-H卤代反应
反应机理:亲电取代机理 α-H反应活性:酰卤、酸酐、腈、丙二酸及其酯>羧酸及其酯 如何提高羧酸及其酯α-H反应活性?
