猪瘟和猪蓝耳病病毒多重RT_PCR检测方法的建立及初步应用
常见猪病PCR检测操作步骤及试剂配制(精)

常见猪病PCR检测操作步骤及试剂配制一、RNA病毒(蓝耳病、猪瘟、乙脑、猪传染性胃肠炎病毒、猪流行性腹泻病毒、轮状病毒等包括病料的处理、RNA的提取、反转录、和PCR扩增、凝胶电泳四个步骤。
1、病料的处理取组织病料约2克,加入4-5毫升灭菌的PBS或者生理盐水,置研磨器(灭菌中研磨或者用剪刀细心剪碎,置-20℃中反复冻融三次,即可用于检测。
2、RNA的提取1取上述冻融三次的病料约200微升置1.5毫升的离心管中,加入500-600微升TRIzol剧烈振摇30秒后,静置5分钟后,再次剧烈振摇30秒后,静置5分钟。
2在加入200微升的氯仿,上下颠倒混匀30s,静置5分钟,4℃ 12000g 离心15 min。
离心完毕后,取上清约400-500微升(注意不要吸到中间层白色物质置新的灭菌好的离心管中,加入等体积的异丙醇,颠倒数次后(不可剧烈震动静置10分钟,4℃12000g离心10 min.可见管底部有少量白色沉淀,倒掉异丙醇,加入1毫升75%的乙醇(DEPC水配制,振摇,将白色沉淀悬浮,4℃7500g离心5 min。
弃去上清,干燥沉淀物(将离心管倒置于卫生纸或者其它吸水纸上,室温约5 min即可加入20μLDEPC 水溶解用于RT-PCR,或于-20℃保存备用。
两步法:1、反转录在10μL的反转录体系中加入:上述步骤中提取的RNA7μL、5×Buffer 2μL、0.5μL或者下游引物0.5μL;65℃10分钟, 10 mM dNTP 0.25μL、Oligo (dT18迅速放置-20摄氏度冰箱中2分钟,加入M-MLV 100U/μL 0.25μL(反转录酶37℃水浴1h,即可做为PCR扩增的模板,立即用于PCR扩增或置于- 20 ℃保存备用。
2、PCR扩增设立阳性和阴性对照,阳性对照一般为病毒液,阴性对照用灭菌的双蒸水做为PCR反应模板。
反应总体系为25μLcDNA 2μL,(模板25mmol/L Mg2+ 1.5μL,2.5mmol/L dNTPs 2.0μL,10× Mg2+ free PCR Buffer 2.5μL,20mmol/ L上下游引物各1μL,Taq DNA聚合酶(5U/μL0.2μL无菌双蒸水补至25.0μL。
RT—PCR检测高致病性猪蓝耳病方法的探讨

2 0分钟 。弃上清 液, 沿管壁缓缓滴入 1 毫升 7 %乙醇 , 5 轻轻旋
转一周后倒掉 ,将离心管倒扣于吸水纸 上 1分钟 ,自然风干
( 以无 乙醇味为准 ) 。将 D P E C处理 的灭菌去 离子水与 R N A 酶抑制剂混合 ( 9: 按 1比例配制 ) 成混合液 , 1 制 取 0微升将 病毒 R N溶解 , 2微升用于 R - C A 取 T P R反应模板 。 分步法 R - C 。R T P R T体系的组成 建立 。反转录反应液 1 6
微升 , N酶抑制剂 1 A R 微升 , 录酶 1 反转 微升 , 已溶解 的病毒
R A2微升 , N 总体积 2 0微升。 混匀放入 P R扩增管中 , P R C 在 C 扩增仪上进行 以下循环 ,2U6 4 ' 0分钟 ,8C : 9  ̄5分钟 ,扩增完 毕 后备用 。 P R体系的组成建立 。C C P R反应液 1 6微升 ,a D A聚合 Tp N
养殖技术顾 问 2O. O98
研 究 与 综 述
酶 2微升 , 反转录产物 2微升 , 总体积 2 0微升。混匀 , 加入 并 2 O微升矿物 油覆 盖 , 于 P R扩增仪上 , 如下扩增 程序 扩 放 C 按 增 ,4 0 ,5 O秒 ×3 9 ℃3 秒 5 ℃3 5循环 ,2C 0 ,2 7  ̄3 秒 7 ℃5分钟 。 扩 有 的是不 同的细 菌混合 感染 ,本实验在 细菌学的检测 中发现 没有其他 细菌所引起的并发症状 。 操作过程 中的影 响。在 R - C T P R的操作过程 中。 键环 节 关 是 R A的提取 。通 过变性剂破碎 细胞 或者组织 , N 然后经过 氯
高致病性猪蓝耳病与经典猪蓝耳病二重RT—PCR检测方法的建立及应用

关键词:高致病性猪蓝耳病 ;猪蓝耳病;二重 RT-PCR
Establishment And Apply of du‘ plex RT -PCR Assay for Detecting Highly P ̄hogenic Porcine Reproduc。 tive and Respiratory Syndrome Virus And Porcine Reproductive and Res。 peratory Syndrome Virus
猪 繁 殖 与 呼 吸 综 合 征 (Porcine Re—
productive and Respirator y Syndrome,
猪瘟病毒TaqMan实时荧光定量PCR检测方法的建立及初步应用

猪瘟病毒TaqMan实时荧光定量PCR检测方法的建立及初步应用岳锋;朱艳平;银梅;王选年【摘要】根据GenBank中猪瘟病毒(classical swine fever virus,CSFV)5' NTR的保守序列,设计1对特异性引物和TaqMan探针,以CSFV全长基因重组质粒pGEM-CSFV为标准品,建立TaqMan实时荧光定量PCR标准曲线,进行特异性、敏感性和重复性试验,并检测人工感染CSFV后不同时期猪血浆中CSFV的载量.结果表明,标准曲线循环阈值与模板浓度具有良好的线性关系,R2=0.999;敏感性高,最低检测限为1×101拷贝/μL;特异性强,与猪圆环病毒2型、猪细小病毒、猪伪狂犬病病毒和猪繁殖与呼吸综合征病毒无交叉反应性;重复性好,组内和组间变异系数均小于2%.人工感染CSFV后第7天猪血浆中CSFV载量达到峰值,之后逐渐降低.结果表明,建立的TaqMan实时荧光定量PCR方法具有特异、敏感、重复性好等优点,为CSFV的定量分析及临床诊断奠定基础.【期刊名称】《中国畜牧兽医》【年(卷),期】2014(041)006【总页数】5页(P18-22)【关键词】猪瘟病毒;实时荧光定量PCR;TaqMan探针【作者】岳锋;朱艳平;银梅;王选年【作者单位】新乡学院生命科学与技术系,河南新乡453003;新乡学院生物技术研究所,河南新乡 453003;新乡学院生命科学与技术系,河南新乡453003;新乡学院生物技术研究所,河南新乡 453003;河南科技学院动物科学学院,河南新乡 453003;新乡学院生命科学与技术系,河南新乡453003;新乡学院生物技术研究所,河南新乡453003【正文语种】中文【中图分类】S858.28猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起猪的一种热性、出血性传染病,是严重威胁养猪业的重要传染病之一,被世界动物卫生组织(office international des epizooties,OJE)列入OJE疫病名目,也是中国农业部规定的一类传染病(殷震等,1997)。
BVDV荧光RT-PCR检测方法的建立和初步应用

吉林农业大学硕士学位论文BVDV荧光RT-PCR检测方法的建立和初步应用姓名:李天松申请学位级别:硕士专业:预防兽医学指导教师:胡桂学20050601吉林农业大学碗士学位论文BVDV时实定量荧光RT--PCR检测方法的建立和初步应用2结果2.1病毒培养正常MDBK细胞呈梭形、均匀铺在细胞培养瓶的底部,中心部较亮,边缘明显,有的地方呈现细胞集落。
接毒后72h开始出现细胞病变(CPE),细胞开始变圆、细胞核圆缩边缘、胞浆内出现大量空泡,细胞逐渐脱落,细胞单层呈网状,最后大部分或全部从瓶壁脱落下来,如图l、2。
图1正常MDBK细胞Fig.1TheMDBKconlrolcell2.2TCID50测定结果图2接毒MDBK细胞Fig.2TheinfectedMDBKcell细胞病变观察结果见表3。
表3OregonC24VTGID50测定结果!垫里苎堡!!婪!!竺缎丝!∑婴12熊稀释度细胞孔观察结果累计细胞孔数细胞CPE出现CPE孔不出现CPE孔出现CPE孔不出现CPE孔孔数孔的%10"1803103110010一712312495.810—711621888.91044496156010~355111631.310417218201010‘717t2526410‘808033330根据Re酣.Muench法计算提供的方法:.19.高于50%的百分数.50一”。
”ou。
1¨’~”¨)TC甄o=i磊赢磊孬丽i赢鬲i再F“m5%m31。
3 ̄0‘31uu50-高于50%的百分数.低于50%的百分数所以传代的OregonC24V病毒的TOlD50为O.1mL1043。
经查反对数约得19952.6即将O.1mL病毒进行19952.6倍稀释后的O.1mL病毒液为1个TCIDs0。
2.3MgCl2用量优化结果用预先设定的PCR反应体系和条件扩增RNA,计算机绘制样品曲线如图3:图3MgCl2优化结果Fig.3The代sultofMgCholrdmization由上至下3条线分别是5耻L、4pL、3uLMgCh用量的结果曲线,由图3可见,当MgCl2用量为5uL时,曲线里典型的“S”形。
猪瘟病毒、猪繁殖与呼吸障碍综合征病毒和乙型脑炎病毒多重RT-PCR检测方法的建立

病毒 , 因此 , 过 特 异 性 引 物建 立 多重 RT P R 方 rs TG V) 猪 细 小 病 毒 ( oc e pro i s 通 -C u, E , p ri av vr , n u 法 , 疑似病 猪 的组织样 品进行检测 , 对 仅需 1次反应 P V)伪狂犬病毒 ( su oa i i sP V) P , pe drb sv u , r 和猪 e r 即可诊 断 C F P R V 和 J V 的 单 独 或 混 合 感 圆环病毒 2型 ( ocn i o iu y e2 P V-) S V、 R S E p riec c vr stp , C 2 均 r
维普资讯
第2卷 第 1 7 期
猪非典型性瘟病毒RT-PCR检测方法的建立及初步应用
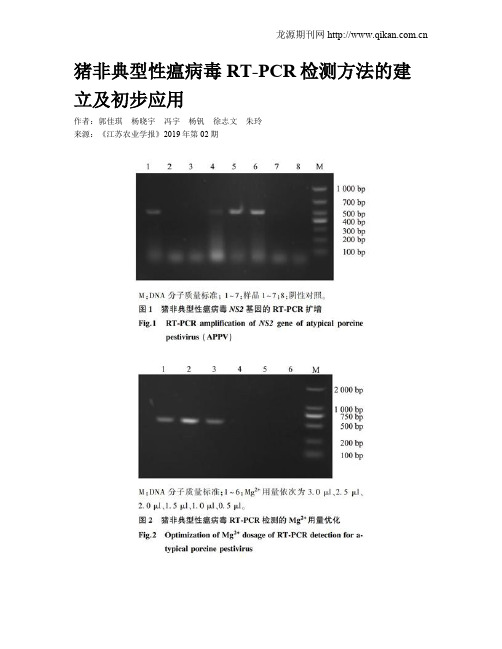
猪非典型性瘟病毒RT-PCR检测方法的建立及初步应用作者:郭佳琪杨晓宇冯宇杨钒徐志文朱玲来源:《江苏农业学报》2019年第02期摘要:为建立一种快速、准确检测猪非典型性瘟病毒(APV)的方法,根据Genbank发布的APPVNS2基因序列,设计合成1对扩增后目的基因片段大小为500bp的特异性引物。
建立的R’T-PCR方法对猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病毒(PRV)和猪瘟病毒(CSFV)的检测结果均为阴性,该方法对APPV的最低检岀量为1μl4.95×10拷贝,重复性试验中组间、组内试验结果均与预期相符。
应用该方法对68份疑似患病的仔猪样品进行检测,阳性病料检出率为7.35%。
利用Mega7.0绘制APⅤ系统进化树,对APPⅤ进行遗传进化分析,结果显示本试验检出的APPⅤ(SC株)与中国报道的APPV的亲缘关系较近。
建立的APPV RT-PCR检测方法可用于APPV的临床诊断及流行病学检测。
关键词:猪非典型性瘟病毒;RT-PCR;检测中图分类号:S858281.34+7文献标识码:A文章编号:1000-4440(2019)02-0357-06仔猪先天性震颤(Congenital tremors,CT)会导致仔猪出生后数小时内出现骨骼肌双侧痉挛性收缩,妨碍仔猪站立、步行和寻找乳头3,致使仔猪饥饿和初乳摄入不足,严重的可导致仔猪死亡。
一般根据神经系统是否发生病变,将CT分为A型和B型,A型有明显的大脑和脊柱的组织学损伤,B型无损伤45。
A型又可分为A~A-V5种亚型,其中只有A-I型与AⅡ型具有传染性。
A-型一般认为是由猪瘟病毒(Classical swine fever virus,CSFV)引起,以小脑发育不全为特征67。
AⅡ型的病因存在一定争议,直到2015年,Hause等通过宏基因组测序发现了猪非典型性瘟病毒(Atypical porcine pestivirus virus,APPV)2016年,Arruda9确定APPV是A的病因。
猪蓝耳病RT-PCR检测方法的建立

DoI : 1 0 . 3 9 6 9 / J . I SSN. 1 6 71 — 6 0 2 7 . 2 0 1 7 . 0 6. 0 1 1
国 内外诸 多学者 已对高致病 性猪蓝耳 病开展 了深入研
究, 并建立 了间接免疫荧光试 验 、 免疫过 氧化物酶单层试验 、
1 材 料
2 . 1 引物的设 计与合成
经查 阅国内外大量文献后发现 , 高 致病性 猪繁殖 与呼 吸综合征病 毒 ( P R R s V ) 的开放 阅读框 7
( o f f 7 ) 序列相 对保守 , 依据 G e n B a n k数据 库 中公 布 P R R S V
1 . 1 参考序 列 高致病性蓝 耳病病毒标 准株 、蓝耳病 标准
株、 蓝耳病北美 株 、 蓝耳病 欧洲株 等设 计引 物时所参考 的序
列 均查 询 自 G e n B a n k 。
的o r f 7 基 因序 列 和 高致 病 性 蓝耳 病 标 准株 基 因序 列 , 用
P r i m e r 5 . 0软件设 计引物 , 扩增 o r f 7 至近基 因组尾端 , 产 物片
要: 本研 究针 对 高致病 性猪繁 殖 与呼吸 综合征 病毒 ( P RRS V) 的开放 阅读框 7 ( o r  ̄ 7 ) 序 列设 计扩增 引物 , 建立
RT — P C R 检测方法 , 既 可检测 出高致病性蓝耳病 , 也 可检 测出蓝耳病经典毒株 , 提 高了蓝耳病 的检 出率。
1 0 × On e S t e p RNA PCR Bu fr e 5 L
作者简 介 : 纪爱英 ( 1 9 6 2  ̄ ) , 女, 河北省魏 县人 , 本科 , 农 业技
用RT—PCR方法检测猪瘟与猪蓝耳病混合感染

小为 4 0b 。 0 p
弓 物 P : ’一 C C T G Y G A C C G一 l 15 G T C G T G T AG T G 3; ’ 引物 P : ’ T A G T T A A A G G A一 ’ 25 一 G T C G C C C G T A 3 ; 弓 物 P : ’ A G C AG C G C A C 3 ;引物 l 3 5 一 T G C C A T A T A一 ’
21 年 02
7
l 墨 兰兰垫
j
周 伦江 ’ 修 金生 z 吴学 敏 陈如 敬 ’ 严 山 ’
用R—C T P R方法检测猪瘟 与猪蓝耳病 混合感 染
王 隆柏
(. 省农 业科 学 院畜牧 兽医研 究所 1 福建
摘
福建 省畜 禽疫病 防 治工程 技术 研 究中心
福州 3 00 ) 5 0 2
福 州 30 1: 50 3
2福建 农林 大 学动物 科学 学 院 .
要 福建省某规模化猪场暴发一种 以保育猪精神沉郁 、 体温升 高、 腹泻、 消瘦等为主要特征 的传 染性 疾病。利用 R — C TPR
和 P R分别对采集的病料进行猪瘟病毒 、 C 猪蓝耳病病毒、 猪伪狂犬病毒、 猪圆环病毒和猪细小病毒检测, 结果猪瘟病毒和猪蓝
以上 引物均 由大连 T K R A A A公 司合成 。 1 R A和 D A提取 . 4 N N 取 患 猪 的肺 、淋 巴结 、 肾 等 组织 , 菌 条件 下 剪 取 约 2 g的 组 织 病 料 , 入 无 加
猪瘟兔化弱毒疫苗中病毒含量实时荧光定量RT_PCR检测方法的建立及初步应用

猪 瘟 (classical swine fever,CSF)是 由 猪 瘟 病 毒 (classical swine fever virus,CSFV)引 起 猪 的 一 种 高度接触性传染 病。 目 前,中 国 猪 瘟 的 流 行 以 温 和 型猪瘟和母猪持续 感 染 引 起 的 流 产、死 胎 和 新 生 仔 猪死亡为主;同时,猪 瘟 疫 情 表 现 复 杂,区 域 性 流 行 和 零 星 散 发 并 存 ;猪 瘟 免 疫 猪 群 频 繁 发 病 ,往 往 还 伴 随有多种原因引起 的 免 疫 失 败,严 重 威 胁 养 猪 业 的 健康发展(王 琴,2012)。 疫 苗 免 疫 接 种 仍 是 预 防 和 控制猪 瘟 的 重 要 手 段,中 国 的 猪 瘟 兔 化 弱 毒 (hog cholera lapinized virus,HCLV)是 国 内 制 备 猪 瘟 弱 毒疫苗种毒,用于生 产 猪 瘟 兔 化 弱 毒 疫 苗 细 胞 苗 和 脾淋苗(仇 华 吉 等,2005;宁 宜 宝 等,2011)。 国 内 有 些猪瘟兔化弱毒疫苗生产厂家生产的疫苗效价达不 到免疫预防需求。目前测定猪瘟弱毒疫苗的抗原效 价或疫苗效力主要 采 用 兔 体 定 型 热 反 应,对 于 规 模 化猪场猪瘟的防 疫,该 方 法 费 事、费 力,不 太 适 合 猪 场 对 猪 瘟 疫 苗 选 择 的 需 求 ,因 此 建 立 一 种 敏 感 性 高 、 特异性强的猪瘟兔化弱毒疫苗中病毒含量检测方法 有实际意 义。 鉴 于 实 时 荧 光 定 量 RT-PCR 技 术 具
猪瘟病毒实时荧光定量PCR检测方法的建立与应用

2 0 1 7 , 4 4 ( 7 ) : 2 1 1 2 — 2 1 1 8
C h i n a An i ma l Hu s b a n dr y & Ve t e r i n a r y Me di c i n e
d o i :1 0 . 1 6 4 3 1 / j . c n k i . 1 6 7 1 — 7 2 3 6 . 2 0 1 7 . 0 7 . 0 2 9
Re a l — t i me qu a nt i t a t i ve PCR a s s a y wa s e s t a bl i s he d us i n g t he t o t a l R NA o f CSFV a s t e mp l a t e . The s p e c i f i c i t y,s e ns i t i v i t y a nd r e pe a t a b i l i t y of t he as s a y we r e t e s t e d, a nd s a mp l e s t a ke n f r o m c l i n i c
最低 检测模板浓度为 1 0拷 贝/ I , 并且 C S F V 的最 低 S F V 感 染 样 品 中 检 出
1 9份 阳 性 样 品 , 与本 课 题 组 建 立 的 C S F V Ne s t e d R T — P C R检 测 结 果 和 克 隆测 序 结 果 一 致 。本 研 究 成 功 建 立 了 C S
Es t a b l i s h me n t a n d Ap p l i c a t i o n o f Re a l — t i me Qu a n t i t a t i v e P CR As s a y f o r
猪主要RNA病毒病多重二温式RT-PCR检测方法的建立及初步应用

主 要 R A病 毒 病 进行 检 测 。用 5 N O份 临 床 病 料对 本 研 究 多 重 P R 技术 和单 项 P R技 术 进 行 对 比验 证 , 果 显 示 , C C 结 两
者 的 总符 合 率 为 9 % 以上 。表 明建 立 的多 重 P R 检测 方 法 , 有 特 异 、 速 、 3 C 具 快 准确 的 特 点 , 用 于 对 这 3种 病 毒 的 同 可
的 Np s2基 因 和 J V 的 E基 因 为相 对 保 守 区域 J E 。利用 生 物 学 软 件 在 保 守 序 列 分 别 设 计 一对 引 物 , 过 对 P R反 应 通 C
条 件 的 优 化 , 定 了最 佳 引 物 浓度 、 佳 Mg 浓 度 和最 佳 退 火 温 度 , 立 了多 重 二 温 式 P R方 法 检 测 C F P R V 确 最 “ 建 C SV、 R S
和 J V 其扩 增 的 目的 片断 大 小 分 别 为 C F ( 8 p 、R S 56b ) J V( 7 p , 传 统 三 温 式 P R过 程 中 E。 S V 4 2b ) P R V(7 p 和 E 3 5b ) 将 C
的退 火 与延 伸 合 并 为一 步 , 而 大 大 节 省 临床 检 测 时 间 , 时又 能通 过 一 个 反 应 体 系 对 C F 、 R S 从 同 S V P R V及 J V三 种 猪 E
路 斌 王 一成 吴 润 , 秀 芳 , 丽 华 李 军 星 王 朝 文 , , 袁 徐 , ,
( . 肃 农 业大 学 , 肃 兰 州 1甘 甘 70 7 ; . 江 省 农业 科 学 院 畜 牧 兽 医研 究所 , 江 杭 州 30 0 2 浙 浙 30 2 ) 10 1
猪瘟病毒荧光定量RT-PCR检测方法的建立

荧 光定 量 P R法 检 测 , 时用 套 式 P R 法 进 行检 C 同 C
测 , 比较二 者 的阳性检 出率 。 并
TT C G C GA TG AGC A GA一 TAMAR , 物 由 3一 A 引
标准 品 , 建立 了一种检 测 C F 的 荧光 定量 P R方 法( Q P R) 对该 方 法进 行 特异 性 、 感性和 重 复性 试 SV C F —C , 敏 验 。 结果显 示 , 可特 异地检 测 C F 该方 法在 1 l 贝/ L 范 围 内具 有 良好 的线 性 关 系, S V, 0~ O拷 肚 灵敏 度 可达 1 O拷 贝/ L, 复检 测 的 变异 系数 均小 于 5 。 临床 样品检 测表 明建 立 的方 法与套 式 P R 灵敏度 相 近。结 重 C
vto e i g n公 司 产 品 ; r AMV ( t 、 R NA 5 U/L L) HP IR
( 0U/ L 、 P 处 理 水 、 x T q ( U/ L) 4  ̄ ) DE C E a 5 u 、
诊 断提 供 了有效 的手 段 ] 。但 这些 方法 在 特异 性 、 敏感性 以及 时效 性 等 方 面都 有 各 自的不 足 , 适 用 不
用一对 特异 性 引物及 T q n荧 光探针 建立 了一种 a Ma
能快 速 、 异 、 敏 检 测 C F 的 实 时 荧 光 定 量 特 灵 SV
毒疫苗 ( L , 病 毒性 腹 泻病 毒 ( VD , HC V) 牛 B V) 猪繁 殖 与 呼 吸 综 合 征 病 毒 ( R V) 伪 狂 犬 病 毒 P RS ,
附试验 ( L S 、 清 学 试验 等 为 C F 的鉴 定 和 E IA) 血 SV
猪瘟病毒实时荧光定量RT_PCR检测方法的建立和初步应用

猪瘟病毒实时荧光定量RT PCR检测方法的建立和初步应用李军,潘艳,禤雄标,胡帅,马春霞,谢宇舟,陈泽祥,许力干,谢永平,杨威(广西兽医研究所,广西南宁 530001)摘要:根据G enBank公布的猪瘟病毒基因组5 非编码区基因序列进行同源性比较分析,选择保守序列区作为扩增区域,设计1对特异性扩增引物,通过优化反应条件,建立了一个用于猪瘟病毒快速定量检测的SY BR Gr een 荧光定量RT P CR 方法。
试验结果表明该方法重复性好,反应批内循环阈值差异不显著。
与猪繁殖与呼吸综合征病毒、伪狂犬病病毒和猪圆环病毒2型等猪源病毒无交叉反应,具有高度的特异性,而且灵敏度高,最小检出量为2 102病毒基因组拷贝数。
利用此方法对15例临床样本进行检测,其结果与兔体交叉免疫试验一致,表明此方法可作为猪瘟实验室快速诊断和疫情监测的一种快速、准确、简便的检测工具。
关键词:猪瘟病毒;实时荧光定量RT PCR中图分类号:Q78 文献标识码:A 文章编号:1671 7236(2011)03 0116 04猪瘟病毒(classical sw ine fev er virus,CSFV)属于黄病毒科瘟病毒属,是猪的一种重要传染性疾病病原,猪是本病的唯一宿主,病猪和带毒猪是最主要的传染源,直接接触是病毒传播的主要方式。
猪瘟发病特征为发病急,高热稽留和细小血管壁变性,引起全身广泛性小点出血,脾梗死,具有很高的发病率和死亡率,对养猪业造成了严重的经济损失,被世界动物卫生组织列为A类传染病,是国际贸易重要检疫对象之一(Meuw issen等,1999)。
目前,CSFV的检测方法主要有3大类,即兔体交叉免疫试验、基于病毒抗原和抗体反应的血清学诊断方法和针对病毒核酸检测的PCR技术(梁仕岩等,2009)。
兔体交叉免疫试验和血清学诊断方法检测病毒抗原虽然具有一定的灵敏度,但是操作繁琐,周期较长。
PCR可以检测血液、粪便、分泌物中CS FV的核酸,实现早期诊断,在CSFV的检测中发挥重要的作用(傅烈振等,1998;张朝红等,2007;刘建柱等,2003)。
猪瘟巢式RT—PCR监测方法的建立

补D E P C 水至 2 0 L 。4 2 %反转 录 1 h , 得到相应 的 c D N A模
板。
3 . 3 猪 症病毒 巢式 P C K 方 法的建 立
步对猪瘟病毒 D N A进行扩增 :
本 实验 方法 分为 2
猪瘟病 毒 1 扩P C R体系 为 2 5 L :反 转录产 物 3 L 、 1 0XP C R B u f e r 2 . 5 L 、 d N T P s 2 I - L L 、一扩 上下 游引物 P R 1 和P F 1 各0 . 5 L 、 r T a q O . 2 5 L 、 补水至 2 5 L 。 反应程序为 : 9 4 %变 性 5 m i n ; 9 4 o C 3 0 s , 5 5 ℃ 3 0 s , 7 2 %1 m J n ,共 3 2个 循 环; 最后 7 2 %延伸 1 0 mi n 。 猪瘟 病毒 2扩 P C R体 系为 2 5 L :3 L 1 扩P C R产 物、 1 0×P C R B u f e r 2 . 5 L 、 d N T P s 2 L 、二 扩上下游 引物 P R 2和 P F 2各 0 . 5 L 、 r T a q 0 . 2 5 L 、 补水至 2 5 L 。反应程 序为 : 9 4 ℃变性 5 mi n ; 9 4 % 3 0 s , 5 5  ̄ C 3 0 s , 7 2  ̄ C l m i n ,共 3 2 个循环 ; 最后 7 2 ℃延伸 l O m i n 。
验 研 究
猪瘟巢 式 RT P C R 监测 方法 的建 立
杨若松 , 寇晓晶 , 李 敬 , 张 俊 , 贺忠海
( 1 . 河 北省 张家 口市 动物疫 病预 防控 制 中心政 府 ,张家 口 0 7 5 0 0 0 ; 2 . 甘 肃省 动物 疫病 预 防控制 中心 。兰 州 7 3 0 0 0 0 )
猪瘟病毒和猪繁殖与呼吸综合征病毒一步法双重荧光RT-PCR检测方法的建立及应用

猪瘟病毒和猪繁殖与呼吸综合征病毒一步法双重荧光RT-PCR检测方法的建立及应用于新友,李天芝(山东绿都生物科技有限公司,山东滨州 256600)摘 要:为建立猪瘟病毒(CSV)和猪繁殖与呼吸综合征病毒(PRRSV)现场快速鉴别检测方法,参照GenBank中CSV和PRRSV特异性基因序列,设计特异引物和TaqMan探针,通过优化反应条件,建立了检测CSV和PRRSV的一步法荧光RT-PCR方法,并验证了该方法的特异性、敏感性、重复性。
结果显示,该方法检测CSV和PRRSV的灵敏度分别可达0.25和1.99 TCID50/100 μL,对猪细小病毒(PPV)、猪乙型脑炎病毒(JEV)、猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)的检测结果均为阴性。
本试验建立的TaqMan一步法荧光定量RT-PCR检测方法,可对CSV和PRRSV进行快速诊断,适合现场检测。
关键词:猪瘟病毒;猪繁殖与呼吸综合征病毒;现场检测;TagMan;一步法;荧光RT-PCR中图分类号:S852.65 文献标识码:B 文章编号:1005-944X(2018)04-0088-04DOI:10.3969/j.issn.1005-944X.2018.04.022Establishment and Application of an One-step Fluorescent RT-PCR Methodfor Dection of CSFV and PRRSVYu Xinyou,Li Tianzhi(Shandong Lüdu Bio-Industry Co.,Ltd,Binzhou,Shandong 256600,China)Abstract:In order to establish a field rapid indentification method for detection of Classical swine fever virus (CSFV)and Porcine reproductive and respiratory syndrome virus(PRRSV),specific primers and TaqMan probes were designed according to the specific gene sequences of CSFV and PPRSV in GenBank,then an one-step fluorescent RT-PCR method for CSFV and PRRSV detection was established by optimizing the reaction conditions,and the specificity,sensitivity and repeatability of the method were verified. The results showed that the minimum values of CSFV and PPRSV detected by this method were 0.25 and 1.99 TCID50/100 μL,respectively,and the detection results of Porcine parvovirus(PPV),Japanese encephalitis virus(JEV),Pseudorabies virus(PRV)and Porcine circovirus type 2(PCV2)were all negative. As a conclusion,the one-step fluorescent RT-PCR method established in this article could be used for rapid diagnosis of CSFV and PRRSV,and it was suitable for field detection.Key words:CSFV;PRRSV;field detection;TagMan;one-step method;fluorescent RT-PCR猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种高度接触性、致死性猪传染病,临床上以高热稽留、皮肤和黏膜出现大量出血点和高死亡率为主要特征。
非洲猪瘟病毒、高致病性猪繁殖与呼吸综合征病毒二重实时荧光定量PCR_检测方法的建立与初步应用

·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报摘 要:建立一种特异、敏感、快速的实时荧光定量PCR (FQ-PCR )方法,用于非洲猪瘟病毒(ASFV )和高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV )的鉴别诊断。
针对ASFV 的B646L 基因和HP-PRRSV 的NSP2基因分别设计特异性引物/探针对,经优化反应体系、反应程序等反应条件,建立一种基于探针技术的FQ-PCR 方法,验证方法的敏感性、特异性和重复性,对130份临床样品进行检测,并与OIE 检测方法(ASFV )及国标方法(HP-PRRSV )进行比较分析。
本研究成功建立的ASFV 和HP-PRRSV 二重FQ-PCR 检测方法在10-1~105 copies/μL 模板范围内有良好的线性关系;对ASFV 和HP-PRRSV 基因出现阳性扩增,但对猪日本乙型脑炎病毒(JEV )、猪瘟(CSFV )、猪细小病毒(PPV )、猪伪狂犬病病毒(PRV )、猪圆环病毒2型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV )美洲经典株(VR2332株)、健康猪脾脏等7种病原核酸样品对照未出现扩增;批内、批间试验变异系数在0.53%~3.14%,重复性良好;对ASFV 和HP-PRRSV 的最低检测模板浓度均为10 copies/μL ;利用建立的二重FQ-PCR 方法对130份临床样品进行检测,检测结果与OIE 检测方法(ASFV )及国标方法(HP-PRRSV )完全一致。
本研究成功建立了鉴别ASFV 和HP-PRRSV 二重FQ-PCR 检测方法,为ASFV 和HP-PRRSV 的鉴别诊断提供了快速、敏感、特异且能满足临床检测需求的检测方法。
关键词:非洲猪瘟病毒;高致病性猪繁殖与呼吸综合征病毒;二重FQ-PCR中图分类号:S852.65 文献标志码:A 文章编号:1674-6422(2024)02-0118-13Development and Application of a Duplex FQ-PCR for Diff erential Detection of African Swine Fever Virus and Highly Pathogenic Porcine Reproductive andRespiratory Syndrome VirusLIU Ying, YAN Ruoqian, WANG Dongfang, YANG Haibo, ZHAO Meixu, SONG Dan, ZHAO Xueli,XIE Caihua, WANG Shujuan, MA Zhenyuan, CHAI Mao, WANG Cui, LIU Meifen(Henan Provincial Key Laboratory of Monitoring, Early Warning and Prevention and Control of Major Animal Diseases Henan Centre forAnimal Disease Control & Prevention, Zhengzhou 450008, China)收稿日期:2022-01-06项目基金:河南省科技创新领军人才(04200510012);河南省现代农业产业技术体系课题(豫财科[2020]92号)作者简介:刘影,女,硕士,主要从事动物疫病分子生物学及免疫学研究通信作者:刘梅芬,E-mail:****************非洲猪瘟病毒、高致病性猪繁殖与呼吸综合征病毒二重实时荧光定量PCR 检测方法的建立与初步应用刘 影,闫若潜,王东方,杨海波,赵美雪,宋 丹,赵雪丽,谢彩华,王淑娟,马震原,柴 茂,王 翠,刘梅芬(河南省动物疫病预防控制中心 河南省重大动物疫病监测预警及防控重点实验室,郑州450008)2024,32(2):118-130Abstract: To develop a specific, sensitive and rapid real-time fluorescence quantitative PCR (FQ-PCR) method for the differential diagnosis of African swine fever virus (ASFV) and highly pathogenic porcine reproductive and respiratory syndrome virus (HP-PRRSV), specific primer/probe pairs were designed for B646L of ASFV and NSP2 of HP-PRRSV for development of a F Q-PCR method based on probe technology. The FQ-PCR method was optimized for its reaction conditions to and verified for its sensitivity,· 119 ·刘 影等:非洲猪瘟病毒、高致病性猪繁殖与呼吸综合征病毒二重实时荧光定量PCR 检测方法的建立与初步应用第32卷第2期非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的一种急性、热性、高度接触性的传染病,家猪和欧亚野猪均可感染发病,其特征是发病急、死亡率高,家猪中的发病率、死亡率可达100%。
多重RT-PCR一步法技术同时检测猪瘟病毒和蓝耳病病毒方法的建立以及初步应用

多重RT-PCR一步法技术同时检测猪瘟病毒和蓝耳病病毒方法的建立以及初步应用孔繁德;王荣;陈琼;吴德峰;徐淑菲【期刊名称】《生物技术通报》【年(卷),期】2009(000)001【摘要】猪瘟病毒和蓝耳病病毒均能导致猪繁殖障碍,对养猪生产影响很大.根据猪瘟病毒(CSFV)和猪蓝耳病(PRRS)的基因保守序列设计了2对针对这2种病毒的特异引物,并建立了多重RT-PCR方法,分别对其最佳反应条件、特异性及敏感性进行了测定,结果表明能同时扩增得到2条与试验设计相符的167 bp(CSFV)和320 bp(PRRS)特异性条带,同时具有较好的特异性;敏感性检测结果表明,临床阳性的样品提取的核酸稀释1000倍后仍能检测出CSFV和PRRSV.本方法的建立对于这2种病毒病的早期快速检测具有十分重要的意义.【总页数】5页(P112-116)【作者】孔繁德;王荣;陈琼;吴德峰;徐淑菲【作者单位】厦门出入境检验检疫局,厦门,361012;福建农林大学,动物科学学院,福州,351006;厦门市农产品质量安全检验测验中心,厦门,361009;福建农林大学,动物科学学院,福州,351006;厦门出入境检验检疫局,厦门,361012【正文语种】中文【中图分类】S8【相关文献】1.一步法多重RT-PCR检测猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒方法的建立和应用 [J], 于新友;李天芝;沈志强2.多重荧光RT-PCR技术检测猪流感病毒、猪乙型脑炎病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒方法的建立 [J], 梁晓艳;万东山;郭兰英3.猪瘟病毒猪细小病毒猪繁殖与呼吸综合征病毒猪伪狂犬病病毒多重PCR方法的建立以及初步应用 [J], 赵耘;秦玉明;张广川;赵启祖;宁宜宝;戴志红;谢磊4.非洲猪瘟病毒、猪瘟病毒和猪繁殖与呼吸综合征病毒多重TaqMan荧光定量RT-PCR检测方法的建立 [J], 王建华;陈小金;赵丹;王玉玲;张俊哲;肖妍;董志珍;赵祥平5.猪源牛病毒性腹泻病毒与猪瘟病毒一步法双重RT-PCR鉴别检测方法的建立及应用 [J], 梁洪;王怀禹;粟元文;魏玲因版权原因,仅展示原文概要,查看原文内容请购买。
猪瘟病毒荧光定量RT—PCR检测方法的建立及其初步应用

猪瘟病毒荧光定量RT—PCR检测方法的建立及其初步应用夏芳;何玲;罗满林;陈瑞爱【期刊名称】《广东畜牧兽医科技》【年(卷),期】2011(036)005【摘要】A set of primers and a TaqMan probe directed to the 5' NTR of CSFV genome sequences were designed for the PCR detection of CSFV. The total RNA extracted from the virus was used as the template for reverse transcription and PCR. The PCR products were cloned into pMD 18-T vector and the plasmid isolated from the positive clone was used for the standard material for the standard curve. So the specific RT-PCR method for detection of CSFV was established. The sensitivity of the assay was 10~ copies/tJ L. The viruses were detected in blood, spleen, lymph nodes and tonsils of the pigs immunized with different doses of classical swine fever cell vaccine.%针对CSFV基因组5'端非编码区序列设计并合成了高度特异的一对引物和一条探针,用于猪瘟病毒实时荧光定量PCR检测方法的建立。
将提取的病毒的总RNA做为模板进行反转录和PCR,将PCR产物克隆到pMDl8-T载体后进行大肠杆菌转化,提取阳性质粒做为标准品绘制标准曲线,成功地建立了特异性检测CSFV的荧光定量RT-PCR方法,其灵敏度达到10。
猪瘟和猪蓝耳病混合感染的荧光RT—PCR检测

猪瘟和猪蓝耳病混合感染的荧光RT—PCR检测
许瑞
【期刊名称】《兽药市场指南》
【年(卷),期】2013()9
【摘要】一、被检猪场情况河南省正阳县某养猪规模场,猪群来源自繁自养,为饲养管理场户主本人及家庭成员,养殖场相对独立,有门禁、消毒设施,进场消毒、换胶靴,定期消毒。
【总页数】2页(P49-50)
【关键词】PCR检测;混合感染;猪蓝耳病;RT;荧光;猪瘟;消毒设施;自繁自养
【作者】许瑞
【作者单位】驻马店市动物疫病预防控制中心
【正文语种】中文
【中图分类】S858.28
【相关文献】
1.用RT—PCR方法检测猪瘟与猪蓝耳病混合感染 [J], 王隆柏;周伦江;修金生;吴学敏;陈如敬;严山
2.猪蓝耳病病毒变异株TaqMan探针实时荧光定量RT-PCR鉴别诊断方法的建立[J], 晏勇邦;龚中贵;王俊峰;邓理主;王林川
3.应用荧光RT-PCR技术检测高致病性猪蓝耳病病毒 [J], 罗长保;肖性龙;鱼海琼;
田纯见;林志雄;余以刚;吴晖
4.高致病性猪蓝耳病与经典猪蓝耳病二重RT-PCR检测方法的建立及应用 [J], 杨
泽林;曾政;冉智光;米自由;熊仲良
5.猪瘟与猪蓝耳病混合感染的荧光定量RT-PCR诊断 [J], 彭彩丽;廖飞;杨胜红;赵孝木;杨先富
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
·426·
中国生物制品学杂志 2013 年 3 月第 26 卷第 3 期 Chin J Biologicals March 2013,Vol. 26 No. 3
98. 2%,while those of amplified PRRSV to ten representative PRRSV strains were 94. 1% ~ 97. 9%. Conclusion A multi- plex RT-PCR method for detection of CSFV and PRRSV was successfully developed,which laid a foundation of early diag- nosis and epidemiological investigation of classical swine fever and porcine respiratory and reproductive syndrome. Key words: Classical swine fever virus(CSFV); Porcine respiratory and reproductive syndrome virus(PRRSV); Multiplex reverse transcription-polymerase chain reaction
中国生物制品学杂志 2013 年 3 月第 26 卷第 3 期 Chin J Biologicals March 2013,Vol. 26 No. 3
·425·
· 技术方法 ·
猪瘟和猪蓝耳病病毒多重 RT-PCR 检测方法的 建立及初步应用宝来利来生物工程股份有限公司,山东 泰安 271000
摘要: 目的 建立猪瘟病毒(Classical swine fever virus,CSFV)和猪蓝耳病病毒(Porcine respiratory and reproductive syndrome virus,PRRSV)多重 RT-PCR 检测方法,并进行验证及初步应用。方法 根据 GenBank 中登录的 CSFV 和 PRRSV 疫苗株基因组序列,分别设计针对 CSFV 和 PRRSV 的两对引物,建立多重 RT-PCR 检测方法,并进行敏感性 及特异性验证。用建立的多重 RT-PCR 法检测 20 份疑似猪瘟、猪蓝耳病或混合感染病料,并与市售 RT-PCR 试剂盒 的检测结果进行比较;检测病料的部分 PCR 产物测序后,与 9 株具有代表性的 CSFV 毒株和 10 株具有代表性的 PRRSV 毒株进行核苷酸序列同源性比对。结果 以 CSFV 和 PRRSV 混合引物扩增,分别可扩增出 286 和 664 bp 的特异性条带。建立的多重 RT-PCR 检测方法可检出 100 倍稀释的病毒 RNA;该方法可检出 CSFV、PRRSV 及 CSFV 与 PRRSV 混合病毒,而猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Transmissible gastro-enteritis virus,TGEV)、猪圆环病毒(Porcine circovirus,PCV)、猪细小病毒(Porcine parvovirus,PPV)和猪 伪狂犬病病毒(Porcine pseudorabies virus,PRV)的检测结果均为阴性;该方法检测 20 份疑似猪瘟、猪蓝耳病或混合 感染病料的结果与市售 RT-PCR 试剂盒比较,灵敏度达 100%;选取的两份 CSFV 扩增片段与 9 株具有代表性的 CSFV 毒株的核苷酸序列同源性在 92. 3% ~ 98. 2%之间,扩增的 PRRSV 与 10 株具有代表性的 PRRSV 毒株的核苷 酸序列同源性在 94. 1% ~ 97. 9%之间。结论 成功建立了 CSFV 和 PRRSV 多重 RT-PCR 检测方法,为猪瘟和猪蓝 耳病的早期诊断及流行病学调查奠定了基础。 关键词: 猪瘟病毒;猪蓝耳病病毒;多重逆转录聚合酶链反应
猪瘟是由黄病毒科(Flaviviridae)瘟病毒属(Pesti virus)的猪瘟病毒(Classical swine fever virus,CSFV)[1] 引起的猪高致死性烈性传染病,该病以高热稽留、全 身广泛性出血、败血症、母猪繁殖障碍为主要特征[2]。 猪繁殖与呼吸综合征(Porcine respiratory and reproductive syndrome,PRRS)又称猪蓝耳病,是由动脉炎 病 毒 科(Arteriviridae)动 脉 炎 病 毒 属(Arterivirus)猪 繁殖与呼吸综合征病毒(PRRS virus,PRRSV)[3]引 起的一种猪高度接触性传染病,该病以母猪发生流 产、产死胎、弱胎、木乃伊胎以及仔猪呼吸困难、高死 亡率等为特征[4]。目前很多猪场均同时存在这两种 疾病,严重影响猪的生产[ 。 5-6]
中图分类号: S852. 65 + 1 S851. 34 + 7. 1 / . 7-1 文献标识码: A 文章编号:1004-5503(2013)03-0425-05
Development and preliminary application of multiplex RT-PCR for classical swine fever virus and porcine reproductive and respiratory syndrome virus
1. 2 主 要 试 剂 rTaq DNA 聚 合 酶 、dNTP Mixture (各 10 mmol / L)、DNA marker DL2000、反转录酶 M-MLV(Rnase H-)和 RNA 酶抑制剂 RNase Inhibitor 购自宝生物工程(大连)有限公司;Trizol 试剂购自上 海英骏生物技术有限公司;RNA 吸附柱为北京百泰 克生物技术有限公司产品;其他试剂均为国产试剂。 1. 3 引 物 设 计 及 合 成 根 据 GenBank 中 登 录 的 CSFV(JQ411591)和 PRRSV(EF635006)疫 苗 株 的 基因组序列,应用 Primer 5. 0 软件各设计 1 对引物, 见表 1。引物由生工生物工程(上海)股份有限公司 合成。
CHEN Tian-tian,CHENG Fu-liang,LIANG Jin,SU Zhi-rui,FAN Qun-ping Shandong Baolai Bioengineering Co. Ltd.,Tai’an 271000,Shandong Province,China
Corresponding author:CHENG Fu-liang,E-mail:cfl_0428@ Abstract: Objective A multiplex RT-PCR method for detection of classical swine fever virus(CSFV)and porcine repro- ductive and respiratory syndrome virus(PRRSV)was developed,verified and preliminarily applied. Methods According to the genomic sequences of CSFV and PRRSV reported in GenBank,two specific pairs of primers were designed,based on which a multiplex RT-PCR method was developed and verified for sensitivity and specificity. Twenty suspected sam- ples with CSFV,PRRSV or mixed infection were detected by the developed method,of which the results were compared with those by commercial RT-PCR kit. The PCR products of partial samples were sequenced,and analyzed for homolo- gies of nucleotides to those of representative nine CSFV strains and ten PRRSV strains. Results Specific gene fragments at lengths of 664 and 286 bp respectively were amplified by RT-PCR using the mixed primers for CSFV and PRRSV. The viral RNA at a dilution of 1 ∶ 100 was detected by the developed method. The detection results of CSFV,PPRSV and mixture of the two viruses were positive,while those of porcine epidemic diarrhea virus (PEDV),transmissible gastro-en- teritis virus(TGEV),porcine circovirus(PCV),porcine parvovirus(PPV) and porcine pseudorabies virus(PRV) were negative. Compared with that of commercial RT-PCR kit,the sensitivity of the developed method for 20 suspected sam- ples was 100%. The homologies of nucleotides amplified CSFV to those of nine representative CSFV strains were 92. 3% ~
