限度样品一览表
限度样品管理规定

1、目的
对限度样品进行有效管理,确保品质实物标准有效的被应用。
2、范围
本规定適用于所有产品限度样品的管理。
3、权责 3.1品保部
对限度不良样品的收集和作成,并负责其保存和管理。
3.2相关部门
提供有代表性限度不良样品给品保部确认。
4、定义
限度样品:按书面标准描述做成的合格或不合格的有缺限的产品为限度样品。
5、作业内容
5.1 限度样品的作成:
品保部收集有缺陷的样品,按品名分类注明产品不良状态,交品保部负责人或客户确认,确认结果后用文字叙述在相应标签的限度里,再按客户分类,品保部组长审核,标签样式如下:
5.2限度样品的管理:
5.2.1限度样品保存在品保部,客户承认的限度样品参见<限度样品一览表>。
5.2.2限度样品的有效期限为一年,超过一年的限度样品须重新确认,限度样品确认由
品保部负责。
5.2.3当客户允收标准发生变更时,对应产品的限度样品须重新按照客户标准确认一次,做
成新的限度样品来培训检查员和作业员。
5.2.4客户提供的限度样品统一贴“限度样品”标签,客户标签和“限度样品”标签同时保
存,以便追溯。
6.相关文件
无
7.使用表单 无。
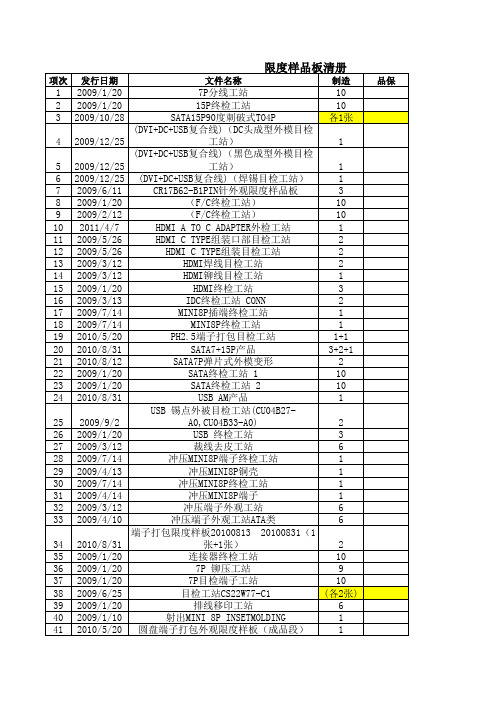
限度样品板清单
HDMI HOT-BAR 焊 目检工站
1
101 2011/11/19
LED开关外观限度样板
1
102 2011/11/19
USB AF 手工
1
103 2011/11/19 双并线+SR CABLE外观不良限度样板
4
104 2011/11/23
四合一卡座系列
1
105 2011/11/24
SATA外观限度看板
95 2011/10/13
USB3.0自动机目检工站
1
96 2011/10/13
MICRO USB 5P CONN
1
97 2011/10/13
MINI USB 5P CONN
1
98 2011/10/13
X-BOX主体外观限度样板
1
99 2011/10/13
USB AF双层 CONN
1
100 2011/10/25
10 10 1 2 9 2 2 2 1 2 1 5 2 各1张 1 1 3 2 1 4张 1 2 1 1 1 1 1 1 14 1 6 1 1 2 1 1 1 1 1 1 1 12 3 1+2 1 1+2 1
各1张
88 2011/6/20
SATA7+6P胶芯撞伤不良限度样品板
1
89 2011/6/23
1
11 2009/5/26
HDMI C TYPE组装口部目检工站
2
12 2009/5/26
HDMI C TYPE组装目检工站
2
13 2009/3/12
HDMI焊线目检工站
2
14 2009/3/12
HDMI铆线目检工站
1
美英欧药典微生物限度标准与中国药典的比较

• d. 不得有金黄色葡萄球菌/1g或1ml或1斑
• 3类 • A口服和直肠给药的制剂
• • a.活菌总数 细菌不超过103,霉菌和酵母菌不
超过102/1g或1ml
• • b.不得有大肠埃希菌/1g或1ml
• • B.含天然原料动物、植物、矿物的口服制剂,
不包括抗菌制剂,有关当局同意的原料微生物 污染活菌超过103/g或ml,4类规定的草药除外。
• a.活菌总数,细菌不超过104、霉菌和酵 母菌不超过102/g或ml。
• b.肠道菌和某些其他革兰阴性菌不超过 102/g或ml
• c.不得有沙门菌(10g或10ml)
• d.不得有大肠埃希菌(1g或1ml)
BP和EuP
• 原料、口服制剂的绝大多数品种规定了细菌数、 霉菌和酵母菌数,
• 有8个原料品种(注射葡聚糖1、胰酶、木薯淀 粉等)和1个制剂品种(平婆颗粒)未规定细 菌数、霉菌和酵母菌数。
细菌数分档,有5档: (102,103,104,105,107),
霉菌和酵母菌数分档,有3档:(102,104,105)。 细菌数的档次少,霉菌和酵母菌数只一个档,1g或
3 控制菌及检验量
• USP 要求10g或10ml样品不得有大肠埃希菌、 沙门菌、金黄色葡萄球菌、铜绿假单胞菌。
• 原料、口服制剂
• 多数品种要求检查大肠埃希菌和沙门菌,
• 少数口服品种还规定10g或10ml不得有金黄色 葡萄球菌和.铜绿假单胞菌或金黄色葡萄பைடு நூலகம்菌。
• 也有少部分品种控制肠道菌、肠杆菌科、大肠 菌群。
细菌数分的档次有10档
(10,102,2×102, 3×102,5×102,103,104, 105,106,107)。
微生物限度检验

2007.4
1
微生物限度检查 (Microbial Limits Test) :
是指非无菌制剂及原,辅料受到微生物污染程度的检查。 包括:
1)细菌计数; 2)霉菌及酵母菌计数; 3)控制菌检查:大肠杆菌,沙门菌,铜绿假单胞菌,金黄色葡 萄球菌,大肠菌群
2
细菌、霉菌及酵母菌计数
稀释剂对照组:
蛋白胨稀释液 9.9ml 104 cfu/ml菌悬液 0.1 ml
计数B (阴性对照)
菌种组:
104 102
计数C (阳性对照)
空白样品组:
计数D
24
结果判断依据:
1、样品组和稀释剂对照组微生物计数结果吻合,表明: - 添加的中和剂完全消除了样品的抑菌性。 2、稀释剂对照组和菌种组微生物计数结果吻合,表明: - 中和剂没有毒性,没有影响测试菌的生长。 - 测试方法和培养条件不影响测试菌的生长。 3、空白样品组测试结果阴性,表明: - 本次测试样品合格。 - 无菌操作正确。没有污染事件发生。
甘露醇氯化钠琼 脂 (或卵黄氯化钠琼 脂) 35-37 ℃,18-72h
0.2ml 涂抹于 含庆大霉素的哥 伦比亚琼脂 厌氧, 35-微生物限度检查法与英美比较
比较项目
检验条件规定 计数测定方法 控制
ChP2005
总体10000级、局部100级 平皿法、薄膜过滤法、MPN 大肠埃希菌、大肠菌群、沙门 菌(10)、铜绿假单胞菌、金葡 球菌、梭菌、其他致病菌 pH7.0氯化钠-蛋白胨缓冲液; pH6.8/7.6PBS;0.9%NaCl 细菌数:营养琼脂,48hrs 霉菌及酵母:玫瑰红钠琼脂, 72hrs,5~7天
10
恢复试验
- 微生物方法验证的实质就是评价和考察微生 物恢复试验(恢复生长)的可信度。 - 恢复试验就是确认某一检验方法,它可以使 加入其中的各种微生物都能够恢复生长。
限度样品管理办法

1 . 目的:为使本公司限度样品能有效管理及正常使用,特订定本办法。
2、适用范围:凡外观检验之半、成品均适用之3. 术语定义:限度样品:制程上因产品外观品质无法以书面订定规格而批准容许的外观实物样品。
4. 权责:品质部:负责限度样品的提供、量产限度样品的批准、管理、定期检验、报废批准。
研发部:负责量产前限度样品提交客户批准或自行批准。
使用单位:负责限度样品的保管、使用与清洁。
5. 作业内容:限度样品之批准与制作:量产前:由品质部提供样品给与研发部门,由研发部主管批准。
如需要客户批准时会同客户,针对品质上各项不明确点由客户确认并批准。
若因客户要求,需在限度样品制作、批准完成前先行量产,得到客户同意后,可先行量产后再制作、批准限度样品。
量产后:由品质部提供样品,并由品质最主管批准。
设计变更时:同办理。
当客户的品质标准有异议:需重新签认样品时,同办理。
所有限度样品均需在《限度样品标示卡》上填上品名、料号、版本号、外观类别、日期、站别、批准人及限度类别,限度类别分为:轻微、一般、严重,每个类别最少为三个限度样品。
限度样品须放置于硬纸板(或塑胶)盒子内,并用《限度样品标示卡》进行标示。
限度样品的制作份数为三份,制造、品质使用单位各一份,品质文员保存一份。
限度样品之使用:对于制程上各工程之半成品、成品在检验外观有无法判定时,可以用限度样品进行参照判定,以符合品质要求。
客户对外观品质有疑问时,可借助限度样品进行判定。
限度样品之管理:限度样品批准后,由使用单位专人负责并固定放置位置并定期进行清洁。
对于须鉴定产品色泽样品,应妥善保存,避免损毁或褪色造成标准不同。
使用单位将批准后的限度样本登录于《限度样品一览表》。
品质部每6个月一次对限度样品进行检验,若发现有异常时,报废处理。
检验完成后在《限度标示卡》上写上检验日期与检验人姓名,并在其上面盖上检验合格章。
限度样品的保质期限:限度样品从批准日期算起保质期限为三年。
限度样品的报废:限度样品保质期限到后,由品质部文员统一收回并统一报废处理。
限度样品标准书

页数
3/5
精心整理
限度样品管制表
零件料号 不良项目(部位) 制作日期 使用周期 制作人 备注
文件名称
限度样品及标准样品管制标准书
发行日期
文件编号
版次/本
A
页数
3/5
精心整理
系列标准样品管制表
零件料号 制定日期 有效日期 更换日期 更换原因 更换日期 更换原因
受的零部件或产品. ﹑缺料﹑包风﹑缩水﹑毛边. 明合格标准底限者为限度样品.
文件名称 文件编号
限度样品及标准样品管制标准书 版次/本
发行日期
A
页数
2/5
精心整理 品.
4.2.标准样品: 项目承认 OK 之合格品. 项目承认 OK 之合格品.
五.作业内容: 5.1.作业内容: 样品制作后由品保判定.
文件编号
版次/本
六.记录表单:
6.1.限度样品管制表.
6.2.标准样品管制表.
七.使用标签:
发行日期
A
页数
3/5
限度样品标签
样品料号标: 准样品标签
样不品良料项号目:: 制做日期: 制做日期: 有效日期: 有制效做日: 期: 制核做准::审核:
核准:审核:
文件名称
限度样品及标准样品管制标准书
发行日期
精心整理 文件名称 文件编号
限度样品及标准样品管制标准书 版次/本
发行日期
A
页数
1/5
精心整理 一.目的:
为了确保产品质量符合要求,保障客户权益,对产品作限度样品及标准样品,作为厂内零件﹑半成品﹑ 成品之质量判定参考. 二.适用范围: 本公司所有产品和零件﹑半成品﹑成品均适用之. 三.管理责任: 3.1.限度样品及标准样品制作与更换:品保部各 QC 3.2.限度样品及标准样品之审核:品保部课级以上主管 3.3.限度样品及标准样品之核准:品保部主管 3.4.限度样品及标准样品之管制:品保部各组组长 四.名词解释: 4.1.限度样品:
微生物限度检查记录表

(18~24h)
RV沙门选择培养
(18~24h)
木糖赖氨酸脱氧胆酸盐分离培养
(18~48h)
三糖铁琼脂斜面穿刺接种
(18~24h)
供试品
阴性对照
阳性对照
结果
□检出沙门菌□未检出沙门菌(规定:不得检出/10g)
五、耐胆盐革兰阴性菌检查
胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配置批号:)、紫红胆盐葡萄糖琼脂培养基(配置批号:)
2天
3天
4天
5天
6天
7天
均值
结果
cfu/gml(规定:≦8000cfu/gml)
cfu/gml(规定:≦80cfu/gml)
三、大肠埃希菌检查
胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配置批号:)、麦康凯琼脂培养基(配置批号:)
胰酪大豆胨液体培养基增菌培养
(30~35℃,18~24h)
麦康凯液体培养基选择培养
微生物限度检查记录(通用)
样品名称
检验编号
批号
规格
检品来源
数量
检验依据
消毒时间
紫外:
检验日期
完成日期
供
试
液
制
备
1.常规法:取供试品10gml,用胰酪大豆胨琼脂培养基稀释至100ml,用匀浆仪等适宜的方法混匀,制成1:10供试液。
2.薄膜过滤法:取本品用开口面积为20cm2的灭过菌的金属模板压在内层面上,将无菌棉签用pH7.0无菌氯化钠-蛋白胨缓冲液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置,擦拭总面积为100cm2。每支棉签擦抹完后立即用灭菌剪刀将棉签头剪断,将剪下的棉签头投入盛有30mlpH7.0无菌氯化钠-蛋白胨缓冲液的灭菌广口瓶(或大试管)中。全部擦抹棉签投入瓶中后,振摇1分钟,静置10分钟,即得供试液。
限度样板或样品管理规范(含表格)

限度样板或样品管理规范(IATF16949-2016/ISO9001-2015)1.0目的:明确规定公司对产品外观及其他检验项目的限度样品或样板管理办法,以及客户端传达至公司的限度样板或样品的管理办法。
2.0适用范围:本规定适用于公司所有产品相关限度样品或样板的管理。
凡外观检验之半、成品均适用之3.0职责:品质部为本管理规定的总负责人3.1 技术部/生产部: 负责协助品质部限度样板及样品的签定及执行;3.2 品质部: 负责公司内部产品的限度样板或样品的确认及、签定及管理,对客户端传递的限度样板或样品进行确认及管理。
负责对各部门进行宣达、传递及培训。
4.0定义限度样板:制程上因产品外观品质无法以书面订定规格而批准容许的外观实物样品5.0作业内容:5.1限度样品之批准与制作:5.1.1 量产前:由品质部与技术部主管共同批准。
如需要客户批准时,会同客户针对品质上各项不明确点由客户确认并批准。
若因客户要求,需在限度样品制作、批准完成前先行量产,得到客户同意后,可先行量产后再制作、批准限度样品。
5.1.2量产后: 由品质部提供样品,并由品质最主管批准。
5.1.3设计变更时:同5.1.1办理。
5.1.4当客户的品质标准有异议:需重新签认样品时,同5.1.1办理。
5.1.5所有限度样品均需在《限度样品标示卡》上填上品名、料号、签定项目、日期、批准人及限度类别,限度类别分为:轻微、一般、严重,每个类别最少为三个限度样品。
5.1.6限度样品须放置于硬纸板(或塑胶)盒子内,并用《限度样品标示卡》进行标示。
5.1.7限度样品的制作份数为三份,制造、品质使用单位各一份,品质文员保存一份。
5.2限度样品之使用:5.2.1对于制程上各工程之半成品、成品在检验外观有无法判定时,可以用限度样品进行参照判定,以符合品质要求。
5.2.2客户对外观品质有疑问时,可借助限度样品进行判定。
5.3限度样品之管理:5.3.1限度样品批准后,由使用单位专人负责并固定放置位置并定期进行清洁。
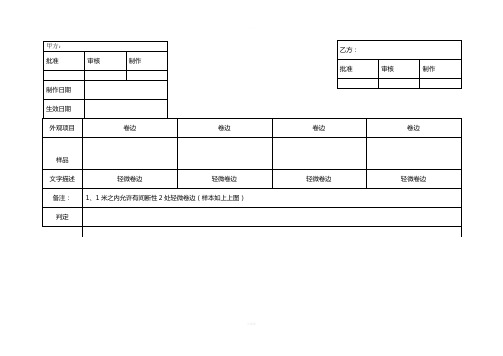
外观限度样本
判定
备注:1、限度样本的允许范围如有变更,将参照《原料镍带标准》为准
2、此标准一式两份,双方确认以后方可生效
3、标准签订后不得随意更改,更改时必须双方确认
甲方:
批准
审核
制作
制作日期
生效日期
外观项目
卷边
卷边
卷边
卷边
样品
文字描述
轻微卷边
轻微卷边
轻微卷边
轻微卷边
备注:
1、1米之内允许有间断性2处轻微卷边(样本如上上图)
判定
乙方:
批准
审核
பைடு நூலகம்制作
制作日期
生效日期
外观限度样本
外观项目
卷边
卷边
卷边
卷边
样品
文字描述
严重卷边
严重卷边
严重卷边
严重卷边
备注:
2、如果1米之内出现3处轻微卷边(样本如上上图)
食品实验室接收检测样品量公示表

单个种类产品数量在500<N≤3000时所抽样品数量为9
单个种类产品数量在5003000<N≤10000时所抽样品数量为18
单个种类产品数量在N>10000时所抽样品数量21
2。香水类的化妆品抽取样品:
单个种类产品数量在0<N≤150时所抽样品数量2
3个以内检测项目0。3kg(如项目较多或检验过氧化值、酸价等特殊项目需酌情加每个检测项目至少不少于50g样品。(单包装重量不低于0。1kg,如项目较多,需酌情加量)
同上
化妆品
出口化妆品检验检疫工作规程
1.护肤/发用/美容化妆品、卫生清洁用品、特殊功能化妆品:
单个种类产品数量在0<N≤150时所抽样品数量为3,
《鲜、冻禽产品》(GB 16869-2005)
进口肉类:取样的数量能够充分代表批的整体,货物总件数小于等于100件的,随机抽样7件;货物总件数101-250件的,随机抽样8件;货物总件数250-10000件的,随机抽样9件;货物总件数大于等于10000件的,最多抽样9件。实施检测项目的样品数量则根据样品检测情况确定混样数量,每个混样重量不得少于1KG。
应按分析项目要求分别采取不同部位的样品或混合后采样,每类检测项目至少取1个样品,每个样品至少2kg。
生产时间(尽量覆盖所有加工日),每次检测至少取5个样品,每个样品至少200g。
同上
同上
肉制品
《出入境动物检疫采样》GB 18088-2000;《鲜、冻禽产品》GB 16869—2005;《肉与肉制品取样方法》GB/T 9695。19-88;《食品微生物检验总则》GB/T 4789。1-2003;食品卫生检验方法理化部分总则GB 5009。1-2003
