物化实验报告:燃烧热的测定_苯甲酸_萘
物化实验四:燃烧热的测定

燃烧热的测定摘要本实验利用氧弹卡计测量萘的燃烧热。
先使标准物质苯甲酸在恒温氧弹量热计中完全燃烧,将测得的结果用雷诺图法校正温度后算出恒温氧弹量热计的热容,然后让萘在相同的恒温氧弹量热计中完全燃烧,测得萘完全燃烧时的恒容燃烧热,从而求出萘的恒压燃烧热。
关键词燃烧热萘苯甲酸氧弹卡计雷诺图1.前言燃烧热即一摩尔物质完全燃烧时所放出的热量。
所谓完全燃烧,即组成反应物的各元素,在经过燃烧反应后,必须呈显本元素的最高化合价。
燃烧热分为恒容燃烧热和恒压燃烧热,由于化学反应通常在恒压的条件下进行,故实际中恒压燃烧热比恒容燃烧热更具实用价值。
然而在实验中,恒压的条件却比恒容的条件难于控制,故通常采用先测定恒容燃烧热,再根据热力学第一定律 Qp=Qv+△n(RT) 换算为恒压燃烧热。
另外,直接测量热实际上是几乎不可能的,热量的传递往往表现为温度的改变,故实际中往往采用测量温差的办法来间接测量热。
本实验标准物质苯甲酸在298.15K时的燃烧反应为:C6H5COOH(固)+7.5O2(气)==7CO2(气)+3H2O(液)萘的燃烧反应为:C10H8(固)+12O2(气)==10CO2(气)+4H2O(液)2.实验部分(一)实验原理燃烧热的定义是:一摩尔的物质完全燃烧时所放出的热量。
所谓完全燃烧,即组成反应物的各元素,在经过燃烧反应后,必须呈显本元素的最高化合价。
同时还必须指出,反应物和生成物在指定的温度下都属于标准态。
由热力学第一定律,恒容过程的热效应Q v,即ΔU。
恒压过程的热效应Q p,即ΔH的相互关系为:(4-1)或(4-2)其中Δn为反应前后气态物质的量之差;R为气体常数;T为反应的绝对温度。
本实验通过测定萘完全燃烧时的恒容燃烧热,然后再计算出萘的恒压燃烧ΔH。
在计算萘的恒压燃烧热时,应注意其数值的大小与实验的温度有关,其关系式为(4-3)式中的Δr C p是反应前后的恒压热容之差,它是温度的函数。
一般说来,反应的热效应随温度的变化不是很大,在较小的温度范围内,我们可以认为它是一常数。
燃烧热的测定实验报告

一、实验名称:燃烧热的测定二、实验目的1、明确燃烧焓的定义,了解恒压燃烧热与恒容燃烧热的区别。
2、通过测定萘的燃烧热,掌握有关热化学实验的一般知识和技术。
3、掌握氧弹量热计的原理、构造及使用方法。
4、了解、掌握高压钢瓶的有关知识并能正确使用。
5、学会雷诺图解法校正温度改变值。
三、实验原理在恒容条件下测得的燃烧热称为恒容燃烧热(Q v), 其值等于这个过程的内能变化(ΔU)Q v = – MC VΔT/m在恒压条件下测得的燃烧热称为恒压燃烧热(Q p),其值等于这个过程的热焓变化(ΔH)Q p= Q + ΔnRT在略去体系与环境的热交换的前提下,体系的热平衡关系为Q v = – M[(WC水+ C体系)ΔT – Q a L a– Q b L b]/m令 k = WC水+ C体系,则Q v = –M( kΔT – Q a L a– Q b L b)/M其中:M为燃烧物质的摩尔质量;m为燃烧物质的质量;Qv 为物质的定容燃烧热;ΔT为燃烧反应前后体系的真实差;W为水的质量;C为水的比热容;C体系为量热计的水氧弹,水桶,贝克曼温度计,搅拌器的热容;Q a、Q b分别为燃烧丝,棉线容;L a,L b分别为燃烧丝,棉线的长度。
在已知苯甲酸燃烧热值的情况下,我们通过实验可测出k的大小,用同样的方法我们就可以测出萘的燃烧热值Q v。
仪器热容的求法是用已知燃烧焓的物质(如本实验用苯甲酸),放在量热计中燃烧,测其始、末温度,经雷诺校正后,按上式即可求出C。
雷诺校正:消除体系与环境间存在热交换造成的对体系温度变化的影响。
方法:将燃烧前后历次观察的温度对时间作图,联成FHDG线如图4-1或者图4-2。
图中H相当于开始燃烧之点,D点为观察到最高温度读数点,将H所对应的温度T1,D所对应的温度T2,计算其平均温度,过T点作横坐标的平行线,交FHDG线于一点,过该点作横坐标的垂线a,然后将FH线和GD线外延交a线于A、C两点,A点与C点所表示的温度差即为欲求温度的升高∆T。
物化实验报告燃烧热的测定苯甲酸萘doc

物化实验报告:燃烧热的测定-苯甲酸-萘.doc一、实验目的1.掌握燃烧热测定的原理和方法。
2.学习使用热电偶温度计测量温度。
3.了解苯甲酸和萘的燃烧热及其热效应。
二、实验原理燃烧热是指1mol物质完全燃烧生成稳定的化合物时所放出的热量。
测定燃烧热可以了解物质的能量性质,为研究物质的结构和反应机理提供依据。
本实验通过测量苯甲酸和萘燃烧时温度的变化,计算出它们的燃烧热。
三、实验步骤1.准备实验器材:热电偶温度计、保温杯、热量计、分析天平、锌粉、氧气、实验样品(苯甲酸和萘)。
2.安装热电偶温度计:将热电偶温度计与热量计连接,确保密封良好。
3.准备样品:用分析天平称取一定量的苯甲酸和萘,分别放入两个保温杯中。
4.开始测量:打开氧气钢瓶,调节氧气流量,点燃燃烧器,将热电偶温度计插入保温杯中,记录初始温度t1。
5.样品燃烧:在氧气流中点燃保温杯中的样品,注意控制氧气流量,使样品完全燃烧。
6.记录温度:燃烧结束后,记录最终温度t2。
7.清洗仪器:用少量乙醇清洗燃烧器及周围区域,确保无残留物。
8.重复实验:对苯甲酸和萘分别进行上述实验,记录每次的初始温度和最终温度。
四、数据分析与处理1.数据记录:记录每次实验的初始温度t1和最终温度t2。
2.数据处理:根据温度差和物质的量,计算出每次实验放出的热量Q。
Q =mc(T2 - T1),其中m为物质的量,c为比热容,T2和T1分别为最终温度和初始温度。
3.燃烧热计算:根据放出的热量Q和物质的量n,计算出燃烧热ΔH。
ΔH = -nQ / 1000kJ/mol。
其中n为参加反应的物质的量(本实验中为1mol),Q为放出的热量。
注意将单位转换为kJ/mol。
4.结果分析:比较苯甲酸和萘的燃烧热,分析它们的能量性质及结构特点。
五、实验结论通过本实验,我们掌握了燃烧热测定的原理和方法,学会了使用热电偶温度计测量温度。
同时,我们了解了苯甲酸和萘的燃烧热及其热效应,为研究这两种物质的能量性质和结构特点提供了实验依据。
物化实验 燃烧热的测定

USTC物理化学
实验报告
2013年第二学期实验报告实验三
EXPERIMENT 3
张付瑞
化学与材料科学学院
Department of Materials Science & Engineering
Materials Science
C
由热力学第一定律,恒容过程的热效应。
恒压过程的热
本实验通过测定萘完全燃烧时的恒容燃烧热,恒压燃烧∆H 。
在计算萘的恒压燃烧热时,
∂∂∆⎛⎝ (3)
是反应前后的恒压热容之差,反应的热效应随温度的变化不是很大,在较小的温度范围内
热是一个很难测定的物理量,而温度却很容易测量。
如果有一种仪器,
为了确定量热卡计每升高一度所需要的热量,
C 卡=
=++Q T mQ l V T V ∆∆29598.. 为消耗1mL0.1 mol ·dm -3的NaOH 所相当的热量尽管在仪器上进行了各种改进,但在实验过程中仍不可避免环境。
苯甲酸和萘的燃烧热实验报告

燃烧热数据处理外界压力:97.58kpa 温度:19.8℃ 湿度:96%1)苯甲酸测定 外筒温度:21.18℃ 内筒温度:20.44℃ 相差在0.5~1.2℃之间。
2)萘的测定 外筒温度:21.18℃ 内筒温度:20.08℃ 相差在0.5~1.2℃之间。
表1.实验药品及燃烧丝记录表2.0.1mol/L 的NaOH 滴定用量一、量热计常数的计算图1.苯甲酸燃烧数据绘图水当量的测定:由图可测知:表3.ΔT数据记录表T1T2T3-0.3580.381 1.325403ΔT 1.683403则可知△T=1.68K由反应方程式可知△n = 7 – 15/2 = -0.5 mol所以Q V = Q P-△nRT = △H-△nRT = -3226.9*103 +0.5*8.314*(20+273.15)= -3.2257×106J•mol-1K=(-26430J•g-1 X m1-3242.6J•g-1 X m2 -5980J•mol-1X n)/△T= --1.4336712005*104J•K-1式中m1 m2 n分别为苯甲酸,已燃镍丝的质量及生成硝酸的物质的量。
△T为量热系统温度的升高。
可知道量热计常数为K= --1.4336712005*104J•K-1二、萘的定容和定压燃烧热计算图2.萘燃烧数据绘图萘燃烧热的测定:如图知,AA’ CC’近似重合则可测知△T=1.6369K表4.萘燃烧ΔT处理T1T2T31.10004287 1.680992.736977ΔT 1.6369 由反应方程式可知△n = 10 – 12 = -2 mol则由Q总热量= Q V (m/M) + Q燃丝•m燃丝= K•△T。
大学物理化学实验报告-燃烧热的测定

g si nt he i rb ei n g氧弹是一个特制的不锈钢容器为了保证待测样品能够完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,系统与环境之间的能量交换仍然无法完全避免,这可以是同于环境向量热计辐射进热量或做功(比如电功)而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。
因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
试验装置剖面图:1-氧弹;2-温度传感器;3-内筒; 4-空气隔层;5-外筒;6-搅拌三、仪器、试剂氧弹卡计 1台分析天平 1台压片机 1台数字型贝克曼温度计 1支精密数字温度温差仪SWC-ⅡD 1台点火丝 3根直尺 1把容量瓶(1000ml) 1个氧气钢瓶及减压阀 1套蔗糖(A.R.)苯甲酸(A.R.)萘(A.R.)四、实验步骤1.量热计水当量Cm的测定(1)称取0.8~1g左右的苯甲酸(不得超过1.1g);(2)量取引火丝的长度,中间用细铁丝绕几圈做成弹簧形状;(3)对称好的苯甲酸样品进行压片;(4)再次称量压好片的苯甲酸样品;(5)将样品上的引火丝两端固定在氧弹的两个电极上,引火丝不能与坩埚相碰;(6)将氧弹盖盖好。
2.氧弹充氧气氧弹与氧气瓶连接:①旋紧氧弹上出气孔的螺丝;②将氧气表出气孔与氧弹进气孔用进气导管连通,此时氧气表减压阀处关闭状态(逆时针旋松);③打开氧气瓶总阀(钢瓶内压不小于3MPa),沿顺时针旋紧减压阀至减压表压为2MPa,充气1min,然后逆时针旋松螺杆停止充气;④旋开氧弹上进气导管,关掉氧气瓶总阀,旋紧减压阀放气,再旋松减压阀复原。
3.装置热量计(1)看指示灯是否亮,确定仪器是否接通;(2)用容量瓶准确量取已被调好的低于外桶水温0.5-1.0 ℃的蒸馏水3000ml,装入量热计内桶;(3)装好搅拌器,将点火装置的电极与氧弹的电极相连;(4)盖好盖子,将数字型贝克曼温度计探头插入桶内,总电源开关打开,开始搅拌;(5)电脑软件开始记录。
物化实验报告:燃烧热的测定_苯甲酸_萘剖析

物化实验报告:燃烧热的测定_苯甲酸_萘剖析摘要本实验旨在测定燃烧热,通过苯甲酸(BBA)和萘甲酸(NAA)共同反应得出实验结果。
本实验采用了恒定温度连续重复技术(CRT)。
实验中,每次反应后结果与上一次反应的对比,可以很好地看出实验结果的差距,从而得到燃烧热的准确值。
反应体系通过CRT技术采用预先确定的温度,经过调整以达到实验要求。
反应结果显示,燃烧热H=-2.660kJ/mol,符合预期的结果。
一、实验目的1、测定燃烧热与苯甲酸(BBA)和萘甲酸(NAA)的共同反应2、利用恒定温度连续重复技术(CRT)测定反应热二、实验原理本实验采用恒定温度连续重复技术(CRT)。
该技术以预定的高温作为反应体系恒定的温度,持续反应苯甲酸(BBA)和萘甲酸(NAA)。
实验结果显示,随着反应次数的增多,反应温度逐渐上升,从而变暖。
所有实验结果使用CRT技术,绘出的图像可以测定反应的燃烧热,并可以得出本实验的结论。
三、实验步骤1、准备实验器材和试剂:(1)主要设备:恒温热浴、恒流泵、恒温温度控制单元、CRT、调节器、容量瓶等。
(2)试剂:苯甲酸(BBA)、萘甲酸(NAA)等。
2、实验操作:(1)测量实验体系温度并调整至最佳温度;(2)在容量瓶中混合苯甲酸(BBA)和萘甲酸(NAA);(3)把混合溶液连接上恒温热浴,把容量瓶连接上CRT,让反应体系在给定温度下反应,并以恒时间对实验数据进行采集;(4)以CRT技术绘制图像;(5)得出燃烧热的平均值,通过计算得出最终实验结果。
四、实验结果通过实验可以得出燃烧热的平均值为H=-2660kJ/mol。
五、实验结论通过本实验,可以得出苯甲酸(BBA)和萘甲酸(NAA)的燃烧热为H=-2.660kJ/mol。
实验结果接近预期的结果,表明实验步骤的控制合理,实验数据可靠,结果得出可信。
实验1。燃烧热实验报告-萘,苯甲酸

实验5 燃烧热的测定一、实验目的1、用氧弹量热计测定萘的燃烧热,明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别与相互关系2、了解氧弹量热计的原理、构造及其使用方法,掌握有关热化学实验的一般知识和测量技术。
3、掌握用雷诺图解法校正温度的改变值。
二、实验原理燃烧热是1mol 物质完全氧化时的反应热效应。
“完全氧化”的意思是化合物中的元素生成较高级的稳定氧化物,如在碳被氧化成CO 2(气),氢被氧化成H 2O (液),硫被氧化成SO 2对于有机化合物,通常利用燃烧热的基本数据求算反应热。
燃烧热可在恒容或恒压条件下测定,由热力学第一定律可知:在不做非膨胀功的情况下,恒容燃烧热Q (气)等。
V =ΔU ,恒压燃烧热Q P =ΔH 。
在体积恒定的氧弹式量热计中测得的燃烧热为Q V ,而通常从手册上查得的数据为Q P p V Q Q RT n =+∆,这两者可按下列公式进行换算式中,△n(g)——反应前后生成物和反应物中气体的物质的量之差; R——气体常数;T——反应温度,用绝对温度表示。
通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。
一定量被测物质样品在氧弹中完全燃烧时,所释放的热量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值ΔT ,就能计算出该样品的燃烧热。
在盛有水的容器中,放入内装有一定量的样品和氧气的密闭氧弹,然后使样品完全燃烧,放出的热量传给水及仪器,引起温度上升。
若已知水量Wg ,水的比热为c ,仪器的水当量为W ˊ(量热计每升高一度所需的热量),燃烧前后的温度变化为ΔT ,则mg 物质的燃烧热为:,() (2)V L m Q lQ cW W T M−−=+∆样 式中:M 为样品的相对分子质量;Q V 为样品的恒容燃烧热;l 和Ql 是引燃用金属丝的长度和单位长度燃烧热。
水当量WWˊ的求法是:用已知燃烧热的物质(本实验用苯甲酸)放在量热计中燃烧,测其始末温度,求出T∆,便可据式(2)求出WWˊ。
物化实验报告:燃烧热的测定_苯甲酸_萘(优选.)

最新文件---------------- 仅供参考--------------------已改成-----------word文本 --------------------- 方便更改赠人玫瑰,手留余香。
华南师范大学实验报告课程名称物理化学实验实验项目燃烧热的测定【实验目的】①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。
②掌握量热技术的基本原理,学会测定奈的燃烧热。
③了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。
④学会雷诺图解法校正温度改变值。
【实验原理】燃烧热是指1摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(O v),恒容燃烧热这个过程的内能变化(ΔU)。
在恒压条件下测得的燃烧热称为恒压燃烧热(Q p),恒压燃烧热等于这个过程的热焓变化(ΔH)。
若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:c H m = Q p=Q v +Δn RT(1)本实验采用氧弹式量热计测量蔗糖的燃烧热。
测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。
氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。
因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律在盛有定水的容器中,样品物质的量为n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。
设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C (通常称为仪器的水当量,即量热计及水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T 1、T 2,则此样品的恒容摩尔燃烧热为:nT T C Q m V )(12,--= (2) 式中,Qvm 为样品的恒容摩尔燃烧热(J·mol -1);n 为样品的摩尔数(mol);C 为仪器的总热容(J·K -1或J / oC)。
燃烧热的测定(华南师范大学物化实验)

华南师范大学实验报告燃烧热的测定一、实验目的(1)明确燃烧热的定义,了解恒压燃烧热与恒容燃烧烧热的差别与联系。
(2)测定萘的燃烧热,掌握量热技术基本原理。
(3)了解氧弹卡计的基本原理,掌握氧弹卡计的基本实验技术。
(4)使用雷诺校正法对温度进行校正。
二、实验原理2.1基本概念1mol物质在标准压力下完全燃烧所放出的热量,即为物质的标准摩尔燃烧焓,用表示。
若在恒容条件下,所测得的1mol物质的燃烧热则称为恒容摩表示,此时该数值亦等于这个燃烧反应过程的热力学能变尔燃烧热,用Q V,mΔr U m。
同理,在恒压条件下可得到恒压燃烧热,用Q p,m表示,此时该数值亦等于这个燃烧反应过程的摩尔焓变Δr H m。
化学反应的热效应通常用恒压热效应Δr H m来表示。
假若1mol物质在标准压力下参加燃烧反应,恒压热效应即为该有机物的标准摩尔燃烧热。
把燃烧反应中涉及的气体看做是理想气体,遵循以下关系式:Q p,m=Q V,m+(ΣV B)RT ①2.2氧弹量热计本实验采用外槽恒温式量热计,为高度抛光刚性容器,耐高压,密封性好。
量热计的内筒,包括其内部的水、氧弹及其搅拌棒等近似构成一个绝热体系。
为了尽可能将热量全部传递给体系,而不与内筒以外的部分发生热交换,量热计在设计上采取了一系列措施。
为了减少热传导,在量热计外面设置一个套壳。
内筒与外筒空气层绝热,并且设置了挡板以减少空气对流。
量热计壁高度抛光,以减少热辐射。
为了保证样品在氧弹内燃烧完全,必须往氧弹中充入高压氧气,这就要求要把粉末状样品压成片状,以免充气时或燃烧时冲散样品。
2.3量热反应测量的基本原理量热反应测量的基本原理是能量守恒定律。
通过数字式贝克曼温度计测量出燃烧反应前后的温度该表ΔT,若已知量热计的热容C,则总共产生的热量即为Q V=CΔT。
那么,此样品的摩尔恒容燃烧热为②式是最理想的情况。
但由能量守恒原理可知,此热量Q V的来源包括样品燃烧放热和点火丝放热两部分。
物化实验报告:燃烧热的测定_苯甲酸_萘

华南师范大学实验报告课程名称物理化学实验实验项目燃烧热得测定【实验目得】①明确燃烧热得定义,了解恒压燃烧热与恒容燃烧热得区别。
②掌握量热技术得基本原理,学会测定奈得燃烧热。
③了解氧弹卡计主要部件得作用,掌握氧弹量热计得实验技术.④学会雷诺图解法校正温度改变值。
【实验原理】燃烧热就是指1摩尔物质完全燃烧时所放出得热量。
在恒容条件下测得得燃烧热称为恒容燃烧热(O v),恒容燃烧热这个过程得内能变化(ΔU)。
在恒压条件下测得得燃烧热称为恒压燃烧热(Q p),恒压燃烧热等于这个过程得热焓变化(ΔH)。
若把参加反应得气体与反应生成得气体作为理想气体处理,则有下列关系式:cH m = Q p=Q v +ΔnRT (1)本实验采用氧弹式量热计测量蔗糖得燃烧热。
测量得基本原理就是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出得热量使卡计本身及氧弹周围介质(本实验用水)得温度升高。
氧弹就是一个特制得不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其她氧化剂),还必须使燃烧后放出得热量尽可能全部传递给量热计本身与其中盛放得水,而几乎不与周围环境发生热交换。
但就是,热量得散失仍然无法完全避免,这可以就是同于环境向量热计辐射进热量而使其温度升高,也可以就是由于量热计向环境辐射出热量而使量热计得温度降低。
因此燃烧前后温度得变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热(水、氧弹、量热计、温度计)量热原理—能量守恒定律在盛有定水得容器中,样品物质得量为n摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出得热量传给水及仪器各部件,引起温度上升。
设系统(包括内水桶,氧弹本身、测温器件、搅拌器与水)得总热容为C(通常称为仪器得水当量,即量热计及水每升高1K所需吸收得热量),假设系统与环境之间没有热交换,燃烧前、后得温度分别为T1、T2,则此样品得恒容摩尔燃烧热为:(2)式中,Qvm为样品得恒容摩尔燃烧热(J·mol—1);n为样品得摩尔数(mol);C为仪器得总热容(J·K—1或J / oC)。
燃烧热的测定_苯甲酸_萘
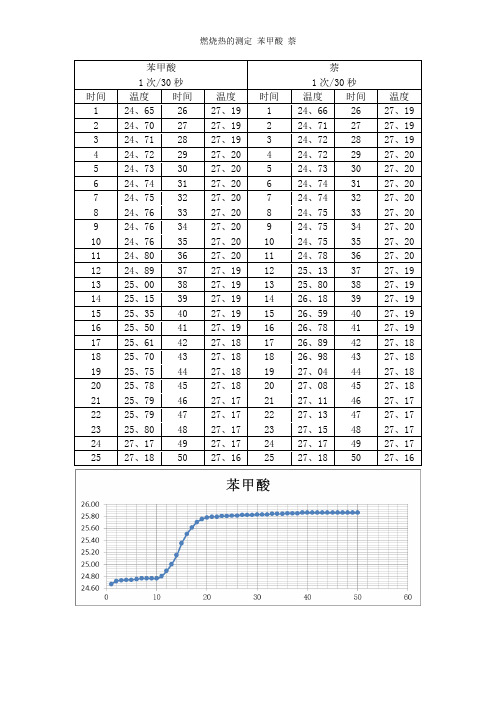
苯甲酸萘1次/30秒1次/30秒时间温度时间温度时间温度时间温度1 24、65 26 27、19 1 24、66 26 27、192 24、70 27 27、19 2 24、71 27 27、193 24、71 28 27、19 3 24、72 28 27、194 24、72 29 27、20 4 24、72 29 27、205 24、73 30 27、20 5 24、73 30 27、206 24、74 31 27、20 6 24、74 31 27、207 24、75 32 27、20 7 24、74 32 27、208 24、76 33 27、20 8 24、75 33 27、209 24、76 34 27、20 9 24、75 34 27、2010 24、76 35 27、20 10 24、75 35 27、2011 24、80 36 27、20 11 24、78 36 27、2012 24、89 37 27、19 12 25、13 37 27、1913 25、00 38 27、19 13 25、80 38 27、1914 25、15 39 27、19 14 26、18 39 27、1915 25、35 40 27、19 15 26、59 40 27、1916 25、50 41 27、19 16 26、78 41 27、1917 25、61 42 27、18 17 26、89 42 27、1818 25、70 43 27、18 18 26、98 43 27、1819 25、75 44 27、18 19 27、04 44 27、1820 25、78 45 27、18 20 27、08 45 27、1821 25、79 46 27、17 21 27、11 46 27、1722 25、79 47 27、17 22 27、13 47 27、1723 25、80 48 27、17 23 27、15 48 27、1724 27、17 49 27、17 24 27、17 49 27、1725 27、18 50 27、16 25 27、18 50 27、16类似处理方法② 计算卡计的热容C,并求出两次实验所得水当量的平均值。
燃烧热的测定实验报告

实验一、燃烧热的测定【实验目的】1.通过测定萘的燃烧热,掌握有关热化学实验的一般知识和技术。
2.掌握氧弹量热计的原理、构造及使用方法。
3.掌握高压钢瓶的有关知识并能正确使用。
【实验原理】燃烧热是指1mol物质完全燃烧时的热效应。
通过盖斯定律可用燃烧热数据间接求算,,测定燃烧热的氧弹式量热计是重要的热化学仪器,应用广泛。
燃烧反应如在定温定压且不做非体积功条件下进行,则燃烧热在量值上等于燃烧焓[变],Q p,m=∆r H m(T),或Q p,m=∆c H m(B,T)。
若定温定压燃烧反应的压力不高或接近标准压力,则有Q p,m=∆c H m (B,T)。
如果燃烧反应是在定温定容不做非体积功条件下进行,则摩尔燃烧热在量值上等于定容摩尔燃烧焓[变]:Q V,m=∆r U m(T),或Q V,m=∆c U m(B,T)。
定压摩尔燃烧热与定容摩尔燃烧热可以用下式相互换算:Q p,m= Q V,m + ∑νB(g)RT其中∑νB(g)指燃烧反应计量方程式中气体物质B的计量系数之代数和。
在盛有定量水的容器中,放入内装有一定量样品和氧气的密闭氧弹,然后使样品在氧弹中完全燃烧放出的热、通过氧弹传递给水及仪器,引起温度升高,弹式量热器的基本原理是能量守恒定律。
测量介质在燃烧前后温度变化值(∆T)。
则可得到该样品的恒容燃烧热Q V,m。
即Q V,m = (M/m)·W•ΔTW为水当量。
(在实验测量中,燃烧丝、棉线的燃烧放热等因素都要考虑)。
本实验采用环境式量热计。
环境恒温式量热计属于密闭体系,没有物质的交换只有能量的交换,体系为样品等能燃烧的物质,体系燃烧产生的热量通过氧弹传到环境(水和仪器),使温度升高。
做雷诺数校正图求出△T。
就可求得样品燃烧热。
1)本实验由苯甲酸数据求出水当量WQ总热量=Q样品·(m/M)+Q然丝·m燃丝+Q棉线·m棉线=W·ΔT式中Q然丝=-1400.8J·g-1;Q棉线=-17479 J·g-12)将水当量值代入1)就可求出Q样品,再换算成Qv。
物化实验报告:燃烧热的测定

燃烧热的测定一、实验目的1、用氧弹量热计测定萘的燃烧热,明确燃烧热的定义,了解恒压燃烧热与衡蓉燃烧热的差别与相互关系;2、了解量热计的原理、构造和使用方法,掌握有关热化学实验的一般知识和测量技术;3、掌握用雷诺图解法校正温度的改变值。
二、实验原理1、燃烧热定义:一定温度和压力或者体积下,1mol 纯物质完全氧化时的反应热。
对于苯甲酸,如在25℃下,按下式完全反应,燃烧热为-3226.8kJ/mol 。
由热力学第一定律可知:在不做非膨胀功的情况下,恒容燃烧热v Q U =∆,恒压燃烧热p Q H =∆。
在氧弹式量热计中测得燃烧热热为Q ,其与p Q 的关系为p v Q Q nRT =+∆在盛有定量水的容器中,放入内装有m g 样品和W g 氧气的密闭氧弹,然后使样品完全燃烧,放出的热量会传给水及仪器,引起温度上升。
计燃烧前后的体系温度分别为0,n t t ,则物质的总的燃烧热为0'(')()n Q CW W t t =+-2、用雷诺作图法校正ΔT :尽管在仪器上进行了各种改进,但在实验过程中仍不可避免环境与体系间的热量传递。
这种传递使得我们不能准确地由温差测定仪上读出由于燃烧反应所引起的温升ΔT 。
而用雷诺作图法进行温度校正,能较好地解决这一问题。
将燃烧前后所观察到的水温对时间作图,可联成FHIDG 折线,如图(1)和图(2)所示。
图(1)中H 相当于开始燃烧之点。
D 为观察到的最高温度。
在温度为室温处作平行于时间轴的JI 线。
它交折线FHIDG 于I 点。
过I 点作垂直于时间轴的ab 线。
然后将FH 线外延交ab 线于A 点。
将GD 线外延,交ab 线于C 点。
则AC 两点间的距离即为ΔT 。
图中AA ′为开始燃烧到温度升至室温这一段时间 t1内,由环境辐射进来以及搅拌所引进的能量而造成量热计的温度升高。
它应予以扣除之。
CC ′为温度由室温升高到最高点D 这一段时间 t2内,量热计向环境辐射而造成本身温度的降低。
实验报告燃烧热的测定

实验报告燃烧热的测定一、实验目的1、用氧弹量热计测定萘的燃烧热。
2、了解氧弹量热计的原理、构造及使用方法。
3、掌握雷诺温度校正图的绘制和使用。
二、实验原理燃烧热是指 1mol 物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(Qv),恒容燃烧热等于这个过程的内能变化(ΔU)。
在恒压条件下测得的燃烧热称为恒压燃烧热(Qp),恒压燃烧热等于这个过程的焓变(ΔH)。
Qp 和 Qv 的关系为:Qp = Qv +ΔnRT,其中Δn 为反应前后气体物质的量的变化,R 为气体常数,T 为反应温度。
本实验采用氧弹量热计测量萘的燃烧热。
氧弹量热计的基本原理是能量守恒定律。
样品在氧弹中完全燃烧所释放的能量使量热计本身及周围介质(水)的温度升高,测量燃烧前后量热计(包括水)温度的变化值,就可以算出该样品的燃烧热。
三、实验仪器和试剂1、仪器氧弹量热计压片机贝克曼温度计数字式精密温差测量仪氧气钢瓶及减压阀万用电表2、试剂萘(分析纯)引燃丝(铁丝)氧气四、实验步骤1、样品准备用电子天平称取约 08g 左右的萘,用压片机压成片状。
准确称取引燃丝的质量。
2、氧弹安装将氧弹内壁擦干净,将样品片放在坩埚中,引燃丝两端分别固定在两个电极上,使引燃丝与样品接触良好。
拧紧氧弹盖,充入约15MPa 的氧气,放置5 分钟,检查是否漏气。
3、量热计准备用量筒量取 3000ml 水,倒入量热计内筒。
安装好贝克曼温度计和数字式精密温差测量仪。
4、点火燃烧将氧弹放入量热计内筒,接好点火电极。
开启搅拌器,待温度稳定后,点火。
5、数据记录每隔 30 秒记录一次温度,直至温度不再升高,继续记录 5 分钟左右。
6、实验结束取出氧弹,放出剩余气体,检查样品是否燃烧完全。
五、数据处理1、雷诺温度校正绘制温度时间曲线。
对曲线进行雷诺温度校正,得到准确的燃烧前后温度变化值(ΔT)。
2、计算燃烧热根据公式 Qv =(C 总×ΔT m 丝×Q 丝)/m 样,计算萘的恒容燃烧热。
燃烧热的测定-实验报告

燃烧热的测定一、实验目的●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。
●了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的使用方法,熟悉贝克曼温度计的调节和使用方法●掌握恒容燃烧热和恒压燃烧热的差异和相互换算二、实验原理摩尔燃烧焓∆c H m 恒容燃烧热Q V∆r H m = Q p ∆r U m = Q V对于单位燃烧反应,气相视为理想气体∆c H m = Q V +∑νB RT=Q V +△n(g)RT氧弹中放热(样品、点火丝)=吸热(水、氧弹、量热计、温度计)待测物质QV-摩尔恒容燃烧热Mx-摩尔质量ε-点火丝热值bx-所耗点火丝质量q-助燃棉线热值cx-所耗棉线质量K-氧弹量热计常数∆Tx-体系温度改变值三、仪器及设备标准物质:苯甲酸待测物质:萘氧弹式量热计1-恒热夹套2-氧弹3-量热容器4-绝热垫片5-隔热盖盖板6-马达7,10-搅拌器8-伯克曼温度计9-读数放大镜11-振动器12-温度计四、实验步骤1.量热计常数K的测定(1) 苯甲酸约1.0g,压片,中部系一已知质量棉线,称取洁净坩埚放置样片前后质量W1和W2(2)把盛有苯甲酸片的坩埚放于氧弹内的坩埚架上,连接好点火丝和助燃棉线(3) 盖好氧弹,与减压阀相连,充气到弹内压力为1.2MPa为止(4)把氧弹放入量热容器中,加入3000ml水(5) 调节贝克曼温度计,水银球应在氧弹高度约1/2处(6) 接好电路,计时开关指向“1分”,点火开关到向“振动”,开启电源。
约10min后,若温度变化均匀,开始读取温度。
读数前5s振动器自动振动,两次振动间隔1min,每次振动结束读数。
(7)在第10min读数后按下“点火”开关,同时将计时开关倒向“半分”,点火指示灯亮。
加大点火电流使点火指示灯熄灭,样品燃烧。
灯灭时读取温度。
(8)温度变化率降为0.05°C·min-1后,改为1min计时,在记录温度读数至少10min,关闭电源。
燃烧热的测定_苯甲酸_萘(实验处理)
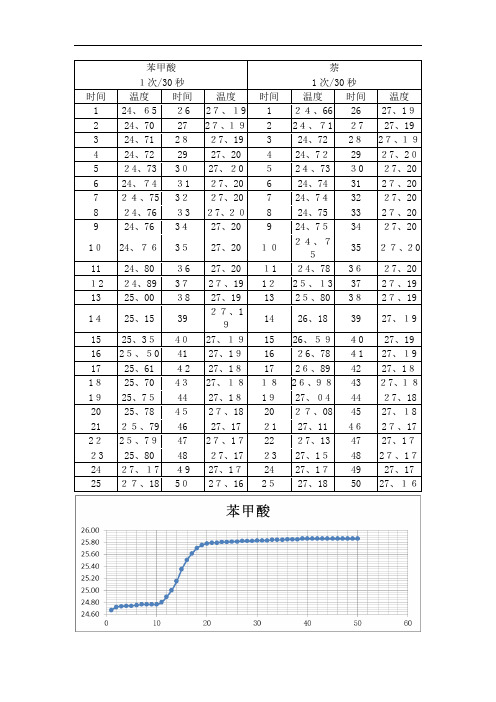
苯甲酸萘1次/30秒1次/30秒时间温度时间温度时间温度时间温度1 24、65 26 27、19 1 24、66 26 27、192 24、70 27 27、19 2 24、71 27 27、193 24、71 2827、19 3 24、72 2827、194 24、72 29 27、20 4 24、7229 27、205 24、73 3027、20 524、73 30 27、206 24、74 31 27、20 6 24、74 31 27、207 24、75 3227、20 7 24、7432 27、208 24、76 33 27、208 24、75 33 27、209 24、76 3427、20 9 24、7534 27、201024、763527、20 1024、7535 27、2011 24、80 36 27、20 11 24、78 3627、20 12 24、89 3727、19 1225、13 37 27、19 13 25、00 38 27、19 13 25、80 3827、191425、15 39 27、1914 26、18 39 27、1915 25、354027、1915 26、5940 27、1916 25、50 41 27、1916 26、78 41 27、1917 25、61 42 27、1817 26、89 42 27、181825、70 4327、181826、9843 27、181925、7544 27、181927、04 44 27、1820 25、78 4527、18 20 27、08 45 27、1821 25、79 46 27、17 21 27、11 4627、17 2225、7947 27、1722 27、13 47 27、1723 25、80 48 27、17 23 27、1548 27、1724 27、17 49 27、1724 27、1749 27、1725 27、18 5027、16 2527、18 50 27、16类似处理方法② 计算卡计得热容C,并求出两次实验所得水当量得平均值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华南师范大学实验报告课程名称 物理化学实验 实验项目 燃烧热的测定【实验目的】①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。
②掌握量热技术的基本原理,学会测定奈的燃烧热。
③了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。
④学会雷诺图解法校正温度改变值。
【实验原理】燃烧热是指1摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(O v ),恒容燃烧热这个过程的内能变化(ΔU )。
在恒压条件下测得的燃烧热称为恒压燃烧热(Q p ),恒压燃烧热等于这个过程的热焓变化(ΔH )。
若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:∆c H m = Q p =Q v +Δn RT (1)本实验采用氧弹式量热计测量蔗糖的燃烧热。
测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。
氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。
因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律在盛有定水的容器中,样品物质的量为n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。
设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C (通常称为仪器的水当量,即量热计及水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T 1、T 2,则此样品的恒容摩尔燃烧热为:nT T C Q m V )(12,--= (2) 式中,Qvm 为样品的恒容摩尔燃烧热(J·mol -1);n 为样品的摩尔数(mol);C 为仪器的总热容(J·K -1或J / oC)。
上述公式是最理想、最简单的情况。
图 1 氧弹量热计构造示意图图 2 氧弹构造示意图 1、氧弹 1-厚壁圆筒;2-弹盖 2、内水桶(量热容器) 3-螺帽; 4-进气孔 3、电极 4、温度计 5-排气孔;6-电极 5、搅拌器 6、恒温外套 8-电极(也是进气管)但是,由于(1):氧弹量热计不可能完全绝热,热漏在所难免。
因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷诺校正才能得到准确的温差变化。
(2)多数物质不能自燃,如本实验所用萘,必须借助电流引燃点火丝,再引起萘的燃烧,因此,等式(2)左边必须把点火丝燃烧所放热量考虑进去就如等式(3):ΔT 点火丝,C Q m nQ m V =--点火丝 (3)式中:m 点火丝为点火丝的质量,Q 点火丝为点火丝的燃烧热,为-6694.4 J / g ,∆T 为校正后的温度升高值。
仪器热容的求法是用已知燃烧焓的物质(如本实验用苯甲酸),放在量热计中燃烧,测其始、末温度,经雷诺校正后,按上式即可求出C 。
雷诺校正:消除体系与环境间存在热交换造成的对体系温度变化的影响。
方法:将燃烧前后历次观察的贝氏温度计读数对时间作图,联成FHDG 线如图2-1-2。
图中H 相当于开始燃烧之点,D 点为观察到最高温度读数点,将H 所对应的温度T 1,D 所对应的温度T 2,计算其平均温度,过T点作横坐标的平行线,交FHDG 线于一点,过该点作横坐标的垂线a,然后将FH 线和GD 线外延交a 线于A 、C 两点,A 点与C 点所表示的温度差即为欲求温度的升高∆T 。
图中AA’表示由环境辐射进来的热量和搅拌引进的能量而造成卡计温度的升高,必须扣除之。
CC’表示卡计向环境辐射出热量和搅拌而造成卡计温度的降低,因此,需要加上,由此可见,AC 两点的温度差是客观地表示了由于样品燃烧使卡计温度升高的数值有时卡计的绝热情况良好,热漏小,而搅拌器功率大,不断稍微引进热量,使得燃烧后的最高点不出现,如图2-1-3,这种情况下∆T 仍可以按同法校正之。
图4-1 绝热较差时的雷诺校正图图4-2 绝热良好时的雷诺校正图外槽恒温式氧弹卡计(一个);氧气钢瓶(一瓶);压片机 (2台);数字式贝克曼温度计(一台);0~100℃温度计(一支);万用电表(一个);扳手(一把);萘(A .R);苯甲酸(A.R或燃烧热专用);铁丝(10cm长);【实验步骤】一、量热计常数K的测定。
1、苯甲酸约1.0g,压片,中部系一已知质量棉线,称取洁净坩埚放置样片前后质量W1和W2 。
2、苯甲酸约1.0g,压片,中部系一已知质量棉线,称取洁净坩埚放置样片前后质量W1和W2 。
3、把盛有苯甲酸片的坩埚放于氧弹内的坩埚架上,连接好点火丝和助燃棉线。
4、盖好氧弹,与减压阀相连,充气到弹内压力为1.2MPa为止。
6、把氧弹放入量热容器中,加入3000ml水。
7、插入数显贝克曼温度计的温度探头。
8、接好电路,计时开关指向“1分”,点火开关到向“振动”,开启电源。
约10min后,若温度变化均匀,开始读取温度。
读数前5s振动器自动振动,两次振动间隔1min,每次振动结束读数。
9、在第10min读数后按下“点火”开关,同时将计时开关倒向“半分”,点火指示灯亮。
加大点火电流使点火指示灯熄灭,样品燃烧。
灯灭时读取温度。
10、温度变化率降为0.05°C·min-1后,改为1min计时,在记录温度读数至少10min,关闭电源。
先取出贝克曼温度计,再取氧弹,旋松放气口排除废气。
11、称量剩余点火丝质量。
清洗氧弹内部及坩埚。
二、萘的恒容燃烧热的测定1、取萘0.6g压片,重复上述步骤进行实验,记录燃烧过程中温度随时间变化的数据。
【注意事项】①为避免腐蚀,必须清洗氧弹②点火成败是实验关键。
应仔细安装点火丝和坩埚。
点火丝不应与弹体内壁接触,坩埚支持架不应与另一电极接触。
③每次实验前均应称量坩埚。
【文献值】【实验数据与处理】[实验原始数据]第一组测定的数据:苯甲酸①第二组测定的数据:苯甲酸②第三组测定的数据:萘①[实验数据的处理]①雷诺校正作图② 计算卡计的热容C ,并求出两次实验所得水当量的平均值。
苯甲酸的燃烧反应方程式为:()()()()176********, 3226.02c m C H O s O g CO g H O l H kJ mol θ-+→+∆=-⋅根据基尔霍夫定律:∴ΔC p ,m =7×C p ,m (CO 2,g )+3×C p ,m (H 2O,l )-C p ,m (苯甲酸,s )-215C p ,m (O 2,g ) =154.6805 J/mol •K∴ 当室温为26.0℃ 时苯甲酸的燃烧焓为:△c H m (26.0℃)=△c H m (25.0℃)+△C p ×△T=-3226.9+154.6805×(26.0-25.0)×10-3 =-3225.84 kJ/mol 则:苯甲酸的恒容摩尔燃烧热为:Q V = △c U m =△c H m - RT ∑B V B (g)=-3225.84-8.314×299.15×(7-7.5) ×10-3= -3224.6 kJ/mol 又:nQ V =-C △T -Q V 点火线·m 点火线∴(Ⅰ)苯甲酸①燃烧的数据处理:Q V 点火丝·m 点火丝= -6694.4×10-3×3.7×10-3 =-0.02477 kJ,nQ -Tm Q m v C ∆•-=丝丝=1.29931.29)-0.02477()-3224.6(122.120.4874--⨯-=15.517 kJ/℃(Ⅱ)苯甲酸②燃烧的数据处理:Q V 点火丝·m 点火丝= -6694.4×10-3×9×10-4 =-6.025×10-3 kJ,nQ -Tm Q m v C ∆•-=丝丝=648.30373.31)-0.006025()-3224.6(122.120.4354--⨯-=15.866 kJ/℃(Ⅲ)两次实验所得水当量的平均值为:C =(15.517+15.866)÷2=15.692 kJ/℃③计算萘的恒容摩尔燃烧热Q V ,m根据公式:nQ V =-C △T -Q V 点火线·m 点火线则:(Ⅰ)萘①燃烧的数据处理:Q V 点火丝·m 点火丝= -6694.4×10-3×5.4×10-3 =-0.03615 kJ Q V ,m =(-C △T -Q V 点火线·m 点火线)/n=()128.180.47310.0361547.28695.2915.692---⨯=-5217.9 kJ/mol(Ⅱ)萘②燃烧的数据处理:Q V 点火丝·m 点火丝= -6694.4×10-3×1.7×10-3 =-0.01138 kJ Q V ,m =(-C △T -Q V 点火线·m 点火线)/n=()128.180.48190.01138627.27867.2815.692---⨯=-5178 kJ/mol(Ⅲ)萘的恒容摩尔燃烧热平均值为m v,Q =(-5217.9-5178) ÷2=-5197.5 kJ/mol④求萘的恒压摩尔燃烧热Q p ,m (即△c H m )萘燃烧的化学方程式为:()()()()10822212104C H s O g CO g H O l +→+()2BBg ν=-∑,根据基尔霍夫定律:∴ΔC p ,m =10×C p ,m (CO 2,g )+4×C p ,m (H 2O,l )-C p ,m (萘,s )-12C p ,m (O 2,g ) =154.304 J/mol •K∴26.0℃ 时萘的燃烧焓为:△c H m (26.0℃)=△c U m + RT ∑B V B (g)=-5206.63+8.314×299.15×(-2)×10-3 =-5211.604 kJ/mol⑤由基尔霍夫定律将△c H m (T )换成△c H m (298.15K ),并与文献比较△c H m (25.0℃)=△c H m (26.0℃)+△C p ×△T=-5211.604+154.304×(25.0-26.0) ×10-3 =-5211.758 kJ/mol相对误差:%1008.5153|)8.5153(758.5211|⨯---=∆=1.12%【实验结果与讨论】实验求得萘的燃烧热Q P,实与文献值Q P ,标=-5153.85 kJ ⋅mol -1的误差为1.12%(小于3%)。
