第二讲元素周期表
初中化学元素周期表

初中化学元素周期表初中化学元素周期表是一个包含许多化学元素的表,是初中学生了解化学元素的重要基础。
以下是初中化学元素周期表:一档元素:氢(H)、碳(C)、氮(N)、氧(O)、氟(F)、磷(P)、硫(S)、氯(Cl)二档元素:锂(Li)、铍(Be)、硼(B)、碳素(C)、硅(Si)、磷(P)、硒(Se)、氯(Cl)三档元素:钠(Na)、镁(Mg)、铝(Al)、硫(S)、硒(Se)、氟(F)、氯(Cl)、氧(O)四档元素:钾(K)、钙(Ca)、铜(Cu)、氮(N)、磷(P)、硫(S)、氟(F)、氯(Cl)五档元素:铬(Cr)、锰(Mn)、钴(Co)、氮(N)、磷(P)、硫(S)、氟(F)、氯(Cl)六档元素:镍(Ni)、铜(Cu)、氮(N)、氧(O)、氟(F)、氯(Cl)、锶(Sr)七档元素:钯(Pd)、银(Ag)、氮(N)、氧(O)、氟(F)、氯(Cl)、钆(Ga)八档元素:铂(Pt)、金(Au)、氧(O)、氟(F)、氯(Cl)、氩(Ar)九档元素:铼(Re)、钯(Pd)、金(Au)、氟(F)、氯(Cl)、氩(Ar)十档元素:铱(Ir)、钯(Pd)、金(Au)、氯(Cl)、氩(Ar)、铼(Ru)十一档元素:钌(Rh)、铂(Pt)、金(Au)、氯(Cl)、氩(Ar)、钛(Ti)十二档元素:锇(Os)、铂(Pt)、金(Au)、氩(Ar)、砷(As)、砹(O)、锡(Sn)十三档元素:锆(Zr)、钴(Co)、铬(Cr)、硅(Si)、磷(P)、氧(O)、氮(N)十四档元素:钼(Mo)、铬(Cr)、钒(V)、磷(P)、氧(O)、氮(N)、碳(C)十五档元素:铱(Ir)、钒(V)、氮(N)、氧(O)、氟(F)、氯(Cl)、碳(C)十六档元素:锆(Zr)、钴(Co)、氮(N)、氧(O)、氟(F)、氯(Cl)、氩(Ar)十七档元素:砷(As)、磷(P)、氮(N)、氧(O)、氟(F)、氯(Cl)、氩(Ar)十八档元素:锕(Kr)、氮(N)、氧(O)、氟(F)、氯(Cl)、氩(Ar)、氦(He)初中化学元素周期表可以帮助我们轻松了解和记忆相关化学元素的信息。
人教版-化学必修二元素周期表-讲课课件

第1课时
元素周期表最新进展
据中国科学报2016年1月6日报道,第113号、115号、 117号和118号如今已经被正式添加到元素周期表中,这 也意味着,这张表的第七行终于完整了。 日本理化学研究所(RIKEN)仁科加速器研究中心于 2004年首次宣布发现了第113号元素,在2012年又报告了 一次可信度更高的目击,于是将第113号元素的命名优先 权交给了日本的研究者,取名Nihonium。 115号和117号元素由劳伦斯利弗莫尔国家实验室、橡树 岭国家实验室和俄罗斯的科学家联合合成 ,他们将115 号元素命名为Moscovium,117号元素命名为Tennessine
问题1
各周期的元素种类数目是多少?
分类
行数
所含元素种 类数
起止元素及其原 子序数
短一
1
周 期
二
2
三
3
四
4
长
五
5
周
六
6
期
七
7
2 8 8
2 8
1H―→2He 3Li―→10Ne 11Na―→18Ar
8 8
18
8 19K―→36Kr 18
18
18
18
37Rb―→54Xe
18
32
32
55Cs―→86Rn
32
人教版-化学必修二元素周期表-讲课 课件( 优秀课 件)
练习
Cl 第三周期,第ⅦA族 Cu 第四周期,第ⅠB族 Fe 第四周期,第 Ⅷ 族
人教版-化学必修二元素周期表-讲课 课件 优秀课 件)
归纳整理
记 忆 口 诀
人教版-化学必修二元素周期表-讲课 课件( 优秀课 件)
棱台型元素周期表
元素周期表PPT课件

谢 谢!
类别
主族
副族
Ⅷ族
副族
主族
0族
名称 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB
Ⅷ
ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0族
位置与结 构的关系
①主族元素的族序数=最外层电子数 ②副族元素最外层电子数一般不等于族序数(ⅠB族、ⅡB族除外),最外层只有1~2个电子
例1 下列有关元素周期表的说法正确的是 ()
2.“0族定位法”确定元素的位置 (1)0族元素的周期序数和原子序数
0族元素 周期序数 原子序数
He
Ne
Ar
Kr
Xe
Rn
Og
1
2
3
4
5
6
7
2
10
18
36
54
86
118
(2)推断方法 ①比大小定周期:比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,那么 该元素就和原子序数大的0族元素处于同一周期。 ②求差值定族数:若某元素原子序数比相应0族元素多1或2,则该元素应处在0族元素所在周期的下一周 期的第ⅠA族或第ⅡA族;若比相应的0族元素少1~5时,则应处在同周期的第ⅦA~ⅢA族。
高中化学 必修第一册
第四章 第一节 原子结构与元素周期表
第2课时 元素周期表
学习目标
1.知道元素周期表的结构。 2.能说出元素周期表的编排原则及其结构,能根据原子序数确定元素在周期表中的位置。
二、现行元素周期表的编排原则
1.原子序数
(1)含义: 按照元素在 周期表 中的顺序给元素编号。
(2)原子序数与原子结构的关系: 原子序数= 核电荷数 = 质子数 = 核外电子数 。
化学元素周期表(内容+记忆方法)

化学元素周期表(内容+记忆方法)本文介绍了元素周期表中的各个元素,共七个周期。
第一周期包括氢和氦两种元素。
第二周期包括锂、铍、硼、碳、氮、氧、氟和氖。
第三周期包括钠、镁、铝、硅、磷、硫、氯和氩。
第四周期包括钾、钙、钪、钛、钒、铬、锰、铁、钴、镍、铜、锌、镓、锗、砷、硒、溴和氪。
第五周期包括铷、锶、钇、锆、铌、钼、锝、钌、铑、钯、银、镉、铟、锡、锑、碲、碘和氙。
第六周期包括铯、钡、镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥、铪、钽、钨、铼、锇、铱、铂、金、汞、铊、铅、铋、钋、砹和氡。
第七周期包括钫、镭、锕、钍、镤、铀、镎、钚、镅、锔、锫、锎、锿、镄、钔、锘、铹、鑪、钅、钨、䥑、鐽、錀和未命名元素。
研究周期表需要掌握各个元素的名称、符号、原子序数和化学性质等知识,可以通过记忆、归纳和实践等多种方法来提高研究效果。
化合价:化学中,不同原子之间的结合方式和数量是通过化合价来表示的。
一价的有氢、氯、钾、钠和银,二价的有氧、钙、钡、镁、锌,三价的有铝、五价的有磷,二价的有碳、二价和三价的有铁,莫丢二、三、四、五价的有氮,最常见的是铜和汞的二价,单质的化合价为零。
常见原子团化合价口诀:在化学中,不同的原子团之间的化合价也可以通过一些简单的口诀来记忆。
负一价的有硝酸根和氢氧根,负二价的有硫酸根和碳酸根,负三价的有磷酸根,唯一的正一价的是铵根,而金属的活动性可以根据以下口诀来记忆:钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金。
口诀:周期表中,元素按行和列排列,行称为周期,列称为族。
周期表中有七个周期,其中前三个周期为短周期,第四至第六周期为长周期,第七周期为不完整周期。
周期表中的元素外层电子数按照2、8、8、18、18、32、32的顺序排列。
镧系和锕系元素各有15个。
族分为7个主族和7个副族,以及一个Ⅷ族。
主族和副族的区别在于元素的外层电子数,主族元素的外层电子数为长周期的元素,而副族元素的外层电子数为短周期的元素。
第2讲 元素周期表 元素周期律
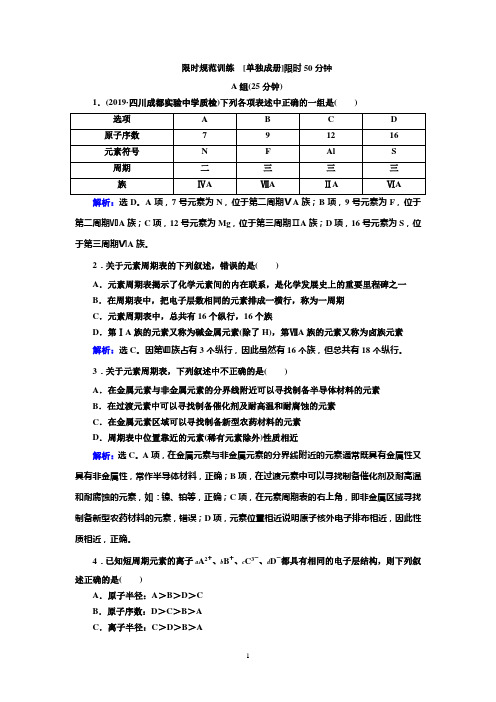
限时规范训练[单独成册]限时50分钟A组(25分钟)1.(2019·四川成都实验中学质检)下列各项表述中正确的一组是()解析:选D。
A项,7号元素为N,位于第二周期ⅤA族;B项,9号元素为F,位于第二周期ⅦA族;C项,12号元素为Mg,位于第三周期ⅡA族;D项,16号元素为S,位于第三周期ⅥA族。
2.关于元素周期表的下列叙述,错误的是()A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一B.在周期表中,把电子层数相同的元素排成一横行,称为一周期C.元素周期表中,总共有16个纵行,16个族D.第ⅠA族的元素又称为碱金属元素(除了H),第ⅦA族的元素又称为卤族元素解析:选C。
因第Ⅷ族占有3个纵行,因此虽然有16个族,但总共有18个纵行。
3.关于元素周期表,下列叙述中不正确的是()A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素C.在金属元素区域可以寻找制备新型农药材料的元素D.周期表中位置靠近的元素(稀有元素除外)性质相近解析:选C。
A项,在金属元素与非金属元素的分界线附近的元素通常既具有金属性又具有非金属性,常作半导体材料,正确;B项,在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素,如:镍、铂等,正确;C项,在元素周期表的右上角,即非金属区域寻找制备新型农药材料的元素,错误;D项,元素位置相近说明原子核外电子排布相近,因此性质相近,正确。
4.已知短周期元素的离子a A2+、b B+、c C3-、d D-都具有相同的电子层结构,则下列叙述正确的是()A.原子半径:A>B>D>CB.原子序数:D>C>B>AC.离子半径:C>D>B>AD.单质的还原性:A>B>D>C解析:选C。
A、B、C、D在元素周期表中的大体位置为C DB A,所以原子半径:B>A>C>D,原子序数:A>B>D>C,离子半径:C>D>B>A,单质的还原性:B>A>C>D。
初三化学元素周期表(完整版)

初三化学元素周期表(完整版)初三化学元素周期表顺口溜:氢(qīng) 氦(hài)锂(lǐ) 铍(pí) 硼(péng) 碳(tàn) 氮(dàn) 氧(yǎng) 氟(fú) 氖(nǎi)n) 硫(liú)氯(lǜ) 氩(yà)钠(nà) 镁(měi) 铝(lǚ) 硅(guī) 磷(lí钾(jiǎ) 钙(gài) 钪(kàng) 钛(tài) 钒(fán) 铬(gè) 锰(měng) 铁(tiě) 钴(gǔ) 镍(niè) 铜(tóng) 锌(xīn) 镓(jiā) 锗(zhě) 砷(shēn) 硒(xī) 溴(xiù)氪(kè)铷(rú) 锶(sī) 钇(yǐ) 锆(gào) 铌(ní) 钼(mù) 锝(dé) 钌(liǎo) 铑(lǎo) 钯(pá) 银(yín) 镉(gé) 铟(yīn) 锡(xī) 锑(tī) 碲(dì) 碘(diǎn) 氙(xiān)铯(sè) 钡(bèi) 镧(lán) 铪(hā) 钽(tǎn) 钨(wū) 铼(lái) 锇(é) 铱(yī) 铂(bó) 金(jīn) 汞(gǒng) 铊(tā) 铅(qiān) 铋(bì) 钋(pō) 砹(ài) 氡(dōng)钫(fāng) 镭(léi) 锕(ā) 钅卢(lú) 钅杜(dù) 钅喜(xǐ) 钅波(bō) 钅黑(hēi) 钅麦(mài) 钅达(dá) 钅仑(lún)镧(lán) 铈(shì) 镨(pǔ) 钕(nǚ) 钷(pǒ) 钐(shān) 铕(yǒu) 钆(gá) 铽(tè) 镝(dí) 钬(huǒ) 铒(ěr) 铥(diū) 镱(yì)镥(lǔ)锕(ā) 钍(tǔ) 镤(pú) 铀(yóu) 镎(ná) 钚(bù) 镅(méi) 锔(jū) 锫(péi) 锎(kāi) 锿(āi) 镄(fèi) 钔(mén) 锘(nuò) 铹(láo)附化学元素周期表口诀青害李皮朋,探丹阳付奶。
元素周期表ppt课件

05
元素周期表的未来发展
新的元素发现与合成
合成新元素
随着科学技术的不断进步,科学家们 可能会合成更多超重元素,进一步丰 富元素周期表。
探索新元素特性
新元素的发现将有助于深入了解元素 的性质和行为,为科学研究和技术创 新提供更多可能性。
元素周期表的完善与修正
修正元素性质
随着新元素的合成和性质研究,元素周期表中的元素性质可能会得到修正和完 善。
调整周期表结构
根据新发现和研究成果,元素周期表的排列和分类可能会进行相应的调整和优 化。
元素周期表在未来的应用前景
科学研究
元素周期表在化学、物理、材料科学等领域的研究中发挥着重要作用,未来仍将 是科学家们的重要工具。
技术创新
元素周期表中的元素是许多技术和产品的关键组成部分,随着新元素的发现和应 用,将有助于推动技术创新和产业发展。
THANKS
感谢观看
材料分类与鉴别
元素周期表为材料分类和鉴别提 供了依据,有助于对不同材料进
行科学分类和鉴别。
在生命科学领域的应用
生物分子结构研究
元素周期表在解析生物分子结构中发挥了重要作用,例如蛋白质 和核酸的结构研究。
药物设计与研发
通过元素周期表,可以预测药物分子的性质和行为,有助于新药的 研发和优化。
生物地球化学循环
通过元素周期表,科学家可以了解材料的物理和 化学性质,从而在材料科学和工程领域进行有效 的应用。
促进化学和其他学科的发展
元素周期表为化学学科提供了基础框架,同时也 为其他学科提供了重要的参考和借鉴。
02
元素周期表中的元素
《初中化学课件:元素周期表》
IV. 主族元素和副族元素的区别
元素周期表中的元素可以按照主族元素和副族元素进行分类。掌握它们之间的区别是理解元素周期表的关键。
V. 元素的周期性规律
元素周期表中的元素具有一定的周期性规律,了解这些规律有助于我们预测 元素的性质和行为。
VI. 元素周期表中元素的特性和性质
金属元素
大多数元素周期表中的元素都是金属,它 们具有良好的导电性和热导性,并且容易 形成阳离子。
XI. 小结及练习题
通过本次课程的学习,我们对元素周期表有了更深入的了解。现在是时候进行一些练习,深化对元素周期表的 理解。
II. 元素周期表的历史和发展
元素周期表的历史可以追溯到几个世纪前,通过不同化学家的贡献和发现,元素周期表逐渐得以成型,为我们 揭示了元素世界的奥秘。
III. 元素周期表的基本结构
元素周期表由一系列的行和列组成,每个方格代表一个元素。了解元素周期表的基本结构可以帮助我们轻松地 找到某种元素以及理解它们的位置和特征。
非金属元素
非金属元素通常具有不良的导电性和热导 性,它们往往以共价键的形式与其他元素 结合。
惰性气体
惰性气体位于元素周期表的右上方,它们具有非常低的反应性,几乎不与其他元素反应。
VII. 元素周期表的应用
1
化学研究
元素周期表是化学研究的基础,它帮助科学家理解元素之间的相互作用和反应机 理。
2
工业生产
元素周期表指导着工业生产中的材料选择和合成,促进了许多创新和技术发展。
3
教育教学
元素周期表是化学教育的重要工具,帮助学生理解和记忆元素的特性和周期性规 律。
VIII.扩展和改进元素周期表,发现新的元素,并进一步研究和理解元素世界。
关于化学必修二_元素周期表课件

2020/12/30
ⅠA
0
ⅡA ⅢA Ⅳ A ⅤA ⅥA ⅦA
2020/12/30
主族序数=最外层电子数
注 意
2020/12/30
2020/12/30
总结:
周期
短周期
第 1周期 第 2周期
第 3周期 第 4周期
—— 2 种
5 6
族 。
2020/12/30
0族
稀有气体元素
7
元素周期表助记词
• 横行叫周期,共有七周期; • 三四分长短,第七不完全。 • 纵行称作族,共有十六族; • 二、三分主副,先主后副族; • VIII族最特殊,三行是一族; • 二次分主副,副后是主族。 • 一、八依次现,一、零再一遍。 • 锕、镧各十五,均属IIIB族。
1.每一横行原子电子层数相同 2.每一纵行原子最外层电子数相同
2020/12/30
1. 在元素周期表中横行和纵行又称为什么? 2. 元素周期表中有多少横行,多少周期?
多少纵行,多少族?
2020/12/30
2020/12/30
(1)周期(横行) 具有相同的电子层数而又按原子 序数递增的顺序排列的一系列元 素,称为一个周期。
2020/12/30
周 期
1 2 3
2020/12/30
周期数=电子层数
短周期:第1~3周期
周 期
长周期:第4~7周期
周期表里数周期,1234567.
2020/12/30
类别
周期序数 起止元素 所含元素总数 电子层数
1
H——He
2
1
短周期
2
元素周期表2PPT课件

根据实验讨论钠与钾的性质有 什么相似性和不同性。你认为元素 的性质与他们的原子结构有关系吗? 其余碱金属的性质又如何?
钠与钾都能与氧气、水发生 反应,但反应的剧烈程度不同
★思考与交流: 钠和钾的性质有什么相似性和不同, 与它们的原子结构有无关系?
钠和钾都能与氧气、水剧烈反应,但是 钾的反应更为剧烈。 与原子结构有密切关系:因物质结构 决定性质
复习:
一、1_、__2_、___3周期是短周期,分别包含 元素的种类数是__2_、__8_ 、 ___8_。
二、4_、__5_、_ _6_、_ 周期是长周期,分别包含 元素的种类数是_1_8_、1__8_ 、 _3_2__ .
复习: 4、周期表中有_7__主族,_7__副族、
_1__ VIII , ___1__零族。
元素的金属性逐渐 增强 ,与水和氧气 的反应越来越 剧烈 ,生成的氧化物越来 越 复杂 。最高价氧化物对应水化物的碱 性越来越 强 。
碱金属元素的原子结构
名称 符号 核电荷数 电子层结构 原子半径
逐渐增大
锂 Li 3 钠 Na 11 钾 K 19 铷 Rb 37 铯 Cs 55
21 2 81 288 1 2 8 18 8 1 2 8 18 18 8 1
钾
钠
与氧气 反应
与水反 应
钠、钾化学性质比较
钠
钾
与氧气 剧烈燃烧,火焰呈 剧烈燃烧,火焰呈 反应 黄色,生成 淡黄色色 色 紫 的固体
与水面上 四处 游、滴入酚酞 溶液呈 红 色
在水面上、 成 银白色、在水面上 四处 、滴入酚酞 溶液呈 色,有 微弱爆炸
物质的性质主要取决于原子的 最外层电子数,从碱金属原子的 结构可推知其化学性质如何?
《化学元素周期表》课件

周期表各元素
第一周期
• 氢 (H) • 氦 (He)
第二周期
• 锂 (Li) • 铍 (Be) • 碳 (C) • 氮 (N) • 氧 (O) • 氟 (F) • 氖 (Ne)
第三周期
• 钠 (Na) • 镁 (Mg) • 铝 (Al) • 硅 (Si) • 磷 (P) • 硫 (S) • 氯 (Cl) • 氩 (Ar)
2
元素周期表在化学和材料科学中的重要性
介绍元素周期表在化学合成、材料设计等领域的重要作用。
总结
1 元素周期表的历史和意义
回顾元素周期表的历史发展并强调其在科学研究中的重要意义。
2 元素周期表的分类方式
总结元素周期表的分类方法和结构,并来自明其对元素归类的作用。3 周期表中各元素的特点及应用
通过回顾周期表中各元素的特点和应用,强调不同元素对人类生活和科学研究的贡献。
《化学元素周期表》PPT 课件
欢迎大家来参加《化学元素周期表》PPT课件!在本课件中,我们将介绍化学 元素周期表的背景和历史,以及它的分类方法和各种特征。让我们一起探索 这个神奇的科学世界吧!
化学元素周期表的背景和历史
1
元素周期表的起源
我们将了解化学元素周期表的起源以及它是如何被发现和发展的。
2
元素分类的发展
探索化学元素的分类方法是如何逐步发展并最终形成元素周期表的。
3
重要的里程碑
介绍一些在元素周期表发展历程中具有重要意义的里程碑事件。
周期表结构
1 原子序数和元素符号 2 分组和周期
解释原子序数和元素符号 在周期表中的含义和作用。
了解元素周期表的分组和 周期结构,以及每个分组 和周期的特征。
(完整版)化学元素周期表(高清)
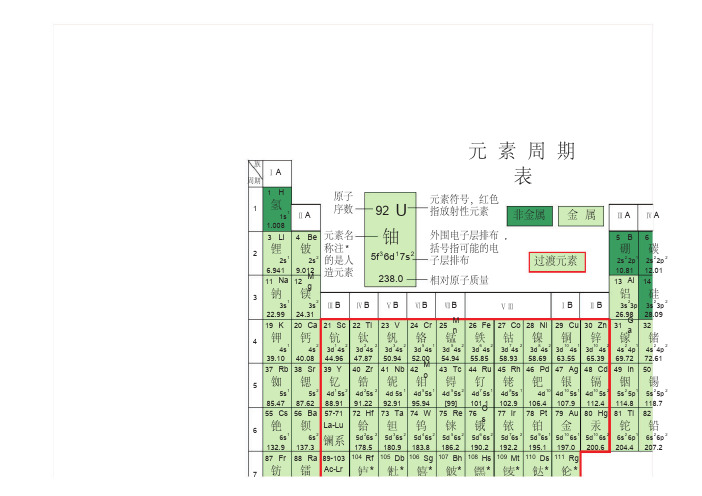
1H3Li4Be5B611Na 12Mg13Al 1419K 20Ca 21Sc 22Ti23V24Cr 25Mn26Fe 27Co 28Ni29Cu 30Zn 31Ga3237Rb 38Sr 39Y40Zr41Nb 42Mo43Tc44Ru 45Rh 46Pd 47Ag 48Cd 49In5055Cs 56Ba 72Hf 73Ta 74W75Re 76Os77Ir78Pt79Au 80Hg 81Tl8287Fr 88Ra 104Rf 105Db 106Sg 107Bh 108Hs 109Mt 110Ds 111Rg元素周期表氢1s11.008锂铍硼碳2s12s22s 22p12s 22p26.9419.01210.8112.01钠镁铝硅3s13s23s 23p3s 23p222.9924.3126.9828.09钾钙钪钛钒铬锰铁钴镍铜锌镓锗4s14s23d 14s23d 24s23d 34s23d 54s13d 54s23d 64s23d 74s23d 84s23d 104s13d 104s24s 24p14s 24p239.1040.0844.9647.8750.9452.0054.9455.8558.9358.6963.5565.3969.7272.61铷锶钇锆铌钼锝钌铑钯银镉铟锡5s15s24d 15s24d 25s24d 5s14d 55s14d 55s24d 75s14d 85s14d104d 105s14d 105s25s 25p15s 25p285.4787.6288.9191.2292.9195.94[99]101.1102.9106.4107.9112.4114.8118.757-71铯钡La-Lu铪钽钨铼锇铱铂金汞铊铅6s16s25d 26s25d 36s25d 46s25d 56s25d 66s25d 76s25d 96s15d 106s15d 106s26s 26p16s 26p2132.9137.3178.5180.9183.8186.2190.2192.2195.1197.0200.6204.4207.289-103钫镭Ac-Lr1234567镧系周期族ⅠAⅡA ⅢBⅣBⅤB ⅥBⅦBⅠB ⅡBⅤⅢⅢA ⅣA U92铀5f 36d 17s 2238.0相对原子质量元素符号,红色指放射性元素外围电子层排布,括号指可能的电子层排布原子序数元素名称注*的是人造元素非金属金属过渡元素杜钅钅卢钅喜钅波钅钅钅钅黑麦达仑********57La 58Ce 59Pr 60Nd 61Pm62S m63Eu 64G d65Tb 66Dy 67Ho 68Er69T m7089Ac 90Th 91Pa 92U93Np 94Pu 95Am96C m97Bk 98Cf99Es 100Fm101M d1027s17s2(6d 27s 2)(6d 37s 2)(6d 47s 2)(6d 57s 2)(6d 67s 2)[223]226.0[261][262][263][262][265][266][269][272]镧铈镨钕钷钐铕钆铽镝钬铒铥镱5d 16s24f 15d 16s4f 36s24f 46s24f 56s 24f 66s24f 76s24f 75d 16s4f 96s24f 106s24f 116s24f 126s24f 136s24f 146s2138.9140.1140.9144.2[147]150.4152.0157.3158.9162.5164.9167.3168.9173.0锕钍镤铀镎钚镅锔锫锎锿镄钔锘6d 17s26d 27s25f 26d 17s 5f 36d 17s 5f 46d 17s5f 67s25f 77s25f 76s 17s5f 97s25f 107s25f 117s25f 127s2(5f 137s2(5f 147s2227.0232.0231.0238.0237.0[244][243][247][247][251][252][257][258][259]7镧系锕系锕系杜钅钅卢钅喜钅波钅钅钅钅黑麦达仑****************电子层2HeC 7N8O9F10NeSi15P16S17Cl18ArG e33As 34Se 35Br36KrSn 51Sb 52Te 53I54Xe Pb 83Bi84Po 85At86Rn 0氦1s24.003碳氮氧氟氖2s 22p22s 22p32s 22p42s 22p52s 22p612.0114.0116.0019.0020.18硅磷硫氯氩3s 23p23s 23p33s 23p43s 23p53s 23p628.0930.9732.0735.4539.95锗砷硒溴氪4s 24p24s 24p34s 24p44s 24p54s 24p672.6174.9278.9679.9083.80锡锑碲碘氙5s 25p25s 25p35s 25p45s 25p55s 25p 6118.7121.8127.6126.9131.3铅铋钋砹氡6s 26p26s 26p36s 26p46s 26p56s 26p6207.2209.0[209][210][222]ⅣAⅤA ⅥA ⅦA 0族电子数KLM N O PK LM N OKL M N K L M K L K 281832188281818828188288282注:Yb 71LuNo 103Lr镱镥4f 146s 24f 145d 16173.0175.0锘铹5f 147s2(5f 146d 17s 2)[259][260]注:1.相对原子质量录自1995年国际原子量表,并全部取4位有效数字。
元素周期表(带拼音)

元素周期表(带拼音)元素周期表是以原子或离子的符号作为标准号,以元素符号来表示元素种类或含量的化学符号,以及元素符号所代表的意义,可以反映元素特性的化学符号。
元素符号,是由原子排列顺序表示。
在原子排列中,每个原子或离子排列构成一个元素序列。
所有在排列中的原子按其分子个数表示为每个原子中分子所占组成单位,元素符号的大小就表示了所代表元素序号和该序号在化学上的意义,以及该序列对应分子之间的区别,也代表了元素之间互相影响而又相互独立的一个系统在一定程度上说明这个系统是否稳定和连续。
在化学性质上,元素都是平衡态,这也是我们要强调必须保持同一性的原因之一:原子形成过程不可能同时完全相同,但是它们之间不可能完全相同。
因此原子或离子之间并没有绝对紧密相联,即原子或离子能够存在于同一个空间中。
一、为什么要以原子命名?从化学角度看,元素在地球上存在的时间比地球上现有的原子的生命还早。
而目前最有可能用得上原子理论的就是原子族的相关元素(如铀、镭、铌、钽、锂、钡、钴、锆、硅、铂、镭)和元素族的所有原子核组成的有机金属元素。
我们知道,化学元素周期表中所列元素周期表所用原子或离子序号用一种特定形式表示。
如元素周期表中第一个原子按其序号可称为第 I元素第IV元素。
这些元素的序号一般就可以代表它们在化学上的含义。
因此,以原子命名可以避免用原子概念对原子现象作出概括描述,从而使化学元素周期表不会过于死板(例如只用原子名称)。
1、取其首字为元素名的依据在化学方面,有一种公认的元素命名原则,那就是尽量不用首字)来命名。
如在元素周期表中:第 I、 II、 III、 IV这四个数字为首字,其他每一个数字都要对应第一个字母:如第 I 对应1 (这四个数字是按首字第一英文字母排序而来)、第 II、 IV对应1 (这四个数字是按首字第二英文字母排序而来)。
但如果把这四个数字拆开来看则不存在这种说法或现象,如取1 (这个数字是按照首字“一”这一英文字母排序而来)来命名这四个数字则是不合理行为。
第2讲元素及元素周期表

工具。回答下列问题:
(1)元素周期表中不同元素间最本质的区分是 A (
填字母)。
A.质子数不同
B.中子数不同
C.相对原子质量不同
(2)1869年,
B (填字母)发现了元素周期
律并编制出元素周期表。
A.张青莲
B.门捷列夫
C.拉瓦锡
首页
末页
(3)元素周期表中氟元素的有关信息如图所示,下列说
法正确的是
B (填字母)。
A. Si
B. Fe
C. O
D. Al
首页
末页
4. (202X·天津)截止目前,我国的稀土储量居世界第 一位。铕(Eu)是一种稀土元素,下列有关说法中错误 的是( A ) A. 铕属于非金属元素 B. 铕的原子序数是63 C. 铕原子中的质子数为63 D. 铕的相对原子·临沂)下列是钠元素、氯元素在元素周期表 中的信息及有关粒子的结构示意图。请回答下列问题:
(1)D所表示的粒子是 Na+
(填写化学符号),
氯原子的结构示意图是 E
(填序号)。
(2)D、F形成化合物的化学式是 NaCl 。 (3)与元素的化学性质关系最密切的是④(填序号)。
①原子的核外电子数
②元素的相对原子质量
③元素的原子序数
④原子的最外层电子数
首页
末页
6.(2015·天津)元素周期表是学习和研究化学的重要
A.氟属于金属元素
B.氟的原子序数是9
C.氟的相对原子质量是19.00g
(4)氟原子结构示意图为
,氟原子在化学反应
中易 得到 (填“得到”或失去”)电子,由钠元素
和氟元素组成的化合物氟化钠的化学式为 NaF 。
首页
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、结构
IA
1 2
周3 期
4
IIA
族
IIIB IV VB VI VII
VIII
B
B
B
5
过渡元素
6
镧 系
锕
7
系
0
IIIA IVA VA VIA VIIA
IB IIB
短周期
第1周期:2 种元素 第2周期:8 种元素 第3周期:8 种元素
第4周期:18 种元素
周期 长周期 第5周期:18 种元素
C.副族元素中没有非金属元素. C
D.碱金属元素是指ⅠA族的所有元素.
4、已知短周期元素
X、 Y 、Z在周期
X
表中的位置如右图
Y
则它们分别是什么 Z 元素?
X是氦 、Y是 氟、Z是硫。
右表为元素周期表前四周期的一部分,下列有关
R、W、X、Y、Z五种元素的叙述中,判断正误: (1)Y、Z的阴离子电子层结构都与R原子的相
(横行)
第6周期:32 种元素
镧57La – 镥71Lu 共15 种元素称镧系元素
不完全周期 第7周期:现有26种元素
锕89Ac – 铹103Lr 共15 种元素称锕系元素
周期序数 = 电子层数
七个,ⅠA~ⅦA, 由短周期 主族 和长周期元素共同组成的族
副族 七个, ⅠB~ⅦB,只有长周
族
期元素组成的族
上层原子序数+下层元素种数=下层原子序数
ⅠA
0族
1
ⅡA
ⅢA ⅣA ⅤA ⅥA ⅦA
2
3
1A2
C13
4B 20
D31
5
6
7
2、同主族相邻周期的A、B两种元素所在
的周期分别有m种和n种元素,且A在B的上
周期,当A的原子序数为x时,则B的原子
序数为B(D
)
A.x-n
B. x+m
C.x-m
D.x+n
●元素周期表的应用
思考
甲、乙两种非金属元素:⑴甲单质比乙单质容易 与H2化合;⑵甲单质能与乙的简单阴离子反应置 换出乙的单质;⑶甲的最高价氧化物对应的水化
物酸性比乙的强;⑷与某金属反应时,甲原子得
电子数目比乙的多;⑸甲单质的熔、沸点比乙的
低。一般能说明甲比乙的非金属性强的是( C )
高三一轮复习系列教案
第五章 物质结构 元素周期律
第二讲 元素周期律和元素周期表
讨论2 :(07全国)用A+、B-、C2―、D、E、F、G和H分别表示
含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是 K 、B元素是 C1 、C元素是__S___
(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是 HC1 。
非 金 属 性 逐 渐 增 强
Cs Ba Tl Pb Bi Po At
金属性逐渐增强
原
子
核
元
外
素
电
性
子
质
排 布
决定
的 周
归纳
的
期
周
性
元 素 编制
周
期 律
元 素 周 期 表
期 性
元素性质
原子结构
表中位置
二、 元素周期表
1、编排原则
⑴按原子序数 递增的顺序从左向右排列
⑵把 电子层数 相同的排为同一横行
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子 式是 F2 。
(4)F是由两种元素组成的三原子分子,其分子式是 H2S ,
电子式是
。
(5)G分子中含有4个原子,其分子式是 H2O2 或 PH3 。
一、元素周期律
1.定义:元素的性质随着元素原子序数的递增而
呈周期性的变化,这个规律叫做元素周期律。 2.内容:随着原子序数(核电荷数)递增: ①原子核外电子排布呈周期性变化 ②原子半径呈周期性变化 ③元素主要化合价呈周期性变化 ④元素的金属性与非金属呈周期性变化
3、(05年全国Ⅲ)同一主族的两种元素的原子序数
之差不可能是( )D
A、16 B、26 C、36 D、46
4、某元素原子的最外层有两个电子,则有关 该元素的说法正确的是
A、 一定是第 ⅡA 元素
D
B、 一定是金属元素
C、 最高价一定为+2价
D、 可能是金属元素,也可能不是金属元素
5、下列叙述中正确的是: A.除零族元素外,短周期元素的最高化合 价在数值上都等于该元素所属的族序数。 B.除短周期外,其它周期均有18种元素.
3 Na MgⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB Al Si P S Cl Ar 18
4 K Ca
36
5
54
6
镧系
86
7
锕系
每周期元素种类依次为:
2、8、8、18、18、32、26
练习2.同一主族相邻上下两种原子序数之差
• 第ⅠA、ⅡA:
上层原子序数+上层元素种数=下层原子序数
• 第ⅢA-----0族:
同
(2)W的氢化物比X的氢化物稳定 (3)Y元素的非金属性比W元素的非金属性强
方法:通过周期表的结构和它们
所在的位置判断: R为 Ar 、W为 P、 Y为 S 、 X
WY
R
X为 N 、 Z为Br。
Z
考点二:元素的金属性和非金属性强弱的判断依据:
1.元素的非金属性(氧化性)强弱比较:
①根据元素周期表判断; ②根据元素单质与氢气反应的难易,以及生 成气态氢化物的稳定性判断; ③根据元素最高价氧化物的水化物的酸性强 弱 ④根据盐溶液中非金属单质间的置换关系; ⑤根据电解池中阴离子在阳极的放电性顺序。
1.寻找用于制取农药的元素 2.寻找半导体材料
3.寻找催化剂、耐高温、耐腐蚀的合金材料
考点一、对周期表结构的考查 1、 原子8305X处于周期表中 四 周期 ⅦA 族 它的原子核中有 45 个中子
2、某周期IIA族元素的原子序数为x,则同周期的
IIIA 族元素的原子序数为( ) D
A、只能是x+2 B、可能是x+8或x+18 C、只能是x+1 D、可能是x+1或x+11或x+25
3.实质:元素原子的核外电子排布的周期性变 化。
原子核外电子排布的周期性变化
+6 2 4
元素原子半径的周期性变化
原 子 半 径 逐 渐 增 大
原子半径逐渐减小
元素化合价
元素的金属性和非金属性递变规律
非金属性逐渐增强
H
金 属 性 逐 渐 增 强
Li Be B C N O F Na Mg Al Si P S Cl K Ca Ga Ge As Se Br Rb Sr In Sn Sb Te I
(纵行)
第Ⅷ族 第8、9、10三列元素组成的族
0族 稀有气体元素
主族序数 = 最外层电子数
练习1:图中只画出了元素周期表的框图,请在图中标明:(1)
族序数;(2)1~20号元素的符号;(3)镧、锕系;(4)稀有
气体的原子序数。
ⅠA
0Байду номын сангаас
1 H ⅡA
ⅢA ⅣA ⅤA ⅥA ⅦA He 2
2 Li Be
B C N O F Ne 10
