(2017-2019)高考化学真题分类汇编专题16工艺流程题(教师版)
2017年高考化学工艺流程

2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:MgO SiO2FeO、Fe2O3CaO Al2O3B2O330%~40%20%~25%5%~15%2%~3%1%~2%1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
2.(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:回答下列问题:(1)步骤①的主要反应为:FeO·Cr 2O 3+Na 2CO 3+NaNO 3−−−→高温 Na 2CrO 4+ Fe 2O 3+CO 2+ NaNO 2 上述反应配平后FeO·Cr 2O 3与NaNO 3的系数比为__________。
该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_______________及含硅杂质。
(3)步骤④调滤液2的pH 使之变____________________(填“大”或“小”),原因是_________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。
向“滤液3”中加入适量KCl ,蒸发浓缩,冷却结晶,过滤得到K 2Cr 2O 7固体。
冷却到___________________(填标号)得到的K 2Cr 2O 7固体产品最多。
a.80℃b.60℃c.40℃d.10℃步骤⑤的反应类型是___________________。
2017年高考化学《工艺流程》真题及专题讲解

2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:CaO Al2O3B2O3 MgO SiO2FeO、Fe2O330%~40% 20%~25% 5%~15% 2%~3% 1%~2% 1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
2.(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:资料:TiCl4及所含杂质氯化物的性质(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-12C(s)+O2(g)=2CO(g)ΔH2=-220.9kJ·mol-1①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④氯化产物冷却至室温,经过滤得到粗TiCl4(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。
示意图如下:物质a是______________,T2应控制在_________。
2017年高考化学《工艺流程》真题及专题讲解

2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:MgO SiO2FeO、Fe2O3CaO Al2O3B2O330%~40%20%~25%5%~15%2%~3%1%~2%1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
__________。
该步骤不能使用陶瓷容器,原因是滤渣2的主要成分是_______________a.80℃b.60℃c.40℃d.10℃步骤⑤的反应类型是___________________。
(5)某工厂用m1kg铬铁矿粉(含Cr2O340%)制备K2Cr2O7,最终得到产品m2kg,产率为_____________。
4.(14分)水泥是重要的建筑材料。
水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。
实验室测定水泥样品中钙含量的过程如图所示:回答下列问题:(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。
加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)(45.(14FeTiO3,(1)“(2)“写出相应(3)TiO2所得实验分析40(4)Li2的数目为(5)若Fe3+恰342(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式。
6.(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。
高考化学工艺流程真题及专题讲解

2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:MgO SiO2FeO、Fe2O3CaO Al2O3B2O330%~40%20%~25%5%~15%2%~3%1%~2%1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
2.(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:资料:TiCl4及所含杂质氯化物的性质化合物SiCl4TiCl4AlCl3FeCl3MgCl2沸点/℃58136181(升华)3161412熔点/℃−69−25193304714在TiCl4中的溶解互溶——微溶难溶性(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-12C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
2017年高考化学真题工艺流程汇编

(2017.新课标 II 卷 26)水泥是重要的建筑材料。水泥熟料的主要成分为 CaO、SiO2,并 含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题: (1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入 硝酸的目的是__________,还可使用___________代替硝酸。 (2)沉淀 A 的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反 应的化学方程式为____________________________________。 ( 3 )加氨水过程中加热的目的是 ___________ 。沉淀 B 的主要成分为 _____________ 、 ____________(写化学式) 。 (4)草酸钙沉淀经稀 H2SO4 处理后,用 KMnO4 标准溶液滴定,通过测定草酸的量可间接 获知钙的含量,滴定反应为: MnO 4-+H ++H 2C2O4→Mn 2++CO 2+H 2O 。实验中称取 0.400 g 水泥样品,滴定时消耗了 0.0500 mol·L−1 的 KMnO4 溶液 36.00 mL,则该水 泥样品中钙的质量分数为______________。 (1)将样品中可能存在的 Fe2+氧化为 Fe3+ H2 O2 (2)SiO2 (或 H2SiO3) SiO2+4HF=SiF4↑+2H2O(或 H2SiO3+4HF= SiF4↑+3H2O) (3)防止胶体生成,易沉淀分离 Fe(OH)3 Al(OH)3 (4)45.0% (2017.新课标 III 卷 27)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的 主要成分为 FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
2017年高考化学《工艺流程》真题及专题讲解

2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:CaO Al2O3B2O3 MgO SiO2FeO、Fe2O330%~40% 20%~25% 5%~15% 2%~3% 1%~2% 1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
2.(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:资料:TiCl4及所含杂质氯化物的性质熔点/℃?69 ?25 193 304 714在TiCl4中的互溶——微溶难溶溶解性(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-12C(s)+O2(g)=2CO(g)ΔH2=-220.9kJ·mol-1①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
2017年-2019年高考化学真题汇编(附全解全析):工艺流程题(大题)

3.[2019新课标Ⅲ] 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰
矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的 pH 范围如下:
金属离子
Mn2+
Fe2+
(2)“氧化”中添加适量的MnO2的作用是________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。 (4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。 (5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_________
2017 年-2019 年高考真题汇编:工艺流程题
1.[2019 新课标 Ⅰ]硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以 硼镁矿(含 Mg2B2O5·H2O、SiO2 及少量 Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题: (1)在 95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。 (2)“滤渣 1”的主要成分有_________。为检验“过滤 1”后的滤液中是否含有 Fe3+离子,可选用的
_______工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。 2.[2019新课标Ⅱ]立德粉ZnS· BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品 时,钡的焰色为__________(填标号)。 A.黄色 B.红色 C.紫色 D.绿色
2017年高考化学《工艺流程》真题及专题讲解

2017年高考化学《工艺流程》真题及专题讲解2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:MgO SiO2FeO、Fe2O3CaO Al2O3B2O330%~40% 20%~25% 5%~15% 2%~3% 1%~2% 1%~2% 回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
2.(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:资料:TiCl4及所含杂质氯化物的性质化合物SiCl4TiCl4AlCl3FeCl3MgCl2沸点/℃58 136 181(升华)316 1412熔点/℃−69 −25 193 304 714在TiCl4中的溶解性互溶——微溶难溶(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g)ΔH1=+175.4 kJ·mol-12C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
2017年高考化学《工艺操作规范》真题及专题讲解

2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:MgO SiO2FeO、Fe2O3CaO Al2O3B2O330%~40%20%~25%5%~15%2%~3%1%~2%1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
2.(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:资料:TiCl4及所含杂质氯化物的性质(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-12C(s)+O2(g)=2CO(g)ΔH2=-220.9kJ·mol-1①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。
示意图如下:物质a是______________,T2应控制在_________。
2017-2019年高考真题化学分项汇编_专题16 工艺流程题

专题16 工艺流程题1.[2019新课标Ⅰ]硼酸(H 3BO 3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。
一种以硼镁矿(含Mg 2B 2O 5·H 2O 、SiO 2及少量Fe 2O 3、Al 2O 3)为原料生产硼酸及轻质氧化镁的工艺流程如下:回答下列问题:(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。
为检验“过滤1”后的滤液中是否含有Fe 3+离子,可选用的化学试剂是_________。
(3)根据H 3BO 3的解离反应:H 3BO 3+H 2OH ++B(OH)−4,K a =5.81×10−10,可判断H 3BO 3是______酸;在“过滤2”前,将溶液pH 调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO 3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是_________。
【答案】(1)NH 4HCO 3+NH 3(NH 4)2CO 3(2)SiO 2、Fe 2O 3、Al 2O 3 KSCN (3)一元弱 转化为H 3BO 3,促进析出 (4)2Mg 2++323CO -+2H 2OMg(OH)2·MgCO 3↓+23HCO -(或2Mg 2++223CO -+H 2OMg(OH)2·MgCO 3↓+CO 2↑) 溶浸 高温焙烧【解析】(1)根据流程图知硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,用碳酸氢铵溶液吸收,反应方程式为:NH 3+NH 4HCO 3(NH 4)2CO 3。
(2)滤渣I 为不与硫酸铵溶液反应的Fe 2O 3、Al 2O 3、SiO 2;检验Fe 3+,可选用的化学试剂为KSCN ,(3)由硼酸的离解方程式知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH 调节至3.5,目的是将B(OH)−4转化为H 3BO 3,并促进H 3BO 3析出,(4)沉镁过程中用碳酸铵溶液与Mg 2+反应生成Mg(OH)2∙MgCO 3,沉镁过程的离子反应为:2Mg 2++2H 2O+3CO 32-Mg(OH)2∙MgCO 3↓+2HCO 3-;母液加热分解后生成硫酸铵溶液,可以返回“溶浸”工序循环使用;碱式碳酸镁不稳定,高温下可以分解,故由碱式碳酸镁制备轻质氧化镁的方法是高温焙烧。
2019年高考化学-工艺流程题专题复习

(用离子方程式表示) 。
( 4)有关物质的溶解度如图所示。向“滤液 3”中加 入适量 KCl ,蒸发浓缩,冷却结晶,过滤得
到 K2Cr2O7 固体。冷却到 ___________(填标号)得到的 K2Cr2O7 固体产品最多。
a. 80℃
b. 60℃
c. 40℃
d. 10℃
步骤⑤的反应类型是 ___________________ 。
Na 2CrO4+ Fe 2O3 +CO2+ NaNO2
上述反应配平后 FeO·Cr 2O3 与 NaNO3 的系数比为 _______。该步骤不能使用陶瓷容器,原因是
_____。
( 2)滤渣 1 中含量最多的金属元素是 _______,滤渣 2 的主要成分是 __________ 及含硅杂质。
( 3)步骤④调滤液 2 的 pH 使之变 ____________(填“大”或“小”) ,原因是 _____________
( 6)高温下 FePO4 与 Li 2CO3 和 H2C2O4 混合加热可得 LiFePO4,根据电子守恒和原子守恒可得此反 应的化学方程式为 2FePO4 + Li 2CO3+ H 2C2O4 高温 2LiFePO4+ H 2O↑ + 3CO2↑。
【名师点睛】工艺流程题,就是将化工生产过程中的主要生产阶段即生产流程用框图形式表示出来, 并根据生产流程中有关的化学知识步步设问, 形成与化工生产紧密联系的化工工艺试题。
( 5)若“滤液②”中 c(Mg 2 ) 0.02mol L 1 ,加入双氧水和磷酸(设溶液体积增加 1 倍),使
Fe3 恰好沉淀完全即溶液中 c(Fe3 ) 1.0 10 5 mol L 1,此时是否有 Mg3(PO4) 2 沉淀生成?
高考真题化学分项详解专题十六 碳、硅及无机非金属材料 (含参考答案与解析)

高考真题化学分项详解专题十六碳、硅及无机非金属材料1.【2019·全国高考真题】陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是( )A .“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B .闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C .陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D .陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点2.【2018·江苏高考真题】下列有关物质性质与用途具有对应关系的是( ) A .NaHCO 3受热易分解,可用于制胃酸中和剂B .SiO 2熔点高硬度大,可用于制光导纤维C .Al 2O 3是两性氧化物,可用作耐高温材料D .CaO 能与水反应,可用作食品干燥剂3.【2020·浙江高考真题】35Ca SiO 是硅酸盐水泥的重要成分之一,其相关性质的说法不正确...的是( )A .可发生反应:Δ3543232Ca SiO 4NH ClCaSiO 2CaCl 4NH 2H O +++↑+B .具有吸水性,需要密封保存C .能与2SO ,反应生成新盐D .与足量盐酸作用,所得固体产物主要为2SiO4.【2007·广东高考真题】下列说法正确的是( ) A .硅材料广泛应用于光纤通讯 B .工艺师利用盐酸刻蚀石英制作艺术品 C .水晶项链和餐桌上的瓷盘都是硅酸盐制品 D .粗硅制备单晶硅不涉及氧化还原反应5.【2013·江苏高考真题】下列有关物质性质的应用正确的是( ) A .液氨汽化时要吸收大量的热,可用作制冷剂B .二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸C .生石灰能与水反应,可用来干燥氯气D.氯化铝是一种电解质,可用于电解法制铝6.【2019·浙江高考真题】下列说法不正确...的是()A.液氯可以储存在钢瓶中B.天然气的主要成分是甲烷的水合物C.天然石英和水晶的主要成分都是二氧化硅D.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等7.【2010·江苏高考真题】下列有关物质的性质或应用的说法不正确的是()A.二氧化硅是生产光纤制品的基本原料B.水玻璃可用于生产黏合剂和防火剂C.盐析可提纯蛋白质并保持其生理活性D.石油分馏可获得乙烯、丙烯和丁二烯8.【2009·广东高考真题】下列关于硅单质及其化合物的说法正确的是()①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、水晶饰物都是硅酸盐制品③高纯度的硅单质广泛用于制作光导纤维④陶瓷是人类应用很早的硅酸盐材料A.①②B.②③C.①④D.③④9.【2018·海南高考真题】化学与生产生活密切相关,下列说法错误的是()A.Na2O2可与CO2反应放出氧气,可用于制作呼吸面具B.SiO2具有导电性,可用于制作光导纤维和光电池C.聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层D.氯水具有较强的氧化性,可用于漂白纸张.织物等10.【2011·江苏高考真题】下列有关物质的性质和该性质的应用均正确的是()A.常温下浓硫酸能使铝发生钝化,可用铝制容器贮运浓硫酸B.二氧化硅不与任何酸反应,可用石英制造耐酸容器C.二氧化氯具有还原性,可用于自来水的杀菌消毒D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀11.【2009·重庆高考真题】材料与化学密切相关,表中对应系错误的是()12.【2015·全国高考真题】食品干燥剂应无毒、无味、无腐蚀性及环境友好。
高考化学工艺流程题

• • •工艺流程图题型突破1 •【2017新课标1卷】(14分)LiiTiQq 和LiFePO,都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiOs,还含有少 量MgO 、SiO=等杂质)来制备,工艺流程如下:(1) 〃酸浸〃实验中,铁的浸出率结果如下图所示。
由图可知,当铁的浸出率为7酬时,所采用的实验条件为 _______________(2) 〃酸浸〃后,钛主要以TiOClf 形式存在,写出相应反应的离子方程式 _________________ (3) T I O Z -A H Z O 沉淀与双氧水、氨水反应40 min 所得实验结果如下表所示:温度/c°30 35 40 45 50 TiOz-AHzO 转化率%9295979388分析40 C TiOz-AHzO o⑷Li=Ti s Ox 冲Ti 的化合价为+4,其中过氧键的数目为 ____________________ o⑸若“滤液②"中c(Mg 2+) = 0.02 mol- L-*,加入双氧水和磷酸(设溶液体积增加1倍),使Fe 3+ 恰好沉淀完全即溶液中c(Fe s+) = 1.0xl0-5 mol-r 1 .此时是否有Mg=(PO 扰沉淀生成?滤渣回答下列问题:滤液②警竺竄愕等L 唤11—r*/弋'f—/■L7(t / r6{ cL-r^-酸浸—滤液① 水解 过滤(列式计算)。
FePCh、Mg3(PO.)=的心分别为 1.3xl0-224.0xl0-24o(6)写出"高温憾烧②"中由FePOj制备LiFePOd的化学方程式______________________ 。
【答案】(1) 100C\ 2h, 90C°, 5h (2) FeTiOs+ 4H*+4O- = Fe=++ TiOClf + 2H=0(3)低于40C。
,TiO=-AH=O转化反应速率随温度升高而增加;超过40C°,双氧水分解与氨气逸出导致TiO=-AH=O转化反应速率下降(4) 41 Q y 1 O"22(5) F扌恰好沉淀完全时.QPO:)二-------- mol・L亠1.3X10』mol・L,刃MgJ肪(PO:) =l.Ox 10'(0.01)3x(1.3xl(r17)2=1.7xl(r J0< a ,因此不会生成Mg3(PO.)2沉淀。
专题16 工艺流程 -2019年高考化学母题题源系列 Word版含解析

专题16 工艺流程【母题来源】2019年高考新课标Ⅰ卷【母题题文】硼酸(H 3BO 3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。
一种以硼镁矿(含Mg 2B 2O 5·H 2O 、SiO 2及少量Fe 2O 3、Al 2O 3)为原料生产硼酸及轻质氧化镁的工艺流程如下:回答下列问题:(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。
为检验“过滤1”后的滤液中是否含有Fe 3+离子,可选用的化学试剂是_________。
(3)根据H 3BO 3的解离反应:H 3BO 3+H 2OH ++B(OH)−4,K a =5.81×10−10,可判断H 3BO 3是______酸;在“过滤2”前,将溶液pH 调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO 3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是_________。
【参考答案】(1)NH 4HCO 3+NH 3(NH 4)2CO 3(2)SiO 2、Fe 2O 3、Al 2O 3 KSCN (3)一元弱 转化为H 3BO 3,促进析出(4)2Mg 2++323CO -+2H 2OMg(OH)2·MgCO 3↓+23HCO -(或2Mg 2++223CO -+H 2OMg(OH)2·MgCO 3↓+CO 2↑) 溶浸 高温焙烧【试题解析】(1)根据流程图知硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,用碳酸氢铵溶液吸收,反应方程式为:NH 3+NH4HCO3(NH4)2CO3。
(2)滤渣I为不与硫酸铵溶液反应的Fe2O3、Al2O3、SiO2;检验Fe3+,可选用的化学试剂为KSCN,(3)由硼酸的离解方程式知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,目的是将B(OH)−4转化为H3BO3,并促进H3BO3析出,(4)沉镁过程中用碳酸铵溶液与Mg2+反应生成Mg(OH)2∙MgCO3,沉镁过程的离子反应为:2Mg2++2H 2O+3CO32-Mg(OH)2∙MgCO3↓+2HCO3-;母液加热分解后生成硫酸铵溶液,可以返回“溶浸”工序循环使用;碱式碳酸镁不稳定,高温下可以分解,故由碱式碳酸镁制备轻质氧化镁的方法是高温焙烧。
2017年高考化学《工艺流程》真题及专题讲解

2017年高考化学《工艺流程》试题汇编1.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:硼镁泥的主要成分如下表:MgO SiO2FeO、Fe2O3CaO Al2O3B2O330%~40%20%~25%5%~15%2%~3%1%~2%1%~2%回答下列问题:(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
__________。
该步骤不能使用陶瓷容器,原因是滤渣2的主要成分是_______________K 2Cr2O7固体。
冷却到___________________(填标号)得到的K2Cr2O7固体产品最多。
a.80℃b.60℃c.40℃d.10℃步骤⑤的反应类型是___________________。
(5)某工厂用m1kg铬铁矿粉(含Cr2O340%)制备K2Cr2O7,最终得到产品m2kg,产率为_____________。
4.(14分)水泥是重要的建筑材料。
水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。
实验室测定水泥样品中钙含量的过程如图所示:回答下列问题:(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。
加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为(3)(45.(FeTiO3,(1)(2)写出相应(3)所得实验分析(4)的数目为(5),加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
三年高考(2017-2019)高考化学真题分项汇编专题16工艺流程题(含解析)
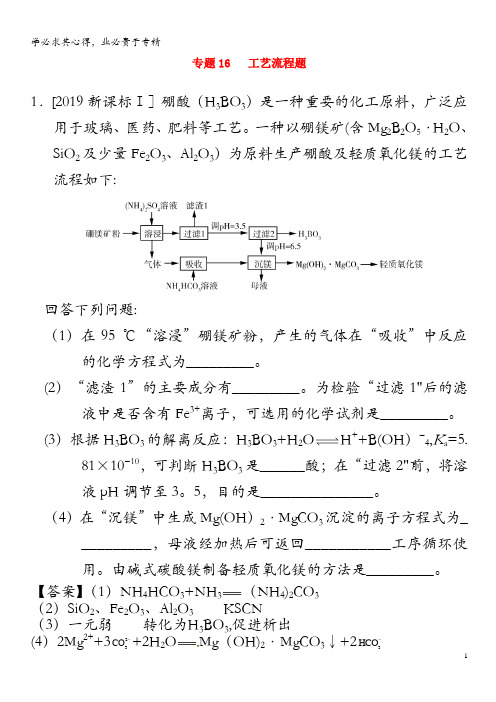
专题16 工艺流程题1.[2019新课标Ⅰ]硼酸(H 3BO 3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。
一种以硼镁矿(含Mg 2B 2O 5·H 2O 、SiO 2及少量Fe 2O 3、Al 2O 3)为原料生产硼酸及轻质氧化镁的工艺流程如下:回答下列问题:(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。
为检验“过滤1"后的滤液中是否含有Fe 3+离子,可选用的化学试剂是_________。
(3)根据H 3BO 3的解离反应:H 3BO 3+H 2O H ++B(OH )−4,K a =5.81×10−10,可判断H 3BO 3是______酸;在“过滤2"前,将溶液pH 调节至3。
5,目的是_______________。
(4)在“沉镁”中生成Mg(OH )2·MgCO 3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是_________。
【答案】(1)NH 4HCO 3+NH 3(NH 4)2CO 3(2)SiO 2、Fe 2O 3、Al 2O 3 KSCN(3)一元弱 转化为H 3BO 3,促进析出(4)2Mg 2++323CO -+2H 2O Mg (OH)2·MgCO 3↓+23HCO -(或2Mg 2++223CO +H 2O Mg(OH )2·MgCO 3↓+CO 2↑) 溶浸 高温焙烧【解析】(1)根据流程图知硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,用碳酸氢铵溶液吸收,反应方程式为:NH 3+NH 4HCO 3(NH 4)2CO 3。
(2)滤渣I 为不与硫酸铵溶液反应的Fe 2O 3、Al 2O 3、SiO 2;检验Fe 3+,可选用的化学试剂为KSCN ,(3)由硼酸的离解方程式知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH 调节至3.5,目的是将B (OH )−4转化为H 3BO 3,并促进H 3BO 3析出,(4)沉镁过程中用碳酸铵溶液与Mg 2+反应生成Mg (OH)2∙MgCO 3,沉镁过程的离子反应为:2Mg 2++2H 2O+3CO 32-Mg(OH )2∙MgCO 3↓+2HCO 3-;母液加热分解后生成硫酸铵溶液,可以返回“溶浸”工序循环使用;碱式碳酸镁不稳定,高温下可以分解,故由碱式碳酸镁制备轻质氧化镁的方法是高温焙烧。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题16 工艺流程题1.[2019新课标Ⅰ]硼酸(H 3BO 3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。
一种以硼镁矿(含Mg 2B 2O 5·H 2O 、SiO 2及少量Fe 2O 3、Al 2O 3)为原料生产硼酸及轻质氧化镁的工艺流程如下:回答下列问题:(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。
为检验“过滤1”后的滤液中是否含有Fe 3+离子,可选用的化学试剂是_________。
(3)根据H 3BO 3的解离反应:H 3BO 3+H 2O 垐?噲?H ++B(OH)−4,a =5.81×10−10,可判断H 3BO 3是______酸;在“过滤2”前,将溶液pH 调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO 3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是_________。
【答案】(1)NH 4HCO 3+NH 3(NH 4)2CO 3(2)SiO 2、Fe 2O 3、Al 2O 3 SCN(3)一元弱 转化为H 3BO 3,促进析出(4)2Mg 2++323CO -+2H 2OMg(OH)2·MgCO 3↓+23HCO -(或2Mg 2++223CO -+H 2OMg(OH)2·MgCO 3↓+CO 2↑) 溶浸 高温焙烧【解析】(1)根据流程图知硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,用碳酸氢铵溶液吸收,反应方程式为:NH 3+NH 4HCO 3 (NH 4)2CO 3。
(2)滤渣I 为不与硫酸铵溶液反应的Fe 2O 3、Al 2O 3、SiO 2;检验Fe 3+,可选用的化学试剂为SCN , (3)由硼酸的离解方程式知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH 调节至3.5,目的是将B(OH)−4转化为H 3BO 3,并促进H 3BO 3析出,(4)沉镁过程中用碳酸铵溶液与Mg 2+反应生成Mg(OH)2∙MgCO 3,沉镁过程的离子反应为:2Mg 2++2H 2O+3CO 32-Mg(OH)2∙MgCO 3↓+2HCO 3-;母液加热分解后生成硫酸铵溶液,可以返回“溶浸”工序循环使用;碱式碳酸镁不稳定,高温下可以分解,故由碱式碳酸镁制备轻质氧化镁的方法是高温焙烧。
2.[2019新课标Ⅱ]立德粉nS·BaSO 4(也称锌钡白),是一种常用白色颜料。
回答下列问题:(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。
灼烧立德粉样品时,钡的焰色为__________(填标号)。
A .黄色B .红色C .紫色D .绿色(2)以重晶石(BaSO 4)为原料,可按如下工艺生产立德粉:①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。
回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO 2和一种清洁能气体,该反应的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。
其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S 2−的含量可以用“碘量法”测得。
称取m g 样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L −1的I 2−I 溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min ,有单质硫析出。
以淀粉为指示剂,过量的I 2用0.1000 mol·L −1Na 2S 2O 3溶液滴定,反应式为I 2+2223S O -2I −+246S O -。
测定时消耗Na 2S 2O 3溶液体积V mL 。
终点颜色变化为_________________,样品中S 2−的含量为______________(写出表达式)。
【答案】(1)D(2)①BaSO 4+4CBaS+4CO ↑CO+H 2OCO 2+H 2 ②BaCO 3③S 2−+Ba 2++n 2++24SO - BaSO 4·nS ↓ (3)浅蓝色至无色 125.000.10003221001000V m -⨯⨯⨯⨯()% 【解析】【分析】(1)焰色反应不属于化学变化,常用检验金属元素存在,常见金属元素焰色:钠Na(黄色)、锂Li(紫红)、钾(浅紫)、铷Rb(紫色)、钙Ca(砖红色)、锶Sr(洋红)、铜Cu(绿色)、钡Ba(黄绿)、铯Cs(紫红);(2)流程分析:重晶石与焦炭在回转炉中反应BaSO4+4CBaS+4CO↑,生成还原料BaS,硫化钡溶液与硫酸锌发生复分解反应S2−+Ba2++n2++24SO-BaSO4·nS↓,得到立德粉。
①注意焦炭过量生成CO,反应物为硫酸钡与焦炭,产物为BaS与CO,写出方程式;CO与水蒸气反应生成CO2与H2,写出方程式CO+H2OCO2+H2。
②根据信息臭鸡蛋气味气体为硫化氢气体,由强酸制弱酸原理,还原料硫化钡与空气中水、二氧化碳反应生成了碳酸钡与硫化氢气体。
③硫化钡与硫酸锌为可溶性强电解质,写成离子形式,产物硫酸钡与硫化锌为沉淀,不可电离,写出离子方程式。
(3)碘单质与淀粉混合为蓝色,用硫代硫酸钠滴定过量的I2,故终点颜色变化为浅蓝色至无色;根据氧化还原反应得失电子数相等,利用关系式法解题。
【详解】(1)焰色反应不是化学变化,常用检验金属元素存在,常见金属元素焰色:A.钠的焰色为黄色,故A错误;B.钙的焰色为红色,故B错误;C.钾的焰色为紫色,故C错误;D.钡的焰色为绿色,故D 正确;故选D。
(2)①注意焦炭过量生成CO,反应物为硫酸钡与焦炭,产物为BaS与CO,写出方程式BaSO4+4CBaS+4CO↑;CO与水蒸气反应生成CO2与H2,写出方程式:CO+H2OCO2+H2。
②根据信息臭鸡蛋气味气体为硫化氢气体,由强酸制弱酸原理,还原料硫化钡与空气中水,二氧化碳反应生成了碳酸钡与硫化氢气体。
③硫化钡与硫酸锌为可溶性强电解质,写成离子形式,产物硫酸钡与硫化锌为沉淀,不可电离,写出离子方程式:S2−+Ba2++n2++24SO-BaSO4·nS↓。
(3)碘单质与硫离子的反应:S2-+I2S+2I-;碘单质与淀粉混合为蓝色,用硫代硫酸钠滴定过量的I2,故终点颜色变化为浅蓝色至无色;根据氧化还原反应得失电子数相等,利用关系式法解题;根据化合价升降相等列关系式,设硫离子物质的量为n mol:S2- ~I22S2O32- ~I21 mol 1 mol2 mol 1 moln mol n mol 0.1V×10-3mol 12⨯0.1V×10-3moln+12⨯0.1V×10-3mol=250.1V×10-3mol,得n=(25-12V)0.1×10-3mol则样品中硫离子含量为:2 nM Sm-⨯()×100%=125.00V0.1000322m1000-⨯⨯⨯()×100%。
3.[2019新课标Ⅲ]高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、n、Ni、Si等元素)制备,工艺如下图所示。
回答下列问题:相关金属离子[c0(M n+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:金属离子Mn2+Fe2+Fe3+Al3+Mg2+n2+Ni2+开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9 (1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去n2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。
若溶液酸度过高,Mg2+沉淀不完全,原因是_________ ____________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNiCo y MnO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。
当=y=13时,=___________。
【答案】(1)SiO2(不溶性硅酸盐)MnO2+MnS+2H2SO42MnSO4+S+2H2O(2)将Fe2+氧化为Fe3+(3)4.7(4)NiS和nS(5)F−与H+结合形成弱电解质HF,MgF2Mg2++2F−平衡向右移动(6)Mn2++23HCO-MnCO3↓+CO2↑+H2O(7)13【解析】(1)Si 元素以SiO 2或不溶性硅盐存在,SiO 2与硫酸不反应,所以滤渣I 中除了S 还有SiO 2;在硫酸的溶浸过程中,二氧化锰和硫化锰发生了氧化还原反应,二氧化锰作氧化剂,硫化锰作还原剂,方程式为:MnO 2+MnS+2H 2SO 42MnSO 4+S+2H 2O 。
(2)二氧化锰作为氧化剂,使得MnS 反应完全,且将溶液中Fe 2+氧化为Fe 3+。
(3)由表中数据知pH 在4.7时,Fe 3+和Al 3+沉淀完全,所以应该控制pH 在4.7~6之间。
(4)根据题干信息,加入Na 2S 除杂为了除去锌离子和镍离子,所以滤渣3是生成的沉淀nS 和NiS 。
(5)由HF 垐?噲?H ++F -知,酸度过大,F -浓度减低,使得MgF 2垐?噲?Mg 2++2F -平衡向沉淀溶解方向移动,Mg 2+沉淀不完全。
(6)根据题干信息沉锰的过程是生成了MnCO 3沉淀,所以反应离子方程式为:Mn 2++2HCO 3-MnCO 3↓+CO 2↑+H 2O 。
