大庆中考二轮复习化学推断题80题专题训练(含答案)
中考二轮复习化学推断题50题专题训练(含答案)

中考二轮复习化学推断题50题专题训练(含答案)一、中考化学推断题1.实验室中现有一固体混合物A,其中可能含有 Na2CO3、BaSO4、NaC1、CuO四种物质中的两种或多种。
按如图所示进行实验,出现的现象如图中所述。
(设过程中所有可能发生的反应都恰好完全进行)试根据实验过程和发生的现象判断(1)产生的气体B的化学式是_____。
(2)写出步骤③中生成蓝色沉淀F的化学反应方程式_____。
(3)在溶液C中,一定大量存在的酸根离子是_____。
(4)混合物A中,还不能确定存在的物质是_____(写化学式),要进一步确定其是否存在,可用固体混合物A的样品进行再实验,请简要说明实验操作步骤、发生的现象及结论:_____。
【答案】CO2 CuCl2+2NaOH=Cu(OH)2↓+2NaCl Cl﹣ NaCl 取混合物A适量,溶于足量水中,过滤;向滤液中加入过量稀硝酸,再滴入适量硝酸银溶液,振荡观察;如果有白色沉淀生成,则有氯化钠,如果没有白色沉淀,则没有氯化钠【解析】【分析】硫酸钡难溶于水,难溶于酸,碳酸钠和盐酸反应生成的二氧化碳能使澄清石灰水变浑浊,氧化铜和盐酸反应生成氯化铜和水,氯化铜和氢氧化钠反应生成氯化钠和氢氧化铜沉淀。
所以固体混合物A中加入稀盐酸,生成的气体B能使澄清石灰水变浑浊,则B是二氧化碳,样品中一定含有碳酸钠,滤渣D中加入稀硝酸,没有明显现象,所以样品中一定含有硫酸钡,滤液C中加入氢氧化钠会生成蓝色沉淀,所以样品中一定含有氧化铜。
【详解】(1)产生的气体B的化学式是:CO2;(2)步骤③中生成蓝色沉淀F的反应是氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;(3)在溶液C中,一定大量存在的酸根离子是Cl﹣;(4)混合物A中,还不能确定存在的物质是NaCl,要进一步确定其是否存在,可用固体混合物A的样品进行再实验,实验操作步骤、发生的现象及结论是:取混合物A适量,溶于足量水中,过滤;向滤液中加入过量稀硝酸,再滴入适量硝酸银溶液,振荡观察;如果有白色沉淀生成,则有氯化钠,如果没有白色沉淀,则没有氯化钠。
中考二轮复习化学推断题50题专题训练(含答案)

中考二轮复习化学推断题50题专题训练(含答案)一、中考化学推断题1.A →I 是初中化学常见的物质,它们的相互转化关系如图所示,其中A 、B 组成元素相同且常温下为液体,C 、D 、E 为无色气体,E 为温室气体之一,H 是石灰石的主要成分。
回答下列问题:(1)写出下列物质的化学式:D_____;F_____。
(2)写出反应①的化学方程式_____,基本反应类型为_____。
(3)写出反应②的化学方程式_____。
【答案】H 2 C 2H 2O 22MnO 2H 2O +O 2↑ 分解反应 Ca (OH )2+CO 2═CaCO 3↓+H 2O【解析】【分析】根据题目给出的流程图和信息:根据“H 是石灰石的主要成分”,则推测H 为碳酸钙;结合图框:B 通电生成D 、C ,则B 为水,D 为氢气,C 为氧气;A 分解生成C 、F ,则为双氧水分解生成氧气和水;根据二氧化碳与氢氧化钙反应生成碳酸钙和水等知识,则F 为碳,E 为二氧化碳,G 为氢氧化钙,代入检验,符合题意。
【详解】(1)D 氢气,化学式为H 2;F 为碳,化学式为C ;(2)反应①为双氧水分解生成氧气和水,反应的化学方程式:2H 2O 22MnO 2H 2O +O 2↑;其反应的基本反应类型为分解反应;(3)反应②为二氧化碳与氢氧化钙反应生成碳酸钙和水,其反应的化学方程式Ca (OH )2+CO 2═CaCO 3↓+H 2O 。
【点睛】首先根据将题中有特征的物质推出,找出突破口,然后结合题中的反应和转化图推出其他的物质即可。
2.如图是初中化学常见六种物质之间的关系图。
(物质是溶液的只考虑溶质)图中用“一”表示两端的物质能发生化学反应,“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。
A与B两溶液可以发生中和反应生成一种厨房中常用的调味剂,C在农业上可用来配制波尔多液,D可用于制玻璃,请回答下列问题:(1)请分别写出下列物质的化学式(或溶质的化学式):B___;D___。
中考二轮复习化学推断题专题练习(带答案)

中考二轮复习化学推断题专题练习(带答案)一、中考化学推断题1.已知A、B、C、D、E是初中化学中常见的五种物质,均含有同一种元素。
其中,A、B、D、E是不同类别的物质,B和C含有的元素完全相同,E是一种重要建筑材料的主要成分,它们在一定条件下的转化关系如图所示。
请你完成以下空白:(1)D的化学式为_____。
(2)请写出B→E反应的化学方程式:_____(3)A→C的反应基本类型是:_____(4)请说出C的一种用途:_____【答案】H2CO3 Ca(OH)2+CO2=CaCO3↓+H2O 化合反应作燃料或冶炼金属【解析】【分析】A、B、C、D、E是初中化学中常见的五种物质,均含同一种元素,B和C含有的元素完全相同,B、C可以相互转化,所以B、C是二氧化碳和一氧化碳,A会转化成二氧化碳和一氧化碳,所以A是碳,E是一种重要建筑材料的主要成分,E和B可以相互转化,所以B 是二氧化碳,C是一氧化碳,E就是碳酸钙,D与其它四种物质属于不同的类别,D和二氧化碳可以相互转化,所以D是碳酸,带入验证,推理正确。
【详解】由分析可知(1)D的化学式为H2CO3;(2)B→E的反应是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;(3)A→C的反应是碳和氧气在点燃的条件下生成一氧化碳,此反应属于化合反应;(4)C是一氧化碳,可作燃料或冶炼金属。
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
2.A、B、C、D是初中化学常见的物质,其中A为无色气体单质,B、C为氧化物,且B为有毒气体,D是大理石的主要成分,它们之间的转化关系如图所示(图中反应条件及部分反应物、生成物已省略)。
回答下列问题:(1)写出下列物质的化学式:A_____;B_____;C_____。
(2)实验室常用_____鉴别B和C。
中考二轮复习化学推断题100题专题训练(含答案)

中考二轮复习化学推断题100题专题训练(含答案)一、中考化学推断题1.A~H为初中化学常见物质,相互关系如图所示,“→”表示转化关系,“—”表示相互之间能发生反应(部分反应物、生成物及反应条件省略)。
其中A、G、E为氧化物且A和G的元素组成相同;B、D是常见的两种碱; C是石灰石的主要成分;F是胃酸的主要成分。
(1)A的化学式_____________,C的化学式____________。
(2)F的用途有____________(写出一种即可),D的俗称____________。
(3)写出化学反应①③的化学方程式:①____________;③____________。
(4)下列反应中属于置换反应的是____________。
A.④ B.⑤ C.⑥【答案】CO2 CaCO3除铁锈或制药物烧碱/火碱/苛性钠 Ca(OH) 2+Na2CO3=CaCO3↓+2NaOH CaCO3+2HCl=CaCl2+H2O+CO2↑ B【解析】【分析】A、G为氧化物且A和G的元素组成相同,A、G,可能是CO和CO2或H2O和H2O2中的一种,B为碱,A能与碱反应,A是二氧化碳,G为一氧化碳,G能转化为H,H可能是CO 与金属氧化物反应生成的金属如铁等,F为胃酸的主要成分,F是盐酸,盐酸能与活泼金属反应,盐酸能与碳酸钙反应生成二氧化碳;B、D是常见的两种碱B能够转化为D,B可能是氢氧化钙,D为氢氧化钠;C为石灰石的主要成分,C为碳酸钙,E是氧化物,可能为水;将假设代入检验,符合题意;【详解】(1)A是二氧化碳,化学式是CO2,C是碳酸钙,化学式是CaCO3;(2)F是盐酸,可用作除铁锈或制药物,D是氢氧化钠,俗称是烧碱或火碱或苛性钠;(3)化学反应①是可用碳酸钠溶液与氢氧化钙溶液反应生成氢氧化钠和碳酸钙反应的化学方程式是Ca(OH) 2+Na2CO3=CaCO3↓+2NaOH;反应③是碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;(4)反应④CO与金属氧化物反应生成金属和二氧化碳,该类反应是两种化合物反应生成一种单质和一种化合物,不属于置换反应;反应⑤是金属与盐酸反应生成盐和氢气,该类反应是由一种单质与一种化合物反应生成一种单质和一种化合物,属于置换反应;反应⑥是盐酸和碳酸钙反应生成氯化钙和水和二氧化碳,属于复分解反应。
中考二轮复习化学推断题80题专题训练(含答案)

中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.现有一包不纯的K2CO3固体,可能含有Fe(NO3)3、CaCO3、KCl、BaCl2、Na2SO4、Na2CO3中的一种或几种。
现做如下实验:(1)取固体试样溶于足量水,得无色溶液A,则原固体一定不含______。
(2)向溶液A中加入足量Ba(NO3)2溶液,过滤得白色固体B和无色滤液C.加入Ba(NO3)2溶液时一定发生反应的化学方程式是______。
(3)向固体B中加入足量稀HNO3,固体完全溶解,则原固体一定不含______。
(4)取少量滤液C,先滴加过量稀HNO3,再滴加AgNO3溶液,出现白色沉淀,则原固体一定含有______。
(5)若所取固体试样为13.8g,实验(2)中得到白色固体B的质量为19.7g,则原固体中一定______(选填“不含”或“含”)Na2CO3。
【答案】Fe(NO3)3、CaCO3、BaCl2 K2CO3+Ba(NO3)2=BaCO3↓+2KNO3 Na2SO4 KCl 含【解析】【分析】硝酸铁溶于水,溶液显黄色,碳酸钙难溶于水,硝酸钡和碳酸钾反应会生成白色的碳酸钡沉淀,硫酸根离子和钡离子反应生成不溶于酸的硫酸钡沉淀,碳酸根离子和钡离子也会生成溶于酸的碳酸钡沉淀。
【详解】(1)取固体试样溶于足量水,得无色溶液A,所以原固体一定不含Fe(NO3)3、CaCO3、BaCl2;(2)向溶液A中加入足量Ba(NO3)2溶液,过滤得白色固体B和无色滤液C,加入Ba(NO3)2溶液时一定发生的反应是碳酸钾和硝酸钡反应生成碳酸钡沉淀和硝酸钾,化学方程式是:K2CO3+Ba(NO3)2=BaCO3↓+2KNO3;(3)向固体B中加入足量稀HNO3,固体完全溶解,所以原固体一定不含Na2SO4;(4)取少量滤液C,先滴加过量稀HNO3,再滴加AgNO3溶液,出现白色沉淀,则原固体一定含有KCl;(5) K2CO3+Ba(NO3)2=BaCO3↓+2KNO3,138 19713.8g 19.7gNa2CO3+Ba(NO3)2=BaCO3↓+2NaNO3,106 19710.6g 19.7g13.8g的碳酸钾会生成19.7g的碳酸钡沉淀,10.6g的碳酸钠会生成19.7g的碳酸钡沉淀,原固体一定含有KCl,所以若所取固体试样为13.8g,实验(2)中得到白色固体B的质量为19.7g,所以原固体中一定含Na2CO3。
2024年中考化学二轮复习专题训练:推断题(含答案)

2024年中考化学二轮复习专题训练:推断题(含答案)1.A、B、C、D、E、F、X、Y都是初中化学中的常见物质,已知X是一种混合物,A、B、Y是单质,通常情况下,C是一种具有刺激性气味且相对分子质量为17的气体,能够使酚酞溶液变红。
D、E是含有相同元素的气态氧化物,它们之间有如下转化关系。
请你回答下列问题:(1)X是(填“纯净物”或“混合物”),其分离过程是变化。
(填“物理”和“化学”)(2)A与H2,反应的化学方程式是,其基本反应类型是。
(3)E与氧化铁的反应是工业炼铁的原理,其化学方程式是。
如何预防铁制品生锈(写一条)。
(4)C+D+食盐(主要成分为NaCl)+水→F+NH4Cl,推测F中一定含有元素,作出此判断的依据是。
2.已知A、B、C、D、E为初中常见的五种物质,A、B、C、D分别为酸、盐、单质、氧化物中的一种。
A为紫红色固体,E为侯式制碱法制得的“碱”,D与C不含相同元素。
图中“—”表示两种物质能发生化学反应,“→”表示一种物质可以通过一步反应转化为另一种物质。
(部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)。
请回答问题:(1)C、D物质的化学式:C;D。
(2)D、E在溶液中反应的现象。
(3)A、B反应的化学方程式。
(4)图中一定不涉及的基本反应类型是反应。
3.初中化学常见的四种物质之间的转化关系(部分物质和反应条件已经略去)如图所示。
甲是天然气的主要成分,乙、丙元素组成完全相同。
(1)甲的化学式为。
(2)2O→乙反应的基本反应类型为。
(3)乙→丙反应的化学方程式为。
4.A~F是初中化学常见物质,其中A和C是组成元素相同的两种液体,D和E是碳元素的两种氧化物,F为黑色固体单质。
它们相互反应和转化关系如图所示(图中的“→”表示物质间存在转化关系,部分反应物、生成物或反应条件已略去)。
回答下列问题:(1)E的化学式为,固态D的俗称是。
(2)F的单质有多种,它们的物理性质不同的原因是。
中考二轮复习化学推断题50题专题训练(含答案)

中考二轮复习化学推断题50题专题训练(含答案)一、中考化学推断题1.A~F 是初中化学常见物质,它们之间的转化关系如下图所示(部分产物已略去)。
(1)写出 A 的化学式________,其常见用途为________(写一条)。
(2)反应①的化学方程式为________,该反应属于________(填基本反应类型)。
(3)反应②的现象为____________。
(4)反应③是________(填“放热”或“吸热”)反应。
(5)反应④是工业上生产漂白粉的原理,该反应的化学方程式为________。
【答案】CO2灭火或做气体肥料或制碳酸饮料等(合理即可) H2CO3 + Ca(OH)2 = CaCO3↓+ 2H2O 复分解反应红(棕)色粉末逐渐变成黑色粉末/ 红(棕)色粉末出现黑色物质放热 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O【解析】【分析】A能与H2O反应生成碳酸,二氧化碳与水反应生成碳酸,则A为二氧化碳;碳酸与氢氧化钙反应生成碳酸钙和水,则B为碳酸钙;碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,则C为氧化钙;二氧化碳与碳在高温条件下反应生成一氧化碳,一氧化碳与氧化铁在高温条件下反应生成铁与二氧化碳,则D为碳,E为一氧化碳,F为铁。
将猜想代入框图验证,猜想正确。
【详解】根据以上分析可知:(1)写出 A 的化学式CO2,其常见用途为灭火或做气体肥料或制碳酸饮料等;(2)反应①是碳酸与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为H2CO3 +Ca(OH)2 = CaCO3↓+ 2H2O,该反应是由两种化合物互相交换成分,生成另外两种化合物的反应,属于复分解反应;(3)反应②是一氧化碳与氧化铁在高温条件下反应生成铁与二氧化碳,反应的现象为红(棕)色粉末逐渐变成黑色粉末/ 红(棕)色粉末出现黑色物质;(4)反应③是氧化钙与水反应生成氢氧化钙,该反应是放热反应;(5)反应④是工业上生产漂白粉的原理,根据流程图可知,氢氧化钙与氯气反应生成CaCl2、Ca(ClO)2和H2O,反应的化学方程式为2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O。
中考化学推断题80题专题训练(含答案)

中考化学推断题80题专题训练(含答案)一、中考化学推断题1.有一包固体,可能是Cu(NO3)2、K2SO4、KCl、K2CO3、KOH中的一种或几种组成。
为了探究该固体的组成,某化学小组设计并开展以下实验:已知,步骤I中固体全部消失,溶液呈蓝色,无气泡产生,步骤II、III中均可观察到有白色沉淀生成。
请回答下列问题:(1)经推论,原固体中一定不含K2CO3,理由是___________________(2)原固体中一定含有的物质是________________。
(3)步骤II中产生白色沉淀的化学方程式是_______________。
(4)步骤III所得蓝色滤液中一定含有的阳离子是____________。
【答案】向固体中加入过量的稀盐酸时,无气泡产生Cu(NO3)2、K2SO4 Ba(NO3)2+ K2SO4=BaSO4↓+2KNO3 Cu2+、K+、H+【解析】本题是推断题。
首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可。
解题时注意加入试剂的量对反应后溶液成分的影响。
(1)碳酸钾与盐酸反应生成氯化钾、水和二氧化碳。
原固体中一定不含K2CO3,理由是向固体中加入过量的稀盐酸时,无气泡产生;(2)固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜,硝酸铜与氢氧化钾能发生反应不能共存,则说明一定不存在氢氧化钾,根据题(1)的分析固体中一定不含K2CO3,在步骤Ⅰ得到的蓝色溶液中加入硝酸钡溶液有白色沉淀生成,硫酸钾与硝酸钡反应生成硫酸钡沉淀和硝酸钾,说明固体中一定有硫酸钾,在步骤Ⅱ得到的蓝色溶液中加入硝酸银溶液产生白色沉淀,含氯离子的溶液与硝酸银反应生成氯化银的沉淀,由于在步骤Ⅰ中加入了盐酸,不能说明固体中一定有氯化钾,所以原固体中一定含有的物质是Cu(NO3)2、K2SO4;(3)步骤II中产生白色沉淀的反应是硫酸钾与硝酸钡反应生成硫酸钡沉淀和硝酸钾,化学方程式是Ba(NO3)2+ K2SO4=BaSO4↓+2KNO3;(4)根据题(2)中的分析可知,步骤III所得蓝色滤液中一定含有的阳离子是 Cu2+、K+、H+。
中考二轮复习化学推断题80题专题训练(含答案)

中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.已知A、B、C、D四种物质均为初中化学常见的物质,它们相互转化的关系如图所示。
请写出符合要求的化学方程式。
(1)若A与B属于同类物质,发生复分解反应,生成的C是一种常见的难溶于水的白色固体,纯净的C物质可用作补钙剂_____________。
(2)若B为稀硫酸,C为密度最小的气体,则A符合的条件是_________________。
(3)若D为水,写出一个符合条件的化学方程式:___________________。
【答案】Na2CO3+CaCl2=CaCO3↓+2NaCl金属活动性顺序表中排在氢前面的金属NaOH+HCl=NaCl+H2O(或CO2+2NaOH=Na2CO3+H2O等合理即可)【解析】【分析】A、B、C、D四种物质均为初中化学常见的物质,若A与B属于同类物质,发生复分解反应,则是盐和盐的反应,生成的C是一种常见的难溶于水的白色固体,纯净的C物质可用作补钙剂,则C为碳酸钙;若B为稀硫酸,C为密度最小的气体,则C为氢气;若D为水,则酸和碱反应生成盐和水。
【详解】(1)若A与B属于同类物质,发生复分解反应,生成的C是一种常见的难溶于水的白色固体,纯净的C物质可用作补钙剂,则C为碳酸钙,化学方程式为。
(2)若B为稀硫酸,C为密度最小的气体,则C为氢气,则A符合的条件是金属活动性顺序表中排在氢前面的金属。
(3)若D为水,则酸和碱反应生成盐和水,或者非金属氧化物和碱生成盐和水,符合条件的化学方程式为:。
【点睛】金属活动性顺序表中排在氢前面的金属和酸发生置换反应生成氢气,酸和碱反应生成盐和水,非金属氧化物和碱生成盐和水。
2.“化学扑克”牌的玩法是:上家出牌,如果下家牌中的物质能与上家的发生反应,即可出牌,按此规则,出完牌的为赢家,下图表示的是某局牌的最后一轮。
桌面上是一张图甲的“盐酸”牌,ABCD四位玩家手中都剩下一张牌(如图)。
中考二轮复习化学推断题80题专题训练(含答案)
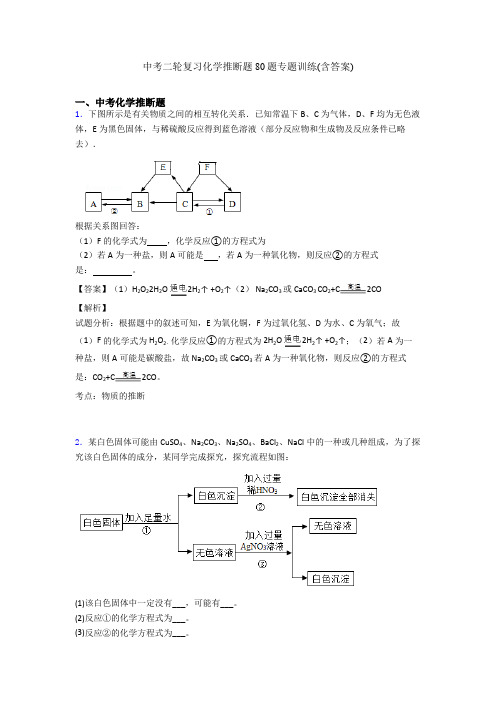
中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.下图所示是有关物质之间的相互转化关系.已知常温下B、C为气体,D、F均为无色液体,E为黑色固体,与稀硫酸反应得到蓝色溶液(部分反应物和生成物及反应条件已略去).根据关系图回答:(1)F的化学式为,化学反应①的方程式为(2)若A为一种盐,则A可能是,若A为一种氧化物,则反应②的方程式是:。
【答案】(1)H2O22H2O2H2↑ +O2↑(2) Na2CO3或CaCO3 CO2+C2CO【解析】试题分析:根据题中的叙述可知,E为氧化铜,F为过氧化氢、D为水、C为氧气;故(1)F的化学式为H2O2,化学反应①的方程式为2H2O2H2↑ +O2↑;(2)若A为一种盐,则A可能是碳酸盐,故Na2CO3或CaCO3若A为一种氧化物,则反应②的方程式是:CO2+C2CO。
考点:物质的推断2.某白色固体可能由CuSO4、Na2CO3、Na2SO4、BaCl2、NaCl中的一种或几种组成,为了探究该白色固体的成分,某同学完成探究,探究流程如图:(1)该白色固体中一定没有___,可能有___。
(2)反应①的化学方程式为___。
(3)反应②的化学方程式为___。
【答案】CuSO4、Na2SO4 NaCl BaCl2+Na2CO3=BaCO3↓+2NaCl BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑【解析】【分析】硫酸铜在溶液中显蓝色,碳酸钠和氯化钡反应生成能溶于稀硝酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于稀硝酸的硫酸钡沉淀,氯离子和银离子反应会生成不溶于稀硝酸的氯化银沉淀。
白色固体加入足量的水溶解,得到白色沉淀和无色溶液,所以样品中一定不含硫酸铜,白色沉淀加入足量的稀硝酸全部溶解,白色沉淀为碳酸钡,所以样品中一定不含硫酸钠,一定含有氯化钡和碳酸钠;无色溶液加入足量的硝酸银,会生成白色沉淀,氯化钡会引入氯离子,所以样品中可能含有氯化钠。
中考二轮复习化学推断题50题专题训练(含答案)

②取洗涤干燥后的A固体19.7g,滴加过量稀HNO3,固体全溶解,溶液变蓝且有气体产生,将气体通入足量的石灰水中,得到10.0g固体。③向无色滤液B中通入CO2,产生白色沉淀。试根据上述现象回答下列问题:
(1)沉淀中滴加稀HNO3,溶液变蓝的化学方程式是_______。
【答案】置换反应CuO+2HCl=CuCl2+H2OCaCO3+2HCl=CaCl2+H2O+CO2↑(或CaCO3 CaO+CO2↑)
【解析】
【分析】
根据A~E是初中化学常见的物质,A、D均是氧化物且反应①有红色物质生成,C是胃液的主要成分,B是密度最小的气体,E可用作补钙剂,所以C是盐酸,B是氢气,E是碳酸钙,碳酸钙和D可以相互转化,所以D是二氧化碳,氢气会与A反应,A会转化成二氧化碳,所以A是氧化铜。
①C的化学式为_____。
②B与D反应的化学方程式为_____;其反应类型_____。
③F转化为E的化学方程式为_____。
【答案】CuSO4Fe2O3+6HCl=2FeCl3+3H2O复分解反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【解析】
【分析】
根据A~F均为初中化学常见的物质,A是目前世界上年产量最高的金属,所以A是铁,B是A的最高价金属氧化物,所以B是氧化铁,D是胃酸的主要成分,所以D是盐酸,C中金属元素的质量分数为40%,其水溶液呈蓝色,常用来配制农药波尔多液,硫酸铜中铜的质量分数为40%,其水溶液呈蓝色,常用来配制农药波尔多液,所以C是硫酸铜,E属于碱,F属于盐,E会与硫酸铜反应,和F会相互转化,氢氧化钠能与硫酸铜反应生成硫酸钠和氢氧化铜,氢氧化钠与二氧化碳反应生成碳酸钠和水,碳酸钠与氢氧化钙反应生成氢氧化钠和碳酸钙,所以E是氢氧化钠,F是碳酸钠,将猜想代入框图进行验证,猜想正确。
大庆中考二轮复习化学推断题80题专题训练(含答案)

大庆中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.甲、乙两物质可相互转化:“甲−−→←−−乙”(“→”表示一步进行转化)。
(1)若甲乙都属于同类别物质①若甲乙均为氧化物,乙为一氧化碳,则甲为______写化学式,下同)。
②若甲乙均为单质,写出甲和乙的一种组合:甲 ______、乙 ______ 。
(2)若甲乙属于不同类别的含钠化合物,甲的相对分子质量小于乙,则“乙→甲”的化学方程式为______。
【答案】CO2 Fe H2 Na2CO3+Ba(OH)2= BaCO3↓+2NaOH [或Na2CO3+Ca(OH)2=CaCO3↓+2NaOH][或Na2SO4+Ba(OH)2= BaSO4↓+2NaOH 或2NaCl+2H2O 通电2NaOH+H2↑+Cl2↑]【解析】【详解】(1)若甲乙都属于同类别物质①若甲、乙均为氧化物,乙为一氧化碳,一氧化碳在氧气中燃烧生成二氧化碳,二氧化碳与碳在高温条件下反应生成一氧化碳,则甲为二氧化碳,化学式为:CO2;②若甲、乙均为单质,铁能与酸反应生成氢气,氢气具有还原性,能与氧化铁反应生成铁,甲和乙的一种组合:甲是铁,化学式为Fe;乙是氢气,化学式为H2;(2)若甲、乙属于不同类别的含钠化合物,氢氧化钠与二氧化碳反应生成碳酸钠,碳酸钠与氢氧化钙(或氢氧化钡)反应生成氢氧化钠和碳酸钙(或碳酸钡),碳酸钠能与氢氧化钠相互转化,氢氧化钠的相对分子质量小于碳酸钠的相对分子质量,所以乙是碳酸钠,甲是氢氧化钠,则“乙→甲”的化学方程式为Na2CO3+Ba(OH)2= BaCO3↓+2NaOH [或Na2CO3+Ca(OH)2= CaCO3↓+2NaOH];或者:若甲、乙属于不同类别的含钠化合物,氢氧化钠与硫酸应生成硫酸钠和水,硫酸钠与氢氧氢氧化钡反应生成氢氧化钠和碳酸钡,硫酸钠能与氢氧化钠相互转化,氢氧化钠的相对分子质量小于硫酸钠的相对分子质量,所以乙是硫酸钠,甲是氢氧化钠,则“乙→甲”的化学方程式为Na2SO4+Ba(OH)2= BaSO4↓+2NaOH;或者:若甲、乙属于不同类别的含钠化合物,氢氧化钠与盐酸反应生成氯化钠,电解氯化钠的水溶液生成氢氧化钠、氢气和氯气,氯化钠能与氢氧化钠相互转化,氢氧化钠的相对分子质量小于氯化钠的相对分子质量,所以乙是氯化钠,甲是氢氧化钠,则“乙→甲”的化学方程式为:2NaCl+2H2O 通电2NaOH+H2↑+Cl2↑。
大庆中考二轮复习化学推断题80题专题训练(含答案)

大庆中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.如图中的物质均为初中化学常见的物质。
其中甲、乙、丙、丁、戊均为单质,丙是空气中含量最多的气体。
常温下,丁为黑色固体,戊为紫红色金属;G是一种具有刺激性气味的气体,其水溶液呈碱性,工业上用甲和丙化合制备G;农业上常用F改良酸性土壤(如图中部分反应条件已省略)。
回答下列问题:(1)D为_____;G为_____。
(2)工业上用甲和丙化合制备G,反应中甲与丙的分子个数比为_____,在电解A实验中,_____极产生物质乙。
(3)H和E反应生成C和戊的化学方程式为_____。
(4)工业上可以用甲和四氯化硅在高温条件下发生置换反应来制取硅单质。
此反应的化学方程式为_____。
【答案】氧化钙氨气 3:1 正极 CuO+CO 加热Cu+CO2 SiCl4+2H2高温Si+4HCl【解析】【分析】由图可知,A是水,通电时生成氢气甲和氧气乙,氢气和空气中含量最多的氮气在一定条件下反应生成氨气G,熟石灰F和硫酸铵在加热条件下反应能生成氨气;B是碳酸钙,在高温条件下分解生成二氧化碳C和氧化钙D,氧化钙和水反应生成氢氧化钙F;二氧化碳C 和木炭丁在高温条件下反应生成一氧化碳E,氧气和铜戊在加热条件下反应生成氧化铜H,氧化铜和一氧化碳在加热条件下反应生成铜和二氧化碳;氢气和四氯化硅在高温条件下发生置换反应生成硅单质和氯化氢气体。
【详解】(1)由分析可知, D为氧化钙,故填氧化钙;G为氨气,故填氨气。
(2)由分析可知,甲为氢气,丙为氮气,氢气和氮气在高温高压、催化剂存在条件下反应生成氨气,反应的化学方程式为:N2+3H2催化剂高温高压2NH3,由化学方程式可知,反应中甲与丙的分子个数比为3:1,故填3:1;由分析可知,乙为氧气,电解水时,正极产生氧气,故填正极。
(3)由分析可知,H为氧化铜,E为一氧化碳,氧化铜和一氧化碳在加热条件下反应生成铜和二氧化碳,故反应的的化学方程式写为:CuO+COΔCu+CO2。
中考二轮复习化学推断题80题专题训练(含答案)

中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.A ﹣G 是初中化学中常见的物质,其相互反应及转化关系如图所示,部分反应条件省略.已知A 是易与人体血红蛋白结合的有毒气体,B 是赤铁矿的主要成分,C 是相对分子质量最小的氧化物,F 是最轻的气体.(1)G 的化学式为___________。
(2)写出相应反应的化学方程式:①____________。
②____________。
(3)反应③的实验现象是____________。
【答案】Fe 3O 42323CO+Fe O 2Fe+3CO 高温 2222H O 2H +O ↑↑通电 火星四射,剧烈燃烧,生成黑色固体【解析】【详解】 (1)A ﹣G 是初中化学中常见的物质,A 是易与人体血红蛋白结合的有毒气体,所以A 是一氧化碳,B 是赤铁矿的主要成分,所以B 是氧化铁,C 是相对分子质量最小的氧化物,所以C 是水,F 是最轻的气体,所以F 是氢气,氧化铁和一氧化碳反应会生成铁和二氧化碳,水分解生成氢气和氧气,所以E 是氧气,D 会与氧气反应生成G ,所以D 是铁,G 是四氧化三铁,经过验证,推导正确,所以G 是Fe 3O 4;(2)反应①是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:2323CO+Fe O 2Fe+3CO 高温;反应②是水在通电的条件下生成氢气和氧气,化学方程式为:2222H O 2H +O ↑↑通电;(3)反应③是铁和氧气在点燃的条件下生成四氧化三铁,实验现象是:火星四射,剧烈燃烧,生成黑色固体。
2.甲、乙、丙三种物质均含有氧元素.甲、乙是组成元素完全相同的化合物,丙是单质;乙通常为液体,在一定条件下可分解成丙;它们之间有如图所示的转化关系.则:甲的化学式为_____;乙分解生成丙的化学方程式为_____.从微观的角度解释甲、乙性质有差异的原因是_____.【答案】H 202 22H O 通电 22H ↑+ 2O ↑ 两种物质的分子结构不同【解析】甲、乙、丙三种物质均含地壳中含量最多的元素,所以均含氧元素,甲、乙是组成元素完全相同的化合物,丙是单质,所以丙是氧气,乙通常为液体,在一定条件下可分解生成丙,甲会分解生成氧气和乙,所以甲是过氧化氢溶液,乙是水,经过验证,推导正确,所以甲分解生成乙的反应是过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H 2O 通电 2H 2↑+O 2↑,水和过氧化氢化学性质不同的原因是分子的构成不同。
大庆中考二轮复习化学推断题80题专题训练(含答案)

(1)E的化学式为_____.
(2)C的用途之一为_____.
(3)①②③三个反应的基本反应类型都可能为_____.
(4)A→E反应的化学方程式为_____.
【答案】CaCO3冶炼金属化合反应CO2+Ca(OH)2===CaCO3↓+H2O
【解析】
【详解】
(1)根据题目给出的流程图和信息:A~E是初中化学常见的物质,E是大理石的主要成分,D是能供给呼吸的气体单质,因此D是氧气,E是碳酸钙;故E化学式为:CaCO3;
(1)请利用编号①﹣⑧位置上的物质,按照规则把缺失的通关密码依次补全:
①
③
___
___
___
___
⑧
线索Ⅱ:(2)写出①和⑧两种物质参加的两个化学方程式:___;___。
线索Ⅲ:(3)选择一组物质,写出纯碱制烧碱的化学方程式:___;写一个中和反应的化学方程式:___;(写一个即可)。祝贺你完成以上任务,获得开启第一间密室的钥匙。
【详解】
(1)生成无色气体的是碳酸钙和稀盐酸,化学反应方程式CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)在上述实验基础上,补充恰当的实验,就是要进一步确定含有氯化钡还是硫酸钠。具体操作是向无色溶液b中加入氯化钡溶液,出现白色沉淀说明固体粉末中有硫酸钠没有氯化钡,没有明显现象,说明有氯化钡没有硫酸钠。
【详解】
(1)由分析知,气体B为二氧化碳,化学式为:CO2;沉淀G为氢氧化镁,化学式为:Mg(OH)2;
(2)碳酸钠与硫酸反应生成硫酸钠、水、二氧化碳;硫酸和氯化钡反应生成氯化氢,又和氢氧化钠反应生成氯化钠和水,氯化镁与氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,硫酸镁和氢氧化钠反应生成硫酸钠和氢氧化镁沉淀,故滤液F中的溶质为硫酸钠、氯化钠(或Na2SO4、NaCl);
中考二轮复习化学推断题50题专题训练(含答案)

中考二轮复习化学推断题50题专题训练(含答案)一、中考化学推断题1.A~E均为初中化学常见的物质,它们之间的关系如图所示(部分物质已经略去)。
已知A 是目前世界上年产量最高的金属;B是胃酸的主要成分;C中金属元素的质量分数为40%,其水溶液呈蓝色,常用来配制农药波尔多液;D属于碱;E属于盐。
则C的化学式为__________;A与B反应的化学方程式为__________;E转化为D的化学方程式为__________。
【答案】CuSO4 Fe+2HCl=FeCl2+H2↑ Na2CO3+Ca(OH)2=2NaOH+CaCO3↓【解析】A是目前世界上年产量最高的金属,则A是铁;B是胃酸的主要成分,则B是盐酸;C中金属元素的质量分数为40%,其水溶液呈蓝色,常用来配制农药波尔多液,则C是硫酸铜;D属于碱,E属于盐,且E、D能与HCl反应,D能与CuSO4反应,并且常见,则D 可能是NaOH,E可能是Na2CO3。
C的化学式为CuSO4;A与B的反应是铁与盐酸反应,反应的化学方程式为Fe+2HCl=FeCl2+H2↑;E转化为D是碳酸钠转化为氢氧化钠,反应的化学方程式为Na2CO3+Ca(OH)2=2NaOH+CaCO3↓。
点睛:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
2.某白色固体可能由CuSO4、Na2CO3、Na2SO4、BaCl2、NaCl中的一种或几种组成,为了探究该白色固体的成分,某同学完成探究,探究流程如图:(1)该白色固体中一定没有___,可能有___。
(2)反应①的化学方程式为___。
(3)反应②的化学方程式为___。
【答案】CuSO 4、Na 2SO 4 NaCl BaCl 2+Na 2CO 3=BaCO 3↓+2NaCl BaCO 3+2HNO 3=Ba(NO 3)2+H 2O+CO 2↑【解析】【分析】硫酸铜在溶液中显蓝色,碳酸钠和氯化钡反应生成能溶于稀硝酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于稀硝酸的硫酸钡沉淀,氯离子和银离子反应会生成不溶于稀硝酸的氯化银沉淀。
大庆中考二轮复习化学推断题80题专题训练(含答案)

大庆中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.A-H表示初中化学常见物质,它们之间转化关系如图所示(部分生成物已略去)其中A为红棕色固体,反应①为冶金工业的重要反应,且B、D组成元素相同,C、F为金属单质,其它物质为化合物,其中F为紫红色,H为白色沉淀。
请按要求填空:(1)写出下列物质的化学式:A________D________E________(2)①~④的反应中属于置换反应的是________(填序号)。
(3)反应①的化学方程式为___________。
【答案】Fe2O3 CO2 CuSO4②③ 3CO+Fe2O3高温2Fe+3CO2【解析】【分析】A~H表示初中化学常见物质,A为红棕色固体,反应①为冶金工业的重要反应,且B、D 组成元素相同,所以A是氧化铁,B是一氧化碳,D是二氧化碳,C是铁,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,H为白色沉淀,所以H是碳酸钙,C、F为金属单质,其它物质为化合物,F为紫红色,所以F是铜,铁和稀硫酸反应生成硫酸亚铁和氢气,所以G是硫酸亚铁,E和铁反应会生成硫酸亚铁和铜,所以E是硫酸铜,经过验证,推导正确,【详解】(1)所以A是Fe2O3,D是CO2,E是CuSO4;(2)①是一氧化碳和氧化铁高温生成铁和二氧化碳,不属于置换反应,②是铁和硫酸铜反应生成硫酸亚铁和铜,属于置换反应,③是铁和稀硫酸反应生成硫酸亚铁和氢气,属于置换反应,④是二氧化碳和氢氧化钙生成碳酸钙沉淀和水,不属于置换反应,所以①~④的反应中属于置换反应的是②③;(3)反应①是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O3高温2Fe+3CO2。
2.下图为A~G(初中常见物质)的转化关系,其中A 是天然气的主要成分。
根据以上信息回答下列问题:(1)写出A 的常见用途为____(任写一条)。
(2)反应①的现象为______。
(3)写出反应③的化学方程式_____。
大庆中考二轮复习化学推断题80题专题训练(含答案)

大庆中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.实验室有溶液样品M ,其中可能含有43NH NO 、3NaNO 、2BaCl 、2MgCl 、24Na SO 五种物质中的一种或几种。
为确定样品M 的成分,设计并完成了如下图所示的实验(假设除标有“过量”外,均恰好完全反应)。
(1)气体B 为______(填化学式,下同)。
(2)溶液D 中一定含有的阳离子为______。
(3)该溶液样品M 中一定含有的物质为______。
【答案】3NH H +、Na +、2Ba + 43NH NO 、2MgCl 、24Na SO【解析】【分析】向样品中加过量的氢氧化钡生成刺激性气味的气体B ,可知样品中一定有硝酸铵,B 是氨气;氢氧化钡与氯化镁反应生成可溶于硝酸的氢氧化镁沉淀,硫酸钠与氢氧化钡反应生成难溶于硝酸的硫酸钡沉淀,固体C 中加稀硝酸部分溶解,说明固体C 中有硫酸钠和氢氧化镁;溶液D 中加硝酸银产生白色沉淀E ,说明E 是氯化银,溶液D 中一定有氯离子。
【详解】(1)根据分析知,气体B 为NH 3。
(2)样品M 中有硫酸钠,加入的氢氧化钡和稀硝酸都过量,故溶液D 中一定有H +、Na +、2Ba +。
(3)该溶液样品M 中一定含有的物质为43NH NO 、2MgCl 、24Na SO 。
2.A ~G 是初中化学常见的物质,A 和C 在常温下均为无色液体,且组成元素相同;D 是天然气的主要成分;E 与F 含有相同的两种元素,且F 是有毒气体。
它们的转化关系如图,根据图示回答下列问题。
(1)A的化学式为_____;(2)反应②的化学方程式为_____;(3)反应③属于基本反应类型中的_____反应;(4)列举一项固态E在实际生活中的用途_____。
H O CH4+2O2 CO2+2H2O 化合人工降雨【答案】22【解析】【分析】~是初中化学常见的物质,A和C在常温下均为无色液体,且组成元素相同,由A与A GC的关系可知,A是过氧化氢,C是水,B是氧气;D是天然气的主要成分,D是甲烷;E 与F含有相同的两种元素,且F是有毒气体,F是一氧化碳,E是二氧化碳,G是碳酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大庆中考二轮复习化学推断题80题专题训练(含答案)一、中考化学推断题1.现有一固体混合物A的成分,已知其中可能含有NH4C1、Na2SO4、CuCl2、NaCl、AgCl几种物质中的两种或多种。
按如图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应均恰好完全反应)。
试根据实验过程和发生的现象填写以下空白(均填写相应的化学符号):(1)混合物A中,一定不存在的物质是_____,可能存在的物质是_____(2)气体B是_____,现象X为_____(3)滤液C中,存在的金属阳离子是_____(4)滤渣D是_____。
(5)写出实验过程③中发生的化学反应的化学方程式_____。
【答案】AgCl NaCl NH3酚酞试液变红色Na+Cu(OH)2BaCl2+Na2SO4=BaSO4↓+2NaCl 【解析】【分析】此题属于叙述实验型框图推断题,解题时,要紧跟实验步骤,抓住特征现象,比如:特征颜色、特征离子的检验等。
在固体A中加入NaOH溶液,产生一种气体,将气体通入酚酞溶液中,有现象,结合白色固体中的物质成分,可判断含有NH4C1,气体B为氨气,在滤液C中加入BaCl2溶液,产生白色沉淀,可以判断原白色固体中一定含有Na2SO4,在滤渣D 中加入稀硫酸,得到蓝色溶液,说明原白色固体中含有CuCl2。
【详解】(1)因为AgCl沉淀,且不溶于稀硫酸,所以混合物A中,一定不存在的物质是AgCl,可能存在的物质是:NaCl;(2)经上面的分析,气体B是NH3,氨气溶于水形成氨水,呈碱性,所以现象X是:酚酞试液变红色;(3)滤液C中,存在的金属阳离子是Na+;(4)滤渣D是CuCl2与NaOH相互反应的生成物,是Cu(OH)2;(5)实验过程③中发生的化学反应的化学方程式是;BaCl2+Na2SO4=BaSO4↓+2NaCl。
2.甲、乙、丙三种物质均含有氧元素.甲、乙是组成元素完全相同的化合物,丙是单质;乙通常为液体,在一定条件下可分解成丙;它们之间有如图所示的转化关系.则:甲的化学式为_____;乙分解生成丙的化学方程式为_____.从微观的角度解释甲、乙性质有差异的原因是_____.【答案】H 202 22H O 通电 22H ↑+ 2O ↑ 两种物质的分子结构不同【解析】甲、乙、丙三种物质均含地壳中含量最多的元素,所以均含氧元素,甲、乙是组成元素完全相同的化合物,丙是单质,所以丙是氧气,乙通常为液体,在一定条件下可分解生成丙,甲会分解生成氧气和乙,所以甲是过氧化氢溶液,乙是水,经过验证,推导正确,所以甲分解生成乙的反应是过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H 2O 通电 2H 2↑+O 2↑,水和过氧化氢化学性质不同的原因是分子的构成不同。
3.A ∼E 是初中化学常见的五种不同类别的物质,C 常用作建筑材料,E 常用作食品干燥剂。
他们之间的关系如图所示,“−”表示相连的物质能发生反应,“→”表示一种物质能生成另一种物质(部分反应物、生成物和反应条件已略去).请回答下列问题:(1)E 的化学式是_____。
(2)D 转化为C 的化学方程式_____,反应现象是_____。
(3)A 与B 反应的化学方程式_____,其基本反应类型为_____。
【答案】CaO 2232CO +Ca(OH)=CaCO +H O ↓ 出现白色沉淀22Fe+2HCl=FeCl +H ↑ 置换反应【解析】【分析】A ∼E 是初中化学常见的五种不同类别的物质,C 常用作建筑材料,则C 为碳酸钙,属于盐,E 常用作食品干燥剂,则E 是氧化钙,属于氧化物,E 能生成D ,D 能生成C ,则D 是氢氧化钙,属于碱,B 能和D 、C 反应,则B 是酸,则B 是盐酸,A 和B 反应,则A 是金属单质。
【详解】(1)E 常用作食品干燥剂,则E 是氧化钙,故E 的化学式是CaO 。
(2)C 常用作建筑材料,则C 为碳酸钙,E 能生成D ,D 能生成C ,则D 是氢氧化钙,D转化为C 的反应是氢氧化钙和二氧化碳反应生成碳酸钙和水,化学方程式为2232CO +Ca(OH)=CaCO +H O ↓,反应现象是出现白色沉淀。
(3)B 能和D 、C 反应,则B 是酸,则B 是盐酸,A 和B 反应,则A 是金属单质,A 可以是铁,故A 与B 反应的化学方程式22Fe+2HCl=FeCl +H ↑,反应符合一种单质和一种化合物生成另一种单质和另一种化合物的反应,故基本反应类型为置换反应。
【点睛】C 常用作建筑材料,则C 为碳酸钙, E 常用作食品干燥剂,则E 是氧化钙, E 能生成D ,D 能生成C ,则D 是氢氧化钙。
4.构建知识网络是一种重要的学习方法.如图是关于氧化铜化学性质的知识网络图(“_”表示一种物质能转化为另一种物质,“→”表示两种物质问能发生化学反应),其中A 是密度最小的气体,c 为红色固体单质.请回答下列问题.(1)A 物质的化学式为_____.(2)C 物质的一种用途是_____.(3)如果过程②所加的试剂为稀硫酸,反应过程的现象是_____.(4)写出反应③的化学方程式_____,并注明基本反应类型_____.【答案】H 2 做导线 黑色粉末逐渐消失,溶液由无色变为蓝色 C+2CuO高温2Cu+CO 2↑ 置换反应【解析】【详解】(1)密度最小的气体是氢气,氢气的化学式是H 2,故答案为:H 2;(2)红色固体单质为铜,物质的性质决定物质的用途,铜具有优良的导电性,可用来做导线,故答案为:做导线;(3)反应②为氧化铜和硫酸反应生成硫酸铜和水,现象是:黑色粉末逐渐消失,溶液由无色变为蓝色,故答案为:黑色粉末逐渐消失,溶液由无色变为蓝色;(4)氧化铜要转化为铜,一般要使用还原剂碳或氢气,碳和氧化铜高温生成铜和二氧化碳;反应物是一种单质和一种化合物,生成物也是一种单质和化合物,属于置换反应,故答案为:C+2CuO高温2Cu+CO 2↑;置换反应。
【点睛】在学习中要求学生要熟记一些物质的性质,并能根据性质判断属于哪种物质.如根据密度最小判断是氢气,根据红色金属单质判断是铜。
5.酸、碱、盐在生产、生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、酚酞、碳酸钠、硝酸钡等五瓶无色溶液,现将其任意编号:A B C D E 、、、、,然后两两组合进行实验,其部分现象如下表:①写出溶液B C 、中溶质的化学式:B _____,C _____。
②写出溶液D 与C 反应的化学方程式_____。
(2)将氯化钠和氯化钙的混合物22.8g 溶于水,再加入100g 溶质质量分数为10.6%的碳酸钠溶液,恰好完全反应,则该混合物中氯元素的质量分数为_____(结果精确到0.1%)。
【答案】24H SO ()32Ba NO ()233332Na CO Ba NO BaCO 2NaNO +↓+ 62.3%【解析】【分析】物质中两两混合能产生气体的两种物质为稀硫酸和碳酸钠,则B 、D 分别为稀硫酸和碳酸钠中的一种,物质中两两混合,溶液变红的有氢氧化钠+酚酞、碳酸钠+酚酞,应为D+E 溶液变红,所以D 为碳酸钠,E 为酚酞,B 为稀硫酸,D+C 产生沉淀,所以C 为硝酸钡,A 为氢氧化钠。
【详解】(1)根据上述分析,B 的化学式为H 2SO 4,C 的化学式为Ba(NO 3)2;D 为碳酸钠,C 为硝酸钡,D 与C 反应生成碳酸钡沉淀和硝酸钠,方程式为:()233332Na CO Ba NO BaCO 2NaNO +↓+ (2)氯化钠与碳酸钠不反应,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,设氯化钙的质量为x , 2233CaCl +Na CO =CaCO +2NaCl111106x100g 10.6%↓⨯111x =10610010.6%g ⨯x=11.1g所以固体中氯化钠的质量为22.8g-11.1g=11.7g氯化钙中氯元素的质量为71111×100%×11.1g=7.1g,氯化钠中氯元素的质量为35.558.5×100%×11.7g=7.1g,所以固体中氯元素的质量为7.1g+7.1g=14.2g固体中氯元素的质量分数为14.222.8gg×100%≈62.3%。
6.甲、乙、丙是仅由碳、氧两种元素组成的单质或化合物,其中丁由钙、氧和碳三种元素组成。
它们之间的转化关系如图所示(图中部分反应物、生成物及反应条件已略去)。
(1)写出下列物质的化学式:甲______、丙______。
(2)实验室制取甲的化学方程式______。
(3)写出甲与澄清石灰水发生反应的化学方程式______。
(4)由甲转化为丙的化学方程式______。
【答案】CO2 CO CaCO3+2HCl=CaCl2+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2OCO2+C 高温2CO【解析】【分析】根据题干提供的信息进行分析解答,甲、乙、丙是仅由碳、氧两种元素组成的单质或化合物,丁由Ca、O和C三种元素组成,故丁是碳酸钙,碳酸钙能高温分解生成氧化钙和二氧化碳,故甲是二氧化碳,由于甲能与丙相互转化,乙能生成二氧化碳和丙,故乙可能是氧气,也可能是炭,丙可能是一氧化碳;若甲中不含碳元素,则甲可能是碳酸钙与酸反应生成的水,根据过氧化氢能分解生成水和氧气,氧气能与水相互转化即可完成解答。
【详解】由分析可知:(1)甲的化学式为CO2,丙的化学式为CO;(2)实验室通过碳酸钙和稀盐酸反应制取二氧化碳,其反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)二氧化碳和澄清石灰水可反应生成碳酸钙和水,反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;(4)二氧化碳和碳反应可生成一氧化碳,反应的化学方程式为CO 2+C 高温2CO 。
7.有一包固体粉末,由2CuCl 、3CaCO 、24Na SO 、2BaCl 和NaOH 中的三种物质组成。
为确定其成分,进行如下实验:(1)写出生成无色气体的化学反应方程式________________;(2)在上述实验基础上,补充恰当的实验,即可确定这包固体粉末的成分。
需要充实验的具体操作是________________________。
(3)请设计实验验证加入的NaOH 恰好适量,写出具体的操作步骤和依据的现象________________。
【答案】CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 向无色溶液b 中加入氯化钡溶液,出现白色沉淀说明固体粉末中有硫酸钠没有氯化钡,没有明显现象,说明有氯化钡没有硫酸钠。
向蓝色溶液中滴加氢氧化钠,至刚好不在产生蓝色沉淀。
