【江苏】2014版化学《高考专题辅导》课件:专题三 第2讲 金属元素单质及其重要化合物
高中化学高考化学第二轮专题复习 金属及其化合物ppt实用资料

钠 、镁、铝、 铁分别与空气或 氧气的反应(现象和反应方程式)
知识清单
一、金属的化学性质
5、金属与水的反应:(现象与反应式)
(1)钠与水的反应:
离子方程式:2Na+2H2O=2Na++2OH-+H。2↑
(2)铁与水蒸气的反应: 反应式:3Fe+4H2O 高温 Fe3O4+4H2 。
离子方程式: Fe2++2OH-=Fe(OH)2↓ ;
离子方程式:Fe3++3OH-=Fe(OH)3↓ ; 总方程式:4Fe(OH)2+O2+2H2O=4Fe(OH;)3
二、几种重要的金属化合物
2、金属的氢氧化物
(1)铁的氢氧化物
②与酸的反应——生成盐和水;
Fe(OH)2+ 2 HCl = FeCl2+2H2O
④铁的不同价态物质间的转化
三价铁离子的检验: 离子方程式: Fe3++3SCN-=Fe(SCN)3 ;
二价铁离子的检验:(转化为Fe3+再检验) 离子方程式: Fe2+ + Cl2 = Fe3++2Cl- ;
在一定条件下Fe、Fe2+、Fe3+之间 会相互转化。
二、几种重要的金属化合物 2、金属的氢氧化物
1、金属基础知识:
况吗?
人类最早发现和使用的金属是铜 ,
应用最广泛的金属是 铁 ,地壳中含量
最多的三种金属,按含量由大到小的 顺序排列分别是: 铝、铁、钙 。
2、金属原子的最外层电子数一般少于 4个,因此在化学反应中容易失去 电子 而成为金属离子 。
知识清单
高考化学一轮复习专题三3.11金属及其化合物课件苏教版

3
④与盐溶液反应的离子方程式 a.与硝酸银溶液:Cu+2Ag+===2Ag+Cu2+; b.与FeCl3溶液:Cu+2Fe3+===2Fe2++Cu2+。
2.氧化铜和氧化亚铜 名称 颜色 与酸反 应(H+) 与 H2 反应 转化关系 氧化铜 黑色 CuO+2H ===Cu2++H2O △ H2+CuO===== Cu+H2O
考点
铜及其化合物
1.单质铜 (1)物理性质:紫红色固体,具有良好的延展性、导热性 和导电性。 (2)化学性质 ①铜生锈的化学方程式: 2Cu+O2+CO2+H2O===Cu2(OH)2CO3。
△ ②与单质硫的化学方程式:2Cu+S=====Cu2S。 ③与氧化性酸反应 △ a.与浓硫酸共热的化学方程式:Cu+2H2SO4(浓) ===== CuSO4+SO2↑+2H2O; b.与稀硝酸反应的离子方程式:3Cu+8H++2NO ===3失去生理活性,因此人们利用 了它的这一性质用胆矾、熟石灰、水配成了波尔多液,用来杀 灭植物的病毒。
5.从自然界获取铜 铜在自然界中主要以化合态存在,常见的铜矿有黄铜矿 (CuFeS2),孔雀石[CuCO3、Cu(OH)2]。 工业上主要采用高温冶炼黄铜矿的方法获得铜。用这种方 法冶炼得到的铜,含铜量为 99.5%~99.7%,还含有 Ag、Au、 Fe、Zn 等杂质。要达到电气工业生产用铜的要求,这种由黄铜 矿高温冶炼得到的铜还必须经过电解精炼, 电解精炼得到的铜, 含铜量高达 99.95%~99.98%。
4.铜盐 (1)Cu2(OH)2CO3的名称为碱式碳酸铜,是铜绿、孔雀石 的主要成分,受热分解可生成黑色的氧化铜,化学方程式: △ Cu2(OH)2CO3 ===== 2CuO+CO2↑+H2O,可溶于稀硫酸,离 子方程式:Cu2(OH)2CO3+4H ===2Cu2 +CO2↑+3H2O。
高三化学金属元素及其化合物苏教版知识精讲

高三化学金属元素及其化合物苏教版【本讲教育信息】一、教学内容:金属元素及其化合物二、教学目标以典型的金属—ⅠA和ⅡA族元素中的钠、镁为例,从其原子的核外电子排布入手,理解ⅠA和ⅡA族(单质、化合物)的相似性和递变性。
了解典型金属(钠、镁、铝、铁和铜)的物理性质和化学性质。
综合运用一些重要化合物的性质进行解题重点掌握Na2O、Na2O2;铝、氧化铝、氢氧化铝的两性、Al3+、AlO2-、Al(OH)3和Fe、Fe2+、Fe3+的三角相互转变三、教学重点、难点Na2O、Na2O2的性质;铝、氧化铝、氢氧化铝的两性、Al3+、AlO2-、Al(OH)3和Fe、Fe2+、Fe3+的三角相互转变四、教学过程:(一)金属元素概述:1、金属在元素周期表中的位置及结构特点:金属元素分布在周期表的左下部,金属元素原子最外层电子数比同周期非金属元素原子最外层电子数少,一般小于4(Ge、Sn、Pb=4,Sb、Bi=5,Po=6)。
金属元素原子半径比同周期非金属原子半径大。
金属原子的结构特点决定了金属原子易失去电子显强还原性。
金属元素形成的金属单质固态时全是金属晶体。
2、金属的物理性质:通性:(1)状态:通常情况下,除汞外其他金属都是固态。
(2)金属光泽:多数金属具有光泽,但除Mg、Al、Cu、Au在粉末状态有光泽外,其他金属在块状时才表现出来。
(3)易导电、导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
(4)延展性。
(5)熔点及硬度:由金属晶体中金属离子跟自由电子间的作用强弱决定。
特性(1)颜色:绝大多数金属都是银白色,有少数金属具有颜色,例如:Au为金黄色,Cu为紫红色,Cs为银白略带金色。
(2)密度:与原子半径、相对原子质量、晶体质点排列的紧密程度有关。
最重的金属为锇(Os 22.57g·cm-3)、铂(Pt 21.45g·cm-3),最轻的金属是锂(Li 0.534g·cm-3)(3)熔点:最高的金属是钨(W 3413℃),最低的为汞(Hg -39℃)。
高考化学一轮复习 专题3第2单元 铁、铜的获取及应用课件 苏教版

从矿物到基础材料
第二单元
铁、铜的获取及应用
2013高考导航
考纲要求 1.了解铁的主要 性质及其应用。 2.了解铁的重要 化合物的主要性 质及其应用。 3.了解铜及其重 要化合物的主要 性质及其应用。 命题热点 预计2013年高考将会以铁及铁的化 合物为载体,对基本概念、基本理 论进行考查,以选择题、推断题及 计算题题型为主,也可能涉及与现 代科技有关的应用问题、与社会生 产生活紧密相连的问题,如铁的腐 蚀、饮用水的净化等,二价铁与血 红蛋白作用、氯化铁腐蚀印刷电路 板等,与生物、物理学科的相关渗 透,也是高考的热点之一。
Fe+2Fe3+===3Fe2+ ________________________________ 。
思考感悟 铁的化学性质活泼,为什么可以用铁罐贮存和运 输浓H2SO4和浓HNO3?
【提示】
常温下,铁遇浓H2SO4、浓HNO3发生
钝化,在铁表面形成一层致密的氧化膜,阻止内
部的金属继续与酸反应,因而常温下可用铁罐来
中加入氧化剂(如H2O2),使Fe2+被氧化 为Fe3+,然后加碱或盐调节pH,使Fe3
+转化为Fe(OH) 3沉淀除去。
即时应用
1.某厂的酸性工业废水中含有一定量的 Fe3+、Cu2+、Au3+等离子。有人设计了 图中的工艺流程,利用常用的酸、碱和工 业生产中的废铁屑,从废水中回收金,并
生产一定量的铁红和氧化铜。
- CO2 3 等相互促进水解而不能大量共存。
2+
3+
-
-
②Fe 与 NO3 (H )、 ClO 、 MnO4 (H ),
- Fe3+与 S2-、I-、HS-、SO2 3 在溶液中因
2+
-
+
【优化探究】高考化学(苏教版)一轮复习配套课件2-3铁、铜的获取及应用

+14H2O。(√)
4 . FeCl3 溶液中滴入 KSCN : Fe3 + + 3SCN - ===Fe(SCN)3↓( 血红 色 )。 (× )
5.铜锈的成分为CuO,可用盐酸清洗除去。(×)
6.Fe(OH)3、FeCl2、Cu2(OH)2CO3、Cu(OH)2均可由化合反应生 成。(×)
“铁三角”及其重要应用
[解析 ] 解答本题的关键是熟悉铁的不同价态离子的溶液的颜色 及其转化条件,从框图可知,铁和稀盐酸反应生成FeCl2溶液,为浅绿 色,即 D 的主要成分为 FeCl2 ,加入试剂 2 后变为淡黄色溶液,联想最 终变为深红色溶液 F( 硫氰化铁溶液 ) ,可以推断溶液 E 的主要成分为 Fe3 + ,试剂 2 为强氧化剂, S 不符合条件。铁和水蒸气反应生成固体 Fe3O4 , Fe3O4 与盐酸反应的方程式为 Fe3O4 + 8HCl===2FeCl3 + FeCl2 +4H2O,所以溶液B为FeCl3和FeCl2的混合溶液,加入试剂1(KSCN溶 液 ) 后, Fe3 + 变为硫氰化铁,加入试剂 2( 强氧化剂 ) , Fe2 + 被氧化为 Fe3+,并进一步转化为硫氰化铁所以溶液颜色加深。
第三单元
[考纲展示]
铁、铜的获取及应用
3.掌握铁、铜冶练的化学原理。
1.了解铁、铜的主要性质及应用。 2.了解铁、
铜的重要化合物的主要性质及应用。
[主干知识] 一、铁 1.在元素周期表中的位置:铁位于周期表中第 四 周期, Ⅷ 族。 2.物理性质 具有金属的共性,具有能被 磁体吸引 3.化学性质 铁元素性质活泼,有较强的还原性。 的特性。
1.“铁三角”中的转化关系
2.重要应用
(1)除杂
(2)判断离子共存
(江苏专版)高考化学一轮复习第二板块专题三金属及其化合物第一部分1.3铁及其重要化合物课件

1.亚铁盐和铁盐的性质 (1)亚铁盐 含有 Fe2+的溶液,呈 浅绿 色,既有氧化性,又有还原性。 ①氧化性: Fe2+与 Zn 反应的离子方程式 _Z_n_+__F_e_2_+_=_=_=_F_e_+__Z__n_2+___。 ②还原性: Fe2+与 Cl2 反应的离子方程式 _2_F__e2_+_+__C_l_2_=_=_=_2_F_e_3_+_+__2_C_l_-。 Fe2+在酸性条件下被 H2O2 氧化的反应的离子方程式 _2_F_e_2+_+__H__2_O_2_+__2_H_+_=_=__=_2_F_e_3+_+__2_H__2_O___。
式
_H_2_O__
_3_H__2_O_______
Fe3O4+8H+=== Fe2++2Fe3++ 4H2O
第九页,共37页。
3.铁的氢氧化物
(1)Fe(OH)2 与 Fe(OH)3
化学式
Fe(OH)2
Fe(OH)3
色态
_白__色__固__体__
_红__褐__色__固__体__
与盐酸反 应
_F_e_(_O_H__)_2+__2_H__+__ _=_=_=_F_e_2_+_+__2_H__2O__
1.3 铁及其重要 (zhòngyào)化合物
第一页,共37页。
目录
CONTENTS
1 铁及其氧化物 2 亚铁盐和铁盐 3 课下达标(dá biāo)练
第二页,共37页。
知识点 一 铁及其氧化物
第三页,共37页。
1.铁 (1)原子结构 铁位于元素周期表中 第 4 周期Ⅷ族 。
第四页,共37页。
第八页,共37页。
2.铁的氧化物
化学式
FeO
俗名
Fe2O3 铁红
江苏专版高考化学一轮复习第二板块专题三金属及其化合物第一部分1.2铝镁及其重要化合物名师课件

延展性,密度较小,质地柔软。
3.化学性质
写出图中有关反应的化学方程式或离子方程式: △
② 2Al+3Cl2=====2AlCl3
④ 2Al+2OH-+2H2O===2AlO- 2 +3H2↑ 高温
⑤ 2Al+Fe2O3=====2Fe+Al2O3 (铝热反应)
6.铝与酸、碱反应的计算方法 铝分别与盐酸、NaOH 溶液反应的化学方程式为 2Al+6HCl===2AlCl3+3H2↑ 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 从化学方程式可以看出,Al 与酸、碱反应时生成 H2 的实 质是:Al 失 3e-,A+3l,所以不论是 Al 与酸还是与碱反应,Al 与产生 H2 的关系均是:2Al~3H2。
氨气;Al2O3、Al(OH)3 与稀硫酸反应生成硫酸铝和水,与氢
氧化钠溶液反应生成偏铝酸钠和水;Al 与稀硫酸反应生成硫
酸铝和氢气,与氢氧化钠溶液反应生成偏铝酸钠和氢气。
2.下列变化不能通过一步化学反应直接完成的是 ( )
A.Al(OH)3―→Al2O3
B.Al2O3―→Al(OH)3
C.Al―→Al2O3
A.Al(OH)3 分解
B.COD.Al2O3+OH-
解析:NaOH 溶液先与 CO2 反应,气压减小,易拉罐变瘪;
再与铝表面的 Al2O3 反应,最后与 Al 反应,生成 H2,易拉
罐变鼓。
4.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应 又能与强碱溶液反应放出 H2 的金属,就铝的这一特殊性质回 答下列问题:
方案一:碱溶法 方案二:酸溶法
对点练习
江苏省高考化学一轮复习专题演练:专题金属元素及其化合物专题提升苏教 含解析
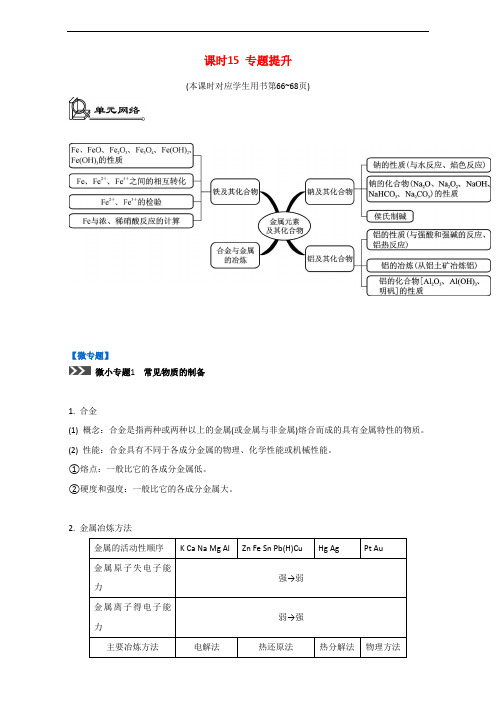
课时15 专题提升(本课时对应学生用书第66~68页)【微专题】微小专题1常见物质的制备1. 合金(1) 概念:合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
(2) 性能:合金具有不同于各成分金属的物理、化学性能或机械性能。
①熔点:一般比它的各成分金属低。
②硬度和强度:一般比它的各成分金属大。
2. 金属冶炼方法金属的活动性顺序K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au金属原子失电子能强→弱力金属离子得电子能弱→强力主要冶炼方法电解法热还原法热分解法物理方法(1) 电解法冶炼金属2Al2O3(熔融)4Al+3O2↑MgCl2(熔融)Mg+Cl2↑2NaCl(熔融)2Na+Cl2↑(2) 热还原法①焦炭还原法,如C+2CuO2Cu+CO2↑②一氧化碳还原法,如3CO+Fe2O32Fe+3CO2③氢气还原法,如4H2+Fe3O43Fe+4H2O④活泼金属还原法,如2Al+Cr2O3Al2O3+2Cr、10Al+3V2O56V+5Al2O3(3) 热分解法2HgO2Hg+O2↑2Ag2O4Ag+O2↑3. 海水中镁的提取(1) 流程(2) 注意事项和相关反应①利用海边的贝壳(主要成分是CaCO3)制备石灰乳,整个工艺是浓缩Mg2+,电解熔融MgCl2制备镁。
②主要的化学方程式:MgCl2+Ca(OH)2Mg(OH)2↓+CaCl2Mg(OH)2+2HCl MgCl2+2H2OMgCl2·6H2O MgCl2+6H2O↑MgCl2(熔融)Mg+Cl2↑4. 铝土矿(含Al2O3、Fe2O3等)炼铝(1) 流程(2) 注意事项和相关反应①溶解铝土矿的方法有酸溶法(H2SO4溶液)和碱溶法(NaOH溶液),该流程采用碱溶法。
②主要的化学方程式:Al2O3+2NaOH2NaAlO2+H2ONaAlO2+2H2O+CO2Al(OH)3↓+NaHCO32Al(OH)3Al2O3+3H2O2Al2O3(熔融)4Al+3O2↑微小专题2有关铜的问题1. 铜单质(1) 物理性质:紫红色固体,具有良好的延展性、导热性和导电性。
2014届高考化学一轮复习名师讲解课件:第三章-金属及其化合物3-4--53张PPT

第12页,共53页。
Al、Fe、Cu 都是重要的金属元素。下列说法正确的是( ) A.三者对应的氧化物均为碱性氧化物 B.三者的单质放置在空气中均只生成氧化物 C.制备 AlCl3、FeCl3、CuCl2 均不能采用将溶液直接蒸干 的方法 D.电解 AlCl3、FeCl3、CuCl2 的混合溶液时阴极上依次析 出 Cu、Fe、Al
第8页,共53页。
(对应学生用书 P48)
金属活 动顺序
原子失 电子能
力
阳离子 得电子 能力
K Ca Na
Mg Al Zn
Fe Sn Pb
H Cu Hg Ag Pt Au
由易到难,还原性由强到弱
由难到易,氧化性由弱到强
第9页,共53页。
金属 活动 顺序
K Ca Na和Biblioteka 2 反应常温下 易被氧 化
第28页,共53页。
[实验方案] (1)解决问题①需用到的药品有 CuSO4 溶液、________(填 试剂),同时进行相关实验。 (2)解决问题②的实验步骤和现象如下:取 98 g Cu(OH)2 固体,加热至 80℃~100℃时,得到黑色固体粉末,继续加热 到 1000℃以上,黑色粉末全部变成红色粉末 A。冷却后称量, A 的质量为 72 g,A 的化学式为________。向 A 中加入适量的 稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
(1)溶液中的 Cu2+常为蓝色(浓 CuCl2 溶液为蓝绿色,稀 CuCl2 溶液为蓝色),可作为 Cu2+的判断依据。如 CuSO4 溶液 呈蓝色。
高中化学苏教版必修1 专题3第一单元第2课时 铝的性质 课件(17张)

为3∶2。
1.铝既能与盐酸反应又能与强碱溶液反应,但不能说铝具有 两性。
2.铝与强酸、强碱反应后产物的化合价相同,但存在形式不 同,前者以 Al3+形式存在,后者以 AlO2-形式存在。
本部分内容讲解结束
按ESC键退出全屏播放
[解析] 根据反应:2Al+6HCl===2AlCl3+3H2↑,2Al+ 2NaOH+2H2O===2NaAlO2+3H2↑。可见质量相同的铝分 别与足量的盐酸、氢氧化钠溶液反应时产生氢气的量相同;
但相同质量的铝分别与不足量的盐酸、氢氧化钠溶液反应时
产生氢气的量不同,需要HCl的物质的量比氢氧化钠的多。 现产生H2的体积比为1∶2,说明盐酸的量不足,根据0.3 mol HCl产生H2为0.15 mol,可知铝与NaOH反应产生的H2 为0.3 mol,继而求出放入的铝粉应为0.2 mol,即5.4 O__H_)_3_+__N_a_O__H_=_=__=_N_a_A__lO__2+__2_H__2_O__________________。
1.铝在空气中能表现出良好的抗腐蚀性,是因为 _铝__与__空__气__中__的__氧__气__反__应__生__成__致__密__的__氧__化__膜___并__牢__固__地__覆__盖__在__铝_ _表__面__,__阻__止__了__内__部__的__铝__与__空__气__接__触____________________。
输。
4.工业上常用铝粉还原一些金属氧化物,这类反应被称为 __铝__热___反应,此类反应_放__出__ (填“放出”或“吸收”)大量 的热,写出铝与氧化铁反应的化学方程式: _2_A_l+__F__e_2O__3=_=高_=_温=_=_A__l2_O_3_+__2_F_e___________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4)(2012·重庆高考)NaHCO3的热稳定性大于Na2CO3。( × )
分析:NaHCO3受热可生成Na2CO3,故NaHCO3的热稳定性小于
Na2CO3。
(5)(2013·江苏高考)用铂丝蘸取少量某溶液进行焰色反应,火
焰呈黄色,该溶液一定是钠盐溶液。( × ) 分析:焰色反应是元素性质,故原溶液也可能是NaOH溶液。 (6)(2012·江苏高考)明矾能水解生成Al(OH)3胶体,可用作净 水剂。( √ ) 分析:明矾水解生成的Al(OH)3胶体中,胶粒带正电,通过电性吸 引作用,破坏了水中胶体杂质的稳定性,使胶体杂质聚沉,同时
====3Fe3++NO↑+3H O。( × ) 方程式是3Fe2++4H++ NO3 2
分析:磁性氧化铁的主要成分是Fe3O4(+2、+3混合价态),作为
氧化物的形式不能拆成离子形式,且方程式原子不守恒。
热点考向 1
钠如图所示,甲、 乙、丙、丁分别代表Na2CO3、NaOH、NaHCO3、 CO2四种物质,a、b、c、d、e、f分别表示两 种物质间的转化关系。对于图中两种物质间 的转化,通过一步反应就能实现的有( A.只有a、b、c、d )
2 3 2 2
(3)Al(OH)3与强酸、强碱发生反应的离子方程式分别为
Al(OH)3+3H+====Al3++3H2O 、___________________________ Al(OH)3 OH-====AlO- _______________________ 2 2H2O 。
3.铁及其化合物: Fe+S ==== FeS 、 (1)铁与S、Cl2发生反应的化学方程式分别为_____________
点燃 2Fe+3Cl 2 ==== 2FeCl3 。 ___________________
△
(2)Fe与CuSO4、FeCl3溶液反应的离子方程式分别为 Fe+Cu2+====Fe2++Cu 、________________ Fe+2Fe3+====3Fe2+ 。 _________________ (3)Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,其反应方程 4Fe(OH)2+O2+2H2O====4Fe(OH)3 其现象为_____________ 白色迅速变成 式为____________________________, 灰绿色,最终变成红褐色 。 ______________________
Al(OH)3还能吸附一些悬浮物,所以明矾具有净水作用。
(7)(2012·山东高考)Fe与稀硝酸、稀硫酸反应均有气泡产生,
说明Fe与两种酸均发生置换反应。( × ) 分析:铁与稀硝酸发生的反应不是置换反应。 (8)(2012·江苏高考)FeCl3溶液能与Cu反应,可用于蚀刻印刷 电路。( √ ) 分析:Fe3+把Cu氧化(即腐蚀铜)。 (9)(2013·大纲版全国卷)磁性氧化铁溶于稀硝酸,反应的离子
(×) 分析:虽可发生反应2Na2O2+2CO2====2Na2CO3+O2,但生成的 Na2CO3不会出现黏稠现象,所以主要是发生了反应 2Na2O2+2H2O====4NaOH+O2↑,生成的NaOH潮解而出现黏稠现 象。
(3)(2013·山东高考)等质量的铝分别与足量的氢氧化钠溶 液、稀硫酸、盐酸、稀硝酸反应,放出氢气且消耗溶质物质的 量最少的是氢氧化钠溶液。( √ ) 分析:首先稀硝酸与金属铝反应不生成氢气,根据生成物的化学 式:NaAlO2、Al2(SO4)3、AlCl3,通过物料守恒可直接判断出等 量的铝消耗NaOH物质的量最少。
(3)NaHCO3受热分解的化学方程式为 △ 2NaHCO 3 ==== Na2CO3+H2O+CO2↑ 。 ____________________________ (4)饱和Na2CO3溶液中通入足量的CO2气体发生反应的化学方程 Na2CO3+CO2+H2O====2NaHCO3↓ 。 式为__________________________
B.只有b、c、d、e
C.只有c、d、e、f
D.a、b、c、d、e、f
【解题探究】 (1)如何才能将Na2CO3转化为NaOH? 提示:利用复分解反应,向碳酸钠溶液中加入Ca(OH)2或Ba(OH)2 等。
(2)有哪些途径可将NaHCO3转化为CO2?
提示:①NaHCO3与强酸反应;②NaHCO3受热分解;③NaHCO3与强酸 弱碱盐溶液反应,如NaHCO3与Al2(SO4)3的反应。
2.铝及其化合物: AlCl3 也能与NaOH溶液反应生成 (1)铝能与盐酸反应生成_____, NaAlO2 。 ______ (2)Al2O3与强酸、强碱发生反应的离子方程式分别为 +====2Al3++3H O Al O +6H 2 3 2 、___________________________ Al O 2OH- 2AlO- H O 。 ______________________
(1)(2012·北京高考)切开的金属Na暴露在空气中,光亮表面逐
渐变暗,其反应方程式为2Na+O2====Na2O2。( × )
分析:钠在常温下暴露在空气中,钠被空气中的氧气氧化成氧化
钠:4Na+O2====2Na2O。
(2)(2012·北京高考)Na2O2在潮湿的空气中放置一段时间,变
成白色黏稠物,其反应方程式为2Na2O2+2CO2====2Na2CO3+O2。
第2讲 金属元素单质及其重要化合物
1.钠及其化合物:
(1)Na与冷水剧烈反应的化学方程式为 ++2OH-+H ↑ 2Na+2H O====2Na 2 2 _________________________ 。 (2)Na2O2与CO2、H2O反应的化学方程式分别为 2Na2O2+2CO2====2Na2CO3+O2 、________________________ 2Na2O2+2H2O====4NaOH+O2↑ 。 ________________________
