荧光微丝
Actin-Trakcer Green(微丝绿色荧光探针

Actin-Trakcer Green(微丝绿色荧光探针)产品简介:Actin-Trakcer Green是一种Actin绿色荧光探针,可以用于培养细胞或组织切片的Actin特异性荧光染色。
Actin-Trakcer Green探针为荧光染料FITC标记的毒蕈肽(phalloidin),即phalloidin-FITC,其分子量约为1251.4,最大激发波长为496nm,最大发射波长为516nm。
本产品可以用于细胞或组织内的微丝(microfilament)的荧光检测。
本产品使用时的推荐稀释比例为1:40-1:200。
如果每个片子需要使用200μl染色工作液,每个包装的本产品足够用于40-200个片子的染色。
保存条件:-20℃避光保存,一年有效。
注意事项:为避免反复冻融,建议适当分装。
对于微量的液体,每次使用前先离心数秒钟,使液体充分沉降到管底。
荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
需自备盖玻片和载玻片(可以向碧云天订购)。
Phalloidin 有一定毒性(LD50为2 mg/kg体重),1ml Actin-Tracker Green中的phalloidin少于0.2mg,使用时请注意适当防护。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:1.固定细胞或组织切片的荧光染色:a.用PBS洗涤细胞或组织切片2次。
b.用碧云天的免疫染色固定液(P0098)或PBS配制的3.7%甲醛溶液室温固定细胞或组织切片约10分钟。
注意:甲醇可以破坏actin蛋白,因此不能使用含有甲醇的固定液。
并且尽量使用不含甲醇的甲醛。
c.用碧云天的免疫染色洗涤液(P0106)或含0.1% Triton X-100的PBS洗涤2-4次,每次约5分钟。
d.用碧云天的免疫荧光染色二抗稀释液(P0108)或含有1-5%BSA和0.1% Triton X-100的PBS按照1:40-1:200的比例稀释Actin-Tracker Green,例如5μl或25μl Actin-Tracker Green用1ml稀释液稀释,稀释后的溶液即为Actin-Tracker Green染色工作液。
Actin-Tracker Green(微丝绿色荧光探针) 产品说明书
Actin-Tracker Green(微丝绿色荧光探针) 产品编号产品名称包装C1033 Actin-Tracker Green(微丝绿色荧光探针) 0.2ml产品简介: Actin-Tracker Green 是一种Actin 绿色荧光探针,可以用于培养细胞或组织切片的Actin 特异性荧光染色。
Actin-Tracker Green 探针为荧光染料FITC 标记的毒蕈肽(phalloidin),即phalloidin-FITC ,其分子量约为1251.4,最大激发波长为496nm ,最大发射波长为516nm 。
本产品可以用于细胞或组织内的微丝(microfilament)的荧光检测。
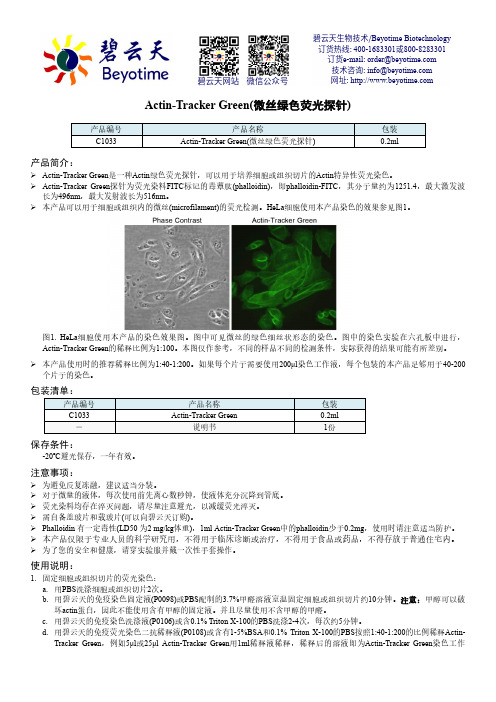
HeLa 细胞使用本产品染色的效果参见图1。
图1. HeLa 细胞使用本产品的染色效果图。
图中可见微丝的绿色细丝状形态的染色。
图中的染色实验在六孔板中进行,Actin-Tracker Green 的稀释比例为1:100。
本图仅作参考,不同的样品不同的检测条件,实际获得的结果可能有所差别。
本产品使用时的推荐稀释比例为1:40-1:200。
如果每个片子需要使用200μl 染色工作液,每个包装的本产品足够用于40-200个片子的染色。
包装清单:产品编号产品名称 包装 C1033Actin-Tracker Green 0.2ml - 说明书 1份保存条件:-20ºC 避光保存,一年有效。
注意事项:为避免反复冻融,建议适当分装。
对于微量的液体,每次使用前先离心数秒钟,使液体充分沉降到管底。
荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
需自备盖玻片和载玻片(可以向碧云天订购)。
Phalloidin 有一定毒性(LD50 为2 mg/kg 体重),1ml Actin-Tracker Green 中的phalloidin 少于0.2mg ,使用时请注意适当防护。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
2简述荧光检测细胞骨架的实验流程

2简述荧光检测细胞骨架的实验流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!荧光检测细胞骨架的实验是一种常用的技术,用于观察和分析细胞内部的微丝、微管和中间纤维等细胞骨架组件的分布和动态变化。
第八章 微丝 第九章 微管 第十章 中间纤维

第八章微丝本章重点:微丝的功能微丝特异性药物主要内容:形态结构:存在形式:分散存在,聚集成束,交联成网微丝的化学组成肌肉由肌原纤维组成肌原纤维: 粗肌丝和细肌丝组成,粗肌丝:肌球蛋白细肌丝:肌动蛋白/原肌球蛋白/肌钙蛋白。
微丝的组装一.在适宜的温度,存在ATP、K+、Mg2+离子的条件下,(达临界浓度以上)肌动蛋白单体可自组装为纤维。
组装步骤:1.成核:几个G-肌动蛋白开始聚合形成核心结构;2.微丝生长:G-肌动蛋白从两端加到多聚体上,加到正端比加到负端速度快10倍以上。
(此为结构极性;功能极性即行使功能具有方向性)3.处于平衡状态:微丝延长到一定时期,游离肌动蛋白单体浓度降低至临界浓度,正端延长速度等于负端缩短速度,长度处于平衡状态(此过程---踏车现象)二.微丝组装的非稳态动力模型ATP肌动蛋白浓度高时,纤维末端形成一连串的ATP肌动蛋白---ATP 帽。
ATP肌动蛋白对F-肌动蛋白亲和力高。
ADP肌动蛋白亲和力低。
三.★微丝特异性药物(重点)细胞松弛素B可切断微丝纤维,并结合在微丝末端抑制肌动蛋白加合到微丝纤维上,特异性的抑制微丝功能。
鬼笔环肽与微丝能够特异性的结合,使微丝纤维稳定而抑制其解聚。
荧光标记的鬼笔环肽可特异性的显示微丝。
★微丝功能(重点):五月天 - 时光机.wma(1)维持细胞的形态:参与构成细胞骨架,很多细胞质膜下有肌动蛋白和一些微丝结合蛋白形成的骨架网络,使细胞膜具有一定的强度和韧性,维持形态。
(形成微绒毛和应力纤维)(2)肌肉的收缩:骨骼肌细胞的收缩单位是肌原纤维。
肌肉收缩是细肌丝与粗肌丝相互滑动所致。
(3)细胞的运动与物质转运:1.细胞运动质膜下平行排列的肌动蛋白纤维使细胞产生各种运动。
如阿米巴运动,变皱膜运动,胞质环流及吞噬活动等。
这些运动可被细胞松弛素抑制。
(变皱膜运动:1.微丝伸长,细胞表面突起,形成伪足;2.伪足与基质接触部位形成黏着斑;3.黏着斑解离,细胞向前移动。
微管与微丝的免疫荧光标记及形态观察实验报告

微管与微丝的免疫荧光标记及形态观察实验报告实验步骤:成纤维细胞微丝的染色:在平皿中用盖片培养C6成纤维细胞。
将盖片放入盛有PBS的平皿内用吸管轻轻吹洗盖片,换液三次,每次3min,洗去培养液。
将盖片移入2百分比Triton X100液,置37℃恒温箱内处理20至30min。
M缓冲液有稳定细胞骨架的作用。
立刻将盖片移入M缓冲液,换洗三次,每次3min。
将盖片移入3百分比戊二醛固定5min。
将盖片移入0.2百分比考马斯亮蓝染液染液中,染色15min。
然后小心的用自来水冲洗,空气干燥。
成纤维细胞微丝对细胞松弛素B的反应:在平皿中有三张成纤维细胞贴壁生长的盖片,在超净工作台内将一张盖片移入另一平皿中继续培养,用作对照。
在有两片的平皿内加100uL每mL的细胞松弛素B 4滴继续培养半h。
将用细胞松弛素B处理过的两张盖片取一张做染色处理,另一张用培养液洗五次在平皿内换5次培养液,每次都要摇动,继续培养观察。
2h后细胞形态恢复,接近正常。
对恢复的盖片与第一张没用药的盖片一同做染色处理。
注意事项:洗片时要轻柔,以免把细胞从载片上洗去。
恢复时间要足够,否则细胞不会恢复到未处理前的情况。
细胞盖片注意正反面。
染色后应冲洗盖片背面,避免损伤细胞。
形态观察及实验报告:真核细胞胞质中纵横交错的纤维网称为细胞骨架。
根据纤维直径、组成成分和组装结构的不同,分为微管、微丝和中间纤维。
微丝是肌动蛋白构成的纤维。
单根微丝直径约7nm,在光学显微镜下看不到。
本实验用考马斯亮蓝R250显示微丝组成的应力纤维。
应力纤维在体外培养的贴壁细胞中尤为发达,形态长而直,常与细胞的长轴平行并贯穿细胞全长。
细胞松弛素B可与微丝的亚单位肌动蛋白结合,从而破坏微丝,改变细胞的形状。
考马斯亮蓝R250可以染各种蛋白,并非特异染微丝。
但在该实验条件下,微管结构不稳定,有些类型的纤维太细,光镜下无法分辨。
因此,我们看到的主要是由微丝组成的应力纤维。
实验二 生物样品的荧光观察

实验二生物样品的荧光观察一、实验目的1、初掌握荧光显微镜和激光共聚焦扫描显微镜的结构、原理、使用方法及其在细胞生物学研究中的应用。
2、掌握生物材料的荧光染色和活体荧光蛋白的观察方法。
3、了解激光共聚焦的原理。
二、实验原理1、某些物质经短波光照射后,分子被激活,吸收能量后呈激发态。
其能量除部分转换为热量外,相当一部分则以波长较长的光能辐射出来,这种波长长于激发光的可见光称为荧光。
细胞内的某些物质经过短波光照射后,可以发出自发荧光。
在生物学研究中,能将发荧光的有机化合物-荧光染料与特定的细胞组分相结合,通过激发后产生的荧光对细胞组分进行定性和定位。
2、生物样品的荧光观察采用荧光显微镜或激光共聚焦显微镜。
荧光显微镜以波长较短的光为光源,照射被检样品,激发被检物品内的荧光物质发出可见的荧光,通过物镜和目镜放大成像。
激光共聚焦显微镜也是来观察样品中荧光分布状况的。
激光共聚焦显微镜是以激光为光源,在某一瞬间只用很小一部分光照明,通过检测器的一个小孔或裂缝后成像,保证只有来自该焦平面的光成像,而来自焦平面外的散光则被小孔和裂缝挡住,成像异常清晰。
此外,激光共聚焦显微镜可以在同一样品的不同焦平面进行扫描得到不同焦平面的图像,然后通过计算机重构出样品的三维结构。
3、本实验中微丝的荧光观察采用荧光素标记的鬼笔环肽(phalloidin),鬼笔环肽可以专一的结合在聚合状态的肌动蛋白丝上,起到稳定微丝的作用。
细胞核的观察用DAPI(diamidino-2-phenylindole)染色。
DAPI 能与DNA双螺旋的凹槽部分相互作用,从而与DNA双链紧密结合。
结合后产生的荧光基团的吸收峰358nm,而散射峰是461nm。
而植物细胞的花粉管、筛板和胞间连丝含有胼胝质成分,经苯胺蓝染色后,用紫外光激发,可以发出黄绿色荧光。
4、激光共聚焦扫描显微镜(laser scanning confocal microscope,LSCM)原理:用激光作扫描光源,逐点、逐行、逐面快速扫描成像,扫描的激光与荧光收集共用一个物镜,物镜的焦点即扫描激光的聚焦点,也是瞬时成像的物点。
细胞骨架观察-荧光

细胞骨架的观察——微管的间接免疫荧光定位[实验目的]1.掌握微丝的染色观察的原理和方法2.观察微丝在培养细胞中的形态及分布方式3.了解细胞骨架成分显色方法的原理及操作步骤[实验原理]细胞骨架是真核细胞胞质中由微丝,微管中间纤维等交织形成的纵横交错的立体纤维网络结构,对细胞形状的保持,细胞内物质运输,细胞运动,细胞内各结构相对位置的固定等有重要作用。
微丝微管和中间纤维是根据纤维直径,组成成分或组装结构的不同划分的,均由单体蛋白以较弱的非共价键结合在一起构成纤维性多聚体,很容易进行组装和去组装。
微丝微管中间纤维等都是直径很小的结构,最大的单根微管才35nm左右,只有在电镜下才能看见。
目前观察真核细胞中细胞骨架的主要方法有电镜,间接免疫荧光技术,酶标和组织化学等。
常用的显示细胞骨架成分的特异性方法有1.特异性的药物结合反应(如罗丹明标记的鬼笔环肽)2.免疫细胞化学的方法制备细胞骨架蛋白的特异性抗体,用免疫荧光,免疫酶标的方法显示细胞骨架鬼笔环肽为连环七肽,是从毒性萜类中分离出的剧毒生物碱,与聚合的微丝具有强亲和力,可抑制微丝的解聚,使微丝保持温度状态,用荧光标记物标记的鬼笔环肽在荧光显微镜下清晰显示微丝的分布采用微管蛋白单克隆抗体作为第一抗体与细胞内的微管蛋白结合,再用荧光素标记的抗产生微管蛋白的抗体的第二抗体结合,就可用荧光显微镜观察微管的存在状态。
[实演器材]1.材料:体外培养的贴壁生长细胞2.试剂:PBS溶液,小鼠抗人微管的单克隆抗体,FITC标记的羊抗鼠荧光抗体,BSA封闭液,含有DAPI的防荧光淬灭剂,4%多聚甲醛,Trition X-100溶液3.设备:细胞培养设备,倒置显微镜恒温箱显微镜培养皿镊子吸水纸[实验步骤]1.细胞培养在盖玻片上,至70-80%融汇度2.取细胞爬片,用PBS洗涤2次,每次10min勿震荡。
3.吸弃PBS缓冲液,用4%多聚甲醛室温固定5-10min4.吸弃固定液,用PBS洗涤3次,每次10min5.吸弃PBS缓冲液,用0.1%Trition X-100 PBS溶液室温处理5-10min6.用PBS洗涤3次,每次10min7.用吸水纸吸去盖玻片上的液体,在盖玻片上滴加20ul2%BSA封闭液,密闭湿盒中封闭30-60min8.用吸水纸吸去盖玻片上的封闭液,在盖玻片上滴加20ul的小鼠抗人单克隆抗体,盖上盖玻片,密闭湿盒中37℃孵育30min9. 用吸水纸吸去盖玻片冲掉,用PBS缓冲液洗涤3次,每次5-10min10. 用吸水纸吸去盖玻片上的一抗液,在盖玻片上滴加20ul的FITC标记的二抗溶液,盖上盖玻片,密闭湿盒中37℃孵育30min11. 用PBS将无细胞的盖玻片冲掉,用PBS缓冲液洗涤3次,每次10min12. 用吸水纸吸去盖玻片上的液体,滴加5ul含DAPI的防荧光淬灭剂,将盖玻片有细胞的一面朝下,轻轻盖于含有防荧光淬灭剂的载玻片上,避免产生气泡13. 至于荧光显微镜下观察(FITC用蓝色光激发观察绿色荧光,细胞核经DAPI 染色后用紫外光激发,产生蓝色荧光)[结果的分析与记录]可以看出在第一张图片中,绿色荧光比较多,几乎是成片出现,可能是因为二抗加的过多,并且在洗涤过程中可能没有洗干净,所以导致绿色成片出现。
【PPT课件】第八章 细胞骨架
纤毛、鞭毛和基体
基体
结构比较
Centriole: “9+0” pattern
cilia and flagella: “9+2” pattern
28
例:神经元轴突运输的类型及运输模式
色素颗粒的运输
微管的结构异常与疾病
24
在早老性痴呆患者(阿尔茨海默病)的脑神经元
内,tau蛋白的过磷酸化使其很容易从微管上解离
下来形成神经原纤维缠结。
25
微管依赖性马达蛋白 (motor protein)
驱动蛋白(kinesin)
通过结合和水解ATP, 向着微管(+)极运输 小泡。
动力蛋白( dynein )
深绿:微管 浅兰:内质网 黄色:高尔基体
上图:内质网抗体染色 下图:微管抗体染色
上图:高尔基抗体染色 下图:微管抗体染色
containing -tubulin
The centrosome is the major MTOC of animal cells
影响微管组装的特异性药物
秋水仙素(colchicine) 阻断微管蛋白组 装成微管,可破坏纺锤体结构。
紫杉醇(taxol)、重水(D2O)能促进微管
的装配,并使已形成的微管稳定。但这
第八章
细胞骨架
(Cytoskeleton)
红色荧光显示微丝、绿色显示微管、蓝色显示细胞核
概 述
细胞骨架(Cytoskeleton) 是真核细胞中的蛋白质纤维网架体 系,它对于维持细胞的形状、细胞的运 动、细胞内的物质运输、染色体的分离 和细胞的分裂起着重要的作用。
细胞骨架由以下组分构成
实验十二微丝的观察(荧光探针标记)

将荧光探针标记技术应用于更多领域,如疾病诊断、药物筛选等, 推动生物医学研究的发展。
THANKS FOR WATCHING
感谢您的观看
实验十二微丝的观察(荧光探针标 记)
目 录
• 引言 • 实验材料与方法 • 微丝的结构与功能 • 荧光探针标记技术在微丝观察中的应用 • 实验步骤与操作 • 实验结果与分析 • 结论与展望
01 引言
实验目的
观察微丝在细胞内的分布和动态变化
通过荧光探针标记微丝,利用荧光显微镜观察其在细胞内的分布和动态变化,了 解微丝在细胞生理过程中的作用。
荧光探针的特异性
实验结果表明,所使用的荧光探针具有较高的特异性,能够准确标 记微丝。
微丝的功能分析
通过对微丝的动态观察,发现微丝在细胞运动、分裂等过程中发挥重 要作用。
对未来研究的展望
深入研究微丝的功能
进一步探讨微丝在细胞内的具体作用机制,以及与其他细胞结构 的相互作用。
发展新的荧光探针技术
研发更灵敏、更特异的荧光探针,以实现对微丝更精细的观察和研 究。
微丝形态与功能探讨
微丝在细胞内的形态和分布与其功能密切相关。例如,细胞边缘的微丝可能与细胞形状维持和细胞运动有关,而 应力纤维则可能与细胞收缩和机械传导有关。通过对微丝形态和分布的观察和分析,可以进一步探讨微丝在细胞 内的功能。
与理论预测的比较
与已知微丝结构的比较
通过对比已知的微丝结构和本实验观察到的微丝结构,可以验证实验结果的准确性。在本实验中,观 察到的微丝结构与已知的微丝结构相符,进一步证实了实验结果的可靠性。
状结构。
微丝的形态
微丝在细胞中呈现动态变化,可以 形成分支、网络或束状结构。
荧光探针标记
荧光显微镜和普通显微镜有何区别

荧光显微镜和普通显微镜有何区别细胞中有些物质,如叶绿素等,受紫外线照射后可发荧光;另有一些物质本身虽不能发荧光,但如果用荧光染料或荧光抗体染色后,经紫外线照射亦可发荧光,荧光显微镜就是对这类物质进行定性和定量研究的工具之一。
荧光显微镜和普通显微镜有以下的区别:1.照明方式通常为落射式,即光源通过物镜投射于样品上;2.光源为紫外光,波长较短,分辨力高于普通显微镜;3.有两个特殊的滤光片,光源前的用以滤除可见光,目镜和物镜之间的用于滤除紫外线,用以保护人目。
荧光显微镜照片(微管呈绿色、微丝红色、核蓝色)倒置荧光显微镜配置如下:用途:GFM-800 系列无限远倒置荧光显微镜是由倒置生物显微镜系统和落射荧光显微镜系统组成。
采用优良的无限远光学系统,操作性能按人机工程学要求设计,紧凑稳定的高刚性主体,充分体现了显微操作的防振要求, 旋转摆入摆出式聚光系统,使操作过程中更加舒适与轻松。
GFM-800倒置荧光显微镜配有无限远长工作距离平场消色差物镜、大视野目镜、长工作距离聚光镜、同时配有相衬装置及长工作距离平场相衬物镜可对高培养瓶或培养皿内进行无沾染培养显微观察的特点;GFM-800系列倒置荧光显微镜系统采用模块化设计理念,可以安全、快揵地调整照明系统,切换荧光滤色片组件。
特别适用于对活体细胞和组织、流质、沉淀物等进行显微研究,是生物学,细胞学,肿瘤学,遗传学,免疫学等研究工作的理想仪器。
可供科研、高校、医疗、防疫和农牧等部门使用。
成像系统简介:GFM-800P 倒置电脑型荧光显微镜GFM-800S倒置数码荧光显微镜是将精锐的光学显微镜技术、先进的光电转换技术、尖端的计算机图像处理技术完美地结合在一起而开发研制成功的一项高科技产品。
可以在计算机显示器上很方便地观察荧光图像,从而对荧光图谱进行分分析,评级等对图片进行输出、打印。
技术规格:1.目镜:大视野目镜10X(Ф22) 1对对中望远镜1个(相衬装置用)2.物镜类型放大倍数数值孔径(NA) 工作距离(mm) 盖玻片厚度(mm)平场消色差物镜PL L 10X 0.25 4.3 1.2 PL L 20X 0.40 8.0 1.2 PL L 40X 0.60 3.5 1.2相衬物镜PL L 10X 0.25 4.3 1.2 PL L 20X 0.40 8.0 1.2 PL L 40X 0.60 3.5 1.23.总放大倍数:100X~400X4.聚光镜:特长工作距离聚光镜(带相衬装置):工作距离50mm5.固定载物台尺寸:227mmX208mm.6.移动范围:纵向77mm,横向114mm7.玻璃圆载物台板尺寸:Ф118mm.培养皿托板一内槽尺寸:86mm(宽)X129.5mm(长),可适配圆形培养皿Ф87.5mm 培养皿托板二内槽尺寸:34mm(宽)X77.5mm(长),可适配圆形培养皿Ф68.5mm 培养皿托板三内槽尺寸:57mm(宽)X82mm(长)8.调焦机构:同轴粗微动调焦系统,带限位和调节松紧装置;微动手轮格值为:0.002 mm 9.目镜筒:45˚倾斜,瞳距调节范围53~75mm.10.照明系统:A.透射照明光源6V30W 卤素灯(亮度可调) 磨砂玻璃,蓝、绿滤色片B.落射荧光光源100W 超高压直流汞灯,汞灯电源箱(110V 或220V) 11.激发滤色片组:紫光发片波长:330nm~400nm 发射片波长:425nm紫外激发片波长:395nm~415nm 发射片波长:455nm蓝光激发片波长:420nm~485nm 发射片波长:515nm绿光激发片波长:460nm~550nm 发射片波长:590nm系统配套件:电脑型倒置荧光显微镜(GFM-800P): 1.倒置荧光显微镜 2.适配镜3.摄像器(CCD)4.A/D(图像采集)5.计算机(选配)数码型倒置荧光显微镜(GFM-800S): 1、倒置荧光显微镜2、适配镜3、数码相机仪器选配件:1、分划刻度目镜10X(Ф22) 物镜:5X 60X ) 4、300万像素成像器2、超长工作距离聚光镜:工作距离70mm 5、细胞分析软件3、长工作距离聚光镜(带相衬装置):工作距离30mm.。
第八章细胞骨架
Microtubule-associated protein, MAP 微管相关蛋白
聚合速度等于解聚速度 (游离管蛋白达到临 界浓度)
nuleation elongation Steady state
13 15
1972年——Weisenberg——小鼠——分离微管蛋白——体外组装
+
-
微管在体内的装配和去组装在时间和空间
上是高度有序的
细胞中MTOC的常见部位:中心体、纤毛和鞭毛基体 等具有微管组织中心的功能。
The Orientation of Microtubules in a Cell
影响微管组装的特异性药物
秋水仙素(colchicine) 阻断微管蛋白 组装成微管,可破坏纺锤体结构。 紫杉醇(taxol)、重水(D2O)能促进微管 的装配,并使已形成的微管稳定。但这 种稳定对细胞有害。 注:为行使正常的微管功能,微管处于动 态的装配和解聚是其功能正常发挥的 基础。
成核期 — 微丝组装的限速过程 生长期 — 肌动蛋白在核心两端聚合
正端快,负端慢
平衡期 — 聚合速度与解离速度达到平衡
动态调节:
踏车模型(treadmilling model)
(三)微丝的功能
(1)构成细胞的支架,维持细胞的形态
微绒毛 应力纤维
(2)参与细胞分裂
细胞分裂中形成收缩环(内含肌动蛋白 纤维和肌球蛋白纤维)
广义的细胞骨架还包括
核骨架(nucleoskeleton) 核纤层(nuclear lamina) 细胞外基质(extracellular matrix)
形成贯穿于细胞核、细胞质、细胞外的一体 化网络结构。
第一节 细胞骨架的基本结构与功能 一、微管(microtubule)
微丝——精选推荐

微丝微丝(microfilament,MF),又称肌动蛋白纤维(actin filament),是指真核细胞中由肌动蛋白(actin)组成,直径为7nm的骨架纤维。
(一)成分肌动蛋白是微丝的结构成分,分子量为43kD。
肌动蛋白单体外观呈哑铃状,其确切分子结构尚不清楚。
肌动蛋白存在于所有真核细胞中,肌动蛋白在真核细胞进化过程中相当保守,在哺乳动物和鸟类细胞中至少已分离到6种肌动蛋白,4种称为α-肌动蛋白,分别为横纹肌、心肌、血管平滑肌和肠道平滑肌所特有,另两种为β-肌动蛋白和γ-肌动蛋白,见于所有肌肉细胞和非肌肉细胞胞质中。
不同类型肌肉细胞的α-肌动蛋白分子一级结构(约400个氨基酸残基)仅相差4~6个氨基酸残基,β-肌动蛋白或γ-肌动蛋白与α-横纹肌肌动蛋白相差约25个氨基酸残基。
显然这些肌动蛋白基因是从同一个祖先基因进化而来。
多数简单的真核生物,如酵母或粘菌,含单个肌动蛋白基因,仅合成一种肌动蛋白。
然而,许多多细胞真核生物含有多个肌动蛋白基因,如海胆有11个,网柄菌属(Dictyostelium)有17个,在某些植物中有60个。
由于这些生物中不同肌动蛋白的实际数量尚未确定,实际有多少基因表达了尚不清楚。
肌动蛋白亦要经过翻译后修饰,如N-端乙酰化或组氨酸残基的甲基化。
这一过程可以使其具有更多的功能多样性。
(二)装配微丝,亦称为纤维形肌动蛋白(F-actin),是由球形肌动蛋白(G-actin)单体形成的多聚体。
肌动蛋白单体具有极性,装配时呈头尾相接,故微丝具有极性。
微丝的分子结构尚无定论,比较传统的模型认为微丝是由两条肌动蛋白单链呈右手螺旋盘绕形成的纤维,近年来则倾向于认为微丝是由一条肌动蛋白单体链形成的右手螺旋(图9-1)。
在含有ATP和Ca2+以及很低浓度的Na+、K+等阳离子溶液中,微丝趋于解聚成G-actin;而在Mg2+和高浓度的Na2+,K+溶液诱导下,G-actin则装配为纤维状肌动蛋白,新的G-actin加到微丝末端,使微丝延伸。
实验二 生物样品的荧光观察

实验二生物样品的荧光观察一、实验目的1、初掌握荧光显微镜和激光共聚焦扫描显微镜的结构、原理、使用方法及其在细胞生物学研究中的应用。
2、掌握生物材料的荧光染色和活体荧光蛋白的观察方法。
3、了解激光共聚焦的原理。
二、实验原理1、某些物质经短波光照射后,分子被激活,吸收能量后呈激发态。
其能量除部分转换为热量外,相当一部分则以波长较长的光能辐射出来,这种波长长于激发光的可见光称为荧光。
细胞内的某些物质经过短波光照射后,可以发出自发荧光。
在生物学研究中,能将发荧光的有机化合物-荧光染料与特定的细胞组分相结合,通过激发后产生的荧光对细胞组分进行定性和定位。
2、生物样品的荧光观察采用荧光显微镜或激光共聚焦显微镜。
荧光显微镜以波长较短的光为光源,照射被检样品,激发被检物品内的荧光物质发出可见的荧光,通过物镜和目镜放大成像。
激光共聚焦显微镜也是来观察样品中荧光分布状况的。
激光共聚焦显微镜是以激光为光源,在某一瞬间只用很小一部分光照明,通过检测器的一个小孔或裂缝后成像,保证只有来自该焦平面的光成像,而来自焦平面外的散光则被小孔和裂缝挡住,成像异常清晰。
此外,激光共聚焦显微镜可以在同一样品的不同焦平面进行扫描得到不同焦平面的图像,然后通过计算机重构出样品的三维结构。
3、本实验中微丝的荧光观察采用荧光素标记的鬼笔环肽(phalloidin),鬼笔环肽可以专一的结合在聚合状态的肌动蛋白丝上,起到稳定微丝的作用。
细胞核的观察用DAPI(diamidino-2-phenylindole)染色。
DAPI 能与DNA双螺旋的凹槽部分相互作用,从而与DNA双链紧密结合。
结合后产生的荧光基团的吸收峰358nm,而散射峰是461nm。
而植物细胞的花粉管、筛板和胞间连丝含有胼胝质成分,经苯胺蓝染色后,用紫外光激发,可以发出黄绿色荧光。
4、激光共聚焦扫描显微镜(laser scanning confocal microscope,LSCM)原理:用激光作扫描光源,逐点、逐行、逐面快速扫描成像,扫描的激光与荧光收集共用一个物镜,物镜的焦点即扫描激光的聚焦点,也是瞬时成像的物点。
考马斯亮蓝法显示细胞中的微丝课件

通过对染色结果的观察和分析, 发现微丝在细胞中的分布和形态 具有组织特异性,与细胞的生理
功能密切相关。
对未来研究的建议
进一步探讨考马斯亮蓝法染色显示细 胞中微丝的机制,以及染色效果的影 响因素,为该方法的优化和应用提供 理论依据。
深入研究微丝在细胞中的功能和作用 机制,以期为相关疾病的治疗和药物 研发提供新的思路和靶点。
微丝排列
分析微丝在细胞内的排列 情况,是否呈现有规律的 排列方式。
微丝交联
观察微丝之间是否存在交 联,交联的密度和形式如何。
数据分析与解 释
数据收集
收集不同实验条件下的染色结果 数据,包括染色效果、微丝形态、
排列和交联情况等。
数据分析
对收集到的数据进行分析,比较 不同实验条件下的染色效果和微
丝结构差异。
考马斯亮蓝法显示 细胞中的微丝课件
• 引言 • 实验原理 • 实验步骤 • 结果分析 • 结论 • 注意事项与局限性 • 参考文献
01
引言
微丝简介
微丝是一种由肌动蛋白聚合形成的纤维 状蛋白质结构,是细胞骨架的重要组成 部分。它们在细胞形态维持、细胞运动、 物质运输等许多细胞活动中发挥关键作
用。
样品制备
将培养的细胞进行固定,常用的 固定剂包括甲醇和冰醋酸,固定 后使用适宜的缓冲液洗涤细胞。
考马斯亮蓝染色
染色液配制
洗涤
将考马斯亮蓝加入适量的甲醇溶液中, 搅拌均匀后过滤,得到染色液。
染色完成后,使用缓冲液洗涤细胞样 品,去除多余的染色液。
染色过程
将固定和洗涤后的细胞样品加入染色 液中,染色时间根据实验需求而定, 一般为10-30分钟。
THANK YOU
感谢观看
Actin-Tracker-Green_微丝绿色荧光探针

产品编号 C1033
产品名称 Actin-Tracker Green(微丝绿色荧光探针)
包装 0.2ml
产品简介:
¾ Actin-Tracker Green是一种Actin绿色荧光探针,可以用于培养细胞或组织切片的Actin特异性荧光染色。 ¾ Actin-Tracker Green探针为荧光染料FITC标记的毒蕈肽(phalloidin),即phalloidin-FITC,其分子量约为1251.4,最大激发波
说明书
包装 存,一年有效。
注意事项:
¾ 为避免反复冻融,建议适当分装。 ¾ 对于微量的液体,每次使用前先离心数秒钟,使液体充分沉降到管底。 ¾ 荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。 ¾ 需自备盖玻片和载玻片(可以向碧云天订购)。 ¾ Phalloidin 有一定毒性(LD50 为2 mg/kg),1ml Actin-Tracker Green中的phalloidin少于0.01mg,使用时请注意适当防护。 ¾ 为了您的安全和健康,请穿实验服并戴一次性手套操作。
长为496nm,最大发射波长为516nm。 ¾ 本产品可以用于细胞或组织内的微丝(microfilament)的荧光检测。 ¾ 本产品使用时的推荐稀释比例为1:200。如果每个片子需要使用200µl染色工作液,每个包装的本产品足够用于200个片子
的染色。
包装清单:
产品编号
C1033 -
产品名称 Actin-Tracker Green
2. 对于活细胞的荧光染色: Phalloidin通常不具有细胞通透性,因此极少用于活细胞染色。但也有报道活细胞可被标记,可能是通过细胞的吞噬作用 进入了某些细胞。一般对于活细胞的染色需要更多的染料。
动物细胞微丝观察教学实验的设计与探索

动物细胞微丝观察教学实验的设计与探索引言:细胞是构成生物体的基本单位,细胞内的微观结构对生物体的功能有着重要影响。
微丝是细胞骨架的重要组成部分,对细胞形态和运动起着关键作用。
本实验旨在通过显微镜观察动物细胞中的微丝,并通过对实验数据的分析,了解微丝的形态、分布和功能。
材料与仪器:1. 动物细胞样本:可以使用动物组织切片或培养的细胞。
2. 培养基和培养皿:用于培养细胞。
3. 显微镜:用于观察细胞。
4. 草酸乌洛托品:用于染色微丝。
实验步骤:1. 准备细胞样本:可选用已制备好的组织切片,或自行培养的细胞。
如果使用组织切片,将切片置于培养基中,保持湿润。
如果使用培养的细胞,将细胞培养在培养皿中,按照培养基的要求进行处理。
2. 固定和染色细胞:取一个组织切片或培养皿中的细胞样本,用4%的草酸乌洛托品固定细胞,保持10分钟。
然后用磷酸缓冲溶液(pH=7.4)冲洗细胞片3次,每次5分钟。
3. 观察和记录:将固定后的细胞样本放置于显微镜下,使用透射光学镜头观察细胞。
使用不同倍数的镜头,观察细胞的整体形态和细胞器的分布情况。
在观察过程中,特别注意微丝的形态和分布,并记录下自己的观察结果。
结果与讨论:1. 结果:根据观察,记录下细胞的形态和细胞器的分布情况。
特别关注微丝的形态和分布,记录下微丝的长度、数量和排列方式。
2. 讨论:根据观察结果进行讨论,比较不同细胞中微丝的差异,分析微丝在细胞内的功能和作用。
可以探究微丝在细胞运动、细胞分裂和细胞内物质运输中的重要性。
改进与应用:1. 改进:实验中可以将不同类型的细胞进行比较,观察微丝的差异。
也可以进行药物处理实验,观察不同药物对微丝的影响。
可以使用免疫荧光染色等技术,对微丝进行具体标记,进一步深入研究微丝的功能和作用。
2. 应用:微丝是细胞运动和形态稳定的关键组成部分,对细胞的功能和病理状态具有重要影响。
通过这个实验,可以更好地了解微丝的形态和分布,进而研究微丝与细胞功能和疾病的关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
荧光微丝显示技术测量对流层空气流场
一、试验设计原理
1 、荧光微丝是一种含有荧光物质的尼龙丝或涤纶丝,在紫外光(波长为3370~3650 )照射下,能产生明显的可见荧光。
这样,本来细到难以识辨的微丝现在变成了很亮的可见“光”线。
其“光”线直径与原来的物理直径相比明显的增加了,因此便于观察与照相记录。
由于微丝内含有不同的荧光物质,所以它可以显示出不同的颜色,例如蓝色、黄绿色、绿色等。
微丝本身的尺度很小,其直径约为0.01~0.02毫米,重量极轻,一根1米长的微丝仅重0.05毫克,所以它可以像空气中的尘埃一样飘浮在空气中,跟随其流运动以此显示其流的绕流形态。
由于荧光与其它可见光(日光、灯光)相比,他的亮度是较弱的,因此为了便于观察和照相记录,要求实验是具有比较黑暗的实验条件。
例如在白天实验时,可以拉上黑色窗帘。
当进行观察或摄影时,其背景应呈现黑色,因此通常模型要涂以无光黑漆。
2 、对流层是地球大气层靠近地面的一层。
它同时是地球大气层里密度最高的一层,它蕴含了大气层约75%的质量,以及几乎所有的水蒸气及气溶胶。
在对流层内,按气流和天气现象分布的特点又可分为下层、中层和上层。
二试验设计方案
1、丝线的制成
常规丝线法的丝线较粗、对气流干扰较大,一定程度上影响试验结果的准确度和可靠性。
荧光微丝显示技术的丝线直径要足够小但又不能影响视觉观察和拍摄效果,这就对丝线的尺寸和荧光性提出了较高要求。
同时丝线要尽量柔软,才能对气流有较好的跟随性,能较真实反映流场气流流动。
参照文献[3, 4]选择直径及材质较适宜的丝线,如表 1所示。
通过反复对比各种颜色荧光粉的观察和拍摄效果,认为黄绿色荧光粉发出的荧光效果较好,因此选择黄绿色荧光粉将表 1所示的丝线制成荧光微丝。
表 1 多种类型荧光微丝的直径及材质
Table 1 The diameters and materials of various fluorescent mini-tufts 丝线编号S1-1 S1-2 S2-1 S2-2 S3-1 S3-2 S4-1 S4-2
直径/mm 0.24 0.24 0.15 0.15 0.10 0.10 0.04 0.04
材质棉涤纶棉涤纶棉涤纶棉涤纶
2、丝线的粘贴
粘贴前要对荧光微丝进行一些必要的处理:利用柔软剂对丝线进行柔化处理,进一步增强丝线的柔软度,并能使丝线表面变得更加顺滑,减少出现抽丝及相邻丝线相互缠绕的情况;通过抗静电处理,防止试验中丝线与气流摩擦时产生静电,避免丝线相互吸附或吸附于模型表面。
3 、粘贴技术
试验模型表面通常较光洁,而固体粘贴剂和液体粘贴剂极易影响模型表面的粗糙度甚至改变模型的局部外形。
经过大量的试验尝试,最终采用特制的厚度仅为10μm、宽度为10mm的超薄胶带粘贴丝线,其表面光洁度与模型表面基本一致,能够较好保持模型的表面精度,且由于其厚度远小于边界层厚度,对流场的影响可以忽略。
4、光源
利用紫外光源照射丝线发出荧光,要求紫外线波长与丝线所含的荧光物质的吸收波峰相匹配。
研究表明荧光物质在长波紫外线(波长为320~400nm)照射下会发出一定的可见光,其中波长为365和395nm紫外光所产生的荧光效果较其它更明显。
通过表 2中几种不同的紫外线灯,研究主波长及功率对荧光效果的影响。
5、拍摄技术
为增强拍摄效果,使用高清数码相机和高清数码录像机进行流场显示的拍摄,研究各项参数对拍摄效果的影响。
由于紫外光源发出的光线中含有较多的紫光,会对现场荧光加以遮饰,所以首先要调节色温过滤大量的紫光,光圈、曝光时间等要根据具体试验条件及所观察流动状态确定。
周围环境不宜太亮以免影响观察和记录,拍摄时关掉洞内照明灯,并用遮光布阻挡洞外可见光的进入。
6、将制作好的荧光微丝放在气象塔上,测量对流层的空气流场,并做记录。
三、实验误差分析
1、荧光微丝制作没有达到要求,导致误差。
2、拍摄时,周围环境的影响导致误差。
四、结论
进行了荧光微丝法测量对流层空气的流场,包括丝线的制作、粘贴方法的研究、光源的选择、照相摄像的方法等。
五、参考文献
[1]惠增宏,侯金玉,邓磊等.荧光微丝在低速风洞试验中应用的关键技术研究[J].实验流体力学,2015,(1):92-96.DOI:10.11729/syltlx20130117.
[2]范洁川.流动显示技术的若干现状与发展[J].气动试验与测量控制,1995,9 (1)1017.[3]徐晋,谢品华,司福祺等.利用多轴差分吸收光谱技术反演对流层NO2[J].光谱学与光谱分析,2010,30(9):2464-2469.DOI:10.3964/j.issn.1000-0593(2010)09-2464-06.
[4]吴根兴,汪子兴.观察物体表面附近流谱的新方法———萤光微丝法[J].南京航空航天大学学报19804:102110.
[5]汪子兴,吴根兴.萤光微丝法—观察物体表面附近流谱的新方
法[J].力学与实践,1982,2:55 58.。
