温度对胶原蛋白结构影响的二维红外相关光谱的研究
温度对β-胡萝卜素二维相关红外光谱的影响

温度对β-胡萝卜素二维相关红外光谱的影响卢明倩;黄桂媛;王巧贞;许超;黄庶识【摘要】Abtract:[Objective]The aim of this study is to analyze the interaction between the different groups ofβ-carotene in the heating process.[Methods]Two-dimensional correlation spectrosco-py was applied to study the dynamic spectral changes ofβ-carotene from 30℃ to 100℃.[Re-sults]The changes of absorption characteristic peaks ofβ-carotene were inconspicuous in the conventional FTIR spectra and second derivative FTIR spectra during 30℃ to 100℃,which in-dicated that they had no oxidation reation.Two-dimensional correlation analysis showed that the changes of absorption peaks at 968 cm-1 ,1 442 cm-1 ,2 9 6 6 cm-1 and 3 0 1 2 cm-1 were more sen-sitive to temperature.Meanwhile,the order of different groups changes induced by temperature were as follows:the spectral changes of methyl-ene were faster than methyl,the spectral changes of methyl C-H symmetric stretching vibration in low wavenumber were faster than methyl anti-symmetric stretching vibration in high wavenumber,and olefin hydrocarbon symmetric stretching vibration were prior to olefin hydrocarbon anti-symmetric stretching vibration.[Con-clusion]This provides experimental basis for the mechanism of the conformational change ofβ-carotene in heating process.%【目的】了解在升温过程中β-胡萝卜素分子内不同基团之间的相互影响。
二维红外光谱

二维红外光谱
二维红外光谱(2D IR spectroscopy)是一种用于分析化学体系中分子间相互作用的新型光谱技术。
它为研究特定分子组成的分子组合体(例如蛋白质)提供了全新的思路,能够更快、更准确地显示出蛋白质内部的结构特征和功能信息。
二维红外光谱是一种在光谱分析中应用非常广泛的技术,可以用来对大分子的结构进行精确分析。
它通过测量分子频率和强度之间的关系,来揭示大分子结构的信息,从而帮助科学家们更好地理解大分子的内部结构。
二维红外光谱所涉及到的原理主要是红外振动,它是由分子中的键和受力点的振动所引起的。
当分子被一个外部的电磁场所作用时,它将会产生一种称为“红外振动”的效应,即分子中的原子根据电磁场的作用,在各自的方向上产生振动。
该振动有一个固定的频率,而这个频率是由分子结构所决定的,因此,通过测量红外振动的频率,就可以获得分子结构的信息。
二维红外光谱也可以称为“时域分辨红外光谱”,它可以用来实现对大分子结构的连续测量,其基本原理是:利用一个相关的激光场,在两个不同的时间点上测量红外振动的强度,从而实现对大分子的连续测量。
二维红外光谱的应用非常广泛,它可以用来研究大分子的结构特征,以及分子之间的相互作用,还可以用来研究蛋白质的结构,从而有助于更好地了解蛋白质内部的结构特征和功能信息。
此外,这种技术还可以用来研究其它大分子的结构,例如核酸分子,以及大分子复合体,这有助于更好地理解这些分子的结构和功能,从而有助于研究许多生物体系。
总之,二维红外光谱是一种研究大分子结构和功能的重要工具,可以用来实现对大分子的精确测量,从而有助于更好地理解蛋白质和其他大分子的结构和功能。
二维红外相关光谱研究温度对卵转铁蛋白构象的影响

Fi. FRE s e ta o oO v ta s e rn ( )a d Ho o4 v - g1 I p c r fAp - o r n f r i a n l-) o R
ta sern ( )rc r e tro tmp r tr ( 5 ℃ ) rn fri b eo dd a om e ea u e2
S 强; 中等; 弱; 伸缩振动; 弯曲振动 : m: w: : :
( 旷螺旋上的 S r2 ) e12 之间存在分子 内 0…H…( 氢键 。因此 , )
1 8 72
光谱学 与光谱分析
第 3 2卷
卵转铁 蛋 白结合 铁后 结合 位点 处的氢键变化 可能是 引起蛋 白 整体构象变化和氢键作用变化的关键点 。 图 3中无 铁 卵转 铁 蛋 白和 饱 和铁 卵转 铁蛋 白在 16 5 5 c m 处的酰胺 I带和15 5c 4 m 处 的酰胺 Ⅱ带的吸收强度都 随着温度的升高而降低 , 并且发 生了明显 的峰位移 动 , 无铁
二维红外相关图谱使 用 2 -oh D P ca软件进 行相关 处理 得 到 。 中非 阴影 部分 为 正相 关 区域 ,阴影部 分 为 负相 关 区 其
域 。由于同步和异步谱 图中存在对称 和反对 称的关 系,故仅 讨论谱 图左上角 区域 。 二维红外相 关光谱 的读谱规 则 , 阅 参
文 献 1 l 4 。 ,
1 实验部分
1 1 材 料 与 仪 器 .
无铁 卵转铁蛋 白( oO f根据 文献 [5 制备 ,凝胶分 Ap- T ) 13 析软件( l r n lzr分析纯度为 9 . 6 。 Ge poa aye) - 5 5
红外光谱法研究温度变化对卵粘蛋白构象的影响

1 实验 部 分
1 1 试 剂与仪 器 .
K r光谱 纯 ) 自 Sg 公 司 ; 国 Ncl 公 司 N xs 7 B( 购 i ma 美 i e ot eu一 0型 红外 光谱 仪 ; 国耐 弛公 司 24F 8 德 0 1
收 稿 日期 : 0 11—2 2 1 —21 .
பைடு நூலகம்
基金项 目: 国家 自 然科学基金( 准号 : 】O 30 和现代农业产业技术体系专项基金 ( 批 3 11 ) 2 批准号 : A S 1 2 ) C R - . 3 资助 4 K
物质 传递 等都 与卵粘 蛋 白等细胞 外 间质密 切相关 】 .研究 认 为 , 胚蛋 发 育 的过程 中 ,卯粘 蛋 白等 细 在 胞外 问质作 为重要 的“ 理缓 冲池 ” 对 胚胎 的热平 衡发挥 着重 要 的调节作 用 , 生 , 而基 于 热效 应 的各 种 处
理也 作 用于粘 蛋 白等 , 并通 过这 些介质 发挥 作用 .同时 卵粘 蛋 白分 子具 有 特 殊 的超 分 子结 构 , 之 成 使 为研 究 生物 功能材 料 的理想 原料 .由于温度 是 影 响作 为仿 生 材 料 的卵 粘蛋 白变 性 的一 个关 键 因素 , 因此研 究温 度变 化对 卵粘蛋 白构 象 的影 响具 有重要 的理 论意 义和应 用价 值 . 目前 , 于蛋 白质构 象研 究 的主要 方法 有 紫外 光 谱 、 光 光 谱 、红外 光 谱 、 曼 光 谱 、圆 二 色光 用 荧 拉
蛋白分子结构 动态 变化 的微 观信息 , 为揭示变温微扰引起 的蛋 白构象变化机理提供 了初步 的理论依据. 关键词 卵粘蛋 白; 温度 ; 里叶变换红外光谱 ; 傅 二维相关分析
0 5 .3 6 7 3 文献标识码 A D I 1 .99 ji n0 5 - 9 .0 20 . 1 O : 0 36 /. s.2 10 0 2 1 .9 O3 s 7 中图 分 类 号
二维红外相关光谱法研究温度对交联胶原结构的影响

关键 词 交联 胶原 ; 二维红外相关光谱法 ; 构象变化
中 图 分 类 号 : 4 . 064 1 文献标识码 : A D :1 .9 4 i n 10—5 3 2 1 )61 0—7 OI 0 3 6 ̄.s .0 00 9 (0 2 0 —500 s
c m 。
研 究胶 原结构随温度升高的变化有 十分重要 的现 实意义 。常
用 傅里叶红外光 谱技术 (Tl 和二维 ( orl i a s F R) C re t nAn l i ao ys 2 红外相关分 析方 法( D I 来研 究温 度对蛋 白质 结构 的 D) 2- R)
影 响【。】 ” 。钟朝辉等采用 F R研究 温度对鱼鳞 胶原二 级 TI
胶原溶液冷冻 干燥成海 绵 。取微量 ( 1mg 胶原海 绵与 溴 约 ) 化钾 ( i 0mg 混合 , 约 0 ) 研磨成粉末后进行压片制样 , 品装 样 入变温 附件 中,温度从 2 5~15℃每间隔 1 3 o℃采用红外 光 谱仪 ( e sr 7 国 B u e 公 ) T no 德 2 rk r 获得 红外光谱 图。扫描 信 号累计 3 2次 ,光 谱分 辨 率 4c m
第3 卷, 6 2 第 期
20 12 年 6 月
光
谱
学
与
光
谱
分
析
V 1 2 N . ,p5 010 o 3 , o6p l0 —56 .
J n ,2 1 ue 02
S eto c p n p cr lAn lss p cr so y a d S eta ay i
二 维 红外 相关 光 谱 法研 究温 度对 交联胶 原 结构 的影 响
稳定性差 、降解速率过快和机械强度 低等缺 点f , 常采用 4 通 ]
温度对近红外光谱分析的影响研究

温度对近红外光谱分析的影响研究近红外光谱分析是一种非破坏性的技术,可以用于材料、食品、药品、环境等领域的质量控制和分析。
然而,在进行近红外光谱分析时,温度可能会对结果产生影响。
本文将对温度对近红外光谱分析的影响进行研究和分析。
首先,温度对近红外光谱的影响主要体现在两个方面。
第一,温度变化会产生热胀冷缩的效应,导致光学元件的尺寸变化。
由于近红外光谱分析需要稳定的光学路径和光源,光学元件的尺寸变化可能会导致信号强度的变化,进而影响光谱的质量。
第二,温度的变化可能会引起样品的物理或化学变化,从而影响近红外光谱的谱图特征。
例如,某些样品在高温下可能发生热解、失水或发生化学反应,导致光谱发生变化。
为了研究温度对近红外光谱分析的影响,一种常见的方法是通过温控设备控制样品的温度,并记录光谱数据。
然后,分析数据,评估温度对光谱的影响,并找出解决方案来减小温度对光谱分析结果的影响。
研究表明,在样品进行近红外光谱分析时,温度的变化可能导致信号强度的变化。
这是因为温度会影响吸收、散射和透射光的衰减程度。
一些物质在高温下可能发生吸收能量的现象,导致信号强度的减小。
此外,在高温下,样品可能发生物理或化学变化,使光谱发生形状、峰位或峰宽的变化。
因此,在进行近红外光谱分析时,必须考虑样品的温度对光谱信号的影响,并进行相应的校正和补偿。
为了减小温度对近红外光谱分析结果的影响,可以采取一些措施。
首先,可以使用温控设备来控制样品的温度,确保温度的稳定性。
其次,可以根据样品的特性进行校正和补偿。
例如,可以制备一系列温度下的标准样品,并对这些样品进行近红外光谱分析,建立温度对样品光谱的影响模型。
通过该模型,可以对实际样品的光谱数据进行校正和补偿,以消除温度对光谱的影响。
此外,在进行近红外光谱分析时,还可以进行多次重复测量,并取平均值,以减小温度波动对结果的影响。
除了温度对近红外光谱分析结果的影响外,温度还可能对仪器本身产生影响。
例如,温度变化可能导致光纤的弯曲、光源的稳定性变差,进而影响光谱仪的工作性能。
温度对胶原结构的影响(二维红外)
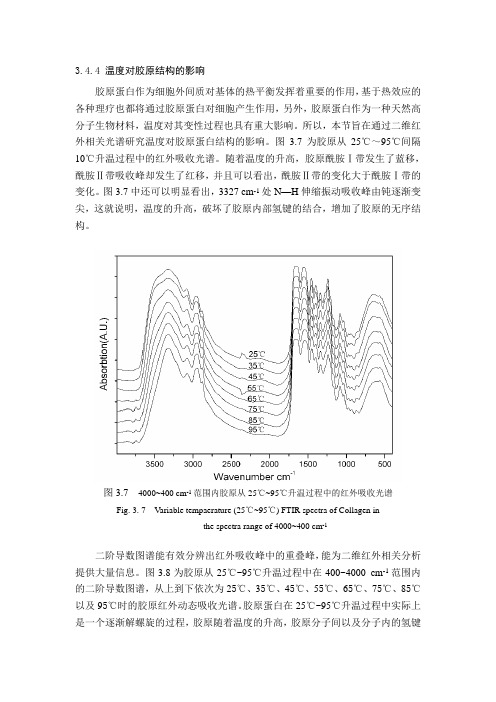
3.4.4 温度对胶原结构的影响胶原蛋白作为细胞外间质对基体的热平衡发挥着重要的作用,基于热效应的各种理疗也都将通过胶原蛋白对细胞产生作用,另外,胶原蛋白作为一种天然高分子生物材料,温度对其变性过程也具有重大影响。
所以,本节旨在通过二维红外相关光谱研究温度对胶原蛋白结构的影响。
图3.7为胶原从25℃~95℃间隔10℃升温过程中的红外吸收光谱。
随着温度的升高,胶原酰胺Ⅰ带发生了蓝移,酰胺Ⅱ带吸收峰却发生了红移,并且可以看出,酰胺Ⅱ带的变化大于酰胺Ⅰ带的变化。
图3.7中还可以明显看出,3327 cm-1处N—H伸缩振动吸收峰由钝逐渐变尖,这就说明,温度的升高,破坏了胶原内部氢键的结合,增加了胶原的无序结构。
图3.7 4000~400 cm-1范围内胶原从25℃~95℃升温过程中的红外吸收光谱Fig. 3. 7 Variable tempaerature (25℃~95℃) FTIR spectra of Collagen inthe spectra range of 4000~400 cm-1二阶导数图谱能有效分辨出红外吸收峰中的重叠峰,能为二维红外相关分析提供大量信息。
图3.8为胶原从25℃~95℃升温过程中在400~4000 cm-1范围内的二阶导数图谱,从上到下依次为25℃、35℃、45℃、55℃、65℃、75℃、85℃以及95℃时的胶原红外动态吸收光谱。
胶原蛋白在25℃~95℃升温过程中实际上是一个逐渐解螺旋的过程,胶原随着温度的升高,胶原分子间以及分子内的氢键被逐渐削弱,三股螺旋结构和肽链转角结构逐渐减少,而其伸展肽链及无序结构却增多。
1694 cm-1、1524 cm-1、1241 cm-1为胶原胶原蛋白酰胺带的吸收峰,它们代表的是胶原分子间及分子内氢键结构,如图3.8所示,随着温度的升高,1694 cm-1、1524 cm-1处吸收峰都逐渐减弱甚至消失,同时1241 cm-1处吸收峰也发生了蓝移,这无疑说明了胶原在升温过程中,其氢键结构在逐渐减少。
二维红外相关光谱的研究和应用

二维红外相关光谱的研究和应用李丹;苏晓声;孟运东;张艳华;王小兵;张驰【摘要】对一维红外光谱存在的问题进行了分析,对二维红外光谱的概念的提出和发展、原理及实验方法、性质及解释规则、相关特点、分析设备和软件、样品及数据处理要求等进行了综述,并采用红外光谱结合二维相关分析技术,对添加不同固化促进剂的环氧树脂配方进行了快速鉴别研究。
研究结果表明,二者在一维红外光谱图上没有差别,但是它们的二维红外相关谱图却存在明显的差异。
在4000cm-1-2500cm-1和1600cm-1-730cm-1两个区域的同步和异步光谱进行研究后发现,配方B有甲基自动峰的出现,而配方A则无;因此,二维相关红外光谱可以用于揭示树脂聚合反应过程中的高分子链段内不同基团的变化规律和相互作用,并用于一维红外谱图无差别的树脂的鉴别。
%A practicable and efficient method for identification of different epoxy formations with different curing accelerator was conducted by Fourier transform infrared spectroscopy(FTIR) combined with two-dimensional correlation spectroscopy(2D) technique. The two resin formulations tested were similar to each other in one-dimensional IR spectra but quite different in 2D-FTIR spectra. An investigation on 2D FTIR synchronous and asynchronous spectra disclosed that in the range of 4000 cm-1~2500cm-1 and 1600 cm-1~730cm-1, methyl auto-peak appears in the synchronous spectrum of formulation B, while not in the formulation A;The results proved that 2D correlation spectra could enhance the resolution of infrared spectra and increase the capability of identification, which make it a powerful and new approach to identifying different resins.【期刊名称】《印制电路信息》【年(卷),期】2013(000)004【总页数】7页(P58-64)【关键词】二维红外相关光谱;同步相关谱;异步相关谱;聚合反应;固化促进剂;环氧树脂;鉴别【作者】李丹;苏晓声;孟运东;张艳华;王小兵;张驰【作者单位】广东生益科技股份有限公司国家电子电路基材工程技术研究中心,广东东莞 523808;广东生益科技股份有限公司国家电子电路基材工程技术研究中心,广东东莞 523808;广东生益科技股份有限公司国家电子电路基材工程技术研究中心,广东东莞 523808;广东生益科技股份有限公司国家电子电路基材工程技术研究中心,广东东莞 523808;广东生益科技股份有限公司国家电子电路基材工程技术研究中心,广东东莞 523808;西南科技大学,四川绵阳 621010【正文语种】中文【中图分类】TN411 引言在人们对环氧树脂研究不断深入的过程中,研究者越来越清晰的意识到研究必须拓展到微观层面,只有深入分析反应过程各种化合物之间、高分子链段内不同基团之间的相互作用,才能对宏观物理现象、产品的性能和质量做出合理而明确的解释。
圆二色和拉曼光谱法分析Ⅰ型胶原蛋白二级结构及热变性

ISSN1006-7167CN31-1707/TRESEARCHANDEXPLORATIONINLABORATORY第40卷第5期 Vol.40No.52021年5月May2021 DOI:10.19927/j.cnki.syyt.2021.05.008圆二色和拉曼光谱法分析Ⅰ型胶原蛋白二级结构及热变性程 红, 王 玲(华中科技大学分析测试中心,武汉430074)摘 要:选用圆二色和拉曼光谱对一种Ⅰ型胶原蛋白的溶液态和固态进行二级结构分析,并分别观察二级结构随温度所发生的改变(即热变性)。
结果表明,圆二色光谱法测试Ⅰ型胶原蛋白溶液态的变性温度约为40℃。
在温度低于40℃时,胶原特有的P2结构随温度升高而降低,三螺旋结构被逐步破坏;拉曼光谱法测试固态即胶原蛋白海绵的变性温度约为200℃,与样品的差热分析结果基本一致。
该工作可作为胶原蛋白相关研究的实验提供参考。
关键词:Ⅰ型胶原蛋白;圆二色;拉曼光谱;二级结构;热变性中图分类号:Q781 文献标志码:A 文章编号:1006-7167(2021)05-0031-05AnalysisoftheSecondaryStructureandThermalDenaturationofTypeICollagenbyCDandRamanSpectroscopyCHENGHong, WANGLing(AnalyticalandTestingCenter,HuazhongUniversityofScienceandTechnology,Wuhan430074,China)Abstract:Twopowerfulspectraltechniques,circulardichroismandRamanspectroscopy,wereselectedtoanalyzethesecondarystructureofatypeIcollageninsolutionandsolidstate,andthechangeofsecondarystructurewithtemperaturewasobserved,whichiscalledthermaldenaturation.TheexperimentdeterminedthatthedenaturationtemperatureofcollagentypeIinsolutionisabout40℃,whenthetemperatureislowerthan40℃,theP2structureofcollagendecreaseswiththeincreaseoftemperatureandthetriplehelixstructureisgraduallydestroyed.Thedenaturationtemperatureofsolidcollagenspongeisabout200℃,whichisconsistentwiththeresultsofdifferentialthermalanalysis.Thisworkcanbeusedasanexperimentalguideandaprotocolforcollagenrelatedresearch.Keywords:typeⅠcollagen;circulardichroism;Ramanspectroscopy;secondarystructure;thermaldenaturation收稿日期:2020 09 27基金项目:国家自然科学基金项目(81773160);华中科技大学实验技术研究项目(0134505006)作者简介:程 红(1976-),女,湖北天门人,高级工程师,主要从事光谱仪器分析。
二维相关红外光谱研究再生蚕丝蛋白膜的构象与温度之间的关系

2004年第62卷第21期,2127~2130化学学报ACT A CHIMICA SINICAV ol.62,2004N o.21,2127~2130・研究通讯・二维相关红外光谱研究再生蚕丝蛋白膜的构象与温度之间的关系彭显能 陈 新 武培怡 邵正中ΞΞ(复旦大学高分子科学系 教育部聚合物分子工程重点实验室 上海200433)摘要 通过二维相关红外光谱,研究了再生蚕丝蛋白膜的构象及其转变与温度之间的关系.实验结果表明,将样品从130℃升温到220℃、或在180℃的恒温过程中,丝素蛋白分子链的构象会发生变化,且不同构象对温度升高过程或180℃恒温过程响应的顺序是无规线团变化先于β2折叠、α2螺旋的形成.关键词 二维相关红外光谱,桑蚕,丝蛋白,薄膜I nvestigation on the Conformation Transition of R egenerated Silk Fibroin Filmsunder Thermal Treatment by tw o 2dimensional (2D)correlation FT 2IR spectroscopyPE NG,X ian 2Neng CHE N ,X in W U ,Pei 2Y i SH AO ,Zheng 2Zhong Ξ(Department o f Macromolecular Science ,The K ey Laboratory o f Molecular Engineering o f Polymer s ,Fudan Univer sity ,Shanghai 200433)Abstract With the advantage of tw o 2dimensional (2D )correlation FT 2IR spectroscopy ,the con formation transition of regenerated silk fibroin film was studied under thermal treatment.The results showed that the con formation changed when the film was heated from 130to 220℃as well as maintained at 180℃for different time courses.It was als o found that the con formation response order was random coil prior to β2sheet and α2helix.K eyw ords tw o 2dimensional correlation FTIR spectroscopy ,Bombyx mori ,silk protein ,film 桑蚕(Bombyx mori )丝蛋白,包括蚕丝纤维,再生丝蛋白,以及直接从蚕腺体中得到的丝蛋白,前人有过不少研究[1~4].由于一些物理或化学的因素例如甲醇浸泡、加热等可以导致丝蛋白分子链发生构象转变[5,6],为此人们采用了各种测试手段对其进行了深入的研究.其中,红外光谱因其简单实用,是最早也是最常用的研究蛋白结构包括丝蛋白结构的方法[2,5~8].我们的研究小组也曾利用红外光谱,研究了丝蛋白的三种主要二级结构:即无规线团,螺旋结构和β2折叠,以及其他一些结构,例如转角和弯曲之间的相互转变[9~12].但是,由于技术和理论上的局限性,丝蛋白构象转变过程中的一些重要问题仍未能弄清,如宏观上以无规构象为主的丝腺体中的丝蛋白,可以在较温和的条件下转变成以β2折叠构象为主的丝纤维,但在此过程中是先形成β2折叠还是无规的丝蛋白先发生变化却不甚明确.在本研究中,我们利用二维相关傅立叶变换红外光谱研究再生蚕丝蛋白膜中分子链的构象变化与温度之间的关系,以期对丝蛋白的构象变化过程进行深入了解.N oda [13]在1986年首次将二维相关的技术引入红外光谱,1993年,他又把二维相关光谱的概念推广到了广义二维相关光谱[14],即从红外光谱推广到了拉曼,近红外,以及荧光光谱等.二维相关光谱有两个主要的优势:第一,它比一维光谱有更高的分辨率;第二,它能区分不同基团对外界刺激的响应顺序,从而在峰位归属上有着重要的用途.对于再生蚕丝蛋白膜而言,由于构象的改变需要能量,因此,如果对丝蛋白膜进行加热,其构象转变就有可能发生[15].由于二维相关红外光谱可以区分在这个过程中不同结构的响应顺序,从而这种新技术在传统的峰位归属之外,还能给我们提供许多独特的有用信息.ΞE 2mail :zzshao @Received April 12,2004;revised June 5,2004;accepted July 7,2004.国家自然科学基金(N os.50373006,20244005,20274010,20221402)、教育部优秀青年教师资助计划项目.1 实验部分1.1 材料准备B.mori蚕丝(废丝)首先在浓度为w=1%的Na2CO3溶液中煮沸1h左右,去除丝胶,用清水冲洗3次,60℃下烘干后,50℃下溶解于9m ol/L的LiBr溶液,得到再生丝蛋白盐溶液.盐溶液用去离子水流动透析3d去除离子,得到再生丝蛋白水溶液(w=3%).将一定量的丝蛋白水溶液浇铸在3 cm×3cm聚苯乙烯塑料盒内,室温(25℃,50%相对湿度)下干燥成膜(约需24h).再生丝蛋白膜厚约为5μm,丝蛋白膜样品放置在干燥器中备用.1.2 红外光谱测试采用Therm o2Nicolet Nexus2479傅立叶变换红外光谱仪测定,测试中采用32次扫描叠加,分辨率为4cm-1.再生丝蛋白膜被夹于两片NaCl盐片中间,并固定在一热台附件上.热电偶连接在热台上以控制样品的温度.为去除水份可能带来的影响以及避免丝蛋白分子链大范围的热分解,实验温度选定在100至230℃.两个系列的实验分别为:其一,选择130至220℃温度区间,每间隔10℃测量一次光谱图,在每一测量温度上的平衡时间为5min.其二,将再生丝蛋白膜恒温在180℃下,检测丝蛋白分子的构象在一定温度下随着时间的变化,每分钟测定一次光谱.1.3 二维红外光谱的相关运算使用2D P ocha软件(由日本K wansei G akuin大学Daisuke Adachi所编写)进行相关运算,得到二维红外相关图[16].在图中,非阴影部分是正相关的区域,阴影部分是负相关的区域.无论是在同步还是异步谱图中,由于存在对称或反对称的关系,故仅讨论左上角区域.关于二维相关光谱的基本概念,可以参阅参考文献[17,18],本文将在结果与讨论中稍作阐述.2 结果与讨论2.1 丝蛋白二级结构的红外光谱研究再生蚕丝蛋白膜在逐级升温过程中其红外图谱列于图1;而图2则显示了其在180℃下随时间的变化.由于我们希望了解丝蛋白的构象与温度之间的关系,而丝蛋白的红外光谱中酰胺Ⅰ区域的信号最强烈,因此我们的实验仅选取酰胺Ⅰ区域进行讨论.对于酰胺Ⅰ区域,丝蛋白红外谱图中各峰位的归属比较清晰:1630,1650,1660cm-1附近的特征峰分别对应于β2折叠,无规线团和α2螺旋结构[2,6~12].从图1中我们可以发现,在酰胺Ⅰ区域内,蚕丝蛋白膜的红外吸收随温度的升高而变化,具体表现在各个峰位存在着一定的微小位移,峰的相对强度也有渐进式的增强或减小.由此我们认为,在我们的实验条件下,再生丝素蛋白膜中蛋白质分子链的构象在一定程度上发生了转变.我们选定一个温度180℃(温度太低变化太微弱,温度太高则氧化太快),观察丝蛋白膜的红外光谱随温度的变化.为了清楚地展示光谱的细微变化,图2中显示的谱图是在每分钟一次红外测试得到的光谱之中等间隔(5min)选取的一些谱图,而且经过纵向位移.我们发现,丝蛋白膜的红外吸收在高温下也随加温时间发生改变,如逐级升温中看到的一样,这种改变非常微弱,甚至比前者更小.由于一维红外谱图所给出的丝蛋白分子链构象与温度之间的关系不甚清晰明了,因此我们运用二维红外相关光谱技术对其进行处理,以期获得更多的有用信息.图1 不同温度下(130~220℃)蚕丝蛋白膜的红外光谱图Figure1 FT2IR spectra of silk fibroin film as temperature increased from130to220℃图2 蚕丝蛋白膜在180℃恒温的条件下红外光谱随时间的变化(0~60min)Figure2 FT2IR spectra of silk fibroin film as temperature maintained at180℃2.2 蚕丝蛋白膜的二维相关红外光谱在二维红外光谱中,同步相关光谱是关于主对角线对称的.谱图上的峰Ψ(ν1,ν2)有两种:在主对角线位置(ν1=ν2)处的一组峰称为自动峰(autopeak).自动峰总是正峰,它们代表吸收谱带对一定微扰影响的敏感程度.位于非主对角线的峰称为交叉峰(crosspeak),通常代表两个吸收峰位有同向或异向的变化(以正或负峰分别表示)[17,18].8212 化学学报V ol.62,2004图3 从130~220℃升温过程中丝蛋白膜的二维相关红外光谱(a )—同步谱,(b )—异步谱.非阴影等高区为正峰;阴影等高区为负峰Figure 3 2D correlation FT 2IR spectra of silk fibroin film as temperature increased from 130to 220℃(a )—Synchronous spectrum ,(b )—Asynchronous spectrum.The unshaded regions are defined as the positive correlation intensities ,whereas shaded regions are defined as negativeones图4 180℃下丝蛋白膜随时间变化(0~60min )的二维相关红外光谱(a )—同步谱,(b )—异步谱.正、负峰的表示同图3Figure 4 2D correlation FT 2IR spectra of silk fibroin film as temperature maintained at 180℃(a )—Synchronous spectrum ,(b )—Asynchronous spectrum.The positive and negative correlations are the same as those defined in Figure 3 由图3(a )中可见,在从130~220℃的逐级升温过程中,丝蛋白膜的同步二维相关红外光谱有两个自动峰:1650,1720cm -1,前者代表了酰胺Ⅰ区的无规线团结构峰,而后者可能是由于热氧化降解而产生的非酰胺C O 双键振动峰[19].我们发现1650和1720cm -1负相关,这一现象可以被解释为,随着实验温度的升高,丝蛋白膜中的无规线团结构不断减少,同时由于热氧化而产生的非酰胺羰基数量则随升温过程不断增加的缘故.同样的信息也可以从图4(a )中得到,在180℃下保持恒温的丝蛋白膜的同步二维相关红外光谱中,同样有两个自动峰:1650,1720cm -1,并且也是负相关的.在二维红外光谱中,异步相关光谱是对主对角线反对称9212N o.21彭显能等:二维相关红外光谱研究再生蚕丝蛋白膜的构象与温度之间的关系的,交叉峰Ψ(ν1,ν2)的符号正负给出了关于峰位ν1和ν2变化的顺序.根据N oda的理论,如果Ψ(ν1,ν2)是正的(主对角线上方),说明ν1是先于ν2变化(响应)的;反之,则说明ν1后于ν2变化(响应)[17,18].130~220℃逐级升温和180℃下恒温的丝蛋白膜的异步二维相关红外光谱见图3(b)和4(b).在图3(b)和图4(b)中主对角线的上方均可以清楚地看到,在~1650,1630cm-1出现了正交叉峰,而在1660,~1650cm-1处存在负交叉峰.由交叉峰的正负,我们可以得出如下的谱带响应顺序,即:~1650,1660cm-1;~1650,1630cm-1.此外,在图3(b)和图4(b)中我们还发现在1720,1660cm-1处出现了负交叉峰,并且在图3(b)中,还有另外一个清晰的负交叉峰[在图4(b)中也存在但不明显]出现在1720,1630cm-1,由于在同步谱图中这一区域是负峰,这里得到的响应顺序应该与谱图上读出来的刚好相反[14],因此得到谱带响应顺序为:1720,1660 cm-1;1720,1630cm-1.如前所述,1630cm-1对应于β2折叠结构,~1650cm-1是无规线团结构的特征位置,而1660 cm-1则表示α2螺旋结构,至于1720cm-1,应当是由于热氧化降解而产生的非酰胺C O双键振动峰[19],因此,我们推断,在升温或高温恒定的过程中,丝蛋白膜中的分子链无规线团构象以及氧化而产生的非酰胺C O结构的响应先于β2折叠和α2螺旋结构,即响应次序应该是:首先是无规线团的“崩溃”以及氧化过程的发生,然后才是β2折叠或α2螺旋结构的增加和完善.至于在图3(b)和图4(b)中出现在1750cm-1左右的交叉峰,我们认为可能是由于红外检测中基线的微小波动产生的或者是由于氧化产生的COOH基团所导致的[19].3 结论从130℃升温到220℃,以及在保持180℃的恒温过程中,再生丝素蛋白膜中分子链的构象将发生相应的变化,而其响应的顺序是无规线团先于β2折叠和α2螺旋结构.同时由于二维光谱的独特优势,通过变换测试的条件和手段,有可能进一步明确在升温情况下丝蛋白二级结构的变化和响应顺序,为丝蛋白在升温过程中构象转变的本质提供实验基础.R eferences1Zhang,H.;Mag oshi,J.;Becker,M.;Chen,J.2Y.;Matsunaga,R.J.Appl.Polym.Sci.2002,86,1817.2T retinnikov,O.N.;T amada,ngmuir2001,17,7406.3T anaka,T.;K obayashi,M.;Inoue,S.I.;Tsuda,H.;Mag oshi,J.J.Polym.Sci.B:Polym.Phys.2003,41, 274.4Mag oshi,J.;Mag oshi,Y.;Becker,M.A.;K ato,M.;Zhang,H.;T anaka,T.;Inoue,S.I.;Nakamura,S.Thermochim.Acta2000,352,165.5Tsukada,M.;G otoh,Y.;Nagura,M.;Minoura,N.;K asai, N.;Freddi,G.J.Polym.Sci.B:Polym.Phys.1994,32, 961.6Freddi,G.;M onti,P.;Nagura,M.;G otoh,Y.;Tsukada,M.J.Polym.Sci.B:Polym.Phys.1997,35,841.7S onoyama,M.;Nakano,K.Appl.Spectrosc.2000,54,968. 8S onoyama,M.;Miyazawa,M.;K atagiri,G.;Ishida,H.Appl.Spectrosc.1997,51,545.9Chen,X.;Shao,Z.2Z.;Marinkovic,N.S.;Miller,L.M.;Zhou,P.;Chance,M.R.Biophys.Chem.2001,89,25.10Chen,X.;K night, D.P.;Shao,Z.2Z.;V ollrath, F.Biochemistry2002,41,14944.11Chen,X.;Zhou,L.;Shao,Z.2Z.;Zhou,P.;K night,D.P.;V ollrath,F.Acta Chim.Sinica2003,61,625(in Chinese).(陈新,周丽,邵正中,周平,K night D.P.,V ollrath F.,化学学报,2003,61,625.)12Chen,X.;Shao,Z.Z.;K night,D.P.;V ollrath, F.Acta Chim.Sinica2002,60,2203(in Chinese).(陈新,邵正中,K night D.P.,V ollrath F.,化学学报,2002, 60,2203.)13N oda,I.Bull.Am.Phys.Soc.1986,31,520.14N oda,I.Appl.Spectrosc.1993,47,1329.15Nakamura,S.;Mag oshi,J.;Mag oshi,Y.In Silk Polymer s.Materials Science and Biotechnology,V ol.Symposium Series544, Eds.:K aplan,D.;Adams,W.W.;Farmer,B.;Viney,C., American Chemical S ociety,Washington,1994,pp.211~221. 16Shen,Y.;Wu,P.2Y.J.Phys.Chem.B2003,107,4224. 17N oda,I.;D owrey,A. E.;Marcott,C.;S tory,G.M.;Ozaki, Y.Appl.Spectrosc.2000,54,236.18Wang,Q.;Hu,X.2Y.Spectrosc.Spect.Anal.2000,20(2), 175(in Chinese).(王琪,胡鑫尧,光谱学与光谱分析,2000,20(2),175.) 19Li,R.2F.;Hu,X.2Z.Acta Polym.Sin.2000,(2),136(in Chinese).(李荣福,胡兴洲,高分子学报,2000,(2),136.)(A0404127 CHE NG,B.;ZHE NG,G. C.)0312 化学学报V ol.62,2004V ol.62,2004N o.21,Ⅰ~Ⅳ G raphical Abstract I nvestigation on the Conform ation T ransition ofR egenerated Silk Fibroin Films underTherm al T reatment by tw o 2dimensional (2D)correlation FT 2IR spectroscopyPE NG,X ian 2Neng ;CHE N ,X in ;W U ,Pei 2Y i ;SH AO ,Zheng 2ZhongActa Chimica Sinica 2004,62(21),2127Fromtheasynchronoustw o 2dimensionalcorrelation FTIR spectrum of silk fibroin film as temperature increased from 130to 220℃,we could find several peaks ,which showed the response order of the different con formation ofsilk fibroin.P arallelization of MRCI ProgramS UO ,Bing ;ZH AI ,G ao 2H ong ;W ANG,Y u 2Bin ;WE N ,Zhen 2Y i ;H U ,X iang 2Qian ;LI ,Le 2MinActa Chimica Sinica 2004,62(21),2131Parallel performance of the MRCI program on Linux W orkstation Cluster was tested throughtw o examples ,one is NSF with 83711668CFS and the other is C 4H 6with 51189722CFS.The speed up curves on 1,2,4,6and 8nodes were obtained.Adsorption for S Atom on Ni Low 2I ndex and (311)Step SurfaceDI AO ,Zhao 2Y u ;Y U ,Shuai 2Qin ;W ANG,Z e 2X in ;QI AO ,Qing 2AnActa Chimica Sinica 2004,62(21),2136The 52parameter M orse potential (for short 52MP )of the interaction between S atom and Ni surface has been constructed.The ads orption of S atom on Ni low index surface and (311)step surface was investigated and all critical characteristics were obtained.The calculated results are in g oodagreement with experiments.In order to show clearly the potential energy surface contour figuresof ads orbing and diffusing of S atom on Ni surfaces ,they have been drawn by origin 510as shown in the left figure.E ffect of Cob alt in Modifying Pt/γ2Al 2O 3C atalyst for Preferential Oxid ation of CO in H ydrogen 2rich StreamY AN ,Jing ;M A ,Jian 2X in ;ZH OU ,Wei Acta Chimica Sinica 2004,62(21),2143The figrue showed the effect of Pt loading and the addition of C o on preferential oxidation of C O over Pt/γ2Al 2O 3.Over the catalysts with Pt loading of w Pt =0.05,the conversion of C O was m ore than 99%and the selectivity of O 2was 27%at 160℃.While over the C o prom oted catalyst with Pt loading of w Pt =0.01and C o loading of w C o =0.03and in the conditions of temperature at 120℃and φO 2/φC O =1.8,the conversion of C O could reach nearly 100%and the selectivity of O 2was 27%.The addition of C o to Pt/γ2Al 2O 3could notnoly improve the activity at low 2temperature but als o reduce significantly the Pt laoding in the catalysts.Ⅰ。
二维相关红外光谱及其应用解读

二维相关红外光谱及其应用1 引言二维相关光谱是一种实验设计与数据处理相结合的分析技术。
对于每一种样品体系,需要根据研究目的,设计合适的实验方案,通过对样品施加特定的微扰(包括机械拉伸力、温度、压力、浓度、磁场、光照等),诱导光谱信号产生动态变化,对一系列的动态谱图进行相关分析计算,便得到二维相关谱图(图1)。
二维相关谱图反映的是样本中各种组成成份或者微观结构单元相应于外界微扰的变化情况,以及这些变化之间相互的联系。
目前应用最广泛的是以温度为变量的二维相关红外光谱技术。
2 二维相关光谱的特性二维相关光谱可用三维立体图或二维等高线图进行可视化显示,便于直观地对二维信息进行解析。
在二维相关光谱的等高线图中,z坐标轴值用x-y平面中的等高线表示。
同步相关光谱代表两个动态红外信号之间的协同程度,它是关于主对角线对称的。
相关峰在对角线和非对角线区域均会出现。
在对角线上有一组峰,它是动态红外信号自身相关而得到的,所以称为自动峰。
自动峰总是正峰,它的强度代表外扰引起的变化程度。
强的自动峰对应于动态谱中强度变化较大的区域,而保持不变的区域则显示出非常小或没有自动峰,这与微观环境对官能团运动的影响是密切相关的。
在二维相关图中(见图1),以圆圈的个数代表Φ(ν1,ν2)的绝对值。
在坐标(A,A),(B,B),(C,C)和(D,D)处的自动峰分别具有2,1,4和2个圆圈,表明(C,C)处的自动峰最强,而(B,B)处的自动峰最弱。
二维同步相关光谱中位于主对角线以外的峰叫做交叉峰,它显示扰动发生过程中ν1和ν2处的强度变化的相关变化。
为了便于观察自动峰和交叉峰的强度的相关变化,可以构造一个相关正方形,把对角线上的自动峰和两侧的交叉峰连贯起来。
所以A和C,B和D是同步相关的(图1a)。
交叉峰的符号既可为正也可为负。
如果发生在ν1和ν2处的强度变化是同一方向的,那么Φ(ν1,ν2)为正;反之,如果发生在ν1和ν2处的强度变化是沿着相反方向的,那么Φ(ν1,ν2)为负。
胶原中氢键变化的红外光谱、拉曼光谱分析

第49卷第1期 2020年1月Vol. 49 No. 1Jan. 2020中©皮革CHINA LEATHER胶原中氢键变化的红外光谱、拉曼光谱分析张奇\唐春雪、丁克毅、何达海2a t(1.西南民族大学化学与环保工程学院,四川成都610041;2.西南民族大学药学院,四川成都610041)摘 要:通过红外光谱和拉曼光谱分析了皮股原经过铝、铬、四羟甲基氯化磷鞣制前后的氢键变化,以及这3种鞣法得到的皮股原湿热收缩前后的氢键变化。
红外光谱和拉曼光谱的分析结果均显示,鞣制使得胶原分 子中的氢键数量增加;鞣制过的皮肢原在湿热收缩过程中伴随着三股螺旋中酰胺羧基氢键的断裂;拉曼光谱 还可以观察到脯氨酸、羟脯氨酸氢键的断裂。
这一结果支持了氢键在维持股原(包括鞣制改性的肢原)三股螺 旋结构稳定的重要性,同时也为进一步研究鞣制改性皮股原的湿热收缩机理提供了试验依据。
关键词:红外光谱;拉曼光谱;鞣制股原;湿热收缩;氢键中图分类号 TS57 文献标识码 A D01:10.13536/ k i.issn l001-6813. 2020-001-003 Analysis for hydrogen bond changing of collagen byF T-IR and Raman spectrumZHANG Q i\T A N G Chunxue1,DING KeyV,HE Dahai(1. College of Chemistry & Environmental Engineering, Southwest Minzu University, Chengdu 610041, C hina;2. College of Pharm acy, Southwest Minzu University, Chengdu 610041, China) Abstract: Hydrogen bond changing of hide powder before and after tanned by chrome salt,aluminum salt and tetra- hydromethyl phosphorus chloride ( THPC) , tanned collagen before and after hydrothermal shrinkage were analyzed by FTIR and Raman spectroscopy. Both the results of FTIR and Raman spectroscopy indicate that the quantity of hydrogen bonds in collagen molecular increases after tanning process. There are hydrogen bonds breaking of amide carbonyl groups from triple helix of collagen during hydrothermal shrinkage. In addition, the breaking of hydrogen bonds of proline and hydroxyl-proline are also observed in Raman spectroscopy. These experimental results support the important role of hydrogen bonds in maintaining the stability of triple helix structure of collagen including tanned collagen, and provide experimental basis for further study of the hydrothermal shrinkage mechanism of tanned collagen.Key words:F T-IR;Raman spectrum;tanned collagen;hydrothermal shrinkage;hydrogen bond点,在有机化合物官能团结构辨认中起着重要作用。
二维红外相关光谱法研究温度对交联胶原结构的影响

二维红外相关光谱法研究温度对交联胶原结构的影响陈以会;田荟琳;李季衡;李国英【摘要】The Fourier transform infrared spectroscopy and two dimensional correlation analysis method were applied to study a denaturing process of uncross-linked collagen and cross-linked collagen during varying temperature. It was found that the intensity of typically characteristic absorptions of collagen decreased and its peak shifted to low frequency, The amide II central absor-bance peak moved to a lower frequency by about ~10 cm-1, which indicated that the inter-chain hydrogen bonds which stabilized the triple helix conformation of collagen were disrupted during thermal denaturation, resulting in a conformational change. The intensity of auto-peak at 1 515 cn-1 was maximum, which suggested that the temperature had a big impact on amide IL In comparison with uncross-linked collagen, the intensity of cross-peaks of cross-linked collagen was weaker, which demonstrated that the effect of temperature on the structure of cross-linked collagen was smaller, and the thermal stability properties of collagen solution could be improved by cross-linking. While the order of second structure changes of cross-linked collagen was different These fundamental data should provide available information for understanding the relationship between the structure and function of cross-linked collagen.%采用傅里叶红外光谱和二维相关分析研究了改性前后胶原在升温(25~115℃)过程中结构的变化.结果显示,改性前后胶原的特征吸收峰强度降低,峰值向低波数移动,其中酰胺Ⅱ带的变化最明显,降低了~10 cm-1,表明维系胶原三股螺旋结构稳定的氢键被破坏,结构发生改变.在1515 cm-1处自相关峰强度最强,说明温度对酰胺Ⅱ带的影响最大.与未改性胶原相比,改性胶原的相关程度更弱,表明改性胶原结构受温度影响要小,交联提高了胶原的热稳定性;改性后胶原结构变化的顺序也不一样.由此可见,二维红外相关分析法能提供由温度引起的胶原结构动态变化的微观信息,对进一步研究改性胶原结构和功能之间的关系有一定的意义.【期刊名称】《光谱学与光谱分析》【年(卷),期】2012(032)006【总页数】7页(P1500-1506)【关键词】交联胶原;二维红外相关光谱法;构象变化【作者】陈以会;田荟琳;李季衡;李国英【作者单位】四川大学制革清洁技术国家工程实验室,四川成都610065;重庆科技学院化学化工学院,重庆401331;四川大学制革清洁技术国家工程实验室,四川成都610065;四川大学制革清洁技术国家工程实验室,四川成都610065;四川大学制革清洁技术国家工程实验室,四川成都610065【正文语种】中文【中图分类】O644.1胶原是动物组织含量最丰富的蛋白,具有维持机体组织结构完整的功能[1]。
温度对近红外光谱检测结果的影响研究

温度对近红外光谱检测结果的影响研究近红外光谱(NIRS)技术为分析领域以及化学、化工和药学等行业提供了灵活的测量和监测常见化合物的方法。
这使得基于近红外光谱的分析方法能够被用于监测和诊断不同的原料和样品。
近红外光谱技术可以连续、远距离以及高灵敏度检测化合物的浓度,从而提高检测的准确度。
由于温度对近红外光谱检测结果的影响,因此必须对近红外光谱检测结果的准确性进行研究。
温度对近红外光谱检测结果具有重要影响。
研究表明,变温状态对模型系数的影响可能会影响样本的分类结果。
因此,为了确保准确的检测结果,必须对检测过程中的温度进行适当的控制。
近红外光谱技术由于其独特的优势,越来越多的企业和研究机构正在研究该技术的改进和应用,特别是加快近红外光谱检测结果的准确性和在温度变化行状态下的可靠性。
为了验证温度对近红外光谱检测结果的影响,我国的研究机构实施了一项研究。
研究人员将测试样本放置在可控的室温环境下,并用近红外光谱仪进行测量,以计算温度下各种合成物的浓度,从而验证温度对检测结果的影响。
研究结果表明,当温度升高时,近红外光谱检测结果的准确度会随之下降。
因此,当进行近红外光谱检测时,必须对温度进行适当的控制,以保证准确的检测结果。
此外,研究结果还表明,随着温度升高,样品中某些含量曲线会出现不同的变化,而另一些曲线会随着温度的变化保持相对稳定。
因此,温度对于近红外光谱检测结果也有一定的影响,使曲线波动变化。
综上所述,温度对近红外光谱检测结果具有重要的影响,因此必须对检测过程中的温度进行适当的控制,确保准确的检测结果。
然而,由于变温对曲线波动的影响,当进行近红外光谱检测时,必须针对不同样品特性采取相应的控制措施,以便获得准确的检测结果。
未来,我国的研究机构将继续探索近红外光谱技术的改进,研究该技术在不同温度状态下的可靠性,以期进一步提高现有的检测方法和评估结果的准确性。
综上,研究表明,温度对近红外光谱检测结果具有重要的影响,为了保证准确的检测结果,必须对检测过程中的温度进行适当的控制。
温度对胶原蛋白结构影响的二维红外相关光谱的研究

第20卷第2期原 子 与 分 子 物 理 学 报Vol.20, .22003年2月CHI NESE JOU RNAL OF A T OM IC AN D M OLECU L AR PHYSICSApr.,2003文章编号:1000-0364(2003)02-0211-08温度对胶原蛋白结构影响的二维红外相关光谱的研究肖和兰1,孙素琴2,周 群2,庞小峰3,蔡国平1(1.清华大学生物科学与技术系,生物膜与膜生物工程国家实验室,北京100084;2.清华大学化学系分析中心生命与健康分析化学实验室,北京100084;3.成都电子科技大学生命科学与技术学院,成都610028)摘要:采用傅立叶红外光谱法(FT IR)和二维相关分析(2D Co rrelation Analysis)技术研究了胶原蛋白在加热(15 ~95 )条件下构象变化的规律。
结果表明:二维相关分析能提供由温度变化引起的蛋白构象变化过程中分子结构动态变化的微观信息,为揭示胶原蛋白的结构特征和变温微扰引起的结构变化机理提供了一些有意义的实验依据和初步的理论分析。
关键词:胶原蛋白;傅立叶变换红外光谱;二维相关分析中图分类号:O561.3,Q51 文献标识码:A1 引言胶原蛋白是重要的细胞外间质成分,主要存在于细胞之间,连接着各细胞、组织和器官,并且是疏松结缔组织(如皮肤,皮下结缔组织等)和致密结缔组织(骨,软骨,牙齿,角膜等)的主要成分。
胶原蛋白是动物体内含量最丰富的蛋白,约占人体蛋白的四分之一以上。
胶原蛋白等细胞外间质在机体生命活动中起着极为重要的作用。
不仅起着机械支持与连接的物理性作用,而且在细胞、组织乃至整体水平上发挥重要的生理调节功能。
衰老,肿瘤,骨质疏松症,红癍狼疮,类风湿等自身免疫疾病都与胶原蛋白等细胞外间质密切相关。
同时,胶原作为一种生物材料在制革工业、医疗等领域有着广泛的应用前景。
目前,至少已发现19型胶原蛋白,其中, 、 和 型等主要的纤维类胶原蛋白,形成较粗的纤维。
蛋白质二级结构 红外 结果处理

蛋白质二级结构红外结果处理蛋白质二级结构是指蛋白质中相对稳定的局部结构,由多肽链在空间上的相对位置决定。
蛋白质二级结构的研究是蛋白质学的重要分支之一,它有助于我们理解蛋白质分子的性质和功能,促进蛋白质相关疾病的研究和治疗。
其中,红外光谱技术被广泛应用于蛋白质二级结构的研究中。
一、红外光谱技术在蛋白质二级结构研究中的应用红外光谱技术是通过测量分子的振动能谱来研究物质的结构和化学成分的非破坏性技术。
对于蛋白质而言,它的振动能谱和蛋白质的二级结构密切相关,因此红外光谱技术被广泛应用于蛋白质二级结构的研究中。
蛋白质的红外光谱主要反映分子中的氨基酸C=O和N-H离子共振振动所引起的谱带,其峰位置和强度与蛋白质的二级结构类型有密切关系。
通过对红外光谱的分析可以检测出蛋白质的α-螺旋、β-折叠、β-转角、无序等结构类型及其比例,详细分析蛋白质的分子结构和空间构象,为研究蛋白质的物理、化学和生物学性质提供了重要的基础和手段。
二、红外光谱结果处理方法1. 峰位分析法。
红外光谱的吸收峰位与蛋白质的吸收峰位相关,可以得到蛋白质不同二级结构的特征峰位置。
通过将蛋白质样品的红外光谱与标准谱进行比较,可以确定蛋白质二级结构的类型和比例。
例如,对于天蚕丝蛋白中的β-结构而言,其C=O振动波数在1620~1650 cm^-1之间,N-H振动波数在3090~3490 cm^-1之间。
因此,通过对天蚕丝蛋白的红外光谱进行分析,可以得到其β-结构的含量和比例。
2. 核磁共振法。
核磁共振技术是一种高分辨率的物理方法,可对氢/氮/碳等原子的核自旋共振信号进行检测和分析。
通过对蛋白质样品的核磁共振信号进行分析,可以精确测得蛋白质的各种二级结构类型和空间构象。
例如,利用氢/氮核磁共振技术可以对α-螺旋、β-折叠、无序等蛋白质结构类型进行检测,而碳核磁共振技术则可以对蛋白质的空间构象进行测定,如二硫键的位置、脱水作用和侧链取向等。
3. 偏振拉曼光谱法。
蛋白质二级结构 红外 结果处理

蛋白质二级结构红外结果处理
蛋白质二级结构分析是生物化学研究中的一个重要方向。
其中,红外光谱法被广泛应用于蛋白质二级结构的分析。
本文主要介绍蛋白质红外光谱法的原理和数据处理方法。
1.蛋白质二级结构的红外光谱特征
蛋白质的红外光谱主要由两个区域组成:氨基酸背景和吸收峰。
氨基酸背景区域通常在1700~1500 cm-1之间。
吸收峰区域主要包括α-螺旋、β-折叠和无规卷曲等结构形式的特征吸收峰。
其中,α-螺旋的特征吸收峰主要在1650~1660 cm-1之间,β-折叠的特征吸收峰主要在1620~1640 cm-1之间。
2.数据处理方法
蛋白质红外光谱法分析的结果通常是一个光谱图。
为了获取蛋白质的二级结构信息,需要对光谱图进行数据处理。
常见的数据处理方法包括以下几种:
(1)傅里叶变换。
傅里叶变换可以将原始光谱信号转化为频谱信号,进而分析其中的特征峰。
(2)二次导数。
二次导数可以增强光谱中的特征峰,提高分析的准确性。
(3)比值谱法。
比值谱法是通过将样品光谱与参考光谱相除来消除光谱中的干扰峰,从而提高分析的准确性。
综上所述,蛋白质红外光谱法是研究蛋白质二级结构的重要手段之一。
通过对光谱数据的处理,可以获得蛋白质二级结构的丰富信息。
温度对牛胶原聚集态的影响

温度对牛胶原聚集态的影响
王香梅;高建峰;蔡中婷
【期刊名称】《高分子通报》
【年(卷),期】2010(0)6
【摘要】本研究采用酶解法制备了牛胶原。
分别用粘度法、紫外分光光度计、红外光谱和原子力显微镜分析方法,考察了不同温度下胶原的物理化学特性。
实验结果表明:粘度法和紫外分光光度计测定的胶原溶液的变性温度约为38℃;红外光谱测定表明,随着温度的提高,胶原膜在1650cm-1的吸收峰减弱;原子力显微镜实验表明了在40℃时牛胶原分子由螺旋结构的长链断裂为小链段和一些小碎片,说明此方法制备的胶原在40℃以上其三股螺旋结构将被破坏。
【总页数】5页(P82-86)
【关键词】胶原溶液;变性温度;聚集态
【作者】王香梅;高建峰;蔡中婷
【作者单位】中北大学化工与环境学院;中北大学理学院
【正文语种】中文
【中图分类】O484.1
【相关文献】
1.聚集条件对罗非鱼皮Ⅰ型胶原自聚集动力学的影响 [J], 闫鸣艳;秦松
2.过氧化氢诱导的罗非鱼皮胶原纤维降解行为(Ⅰ)——降解过程中底物力学性质与聚集态结构的变化 [J], 刘小玲;何虹;姜元欣;江虹锐;李全阳
3.利用二维同步荧光相关光谱研究温度对胶原溶液中分子聚集行为的影响 [J], 吴万烨;武昆;李国英
4.热处理温度对对位芳纶纤维表面聚集态结构和性能影响 [J], 周琴;李杨;林昆杰;刘金勇;郝智;罗筑
5.温度对乌鳢鱼皮胶原蛋白肽聚集体结构及理化特性的影响 [J], 刘炜熹;张业辉;张友胜;焦文娟;赵甜甜;周东来;黄利华;钟伟锐
因版权原因,仅展示原文概要,查看原文内容请购买。
鱼鳞酶溶性胶原蛋白的提取、特性及其二级结构的温度效应研究的开题报告

鱼鳞酶溶性胶原蛋白的提取、特性及其二级结构的
温度效应研究的开题报告
【一、选题背景】
胶原蛋白是一种广泛存在于动物体内结缔组织中的蛋白质。
它是一
种含有大量甘氨酸和羟脯氨酸的特殊蛋白质,是组成体内结缔组织和骨
骼的重要成分。
胶原蛋白现在已被广泛应用于食品、医药、化妆品等行
业中。
其中,鱼鳞酶溶性胶原蛋白具有天然重量轻、易吸收、生物活性
高等优点,在保健、医药、化妆品等领域具有广泛的应用前景。
然而,目前鱼鳞酶溶性胶原蛋白的生产存在成本高、工艺难度大等
问题,因此,开展鱼鳞酶溶性胶原蛋白的提取和性质研究,寻求更加低
成本、高效率的生产方案,对于推动鱼鳞酶溶性胶原蛋白的产业化具有
重要意义。
【二、研究内容】
本次研究旨在开展以下内容:
1.鱼鳞酶溶性胶原蛋白的提取
选取具有产鱼量大、种类多的养殖鱼种,探索鱼鳞酶溶性胶原蛋白
的获得途径及其最佳提取条件,包括反应温度、酶解时间、酶解酶种等。
2.鱼鳞酶溶性胶原蛋白的特性研究
采用相关分析技术,研究鱼鳞酶溶性胶原蛋白的分子量、氨基酸组成、等电点、溶解特性、理化性质等。
3.鱼鳞酶溶性胶原蛋白的二级结构的温度效应研究
通过荧光光谱、红外光谱等技术,研究鱼鳞酶溶性胶原蛋白的二级
结构在不同温度下的变化规律,探究其温度敏感性及与温度的关系。
【三、研究意义】
通过本次研究,可以深入了解鱼鳞酶溶性胶原蛋白的提取方法及其
特性,探究其温度效应规律,有助于为其工业生产提供科学依据。
同时,开展鱼鳞酶溶性胶原蛋白的研究对于促进我国鱼类养殖业的发展,促进
食品、医药等行业的进步和卫生事业的发展也具有积极的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第20卷第2期原子与分子物理学报V o l .20,№.22003年2月C H I N E S E J O U R N A LO FA T O M I CA ND M O LE C U L A RP H Y S I C SA pr .,2003文章编号:1000-0364(2003)02-0211-08温度对胶原蛋白结构影响的二维红外相关光谱的研究✷肖和兰1,孙素琴2,周群2,庞小峰3,蔡国平1✷✷(1.清华大学生物科学与技术系,生物膜与膜生物工程国家实验室,北京100084;2.清华大学化学系分析中心生命与健康分析化学实验室,北京100084;3.成都电子科技大学生命科学与技术学院,成都610028)摘要:采用傅立叶红外光谱法(F T I R )和二维相关分析(2DC o r r e l a t i o nA n a l y s i s )技术研究了胶原蛋白在加热(15࠷~95࠷)条件下构象变化的规律。
结果表明:二维相关分析能提供由温度变化引起的蛋白构象变化过程中分子结构动态变化的微观信息,为揭示胶原蛋白的结构特征和变温微扰引起的结构变化机理提供了一些有意义的实验依据和初步的理论分析。
关键词:胶原蛋白;傅立叶变换红外光谱;二维相关分析中图分类号:O 561.3,Q 51文献标识码:A1引言胶原蛋白是重要的细胞外间质成分,主要存在于细胞之间,连接着各细胞、组织和器官,并且是疏松结缔组织(如皮肤,皮下结缔组织等)和致密结缔组织(骨,软骨,牙齿,角膜等)的主要成分。
胶原蛋白是动物体内含量最丰富的蛋白,约占人体蛋白的四分之一以上。
胶原蛋白等细胞外间质在机体生命活动中起着极为重要的作用。
不仅起着机械支持与连接的物理性作用,而且在细胞、组织乃至整体水平上发挥重要的生理调节功能。
衰老,肿瘤,骨质疏松症,红癍狼疮,类风湿等自身免疫疾病都与胶原蛋白等细胞外间质密切相关。
同时,胶原作为一种生物材料在制革工业、医疗等领域有着广泛的应用前景。
目前,至少已发现19型胶原蛋白,其中,Ⅰ、Ⅱ和Ⅲ型等主要的纤维类胶原蛋白,形成较粗的纤维。
胶原纤维的基本结构单位是由三条肽链(α链)盘绕成三股螺旋结构的原胶原分子,长约300n m ,直径1.5n m 。
原胶原子分子以其重复的G l y-X -Y 序列为主要特点,X 常为脯氨酸,Y 常为羟脯氨酸或Y 赖氨酸,脯氨酸和羟脯胺酸约占氨基酸含量的1/4,而丙氨酸占1/3。
原胶原分子以相互错开1/4分子,平行排列并以共价交联结合为胶原微纤维,进而形成不同粗细的胶原纤维。
与人们熟知的以胶体溶液态存在的各种球蛋白和酶蛋白很不相同,特殊的胶原蛋白分子结构和胶原纤维的超分子结构,使之表现出许多典型的固体凝聚态特性,并成为研究生物高聚物结构与功能特性的理想材料。
我们报道过,胶原蛋白的激光拉曼光谱和荧光光谱特性,指出胶原蛋白肽链的左手螺旋(31h e l i x)和原胶原三股螺旋结构及其所形成的多聚纤维结构对主链构象的特征谱线酰胺Ⅰ和酰胺Ⅲ的影响[1~3]。
本课题旨在通过红外光谱分析,研究温度对胶原蛋白结构的影响。
作者认为在许多生理病理状态下,胶原蛋白等细胞外间质作为机体巨大的“生理缓冲池”对机体的热平衡发挥着重要的调节作用,而基于热效应的各种理疗处理也将作用于胶原蛋白等并通过这些介质对细胞发挥作用。
另外,作为生物材料的胶原蛋白的变性也往往涉及温度效应。
N i m n i 等实验表明胶原蛋白因具有三股螺旋结构而在高温下具有一定的热稳定性[4]。
P a yn c 等研究了胶原蛋白溶液在4࠷~50࠷酰胺Ⅰ带内1660c m -1、1643c m -1和1633c m -1三个子峰面积百分比的变化,从而得出了构象变化的有关✷✷✷通讯作者:蔡国平,E -m a i l :c a i g p @m a i l .t s i n gh u a .e d u .c n 收稿日期:2002-10-21作者简介:肖和兰(1978-),女,清华大学生物科学与技术系细胞生物学硕士研究生,主要从事细胞生物物理学研究。
信息[5]。
但是他们采用的去卷积谱的各谱峰分量的面积百分比的绝对值对于分析蛋白结构变化并没有绝对意义,只能从各谱峰分量面积百分比的相对变化趋势来分析胶原蛋白结构的可能变化趋势。
在红外光谱的基础上,1986年I s a oN o d a 首先提出了二维红外光谱(T w o -D i m e n s i o n a l I n f r a r e d S p e c t r o s c o p y,2D I R )的概念[6]。
二维红外相关光谱法是建立在对红外信号的时间分辨检测的基础之上,是一种研究分子内官能团间相互作用和分子间相互作用的新方法。
在二维红外光谱中,系统受到内部微扰的激发,产生红外吸收光谱的动态变化,对随时间变化的红外信号进行相关分析,从而产生二维红外光谱。
由于二维红外光谱具有很好的分辨率,在研究蛋白质的二级结构方面有其独特的优势,日益引起关注,目前已经被用于肌红蛋白、血清清蛋白、乳白蛋白、视菌紫质等的研究中,人们主要是利用二维相关分析对它们的二级结构进行解析,研究它们的二级结构在温度、压力等外界因素变化时发生的改变。
本文以乳鼠皮肤胶原蛋白为样品,采用傅立叶变换红外光谱技术,并通过二维红外相关分析光谱法,对从15࠷~95࠷每间隔10࠷程序升温过程中胶原蛋白的结构变化从分子水平上进行了初步研究。
根据所得到的结果,对变温过程中胶原蛋白结构变化进行了讨论。
2材料与方法2.1蛋白的制备按常规方法[7]从乳鼠皮肤中提取胶原蛋白并纯化,红外实验前在-40࠷、14P a 的条件下冰冻干燥固体状的胶原蛋白。
取微量(约1m g )胶原蛋白样品与溴化钾压片,并置于红外光谱仪的变温附件中。
2.2红外谱仪和测试条件红外光谱仪为P e r k i nE l m e r 公司的S p e c t r u m G X 傅立叶红外光谱仪,硅碳棒光源,D T G S 检测器,光谱分辨率4c m -1,测量范围400~4000c m -1,扫描信号累加32次。
采用仪器的变温附件和温控装置,从15࠷~95࠷每间隔10࠷对样品程序升温并采样。
2.3二维红外相关光谱按照I s a oN o d a 提出的广义二维红外交叉相关光谱原理,采用清华大学生物科学与技术系陈国强教授自行开发的软件[8]进行二维红外相关分析。
3实验结果3.1胶原蛋白的红外光谱图在常温下(15࠷)胶原蛋白的红外光谱图如图1所示,谱峰指认[5]如表1所示。
T a b l e 1F T I RB a n d a s s i g n m e n t s o f t h e c o l l a ge n W a v e n u m b e r /c m -1I n t e n s i t yA s s i g n m e n t 2928m v αs (C H 2)2850w v s (C H 2)1658s A m i d e Ⅰ1542s A m i d e Ⅱ1470m δ(C H )1455s δ(C H 2)1404s v (C O O -)1243sA m i d e Ⅲ3.2升温过程中胶原蛋白红外光谱图的变化图2显示对胶原蛋白从15࠷~95࠷间每隔10࠷升温过程中的红外光谱图。
蛋白质在1700~1500c m -1范围的酰胺Ⅰ和酰胺Ⅱ带的红外光谱图和对应的二阶导数谱如图3所示。
蛋白质酰胺Ⅰ带组分的特征频率与指认见表2。
升温过程中,胶原蛋白酰胺Ⅰ和酰胺Ⅱ带的红外光谱图的主要特征参数的变化见表3。
3.3胶原蛋白的红外光谱的二维相关分析结果胶原蛋白从15࠷~95࠷升温过程中酰胺Ⅰ和Ⅱ带的红外光谱的二维相关图如图4所示。
T a b l e 2F T I RB a n d a s s i g n m e n t s o f t h e P r o t e i nA m i d e ⅠF r e qu e n c i e s E x t e n d e dC h a i n s L o wC o m po n e n t s H i gh C o m po n e n t s H e l i xU n o r de r e d T u r n s a n dB e n d s R o u n d e dA v e r a ge 16371631162416751654164516631670168316881694D M SD e v i a t i o n 1.42.52.42.61.51.62.21.41.51.11.7M a x i m u mA b s o l u e33443442222D e v i a t i o n212原子与分子物理学报2003年T a b l e 3C h a r a c t e r i s t i c s o f t h e a m i d e Ⅰa n d a m i d e Ⅱb a n d s o f c o l l a g e n d u r i n g r i s i n g t e m pe r a t u r ef r o m15࠷t o 95࠷S p e c t r u mT e m pe r a t u r e /࠷A m i d e ⅠA m i d e ⅡF r e q u e n c y/c m -1I n t e n s i t y(a r b i t r a r y un i t s )F r e q u e n c y/c m -1I n t e n s i t y(a r b i t r a r y un i t s )1516580.6445A15420.4244A2516580.6453A 15420.4262A 3516590.6437A 15420.4242A 4516590.6437A 15400.4240A 5516590.6433A 15400.4248A 6516590.6434A 15400.4231A 7516600.6433A 15370.4231A 8516600.6435A 15360.4269A 9516600.6435A15360.4303A肖和兰等:温度对胶原蛋白结构影响的二维红外相关光谱的研究年肖和兰等:温度对胶原蛋白结构影响的二维红外相关光谱的研究年性。
异步相关图中,在(1620,1514)处出现了负交叉峰,根据二维相关规则,可判断与之对应的两峰所对的基团在升温过程中结构变化的先后次序。
因为在同步图中Ф(1620,1514)<0,在异步图中ψ(1620,1514)<0,故1620c m-1振动峰的变化先于1514c m-1,1620c m-1振动峰对应的是酰胺Ⅰ带伸展肽链的特征频率,1514c m-1振动峰对应的是酰胺Ⅱ带的特征频率,这意味着在升温过程中,酰胺Ⅰ带伸展肽链结构的变化在酰胺Ⅱ结构变化之前,即在升温过程中,胶原蛋白伸展肽链结构发生改变,羰基基团(C EO伸缩振动)的构象变化先于氮氢基团(N H弯曲振动)的构象变化。
