髓鞘染色液(丽春红G法)
改良Van Gieson 丽春红S染色液使用说明
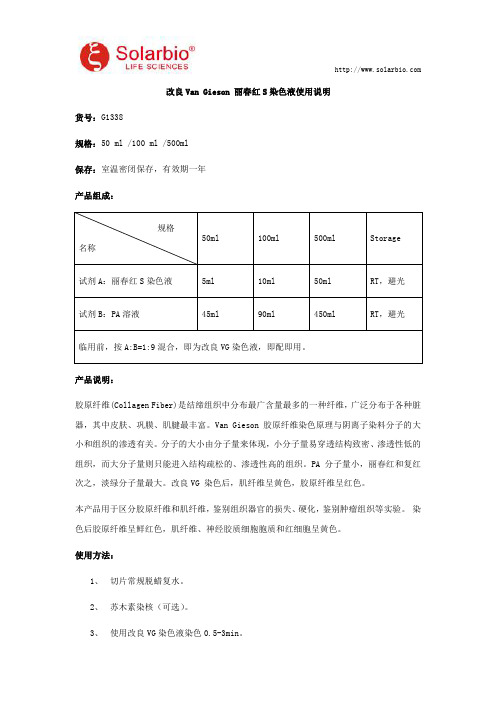
545ml
90ml
450ml
RT,避光
临用前,按 A:B=1:9 混合,即为改良 VG 染色液,即配即用。
产品说明: 胶原纤维(Collagen Fiber)是结缔组织中分布最广含量最多的一种纤维,广泛分布于各种脏 器,其中皮肤、巩膜、肌腱最丰富。Van Gieson 胶原纤维染色原理与阴离子染料分子的大 小和组织的渗透有关。分子的大小由分子量来体现,小分子量易穿透结构致密、渗透性低的 组织,而大分子量则只能进入结构疏松的、渗透性高的组织。PA 分子量小,丽春红和复红 次之,淡绿分子量最大。改良 VG 染色后,肌纤维呈黄色,胶原纤维呈红色。 本产品用于区分胶原纤维和肌纤维,鉴别组织器官的损失、硬化,鉴别肿瘤组织等实验。 染 色后胶原纤维呈鲜红色,肌纤维、神经胶质细胞胞质和红细胞呈黄色。 使用方法:
1、 切片常规脱蜡复水。 2、 苏木素染核(可选)。 3、 使用改良 VG 染色液染色 0.5-3min。
4、 弃染液,直接用 95%酒精液急速分化约数秒钟。 5、 无水乙醇脱水,二甲苯透明,封片,观察拍照。 染色结果:
胶原纤维
红色
肌纤维、神经胶质细胞胞质及红细胞
黄色
注意事项: 1. 试剂要现配现用,不可预先配制后放置,放置后会失去染色力。 2. 改良 VG 染色液的染色时间不宜过长,一般 1min 左右,可根据实验结果适当调整, 出现鲜红色为最佳。 3. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
改良 Van Gieson 丽春红 S 染色液使用说明 货号:G1338 规格:50 ml /100 ml /500ml 保存:室温密闭保存,有效期一年 产品组成:
名称
规格
50ml
100ml
丽春红染色液的配制及使用

丽春红染色液的配制及使用丽春红(PONCEAUS)是一种广泛用于生物化学和分子生物学实验中的缺陷染料,主要用于染色蛋白质凝胶和膜,也可用于检测核酸电泳结果。
下面将介绍丽春红染色液的配制方法和使用注意事项,并附上一些相关实验技巧。
配制丽春红染色液:材料:-丽春红染料粉末-乙醇-蒸馏水或去离子水步骤:1.称取适量的丽春红染料粉末并置于一个干燥的玻璃容器中。
建议根据实验需要确定染色液的浓度,通常可选用0.2-0.5%浓度的丽春红溶液。
2.用乙醇溶解染料粉末,可以先加入适量的乙醇湿润染料,再加入足够量的乙醇溶解。
溶解过程中可以用玻璃棒或磁力搅拌器轻轻搅拌。
3.在染料完全溶解后,加入足够的蒸馏水或去离子水将体积稀释至所需的终浓度。
4.最后,用滤纸或滤膜过滤染色液以去除悬浮物。
使用丽春红染色液的注意事项:1.染色前,确保蛋白质凝胶或膜已完成电泳,否则染色效果可能不佳。
2.准备一个干燥的容器,并将蛋白质凝胶或膜放入其中。
3.用足够的丽春红染色液完全浸泡蛋白质凝胶或膜,充分均匀搅拌,以确保染色效果均匀。
4.染色时间通常为10-30分钟,但染色时间应根据染料浓度和样品特性进行优化。
过长或过短的染色时间都可能对结果产生不良影响。
5.染色后,用蒸馏水或去离子水彻底洗涤蛋白质凝胶或膜,直至染色液中没有可见染料残留为止。
6.最后,可将染色后的蛋白质凝胶或膜进行成像或进一步处理。
一些相关实验技巧:1.在染色前,对蛋白质凝胶或膜进行固定可以提高染色效果和染色均匀性。
2.染色液中的染料浓度和染色时间可根据实验需求进行优化和调整。
3.若需要去除丽春红染色液残留在蛋白质凝胶或膜上的染色产品,可尝试用去离子水或含有10%乙酸溶液进行洗涤。
4.染色后的蛋白质凝胶或膜应避免长时间曝露在光线下,以免染色产品褪色。
丽春红染色液使用说明书

温馨提示 为了您的自身安全,使用试剂前,请做好防护,如穿实验服,带手套等。
储存温度 室温保存。
包装清单 产品编号
HCY047
品名 丽春红染色液
说明书
产品包装 100mL 1份
1
使用说明 1. 将 PVDF 膜、硝酸纤维素膜或醋酸纤维素膜浸没在丽春红染色液中,摇动 3~5min 或更长 时间,直至出现清晰条带。对结果作适当记录。 2. 用蒸馏水,PBS 或其它适当溶液漂洗 2~3 次,每次 3~min,去除丽春红,进行后续的 Western 检测。
注意事项 丽春红染色液不适用于尼龙膜上的蛋白的检测。
杭州昊鑫生物科技股份有限公司
htpp://
丽春红染色液
产品简介 丽春红染色液可用于 PVDF 膜、硝酸纤维素膜和醋酸纤维素膜上的蛋白的检测。丽春红
带负电荷,可以与带正电荷的氨基酸残基结合,同时丽春红也可以与蛋白的非极性区相结合, 从而形成红色的条带。
丽春红对蛋白的染色是可逆的,染色后可以用蒸馏水,PBS 或其它适当溶液洗去。
髓鞘染色液(丽春红G法)
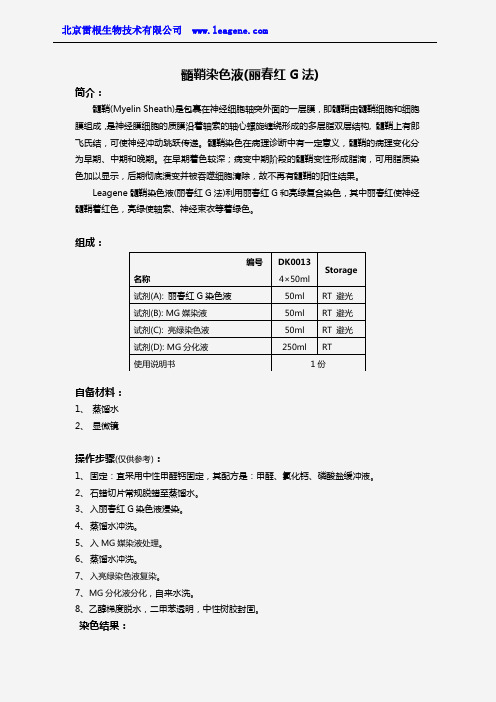
髓鞘染色液(丽春红G 法)简介:髓鞘(Myelin Sheath)是包裹在神经细胞轴突外面的一层膜,即髓鞘由髓鞘细胞和细胞膜组成,是神经膜细胞的质膜沿着轴索的轴心螺旋缠绕形成的多层脂双层结构, 髓鞘上有郎飞氏结,可使神经冲动跳跃传递。
髓鞘染色在病理诊断中有一定意义,髓鞘的病理变化分为早期、中期和晚期。
在早期着色较深;病变中期阶段的髓鞘变性形成脂滴,可用脂质染色加以显示,后期彻底溃变并被吞噬细胞清除,故不再有髓鞘的阳性结果。
Leagene 髓鞘染色液(丽春红G 法)利用丽春红G 和亮绿复合染色,其中丽春红使神经髓鞘着红色,亮绿使轴索、神经束衣等着绿色。
组成:自备材料:1、 蒸馏水2、 显微镜操作步骤(仅供参考):1、 固定:宜采用中性甲醛钙固定,其配方是:甲醛、氯化钙、磷酸盐缓冲液。
2、 石蜡切片常规脱蜡至蒸馏水。
3、 入丽春红G 染色液浸染。
4、 蒸馏水冲洗。
5、 入MG 媒染液处理。
6、 蒸馏水冲洗。
7、 入亮绿染色液复染。
7、MG 分化液分化,自来水洗。
8、乙醇梯度脱水,二甲苯透明,中性树胶封固。
染色结果:编号 名称DK0013 4×50ml Storage 试剂(A): 丽春红G 染色液 50ml RT 避光 试剂(B): MG 媒染液 50ml RT 避光 试剂(C): 亮绿染色液 50ml RT 避光 试剂(D): MG 分化液 250mlRT 使用说明书1份髓鞘红色,横切面多成环状轴索、神经束衣、神经内衣绿色变性髓鞘半环状或不着色注意事项:1、分化这一步很关键,需在镜下观察分化程度。
2、固定液以10%甲醛钙固定液为佳,亦可用10%中性福尔马林替代。
3、MG分化液应注意防止挥发,以免分化效率下降。
4、为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:12个月有效。
相关:编号名称DC0032 Masson三色染色液DF0111 中性福尔马林固定液(10%)DG0005 糖原PAS染色液DH0001 改良Lillie-Mayer苏木素染色液IH0270 甘油明胶封固液NH0043 SSC缓冲液(20×,pH7.0)PS0013 RIPA裂解液(强)TC0699 葡植物总糖和还原糖检测试剂盒(硝基水杨酸法)。
LFB髓鞘染色
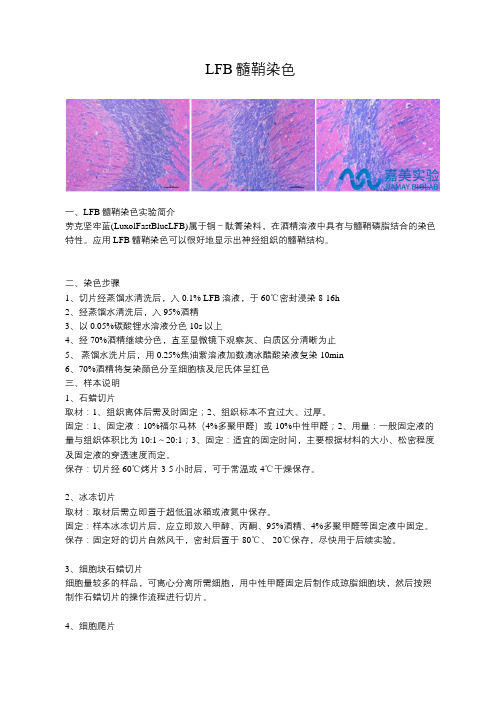
LFB髓鞘染色一、LFB髓鞘染色实验简介劳克坚牢蓝(LuxolFastBlueLFB)属于铜-酞箐染料,在酒精溶液中具有与髓鞘磷脂结合的染色特性。
应用LFB髓鞘染色可以很好地显示出神经组织的髓鞘结构。
二、染色步骤1、切片经蒸馏水清洗后,入0.1% LFB溶液,于60℃密封浸染8-16h2、经蒸馏水清洗后,入95%酒精3、以0.05%碳酸锂水溶液分色10s以上4、经70%酒精继续分色,直至显微镜下观察灰、白质区分清晰为止5、蒸馏水洗片后,用0.25%焦油紫溶液加数滴冰醋酸染液复染10min6、70%酒精将复染颜色分至细胞核及尼氏体呈红色三、样本说明1、石蜡切片取材:1、组织离体后需及时固定;2、组织标本不宜过大、过厚。
固定:1、固定液:10%福尔马林(4%多聚甲醛)或10%中性甲醛;2、用量:一般固定液的量与组织体积比为10:1~20:1;3、固定:适宜的固定时间,主要根据材料的大小、松密程度及固定液的穿透速度而定。
保存:切片经60℃烤片3-5小时后,可于常温或4℃干燥保存。
2、冰冻切片取材:取材后需立即置于超低温冰箱或液氮中保存。
固定:样本冰冻切片后,应立即放入甲醇、丙酮、95%酒精、4%多聚甲醛等固定液中固定。
保存:固定好的切片自然风干,密封后置于-80℃、-20℃保存,尽快用于后续实验。
3、细胞块石蜡切片细胞量较多的样品,可离心分离所需细胞,用中性甲醛固定后制作成琼脂细胞块,然后按照制作石蜡切片的操作流程进行切片。
4、细胞爬片在孔板里做的细胞爬片,爬片取出后,用PBS洗涤2次(根据研究目的,PBS洗涤可选择不做),用4%多聚甲醛4℃固定15分钟,将表面液体吹干,置于-20℃保存。
若在短时间内即开展实验,可在加固定液后,于4℃冰箱中放置一段时间。
5、细胞涂片细胞涂片常用的固定液有95%酒精(最为常用)、酒精-冰醋酸液、乙醚-酒精液和Carney’s液等。
四、注意事项1、常用的固定液为中性甲醛和4%多聚甲醛,能使大多数抗原保存良好,适用于免疫组织化学。
髓鞘染色液使用说明

髓鞘染色液使用说明
规格:100ml×2
有效期:室温保存,6个月有效。
产品简介:
本产品是运用固蓝(luxol fast blue)染色法染脑和髓鞘。
髓鞘(myelin sheath)是一层脂肪组织,包裹在某些神经元的轴突外,具有绝缘作用并提高神经冲动的传导速度,在中枢和外周神经系统中起保护轴突作用。
本染色法可显示正常的髓鞘。
自备材料:
产品名称规格
髓鞘染液A100ml
髓鞘染液B100ml
操作步骤(仅供参考):
1、石蜡切片脱蜡至水;
2、无水乙醇5min;
3、浸入髓鞘染液A在58-60℃条件下染色14h;
4、流水冲洗10min;
5、放入70%乙醇中(无固定时间)
6、浸入髓鞘染液B中,至分色完全(可见中间灰质部分颜色变淡);
7、第5步、6步交替进行;
8、流水冲洗5min;
9、伊红复染数秒(可选);
10,梯度酒精脱水、二甲苯透明、中性树胶封片。
染色结果:
正常髓鞘呈蓝色,脱髓鞘无色,余呈淡红色。
注意事项:
1、髓鞘染液常温密封放置,可保存6个月;100ml髓鞘染液染150张片子为宜,染液可重复利用。
因髓鞘染液中含有酒精所以加温染色时宜密封,不然溶液蒸发,影响染色效果;
2、酒精和髓鞘染液B分化为关键步骤,应交替分化,镜下观察,控制分色;
3、伊红复染可选,如选,宜浅染。
丽春红酸性品红染色液

北京雷根生物技术有限公司
丽春红酸性品红染色液
简介:
结缔组织狭义上是指其含有的三种纤维:胶原纤维、网状纤维、弹力纤维,而胶原纤维(collagen fiber)是分布最广、含量最多的一种纤维。
Masson 三色染色又称马松染色,是结缔组织染色中最经典的一种方法,是胶原纤维染色权威而经典的技术方法。
所谓三色染色通常是指染胞核和能选择性的显示胶原纤维和肌纤维。
该法染色原理与阴离子染料分子的大小和组织的渗透有关:分子的大小由分子量来体现,小分子量易穿透结构致密、渗透性低的组织;而大分子量则只能进入结构疏松的、渗透性高的组织。
Leagene 丽春红酸性品红染色液是Masson 三色染色的有效成分之一,主要用于肌纤维的染色,染色后呈红色。
丽春红酸性品红染色液仅用于科研领域,不用于临床诊断或治疗。
组成:
操作步骤(仅供参考):
1、切片常规脱蜡至水,蒸馏水洗1min 。
2、入丽春红酸性品红染色液染色。
3、蒸馏水稍微冲洗。
4、按要求进行下游实验。
可95%乙醇快速脱水。
无水乙醇脱水3次,每次5~10s 。
二甲苯透明3次,每次1~2min 。
中性树胶封固。
染色结果:
胞浆、肌肉、红细胞
红色
注意事项:
1、 切片脱蜡应尽量干净。
2、 固定起着重要的作用,使用不同的固定液可延或缩短染色时间。
3、 注意密闭保存,否则有效成分挥发会导致染色效率下降。
有效期:12个月有效。
编号 名称 DC0030 Storage 丽春红酸性品红染色液 100ml RT 避光 使用说明书 1份。
GENMED 丽春红染色溶液产品说明书

GENMED SCIENTIFICS INC. U.S.A GMS12202 v.A GENMED丽春红染色溶液产品说明书(中文版)主要用途GENMED丽春红红染色溶液是一种旨在通过使用显色染料丽春红(Ponceau S)与蛋白质氨基基团的结合并显示红色蛋白条带,快速、敏感、可逆地检测在聚丙烯酰胺凝胶(PAGE)、PVDF膜、硝酸纤维素膜(Nitrocellulose membrane;NC)、醋酸纤维素膜(cellulose acetate)上的蛋白成分的权威而经典的技术方法。
该技术由大师级科学家精心研制、成功实验证明的。
适用于蛋白凝胶电泳和WESTERN BLOT 印迹膜的蛋白检测。
产品即到即用,性能长期稳定,着色清晰灵敏,可检测250纳克以上的蛋白。
技术背景丽春红染色剂(Ponceau S)是一种水溶性的阴离子重氮染料,由重氮氨基偶氮苯二磺酸(diazotized4-amino-1,1’-azobenzene-3,4’-disulfonic acid; Acid Yellow 9)和萘酚二磺酸(2-naphthol- 3,6-disulfonic acid;R acid)耦合到四钠盐上。
其分子式为C22H12N4Na4O13S4,分子量为760.6。
最大吸收光谱为520nm波长。
带负电荷的丽春红分子与正电荷的蛋白质氨基基团结合,也可以非共价键形式与蛋白质非极性区域结合。
产品内容GENMED染色液(Reagent A)30毫升产品说明书1份保存方式保存GENMED染色液(Reagent A)在室温下,避免光照,有效保证6月用户自备染色塑料盒:用于纤维膜蛋白印迹染色的容器实验提示方法一、醋酸纤维素膜染色实验开始前,完成蛋白质电泳和转印。
然后进行下列操作。
1.将含有蛋白的醋酸纤维膜置于染色塑料盒里2.小心加入适量的( 毫升/平方厘米)的GENMED染色液(Reagent A),覆盖膜表面3.室温下,孵育5分钟,避免光照4.继续后续酸化、固定、清理处理(注意:建议使用GENMED蛋白质转印印迹膜丽春红(Ponceau S)染色试剂盒-GMS30081)方法二:PVDF膜或硝酸纤维素膜染色实验开始前,完成蛋白质电泳和转印。
丽春红2R-亮绿法在中枢神经纤维束髓鞘染色中的应用

摘 要 目的 : 索 一 种 中 枢 神 经 纤 维 束 髓 鞘 的 染 色 方 法 。 方 法 : 用 丽 春 红 2 一 绿 双重 染 色 法 , 正 常 S 探 应 R 亮 对 D
s ia o d w r ti e a mo e ,a d t e g a t ra d t e n u o s w r t ie r e .Co c u i n :P n e u 2 — b i in p n lc r e e s n d s l n r d n h r y mat n h e r n e e san d g e n a e n ls o s o e a R rl t la
g e n d u l t i ig tc nq e i a q ik smpe a d r l b e my l t i t o n d mo s a ig t e f s i u i n te c n rl n r r e o b e s n n e h i u s uc , i l n e i l e i san me h d i e n t t h a ee l i h e ta e ・ a a n r n
维普资讯
・
4 4 9・
2
生
Q鲞
Me )C m net n,0 6V 1 0N . dJ( o mu ia o s 0 ,o. .0 I i 2 2 5
丽春红 2 一 R 亮绿 法在 中枢神经 纤维束髓鞘染色 中的应用
栗 卓 吕广 明 刘 苏 吴 辉 群 韩 笑 季 达峰
o s h p n lc r e t n ft e a u t S r g e D wly r t w r ee t d b sn o c a R — b i in r e o b e sa n d :T e s i a o d s c i s o h d l p a u - a e as e e d tce y u ig P n e u 2 o r l tg e n d u l t i la me h d Re u t :I h o e a R — b i i n r e ti i g s ci n ,t e a o s a d my l ff s i u ii h h t t r o h to . s l s n te P n e u 2 r l tg e n sa nn e t s h x n n e i o a ee l n t e w i mat ft e la o n e e
P0022丽春红染色液

丽春红染色液产品简介:丽春红(Ponceau S)染色液可以用于PVDF膜、硝酸纤维素膜(nitrocellulose membrane)和醋酸纤维素膜(cellulose acetate membrane)上的蛋白的检测。
丽春红带负电荷,可以与带正电荷的氨基酸残基结合,同时丽春红也可以与蛋白的非极性区相结合,从而形成红色的条带。
丽春红对蛋白的染色是可逆的,染色后可以用蒸馏水,PBS或其它适当溶液洗去。
本试剂盒使用方便,本底低,灵敏度较高,对蛋白的检测下限是250纳克。
保存条件:室温保存,一年有效。
注意事项:丽春红染色液不适用于尼龙膜上的蛋白的检测。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:1.将PVDF膜、硝酸纤维素膜或醋酸纤维素膜浸没在丽春红染色液中,摇动3-5分钟或更长时间,直至出现清晰条带。
对结果作适当记录。
2.用蒸馏水,PBS或其它适当溶液漂洗2-3次,每次3-5分钟,去除丽春红,进行后续的Western检测。
使用本产品的文献:1. Wang C, Xie H, Liu X, Qin Q, Wu X, Liu H, Liu C.Role of nuclear factor-κB in volatile anaesthetic preconditioning with sevoflurane during myocardial ischaemia/reperfusion.Eur J Anaesthesiol. 2010 Aug;27(8):747-56.2. Wu Y, Feng W, Zhang H, Li S, Wang D, Pan X, Hu S.Ca2+-regulatory proteins in cardiomyocytes from the right ventricle in children with congenitalheart disease.J Transl Med. 2012 Apr 2;10:67.3. Jiang X, Ge H, Zhou C, Chai X, Deng H.The role of transforming growth factor β1 in fractional laser resurfacing with a carbon dioxide laser.Lasers Med Sci. 2013 Jul 3.4. Wang X, Lin H, Sui J, Cao L.The effect of fish matrix on the enzyme-linked immunosorbent assay of antibiotics.J Sci Food Agric. 2013 May;93(7):1603-9. doi: 10.1002/jsfa.5931. Epub 2012 Nov 14.5. Wang HJ, Tan YZ.Methods for assessing effects of Wnt/β-catenin signaling in senescence of mesenchymal stem cells.Methods Mol Biol. 2013;976:111-30. doi: 10.1007/978-1-62703-317-6_9.6. Xie H, Liu X, Wang C, Zhu J, Yang C, Liu C, Liu H, Wu X.The changes of technetium-99m-labeled annexin-V in delayed anesthetic preconditioning during myocardial ischemia/reperfusion.Mol Biol Rep. 2014 Jan;41(1):131-7. doi: 10.1007/s11033-013-2845-3. Epub 2013 Nov 6.。
丽春红染色液说明书

北京普利莱基因技术有限公司 电话:************,62053186 Email:***********************Applygen Technologies Inc. DocRev: 201910 Page 1 of 1 丽春红染色液 (Membrane Staining Solution) P1600描述:SDS-PAGE 电泳转膜后为快速检查蛋白是否成功转到膜上或需要将膜上的不同泳道剪切下来,可把膜浸入可逆染色液染色,膜上的蛋白条带将被染成红色,过程完全可逆而且不会影响Western Blot 后续操作。
用水冲洗或直接将染色的膜放入封闭液即可完全洗去膜上的染色。
染色溶液可以回收并反复使用。
适用:硝酸纤维素膜和PVDF 膜的蛋白可逆染色。
储存:室温保存 12个月有效操作步骤:1. 完成蛋白转膜后,将膜完全浸入足量的染色液中,室温孵育2-5分钟,更长的时间并不能明显加深染色。
2.用自来水或蒸馏水快速清洗膜2-3次或用连续水流冲洗,直到膜上红色蛋白条带逐渐显现(期间要仔细进行观察)。
继续冲洗,染色将快速消退。
3. 根据蛋白染色条带,检查蛋白是否成功转到膜上。
用铅笔或圆珠笔对相应的蛋白位置做标记后,可将膜上的不同泳道安全剪切下来。
4. 染色的膜无须进一步处理,可直接进行Western Blot 封闭步骤。
此时封闭液可能变红,但不影响后续操作。
说明:1. 冲洗不足或将导致蛋白条带染色与膜背景的反差小,不易观察;冲洗过度将洗去膜上的染料,使蛋白条带过分退色,此时可加入膜染色液,重新进行染色。
2. 由于染色试剂的可逆性质,膜上的蛋白条带将会退色。
膜上轻微染色不影响后续免疫实验。
3. 染色液可以回收并反复使用10次以上,但反复回收将使染液效力降低。
安全性:无特殊毒性,有刺激性。
按一般化学品操作规程处理即可。
结缔组织多色染色法

结缔组织多色染色法一、Mallory 三色染色法1. 试剂配制(1)重铬酸钾液重铬酸钾2.5g,醋酸5ml,蒸馏水95ml(2)苯胺蓝桔黄G液苯胺蓝0.5g,桔黄G2g磷钨酸1g,蒸馏水100ml(3)酸性复红液酸性复红0.5g ,蒸馏水100ml2. 染色步骤( 1 )中性甲醛液固定组织,石蜡切片,常规脱蜡至水。
(2)重铬酸钾液10min。
(3)蒸馏水冲洗2min,蒸馏水2次。
(4)酸性复红液2min,蒸馏稍洗。
( 5)苯胺蓝液20min,95%乙醇快速分化。
( 6)直接用无水乙醇脱水,二甲苯透明,中性树胶封固。
3. 结果胶原和网状纤维呈蓝色,软骨、粘液、淀粉样变物质呈淡蓝色,神经胶质纤维、肌纤维和酸性颗粒呈红色,髓鞘和红色呈桔红色4. 注意事项(1)酸性复红液易溶解于水,肉眼观察切片上保留一定的红色。
(2)苯胺蓝液染色后,用95%乙醇分化时,须用显微镜观察掌握。
(3)对陈旧的固定标本,其染色效果较差,可增加染色时间。
(4)另张切片,可同时作胶原纤维对照染色而进行鉴别组织成分。
二、Mass on三色染色法1. 试剂配制(1)Masson复合染色液酸性复红1g,丽春红2g,桔黄G2g 0.25%醋酸300ml (2)亮绿染色液高绿SFO.Ig, 0.2%醋酸100ml。
2. 染色步骤中性甲醛液固定组织,石蜡切片,常规脱蜡至水。
(1)Masson复合染色液5min。
(2)0.2%醋酸水溶液稍洗。
(3)5%磷钨酸5-10min。
(4)0.2%醋酸水溶液浸洗2次。
5)亮绿染色液5min, 0.2%醋酸水洗2次6)无水乙醇脱水,二甲苯透明,中性树胶封固3. 结果胶原纤维呈绿色,肌纤维呈红色,红细胞呈桔红色。
4. 注意事项(1) Mass on复合染色液,经磷钨酸分化时须用显微镜控制肌纤维清晰为止。
( 2)亮绿染料可用苯胺蓝替换,可用来作为对比观察染色的效果。
三显示胶原纤维、网状纤维和弹力纤维的三联染色法( 1993 年)1. 试剂配制( 1)高锰酸钾硫酸液0.5% 高锰酸钾水溶液中加入5ml 的硫酸。
髓鞘染色

髓鞘染色操作步骤试剂:Luxol 固蓝MBS(solvent blue 38),乙醇,碳酸锂,冰醋酸切片:8-12um溶液1. 0.1% 固蓝溶液固蓝0.1 g95%乙醇100 ml冰醋酸0.5 ml取固蓝0.1g 加入95%乙醇,在温度50-60℃条件下,于磁力搅拌器中搅拌,用冰乙酸0.5 ml。
2. 0.05%碳酸锂溶液碳酸锂0.05 g去离子水100 ml充分混均。
3. 0.1%甲苯酚紫溶液甲苯酚紫0.1 g95%乙醇100 ml冰醋酸0.5 ml取甲苯酚紫0.1g 加入95%乙醇,在温度50-60℃条件下,于磁力搅拌器中搅拌,用冰乙酸0.5 ml。
染色1. 取出切片,于95%乙醇溶液中浸泡3 min。
2. 取出切片,置于Luxol固蓝溶液中,在57℃温度下,孵育4小时。
3. 取出切片,于95%乙醇溶液中浸洗3 min。
4. 取出切片,于去离子水中浸洗3 min。
5. 切片于0.05%碳酸锂溶液中快速浸洗15 s。
6. 立即取出切片,置于70%乙醇溶液中分化10s,直到灰质和白质能够清晰辨别。
7. 立即取出切片,置于70%乙醇溶液中分化20s,直到灰质和白质能够清晰辨别。
8. 取出切片,于去离子水中冲洗3min。
9. 将切片置于Luxol固蓝溶液中,在57℃温度下,孵育10s。
10. 切片于95%乙醇溶液中浸泡2 min。
11.切片于95%乙醇溶液中浸泡2 min。
12.切片于100%乙醇溶液中浸泡2 min。
13.切片于100%乙醇溶液中浸泡2 min。
14.二甲苯透明2 min。
中性树胶封固。
15. 镜下观察髓鞘。
结果:髓鞘:蓝绿色。
尼氏体:紫色。
丽春红染色原理

丽春红染色原理
丽春红是一种常用的生物染料,广泛应用于生物学和医学领域。
它的染色原理是什么呢?本文将为您详细介绍丽春红染色的原理。
首先,我们需要了解丽春红分子的结构。
丽春红分子属于碱性染料,分子中含有苯环和吡啶环结构,具有强烈的亲水性和阳离子性。
这种结构使得丽春红可以与负电荷基团结合,例如DNA中的磷酸基团和蛋白质中的羧酸基团。
在染色过程中,通常会先将样品进行固定处理。
固定处理可以使细胞或组织保持形态和结构完整性,并使其更易于染色。
一般使用乙醛、甲醛等物质进行固定处理。
接下来,样品会被浸泡在含有丽春红染料的溶液中。
由于丽春红分子具有阳离子性,在溶液中会与带有负电荷基团的目标分子(如DNA、RNA、蛋白质等)发生静电作用而结合在一起。
在染色过程中,通常会加入一些辅助剂以提高染色效果。
例如,醋酸可以降低溶液的pH值,使得目标分子带有更多的负电荷基团,从而增强丽春红与之结合的能力。
此外,甘油等物质也可以增加样品的透明度和稳定性。
最后,样品会被洗涤以去除未结合的染料,并进行显微镜观察或其他分析。
丽春红染色后的样品呈现出红色或粉红色,在显微镜下可以清晰地观察到目标分子的位置和形态。
总之,丽春红染色原理是基于其分子结构中含有阳离子性和亲水性,通过静电作用与带有负电荷基团的目标分子结合在一起。
在染色过程中加入辅助剂可以提高染色效果。
常用特殊染色结果速记

常用特殊染色结果速记注:为了方便广大病理技术人员熟悉和掌握常用病理技术特殊染色的结果,现将作者摘录整理的“常用特殊染色结果速记”呈现给大家,以便使用者在日常工作和学习中记忆。
内容不一定全面,如有错误请以人民卫生出版社出版的《2016年全国卫生技术资格考试指导-病理学技术》一书为准。
结缔组织染色:1.Mallory三色染色结果:胶原和网状纤维蓝色,软骨、黏液、淀粉样变物资呈淡蓝色,神经胶质纤维、肌纤维和酸性颗粒红色,髓鞘和红细胞橘红色。
2.Masson三色染色结果:胶原纤维绿色,肌纤维红色,红细胞橘红色。
胶原纤维染色:1.Van Gieson(V G)苦味酸-酸性品红染色结果:胶原纤维鲜红色,肌纤维、细胞质和红细胞黄色,细胞核蓝褐色。
2.天狼星红苦味酸染色结果:胶原纤维红色,细胞核绿色,其他黄色。
网状纤维染色:1.Gordon-Sweets银氨染色结果:网状纤维黑色,细胞核红色(核固红复染),胶原纤维黄棕色,细胞质淡红(红液复染)。
弹性纤维染色:1.弹性、胶原纤维的双重组合染色法:弹性纤维蓝绿色,胶原纤维红色,背景淡黄色。
2.Gomori醛品红染色法:弹性纤维呈紫红色,背景橘红色。
横纹肌组织染色:1.Mallory磷坞酸苏木素(PTAH)染色结果:细胞核、纤维、肌肉、神经胶质纤维、纤维蛋白、横纹肌均为蓝色;胶原纤维、网状纤维软骨基质及骨呈黄色或玫瑰红色;粗弹性纤维有时为微紫色;有缺氧早期病变的心肌为紫蓝色或棕黄色。
早期心肌病变组织染色:1.Nagar-Olsen染色结果:缺氧心肌、红细胞红色,正常心肌黄色或黄棕色,细胞核蓝色。
2.Poley显示缺氧心肌染色结果:缺氧心肌红色,细胞核紫色,其他组织呈绿色。
糖类染色:1.过碘酸-Schiff(PAS)染色结果:糖原红色,细胞核蓝色。
黏液物质染色:1.Mowry阿尔辛蓝过碘酸雪夫AB/PAS染色结果:中性黏液物资红色,酸性黏液物资蓝色,混合性黏液物资紫红色。
病理技术专业知识

(一)单纯固定液甲醛:1.浓度:40%,气体2.渗透力强,固定均匀,组织收缩小,3.不能使白蛋白和核蛋白沉淀4.保存脂类,必须用冷冻切片。
是糖的保护剂5.可固定高尔基体,线粒体重铬酸钾1.浓度:1%-3%水溶液,有毒,橘红色结晶2.穿透速度快,几乎不收缩,经乙醇脱水后明显收缩,3.未酸化的重铬酸钾不能使蛋白质沉淀,但可使蛋白质变为脂溶剂。
酸化后可使蛋白质沉淀,此时染色体可被保存,但线粒体破坏。
4.固定高尔基体和线粒体有良好效果。
5.酸性染料着色好,碱性染料着色差6.固定的组织需经流水冲洗12-24h,或用亚硫酸盐洗涤。
苦味酸1.黄色结晶体,是一种强酸,易燃易爆,配成饱和溶液储藏2.穿透慢,组织收缩明显,无明显硬化。
3.能沉淀一切蛋白质4.对脂肪和类脂无固定作用。
5. 可软化皮肤和火棉胶,不宜用火棉胶包埋6. 固定时间不宜超过24h,7. 固定的组织应尽快放入70%乙醇,滴加饱和碳酸锂或浓氨水,有助于除去苦味酸固定产生的黄色。
升汞1. 浓度为5%-7%的水溶液,针状结晶2.穿透力低,只宜固定薄片组织,单独应用组织收缩明显3, 对蛋白质有固定作用,4. 对类脂和糖类无固定作用5. 临用时加冰醋酸醋酸1. 刺激性气味的无色液体,低于15℃为冰醋酸5%的醋酸PH为2-8,可抑制细菌和酶的活性,可防止自溶。
2. 穿透力强3 不能沉淀白蛋白,球蛋白,但能沉淀核蛋白4 不能固定脂肪和内酯,不能保存糖5 .固定线粒体和高尔基复合体不能用高浓度的醋酸,可较好的保存染色体6, 缺点是组织膨胀明显,尤其对于胶原纤维和纤维蛋白铬酸1.为三氧化铬的水溶液,浓度%-1%,强氧化剂,不能与乙醇,甲醛等混合2 穿透力弱,一般组织需固定12-24h,固定的组织有收缩,3 能沉淀蛋白质,核蛋白固定良好。
4 对脂肪无固定作用5 固定线粒体和高尔基复合体6. 宜避光保存,以防蛋白质溶解。
7. 必须彻底流水冲洗(≥24h)。
锇酸(四氧化锇)1.淡黄色结晶,剧毒,浓度1%-2%,强氧化剂,不能与乙醇,甲醛等混合2. 渗透力极弱,易使组织变硬,延长固定时间,组织的脆性增加,对染色不利。
髓鞘染色

髓鞘染色操作步骤试剂:Luxol 固蓝MBS(solvent blue 38),乙醇,碳酸锂,冰醋酸切片:8-12um溶液1. 0.1% 固蓝溶液固蓝0.1 g95%乙醇100 ml冰醋酸0.5 ml取固蓝0.1g 加入95%乙醇,在温度50-60℃条件下,于磁力搅拌器中搅拌,用冰乙酸0.5 ml。
2. 0.05%碳酸锂溶液碳酸锂0.05 g去离子水100 ml充分混均。
3. 0.1%甲苯酚紫溶液甲苯酚紫0.1 g95%乙醇100 ml冰醋酸0.5 ml取甲苯酚紫0.1g 加入95%乙醇,在温度50-60℃条件下,于磁力搅拌器中搅拌,用冰乙酸0.5 ml。
染色1. 取出切片,于95%乙醇溶液中浸泡3 min。
2. 取出切片,置于Luxol固蓝溶液中,在57℃温度下,孵育4小时。
3. 取出切片,于95%乙醇溶液中浸洗3 min。
4. 取出切片,于去离子水中浸洗3 min。
5. 切片于0.05%碳酸锂溶液中快速浸洗15 s。
6. 立即取出切片,置于70%乙醇溶液中分化10s,直到灰质和白质能够清晰辨别。
7. 立即取出切片,置于70%乙醇溶液中分化20s,直到灰质和白质能够清晰辨别。
8. 取出切片,于去离子水中冲洗3min。
9. 将切片置于Luxol固蓝溶液中,在57℃温度下,孵育10s。
10. 切片于95%乙醇溶液中浸泡2 min。
11.切片于95%乙醇溶液中浸泡2 min。
12.切片于100%乙醇溶液中浸泡2 min。
13.切片于100%乙醇溶液中浸泡2 min。
14.二甲苯透明2 min。
中性树胶封固。
15. 镜下观察髓鞘。
结果:髓鞘:蓝绿色。
尼氏体:紫色。
介绍一种周围神经纤维和髓鞘的染色法

介绍一种周围神经纤维和髓鞘的染色法
李晨薇
【期刊名称】《现代检验医学杂志》
【年(卷),期】2003(018)002
【摘要】@@ 神经纤维和髓鞘的染色法很多,一般均为单一染色.我们经反复试验在镀银后再进行丽春红套染色,显色对比度好,能清晰地分辨神经纤维和髓鞘.同时一些细微组织的成分结构(如神经内膜、神经束膜等)亦明显被衬托出来,为神经病理学的诊断提供了方便.
【总页数】1页(P23-23)
【作者】李晨薇
【作者单位】陕西省礼泉县医院病理科,陕西,礼泉,713200
【正文语种】中文
【中图分类】R446.8
【相关文献】
1.介绍一种新的神经纤维染色法 [J], 刘红刚;杨金辉
2.介绍一种神经髓鞘染色法 [J], 田玉旺;丁华野;李琳;李丽;黄晓南
3.介绍一种简便快捷的髓鞘染色法 [J], 张革进;陈晨
4.显微拉曼光谱技术联合Karnovsky-Roots染色法快速鉴别周围神经纤维的功能性质 [J], 徐沁同;陈增淦;张键;费琴明;周建平;张峰;姚文华
5.介绍一种新的神经髓鞘染色法 [J], 田玉旺;丁华野;邢惠清;黄晓南
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
髓鞘染色液(丽春红G 法)
简介:
髓鞘(Myelin Sheath)是包裹在神经细胞轴突外面的一层膜,即髓鞘由髓鞘细胞和细胞膜组成,是神经膜细胞的质膜沿着轴索的轴心螺旋缠绕形成的多层脂双层结构, 髓鞘上有郎飞氏结,可使神经冲动跳跃传递。
髓鞘染色在病理诊断中有一定意义,髓鞘的病理变化分为早期、中期和晚期。
Leagene 髓鞘染色液(丽春红G 法)利用丽春红G 和亮绿复合染色,其中丽春红使神经髓鞘着红色,亮绿使轴索、神经束衣等着绿色。
组成:
操作步骤(仅供参考):
1、 固定:宜采用中性甲醛钙固定。
2、 石蜡切片常规脱蜡至蒸馏水。
3、 入丽春红G 染色液浸染。
4、 蒸馏水冲洗。
5、 入MG 媒染液处理。
6、 蒸馏水冲洗。
7、 入亮绿染色液复染。
7、MG 分化液分化,自来水洗。
8、乙醇梯度脱水,二甲苯透明,中性树胶封固。
染色结果:
髓鞘
红色,横切面多成环状 轴索、神经束衣、神经内衣 绿色
变性髓鞘
半环状或不着色
编号 名称
DK0013 4×50ml Storage 试剂(A): 丽春红G 染色液 50ml RT 避光 试剂(B): MG 媒染液 50ml RT 避光 试剂(C): 亮绿染色液 50ml RT 避光 试剂(D): MG 分化液 250ml
RT 使用说明书
1份
注意事项:
1、分化这一步很关键,需在镜下观察分化程度。
2、固定液以10%甲醛钙固定液为佳,亦可用10%中性福尔马林替代。
3、MG分化液应注意防止挥发,以免分化效率下降。
4、为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:12个月有效。
相关:
编号名称
DC0032 Masson三色染色液
DF0111 中性福尔马林固定液(10%)
DG0005 糖原PAS染色液
DH0001 改良Lillie-Mayer苏木素染色液
IH0270 甘油明胶封固液
NH0043 SSC缓冲液(20×,pH7.0)
PS0013 RIPA裂解液(强)
TC0699 葡植物总糖和还原糖检测试剂盒(硝基水杨酸法)。
