PSUR报告模板
PSUR-布洛芬片定期安全性更新报告模板

(布洛芬片药品)定期安全性更新报告第 2 次报告报告期:2013年 1 月1 日至2019 年6 月30 日报告提交时间:2019年7月19日目录一、前言 (3)二、主要内容 (3)(一)、药品的基本信息 (3)(二)、国内外上市情况 (5)1、国内外上市情况参照下表: (5)2、药品批准上市时提出的有关要求(安全性要求): (5)3、批准的适应症(功能主治)和特殊人群: (6)4、注册情况: (7)(三)、因药品安全性原因而采取措施的情况 (7)(四)、药品安全性信息的变更情况: (8)(五)、用药人数估算资料 (8)(六)、药品不良反应报告信息: (8)1、个例药品不良反应: (8)2、药品群体不良事件 (8)(七)、安全性相关的研究信息 (8)(八)、其他信息 (9)1、与疗效有关的信息 (9)2、数据截止日后的新信息 (9)3、风险管理计划 (9)4、专题分析报告 (9)(九)、药品安全性分析评价结果 (9)(十)、结论 (10)(十一)、附件 (11)附件1:药品批准证明文件;附件2:药品质量标准;附件3:药品说明书;附件4:参考文献;正文(说明:本报告所报药品本公司已经有长时间没有生产)一、前言1、布洛芬片为化药制剂产品,我公司布洛芬片的批准文号:国药准字H****,规格为每片0.1克。
2002年10月16日,取得药品注册证;2009年12月14日,获得了药品再注册批件;2014年12月5日,获得了药品再注册批件。
2、布洛芬片,适应症为适用于:①.缓解类风湿关节炎、骨关节炎、脊柱关节病、痛风性关节炎、风湿性关节炎等各种慢性关节炎的急性发作期或持续性的关节肿痛症状,无病因治疗及控制病程的作用。
②.治疗非关节性的各种软组织风湿性疼痛,如肩痛、腱鞘炎、滑囊炎、肌痛及运动后损伤性疼痛等。
③.急性的轻、中度疼痛如:手术后、创伤后、劳损后、原发性痛经、牙痛、头痛等。
④.对成人和儿童的发热有解热作用。
PSUR报告(药品定期安全性报告)模板

某中药注射液定期安全性报告(PSUR模板)一、药品不良反应报告总体概况1、报告总数2009年到2011年我公司收到我省药品不良反应监测中心转发国家药品不良反应监测中心收集、记录的“某中药注射液个例药品不良反应病例”1458例,依此整理形成《药品不良反应/事件报告表》1458份。
2、每年报告数图1-1 2009-2011 年某中药注射液药品不良反应/事件报告数3、报告表类型2009-2011年根据我省药品不良反应监测中心转发国家药品不良反应监测中心收集、记录的“某中药注射液个例药品不良反应病例”,我省药品不良反应监测中心收到关于我公司某中药注射液不良反应/事件报告中,没有群体不良反应报告及死亡报告,一般药品不良反应报告979份,占67.1%;新的一般不良反应报告403份,占27.6%;严重药品不良反应41份,占 2.8% ;新的严重不良反应报告35份,占2.4%。
图1-2 2009-2012年某中药注射液 药品不良反应/事件报告类型统计二、涉及患者信息1、年龄分布2009-2011年不良反应/事件某中药注射液报告中,小于1岁的案例为0,1-4岁的5例,占0.3%; 5-14岁的11例,占 0.8%;15-30 岁的 119 例,占 0.8%; 31-45 岁的 305 例,占 21% 46-60岁的453例,占31% 61岁以上的555例,占38% 从分 布情况看,45-60岁及61岁以上的中老年人比例很高,提示中 老年人更易出现严重药品不良反应/事件。
3.5%■—般扭寺 ■严重银告 ■新的一般禾告图2-1 2009-2012年细某中药注射液药品不良反应/事件患者年龄分布2、性别2009-2011年某中药注射液不良反应/事件报告中,具体分布如下:某中药注射液男性783例,占53.7%;女性675例,占46.3%;男女比是1.16。
图2-2 2009-2011 年某中药注射液药品不良反应/事件患者性别分布3、体重依据2009-2011年不良反应/事件报告,我公司某中药注射液给药方式均是按说明书用量给药,并非是按体表面积差异给药,其中个别个体给药量比说明书要求量多,这些个体年龄分布无规律,仅属于医生根据实际情况进行判断的。
psur报告模板

竭诚为您提供优质文档/双击可除psur报告模板篇一:psuR报告大纲********定期安全性更新报告第1次报告报告期:报告提交时间:国内首次获得药品批准证明文件时间:国际诞生日(ibd)以及国家:药品生产企业:地址:邮编:传真:负责药品安全的部门:负责人:手机:固定电话:电子邮箱:目录一、药品基本信息................................................. ................................................... .. (3)1、药品通用名称:...................................................................................32、药品商品名称:............................................... ................................................... ....................................33、剂型:............................................... ................................................... ................................................... .34、规格:............................................... ................................................... ................................................... .35、批准文号:............................................... ................................................... ............................................36、处方组成:............................................... ................................................... ............................................37、功能主治:...........................................................................................38、用法用量:............................................... ................................................... ............................................3二、国内外上市情况................................................. ................................................... . (3)1、获得上市许可的国家:............................................... ................................................... ........................32、获得上市许可的时间:............................................... ................................................... ........................33、首次上市销售商品名:............................................... ................................................... ........................34、首次上市销售的时间:............................................... ...........................................................................35、批准上市时提出的要求:............................................... ................................................... ....................36、批准的适应症和特殊人群:............................................... ................................................... ................3三、因药品安全原因而采取措施的情况................................................. ................................................... .. (3)1、暂停生产、销售、使用,撤销药品批准证明文件:............................................... ............................32、再注册申请未获批准:............................................... ................................................... ........................33、限制销售:............................................... ................................................... ............................................34、暂停临床研究:............................................... .......................................................................................35、剂量调整:............................................... ................................................... ............................................36、改变用药人群或适应症(功能主治):.............................................. .................................................37、改变剂型或处方:............................................... ................................................... ................................38、改变或限制给药途径:............................................... ................................................... ........................3四、药品安全性信息的变更:............................................... ................................................... ..........................3五、估算用药人数:............................................... ................................................... ..........................................3六、药品不良反应报告信息:...............................................。
定期安全性更新报告(PSUR)提交表

定期安全性更新报告(PSUR)提交表关于定期安全更新报告提交表和进口药品在境外发生的不良反应/事件报告表的填写说明为全面贯彻落实《药品不良反应报告和监测管理办法》(以下简称《办法》),国家食品药品监督管理局药品安全监管司在《关于定期汇总报告和进口药品境外发生的不良反应报告有关问题解释的通知》(国食药监安[2005]89号)文件中对有关问题进行了详细的说明。
同时,此文件中公布了两份表格,分别是“定期安全更新报告提交表”和“进口药品在境外发生的不良反应/事件报告表”,为方便大家填写,现将两份表格的填写要求进行如下说明,以供大家参考:一、定期安全更新报告(PSUR)提交表填写说明1、按国食药监安[2005]89号文件的具体规定提交定期安全更新报告(PSUR),每份报告前附定期安全更新报告提交表。
2、数据起止时间是指本期报告数据资料的起止时间。
3、报告单位相关信息根据实际情况填写,填写信息一旦发生变更请及时同我中心进行沟通。
4、产品信息根据实际情况填写。
5、产品情况说明:主要填写产品国内外相关重要信息,包括:国内外规格、剂型、用法用量、适应症异同、说明书差异等。
如表格空间不够时可另附页说明,附页上标明“产品情况说明”。
6、本期报告评论:简述报告中值得关注的内容,尤其是有关国内的信息及建议。
如表格空间不够时可另附页说明,附页上标明“本期报告评论”。
7、请附国内说明书1份。
二、进口药品在境外发生的不良反应/事件报告表填表说明1、按《办法》和国食药监安[2005]89号文件的具体要求报告进口药品在境外发生的不良反应/事件报告表。
2、每个品种填写一份报告表。
3、商品名、通用名:请同时填写中文和英文名称。
4、病例编号:本单位的病例编号,注意与原始报告编号保持一致。
5、报告类别:新的、严重的、新的并且严重的,可以分别用N,S和N&S符号填写。
6、不良反应/事件名称:所有不良反应表现,标准名称参见《WHO药品不良反应术语集》。
psur报告

psur报告
PSUR(Pperiodic Safety Update Report)报告是由药品注册持有人向监管机构提交的周期性安全更新报告。
这些报告旨在提供药品的整体安全性和有效性的最新信息。
下面是PSUR报告的一般结构和内容:
1. 概要:提供报告的目的和范围,以及报告期间的药品使用情况的基本信息。
2. 药品概述:介绍所涉及药品的基本信息和特点,包括药品名称、剂型、适应症和使用方法。
3. 安全性数据:列出在报告期间发生的所有不良事件和副作用,并对其进行分类和评估。
还可以包括新的安全监测结果、临床试验数据和文献研究的总结。
4. 效力数据:总结报告期间的临床试验结果、药物疗效和治疗效果的新信息。
5. 风险-益关系:综合评估药品的风险和益处,并讨论报告期
间是否存在新的安全问题或改变的使用风险。
6. 信号检测:对可能存在的新安全问题进行信号检测和分析,以确定是否需要进一步的调查或监测。
7. 风险管理:讨论和评估已实施的风险管理措施,并提出可能需要采取的新措施建议。
8. 总结和结论:总结报告期间的主要安全性和有效性结果,提出任何需要采取的行动建议。
这些报告通常由医药公司的药物安全部门或负责药品监测的专业人员编制。
监管机构会审查这些报告,并根据其内容对药品的安全性和有效性进行评估和监控。
PSUR报告(药品定期安全性报告)模板

某中药注射液定期安全性报告(PSUR模板)一、药品不良反应报告总体概况1、报告总数2009年到2011年我公司收到我省药品不良反应监测中心转发国家药品不良反应监测中心收集、记录的“某中药注射液个例药品不良反应病例”1458例,依此整理形成《药品不良反应/事件报告表》1458份。
2、每年报告数图1-1 2009-2011 年某中药注射液药品不良反应/事件报告数3、报告表类型2009-2011年根据我省药品不良反应监测中心转发国家药品不良反应监测中心收集、记录的“某中药注射液个例药品不良反应病例”,我省药品不良反应监测中心收到关于我公司某中药注射液不良反应/事件报告中,没有群体不良反应报告及死亡报告,一般药品不良反应报告979份,占67.1%;新的一般不良反应报告403份,占27.6%;严重药品不良反应41份,占 2.8% ;新的严重不良反应报告35份,占2.4%。
图1-2 2009-2012年某中药注射液 药品不良反应/事件报告类型统计二、涉及患者信息1、年龄分布2009-2011年不良反应/事件某中药注射液报告中,小于1岁的案例为0,1-4岁的5例,占0.3%; 5-14岁的11例,占 0.8%;15-30 岁的 119 例,占 0.8%; 31-45 岁的 305 例,占 21% 46-60岁的453例,占31% 61岁以上的555例,占38% 从分 布情况看,45-60岁及61岁以上的中老年人比例很高,提示中 老年人更易出现严重药品不良反应/事件。
3.5%■—般扭寺 ■严重银告 ■新的一般禾告图2-1 2009-2012年细某中药注射液药品不良反应/事件患者年龄分布2、性别2009-2011年某中药注射液不良反应/事件报告中,具体分布如下:某中药注射液男性783例,占53.7%;女性675例,占46.3%;男女比是1.16。
图2-2 2009-2011 年某中药注射液药品不良反应/事件患者性别分布3、体重依据2009-2011年不良反应/事件报告,我公司某中药注射液给药方式均是按说明书用量给药,并非是按体表面积差异给药,其中个别个体给药量比说明书要求量多,这些个体年龄分布无规律,仅属于医生根据实际情况进行判断的。
定期安全性更新报告(PSUR)提交表 .doc
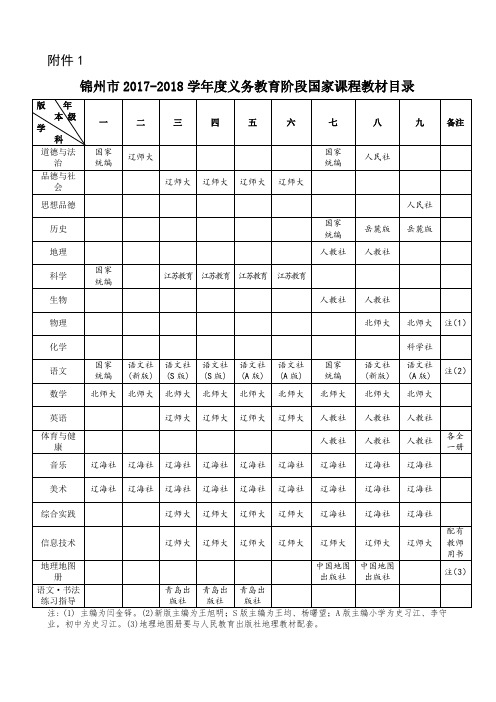
锦州市2017-2018学年度义务教育阶段国家课程教材目录
版 年
本 级
学
科
一
二
三
四
五
六
七
八
九
备注
道德与法治
国家
统编
辽师大
国家
统编
人民社
品德与社会
辽师大
辽师大
辽师大
辽师大
思想品德
人民社
历史
国家
统编
岳麓版
岳麓版
地理
人教社
人教社
科学
国家
统编
江苏教育
江苏教育
江苏教育
江苏教育
生物
人教社
人教社
物理
北师大
北师大
注(1)
化学
科学社
语文
国家
统编
语文社
(新版)
语文社
(S版)
语文社
(S版)
语文社
(A版)
语文社
(A版)
国家
统编
语文社
(新版)
语文社
(A版)
注(2)
数学
北师大
北师大
北师大
北师大
北师大
北师大
北师大
北师大
北师大
英语
辽师大
辽师大
辽师大
辽师大
人教社
人教社
人教社
体育与健康
人教社
人教社
人教社
各全一册
音乐
辽海社
辽海社
注: (1) 主编为闫金铎。(2)新版主编为王旭明;S版主编为王均、杨曙望;A版主编小学为史习江、李守业,初中为史习江。(3)地理地图册要与人民教育出版社地理教材配套。
欧盟psur报告模板-解释说明

欧盟psur报告模板-范文模板及概述示例1:欧盟PSUR报告模板是指欧盟要求医药企业提交的药物安全性更新报告模板。
PSUR(Periodic Safety Update Report)即定期安全性更新报告,是指药物生命周期管理过程中医药企业需要按照一定的时限,定期向监管机构提交的关于药物安全性信息的报告。
欧盟PSUR报告模板旨在确保欧盟范围内销售的药物的安全性,包括有效性和可接受性。
该模板涵盖了广泛的药物信息,包括药物的化学成分、生产和质量控制、药理学特性、剂量选择和用法、临床研究数据、国内和国际市场销售数据以及药物的不良反应和安全性评价等方面。
欧盟PSUR报告模板的目的是为了让监管机构能够对药物的安全性有一个全面的了解,并及时采取必要的措施来保护患者的安全。
同时,PSUR 还可以帮助医药企业监控和评估药物的安全性和效能,并在必要时进行修正和调整。
欧盟PSUR报告模板的内容需根据具体指导文件进行填写,并按照规定的时间表提交给相关监管机构。
医药企业需要收集和整理药物的相关信息,并进行分析和解释,以确保报告的准确性和可靠性。
总之,欧盟PSUR报告模板是欧盟要求医药企业按照一定的时限提交的药物安全性更新报告模板。
它对于保障药物的安全性、监测和评估药物的效能、保护患者的健康至关重要。
医药企业应该十分重视PSUR报告的准备和提交,并确保报告内容的全面和准确。
示例2:标题:欧盟PSUR报告模板:简化药品安全监测流程的利器引言:随着药品市场的不断发展,保障药品安全和监测药品的效果成为了至关重要的任务。
欧盟药品安全监测系统中的Periodic Safety Update Reports (PSURs)报告,对于评估药品的安全性和有效性至关重要。
本文将介绍欧盟PSUR报告模板的重要性,并探讨它在简化药品安全监测流程中的作用。
一、欧盟PSUR报告模板的背景与意义1. 欧盟药品安全监测系统的重要性2. PSUR报告的目的与要求二、欧盟PSUR报告模板的基本框架1. 报告的格式与结构2. 包含的重要信息与要点三、欧盟PSUR报告模板的优势与应用价值1. 简化数据收集和整理的过程2. 提高药品安全监测效率3. 促进跨国合作和信息共享4. 加强监管机构与制药公司之间的合作四、欧盟PSUR报告模板的挑战与改进方向1. 多样性的药品市场和监测需求2. 数据采集和分析的标准化结论:欧盟PSUR报告模板作为药品安全监测的重要工具,在简化流程、提高效率、促进合作等方面发挥了显著作用。
PSUR定期安全性更新报告

(冷冻减脂塑形仪)定期安全性更新报告第一次报告报告期:2017 年12月至2019 年12月报告提交时间:2019年12月国内首次获得医疗器械批准证明文件时间:2017年06月30国际研发授权(ODM)以及国家:意大利米兰,中国大陆医疗器械生产企业:地址:邮编:传真:负责医疗器械安全的部门:研发部/营销部负责人:手机:固定电话:电子邮箱:一、前言 (3)二、主要内容 (4)(一)、医疗器械的基本信息 (4)(二)、国内外上市情况 (5)(1)、国内外上市情况参照下表: (5)(2)、医疗器械批准上市时提出的有关要求(安全性要求): (5)(3)、批准的适应症(功能主治)和特殊人群: (5)(4)注册情况: (6)(三)、因医疗器械安全性原因而采取措施的情况 (6)(四)、医疗器械安全性信息的变更情况: (7)(五)治疗人数估算资料 (7)(六)医疗器械不良反应报告信息: (9)(1)个例医疗器械不良反应: (9)(2)医疗器械群体不良事件 (12)(七)安全性相关的研究信息 (12)(1)已完成的研究 (12)(2)计划或正在进行的研究 (12)(3)已发表的研究 (13)(八)其他信息 (13)(1)与疗效有关的信息 (13)(2)数据截止2月后的新信息 (13)(3)风险管理计划 (13)(4)专题分析报告 (13)(九)医疗器械安全性分析评价结果 (13)(十)结论 (14)(十一)附件 (13)一、前言冷冻减脂塑形仪源自利用人体真皮层下不同的组织对于低温有不同的耐受度的原理而设计成的。
皮下脂肪是皮肤中最不耐低温的部分,因此利用脂肪不耐冷的特性,使用摄氏约零下10至零下11度的皮肤冷凝治疗器,将冷冻波传送至脂肪的部位,例如:腰部、腹部、背部等脂肪堆积处。
经过一段治疗时间后,遇冷破坏的脂肪在之后的二周到二、个月的时间里,透过身体淋巴组织自然代谢过程排出体外。
重要的是,除了脂肪细胞排出之外,其它的皮肤、神经、血管、皮下的干细胞等均得到恢复而不受影响。
×××药品PSUR模板

个例不良反应报告。 (2)、药品群体不良事件: 我公司×××药品自上市以来,未发生过群体不良反应。
七、安全性相关的研究信息 (1)、已完成的研究:我公司未对×××药品进行药品安全性相关研究。 (2)、计划或正在进行的研究:我公司没有计划进行×××药品药品安
全性相关研究。 (3)、已发表的研究:经查询维普网期刊文献数据库,以×××为检索
获得了药品再注册批件。本药品用于便秘的治疗,临床使用疗效确切、质量
稳定、使用安全。
【药品名称】
通用名称:×××药品
汉语拼音: Kai sai lu
【成 分】主要成份为甘油。
【性 状】本品为无色、澄清的黏稠液体。
【功能主治】用于便秘的治疗。
【规 格】10ml;20ml。
【用法用量】将容器顶端刺破或剪开,涂以油脂少许,缓慢插入肛门,然后
第5页共6页
本品放在儿童不能接触的地方;儿童必须在成人监护下使用;如正在使用其 他药品,使用本品前请咨询医师或药师;对于哺乳期的妇女、儿童、老人应 在医师指导下使用。 十、结论
(1)、我公司没有收集到既往的累积数据以及药品说明书不一致的安全 性资料。
(2)针对药品的特殊性、安全性及风险性,我公司特制订了×××药品 的风险管理计划计划,严格按照 GMP 要求及批准工艺处方组织生产,做好 各工序监控,做好药品不良反应收集和用户投诉信息反馈工作,保证广大患 者用药安全。 十一、附件
将药液挤入直肠内,儿童一次 10ml,成人一次 20ml。
二、国内外上市情况
(1)、国内外上市情况汇总表
国家 中国 中国
商品名
×××药 品
×××药 品
注册状 态
已批准
已批准
注册批准 日
psur报告

psur报告:药品安全是一项长期的监管任务随着医疗技术的进步,新药的研发速度也越来越快,同时药品安全问题也引起了越来越多的关注。
为了确保药品的安全性和有效性,药品监管机构制定了一系列的监管措施,并要求药品企业提交。
全称为定期安全性报告(Periodic Safety Update Report),其目的是通过定期跟踪和分析药品的安全性和有效性情况,确保药品使用过程中的风险最小化,并在不断的实践中进一步完善药品的安全性和有效性。
这种监管措施有助于促进药品的合理化使用,有效地保障人民的健康和生命安全。
药品企业需要根据监管机构的要求,定期提交。
报告内容通常包括药品的临床试验数据、药品的使用情况、药品在市场上的监测情况等等,其中最重要的是药品的安全性信息。
报告结果将被药监部门进行评估和审核,从而确定采取的行动,包括但不限于:“保持药品上市许可证的有效性”、“对药品进行新的限制”、“对药品进行暂停或撤销许可证”等。
从的要求和审核标准来看,药监机构非常重视药品的安全性问题。
这也表明了药品安全问题在医药领域是不可忽略的。
对于药品企业来说,药品安全性是他们研发新药的首要保证。
药企需要最大程度地确保研发的药品安全性和有效性,以此为依据向药监机构申请上市许可证。
同时,药品的安全性也是一个动态的过程。
由于人的体质和病情不同,药品在使用过程中也可能出现不同程度的副作用和安全性问题,这就需要通过,对药品的安全性进行长期、系统的监测和分析。
在实践中,的要求和审核标准也在不断演进和完善。
药监机构对于的审核标准越来越严格,药品企业也必须不断完善药品的安全性和效用等信息,以保持药品的市场竞争力。
综上所述,是药品安全监管体系的一个重要组成部分,是药品安全评价的重要手段。
在今后的实践中,监管机构和药企需要积极合作,保证的质量和准确性,以此确保药品的安全性和有效性。
1---PSUR撰写模板

(模版)XXXX定期安全性更新报告第次报告报告期:XX年XX 月XX 日至XX 年XX 月XX日报告提交时间:XX年XX 月XX 日国内首次获得药品批准证明文件时间:年月日国际诞生日(IBD)以及国家:药品生产企业:地址:邮编:传真:负责药品安全的部门:负责人:手机:固定电话:电子邮箱:目录一、药品的基本信息.........................................................................................................................二、国内外上市情况.........................................................................................................................1、获得上市许可的国家和时间、当前注册状态、首次上市销售时间、商品名等 ...........2、药品批准上市时提出的有关要求,特别是与安全性有关的要求 ...................................3、批准的适应症(功能主治)和特殊人群...........................................................................3.1批准的适应症.................................................................................................................3.2特殊人群用药信息.........................................................................................................4、注册申请未获得管理部门批准的原因...............................................................................5、药品生产企业因药品安全性或疗效原因而撤回的注册申请 ...........................................三、因药品安全性原因而采取措施的情况.....................................................................................四、药品安全性信息的变更情况.....................................................................................................1、报告期内说明书核准日期...................................................................................................2、报告期内药品说明书中的安全性相关内容的修改情况 ...................................................3、我国与其他国家药品说明书中的安全性信息存在的差别及原因 ...................................4、其他国家采取某种安全性措施,而药品生产企业并未修改我国药品说明书中的相关安全性资料及理由.....................................................................................................................五、用药人数估算资料.....................................................................................................................六、药品不良反应报告信息.............................................................................................................1、个例药品不良反应...............................................................................................................1.1病例列表.........................................................................................................................1.2 汇总表............................................................................................................................1.3 个例药品不良反应分析................................................................................................2、药品群体不良事件...............................................................................................................七、安全性相关的研究信息.............................................................................................................1、已完成的研究.......................................................................................................................2、计划或正在进行的研究.......................................................................................................3、已发表的研究.......................................................................................................................八、其他信息.....................................................................................................................................1、与疗效有关的信息...............................................................................................................2、数据截止日后的新信息.......................................................................................................3、风险管理计划.......................................................................................................................4、专题分析报告.......................................................................................................................九、药品安全性分析评价结果.........................................................................................................十、结论............................................................................................................................................. 十一、附件.........................................................................................................................................一、药品的基本信息1.1药品名称1.1.1通用名称:1.1.2商品名称:1.2剂型:1.3规格:1.4批准文号:1.5活性成份:1.6适应症:1.7用法用量:二、国内外上市情况1、获得上市许可的国家和时间、当前注册状态、首次上市销售时间、商品名等表一:国内外上市情况(注意:如果本企业的同产品没有在国外上市,请不要填写国外上市情况)2、药品批准上市时提出的有关要求,特别是与安全性有关的要求XXXX获得批准上市时未提出有关要求。
PSUR报告模板

PSUR报告模板附件:一、封面,药品,定期安全性更新报告第次报告报告期: 年月日至年月日报告提交时间:国内首次获得药品批准证明文件时间: 年月日国际诞生日(IBD)以及国家:药品生产企业:地址:邮编:传真:负责药品安全的部门:负责人:手机:固定电话:电子邮箱:机密公告本报告及所有附表或附件可能包含机密信息~仅收件人才可使用。
本报告及所有附表或附件的所有权均属于XXX公司。
如果本报告及所有附表或附件的收件人为非指定的接收者~禁止浏览、传播、分发、拷贝或以其他方式使用本报告及所有附表或附件。
二、目录一、封面...............................................................1 二、目录 (2)三、正文………………………………………………………3 (一)药品基本信息…………………………………………… (二)国内外上市情况………………………………………… (三)因药品安全性原因而采取措施的情况………………… (四)药品安全性信息的变更情况…………………………… (五)用药人数估算资料……………………………………… (六)药品不良反应报告信息………………………………… 1、个例药品不良反应………………………………………… 2、药品群体不良事件…………………………………………………………(十一)附件……………………………………………………备注:目录应尽可能详细,一般包含三级目录,各药品生产企业根据实际情况编撰。
三、正文(一)药品基本信息药品基本信息包括药品的名称(通用名称、商品名称)、剂型、规格、批准文号、活性成分(处方组成)、适应症(功能主治)和用法用量,应以药物说明书为基础填写完整。
(二)国内外上市情况1、药品是否在欧美国家上市;如是,在哪些上市国家,有条件批准的上市条件、注册申请未获管理部门批准的原因、因药品安全性或疗效原因而撤回注册申请等情况如何;2、国外的适应症、治疗人群、剂型、剂量是否与国内有显著差异,具体差异如何。
PSUR模板(仅供参考)

某药品定期安全性更新报告第01次报告报告期:XXXX年XX月XX日至XXXX年XX 月XX 日报告提交时间:年月日国内首次获得药品批准证明文件时间:XXXX年XX月XX日国际诞生日(IBD)以及国家:xxxx年xx月xx日XXX国药品生产企业:地址:邮编:传真:负责药品安全的部门:负责人:手机:固定电话:电子邮箱:目录真实性声明本公司对本报告中所涉及的所有内容、材料及数据的真实性、合法性负法律责任。
特此声明XXXXX有限公司二〇一三年月日目录一、药品基本信息 (6)二、国内外上市情况 (6)(一)国内外上市情况汇总表 (6)(二)药品批准上市时提出的有关要求,特别是与安全性有关的要求 (7)(三)批准的适应症(功能主治)和特殊人群 (7)(四)注册申请未获管理部门批准的原因 (7)(五)因药品安全性或疗效原因而撤回的注册申请的情况 (7)三、因药品安全性而采取措施的情况 (8)(一)暂停生产、销售、使用,撤销药品批准证明文件 (8)(二)再注册申请未获批准 (8)(三)限制销售 (9)(四)暂停临床试验 (9)(五)剂量调整 (9)(六)改变用药人群或者适应症(功能主治) (9)(七)改变剂型或处方 (9)(八)改变或限制给药途径 (10)(九)其他风险控制措施 (10)四、药品安全信息的变更情况: (11)(一)本期报告所依据的药品说明书核准日期(修订日期) (11)(二)上期报告所依据的药品说明书核准日期(修订日期) (11)(三)报告期内药品说明书中安全性相关内容的修改情况(按照实际情况填写): . 11(四)其他 (12)五、用药人数估算资料 (12)六、药品不良反应报告信息 (13)(一)药品不良反应情况 (13)(二)个例药品不良反应 (14)1.药品不良反应病例列表(新的、严重不良反应) (14)2.个例药品不良反应汇总表(所有不良反应) (16)3.分析个例药品不良反应 (16)(三)药品群体不良事件的情况: (17)七、安全性相关的研究信息: (17)(一)已完成的研究: (17)1.非临床研究资料 (17)2.临床研究资料 (18)(二)计划或正在进行的研究 (18)(三)已发表的研究 (18)八、其他信息: (19)(一)与疗效有关的信息 (19)(二)数据截止日后的新信息 (19)(三)风险管理计划 (19)1.修改药品说明书 (19)2.医生干预: (20)3.风险最小化行动 (20)(四)专题分析报告 (20)九、药品安全性分析评价结果 (20)(一)已知不良反应的特点是否发生改变,如严重程度、不良反应结果、目标人群等20(二)已知不良反应的报告频率是否增加,评价这种变化是否说明不良反应发生率有变化 (21)(三)新的且严重的不良反应对总体安全性评估的影响 (21)(四)新的非严重不良反应对总体安全性评估的影响 (21)(五)报告还应说明的各项新的安全信息 (21)十、结论 (22)(一)与既往的累积数据以及药品说明书不一致的安全性资料 (22)(二)建议的措施或已采取的措施和措施的必要性 (22)(三)小结 (22)十一、附件 (23)(一)某药品批准证明文件 (23)(二)某药品质量标准 (23)(三)某药品说明书 (23)(四)参考文献 (23)(五)其他需要提交的资料 (23)一、药品基本信息通用名称:商品名称:剂型:规格:批准文号:活性成分(处方组成):适应症(功能主治):用法用量:注:应按照说明书上内容如实书写,无缺项。
PSUR定期安全性更新报告

(冷冻减脂塑形仪)定期安全性更新报告第一次报告报告期:2017 年12月至2019 年12月报告提交时间:2019年12月国内首次获得医疗器械批准证明文件时间:2017年06月30国际研发授权(ODM)以及国家:意大利米兰,中国大陆医疗器械生产企业:地址:邮编:传真:负责医疗器械安全的部门:研发部/营销部负责人:手机:固定电话:电子邮箱:一、前言 (3)二、主要内容 (4)(一)、医疗器械的基本信息 (4)(二)、国内外上市情况 (5)(1)、国内外上市情况参照下表: (5)(2)、医疗器械批准上市时提出的有关要求(安全性要求): (5)(3)、批准的适应症(功能主治)和特殊人群: (5)(4)注册情况: (6)(三)、因医疗器械安全性原因而采取措施的情况 (6)(四)、医疗器械安全性信息的变更情况: (7)(五)治疗人数估算资料 (7)(六)医疗器械不良反应报告信息: (9)(1)个例医疗器械不良反应: (9)(2)医疗器械群体不良事件 (12)(七)安全性相关的研究信息 (12)(1)已完成的研究 (12)(2)计划或正在进行的研究 (12)(3)已发表的研究 (13)(八)其他信息 (13)(1)与疗效有关的信息 (13)(2)数据截止2月后的新信息 (13)(3)风险管理计划 (13)(4)专题分析报告 (13)(九)医疗器械安全性分析评价结果 (13)(十)结论 (14)(十一)附件 (13)一、前言冷冻减脂塑形仪源自利用人体真皮层下不同的组织对于低温有不同的耐受度的原理而设计成的。
皮下脂肪是皮肤中最不耐低温的部分,因此利用脂肪不耐冷的特性,使用摄氏约零下10至零下11度的皮肤冷凝治疗器,将冷冻波传送至脂肪的部位,例如:腰部、腹部、背部等脂肪堆积处。
经过一段治疗时间后,遇冷破坏的脂肪在之后的二周到二、个月的时间里,透过身体淋巴组织自然代谢过程排出体外。
重要的是,除了脂肪细胞排出之外,其它的皮肤、神经、血管、皮下的干细胞等均得到恢复而不受影响。
PSUR评价意见表模板

黄丸
无
国药准字Z20033020
2003-
02-03
国家
基本药物
医保甲类
OTC乙类
浓缩
丸
每8丸重1.44g(相当于饮片3克)
30000万丸
17
万
产品情况说明:
本产品于2003年2月取得注册批件,适用于……报告期内,无因药品安全性原因而采取措施,有/未对说明书相关药品安全性信息项(如有,什么项)进行修定,企业有/无开展药品安全相关的研究。本品报告期内估计使用人数17万人次,共收集到不良反应报告11例,都为新的不良反应,主要表现为消化道反应及过敏反应。查询相关文献、期刊,检索本品种安全性信息1764篇,安全性信息主要涉及药物性肝损伤及过敏反应。经评估,该药品易引起肝功能损害这一不良反应/该药品已知不良反应的特点和频率是否发生改变,建议……(如:建议严格按照说明书要求用药)。
定期安全性更新报告(PSUR)评价意见表
产品企业名称
湖北8888有限公司
报告期
2003-02-03至2014-12-31
国际诞生日
活性成分
(处方组成)
酒萸肉、茯苓、熟地黄、山药、泽泻、牡丹皮。
药品分类
商品
名称
批准
文号
注册
时间
药品管理状态
剂型
规格
本期国内销量
估计使用人数
六味地
企业申明:
本企业提交的所有材料真实、可信。
负责人:(盖章)
审核意见:
该报告内容较完整,撰写较规范。该品种说明书中所表述不良反应为尚不明确,本报告
期内收集到的11例不良反应都为新的不良反应,建议企业开展安全性评价工作,完善、修改说明书。经评估,对品种暂不予以关注。(国家药品不良反应监测系统中每个品种省中心给予的评价意见,在系统中找到这份报告,报告下面的评价信息,请自行查找)
辛伐他汀片PSUR(定期安全性更新报告)

辛伐他汀片定期安全性更新报告第一次报告报告期:****年**月**日至****年**月**日报告提交时间:****年***月***日国内首次获得药品批准证明文件时间:****年**月国际诞生日(IBD)以及国家:****年**月英国首次批准上市药品生产企业:********药业有限公司地址:*******经济开发区邮编:******传真:****-******负责药品安全的部门:质监部负责人:***手机:139*****固定电话:****-*****电子邮箱:******@机密公告本报告及所有附表或附件可能包含机密信息,仅收件人才可使用。
本报告及所有附表或附件的所有权均属于江苏亚邦爱普森药业有限公司。
如果本报告及所有附表或附件的收件人为非指定的接受者,禁止浏览、传播、分发、拷贝或以其他方式使用本报告及所有附表或附件。
目录一、主要内容(一)药品的基本信息....................................(二)国内外上市情况.....................................1.国内外上市情况参照下表..............................2.药品批准上市时提出的有关要求........................3.批准的适应症(功能主治)和特殊人群...................4.注册情况............................................(三)因药品安全性原因而采取措施的情况..................(四)药品安全性信息的变更情况...........................(五)用药人数估算资料..................................(六)药品不良反应报告信息..............................1.个例药品不良反应...................................2.药品群体不良事件...................................(七)安全相关的研究信息.................................1.已完成的研究.......................................2.计划或正在进行的研究...............................3.已发表的研究.......................................(八)其他信息1.与疗效有关的信息...................................2.数据截止日后的新信息...............................3.风险管理计划.......................................4.专题分析报告.......................................(九)药品安全性分析评价结果.............................(十)结论...............................................二、附件...................................................(一)药品的基本信息通用名称:辛伐他汀片英文名称:Simvastatin Tablets汉语拼音:Xinfatating Pian剂型:片剂,规格:5mg、10mg批准文号:国药准字H****、国药准字H*****活性成分:辛伐他汀适应症:高脂血症对于原发性高胆固醇血症包括杂合子家族性高胆固醇血症、高脂血症或混合性高脂血症的患者,当饮食控制及其它非药物治疗不理想时,结合饮食控制,本品可用于降低升高的总胆固醇、低密度脂蛋白胆固醇、载脂蛋白B和甘油三脂,且可升高高密度脂蛋白胆固醇,从而降低低密度脂蛋白胆固醇/高密度脂蛋白胆固醇及总胆固醇/高密度脂蛋白胆固醇的比率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
某中药注射液定期安全性报告
(PSUR模板)
一、药品不良反应报告总体概况
1、报告总数
2009年到2011年我公司收到我省药品不良反应监测中心转发国家药品不良反应监测中心收集、记录的“某中药注射液个例药品不良反应病例”1458例,依此整理形成《药品不良反应/事件报告表》1458份。
2、每年报告数
图1-1 2009-2011年某中药注射液药品不良反应/事件报告数3、报告表类型
2009-2011年根据我省药品不良反应监测中心转发国家药品不良反应监测中心收集、记录的“某中药注射液个例药品不良反应病例”,我省药品不良反应监测中心收到关于我公司某中药注射液不良反应/事件报告中,没有群体不良反应报告及死亡报告,一般药品不良反应报告979份,占%;新的一般不良反应报告403份,占%;严重药品不良反应41份,占%;新的严重不良反应报告35份,占%。
图1-2 2009-2012年某中药注射液药品不良反应/事件报告
类型统计
二、涉及患者信息
1、年龄分布
2009-2011年不良反应/事件某中药注射液报告中,小于1岁的案例为0,1-4岁的5例,占%;5-14岁的11例,占%;15-30岁的119例,占%;31-45岁的305例,占21%;46-60岁的453例,占31%;61岁以上的555例,占38%。
从分布情况看,45-60岁及61岁以上的中老年人比例很高,提示中老年人更易出现严重药品不良反应/事件。
图2-1 2009-2012年细某中药注射液药品不良反应/事件
患者年龄分布
2、性别
2009-2011年某中药注射液不良反应/事件报告中,具体分布如下:
某中药注射液男性783例,占%;女性675例,占%;男女比是。
图2-2 2009-2011年某中药注射液药品不良反应/事件患
者性别分布
3、体重
依据2009-2011年不良反应/事件报告,我公司某中药注射液给药方式均是按说明书用量给药,并非是按体表面积差异给药,其中个别个体给药量比说明书要求量多,这些个体年龄分布无规律,仅属于医生根据实际情况进行判断的。
4、民族
我公司某中药注射液产品面对群体仅为我国人民,并不涉及出口等问题,依据2009-2011年不良反应/事件报告,在民族分布方面无特别特征。
5、家族药品不良反应、家族病详情
从2009-2011年某中药注射液不良反应/事件报告来看,医疗机构是报告的主要来源,各患者的既往药品不良反应情况、以往病史情况上报情况不理想,虽然各方面的不良反应报告意识虽然逐步加强,但仍然不足,需要进一步完善。
6、原患疾病及对原患疾病的影响
从2009-2011年某中药注射液不良反应/事件报告来看,原患疾病名称描述不统一,需进一步完善;对原患疾病系统的影响中除出现2例导致死亡案例外,大部分为不明显案例,病情严重及病情延长占比例很少,无导致后遗症案例。
某中药注射液不良反应病例的原患疾病系统:心血管系统疾病221例,占%,其中冠心病192例,心肌梗死7例,肺源性心脏病5例,心肌炎6例,高血压性心脏病7例,心律失常3例,主动脉瓣狭窄1例;脑血管系统疾病212例,占%,其中脑梗塞、
脑血栓148例,脑供血不足18例,0脑缺血8例,腔隙性脑梗塞4例,脑梗死22例,脑出血16例;外伤、术伤37例,占%;炎症57例,占%;头痛、头晕、感冒37例,占%;颈/腰椎37例,占%;其他144例,占%。
图2-3 2009-2011年某中药注射液药品不良反应/事件原患疾病系统分布
某中药注射液不良反应/事件对原患疾病系统的影响:不明显495例;病情延长18例;病情加重6例;导致死亡10例。
图2-4 2009-2011年某中药注射液品不良反应/事件对原
患疾病的影响
三、药品信息
1、用药原因
某中药注射液适应症为:夸张血管、增进冠状动脉血流量。
用于心绞痛,亦可用于心肌埂塞等。
从2009-2011年不良反应/事件中看,出现三种治疗原因,分别为皮肤类(牛皮癣)、炎症类(关节炎、盆腔炎)、食物中毒,其中食物中毒已经证实为错误用药所致,其余均与说明书适应症相符。
2、给药途径
某中药注射液给药途径为肌内注射、静脉滴注。
从
2009-2011年不良反应/事件看,某中药注射液给药途径符合要求,全部为静脉滴注。
3、用药数量、药量单位
某中药注射液【用法用量】为肌内注射一次2ml,一日1-2次;静脉滴注一次10-20ml,用5-10%葡萄糖注射液250-500ml 稀释后使用,或遵医嘱。
从2009-2011年不良反应/事件中看,用药单位有ml、mg、%、微升;单位为ml的344例,其中超剂量(>20ml)的占50例,单剂量高达200ml;单位为%的14例;单位为mg的3例;单位微升的4例。
4、用药次数、用药间隔(日)、用药开始时间、用药结束时间
从2009-2011年某中药注射液不良反应/事件看,用药1次的505例,用药2次的14例,用药3次的2例,用药间隔均为1日;用药开始时间到用药结束时间为1天的423例,>1天的98例。
四、药品不良反应信息
1、不良反应名称
从2009-2011年某中药注射液不良反应/事件看,不良反应名称共630例,胃肠道系统损害58例,占%;皮肤及其附件损害194例,占%;全身性损害129例,占%;呼吸系统损害134例,占%;心血管系统68例,占%;其他47例,占%。
图3-1 2009-2011年某中药注射液药品不良反应/事件不
良反应名称统计
2、不良反应过程描述及处理情况
从2009-2011年某中药注射液不良反应/事件看,不良反事件均在用药过程中发生,之后均立即停药,根据不良反应严重情况采取停药、停药+其他用药两种方式缓解不良反应现象,均好转。
3、不良反应发生日期
从2009-2011年某中药注射液不良反应/事件看,不良反应均在用药后5-60分钟内发生,某中药注射液有一例是在用药用药第四天发生的不良反应。
4、合并用药统计
从2009-2011年某中药注射液不良反应/事件看,合并用药主要表现为跟其他药物交替使用,合用药数2—5个的36例,占%,无6—10及>11个合用药的案例。
5、不良反应结果
从2009-2011年某中药注射液不良反应/事件看,不良反应结果有好转、治愈、死亡三种,好转的233例,占%;治愈的278例,占%;死亡的10例,占%,其中7例用药原因为食物中毒,确定为错误用药所致,2例用药原因为肩关节周围炎,1例用药原因为头晕、乏力。
6、国内有无类似不良反应、国内相关文献报道、国外有无类似不良反应、国外相关报道
某某药业集团股份有限公司
二〇一三年一月二十七日。
