离体心脏灌流
离体蛙心灌流实验
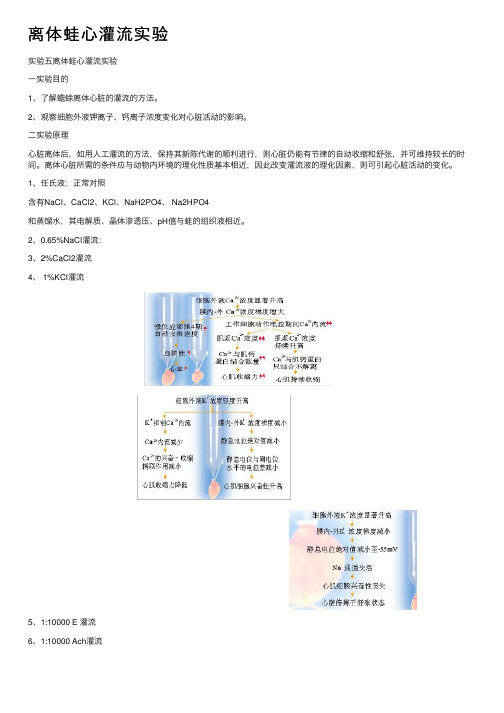
离体蛙⼼灌流实验实验五离体蛙⼼灌流实验⼀实验⽬的1、了解蟾蜍离体⼼脏的灌流的⽅法。
2、观察细胞外液钾离⼦、钙离⼦浓度变化对⼼脏活动的影响。
⼆实验原理⼼脏离体后,如⽤⼈⼯灌流的⽅法,保持其新陈代谢的顺利进⾏,则⼼脏仍能有节律的⾃动收缩和舒张,并可维持较长的时间。
离体⼼脏所需的条件应与动物内环境的理化性质基本相近,因此改变灌流液的理化因素,则可引起⼼脏活动的变化。
1、任⽒液:正常对照含有NaCl、CaCl2、KCl、NaH2PO4、 Na2HPO4和蒸馏⽔,其电解质、晶体渗透压、pH值与蛙的组织液相近。
2、0.65%NaCl灌流:3、2%CaCl2灌流4、 1%KCl灌流5、1:10000 E 灌流6、1:10000 Ach灌流7、⼼得安β1受体阻断剂,抑制肾上腺素与β1受体结合,使E不能发挥作⽤。
8.、阿托品M受体阻断剂,抑制Ach减慢⼼率,加速房室传导,增加⼼房收缩⼒。
三实验器材微机⽣物信号处理系统, physiology系统,学校服务器系统,蟾蜍离体蛙⼼,任⽒液,1%KCl,3%CaCl2,65%NaCl,1/10000 E,⼼得安+1/10000,1/10000 Ach,阿托品+1/10000 Ach。
四实验步骤1、标本制备(观看视频)2、仪器及标本的连接3、具体软件操作:1)离⼦试剂:任⽒液→0.65%NaCl溶液→任⽒液清洗→1%KCl溶液→任溶液→任⽒液清洗⽒液清洗→2%CaCl22)药物试剂:肾上腺素(E)→任⽒液清洗→⼼得安→任⽒液清洗→Ach,任⽒液清洗→阿托品→任⽒液清洗。
五实验结果表1 离体蛙⼼灌流数据记录六结果分析此实验说明⼼脏具有⾃律性,兴奋性,传导性,收缩性,离体⼼脏静脉窦还能产⽣兴奋并传导到⼼房和⼼室,引起⼼脏有节律的兴奋和收缩。
体内细胞所直接⽣存的环境较为稳定,内环境的稳态是细胞、器官维持正常⽣存和活动的必要条件,所以改变灌流的溶液,会引起⼼脏收缩的改变。
心脏灌流

Radnoti 离体工作心脏灌流系统 (Working Heart System)
可进行工作心脏实验, LANGENDORFF 恒 压,恒流,循环或非循环实验。实验可以是 起博或自发心跳状态。
灌流液从左心耳流入左心室,左心室收缩克服 主动脉阻力将心室内液体射入模拟主动脉管道, 使心脏在生理状态下进行灌流实验。在此装置 中,左心室充盈压(前负荷)及主动脉柱压 (后负荷)可以保持恒定,心率亦可通过电起 搏装置加以控制。因此,可以根据需要将三者 同时进行控制,观察药物对心肌收缩性能的影 响,或控制其中两项,观察心肌收缩性与另一 项的关系。此外通过测定冠脉流出液中某些物 质,可以了解药物或其它因素对心脏生化方面 的影响。
缺点和局限性
失去了机体完整统一的内环境和神经体液 调控作用,失去了体内各种组织、细胞之间
的相互关系,不能完全反映心脏在整体情况
下的活动规律与正常整体情况。
离体心脏灌流方法
两栖类动物: 蟾蜍、青蛙等 Straub法、八木法
哺乳类动物:大鼠、家兔、猫等
Langendroff 法
经典的离体蛙心灌流——Straub法
心室腔直接记录和测定左心室内压力变化,如左心室 收缩压(LVSP)、左心室舒张末期压(LVEDP)和左 心室压力变化速率(LV dP/dP)等; 利用放入肺动脉内的导管连接到PMH 73酸碱/血气检
测仪上的电极测定冠状静脉的 Po2, 并可结合灌流液的
Po2和冠状动脉流量计算心肌耗氧量; 经过两根固定在心脏表面的电极可记录心外膜心电图; 心脏内埋藏电极记录希氏束电图等。
• 配合不同的测量装置可测量: 左室压(LVP) 心电 温度 心肌张力 心输出量 灌注压 冠脉血流 新陈代谢 离子 转基因研究
离体心脏灌流

测仪上的电极测定冠状静脉的 Po2, 并可结合灌流液的
Po2和冠状动脉流量计算心肌耗氧量; 经过两根固定在心脏表面的电极可记录心外膜心电图; 心脏内埋藏电极记录希氏束电图等。
Necly等的改进(1967)
在肺静脉或左心房内插入另一根导管,灌流液经 此导管进入左心房,并通过二尖瓣进入左心室,左 心室收缩时将灌流液通过主动脉泵出,该方法可改 变心脏的前后负荷,测定心输出量、压力-容积作 功关系等。
Bardenheuer等的改进(1983)
小球囊插入左心室,通过一个插管将球囊内的液体泵
负荷和后负荷。
注意事项
① 不能损伤或结扎静脉窦; ② 主动脉内的插管不要过深以免抵住主动脉瓣 ③ 两根插管有一定相对位置,插管前要考虑好方向, 插管后应避免血管扭曲,保证灌流畅通 ④ 避免气泡进人心脏。
哺乳类动物离体心脏灌流
——Langendorff 法
Langendorff首次描述了保持哺乳动物离体心
脏存活的方法,采用恒压或恒流方式,从主动脉
根部逆向用含氧灌流液灌流心脏,这种方式的逆
向灌注关闭了主动脉瓣,使得灌注液经冠状动脉
分布,并流入冠状窦和右心房。
实验方法
1.麻醉、取出心脏:在戊巴比妥钠麻醉和人工呼吸
的 情 况 下 迅 速 取 出 心 脏 , 置 于 盛 满 37 ℃ 氧 饱 和 的
Ringer’s液的盘中,去除粘附的心包和肺组织,确定主 动脉的位置,并恰好在其分支下方切断。 2. 主动脉插管:将一个玻璃或塑料的插管插入主 动脉,注意插管不要过深以免损伤主动脉瓣,结扎固 定。
实验4-4 蛙类离体心脏灌流

实验4-4 蛙类离体心脏灌流引言离体心脏灌流实验是生理学中常用的方法之一。
不同种类的动物可以通过体表切口或开放胸骨来取出其心脏进行灌流。
而离体心脏灌流实验可以帮助研究者了解心脏的解剖学和生理学特征。
本实验将讲解如何进行蛙类离体心脏灌流实验。
实验器材和试剂1.蛙类(建议使用大型蛙类)。
2.离体心脏灌流系统,包括:- 离体心脏灌流装置(含灌流缓冲液、温度控制器等)。
- 稳压泵。
3.灌流缓冲液,常用的为Tyrode's盐溶液。
实验步骤1. 先将离体心脏灌流系统检查一遍,保证各项设备均运转正常。
2. 杀死一只蛙类,立即进行解剖,取出心脏,并将其迅速转移到灌流装置中。
在移植心脏时应注意不损伤其血管和肌肉组织。
在灌流系统中,除了心脏,不能有其他生物组织残留。
3. 确认灌流系统中的灌流缓冲液温度为20~25℃。
在开始灌流之前,要先排除灌流管路中的空气。
4. 打开灌流泵,根据所选择的灌流缓冲液flow rate控制注入速度,一般建议在3~8ml/min。
确保满足心脏需求的氧气和营养物质可以通过灌流液输送到心脏内部。
5. 注入灌流缓冲液的同时,对心脏进行观察,确认心脏速率、收缩波幅度等生理特征。
6. 加入适当的药物来研究心脏对药物的反应性。
此时应读取每个添加药物后的心脏特征和响应(如速率、波幅等)。
7. 在实验结束时,切断灌流管路和心脏连接,灌流系统中的灌流液应该被排除并清洁。
结果和分析离体心脏灌流实验可以观察心脏的生理学特征和对不同药物的反应,这有助于研究者了解心脏的生理学机制。
在进行本实验时,需要注意不仅仅是心脏的特征,还要关注灌流流量和药物导致的生理反应。
在实验的过程中,如果发现心脏节律不齐或收缩波幅度明显下降,这可能是灌流流量不足造成的。
而添加不同的药物,可以帮助研究者了解心脏的调控机制,同时也可以评估药物的疗效。
需要注意的是,不同种类的动物其心脏组织的特征也是不同的,因此需要根据具体的实验目的选择合适的动物进行实验。
离体心脏灌流实验报告

离体心脏灌流实验报告离体心脏灌流实验报告心脏是人体最重要的器官之一,它的正常运转对于维持身体的正常功能至关重要。
然而,心脏病是全球范围内的一大健康问题,每年造成数百万人死亡。
为了更好地研究心脏病的发病机制以及开发新的治疗方法,离体心脏灌流实验成为了一种重要的研究手段。
离体心脏灌流实验是指将动物或人体心脏取出后,通过人工装置对其进行血液灌流,模拟体内环境,以便研究心脏的生理和病理过程。
这种实验方法可以提供更加精确和可控的条件,避免了体内环境的干扰,从而更好地研究心脏的功能和疾病。
在离体心脏灌流实验中,首先需要将动物或人体心脏取出,并迅速将其连接到灌流装置上。
灌流装置通常由氧气供应系统、血液泵、温度控制系统等组成,以模拟体内环境。
通过调节血液流速、氧气浓度和温度等参数,可以控制心脏的工作状态,观察其生理反应。
通过离体心脏灌流实验,研究人员可以观察心脏在不同条件下的工作情况,如心脏收缩力、心脏节律等。
同时,还可以通过添加特定的药物或激素,研究其对心脏功能的影响。
这种实验方法可以提供更加直接和准确的数据,有助于深入了解心脏病的发病机制。
除了研究心脏的生理功能外,离体心脏灌流实验还可以用于研究心脏疾病的发展过程。
例如,通过给心脏注射特定的病原体或药物,可以模拟心脏病的发病过程,观察心脏在不同阶段的变化。
这种实验方法可以为心脏病的早期诊断和治疗提供重要的参考。
然而,离体心脏灌流实验也存在一些限制。
首先,由于实验条件的局限性,离体心脏灌流实验无法完全模拟人体内复杂的生理环境,因此得到的结果可能与实际情况存在一定的差异。
其次,由于需要使用动物或人体心脏进行实验,涉及到伦理和道德问题,需要严格遵守相关法律和伦理规定。
尽管存在一些限制,离体心脏灌流实验仍然是研究心脏病的重要手段之一。
通过这种实验方法,研究人员可以更加深入地了解心脏的生理和病理过程,为心脏病的预防和治疗提供重要的理论依据。
未来,随着技术的不断进步,离体心脏灌流实验将进一步发展,为心脏病研究带来更多的突破。
心脏灌流

八木法离体蛙心灌流
特点: 灌流途径按正常循环途径设计,一根蛙心插管插入 左肝静脉并进入静脉窦,另一根蛙心插管仅插入主动 脉,并不穿过主动脉瓣进入心室腔内,可以根据实验 要求设定不同的前负荷和后负荷。
实验步骤
1. 破坏蟾蜍脑脊髓,暴露心脏。 2. 依次将右主动脉、左右前腔静脉、左右肺静脉、后腔静脉和右肝 静脉分离穿双线,双结扎后剪断,只保留左主动脉和左肝静脉。在左肝 静脉下穿线打虚结备用,在左肝静脉剪一斜口,将充有任氏液的蛙心插 管插入左肝静脉,结扎固定。 3.用任氏液将心脏中血液冲洗干净后、在左主动脉下穿线打虚结, 在动脉壁上剪一小口将另一根蛙心插管插入,若立即有液体流入插管, 说明插管正确,将插管口结扎固定。 4.在左主动脉、左肝静脉结扎部位外侧剪断与心脏相连的组织, 将插有蛙心插管的心脏取出与记录装置连接。
Necly等(1967):在肺静脉或左心房内插入另一根 导管,灌流液经此导管进入左心房,并通过二尖瓣进入 左心室,左心室收缩时将灌流液通过主动脉泵出,该方 法可改变心脏的前后负荷,测定心输出量、压力-容积 作功关系等。
经肺静脉、左心房和二尖瓣将微型压力传感器放入左心室腔可 直接记录和测定左心室内压力变化,如左心室收缩压(LVSP)、左 心室舒张末期压(LVEDP)和左心室压力变化速率(LV dP/dP)等; 利用一根放入肺动脉内的导管连接到PMH 73酸碱/血气检测 仪上的E 5046型电极可测定冠状静脉的Po2,并可结合灌流液的Po2和 冠状动脉流量计算心肌耗氧量; 经过两根固定在心脏表面的电极可记录心外膜心电图;心脏内 埋藏电极记录希氏束电图等。
冠状动脉结扎与心肌缺血再灌: Scholz 等(1992,1993)在进行冠状动脉闭塞实验时,先使用改良 Krebs-Henseleit缓冲液以65 mmHg恒定压力灌注离体工作心20min(缺 血前期)。随后通过钳夹左冠状动脉近端15min,造成急性心肌缺血(缺 血期)。此时再重新开放血管夹,对再灌注期间的变化进行30min监测 (再灌注期)。在冠状动脉结扎和再灌注后,心脏会发生室颤. 留取冠状动脉流出液样本,可用于检测乳酸、乳酸脱氢酶(LDH)和 肌酸激酶(CK)。实验完成后,可测量心肌组织中的糖原、乳酸、ATP 和磷酸肌酐。 在缺血前或再灌注前5min通过灌注液给予实验药物。在间接体内 试验中,在准备处 死大鼠制备离体心脏前1h经口服给予实验药物。
离体心脏灌流

灌流压大小恰当,压力过低则冠状动脉灌流量不足,
过高则因主动脉根部过于扩张导致主动脉瓣关闭不全。
灌流液温度恒定:37 ℃ (95% O2 + 5% CO2饱和)。
Langendorff 法的缺陷与改进
由于在实验过程中心室不充盈,心室不按照容
量-压力曲线作功。
后来其实验方法被不断改进,以适应各种不同研 究的需要,如在按上述灌流方法进行灌流以保持心脏 存活的同时,在用另一根插管插入右心房灌流心脏,
人一个体外的闭合循环通路中,并由两个弹性瓣膜控制其
单向流动。
每次心脏收缩时,由球囊排除的液体量相当于心脏的
每搏输出量,可以通过顺序连接的一个流量计探头和一个 积分仪进行测量。前负荷和后负荷可以分别调整。经主动 脉逆灌进入冠状动脉的灌注液流量也可单独记录下来。
其它改进
将微型压力传感器经肺静脉、左心房和二尖瓣放入左
负荷和后负荷。
注意事项
① 不能损伤或结扎静脉窦; ② 主动脉内的插管不要过深以免抵住主动脉瓣 ③ 两根插管有一定相对位置,插管前要考虑好方向, 插管后应避免血管扭曲,保证灌流畅通 ④ 避免气泡进人心脏。
哺乳类动物离体心脏灌流
——Langendorff 法
Langendorff首次描述了保持哺乳动物离体心
的相互关系,不能完全反映心脏在整体情况
下的活动规律与正常整体情况。
离体心脏灌流方法
两栖类动物: 蟾蜍、青蛙等 Straub法、八木法
哺乳类动物:大鼠、家兔、猫等
Langendroff 法
经典的离体蛙心灌流——Straub法
灌流途 心室腔内,灌流液通过 同一蛙心插管进入心室 腔和流出,前负荷和后
则可研究压力-容积作功关系。
离体蛙心灌流实验报告

离体蛙心灌流实验报告
实验目的,通过离体蛙心灌流实验,观察心脏在不同药物作用下的生理变化,
为心脏药理学研究提供实验数据。
实验材料与方法,取新鲜的蛙心,进行离体灌流实验。
首先,将蛙心置于离体
心脏灌流装置中,通过主动脉插管进行心脏灌流。
然后,分别加入不同药物溶液,如肾上腺素、乙酰胆碱等,观察心脏的生理变化。
实验过程中,记录心脏的心率、收缩力、舒张力等指标,并进行统计分析。
实验结果,在加入肾上腺素后,观察到蛙心的心率明显增加,心脏收缩力增强,舒张力减弱;而在加入乙酰胆碱后,心率明显减慢,心脏收缩力减弱,舒张力增强。
这些结果表明,肾上腺素具有增强心脏收缩力和加快心率的作用,而乙酰胆碱则具有减慢心率和减弱心脏收缩力的作用。
实验讨论,离体蛙心灌流实验是一种常用的心脏药理学研究方法,通过模拟体
内环境,观察心脏在不同药物作用下的生理变化。
本实验结果与心脏药理学理论相符,说明离体蛙心灌流实验是一种可靠的实验方法,能够为心脏药理学研究提供重要数据。
结论,通过离体蛙心灌流实验,我们观察到了心脏在不同药物作用下的生理变化,验证了心脏药理学理论。
这为心脏药物的研发和临床应用提供了重要参考,也为心脏疾病的治疗提供了新的思路和方法。
在今后的研究中,我们将进一步探索心脏药物的作用机制,寻找更多有效的心
脏药物,并将离体蛙心灌流实验应用于心脏药理学研究的更多领域,为心脏疾病的治疗和预防做出更大的贡献。
通过本次实验,我们对离体蛙心灌流实验有了更深入的了解,并对心脏药理学
研究有了更加清晰的认识。
希望本实验能为相关领域的研究工作提供一定的参考和帮助。
离体心脏灌流实验报告

一、实验目的1. 熟悉离体心脏灌流技术的基本操作。
2. 观察和分析不同生理、病理因素对离体心脏功能的影响。
3. 掌握记录和分析心脏功能指标的方法。
二、实验原理离体心脏灌流实验是生理学研究中常用的一种方法,通过将心脏从机体中取出,在体外模拟生理环境条件下进行灌流,观察和分析心脏功能的变化。
实验中,通过改变灌流液的成分、温度、pH值等条件,可以研究不同因素对心脏功能的影响。
三、实验材料与仪器1. 实验材料:青蛙、蛙心夹、蛙板、蛙类手术器械、二道仪、任氏液、长滴管、铁支架、玻璃管、量筒、秒表等。
2. 实验仪器:显微镜、电子天平、恒温器、恒温水浴箱、高压消毒锅等。
四、实验方法与步骤1. 实验准备(1)取一只青蛙,用蛙类手术器械进行解剖,暴露心脏。
(2)将心脏夹在蛙心夹上,用线固定在蛙板上。
(3)在心脏主动脉下方穿一线,结扎并留出一段备用。
(4)将心脏主动脉左支结扎,于动脉圆锥处剪一向心斜切口,插入灌流管。
2. 灌流实验(1)将灌流管一端插入恒温器中的任氏液中,另一端与心脏主动脉相连。
(2)调整恒温器,使任氏液温度保持恒定。
(3)开启灌流泵,使任氏液以恒定速度灌流心脏。
(4)观察心脏收缩情况,记录心率、收缩幅度等指标。
(5)依次改变灌流液的成分、温度、pH值等条件,观察心脏功能的变化。
3. 实验数据记录与分析(1)记录不同灌流条件下心脏的心率、收缩幅度等指标。
(2)分析不同生理、病理因素对离体心脏功能的影响。
(3)绘制心脏功能曲线,分析实验结果。
五、实验结果与分析1. 灌流液中加入肾上腺素后,离体心脏心率加快,收缩幅度增强。
2. 灌流液中加入乙酰胆碱后,离体心脏心率减慢,收缩幅度减弱。
3. 降低灌流液温度后,离体心脏心率减慢,收缩幅度减弱。
4. 提高灌流液pH值后,离体心脏心率加快,收缩幅度增强。
六、实验结论1. 肾上腺素和乙酰胆碱对离体心脏功能具有调节作用,肾上腺素使心脏兴奋,乙酰胆碱使心脏抑制。
2. 温度和pH值对离体心脏功能有显著影响,低温和碱性环境有利于心脏功能的维持。
离题心脏灌流实验报告

一、实验目的1. 掌握离体心脏灌流技术的基本操作方法。
2. 观察不同生理和化学因素对离体心脏活动的影响。
3. 了解心脏生理学中离子和体液调节在心脏功能中的作用。
二、实验原理心脏的正常节律性活动依赖于其内环境的稳定性。
离体心脏灌流实验通过在体外模拟心脏的生理环境,研究各种因素对心脏功能的影响。
实验中,离体心脏被置于特定的灌流液中,通过改变灌流液的成分,可以观察心脏的收缩、舒张以及心率等生理指标的变化。
三、实验材料1. 实验动物:青蛙或鱼类。
2. 实验器材:蛙心夹、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿、棉线、任氏液、生理盐水、NaCl、KCl、CaCl2、乳酸、肾上腺素、乙酰胆碱等。
3. 实验试剂:任氏液、生理盐水、0.65%NaCl、2%CaCl2、1%KCl、3%乳酸、1:10000肾上腺素、1:10000乙酰胆碱等。
四、实验方法与步骤1. 蛙心插管法:将青蛙双毁髓后背位置于蜡盘中,暴露心脏,并在左主动脉下方穿一线,于动脉圆锥处结扎。
用蛙心夹固定心脏,将刺激电极插入心室。
2. 灌流液准备:将任氏液或生理盐水加热至37℃,保持恒温。
3. 灌流系统建立:将蛙心夹连接到张力传感器,通过支架固定。
将灌流液从灌流瓶经滴管缓慢滴入蛙心夹,通过张力传感器记录心脏的收缩和舒张。
4. 实验操作:a. 记录正常心脏灌流下的心率和收缩幅度。
b. 分别向灌流液中加入不同浓度的NaCl、KCl、CaCl2、乳酸、肾上腺素、乙酰胆碱等试剂,观察心脏活动的变化。
c. 重复上述步骤,观察不同因素对心脏活动的影响。
五、实验结果与分析1. 正常心脏灌流:在正常灌流条件下,心脏呈现规律的节律性收缩,心率和收缩幅度稳定。
2. NaCl:低浓度NaCl对心脏活动影响较小,高浓度NaCl会导致心率减慢,收缩幅度降低。
3. KCl:低浓度KCl对心脏活动影响较小,高浓度KCl会导致心率加快,收缩幅度降低。
4. CaCl2:低浓度CaCl2对心脏活动影响较小,高浓度CaCl2会导致心率加快,收缩幅度增强。
离体灌流功能介绍

离体灌流功能介绍
离体心脏灌流系统是配合做离体心脏灌流实验的一套系统。
离体心脏灌流实验将动物心脏取出,连接到特定的灌流装置,用灌流液灌注,排除了神经和体液的控制,配合特别分析软件记录心室内压、动脉血压和心电信号,自动分析各项生理参数,离体心脏灌流系统用于病理生理情况下的心功能与血流动力学改变等研究,在生理、病理生理以及药理学研究中已得到广泛地应用。
药物的心脏毒性是指药物作用于心脏后,引起的心脏生理功能异常或者损害的药效反应,如心肌损伤、心律失常、收缩或舒张功能异常,心肌肥厚和心力衰竭等。
近年来,随着新药研发量及上市药物量的不断增加,心脏毒性的不良反应报道也随之上升,因此药物的心脏安全性评价研究越来越受到重视。
Langendorff 离体心脏灌流技术是19世纪末Oskar Langendorff开发的一种实验方法,它凭借重复性高,稳定性强的特点成为心血管研究领域中使用最为广泛的实验模型之一。
该技术通过将导管插入心脏主动脉实现冠状动脉逆行灌注,可用于评估药物对心脏的直接影响或药物对于心肌损伤的保护作用。
因此,在药物前期研发阶段加强对心血管不良反应的研究,可以有效趋利避害,同时拓展药物的新用途。
离体心脏实验报告

一、实验目的1. 掌握离体心脏灌流技术的操作方法。
2. 观察和分析不同理化因素对离体心脏活动的影响。
3. 理解心脏生理学的基本原理,如离子浓度、温度、酸碱度、激素等对心脏功能的影响。
二、实验原理心脏的正常节律性活动依赖于内环境的相对稳定。
改变离体心脏灌流液的理化成分,会影响心肌细胞的兴奋性、自律性、传导性和收缩性,从而影响心脏的舒缩活动。
本实验通过改变灌流液中的离子浓度、温度、酸碱度、激素等,观察对离体心脏活动的影响,进一步理解心脏生理学的基本原理。
三、实验材料与仪器1. 实验动物:蟾蜍2. 实验药品:任氏液、NaCl溶液、CaCl2溶液、KCl溶液、乙酰胆碱溶液、肾上腺素溶液、乳酸溶液、NaHCO3溶液3. 实验仪器:BL-420生物信号分析系统、张力换能器、铁支台、试管夹、蛙类手术器械、蛙心插管、滴管、大烧杯、棉线、双凹夹、滑轮四、实验步骤1. 暴露心脏:取蟾蜍一只,用蛙类手术器械暴露心脏。
2. 心脏插管:将蛙心插管插入心脏,用棉线固定。
3. 摘取心脏:用镊子将心脏从蟾蜍体内取出,置于装有任氏液的培养皿中。
4. 连接仪器:将张力换能器连接到心脏插管,并通过BL-420生物信号分析系统进行数据采集。
5. 实验分组:将实验分为以下几组:空白对照组:用任氏液灌流心脏。
Na+浓度改变组:用不同浓度的NaCl溶液灌流心脏。
K+浓度改变组:用不同浓度的KCl溶液灌流心脏。
Ca2+浓度改变组:用不同浓度的CaCl2溶液灌流心脏。
乙酰胆碱组:用乙酰胆碱溶液灌流心脏。
肾上腺素组:用肾上腺素溶液灌流心脏。
乳酸组:用乳酸溶液灌流心脏。
NaHCO3组:用NaHCO3溶液灌流心脏。
6. 数据采集:观察并记录每组心脏的舒缩节律、幅度和持续时间。
7. 结果分析:分析不同理化因素对离体心脏活动的影响。
五、实验结果1. Na+浓度改变组:随着Na+浓度的增加,心脏的舒缩幅度和持续时间逐渐增加,但超过一定浓度后,心脏活动减弱。
生理学离体心脏实验报告

一、实验目的1. 了解离体心脏灌流法的原理和操作步骤。
2. 观察Na+、K+、Ca2+及肾上腺素(Adr)、乙酰胆碱(ACh)、乳酸对离体心脏活动的影响。
3. 掌握生理学实验技能,提高实验操作水平。
二、实验原理离体心脏灌流法是将心脏从生物体内取出,在一定时间内保持在适宜的环境中,通过改变灌流液的成分,观察其对心脏活动的影响。
心肌细胞的自律性、兴奋性、传导性及收缩性,都与钠、钾及钙等离子有关。
外源性给予去甲肾上腺素或乙酰胆碱可产生类似心交感神经或迷走神经兴奋时对心脏的作用。
三、实验材料与仪器1. 实验材料:青蛙、常用手术器械、蛙板(或蜡盘)、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿(或小烧杯)、棉线、任氏液、0.65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸。
2. 实验仪器:BL-420生物信号分析系统、张力换能器、铁支台、试管夹、蛙类手术器械、蛙心插管、滴管、大烧杯、棉线、双凹夹、滑轮。
四、实验步骤1. 斯氏蛙心插管法:一只青蛙,双毁髓后背位置于蜡盘中,按前面的方法暴露心脏。
仔细识别心脏周围的大血管,在左主动脉下方穿一线,于动脉圆锥下方穿线,将心脏拉出。
2. 心脏插管:将蛙心夹固定在支架上,将心脏放在蛙心夹上,用棉线将心脏与蛙心夹固定。
将蛙心插管插入左心室,用生理盐水冲洗心脏,排除空气。
3. 灌流液准备:分别配制任氏液、0.65%NaCl溶液、2%CaCl2溶液、1%KCl溶液、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸溶液。
4. 灌流实验:将心脏置于灌流槽中,通过灌流泵将灌流液以一定流速(如5ml/min)灌流心脏,同时用计算机采集系统记录心脏的收缩活动。
5. 观察并记录以下指标:(1)在正常灌流液条件下,记录心脏的收缩频率、收缩幅度。
(2)分别加入Na+、K+、Ca2+、肾上腺素、乙酰胆碱、乳酸,观察并记录心脏的收缩频率、收缩幅度。
离体蛙心灌流实验报告

一、实验目的1. 学习离体器官(蛙心)灌流的方法。
2. 观察理化因素对蛙心活动的影响。
3. 掌握实验操作技巧,提高实验技能。
二、实验原理离体蛙心灌流实验是生理学实验中的一个重要实验,通过人工灌流的方法,使离体蛙心在适宜的生理条件下保持正常节律性收缩和舒张。
实验原理如下:1. 蛙心无营养性血管,离体后采用人工灌流的方法,仍可保持其新陈代谢,心脏仍能有节律的自动收缩、舒张,并维持较长时间。
2. 心肌的营养是通过心脏内膜液体的直接渗透而得。
3. 通过改变灌流液中的离子浓度、pH值等理化因素,可以观察蛙心活动的变化,了解理化因素对心脏活动的影响。
三、实验对象与用品1. 实验对象:蟾蜍2. 实验用品:斯氏蛙心套管、蛙心夹、蛙板、蛙类手术器械、二道仪、任氏液、长滴管、铁支架、生理盐水、KCl溶液、CaCl2溶液、肾上腺素、乙酰胆碱等。
四、实验方法与步骤1. 实验准备:将蟾蜍仰卧固定于蛙板上,用剪刀剪开胸壁,暴露心脏。
用蛙心夹夹住蛙心尖部,固定在蛙板上。
2. 动脉插管:在主动脉分支下预埋一条棉线,结扎主动脉左支,剪一向心斜切口,插入斯氏蛙心套管,送入动脉球。
3. 连接实验装置:将蛙心套管与二道仪相连,记录蛙心活动。
4. 灌流液准备:配制正常灌流液(任氏液)和实验灌流液(分别含有不同离子浓度的生理盐水、KCl溶液、CaCl2溶液、肾上腺素、乙酰胆碱等)。
5. 实验操作:a. 将蛙心置于正常灌流液中,观察蛙心活动,记录心率、收缩幅度等指标。
b. 分别将蛙心置于不同实验灌流液中,观察蛙心活动的变化,记录心率、收缩幅度等指标。
c. 对比分析不同灌流液对蛙心活动的影响。
五、实验结果与分析1. 正常灌流液条件下,蛙心以正常节律收缩和舒张,心率适中,收缩幅度适中。
2. 在0.65%NaCl溶液替换任氏液后,蛙心收缩幅度稍微减小,收缩力稍微减弱。
分析原因:相当于细胞外环境中缺乏Ca2+,动作电位2期Ca2+内流减少,胞浆中Ca2+减少,心肌收缩力降低。
实验6 蟾蜍离体心脏灌流

目的要求
基本原理
实验步骤
目的要求
基本原理
实验步骤
1、学习两栖类动物离体心脏灌流的方法,掌 握斯氏插管法。 2、了解心肌的生理特性,证明心脏具有自动 节律性收缩的能力。 3、观察Na+、K+、Ca2+、肾上腺素、乙酰胆碱 (ACh)对心脏活动的影响。 4、理解内环境各种理化因素的相对恒定对于 细胞进行正常生命活动的重要意义。
不同离子溶液对蟾蜍心脏的影响
目的要求
2、用0.65%的NaCL溶液灌流,做好加药标记,观察 心博变化,待曲线出现明显改变,立即用任氏液冲洗 2~3次,并做好冲洗标志。 3、参照实验教程P171,分别向套管内滴加2~6滴5%
基本原理
实验步骤
NaCl溶液、1~3滴2%CaCl2溶液、1~2滴1%KCl溶
蟾蜍离体心脏灌流
目的要求
心肌的自动节律性:心脏离体后,仍能有节律地 自动舒缩。因而可用人工灌流的方法(如斯氏插管法 或八木氏插管法等)进行离体心脏灌流,研究心脏活 动的规律及特点。
基本原理
实验步骤
由于两栖类动物的心脏没有冠状动脉,心肌细胞 直接从心腔的血液中获得营养物质和氧气,故可用斯 氏插管法进行离体心脏灌流。 灌流液的成分应同动物内环境的成分基本一致, 两栖类动物心脏的灌流液为任氏液。始终有任氏液灌 流于心腔,离体心脏可长时间地活动,改变灌流液的 成分,则可引起心脏活动的改变。
目的要求
基本原理
1、蟾蜍离体心脏的灌流方法
实验步骤
2、不同离子溶液对蟾蜍心脏的影响
蟾蜍离体心脏的灌流方法
目的要求
基本原理
实验步骤
1、双毁髓—离体心脏制备
蟾蜍离体心脏的灌流方法
目的要求
离体心脏灌流

实验22 蛙类离体心脏灌流【目的要求】1.学习斯氏或八木氏离体蛙心灌流法。
2.观察Na+、K+、Ca2+及肾上腺素、乙酰胆碱等对离体心脏活动的影响。
【基本原理】心肌具有自动节律性收缩活动的特性,可用人工灌流的方法研究心脏活动的规律及其特点,还可通过改变灌流液的成分或加入某些药物来观察其对心脏活动的影响。
【动物与器材】蟾蜍或蛙、蛙心套管(斯氏套管或八木氏套管)、常用手术器械、蛙心夹、套管夹、记纹鼓及通用杠杆或记录仪与张力换能器、万能滑轮、多用仪或刺激器、蜡盘、滴管、培养皿或小烧杯、任氏液、5%NaCl溶液、2%CaCl2溶液、1%KCl溶液、1∶100000肾上腺素溶液、1∶10000O0乙酰胆碱溶液、300u/ml肝素溶液。
【方法与步骤】1.离体蛙心的制备制备离体蛙心的方法有两种。
(1)斯氏蛙心插管法取一只蟾蜍或蛙,双毁髓后背位置于蜡盘中,按实验19暴露心脏。
仔细识别心脏周围的大血管(参见图4-1,4-2)。
在左主动脉下方穿一线,距动脉圆锥2-3mm处结扎。
再从左、右两主动脉下方穿一线,打一活结备用。
左手提起左主动脉上的结扎线,右手用眼科剪在动脉圆锥前端,沿向心方向剪一斜口,然后将盛有少量任氏液(内加入一滴肝素抗凝)的斯氏蛙心套管由此开口处插入动脉圆锥(图4-8)。
当套管尖端到达动脉圆锥基部时,应将套管稍稍后退,使尖端向动脉圆锥的背部后方及心尖方向推进。
经主动脉瓣插入心室腔内(于心室收缩时插入)。
不可插得过深,以免心壁堵住套管下口。
此时可见套管中液面随心脏搏动而上下移动,用滴管吸去套管中的血液,更换新鲜任氏液,提起备用线,将左、右主动脉连同插入的套管扎紧(不得漏液),再将结线固定在套管的小玻璃钩上。
剪断结扎线上方的血管。
轻轻提起套管和心脏,在心脏下方绕一线,将左右肺静脉、前后腔静脉一起结扎,注意保留静脉窦与心脏的联系,切勿损伤静脉窦,于结扎线的外侧剪去所有牵连的组织,将心脏离体。
用任氏液反复冲洗心室内余血,使灌流液不再有血液。
心脏灌流实验报告结论

一、实验背景心脏灌流实验是一种生理学实验,旨在通过模拟心脏的血液循环过程,研究心脏的功能和血液动力学特性。
本实验采用离体心脏灌流的方法,通过观察不同条件下心脏的血流动力学变化,分析心脏的功能状态和影响因素。
二、实验目的1. 了解心脏灌流实验的基本原理和方法。
2. 观察心脏在不同灌流条件下的血流动力学变化。
3. 分析影响心脏功能的主要因素。
三、实验方法1. 实验材料:离体心脏、灌流装置、生理盐水、药物等。
2. 实验步骤:(1)将离体心脏置于灌流装置中,连接好各种管道。
(2)调整灌流装置,使心脏处于正常工作状态。
(3)观察心脏在不同灌流条件下的血流动力学变化。
(4)在实验过程中,加入不同药物,观察心脏对药物的反应。
四、实验结果1. 心脏在正常灌流条件下,表现出规律性的收缩和舒张,血流动力学指标稳定。
2. 在低灌流压力下,心脏收缩幅度减小,心率减慢,心输出量降低。
3. 在高灌流压力下,心脏收缩幅度增大,心率加快,心输出量增加。
4. 加入肾上腺素后,心脏收缩幅度增大,心率加快,心输出量增加。
5. 加入乙酰胆碱后,心脏收缩幅度减小,心率减慢,心输出量降低。
6. 加入乳酸后,心脏收缩幅度减小,心率减慢,心输出量降低。
五、实验结论1. 心脏灌流实验是一种有效的生理学实验方法,可以模拟心脏的血液循环过程,研究心脏的功能和血液动力学特性。
2. 心脏的收缩和舒张是维持血液循环的关键,心脏功能与灌流压力、药物等因素密切相关。
3. 低灌流压力和乳酸等因素会导致心脏收缩幅度减小,心率减慢,心输出量降低,影响心脏功能。
4. 肾上腺素和乙酰胆碱等药物可以调节心脏功能,改变心脏的收缩幅度、心率和心输出量。
5. 心脏灌流实验为研究心脏疾病、药物作用等提供了重要手段。
六、实验讨论1. 本实验结果表明,心脏灌流实验可以有效地模拟心脏的血液循环过程,为研究心脏功能提供了重要手段。
2. 在实验过程中,应注意灌流压力、药物等因素对心脏功能的影响,以保证实验结果的准确性。
心脏灌流实验报告

一、实验目的1. 学习离体心脏灌流技术的基本原理和方法。
2. 观察不同灌流液成分对离体心脏活动的影响。
3. 分析Na+、K+、Ca2+等离子及肾上腺素、乙酰胆碱等药物对心脏功能的作用。
二、实验原理离体心脏灌流实验是通过将离体心脏置于特定的灌流液中,模拟心脏在体内的生理环境,研究心脏生理功能的一种实验方法。
在实验过程中,通过改变灌流液的成分,可以观察心脏的收缩、舒张、心率、传导性等生理指标的变化,从而了解不同因素对心脏功能的影响。
三、实验材料与仪器1. 实验材料:青蛙、常用手术器械、蛙板、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿、棉线、任氏液、0.65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸。
2. 实验仪器:手术显微镜、手术刀、镊子、剪刀、缝针、线、电子天平、量筒、移液器、秒表、温度计等。
四、实验方法与步骤1. 蛙心制备:- 取青蛙一只,用手术刀在颈部背侧切开皮肤,暴露心脏。
- 用镊子轻轻夹住心脏周围的组织,使其脱离周围组织。
- 将心脏置于蛙板上,用手术刀将心脏周围的血管和神经分离。
- 将心脏固定在蛙心夹上,连接张力传感器。
2. 灌流液准备:- 将任氏液、0.65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸等试剂按照实验要求配置好。
3. 实验操作:- 将蛙心置于任氏液中,调节温度至37℃。
- 用移液器将配置好的灌流液滴入蛙心,记录心脏的收缩、舒张、心率等生理指标。
- 依次更换灌流液,观察不同灌流液成分对心脏功能的影响。
- 记录实验数据,并进行统计分析。
4. 结果分析:- 分析不同灌流液成分对心脏收缩、舒张、心率等生理指标的影响。
- 分析Na+、K+、Ca2+等离子及肾上腺素、乙酰胆碱等药物对心脏功能的作用。
五、实验结果与分析1. 正常灌流液对心脏功能的影响:- 心脏在正常灌流液中呈现规律性的收缩和舒张,心率稳定。
离体蛙心灌流实验原理

离体蛙心灌流实验原理离体蛙心灌流实验是一种常见的心脏生理学研究方法,通过在呼吸、循环、体温、神经影响等条件下灌注药物来研究心脏的生理与病理。
实验所需仪器设备包括:离体蛙心、温度控制器、心肌收缩力检测仪、心室压力传感器等。
实验原理主要基于心肌细胞和心脏整体的生理特征和表现来进行。
心肌细胞存在动作电位和细胞内外环境的离子梯度。
当细胞外液体含有高钠离子、低钾离子、低钙离子时,心肌细胞能够进入顺应期,此时的心肌细胞无法被刺激而产生动作电位。
反之,钠离子的浓度降低,钾离子浓度提高,这时心肌细胞便处于易兴奋状态,钙离子通过轻微的电流而内流,而细胞摇摆起来,并随之产生动作电位。
当心脏收到神经作用、荷尔蒙、温度或其他外部因素时,心脏的血流动态和代谢需要作出反应。
例如,正常情况下,随着感知到体内血压过低的指令,自主神经系统将神经冲动传导到心脏,心脏由此加速并增强收缩力。
如果是在休息时进行实验,将变量固定和控制,以达到结构恒定、纯正、严谨的实验结果。
具体实验步骤如下:1.准备一只已经死亡的蛙,并取出其心脏。
将离体的心脏置于台架上,与灌注溶液流经同一管路。
2.将心脏中的血清和杂质用离体灌满心脏的冰冷盐水,以减小水力影响,同时又可维持心肌收缩。
然后放入恒温水浴盆中,设置体温为32度左右。
3.按照实验需要的药物和试剂与灌注保护液混合后,借水泵引入心室,以保证药物充分灌注到心脏。
为了控制在系统通道中的药物浓度和流速,我们需要在止回阀处实现液位控制和压力控制。
4.通过调整同步泵的速率和灌注药物的时间,可以控制心室的灌注压力和流动情况。
同时,使用心肌收缩力检测仪和心室压力传感器等设备,实时监测并记录实验数据。
最后,统计数据并分析实验结果。
总的来说,离体蛙心灌流实验可以更准确地研究心肌细胞和心脏整体对药物、环境、神经和代谢等不同条件的反应,对心脏相关疾病的诊断和治疗具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验22 蛙类离体心脏灌流【目的要求】1.学习斯氏或八木氏离体蛙心灌流法。
2.观察Na+、K+、Ca2+及肾上腺素、乙酰胆碱等对离体心脏活动的影响。
【基本原理】心肌具有自动节律性收缩活动的特性,可用人工灌流的方法研究心脏活动的规律及其特点,还可通过改变灌流液的成分或加入某些药物来观察其对心脏活动的影响。
【动物与器材】蟾蜍或蛙、蛙心套管(斯氏套管或八木氏套管)、常用手术器械、蛙心夹、套管夹、记纹鼓及通用杠杆或记录仪与张力换能器、万能滑轮、多用仪或刺激器、蜡盘、滴管、培养皿或小烧杯、任氏液、5%NaCl溶液、2%CaCl2溶液、1%KCl溶液、1∶100000肾上腺素溶液、1∶10000O0乙酰胆碱溶液、300u/ml肝素溶液。
【方法与步骤】1.离体蛙心的制备制备离体蛙心的方法有两种。
(1)斯氏蛙心插管法取一只蟾蜍或蛙,双毁髓后背位置于蜡盘中,按实验19暴露心脏。
仔细识别心脏周围的大血管(参见图4-1,4-2)。
在左主动脉下方穿一线,距动脉圆锥2-3mm处结扎。
再从左、右两主动脉下方穿一线,打一活结备用。
左手提起左主动脉上的结扎线,右手用眼科剪在动脉圆锥前端,沿向心方向剪一斜口,然后将盛有少量任氏液(内加入一滴肝素抗凝)的斯氏蛙心套管由此开口处插入动脉圆锥(图4-8)。
当套管尖端到达动脉圆锥基部时,应将套管稍稍后退,使尖端向动脉圆锥的背部后方及心尖方向推进。
经主动脉瓣插入心室腔内(于心室收缩时插入)。
不可插得过深,以免心壁堵住套管下口。
此时可见套管中液面随心脏搏动而上下移动,用滴管吸去套管中的血液,更换新鲜任氏液,提起备用线,将左、右主动脉连同插入的套管扎紧(不得漏液),再将结线固定在套管的小玻璃钩上。
剪断结扎线上方的血管。
轻轻提起套管和心脏,在心脏下方绕一线,将左右肺静脉、前后腔静脉一起结扎,注意保留静脉窦与心脏的联系,切勿损伤静脉窦,于结扎线的外侧剪去所有牵连的组织,将心脏离体。
用任氏液反复冲洗心室内余血,使灌流液不再有血液。
保持套管内液面高度恒定(1.5—2cm),即可进行实验。
(2)八木氏蛙心插管法取一只蟾蜍或蛙,同上法暴露心脏。
于左主动脉下方穿一线,再用蛙心夹夹住心尖,使心脏轻轻吊起(参见图4-2),将线向后绕过左、右前腔静脉,左、右肺静脉及右主动脉支,结扎后剪断,也可分别结扎。
再将心脏翻向头端,用线结扎右肝静脉及后腔静脉(勿伤静脉窦),剪断。
于左肝静脉下方穿一线,打一活结备用,用眼科剪沿向心方向剪一斜口,将装有灌流液的八木氏静脉套管从开口处插入肝静脉(尖端勿伤静脉窦)。
若套管插入静脉,则心脏的颜色变浅,此时可继续加入灌流液。
将心脏内余血冲洗干净,然后扎紧静脉套管(图4-9)。
在左主动脉下方穿一条线,先用眼科剪将动脉剪一小口,再将动脉套管沿向心方向插入动脉(尖端不深入动脉圆锥),此时可见套管中有灌流液流出,随即扎紧套管,剪断左主动脉及左肝静脉,使心脏完全离体。
将套管稳妥地固定在灌流支架上,调节两个套管的方向,使灌流液在心缩时能畅通地搏出心室,从动脉套管流出,即可进行实验2.将插好离体心脏的套管固定在支架上,用蛙心夹夹住心尖(不可夹得过多,以免漏液)。
用记纹鼓记录时,将蛙心夹上的系线与通用杠杆相连(图4-10),调节心搏曲线记录、刺激及记时电磁标三只笔尖与记纹鼓面需接触良好。
如用记录仪描记,则将蛙心夹上的系线绕过一个滑轮与张力换能器相连(图4-11)。
注意:勿使灌流液滴到换能器上。
3.实验观察(1)开动慢鼓记录正常心搏曲线。
(2)向套管内加2—6滴5%NaCl溶液,用电磁标作好加药标记,观察心搏曲线的频率及振幅的变化。
当曲线出现明显变化时,立即吸去套管中的灌流液(作好冲洗标记),用新鲜任氏液清洗2—3次,待心搏恢复正常。
(3)向套管内加入1滴2%CaCl2溶液,观察并记录心搏曲线的变化。
当出现明显变化时,立即更换任氏液(方法同上),待心搏恢复正常。
(4)向套管中加1-2滴1%KCl溶液,记录心搏曲线的变化。
当心搏曲线变化时,立即同(2)法更换灌流液,待心搏恢复。
(5)同(2)法记录套管中加入1—2滴1∶100000肾上腺素溶液后心搏曲线的变化。
(6)同(2)法记录套管中加入1—2滴1∶1000000乙酰胆碱溶液后心搏的变化。
4.将心脏搏动变化的情况填入表4-2。
表4-2几种离子及药物对离体心脏活动的影响【思考题】1.此实验说明心肌有哪些生理特性?2.以本实验为例说明内环境相对恒定的重要意义。
3.各种离子和药物对心搏有何影响,为什么?哺乳动物离体心脏灌流实验哺乳动物离体心脏灌流实验一、实验目的和原理心脏从动物体摘取之后,用有一定压力、温度(37℃)并充氧的修正洛氏液经主动脉根部灌流。
灌流液经冠状动脉口进入冠状血管营养心脏,以维持心脏的节律性活动。
灌流液经冠状血管流入右心房,然后由腔静脉口及肺动脉口流出,在单位时间内的流出量即为冠状动脉血流量(冠脉流量)。
心脏活动可通过张力换能器进行记录,也可用压力换能器(心室内放置水囊)进行记录。
了解哺乳类动物心脏离体灌流方法(Langendorff 氏法)和离体心脏冠脉血流量的测定灌流。
观察肾上腺素、乙酰胆碱对心脏活动及冠脉流量的影响。
二、实验动物大鼠三、实验器材与药品哺乳动物类手术器械一套,注射器,针头,线绳,鼠手术台,灌流液瓶,心脏Langendorff 法灌流装置,恒温循环器,滑轮,烧杯,量筒,修正洛氏液,1:10000,肾上腺素,1:10000 乙酰胆碱。
四、实验方法和步骤1.Langendorff 灌流装置包括恒温、恒压灌流和供气三个部分。
[attach]3[/attach](1).修正洛氏液的配置:成分如下原液 1000ml 2000ml20%NaCl (ml) 45 9010%kCl (ml) 4.2 8.410%CaCl (ml) 2.4 4.85%NaHCO3 (ml) 3 6葡萄糖 2.5 5注意事项:(1)先加蒸馏水(总体积90%左右),再依次加入上述试剂,但加NaHCO3时应逐滴加入,并不断摇晃混匀,防止形成CaCO3沉淀,最后再加入蒸馏水,补足液体量。
(2).将灌流系统用胶管连接,灌流液瓶灌满灌流液。
调整灌流液瓶的高度使灌流压力达到实验要求,一般要求灌流液瓶中心管的下端距心脏的高度为70~90cm,可按心脏的大小而适当调整。
(3).混合气瓶(或球胆)的减压阀出口用软管接至灌流管内的充气管,调节气瓶上的减压阀,使灌流液中的气泡连续且小而均匀。
(4).调节恒温循环器使心脏插管内的灌流液温度恒定在37℃左右。
为了保证离体心脏的表面有一定的温度和湿度,将心脏置于由玻璃或有机玻璃制成的保温灌流槽内。
保温灌流槽的底部有漏斗形的开口,上方盖子盖住可以保持槽内温度恒定.2.标本制备(1).摘取心脏:取心脏前20min,大鼠腹腔注射肝素液抗凝((3125μ/kg)。
取心脏时腹腔麻醉(20%氨基甲酸乙酯,3ml/kg)后,固定仰置于手术台上。
迅速沿胸前壁正中剪开皮肤,打开胸腔,轻轻提起心脏,小心剪断腔静脉、主动脉及心脏周围组织,迅速将心脏连同一段主动脉取出。
手术过程中注意不要损伤心脏,主动脉根部要留0.5~1cm 长度以备插管用。
心脏取出后立刻置于预先备好的充氧的冷克氏液(4℃左右)中,用手指轻压心室以利于其中的剩余的血排出,防止凝血块形成。
心脏停跳后,迅速剪开心包膜并剪去心脏周围的组织(包括肺组织、气管以及附着于心脏上的其他组织),认清主动脉、腔静脉及肺动脉的解剖位置,在主动脉根部穿一棉线备用。
(2).灌流心脏:将主动脉套进心脏插管口内,用棉线将主动脉和心脏插管结扎在一起并固定。
插管进入主动脉不宜过深,以免损伤主动脉瓣及堵住冠状动脉开口,影响冠状血管的灌流。
心脏经充氧的温修正洛氏液灌流后,在lmin 内即可开始恢复跳动,但起初心率较慢,并常有心律不齐,以后逐渐变快而且心律也逐步恢复正常和稳定(大鼠心脏的心率约200~300 次/min),可维持数小时。
3.仪器参数设置显示方式:采集频率800HZ;通道1:心肌收缩,扫描速度1.0s/div,灵敏度2.5g,时间常数直流,滤波频率30HZ。
4.用蛙心夹在心室舒张期夹住心尖,并将连接蛙心夹的丝线通过滑轮连至张力换能器,调节与张力换能器相连丝线的松紧度,使心肌前负荷约5g,记录心脏活动。
5.调节固定保温灌流槽,使保温灌流槽罩住心脏。
灌流液进入冠状血管后到右心房经腔静脉及肺动脉滴入双层灌流槽中,经槽底部的漏斗形开口流出,用量筒收集一定时间内的流出液即为冠脉流量。
流量基本稳定后,进行下列各项观察。
五、实验观察项目1.记录正常情况下的冠脉流量(ml/min)和心脏活动作为对照。
2.由心脏插管的侧管注入1:10000 肾上腺素溶液0.5ml,观察冠脉流量和心脏活动的变化。
3.由心脏插管的侧管注入1:10000 乙酰胆碱溶液0.5ml,观察冠脉流量和心脏活动的变化。
六、实验结果分析记录和测量各种处理前后冠脉流量和心肌收缩张力、心率,并进行统计处理。
七、实验注意事项1.制作离体心脏标本时操作要迅速,不要损伤心脏。
2.灌流压力和灌流液温度要严格维持恒定。
3.冠状血管要保持通畅。
4.注射各种药物时要观察其影响流量的全过程。
