界面化学2008年试题(28)
08届高三化学上学期测试试题

08届高三化学上学期测试试题命题人:韩厚兵第Ⅰ卷(选择题共48分)(考试时间:100 分钟全卷总分:100 分)可能用到的相对原子质量:H : 1 C : 12 Br : 80 I : 127 N : 14 O : 16 P : 31Si : 28 S : 32 Na : 23 Mg : 24 Al : 27 Cu : 64 Ag:108一、选择题(本题包括16小题。
每小题只有一个正确选项。
每小题3分)1.2007 年诺贝尔化学奖德国科学家格哈德·埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。
净化装置中的催化转化器,可将CO、NO、NO2和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。
下列有关说法不正确的是A.催化转化器中的铂催化剂可加快CO 氧化B.铂表面做成蜂窝状更有利于提高催化效果。
C.在铂催化下,NO、NO2可被CO 还原成N2D.碳氢化合物在铂催化下,被CO 直接氧化成CO2和H2O2.对于某些离子的检验及结论一定正确的是()A.加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,一定有CO32-或SO32-B.加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-C.某气体能使湿润红色石蕊试纸变蓝,该气体一定显碱性D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+3.英国研究人员2007 年8 月30 日发表报告认为,全球将有1.4 亿人因为用水而受到砷中毒之害、导致更多的人患癌症。
海带含砷超标,经水浸泡24 小时后,其含砷量才能达到食用安全标准。
下列对砷( As )的有关判断正确的是A.砷原子序数为33 ,它与铝为同主族B.砷的原子半径小于磷的原子半径C.砷化氢的稳定性比溴化氢的强D.砷酸的酸性比硫酸的弱4.某学生积极思考产生喷泉的其他办法,并设计了如图所示装置,在锥形瓶中分别加入足量的下列物质,反应后可产生喷泉的是A.锌片与稀硫酸B.NH4Cl溶液与Ba(OH)2溶液C.CaCO3与稀硫酸D.铁片与浓硝酸5.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了 8 个电子的结构。
08届高三化学第一学期第二次段考试题

08 届高三化学第一学期第二次段考试题化学试题命题人:储方飞注意事项:1.本试卷共6 页,满分100 分,考试时间100 分钟2.本卷可能涉及的相对原子质量:H—1;O—16;Na—23;Cl—35.5;K—39;Fe—56第I 卷(共45 分)一、选择题(本题共15 小题,每题只有一个正确选项,每小题 3 分,共45 分)1.2007 年6 月,“八国峰会”再次就温室气体减排问题展开磋商并初步达成共识。
为减少二氧化碳这种温室气体的排放,下列措施不切实.际...的是()A •大力开发氢能源B •充分利用太阳能C •不使用含碳能源D •提高能源利用率2. 用固体NaOH配制物质的量浓度溶液时,下列操作导致溶液浓度偏高的是()A .在烧杯中溶解时,有少量液体溅出B.样品中混有Na2O杂质C .容量瓶使用前未经干燥D .定容时眼睛在容量瓶刻度线下方3.100g质量分数为3.65%的盐酸与11.6gNa2CO3xH2O刚好完全反应,则x值是()A. 1B. 3C. 7D. 94. 阿伏加德罗常数约为 6.02 X 1023mol 1,下列叙述正确的是()23A . 100g98%的浓硫酸中含氧原子个数为4X 6.02 X 10B. 5.6 g 铁粉与硝酸反应失去的电子数一定为3X6.02X1022C .标准状况下,22.4LCH 4和CH3CI的混合物所含有的分子数目约为 6.02 X 1023D. 6.2g 氧化钠和7.8g 过氧化钠的混合物中所含有的离子总数约为7X6.02 X10225. 下列说法正确的是()A .摩尔是6.02 X 1023个结构微粒的集体12 23B . 0.012kg C所含的原子数精确值是6.02 X 10C. 1mol H 就是1mol 氢 D . 1molH 2SO4 的质量是98g6.标准状况下,13g 某气体的分子数与14g 一氧化碳分子数相等,则该气体的密度为()A.11.6g/L B.1.16g/L C.12.5g/L D.1.25g/L7.下列各组离子,在指定的环境中一定..能大量共存的是()A .滴加石蕊试液显红色的溶液:Fe3*、NH4J C1「、SCN「B .含有大量HCO3「的溶液:NH4+、Ca2+、Mg2*、「C .在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO4"、NO3「D .含有大量ClO「的溶液:H+、Mg2+、「、SO42—&将a g钠投入b g水中(足量水),反应后所得溶液中溶质的质量分数是()a 40a “cc/ 20a “cc/40a …皿A. 100%B. 100%C. 100%D. 100%a+b a+b a+b 22a + 23b9•下列实验操作中错误的是()A •用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出B •蒸发结晶时,应将溶液蒸干,并放在干燥器中冷却C •无锈的细铁丝可以代替铂丝,做焰色反应的工具D .蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处HOOC — CH —CH厂COOH,它可能发生OH的反应是:①与NaOH溶液反应;②与石蕊试液作用变红;③与金属钠反应放出气体;④一定条件下与乙酸酯化⑤一定条件下与乙醇酯化A .①②③B .①②③④C .①②③⑤D .①②③④⑤11.有KOH和KHCO3混合物26.2g,在250 C下煅烧,冷却后称量,质量减少 4.65g , 则原混合物中KOH和KHCO3的物质的量的关系是()A . KOH > KHCO 3 B. KOH V KHCO 3 C . KOH = KHCO12 .将标准状况下的aLHCl(气)溶于1000g水中,得到的盐酸密度为物质的量浓度是13 .向0.1 mol/L的NaOH溶液中加入0.1 mol/L的盐酸。
2008年普通高等学校招生全国统一考试理科综合能力测试(北京卷)化学试题及其答案(Word版)

2008年普通高等学校招生全国统一考试理科综合能力测试(北京卷)化学试题及其答案5.据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。
某种氢氧燃料电池的电解液为KOH溶液。
下列有关该电池的叙述不正确的是A.正极反应式为:O2+2H2O+4e-=4OH―B.工作一段时间后,电解液中KOH的物质的量不变C.该燃料电池的总反应方程式为:2H2+O2=2H2OD.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移6.对H2O的电离平衡不产生影响的粒子是Cl: B.26M3+C. D.A.H:••••7.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是A. Na2CO3B. Na2O2Na2CO3C. NaOH Na2CO3D. Na2O2 NaOH Na2CO38.下列叙述正确的是A.金属与盐溶液的反应都是置换反应B.阴离子都只有还原性C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物D.分子晶体中都存在范德瓦耳斯力,可能不存在共价键9.下列各组物质的无色溶液,不用其它试剂即可鉴别的是①KOH Na2SO4AlCl3②NaHCO3B a(O H)2H2SO4③HCl NaAlO2NaHSO4④C a(O H)2Na2CO3BaCl2A.①②B.②③C.①③④D.①②④10.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是A.由m X a+与n Y b-,得m+a=n-bB.X2-的还原性一定大于Y-C.X、Y一定不是同周期元素D.若X的原子半径大于Y,则气态氢化物的稳定性H m X一定大于H n Y11.下列叙述正确的是A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO 42->c(NH 4+)B.两种醋酸溶液的物质的量浓度分别c 1和c 2,pH 分别为a 和a+1,则c 1=10c 2C .pH=11的NaOH 溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色D.向0.1mol/L 的氨水中加入少量硫酸铵固体,则溶液中-32c(OH )c(NH H O)增大 12.工业上制备纯硅反应的热化学方程式如下:SiCl 4(g)+2H 2(g)Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是A.反应过程中,若增大压强能提高SiCl 4的转化率B.若反应开始时SiCl 4为1mol ,则达平衡时,吸收热量为QkJC.反应至4min 时,若HCl 浓度为0.12mol/L ,则H 2的反应速率为0.03mol/(L min)D .当反应吸收热量为0.025QkJ 时,生成的HCl 通入100mL 1mol/L 的NaOH 溶液恰好反应25.(16分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物。
2008年高考全国一卷化学试题

2008年普通高等学校招生全国统一考试(全国卷Ⅰ)化学试题一.选择题(本题共13小题,在每小题给出的四个选项中,只有一项是符合题目要求的。
)6. 在溶液中加入中量Na2O2后仍能大量共存的离子组是( )A. NH+4、Ba2+、Cl—、NO3—B. K+、AlO2—、Cl—、SO42—C. Ca2+、Mg2+、NO3—、HCO3—D. Na+、Cl—、CO32—、SO32—7. 下列化合物,按其品体的熔点由高到低排列正确的是( )A. SiO2CaCl CBr4 CF2B. SiO2 CsCl CF4 CBr4C. CsCl SiO2CBr4 CF4D. CF4 CBr4 CsCl SiO28. 下列各组物质不属于...同分异构体的是( )A.2,2-二甲基丙醇和2-甲基丁醇B. 邻氯甲苯和对氯甲苯C.2-甲基丁烷和戊烷D. 甲基丙烯酸和甲酸丙酯9. 下列各组给定原子序数的元素,不能..形成原子数之比为1∶1稳定化合物的是A. 3和17B. 1和8C. 1和6D. 7和1210. 下列叙述中正确的是( )A. NH3、CO、CO2都是极性分子B. CH4、CCl4都是含有极性键的非极性分子C. HF、HCl、HBr、Hl的稳定性依次增强D. CS2、H2O、C2H2都是直线型分子11. 已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025KJ/mol该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )12. 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )A. c(OH)>c(HA)>c(HB)>c(H+)B. c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+)D.c(OH-)>c(HB)>c(HA)>c(H+)13. 电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )A.0.10mol/LAg+B.0.02mol/L Zn2+C.0.20mol/L Cu2+D.0.20mol/L Pb2+26.(16分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl 用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。
2008年有机化学真题详解
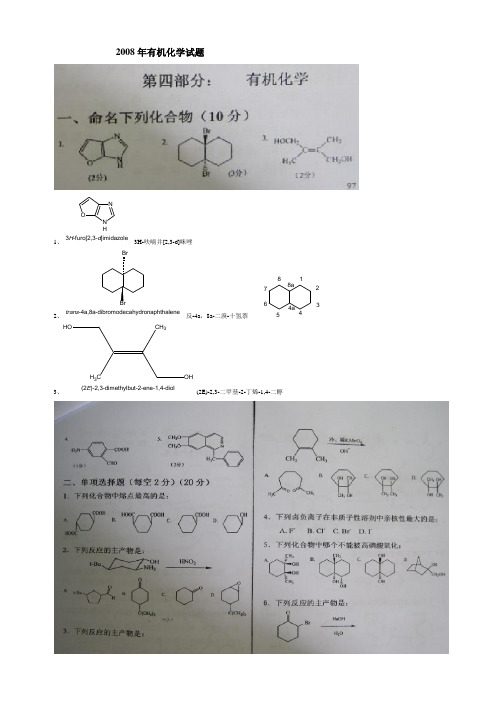
2008年有机化学试题1、ONN H3H -furo[2,3-d ]imidazole3H-呋喃并[2,3-d]咪唑2、trans -4a,8a-dibromodecahydronaphthalene反-4a ,8a-二溴-十氢萘 12344a 56788a3、OHOH CH 3CH 3(2E )-2,3-dimethylbut-2-ene-1,4-diol(2E)-2,3-二甲基-2-丁烯-1,4-二醇4、O N OOHO 2-formyl-4-nitrobenzoic acid 2-甲酰基-4-硝基-苯乙酸5、CH 3OC H 3ON1-benzyl-6,7-dimethoxyisoquinoline1-苯甲基-6,7-甲氧基-异喹啉二、单项选择题1、A (环己醇:熔点:25.2C ) 羧酸的沸点比分子量相近的醇的沸点高的多。
二元羧酸由于分子中碳链两端都连有羧基,分子引力大,熔点比一元羧酸高的多。
一般说来,反式异构体比顺势异构体沸点低,熔点高。
熔点取决于分子对称性,反式对称性较高,故熔点高。
分子间吸引力越大,分子就不容易脱离液面,沸点就越高。
反式异构体分子不能紧密靠在一起,接触面积小,吸引力小,故沸点低。
2、D(邻重氮基生反应生成双键与O 结合)3、C(加热即分解成醛,即选项A)(09、10均考过)4、D亲核性:I->Br->Cl->F-C(羟基相聚较远,不能被氧化)OH OHHIO4OO6、D(Favorskii 重排)7、D磺化反应是一个可逆反应,在低温下得到由反应速度决定的动力学控制产物1-萘磺酸,而在高温下通过可逆反应的平衡,最终得到较为稳定的2-萘磺酸。
8、B(芳构化效应)用Hukel规则解释一下就ok了,它的HOMO被电子填充满了,所以具有芳香性,所以具有稳定性;而其他三个都含有sp3杂化的碳原子,连共轭体系都没形成,何谈芳香性呢?9、D吸电子增强酸性,给电子减弱酸性。
2008年普通高等学校招生全国统一考试理综化学试题及答案-全国2

2008年普通高等学校招生全国统一考试理科综合能力测试本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。
第I卷1至5页,第Ⅱ卷6至15页。
考试结束后,将本试题卷和答题卡一并交回。
第I卷(选择题共126分)注意事项:3.本卷共21小题,每小题6分,共126分。
以下数据可供解题时参考:相对原子质量(原子量):H 1 C 12N 14 O 16 Na 23 P 31 Cl 35.5一、选择题(本题共13小题。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)6.2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述中不正确的是A.分子中碳原子不在一条直线上B.光照下能够发生取代反应C.比丁烷更易液化D.是石油分馏的一种产品7.实验室现有3种酸碱指示剂,其pH变色范围如下甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0 用0.1 000mol/L NaOH 溶液滴定未知浓度的CH3COOH 溶液,反应恰好完全时,下列叙述中正确的是A.溶液呈中性,可选用甲基橙或酚酞作指示剂B.溶液呈中性,只能选用石蕊作指示剂C.溶液呈碱性,可选用甲基橙或酚酞作指示剂D.溶液呈碱性,只能选用酚酞作指示剂8.对于ⅣA族元素,下列叙述中不正确的是A.SiO2和CO2中,Si和O,C和O之间都是共价键B.C、Si和Ge的最外层电子数都是4,次外层电子数都8C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应D.该族元素的主要化合价是+4和+29.取浓度相同的Na0H和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为A.0.01mol/L B.0.017mol/LC.0.05mol/L D.0.50mol/L10.右图为直流电源电解稀Na2SO4 水溶液的装置。
通电后在石墨电极a 和b 附近分别滴加一滴石蕊溶液。
下列实验现象中正确的是A .逸出气体的体积,a 电极的小于b 电极的B .一电极逸出无味气体,另一电极逸出刺激性气味气体C .a 电极附近呈红色,b 电极附近呈蓝色D .a 电极附近呈蓝色,b 电极附近呈红色11.某元素的一种同位素X 的原子质量数为A ,含N 个中子,它与1H 原子组成H m X 分子。
表面与界面化学试卷(a)2008

Fig.1Figure 1 shows an adsorbed structure on an fcc surface. How might this adsorbate structure on the surface be described武汉理工大学教务处试题标准答案及评分标准用纸课程名称—表面与界面化学——(A 卷)1. chemisorption: a chemical bond, involving substantial rearrangement of electron density, is formed between the adsorbate and substrate.Physisorption : the only bonding is by weak Van der Waals - type forces. There is no significant redistribution of electron density in either the molecule or at the substrate surface.2. the surface energies determined are not equal. in air<under argon<and in a vacuum. When the mica is prepared in air, chemisorptions will occur on the mica surface and release heat. Under argon, there is only physisorption occur, the released energy is lower. In a vacuum, no adsorption occurs, the real surface energy is determined.3. The first raindrop sliding down the window glass, the contact angle of the water and glass is the advancing contact angle, which gives a large force to prevent the sliding of raindrop. The first raindrop leaves a water film on the glass. The later raindrop will show a spreading wetting on the window and give a quick sliding rate.4. (1) M=WRT/ A=(2) sodium dodecylsulfate is an ionic surfactant。
2008年全国化学竞赛初赛模拟试卷(28)汇编

2008年全国化学竞赛初赛模拟试卷(28)第一题(5分)1.H2O的沸点(100℃)比HF的沸点(20℃)高,请解释原因。
2.气态氯原子与一个电子结合比气态氟原子与一个电子结合放出更多的能量,请解释原因。
3.在NF3中N-F键能为280kJ/mol,比在BF3中B-F键能(646kJ/mol)的1/2还小,请解释原因。
第二题(2分)通电分解水实验所产生的O2和H2的体积比(理论值)为1︰2。
已知,在标准状况下H2的密度为0.0899g/L,O2的密度为1.429g/L。
但根据该实验计算得到的O2的密度为1.438g/L。
试分析O2的密度出现误差的主要原因(不包括操作失误和仪器失准所致)。
第三题(10分)已知苯甲酸乙酯的沸点为213℃,水-乙醇-环己烷三元共沸物(7%-17%-76%)的共沸点为62.1℃。
1.如右图装置,三颈圆底烧瓶内加入苯甲酸、浓硫酸、过量乙醇、环己烷、沸石,装上分水器和回流冷凝管。
(1)加入环己烷的目的是什么?(2)分水器的作用是什么?2.缓慢加热回流,一定时间后停止加热,放出分水器中液体。
(1)如何判断停止加热的时间?(2)分水器中液体有哪些主要成分?3.如何初步得到初产品,然后进一步提纯?第四题(10分)磷的含氧酸及其盐是一类重要的化工产品,广泛用于食品、营养、肥料、阻燃、去油去污、防腐蚀、防锈、锅炉水处理等。
下面A~F都是磷的含氧酸。
在5℃把红磷加入到剧烈搅拌的NaOH(0.2mol/L)和NaClO(1.5mol/L)混合溶液中,反应得A的二钠盐。
将纯化后的二钠盐溶于水,再通过H型阳离子交换树脂,即可获得纯的酸A的水溶液。
A是一种四元酸,在0℃时,A在空气中是稳定的,温度升高,部分转变成它的异构体B,B是三元酸;也有部分会发生歧化反应,生成另外两种各含2个磷原子的含氧酸C和D,C是四元酸,D是二元酸。
A在酸性介质中加热会分解另外两种各含1个磷原子的含氧酸E和F,E是三元酸、F是二元酸。
界面化学基础习题参考答案

界面化学基础习题参考答案 第一章 1.一个小水滴的体积 V
2 其特点是一级微商 和二级微商 2 皆为负值且服从特劳贝规则。第三类曲线的特点是:溶液表 c c
面张力在低浓度时急剧下降,很快达最低点,随后溶液表面张力随浓度变化趋于缓慢,逐渐趋于一个稳定 值,这类曲线对特劳贝规则适用,其另一特点是,降低溶液表面张力的有效值和效率(cmc)都较高(cmc 小) 。 2.加入溶质后使溶液表面张力降低的性质叫表面活性,用 解答) 。
1 dr ,当加入表面活性物质后, , 0 为正吸附,反之,则为负吸附。 RT d ln c
d RTd ln a Ad
RT ln a
A
1 1 dr 代入得 RT d ln a
公式导出过程如下
dU TdS pdV dA i dni dU TdS pdV dA i dni SdT Vdp Ad ni di
1 mol 甲醇的体积为 32/0.8=40cm3 每个甲醇分子的半径为
40 3 3 8 r cm 2.5110 cm 23 4 6.02 10
1 cm3 的表面积 S=
1
3 1.2 108 cm2 1.2 104 m2 r
1
总表面积 S’=4.8×105m2 ΔG=4.8×105×22.05×10-3·J·m-2 =1.06×104J·m-2 9.不能。因为当水沿毛细管上升到管口时,曲率将发生变化,直到曲率半径增加到附加压力与毛细上升的 静水压相等时,液面停止上升,可见,当水上升到弯管的最高点时,便停止变化。 10. p
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国矿业大学(北京)
研究生课程考试试卷考试科目界面化学
考试时间2008年6月23日
学号
姓名
所属学院
类别(硕士、博士、进修生)
评语:
任课教师签名:
中国矿业大学(北京)
2008年《界面化学》考试题
一、名词解释(每题3分,共18分)
1、毛细凝结与等温蒸馏
2、特劳贝(Traube)规则
3、表面熵与表面总能
4、微乳、反相微乳
5、粗糙因子(粗糙度)
6、加溶作用
二、简单题(每题4分,共24分)
1、试举两例说明表面活性剂的混合会有哪些优点?
2、与小分子的液相吸附相比,自大分子溶液中的吸附有何特点?其吸附方
程与Langmuir方程相比要作哪些修正?
3、晶体表面的不完整性主要包括哪些方面?
4、何谓LB膜和LB技术?按转移方式可分为哪几类?其结构有何特点?
5、常用吸附剂的特点有哪些?并以分子筛为例,谈谈其结构特点及吸附性
质。
6、举例说明何谓Gemini(双子)表面活性剂?其结构特点如何?分析其应用
前景。
三、计算题(每题5分,共35分)
1. 液态铋在550℃时的表面张力是380mN/(m.K),它的临界温度是4620K,
试估计它在1000℃时的表面张力和总表面能。
2. 有一C12H25(OC2H4)7OH溶液,已知此时每个吸附的C12H25(OC2H4)7OH分
子在表面占有面积0.72nm2,问表面吸附量是多少?
3. 在20℃时,已知四氯化碳对水的界面张力为45.1mN/m ;水对正己烷的。
界面张力为51.1mN/m。
求四氯化碳的d
4. 一天然大分子化合物可铺展成每1m2含量为0.8mg的不溶膜。
在20℃时,
此膜使底液水的表面张力降低0.035mN/m。
问此化合物的分子量是多少?
5. 20℃时水在石蜡上的接触角为105°。
试计算水对石蜡的粘附功和铺展系
数。
6. 在20℃时,有某种碳氢高分子化合物做成的管子,水在其中不形成弯月。
面,请给出此管材的表面能色散力分量d
s
7. 自溶液中吸附染料可估计粉末固体的比表面。
若1g炭与100ml 初浓度为
1×10-4mol/L的亚甲蓝水溶液共摇,吸附平衡后染料浓度为0.6×10-4mol/L。
若用2g炭进行此实验,平衡浓度为0.4×10-4mol/L。
若吸附结果服从Langmuir 方程,试计算该炭的比表面。
设单分子层中亚甲蓝分子截面积为0.65nm2。
(注:条件温度为20℃)
四、查阅文献,撰写一篇与界面化学理论和应用相关的综述性论文,
自选题,不少于2000字,要求包括:题目、作者、正文和参考文献(按次序在文中标注),论文要反映本领域的最新成果。
(以B5纸打印)(23分)。
