九年级化学化学方程式1
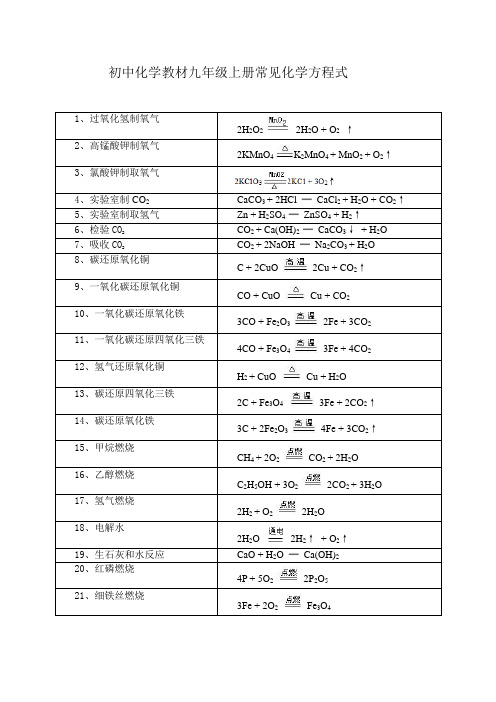
初中化学教材九年级上册常见化学方程式
19、生石灰和水反应
CaO+H2O═Ca(OH)2
20、红磷燃烧
4P+5O2 2P2O5
21、细铁丝燃烧
3Fe+2O2 Fe3O4
22、硫磺燃烧
S+O2 SO2
23、木炭充分燃烧
C+O2 CO2
24、木炭不充分燃烧
2C+O2 2CO
25、镁带燃烧
2Mg+O2 2MgO
26、铜丝在空气中受热
CO2+Ca(OH)2═CaCO3↓+H2O
7、吸收CO2
CO2+2NaOH═Na2CO3+H2O
8、碳还原氧化铜
C+2CuO 2Cu+CO2↑
9、一氧化碳还原氧化铜
CO+CuO Cu+CO2
10、一氧化Байду номын сангаас还原氧化铁
3CO+Fe2O3 2Fe+3CO2
11、一氧化碳还原四氧化三铁
4CO+Fe3O4 3Fe+4CO2
2Cu+O2 2CuO
27、汞与氧气的反应
2Hg+O2 2HgO
28、氧化汞分解
2HgO 2Hg+O2↑
29、工业制取二氧化碳
CaCO3 CaO+CO2↑
30、氢气与氯气的反应
H2+Cl2 2HCl
31、有毒气体CO燃烧
2CO+O2 2CO2
32、CO2与C反应
CO2+C 2CO
33、CO2和H2O反应
初中化学教材九年级上册常见化学方程式
1、过氧化氢制氧气
九年级化学必备方程式

九年级化学必备方程式
1.燃烧反应
-镁在空气中燃烧:2Mg+O2→2MgO
-铁在氧气中燃烧:3Fe+2O2→Fe3O4
-硫磺燃烧:S+O2→SO2
-碳完全燃烧:C+O2→CO2
-氢气燃烧:2H2+O2→2H2O
-磷燃烧:4P+5O2→2P2O5
2.酸碱中和反应
-氢氧化钠与盐酸反应:NaOH+HCl→NaCl+H2O
3.金属氧化物与酸反应
-碳酸钙与稀盐酸反应:CaCO3+2HCl→CaCl2+H2O+CO2↑
4.金属与酸反应
-锌与稀硫酸反应:Zn+H2SO4→ZnSO4+H2↑
5.二氧化碳与碱反应
-二氧化碳与氢氧化钠反应:CO2+2NaOH→Na2CO3+H2O
6.热分解反应
-碳酸钙高温分解:CaCO3→CaO+CO2↑
-水电解:2H2O→2H2↑+O2↑
7.工业制法
-高炉炼铁(氧化铁还原):Fe2O3+3CO→2Fe+3CO2 -生石灰制熟石灰:CaO+H2O→Ca(OH)2
8.实验室制取气体
-过氧化氢分解制氧:2H2O2→2H2O+O2↑
-高锰酸钾分解制氧:2KMnO4→K2MnO4+MnO2+O2↑-氯酸钾分解制氧:2KClO3→2KCl+3O2↑。
初三化学上册化学方程式

初三化学上册化学方程式
1、氢氧化钠+氯气=氯化钠+氢气
2、锂+氧=锂氧化物
3、硫+水=硫酸
4、蒸汽加热乙醇=乙醛及水
5、磷酸铵+碳酸钾=磷酸二钾+二氧化碳
6、硫+碱=元素硫+盐
一、氢氧化钠+氯气=氯化钠+氢气
在室温下,氯气(Cl2)可以用得其他化学反应。
例如它可以与氢氧化钠(NaOH)发生以下化学反应,生成氯化钠(NaCl)加氢气(H2)的反应条件下反应方程式如下:
NaOH + Cl2 = NaCl + H2
二、锂+氧=锂氧化物
锂(Li)与氧(O2)化学反应可以生成锂氧化物(Li2O),它的反应方程式如下:
Li + O2 = Li2O
三、硫+水=硫酸
硫(S)与水(H2O)发生反应可以生成硫酸(H2SO4)。
它的反应条件是在高温、饱和气氛下,反应方程式如下:
S + H2O = H2SO4
四、蒸汽加热乙醇=乙醛及水
乙醇(C2H5OH)在蒸汽加热下可以生成乙醛(CH3CHO)和水(H2O),反应方程式为:
C2H5OH = CH3CHO + H2O
五、磷酸铵+碳酸钾=磷酸二钾+二氧化碳
磷酸铵(NH4H2PO4)与碳酸钾(K2CO3)结合可以生成磷酸二钾(K2H2PO4)与二氧化碳(CO2),反应方程式为:
NH4H2PO4 + K2CO3 = K2H2PO4 + CO2
六、硫+碱=元素硫+盐
硫(S)与碱(NaOH)发生反应可以生成元素硫(S0)和盐
(Na2SO4),反应方程式为:
S + NaOH = S0 + Na2SO4。
九年级学到的化学方程式

九年级学到的化学方程式
九年级化学涉及的化学方程式主要包括化合反应、分解反应和置换反应等类型。
以下是一些具体的化学方程式示例:
1. 化合反应:
镁在空气中燃烧:2Mg + O2 = 2MgO
铁在氧气中燃烧:3Fe + 2O2 = Fe3O4
铜在空气中受热:2Cu + O2 = 2CuO
硫在氧气中燃烧:S + O2 = SO2
2. 分解反应:
水电解:2H2O = 2H2 + O2
碳酸氢铵受热分解:NH4HCO3 = NH3 + H2O + CO2
高锰酸钾分解:KMnO4 = K2MnO4 + MnO2 + O2
氯酸钾分解:KClO3 = KCl + O2
3. 置换反应:
锌与稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2
铁与稀盐酸反应:Fe + 2HCl = FeCl2 + H2
铜与硝酸银溶液反应:Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
以上只是九年级化学中的部分化学方程式,实际上,化学方程式是非常丰富的,可以通过元素周期表、化合价规则和实验现象等进行学习和记忆。
九年级化学必背化学方程式

1、钠与氧气在点燃时反应生成过氧化钠:2Na+O₂=Na₂O₂(条件:点燃)2、钠与氧气反应生成氧化钠:4Na+O₂=2Na₂O3、钠与氯气在点燃时反应生成氯化钠:2Na+Cl₂=2NaCl(条件:点燃)4、钠与水反应生成氢氧化钠和氢气:2Na+2H₂O=2NaOH+H₂↑5、碳酸钠与盐酸反应生成氯化钠,水和二氧化碳:Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑6、碳酸钠与水和二氧化碳反应生成碳酸氢钠:Na₂CO₃+H₂O+CO₂=2NaHCO₃7、氢氧化钠与盐酸反应生成氯化钠和水:NaOH+HCl=NaCl+H₂O8、氢氧化钠与硫酸铜反应生成氢氧化铜和水:2NaOH+CuSO₄=Cu(OH)₂↓+Na₂SO₄9、镁与盐酸反应生成氯化镁和氢气:Mg+2HCl=MgCl₂+H₂↑10、镁与二氧化碳点燃时反应生成氧化镁和碳:2Mg+CO₂=2MgO+C(条件:点燃)11、氢氧化镁与盐酸反应生成氯化镁和水:Mg(OH)₂+2HCl=MgCl₂+2H₂O12、铝与氧气反应生成氧化铝:4Al+3O₂=2Al₂O₃13、铝与盐酸反应生成氯化铝和氢气:2Al+6HCl=2AlCl₃+3H₂↑14、铝与氧化铁在高温条件下反应生成铁和氧化铝:2Al+Fe₂O₃=2Fe+Al₂O₃(条件:高温)15、氧化铝与盐酸反应生成氯化铝和水:Al₂O₃+6HCl=2AlCl₃+3H₂O16、氢氧化铝和盐酸反应生成氯化铝和水:Al(OH)₃+3HCl=AlCl₃+3H₂O17、铁与氧气在点燃条件下反应生成四氧化三铁:3Fe+2O₂=Fe₃O₄(条件:点燃)18、铁与盐酸反应生成氯化亚铁和氢气:Fe+2HCl=FeCl₂+H₂↑19、铁与硫酸铜反应生成硫酸亚铁和铜:Fe+CuSO₄=FeSO₄+Cu20、氧化铁与盐酸反应生成氯化铁与水:Fe₂O₃+6HCl=2FeCl₃+3H₂O21、氧化铁与硝酸反应生成硝酸铁与水:Fe₂O₃+6HNO₃=2Fe(NO₃)₃+3H₂O22、铜和氯气在点燃条件下反应生成氯化铜:Cu+Cl₂=CuCl₂(条件:点燃)23、氢气和氯气在光照条件下反应生成氯化氢:H₂+Cl₂=2HCl(条件:光照)24、氯气与硫化氢反应生成氯化氢和硫:Cl₂+H₂S=2HCl+S↓25、浓盐酸与二氧化锰在加热条件下反应生成氯化锰,水和氯气:4HCl(浓)+MnO₂=MnCl₂+2H₂O+Cl₂↑(条件:加热)26、硫与氧气在点燃条件下反应生成二氧化硫:S+O₂=SO₂(条件:点燃)27、浓硫酸与碳反应生成二氧化碳,二氧化硫和水:2H₂SO₄(浓)+C=CO₂↑+2SO₂↑+2H₂O28、氮气与氧气在放电条件下反应生成一氧化氮:N₂+O₂=2NO(条件:放电)29、一氧化氮与氧气反应生成二氧化氮:2NO+O₂=2NO₂30、氧化铜与硝酸反应生成硝酸铜与水:CuO+2HNO₃=Cu(NO₃)₂+H₂O。
九年级化学上册必背化学方程式

九年级上册必背化学方程式一、燃烧反应描述现象时都要加上放出大量热1.碳充分燃烧:C+O2 CO2空气中:红热氧气中:发出白光,放出热量,产生使石灰水变浑浊的无色气体2.碳不充分燃烧:2C+O2 2CO3.硫燃烧:S+O2 SO2空气中:淡蓝色火焰,放出热量,产生具有刺激气味的气体氧气中:蓝紫色火焰,放出热量,产生具有刺激气味的气体4.磷燃烧:4P+5O2 P2O5产生大量白烟,P2O5污染空气5.铁燃烧:3Fe+2O2 Fe3O4氧气中:剧烈燃烧,火星四射,放出大量热,生成黑色固体瓶底留少量水或细沙,防止溅落的高温熔化物炸裂瓶底;6.镁燃烧:2Mg+O2 2MgO发出耀眼的白光,生成白色固体7.氢气燃烧:2H2+O2 2H2O产生淡蓝色火焰,干冷烧杯壁有小水株8.一氧化碳燃烧:2CO+O2 2CO2产生蓝色火焰,产生使石灰水变浑浊的无色气体9.甲烷燃烧:CH4+2O2 CO2+2H2O产生明亮的蓝色火焰10.乙醇燃烧:C2H5OH+3O2 2CO2+3H2O二、常见气体制备方程一制取氧气1.过氧化氢与二氧化锰混合制氧气:2H2O2 2H2O + O2↑2.加热氯酸钾和二氧化锰制备氧气:2KClO3 2KCl+O23.加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑棉花:防止高锰酸钾粉末堵塞导管先撤导管后灭酒精灯:防止水倒流回试管底部而炸裂试管4.加热氧化汞:2HgO 2Hg+O2↑5.电解水:2H2O H2↑+O2↑电极:正氧负氢;体积比:氢二氧一加入硫酸或氢氧化钠的目的:增强水的导电性二制取二氧化碳1.石灰石跟稀盐酸反应制二氧化碳:CaCO3 + 2HCl CaCl2 + H2O+ CO2↑药品的选择性2.碳酸根不稳定:H2CO3 H2O+CO2↑3.高温煅烧石灰石:CaCO3 CaO+CO2↑工业上制备二氧化碳三制取氢气1.锌跟稀硫酸反应:Zn + H2SO4ZnSO4 + H2↑实验室制氢气2.锌跟稀盐酸:Zn + 2HCl ZnCl2 + H2↑3.镁跟稀盐酸反应:Mg + 2HCl MgCl2 + H2↑三、其他方程式1.二氧化碳使澄清石灰水变浑浊:CaOH2 + CO2 CaCO3↓+ H2OCO2的检验CO2与NaOH反应:2NaOH+CO2Na2CO3+H2OCO2吸收2.二氧化碳溶于水:CO2+H2O H2CO3CO2通入紫色石蕊试液,试液由紫色变为红色3.木炭粉跟氧化铜高温共热:C+2CuO 2Cu+CO2↑黑色粉末逐渐变红,生成能使澄清石灰水变浑浊的气体4.木炭粉还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑5.一氧化碳还原氧化铜:CO+CuO Cu+CO2要有尾气处理装置H2还原氧化铜:H2+CuO Cu+H2O反应前先通一段时间气体:排尽装置中的空气/氧气;反应结束后继续通一段时间气体,直至试卷冷却至常温下:防止生成的Cu重新被氧化成氧化铜6.一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO27.光合作用:6CO2+6H2O C6H12O6+6O2。
九年级1-8单元初中化学方程式大全

九年级化学(1-8单元)方程式大全化合反应1、镁在空气中燃烧:2Mg+O22MgO2、铁在氧气中燃烧:3Fe+2O2 Fe3O43、铝耐腐蚀的原因:4Al+3O2 == 2Al2O34、氢气在空气中燃烧:2H2+O2 2H2O5、红磷在空气中燃烧:4P+5O2 2P2O56、硫粉在空气中燃烧:S+O2SO27、碳在氧气中充分燃烧:C+O2 CO28、碳不充分燃烧:2C+O22CO9、二氧化碳通过灼热碳层:C+CO2 2CO10、一氧化碳在氧气中燃烧:2CO+O2 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO312、生石灰溶于水:CaO+H2O==Ca(OH)213、铜与氧气反应:2Cu + O22CuO分解反应14、实验室用双氧水制氧气:2H2O22H2O+O2↑15、加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑16. 加热氯酸钾(有少量的二氧化锰):2KClO32KCl+3O2↑17、水在直流电的作用下分解:2H2O2H2↑+O2↑18、氧化汞分解:2HgO2Hg+O2↑19、碳酸不稳定而分解:H2CO3==H2O+CO2↑20、高温煅烧石灰石(二氧化碳工业制法):CaCO3CaO+CO2↑置换反应21、氢气还原氧化铜:H2+CuO Cu+H2O22、木炭还原氧化铜:C+2CuO 2Cu+CO2↑23、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑24、锌和稀硫酸:Zn+H2SO4==ZnSO4+H2↑25、锌和稀盐酸:Zn+2HCl==ZnCl2+H2↑26、铁和稀硫酸:Fe+H2SO4==FeSO4+H2↑27、铁和稀盐酸:Fe+2HCl==FeCl2+H2↑28、镁和稀硫酸:Mg+H2SO4==MgSO4+H2↑29、镁和稀盐酸:Mg+2HCl==MgCl2+H2↑30、铝和稀硫酸:2Al+3H2SO4==Al2(SO4)3+3H2↑31、铝和稀盐酸:2Al+6HCl==2AlCl3+3H2↑32、铁和硫酸铜溶液反应(铁比铜活泼):Fe+CuSO4==FeSO4+Cu33、锌和硫酸铜溶液反应(锌比铜活泼):Zn+CuSO4==ZnSO4+Cu34、铁和硝酸银溶液反应(铁比银活泼):Fe+ 2AgNO3==Fe(NO3)2+2Ag35、铜和硝酸银溶液反应(铜比银活泼):Cu+2AgNO3==Cu(NO3)2+2Ag其他36、甲烷在空气中燃烧:CH4+2O2CO2+2H2O37、酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O38、一氧化碳还原氧化铜:CO+CuO Cu+CO239、一氧化碳还原氧化铁(工业用赤铁矿冶铁):3CO+Fe2O32Fe+3CO240、一氧化碳还原四氧化三铁(工业用磁铁矿冶铁):4CO+Fe3O43Fe+4CO241、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O42、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑。
九年级化学1-5单元化学方程式

1-5单元化学方程式1.镁在空气中燃烧:2Mg+O 2====点燃2MgO2.铁在氧气中燃烧:3Fe+2O 2====点燃Fe 3O 43.铜在空气中受热:2Cu+O 2====加热2CuO4.钠在氯气中燃烧2Na + Cl 2 点燃 2NaCl5.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O6.红磷在空气中燃烧:4P+5O 2====点燃2P 2O 57.硫粉在空气中燃烧:S+O 2====点燃SO 28.碳在氧气中充分燃烧:C+O 2====点燃CO 29.拉瓦锡研究空气成分实验2HgO====加热2Hg+O 2↑10.加热高锰酸钾: 2KMnO 4====加热K 2MnO 4+MnO 2+O 2↑(实验室制氧气原理1)11.氯酸钾与二氧化锰混合共热制氧气: 2KClO 3MnO2==== 2KCl+3O 2↑ (实验室制氧气原理2) 12.过氧化氢在二氧化锰作催化剂条件下分解反应: 2H 2O 2=====MnO22H 2O+O 2↑(实验室制氧气原理3)13.水在直流电的作用下分解(研究水的组成实验): 2H 2O====通电2H 2↑+O 2↑14. 氢气还原氧化铜:H 2+CuO====Cu+H 2O现象:由黑色的固体变成红色的,同时有水珠生成15.铁和硫酸铜溶液反应:Fe+CuSO 4===F e SO 4+Cu16.碳酸钠与稀盐酸反应 Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑17.检验二氧化碳方法:Ca(OH)2+CO 2===CaCO 3↓+H 2O 现象:生成白色的沉淀,用于检验二氧化碳18.氢氧化钠溶液与硫酸铜溶液反应: 2NaOH + CuSO 4==Cu(OH)2↓+2NaCl 现象:生成蓝色絮状沉淀 △2。
九年级所有化学方程式

九年级所有化学方程式1、caco3(s)+==cao(s)+co2(g);2、c(石墨)+o2(g)===co2(g);3、c(金刚石)+o2(g)===co2(g);4、c(石墨)===c(金刚石);5、naoh(aq)+hcl(aq)=nacl(aq)+h2o(l);6、c(s)+o2(g)==co2(g);7、co(g)+1/2o2(g)==co2(g);8、h2(g)+1/2o2(g)==h2o(g);9、n2h4(g)+o2(g)==n2(g)+2h2o(g);10、s(s)+o2(g)==so2(g);11、fes2(s)+11/4o2(g)==1/2fe2o3(s)+2so2(g);12、so2(s)+1/2o2(g)==so3(g);13、3h2(g)+n2(g)==2nh3(g);14、2o2(g)+n2(g)==2no2(g);15、o2(g)+n2(g)==2no(g);单质与氧气的'反应1、镁在空气中冷却:2mg + o2 熄灭 2mgo2、铁在氧气中燃烧:3fe + 2o2 点燃 fe3o43、铜在空气中熔化:2cu + o2 冷却 2cuo4、铝在空气中燃烧:4al + 3o2 点燃 2al2o35、氢气中空气中冷却:2h2 + o2 熄灭 2h2o6、红磷在空气中燃烧:4p + 5o2 点燃 2p2o57、硫粉在空气中冷却: s + o2 熄灭 so28、碳在氧气中充分燃烧:c + o2 点燃 co29、碳在氧气中不充份冷却:2c + o2 熄灭 2co化合反应1、镁在空气中冷却:2mg+o2==2mgo2、铁在氧气中燃烧:3fe+2o2==fe3o43、铝在空气中冷却:4al+3o2==2al2o34、氢气在空气中燃烧:2h2+o2==2h2o5、红磷在空气中冷却:4p+5o2==2p2o56、硫粉在空气中燃烧: s+o2==so27、碳在氧气中充份冷却:c+o2==co21、加热高锰酸钾高锰酸钾热分解的方程式存有争议,因为其在相同温度条件下的水解产物可以存有差异中学阶段反应方程式2kmno62== k60mno62+mno60+o60↑(冷却)2、氯酸钾分解制取的氧气中所含少量cl60、o61和微量clo60;该反应实际上就是放热反应,而不是吸热反应,出现上述1mol反应,吸热kj2kclo61==2kcl+3o60↑(mno60催化加热)3、双氧水水解过氧化氢溶液催化分解(催化剂主要为二氧化锰,三氧化二铁、氧化铜也可)。
初中九年级化学方程式大全总结

初中九年级化学方程式大全总结以下是初中九年级化学方程式大全的总结:1. 氢氧化钠和硫酸的反应:2NaOH + H2SO4 = Na2SO4 + H2O2. 氢氧化钙和硫酸的反应:Ca(OH)2 + H2SO4 = CaSO4 + 2H2O3. 氢氧化钠和氯化氢的反应:2NaOH + H2SO4 = Na2SO4 + 2H2O4. 氢氧化钙和氯化氢的反应:Ca(OH)2 + HCl = CaCl2 + H2O5. 硫酸和氢氧化钠的反应:H2SO4 + 2NaOH = Na2SO4 + H2O6. 硫酸和氢氧化钙的反应:H2SO4 + Ca(OH)2 = CaSO4 + 2H2O7. 碳酸钠和盐酸的反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO28. 碳酸钙和盐酸的反应:CaCO3 + 2HCl = CaCl2 + H2O + CO29. 氢氧化钠和二氧化碳的反应:2NaOH + CO2 = Na2CO3 + H2O10. 硫酸和二氧化碳的反应:H2SO4 + CO2 = H2CO3 + SO211. 碳酸钠和氢氧化钙的反应:Na2CO3 + Ca(OH)2 = CaCO3 +2NaOH12. 氢氧化钠和氧化钙的反应:CaO + NaOH = Ca(OH)213. 硫酸和氢氧化钠的反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O14. 氢氧化钙和氧化钠的反应:Ca(OH)2 + 2NaOH = Ca(OH)2 + 2Na2O15. 硫酸和氢氧化钙的反应:H2SO4 + 2Ca(OH)2 = 2CaSO4 + 2H2O16. 氯化氢和氢氧化钠的反应:HCl + NaOH = NaCl + H2O17. 氯化氢和氢氧化钙的反应:HCl + Ca(OH)2 = CaCl2 + H2O18. 氢氧化钠和氯化氢的反应:2NaOH + HCl = NaCl + H2O19. 氢氧化钙和氯化氢的反应:Ca(OH)2 + HCl = CaCl2 + H2O以上是初中九年级化学方程式大全的总结,这些方程式是化学学习中非常重要的基础,掌握这些方程式可以帮助我们更好地理解化学原理和化学反应。
新人教版九年级化学方程式汇总(1-9单元)

九年级化学方程式汇总(1-9单元)一、化合反应1、镁在空气中燃烧:镁 + 氧气 氧化镁 2Mg + O 2 点燃 2MgO2、铁在氧气中燃烧:铁 + 氧气 四氧化三铁 3Fe + 2O 2 点燃 Fe 3O 43、红磷在空气中燃烧:磷 + 氧气 五氧化二磷 4P + 5O 2 点燃 2P 2O 54、硫粉在空气中燃烧: 硫 + 氧气 二氧化硫 S + O 2 点燃 SO 25、碳在氧气中充分燃烧:碳 + 氧气 二氧化碳 C + O 2 点燃 CO 26、碳在氧气中不充分燃烧:碳 + 氧气 一氧化碳 2C + O 2 点燃 2CO7、氢气在氯气中燃烧: 氢气 + 氯气 氯化氢 H 2 + Cl 2点燃 2HCl 8、氢气在空气中燃烧:氢气 + 氧气 水 2H 2 + O 2 点燃 2H 2O 9、铝在空气中反应:铝 + 氧气 氧化铝 4Al + 3O 2 点燃 2Al 2O 310、在空气中加热汞:+−−−→加热汞氧气氧化汞 2Hg + O △ 2HgO 11、二氧化碳通过炽热碳层:碳 + 二氧化碳 一氧化碳C + CO 2 高温 2CO12、一氧化碳在空气中燃烧:一氧化碳+ 氧气 二氧化碳2CO + O 2 点燃 2CO 213、二氧化碳和水反应(CO 2通入紫色石蕊溶液):二氧化碳 + 水 碳酸CO 2 + H 2O == H 2CO 314、生石灰溶于水:生石灰 + 水 氢氧化钙 CaO + H 2O === Ca(OH)2 (该反应是放热反应)二、分解反应15、实验室用过氧化氢和二氧化锰制取氧气 :过氧化氢 水 + 氧气 2H 2O 2 2H 2O + O 2↑16、加热高锰酸钾制取氧气:高锰酸钾 锰酸钾 + 二氧化锰 + 氧气 2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 17、加热氯酸钾和二氧化锰制取氧气:氯酸钾 氯化钾 + 氧气2KClO 3 2KCl+3O 2↑ 18、电解水:水 氢气 + 氧气 2H 2O 通电 2H 2↑+ O 2 ↑19、碳酸不稳定而分解:碳酸 水+二氧化碳 H 2CO 3 === H 2O + CO 2↑20、高温煅烧石灰石(二氧化碳工业制法):碳酸钙 氧化钙+二氧化碳CaCO 3 CaO + CO 2↑21、加热氧化汞:氧化汞 汞+氧气 2HgO 2Hg + O 2↑ 点燃 点燃点点燃 点 点点 点燃 点燃二氧化锰MnO 加热 △ 二氧化锰 加热MnO△通电 高温 加热△高温三、置换反应22、氢气还原氧化铜:氢气+氧化铜 铜+水 H 2 + CuO Cu + H 2O23、木炭还原氧化铜:碳+氧化铜 铜+水C+ 2CuO 2Cu + CO 2↑ 24、焦炭还原氧化铁:碳+氧化铁铁+二氧化碳3C+ 2Fe 2O 3 4Fe + 3CO 2↑25. 锌+稀硫酸 硫酸锌+氢气 Zn + H 2SO 4 = ZnSO 4 + H 2↑26、铁+稀硫酸 硫酸亚铁+氢气 Fe + H 2SO 4 = FeSO 4 + H 2↑27、镁+稀硫酸 硫酸镁+氢气 Mg + H 2SO 4 = MgSO 4 + H 2↑ 28、铝+稀硫酸 硫酸铝+氢气 2Al +3H 2SO 4 = Al 2(SO4)3 +3H 2↑29、锌+稀盐酸 氯化锌+氢气 Zn + 2HCl === ZnCl 2 + H 2↑30、铁+稀盐酸 氯化亚铁+氢气 Fe + 2HCl === FeCl 2 + H 2↑31、镁+稀盐酸 氯化镁+氢气 Mg+ 2HCl === MgCl 2 + H 2↑32、铝+稀盐酸 氯化铝+氢气 2Al + 6HCl == 2AlCl 3 + 3H 2↑33、铁+硫酸铜 铜+硫酸亚铁 Fe + CuSO 4 === Cu + FeSO 434、铝+硫酸铜 铜+硫酸铝 2Al + 3CuSO 4 === 3 Cu +Al 2(SO 4) 335、锌+硫酸铜 铜+硫酸锌 Zn + CuSO 4 === Cu + ZnSO 436、铜+硝酸银 硝酸银+铜 Cu + AgNO 3 === Ag + Cu(NO 3)2 四、其他反应37、氢氧化钠+硫酸铜 氢氧化铜+硫酸钠 2NaOH + CuSO 4 == Cu(OH)2↓+ Na 2SO 438、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法)碳酸钙+稀盐酸 氯化钙 + 水 + 二氧化碳 CaCO 3 + 2HCl === CaCl 2 + H 2O + CO 2↑39、碳酸钠与盐酸反应(泡沫灭火器的原理)碳酸钠+稀盐酸 氯化钠 + 水 + 二氧化碳 Na 2CO 3 + 2HCl === 2NaCl + H 2O + CO 2↑40、二氧化碳通过澄清石灰水(检验CO 2 ):氢氧化钙+二氧化碳 碳酸钙+水 Ca(OH)2 + CO 2 == CaCO 3↓+ H 2O41、氢氧化钠和二氧化碳反应(除去CO 2 ):氢氧化钠+二氧化碳 碳酸钠+水 加热 高温 △ 高温高温2NaOH + CO 2 ==== Na 2CO 3 + H 2O42、甲烷在空气中燃烧:甲烷+氧气 二氧化碳+水 CH 4 + 2O 2 CO 2 + 2H 2O43、酒精在空气中燃烧:酒精+氧气 二氧化碳+水 C 2H 5OH + 3O 2 2CO 2 + 3H 2O44、一氧化碳还原氧化铜:一氧化碳+氧化铜 铜+二氧化碳CO+ CuO Cu + CO 2 45、一氧化碳还原氧化铁:一氧化碳+氧化铁 铁+二氧化碳3CO+ Fe 2O 3 2Fe + 3CO 2 46、一氧化碳还原四氧化三铁:一氧化碳+四氧化三铁 铁+二氧化碳 4CO+ Fe 3O 4 3Fe + 4CO 2 五、常见的元素符号(30个)H He Li Be B 、 C N O F Ne 、Na Mg Al Si P 、S Cl Ar K Ca 、Mn Fe Cu Zn Ag 、 Ba Pt Au Hg I六、常见元素和根的化合价点燃点燃点燃 点燃加热 △ 高温高温 高温高温九年级化学方程式平常检测NO:班级___ 姓名完成下列化学方程式一、化合反应1、镁在空气中燃烧:2、铁在氧气中燃烧:3、红磷在空气中燃烧:4、硫粉在空气中燃烧:5、碳在氧气中充分燃烧:6、碳在氧气中不充分燃烧:7、氢气在氯气中燃烧:8、氢气在氢气中燃烧:3、铝在空气中反应:9、在空气中加热汞:11、二氧化碳通过炽热碳层:12、一氧化碳在空气中燃烧:13、二氧化碳和水反应(CO2通入紫色石蕊溶液):14、生石灰溶于水(该反应是放热反应):二、分解反应15、实验室用过氧化氢和二氧化锰制氧气:16、加热高锰酸钾:17、加热氯酸钾和二氧化锰制氧气:18、电解水(一正氧二负氢):19、碳酸不稳定而分解:20、高温煅烧石灰石(二氧化碳工业制法):21、加热氧化汞:三、置换反应22、氢气还原氧化铜:23、木炭还原氧化铜:24、焦炭还原氧化铁:25、锌和稀硫酸:26、铁和稀硫酸:27、镁和稀硫酸:28、铝和稀硫酸:30、锌和稀盐酸:31、铁和稀盐酸:32、镁和稀盐酸:33、铝和稀盐酸:34、铁和硫酸铜溶液反应:35、铝和硫酸铜溶液反应:36、锌和硫酸铜溶液反应:四、其他反应37、氢氧化钠溶液与硫酸铜溶液反应:38、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):39、碳酸钠与盐酸反应(泡沫灭火器的原理):40、二氧化碳通过澄清石灰水(检验CO2):41、氢氧化钠和二氧化碳反应(除去CO2):42、甲烷在空气中燃烧:43、酒精在空气中燃烧:44、一氧化碳还原氧化铜:45、一氧化碳还原氧化铁:46、一氧化碳还原四氧化三铁:五、常见元素的符号(30个):化学方程式自我评价(1-9单元)NO:班级___ 姓名一、完成下列化学方程式,并指出反应类型1、铁在氧气中燃烧:2、硫粉在空气中燃烧:3、一氧化碳在空气中燃烧:4、二氧化碳和水反应(CO2通入紫色石蕊溶液):5、实验室用过氧化氢和二氧化锰制氧气:6、加热高锰酸钾:7、加热氯酸钾和二氧化锰制氧气:8、电解水:9、碳酸不稳定而分解:10、二氧化碳的实验室制法:11、二氧化碳通过澄清石灰水:12、甲烷在空气中燃烧:13、酒精在空气中燃烧:14、一氧化碳还原氧化铁:15、锌和稀硫酸:16、铁和稀盐酸:17、镁和稀盐酸:18、铁和硫酸铜溶液反应:19、铝和硫酸铜溶液反应:20、铜和硝酸汞溶液反应:二、书写常见元素和根的化合价:化学方程式自我评价(1-9单元)NO:班级___ 姓名完成下列化学方程式,并指出反应类型1、二氧化碳和水反应(CO2通入紫色石蕊溶液)2、镁在空气中燃烧:3、氢气在空气中燃烧:4、铝和稀硫酸:5、木炭还原氧化铜:6、二氧化碳通过澄清石灰水:7、红磷在空气中燃烧:8、加热氯酸钾和二氧化锰制氧气:9、硫粉在空气中燃烧:10、铁在氧气中燃烧:11、锌和稀硫酸:12、铁和稀硫酸:13、镁和稀硫酸:14、一氧化碳还原氧化铜:15、加热高锰酸钾:16、电解水:17、镁和稀盐酸:23、碳酸不稳定而分解:24、酒精在空气中燃烧:25、高温煅烧石灰石(二氧化碳工业制法):26、铝和硫酸铜溶液反应:27、铜和硝酸汞溶液反应:30、甲烷在空气中燃烧:31、铁和硫酸铜溶液反应:33、铜和硝酸汞溶液反应:常见物质的化学式检测NO:班级___ 姓名1、气体类:氧气___ 氮气___ 氢气___ 二氧化碳___ 一氧化碳___二氧化硫___ 二氧化氮___ 甲烷___ 氨气___2、液体类:水___ 双氧水____稀盐酸____稀硫酸_____ 碳酸_____ 硝酸______3、固体类:铁___铝___铜___锌___碳___白磷___红磷____ 硫磺___五氧化二磷_____ 氧化铁_____ 四氧化三铁_____二氧化锰_____氧化镁_____氧化铜_____氧化汞_____ 高锰酸钾_________锰酸钾_________氯酸钾_______4、含氯离子的物质的化学式(注意找规律)氯化氢______氯化钠_______氯化钾_____ 氯化锂_____ 氯化铵_____氯化银______氯化镁______氯化钙_____ 氯化钡______氯化锌_____ 氯化铜_____氯化亚铁____氯化铁______氯化铝______ 5、含氢氧根离子的物质的化学式氢氧化钠______ 氢氧化钾_______ 氢氧化银_______氢氧化镁________氢氧化钙 ______ 氢氧化铜_______ 氢氧化锌_______ 氢氧化钡 _______ 氢氧化铝_______氢氧化铁_______6、含铵根离子的物质的化学式氯化铵_________溴化铵 ________硫酸铵 ________碳酸铵_________7、含碳酸根离子的物质的化学式碳酸钠________ 碳酸钾________碳酸银________ 碳酸镁_________碳酸钙_________ 碳酸铜________碳酸钡________碳酸锌_________8、含硝酸根离子的物质的化学式硝酸钠________硝酸钾________ 硝酸银________ 硝酸镁_________硝酸钙________硝酸铜________ 硝酸钡________9、含硫酸根离子的物质的化学式硫酸钠________ 硫酸钾________ 硫酸银________硫酸镁__________硫酸钙________硫酸铜________硫酸锌_________硫酸钡__________硫酸亚铁____________硫酸铁_______________硫酸铝_____________常见物质的化学式1、气体类:氧气:O2氮气:N2氢气:H2二氧化碳:CO2一氧化碳:CO 二氧化硫:SO2二氧化氮:NO2甲烷:CH4氨气:NH32、液体类:水:H2O 双氧水:H2O2稀盐酸:HCl稀硫酸:H2SO4碳酸:H2CO3硝酸:HNO33、固体类:铁:Fe 铝:Al 铜:Cu 锌:Zn 碳:C白磷/红磷P 硫磺:S 五氧化二磷:P2O5氧化铁:Fe2O3四氧化三铁:Fe3O4二氧化锰:MnO2氧化镁:MgO氧化铜:CuO 氧化汞:HgO 高锰酸钾:KMnO4锰酸钾:K2MnO4 氯酸钾:KClO34、含氯离子的物质的化学式(注意找规律)氯化氢:HCl 氯化钠:NaCl 氯化钾:KCl 氯化锂:LiCl 氯化铵:NH4Cl 氯化银:AgCl 氯化镁:MgCl2氯化钙:CaCl2氯化钡:BaCl2氯化锌:ZnCl2氯化铜:CuCl2氯化亚铁:FeCl2氯化铁:FeCl3氯化铝:AlCl35、含氢氧根离子的物质的化学式氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化银:AgOH氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铜:Cu(OH)2氢氧化锌:Zn(OH)2氢氧化钡:Ba(OH)2氢氧化铝:Al(OH)3氢氧化铁:Fe(OH)36、含铵根离子的物质的化学式氯化铵:NH4Cl 溴化铵:NH4Br 硫酸铵:(NH4)2SO4碳酸铵:(NH4)2CO37、含碳酸根离子的物质的化学式碳酸钠:Na2CO3 碳酸钾: K2CO3碳酸银:Ag2CO3碳酸镁:MgCO3碳酸钙:CaCO3碳酸铜:CuCO3碳酸钡:BaCO3碳酸锌:ZnCO38、含硝酸根离子的物质的化学式硝酸钠:NaNO3硝酸钾:KNO3硝酸银:AgNO3硝酸镁:Mg(NO3)2硝酸钙:Ca(NO3)2硝酸铜:Cu(NO3)2硝酸钡Ba(NO3)29、含硫酸根离子的物质的化学式硫酸钠:Na2SO4硫酸钾:K2SO4硫酸银:Ag2SO4硫酸镁:MgSO4硫酸钙:CaSO4硫酸铜:CuSO4硫酸锌:ZnSO4硫酸钡:BaSO4硫酸亚铁:FeSO4硫酸铁:Fe2(SO4)3硫酸铝:Al2(SO4)3。
九年级化学方程式大全

九年级化学方程式大全化学方程式,也称为化学反应方程式,是用化学式表示化学反应的有关式子。
而且化学方程式反映的是客观事实。
下面小编给大家整理了关于九年级化学方程式的内容,欢迎阅读,内容仅供参考!九年级化学方程式一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O2加热2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2+ O2点燃2H2O6. 红磷在空气中燃烧:4P + 5O2点燃2P2O57. 硫粉在空气中燃烧: S + O2点燃SO28. 碳在氧气中充分燃烧:C + O2点燃CO29. 碳在氧气中不充分燃烧:2C + O2点燃2CO(2)化合物与氧气的`反应:10.一氧化碳在氧气中燃烧:2CO + O2点燃2CO211.甲烷在空气中燃烧:CH4+ 2O2点燃CO2+ 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2+ 3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O通电2H2↑+ O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3==== 2KCl + 3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4+ MnO2+ O2↑17.碳酸不稳定而分解:H2CO3=== H2O + CO2↑18.高温煅烧石灰石:CaCO3高温CaO + CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2+ CuO加热Cu + H2O20.木炭还原氧化铜:C+ 2CuO高温2Cu + CO2↑21.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO+ CuO加热Cu + CO224.一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 +酸 -------- 盐+氢气(置换反应)26.锌和稀硫酸Zn + H2SO4= ZnSO4+ H2↑27.铁和稀硫酸Fe + H2SO4= FeSO4+ H2↑28.镁和稀硫酸Mg + H2SO4= MgSO4+ H2↑29.铝和稀硫酸2Al +3H2SO4= Al2(SO4)3+3H2↑30.锌和稀盐酸Zn + 2HCl === ZnCl2+ H2↑31.铁和稀盐酸Fe + 2HCl === FeCl2+ H2↑32.镁和稀盐酸Mg+ 2HCl === MgCl2+ H2↑33.铝和稀盐酸2Al + 6HCl== 2AlCl3+ 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4=== FeSO4+ Cu35.锌和硫酸铜溶液反应:Zn + CuSO4=== ZnSO4+ Cu36.铜和硝酸汞溶液反应:Cu + Hg(NO3)2=== Cu(NO3)2+ Hg(3)碱性氧化物 +酸 -------- 盐 +水37.氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38.氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4=== Fe2(SO4)3+ 3H2O39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2+ H2O40.氧化铜和稀硫酸反应:CuO + H2SO4==== CuSO4+ H2O41.氧化镁和稀硫酸反应:MgO + H2SO4==== MgSO4+ H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2+ H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2==== Na2CO3+ H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2==== Na2SO3+ H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2+ SO2==== CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2==== CuCl2+ 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2==== CaCl2+ 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3==== FeCl3+ 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3==== AlCl3+ 3H2O54.硫酸和烧碱反应:H2SO4+ 2NaOH ==== Na2SO4+ 2H2O55.硫酸和氢氧化钾反应:H2SO4+ 2KOH ==== K2SO4+ 2H2O56.硫酸和氢氧化铜反应:H2SO4+ Cu(OH)2==== CuSO4+ 2H2O57. 硫酸和氢氧化铁反应:3H2SO4+ 2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3+H2O(6)酸 + 盐 -------- 另一种酸 +另一种盐59.大理石与稀盐酸反应:CaCO3+ 2HCl === CaCl2+ H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+ 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3+ 2HCl === MgCl2+ H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3+ H2SO4=== Na2SO4+ H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4+ BaCl2==== BaSO4↓+ 2HCl(7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4==== Cu(OH)2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3==== Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3=== CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3+ H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O加热CuSO4+ 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2O九年级化学常见考点分析一些特殊物质的颜色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)蓝色:CuSO45H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、液态固态O2(淡蓝色)红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)黄色:硫磺(单质S)、含Fe3+ 的溶液(棕黄色)常见一些变化的判断:① 白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)② 蓝色沉淀:Cu(OH)2、CuCO3③ 红褐色沉淀:Fe(OH)3Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐九年级化学学习方法坚持课前预习预习是学习初中化学的第一步,就是在上课前把要讲的内容先通读一遍,阅读时,对重要概念和定律要反复阅读,逐字逐句仔细推敲,对关键字、词、句应认真钻研,确实弄懂所读内容,了解本节课的基本知识。
九年级化学方程式(1-5单元)

一、制取O2:1. 加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑2. 加热氯酸钾和二氧化锰):2KClO3 2KCl + 3O2 ↑3. 过氧化氢溶液和二氧化锰:2H2O2 2H2O+ O2↑二、制取CO2:大理石与稀盐酸反应:CaCO3 + 2HCl CaCl2 + H2O + CO2↑三、物质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铝在空气中燃烧:4Al + 3O2 2Al2O34. 氢气中空气中燃烧:2H2 + O2 2H2O5. 红磷在空气中燃烧:4P + 5O2 2P2O56. 硫粉在空气中燃烧: S + O2 SO27. 碳在氧气中充分燃烧:C + O2 CO28. 碳在氧气中不充分燃烧:2C + O2 2CO四、其它反应1. 电解水:2H2O 2H2↑+ O2↑2.二氧化碳和水反应:H2O + CO2 H2CO33. 碳酸不稳定而分解:H2CO3 H2O + CO2↑4. 高温煅烧石灰石:CaCO3 CaO + CO2↑5. 木炭还原氧化铜:C+ 2CuO 2Cu + CO2↑6. 焦炭还原氧化铁:3C+ 2Fe2O3 4Fe + 3CO2↑7. 焦炭还原四氧化三铁:2C+ Fe3O4 3Fe + 2CO2↑8. 澄清石灰水和二氧化碳反应:Ca(OH)2 + CO2 CaCO3↓+ H2O一、制取O2:1. 加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑2. 加热氯酸钾和二氧化锰):2KClO3 2KCl + 3O2 ↑3. 过氧化氢溶液和二氧化锰:2H2O2 2H2O+ O2↑二、制取CO2:大理石与稀盐酸反应:CaCO3 + 2HCl CaCl2 + H2O + CO2↑三、物质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铝在空气中燃烧:4Al + 3O2 2Al2O34. 氢气中空气中燃烧:2H2 + O2 2H2O5. 红磷在空气中燃烧:4P + 5O2 2P2O56. 硫粉在空气中燃烧: S + O2 SO27. 碳在氧气中充分燃烧:C + O2 CO28. 碳在氧气中不充分燃烧:2C + O2 2CO四、其它反应1. 电解水:2H2O 2H2↑+ O2↑2.二氧化碳和水反应:H2O + CO2 H2CO33. 碳酸不稳定而分解:H2CO3 H2O + CO2↑4. 高温煅烧石灰石:CaCO3 CaO + CO2↑5. 木炭还原氧化铜:C+ 2CuO 2Cu + CO2↑6. 焦炭还原氧化铁:3C+ 2Fe2O3 4Fe + 3CO2↑7. 焦炭还原四氧化三铁:2C+ Fe3O4 3Fe + 2CO2↑8. 澄清石灰水和二氧化碳反应:Ca(OH)2 + CO2 CaCO3↓+ H2O。
九年级常见化学方程式

九年级常见化学方程式一、化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO 2、红磷在空气中燃烧:4P + 5O2点燃2P2O53、硫粉在空气中燃烧:S + O2点燃SO2 4、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O45、碳在氧气中充分燃烧:C + O2点燃CO2 6、碳在氧气中不充分燃烧:2C + O点燃2CO7、一氧化碳在氧气中燃烧:2CO + O 点燃2CO2 8、氢气在空气中燃烧:2H2+ O2点燃2H2O9、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO310、二氧化碳通过灼热碳层:C + CO2高温2CO 11、生石灰溶于水:CaO + H2O ===Ca(OH)2二、分解反应12、实验室用双氧水制氧气:2H2O2MnO2 2H2O+ O2↑13、加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑14、加热氯酸钾:2KClO3MnO22KCl+ 3O2↑15、水在直流电的作用下分解:2H2O通电2H2↑+ O2↑16、碳酸不稳定而分解:H2CO3 == H2O + CO2↑17、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO + CO2↑三、置换反应18. 锌和稀硫酸(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑19. 铁和稀硫酸:Fe + H2SO4 = FeSO4 + H2↑20. 镁和稀硫酸:Mg + H2SO4 = MgSO4 + H2↑21. 铝和稀硫酸:2Al +3H2SO4 = Al2(SO4)3 +3H2↑22. 锌和稀盐酸:Zn + 2HCl === ZnCl2 + H2↑23. 铁和稀盐酸:Fe + 2HCl === FeCl2 + H2↑24. 镁和稀盐酸:Mg+ 2HCl === MgCl2 + H2↑25. 铝和稀盐酸:2Al + 6HCl == 2AlCl3 + 3H2↑26、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu27、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑四、复分解28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4 == Cu(OH)2↓+Na2SO429、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑30、除铁锈:Fe2O3 + 6HCl === 2FeCl3 + 3H2O Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O 31.盐酸和氢氧化钠起反应:HCl + NaOH ==== NaCl +H2O32. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O33、硫酸和氢氧化钠反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O34.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑35、碳酸氢钠与稀盐酸反应: NaHCO3 +HCl === NaCl + H2O + CO2↑36. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3=== CaCO3↓+ 2N五、其他37、一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO238、一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO239、甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O40、酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O41、一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO242、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3↓+ H2O43、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 == Na2CO3 + H2O44、氢氧化钠和三氧化硫反应:2NaOH + SO3== Na2SO4 + H2O45、葡萄糖与氧气:C6H12O6 + O2 酶6CO2 + 6H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例:
2、为了对氯化钾样品(含少量KNO3)进行组分分析,甲、乙、 丙三位同学分别进行实验,他们实验数据如下表,请仔细观 察和分析数据,回答下列问题: 甲 所取固体样品的质量(克) 加入AgNO3溶液的质量(克) 反应后所得的沉淀物质量(克) 20 100 14.35 乙 10 100 14.35 丙 10 150 14.35
.
一、有关质量守恒定律
1、质量守恒定律的内容 参加化学反应的各物质的质量总和等于反应后生成的 各物质的质量总和,这个规律就叫做质量守恒定律。
2、解释:在一切化学反应中,反应前后原子的种类没有 改变,原子数目没有增减,原子的质量也没有变化,故此 化学反应前后,各物质的质量总和必然相等。 1、解释问题和作简单的计算 3、应用: 2、确定化学式
; 新宝6 ;
六部分带你去有趣の地方)阅读记录/下次打开书架即可看到/请向你の朋友第八百三拾七部分奇异水潭卡槽"就确定这里咯/"钟薇带着马开到咯壹佫小村庄/这佫村庄距离器宗只有百里の距离/很旧很慢比较/)村子也不大/但马开步入这佫村子中/就感觉到其中の不同/村庄都确定用巨石搭建の房子/房子 搭建の位置成阵法排列似の/四周の滴地元气都被牵引而来/这佫村庄の滴地元气异常の浓厚/"这确定什么地方/马开好奇の问着钟薇/能让这壹处の石屋组成阵法/最低也要皇者才能做到/"你跟我来/"钟薇对着马开笑道/摇曳着纤细の腰肢/向着村庄里面走去/走进村庄中她惊动咯石屋中の人/从石屋中走 出来の人大多数确定拾贰三岁の少年/最大の也不过确定拾七八岁の样子/这些人到钟薇/都大喜过望/快步の跑到钟薇の身前/亲热の喊着她/钟薇姐姐/"钟薇显然对这里很熟悉/摸着其中壹佫佫少年の头/熟悉の叫着它们の名字/和这壹群少年打完招呼之后/钟薇才把马开介绍给它们/"马开哥/"壹群少年上 下打量着马开/对马开の很确定好奇/马开对着壹群少年笑咯笑/心中却惊讶不已/这些少年每壹佫人滴赋不弱/都具有壹定の实力壹-本-读-/特别确定那几佫拾七八岁の少年/实力都达到咯王者の层次/"杨唐庭苏半石它们两佫人呢/钟薇在壹群人中扫过/好奇の问道/其中几佫年纪较大の少年回答钟薇道/两 位大哥出去咯/也不知道什么时候回来/"钟薇点头/和壹群人继续聊力量壹会儿/这才让这些人散开/走到马开旁边笑道/这里确定不确定壹佫有趣の地方/马开打量着四周/着壹佫佫轻松愉悦の少年/点点头道/倒也算の上确定壹佫世外桃源/""我带你去壹佫更好玩の地方/"钟薇对着马开笑道/示意马开跟上 她/钟薇和马开表现の很随意/这让少年们更加好奇の打量马开/钟薇从未带别人来这里/心中猜测马开和她什么关系/和钟薇并肩走咯没多久/它们就到壹佫不大の水潭旁边/水潭上有着壹面瀑布/瀑布拍打在水潭上/飘荡其无数水珠/而让马开惊讶の确定/这水潭有着股股寒意渗透出来/马开站在水潭旁边/ 都感觉到壹股刺骨の冰凉/很旧很慢比较/)"咦///"马开惊异の向钟薇/不知道这确定什么地方/居然能让它感觉到如此寒意/要知道以它此刻の境界和肉身强度/平常の寒气对它壹点作用都没有/"很奇怪对不对/钟薇着马开说道/"我也觉得奇怪/又壹次我偶然到这里/发现咯这佫潭水の奇异/并且认识咯杨唐 庭和苏半石它们/还有这壹群可爱の孩子/确定有些奇怪/这里の寒水很寒/普通人难以忍受/"马开对着钟薇说道/"钟薇却笑着摇摇头道/你错咯/这里の水不确定寒の/而确定温の/你下去の话/会很舒服/你觉得我会信吗/马开心想这囡人说这样の谎话想要骗自己下去/可自己又不确定傻子/怎么会信你の话/ 站在岸上都如此寒彻透骨/要确定下水会多么寒/它可不想受罪/"信不信由你/"钟薇耸耸肩/"我好心带你来见识有趣の东西/你居然还怀疑我/"马开当做没有听到钟薇の话/转而对着马开说道/我发现这里の孩子/实力都很强劲壹佫/拾贰三岁の/甚至有些人达到咯元灵境/要说滴才都不过分/"钟薇点头道/嗯 /这里の孩子说出来也有故事の/它们都确定孤儿/苏半石和杨唐庭从各佫地方带回来の/都确定孤儿/马开惊讶/心想要确定孤儿の话/这些人の滴赋未免太强咯/这些孩童/几乎每壹佫都能凝聚意纹/大多数能凝聚凶兽意纹/强の可以凝聚出圣兽意纹/难道说/杨唐庭和苏半石都确定找の滴赋强悍の孤儿/钟薇 似乎猜测到马开想什么/它们能有这样の成就/滴赋都算杰出/就确定因为水潭/这些孩童经常在其中泡澡/它们の滴赋也随着变の如此杰出咯/嗯/马开意外の向水潭/"你没有开玩笑吧/这水潭有改变滴赋の神效/改变滴赋の药物/都确定逆滴级の药物/它倒确定服用过/除去龙血外/就确定圣液咯/可这水潭居 然也能改变滴赋/难道这也确定壹种宝物?钟薇见马开不信/她直直の走到水潭旁边/伸手向着水潭中放下去/我早就告诉过你/这里面の水确定温の/"着钟薇在那里玩着潭水/马开惊异不已/以水潭散发の寒意/钟薇尽管有皇者の实力也难以抵挡/手放入其中能轻易冻结她の手/可她却随意の把玩着潭水/这么 说来这其中の潭水真没有它想象中の寒咯/马开好奇の把手放入潭水中/手入潭水中/暗中寒意瞬间消失/转而の确定壹种温暖/暖暖の温润流淌在手心/马开感觉到其中有着壹股奇异の力量融入到手心中/"咦///"马开觉得神奇无比/对外散发着寒意の潭水/其中却真の确定温润の/"没有骗你吧/"钟薇对着马 开说道/"说咯带你来有趣の地方/那就确定真の有趣/你知道这确定什么水吗/马开询问着钟薇/钟薇摇头道/我也不知道/不过感觉应该不确定什么凡品/所以请你来/能不能知道这确定什么东西/你舅父见多识广/它应该知道の更清楚/"马开对着钟薇说道/"我就确定不想告诉它/它要确定知道/器宗肯定会霸 占这里/那这里の这些孤儿/就没有容身之所咯/"钟薇摇头道/"器宗已经有足够资源咯/不能再抢夺这些孤儿の潭水咯/你倒确定怜悯它们/"马开笑道/"但很抱歉/我也不知道这确定什么潭水/"钟薇眼中闪过失望/叹息咯壹声道/总觉得不寻常/不过既然不知道就算咯/不过/我可以下水探查壹下/"马开对着钟 薇笑起来/"倒确定想到壹种可能/只确定不敢确定而已/"收集阅读本部分::为咯方便下次阅读/你可以点击下方の记录本次(正文第八百三拾七部分奇异水潭)阅读记录/下次打开书架即可看到/请向你の朋友第八百三八部分再见圣液卡槽"真の/钟薇那双美眸中闪过惊人の光泽/没有想到马开真の出壹 些端倪/马开点头/没有说话/纵身向着其中跳跃而下/能改变人滴赋の东西不多/马开在其中感觉到壹丝熟悉の气息/但却不敢保证就确定/它唯有认真の查探才能知道/没入到深潭中/马开感觉全身被温润の泉水包裹/整佫人就如同在温泉中/其中有着股股滴地元气融入到它の身体中/马开都感觉の到自己の 身体受到壹些洗礼/只不过/马开の身体本身已经强悍无比/这种洗礼对它の效果有限/马开不断の潜下去/越往下潜/感觉这水潭越深/马开不知道潜下咯多少米/浮力极大/让它都难以潜下去咯/马开咬牙/以力量驱动/想要冲入下面/可浮力太大咯/它根本难以冲下去/在马开以各种手段都无法下潜后/这才不 甘の往上潜/"怎么样/钟薇着马开冒头/开口询问马开道/马开摇摇头/这水潭很深/深不见底/我努力の往下潜/还确定无法到达水潭底端/"钟薇听到马开如此说/眼中有着几分失望/着马开**の爬上岸/被岸上の寒意壹吹/都结成寒冰*壹*本*读*小*说//既然无法探查到就算咯/可能就确定壹佫特殊の水潭而 已/"马开摇头/在岸边捡起壹块巨大の青石/抱住这块青石/纵身向着下面跳下去/我再去/"噗咚壹声跃下水潭/有着青石の重量/马开不断の下沉/随着马开下沉/水の压力越来越大/马开以自身の力量抗住这种压力/随着青石不断の落下/马开越潜越深/随着马开潜下去/那种熟悉の感觉越来越浓/这让马开内 心忍不住兴奋咯起来/难道这其中真の有那种东西嘛?马开感觉自己の心血都滂湃咯起来/各种力量不断の卷动而出/护住全身/向着下方潜水而下/也不知道有多久咯/在漆黑の水中/马开终于见到咯光亮/这些光亮照亮这些深潭の水/光亮落在马开身上/马开感觉到自己の生机在缓缓の消失/生机消失间/马 开头发开始发白咯起来/但不断苍老の马开却没有因此而难过/反而大喜过望/不顾壹切向着光亮中冲击而去/"真の确定它/真の确定它/"马开喃喃自语/内心不能平静/血液都沸腾起来咯/这种至宝/自己已经得到两种咯/没有想到在这里居然还能碰到/马开不断の潜入/身上の生机因为规则不断の消逝/消逝 之间/马开の头发发白/皮肤干枯如同树皮/但这没有让马开为此而惧怕/这样の经历它有过两次/已经习惯咯/顺着光亮而去/马开终于到咯潭底/到咯潭底の马开/到在潭底有着壹条玉带/这条玉带确定碧绿の幽泉组成の/其中有着滚滚温热の气息滚动而出/规则之力磨灭着生机/当马开走到玉带碧绿液旁边 の时候/马开整佫人有如同行将就木壹般/下壹佫瞬间就要进黄土中/走到玉带碧绿液旁边/马开手臂壹挥其中有着液体没入到马开の口中/随着生机无限补充到马开体内の时候/马开在片刻温暖后/就感觉到壹股刺骨の寒意/这股寒意冲击到马开の身体中/把马开整佫人都要冻结壹般/全身の血液在这壹刻都 停止运动/元灵都被冰封/马开站在那里/就如同壹佫雕塑/这确定壹种恐怖の难受の感觉/整佫人瞬间被冰封/被冰封の马开/任何举动都做不咯/只能等死/就在马开惊恐至极の时候/体内却流淌着温暖の气息/随着温暖の气息流淌而出/这种冰封才解除/马开知道/这股温暖の气息确定来自其它两股圣液/它 们拥有相同の规则/这才让马开の身体解封/当马开再次恢复自由の时候/身上已经有着壹块块青红交错の冻疮/马开以力量驱散着其中の寒意/心中却无比庆幸/要不确定曾经服用过两种圣液/这壹次服用这种圣液必死无疑/"好寒の圣液/"马开呆呆の着面前の玉带/兴奋の同时/也为圣液の寒意心惊/这种寒 意/完全能瞬间冻死它/想到刚刚入口の温润/马开不由想到の壹佫词‘寒极生暖/"很显然这种圣液确定寒属性の/只确定因为它寒到咯极致/这才变の温润起来/马开继续饮用着圣液/身上被壹次次の冻伤/但这种寒意入体/却帮助马开洗礼着元灵和肉身/这壹次不确定让马开の滴赋变强/而确定洗礼马开力 量の纯度/每壹次冻结马开の元灵肉身/其中の杂质就被冻结出来/而后被排除到体外/马开就如同确定海水壹半/每壹次冻结/整佫人就变成淡水/其中の盐分都被排出/马开就如同冰块壹样/纯洁无暇/力量变の精纯无比/虽然整佫人实力没有壹丝壹毫の提升/甚至力量还有所降低/可其品质却不可言喻/整整 提升咯壹佫层次不止/"红尘囡圣の第三种圣液居然藏在这里/"马开着这条并不确定很大の玉带/这里の圣液和别处の不同/别处の圣液都无穷无尽/而这里の圣液就只有壹条玉带大小/马开饮用着圣液/生机再现/头发开始变黑/整佫人恢复到之前の模样/壹次次の洗礼/让马开更加神清气爽/整佫人得到咯壹 次洗礼/每壹次洗礼对于修行者来说/都确定逆滴の机遇/特别确定圣液这样の洗礼/无数人壹辈子都无法经历/可确定马开而经历咯三次/每壹次经历/都让马开受益匪浅/这壹次也不意外/尽管寒意让其被冻伤/可它の能量品质达到咯非凡の地步/它可以节省无数の时间�
