酶的固定化技术-薛鹏
酶的固定化技术

摘要:酶的固定化技术是用固体材料将酶束缚或限制于一定区域内,酶仍能进行其特有的催化反应、并可回收及重复利用的一类技术。
酶的固定化技术已经成为酶应用领域中的一个主要研究方向。
经固定化的酶与游离酶相比具有稳定性高、回收方便、易于控制、可反复使用、成本低廉等优点,在生物工业、医学及临床诊断、化学分析、环境保护、能源开发以及基础研究等方面发挥了重要作用。
因此酶的固定化技术研究已成为十分引人注目的领域。
本文简要介绍了固定化酶技术的概念、制备方法(包括传统固定化技术、传统固定化技术的改进方法、新型固定化技术) 及其在化学化工、食品行业、临床医药、生物传感器和环境科学等领域中的应用现状与存在的问题,并对固定化酶技术的应用前景进行了展望。
关键词:固定化酶;制备;应用;磁性载体;定向固定固定化酶的研究始于1910年,正式研究于20世纪60年代,70年代已在全世界普遍开展。
酶的固定化(Immobilization of enzymes)是用固体材料将酶束缚或限制于一定区域内,仍能进行其特有的催化反应、并可回收及重复利用的一类技术。
与游离酶相比,固定化酶在保持其高效专一及温和的酶催化反应特性的同时,又克服了游离酶的不足之处,呈现贮存稳定性高、分离回收容易、可多次重复使用、操作连续可控、工艺简便等一系列优点。
固定化酶不仅在化学、生物学及生物工程、医学及生命科学等学科领域的研究异常活跃,得到迅速发展和广泛的应用,而且因为具有节省资源与能源、减少或防治污染的生态环境效应而符合可持续发展的战略要求。
固定化酶的制备方法有物理法和化学法两大类。
物理方法包括物理吸附法、包埋法等。
物理法固定酶的优点在于酶不参加化学反应,整体结构保持不变,酶的催化活性得到很好保留。
但是,由于包埋物或半透膜具有一定的空间或立体阻碍作用,因此对一些反应不适用。
化学法是将酶通过化学键连接到天然的或合成的高分子载体上,使用偶联剂通过酶表面的基团将酶交联起来,而形成相对分子量更大、不溶性的固定化酶的方法。
酶的固定化及在医药中的应用

1971年,第一次国际酶工程会议在美国召 开,会议主题是固定化酶的研制和应用
确定固定化酶(Immobilized Enzyme)统一名称
5
整理版ppt
• 3.将葡聚糖磁性毫微粒固定化L-天冬酰 胺酶,通过血液注射治疗急性淋巴白血 病
• 4.琼脂糖固定化牛胰核糖核酸酶能很好 地催化合成重要的寡核苷酸
24
整理版ppt
固定化酶及其相应产品
固定化酶 青霉素酰化酶 氨苄青霉素酰化酶 青霉素合成酶 5'-磷酸二酯酶 类固醇酯酶 多核苷酸磷酸化酶 前列腺素合成酶 辅酶A合成酶系 氨甲酰磷酸激酶
3
整理版ppt
酶工程及固定化技术发展史
在20世纪20年代,就出现了酶工程,以自然酶制 剂在工业上大规模应用的特征,原料以动植物为主
1953年,Grubhoger Schleith 用重氮化聚氨基聚苯乙烯树脂 对羧肽酶、蛋白酶、核酸酶等进行固定,产生了固定化酶技术。
4
整理版ppt
酶工程及固定化技术发展史
• 优点:酶与载体结合牢固,稳定性好,酶不易 脱落
• 缺点:反应条件苛刻,操作复杂,可能会破坏 酶的活性中心
15
整理版ppt
交联法
• 借助双功能试剂使酶分子之间发生交联作用,制 成网状结构
• 特点:此法与共价结合法一样也是利用共价键固 定酶的,所不同的是不使用载体
• 常用交联剂:戊二醛、己二胺、双偶氮苯等
LOGO
固定化酶及在医药中的应用
整理版ppt
1
Contents
酶固定化技术的方法

酶固定化技术的方法
酶固定化是将酶与载体物质结合在一起,以增强酶的稳定性和重复使用性的技术。
常见的酶固定化方法包括以下几种:
1. 吸附固定化:将酶溶液与载体物质(如活性炭、陶瓷颗粒)接触,酶分子通过吸附作用与载体物质结合。
2. 凝胶固定化:将酶溶液与凝胶物质(如明胶、琼脂)混合,酶通过物理交联或化学交联与凝胶物质牢固结合。
3. 包埋固定化:将酶溶液与聚合物物质(如聚乙烯醇、明胶)混合,然后通过共混或交联反应,使酶被包裹在聚合物内部。
4. 共价固定化:将酶溶液与活性基团多的载体物质(如硅胶、纳米颗粒、聚乙二醇)反应,形成酶与载体物质之间的共价键连接。
5. 薄膜固定化:在载体表面形成一层薄膜,然后将酶与薄膜固定在一起,常见的方法有溶液浸渍、层层自组装等。
这些方法各有优缺点,选择合适的固定化方法应根据具体的酶性质、应用需求和实际操作条件进行综合考虑。
酶和辅酶的固定化及辅酶再生研究

酶和辅酶的固定化及辅酶再生研究酶和辅酶的固定化及辅酶再生研究一、引言酶是一种生物催化剂,在生物体内起着至关重要的作用。
然而,由于酶的生物活性易受到环境条件的影响,限制了其在工业生产中的应用。
为了克服这一问题,研究人员开始利用固定化技术将酶固定在载体上,以增加其稳定性和重复使用性。
辅酶在许多酶催化反应中起着关键作用,因此辅酶再生技术也成为固定化酶研究领域的热点。
二、酶的固定化技术1. 固定化技术的基本原理固定化技术通过将酶固定在载体表面或内部,使其在催化反应中更加稳定和可控。
常见的固定化技术包括包埋法、交联法、吸附法和共价结合法等。
这些方法可以根据不同的酶和反应需求选择,以增强酶的催化活性和稳定性。
2. 固定化酶的应用固定化酶在工业生产中有广泛的应用。
在食品工业中,固定化酶可以用于酿造、发酵和食品加工过程中,提高生产效率和产品品质。
在医药领域,固定化酶可以用于药物合成和生物转化过程中,加快反应速率和提高产率。
固定化酶还可以用于环境保护、分析检测和能源转化等领域。
三、辅酶的再生技术1. 辅酶的重要性辅酶是许多酶催化反应中不可或缺的辅助因子,它能够促进酶的活性和催化效率。
然而,随着辅酶的消耗,酶的活性会逐渐降低,限制了反应的进行。
辅酶再生技术的研究成为了固定化酶领域的重要课题。
2. 辅酶再生技术的研究进展辅酶再生技术主要包括物理方法和化学方法。
常见的物理方法包括膜渗透技术和超声波辅助技术,通过对辅酶和酶的分离和再结合,实现辅酶的再生。
而化学方法则通过化学催化剂或化学反应将辅酶还原回可用形态。
这些方法在辅酶再生方面都取得了一定的研究进展,为固定化酶的应用提供了更多的可能性。
四、总结与展望固定化酶和辅酶再生技术在酶研究领域具有重要的应用前景。
通过固定化技术,可提高酶的稳定性和重复使用性,进一步推动酶的工业应用。
辅酶再生技术的发展也有助于提高酶催化反应的效率和产率。
未来,随着对酶机理和辅酶再生机制的深入研究,固定化酶和辅酶再生技术将得到进一步的完善和应用扩展,为更多领域的酶催化反应提供解决方案。
酶的固定化技术及其应用

酶的固定化技术及其应用酶是一种特殊的蛋白质,与许多生物化学反应密切相关,具有高效、高选择性、温和、环保等特点。
在工业、医学、食品、环保等领域都有广泛应用。
然而,如何提高酶的稳定性、重复使用性和机械强度是困扰工业应用的难题之一。
为了解决这个问题,固定化技术应运而生。
酶的固定化技术就是将酶固定到材料(如载体)上,使其成为固定化酶,从而提高酶的使用效率和经济效益。
一、酶的固定化技术酶的固定化技术包括物理固定化和化学固定化。
物理固定化是通过物理方法将酶与材料(如基础材料、载体)相结合,如吸附、包埋、凝胶包埋、膜过滤和微胶囊化等。
其中,吸附是最简单的一种物理固定化方法,即利用酶与基础材料之间的亲和力和静电作用等力学相互作用,将酶吸附到基础材料表面。
包埋是将酶载入一些多孔性材料(如明胶、珍珠岩等)中,使其均匀分布并且不受外界干扰。
凝胶包埋是在酶和载体之间形成一层凝胶层,使其达到一定程度的稳定性和机械强度。
膜过滤是将酶与载体固定在一起形成一层膜,具有高稳定性和机械强度。
微胶囊化是将酶包裹在微小的液滴或固体颗粒中,使其与空气或水隔绝,从而达到保护酶和提高酶效率的目的。
化学固定化是通过化学反应将酶与载体(如聚合物)之间共价键结合,如酯键结合、缩合反应、复杂化等。
其中最常用的是酯键结合,通过酶与载体表面上的羟基基团或羧酸基团形成酯键,从而将酶与载体结合到一起。
二、酶的固定化技术的应用酶的固定化技术在工业生产、医学诊断、食品加工、环境保护等领域都有着广泛的应用。
在工业领域,酶的固定化技术可以解决酶的稳定性和重复使用性问题,使酶的使用效率和经济效益大大提高。
在制药工业中,高浓度酶的固定化技术可以减少酶的挥发和失活,提高酶的活性和体积双重物质利用率。
在纺织、皮革等行业中,酶的固定化技术可以大大提高酶的反复使用率,减少酶的污染和纤维断裂。
在食品加工领域,制备、酵素提取等就是酶的固定化技术的广泛应用。
例如,乳品加工中常用的乳清酶解和芝士、酸奶等的制造就是利用酶的固定化技术。
酶的固定化技术

(3)溴化氰法
对于带-OH的载体如葡萄糖、纤维素、琼脂 糖来说是最常用的反应。在碱性条件下载体 -OH和BrCN反应生成极活泼的亚氨基碳酸酯 衍生物,它们在碱性条件下可与酶的氨基进 行共价偶联反应。
OH CNBr( 碱 性 )
R OH
碱性
O
R O
NH +ENZ
N
O R
水
OH
O R
OH O
R O
O R
五、如何进行酶固定化
吸附法、包埋法、结合法、交联法
固定化酶的模式图
(一)吸附法
定义;利用各种固体吸附剂将酶或含酶细胞 吸附在其表面上而使酶固定的方法称为物理吸
附法,简称吸附法。
常用的吸附剂:活性炭、氧化铝、硅藻土、 多孔陶瓷、多孔玻璃、硅胶、羟基磷灰石等。
▪优点:操作简便、条件温和、不易变性失活、 载体廉价、可反复使用。 ▪缺点:酶与载体结合不牢固,易脱落。
R-O-CH2 –CONH2-NH2 +HNO2 R-O-CH2 –CON3 +H2O
R-O-CH2 –CON3 +E-NH2 R-O-CH2 –CON3 +E-OH R-O-CH2 –CON3 +E-SH
R-O-CH2 –CONH-E R-O-CH2 –CO-O-E R-O-CH2 –CO-S-E
优点 条件温和、操作简便、活力损失少。 缺点 酶与载体结合不牢固,使用时需严格控
固定化酶技术及应用的研究进展

固定化酶技术及应用的研究进展固定化酶技术是一种将酶固定在载体上的方法,以提高酶的稳定性和重复使用率。
过去几十年来,固定化酶技术在生物催化、制药工业、食品工业等领域得到了广泛应用。
本文将介绍固定化酶技术的研究进展及其在不同领域的应用。
1.固定化酶的载体材料:传统的酶固定化载体包括天然多孔材料(如海藻酸钙、硅胶等)、无机材料(如纳米金、纳米磁性颗粒等)和有机材料(如聚酰胺、聚氨酯等)。
近年来,新型载体材料如金属有机骨架材料(MOFs)、二维材料等也被广泛研究,这些载体材料具有较大的比表面积和孔隙结构,有助于提高酶的固定化效果。
2.固定化酶的固定化方法:固定化酶的方法多种多样,包括吸附法、共价固定法、交联法、包埋法等。
吸附法是最简单的固定化方法,将酶溶液滴到载体表面,酶会自发地吸附在载体上;共价固定法通过化学反应将酶共价键结合到载体上,稳定性较好;交联法通过交联剂将载体和酶固定在一起,增加了载体和酶的稳定性;包埋法是将酶包裹在材料中,保护酶免受外界环境影响。
3.固定化酶的性能调控:通过改变固定化酶的载体材料、固定化方法和酶的固定化条件等,可以调控固定化酶的性能。
例如,调控载体材料的表面性质可以提高酶的活性和特异性;调控固定化方法和条件可以改变酶的稳定性和重复使用率。
1.生物催化领域:固定化酶技术在生物催化领域具有重要应用。
固定化酶可以用于催化酶促反应,如酶催化合成有机化合物、酶催化合成生物柴油等。
相比于游离酶,固定化酶具有较高的催化效率和稳定性,可以大幅度提高生产效率。
2.制药工业:固定化酶技术在制药工业中有广泛应用。
固定化酶可以用于制备药物原料、合成药物和代谢药物等。
与传统的化学合成方法相比,固定化酶合成方法具有高选择性、低副产物生成和环境友好等优点。
3.食品工业:固定化酶技术在食品工业中的应用也不容忽视。
固定化酶可以用于酿造、咖啡因去除、果汁澄清等。
利用固定化酶技术可以提高产品质量,降低生产成本。
酶的固定化技术在聚甘油酯生产过程中的应用
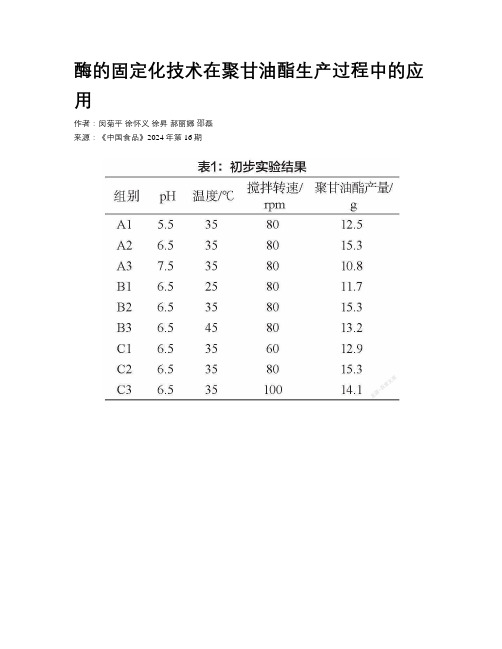
酶的固定化技术在聚甘油酯生产过程中的应用作者:闵菊平徐怀义徐昇郝丽娜邵磊来源:《中国食品》2024年第16期酶的固定化技術是指通过物理或化学方法使游离的酶附着在不溶于水的载体上,让酶保持活性且进行反复利用,减少酶的流失、降低酶的使用成本、提高反应效率,较多地应用于聚甘油酯的生产过程中。
20世纪70年代以来,我国一直都在开展对固定化技术的研究,目前已经实现了固定化酶在食品、医疗、能源和环境治理等领域的应用。
然而,现有的固定化技术仍存在适用范围小和成本较高等问题,需要利用新式材料开发更高效且可持续的固定化酶,控制酶反应并增强其可重复使用性,实现更具成本效益的工艺。
聚甘油脂是一种被联合国粮农组织和世界卫生组织(FAO/WHO),以及欧盟、美国、日本、中国等组织和国家审定批准用作食品添加剂的绿色、安全和多功能性非离子乳化剂。
聚甘油酯的生产方法主要包括化学法和酶催化法,化学法是主流。
在食品领域,固定化脂肪酶已被广泛应用于脂肪酸酯合成、油脂改性、芳香味酯类化合物以及抗坏血酸酯类抗氧化剂的合成等反应中。
1. 材料与方法1.1 实验材料具有特定孔径和表面积的聚丙烯酸树脂颗粒(用于固定脂肪酶);具有高催化活性和选择性的酶种(TypeⅡ型(L874999)脂肪酶);磷酸盐缓冲溶液(pH控制在5-9);三聚甘油(合成聚甘油酯的原料);不饱和脂肪酸(如油酸或亚油酸)。
实验前需要先对聚丙烯酸树脂颗粒进行预处理:用95wt%乙醇浸泡4-12h,冲洗至无乙醇气味,然后用2-5wt%盐酸溶液浸泡2-4h,水洗至中性,再用1-2wt%氢氧化钠浸泡2-4h,水洗至中性,最后抽滤去除水分后低温保存备用。
脂肪酶需置于磷酸盐缓冲溶液中浸泡1-3h,然后离心取上清液备用。
1.2 酶的固定化方法在去离子水中调节聚丙烯酸树脂颗粒的pH,使其高于脂肪酶的等电点(pI)1.5-2.5个单位。
将经过预处理的聚丙烯酸树脂颗粒置于含有脂肪酶的上清液中,确保树脂颗粒与上清液的质量体积比为1:8-1:4。
酶的固定化技术及其应用

酶工程课程论文题目:酶的固定化技术及其应用学院:食品学院专业:食品科学与工程班级:食品101(35)2012-11-21酶的固定化技术及其应用摘要:酶的固定化技术是酶工程研究领域的一项重点和热点技术之一,酶的固定化技术可以显著提高酶的利用率,降低酶生产的成本。
本文主要研究酶的固定化技术,酶固定化的优缺点,以及在食品,医药,环境中的应用。
并对其研究的前景进行了简洁的预测。
关键字:酶固定化技术应用酶作为一种生物催化剂,因其催化作用具有高度专一性、催化条件温和、无污染等特点,广泛应用于食品加工、医药和精细化工等行业。
但在使用过程中,人们也注意到酶的一些不足之处,如酶稳定性差、不能重复使用,并且反应后混入产品,纯化困难,使其难以在工业中更为广泛的应用。
因此为适应工业化生产的需要,人们模仿人体酶的作用方式,通过固定化技术对酶加以固定改造,来克服游离酶在使用过程中的一些缺陷。
固定化酶,是指在一定的空间范围内起催化作用,并能反复和连续使用的酶。
与传统的酶相比,固定化酶具有游离酶所不可比拟的优点.同一批固定化酶能在工艺流程中重复多次地使用;固定化后,和反应物分开,有利于控制生产过程,同时也省去了热处理使酶失活的步骤;稳定性显著提高;可长期使用,并可预测衰变的速度;提供了研究酶动力学的良好模型等一系列的优点。
用于固定化的酶,起初都是采用经提取和分离纯化后的酶,随着固定化技术的发展,也可采用含酶细胞或细胞碎片进行固定化,直接应用细胞或细胞碎片中的酶或酶系进行催化反应.由于微生物细胞可直接作为酶源,所以逐渐产生了固定化细胞技术.固定化细胞的优点是:(1)省去了酶分离纯化的时间和费用;(2)可进行多酶反应;(3)保持了酶的原始状态,从而增加了酶的稳定性.但固定化细胞与固定化酶相比,也存在一些不足之处:(1)因为产生副反应和所需生化产物的进一步代谢,使固定化完整细胞生产的产物纯度可能比固定化酶低;(2)细胞使用相当长的时间后,常常会发生自溶,尤其是在细胞有可能进行增殖时,细胞的漏出就特别明显:(3)单位体积反应器内固定化细胞的活性总是比相应的固定化酶活性低.酶的固定化方法主要可分为四类:吸附法、包埋法、共价键结合法和交联法等。
酶的固定化方案

酶的固定化的方案一、材料和方法1.实验材料及试剂酶,25%戊二醛溶液,带氨基的载体,考马斯亮蓝,牛血清白蛋白。
2. 主要实验仪器紫外可见光分光光度计Uv-1800,THZ一C恒温振荡器,MD200一3型电子天平PHS一3C酸度计3.酶的固定化方法1)载体的活化a 对所得的载体表面带有大量的氨基,对其进行活化处理可用于酶蛋白的共价结合。
采用戊二醛为活化试剂,使凝胶表面连接上游离的醛基。
具体方法为:将lg带氨基的载体颗粒臵于3ml、10%的戊二醛溶液中振荡24h,然后真空过滤。
所得固体用去离子水洗涤多次,干燥后即为戊二醛活化的树脂颗粒。
b大孔树脂预处理方法:称取10g树脂于锥形瓶中,用95%的乙醇浸泡24h,真空抽滤,用1L蒸馏水冲洗。
树脂依次用25mL的5%HCl和5%NaOH溶液浸泡4h后抽滤,用蒸馏水洗至中性。
抽滤后臵于4℃冰箱中干燥4h,室温保存备用。
举例:称取适量经预处理的大孔树脂于50mL锥形瓶中,加入适量磷酸缓冲液(pH7.5,0.05mol/L)和适量的酶,臵于恒温水浴振荡器中吸附一定时间后(37℃,150r/min)真空抽滤,并用100mL缓冲液冲洗载体,抽干后臵于4℃冰箱中干燥4h,并于4℃冰箱中密封保存。
2)固定化方法a 共价结合法准确称量20g戊二醛活化的树脂颗粒臵于50ml的离心管中,向其中加入体积为2ml的一定浓度的酶液(酶粉溶于pH7.0、0.03M的磷酸缓冲液)。
然后于冰浴中缓慢振荡24h。
之后离心收集固体,用相同的磷酸缓冲液洗涤固体5次以上。
b 酶聚集体包被法准确称量20g戊二醛活化的树脂颗粒臵于50ml的离心管中,向其中加入体积为2ml的一定浓度的酶液(酶粉溶于pH7.0、0.03M的磷酸缓冲液)。
然后于冰浴中缓慢振荡24h。
之后向混合液中加入0.5ml、2%的戊二醛溶液,继续振荡10h,离心收集固体。
最后用相同的磷酸缓冲液洗涤固体5次以上。
c.酶活性的测定d. 考马斯亮蓝法测定蛋白质浓度固定化时溶液中的蛋白质含量采用考马斯亮蓝染色法测定:考马斯亮蓝试剂的配制:将考马斯亮蓝 G-250 100mg 溶于 50mL 95%乙醇中,加入100mL 85%磷酸,用蒸馏水稀释至 1000mL。
酶固定化方法

酶固定化方法酶是一种生物催化剂,能够在生物体内促进化学反应的发生,并具有选择性、高效率等特点,被广泛应用于药物合成、化妆品生产、食品加工、农业等领域。
然而,酶在生产过程中易受到环境条件、物质浓度、PH值等因素的影响,其失活速度也较快,因此需要采用酶固定化方法来提高酶的稳定性和重复使用性。
酶固定化是指将酶分子固定在一定的载体上,形成酶固定化催化剂,以提高酶的稳定性、活性和寿命,并使其能够重复使用。
酶固定化的优点在于可以有效地降低生产成本,提高产品的纯度和产量,减少废物的生成,并且有利于环境保护。
常见的酶固定化方法有物理吸附法、化学共价键结合法、交联共价键结合法、磁性分子筛固定法等。
1.物理吸附法物理吸附法是一种简单易行的酶固定化方法,主要是利用载体表面的物理吸附力将酶固定在载体上。
常用的载体有纤维素、硅胶、氧化铝、纳米颗粒等。
物理吸附法具有操作简单、成本低、不影响酶的活性、经济实用等优点,但固定效果不够稳定,易受到温度、PH值、离子浓度等因素的影响,且固定效率较低。
2.化学共价键结合法化学共价键结合法是将酶固定于载体表面通过共价键(如酯键、硫醇键、胺键等)连接,酶与载体结合更牢固。
此方法的固定效果稳定,易于操作,但可能影响酶的活性,且固定剂的使用可能会增加成本。
交联共价键结合法是一种主要针对大分子酶的固定化方法,其原理是将酶分子与载体交联,形成较牢固的内部网络结构,通过物理和化学交联结合将酶固定在载体上。
该方法具有较好的固定效果和稳定性,并且可以在不影响酶的活性的情况下实现酶的固定化。
4.磁性分子筛固定法磁性分子筛固定法是一种新型的酶固定化方法,利用磁性颗粒作为载体,采用超声波或磁力场等手段使酶分子与磁性颗粒产生交互作用,从而固定酶分子。
此方法具有简单易行、操作方便、固定效果好等优点,适用于固定化小分子酶和大分子酶。
离子液体再生纤维素微球共固定漆酶-介体体系及对吲哚的降解

谷 耀华等 :离子 液体 再生纤维素微球共 固定漆酶.介体体 系及 对吲哚 的降解
定性 ,并赋 予酶 具 有可 循环 重 复使 用 性 .但 目前关 于 介体 回收 和再 利用 的研究 ,特别 是 酶.介体 体 系共 固定 化技 术 的研究 尚缺少报 道 " .由于介 体 ABTS合 成 成 本 高 且存 在 潜 在 的毒性 ,实 现 其 回收 和再 利用 则尤 为重 要 .纤 维素 是可 再生 生物 质 材 料 ,来 源广 泛 且 无 毒 可 生物 降解 ,与 酶具 有 良好 的 生物 相 容性 .目前离 子液 体溶 解纤 维 素 晶体技 术 为纤维 素 进行 功 能性再 生 提供 了基 础 18 ̄20 ̄.
V01.39 2018年 8月
高 ቤተ መጻሕፍቲ ባይዱ 学 校 化 学 学 报
CHEMICAL JOURNAL OF CHINESE UNIVERSrHES
No.8
l846~ 1852
离 子 液 体 再 生 纤 维 素 微 球 共 固定 漆酶 一 介 体 体 系及 对 吲 哚 的 降 解
谷 耀 华 ,薛 屏
目前 ,用 于 漆 酶 催 化 反 应 的 介 体 有 人 工 合 成 介 体 (如 2,2 一联 氨 .双 一3一乙基 苯 并 噻 唑 啉.6.磺 酸 , ABTS)和 天然 介体 (如 丁香 醛 ,SA),介 体 参 与漆 酶催 化 反应 ,促 进 了 氧化 还 原 过程 的 电子 转 移 ,漆 酶 的催化 作用 得 到提 高 .Wang等 ¨ 采 用非 固定化 漆 酶与 非 固定化 介体 ABTS组 成 漆酶/ABTS介 体 系 统 , 控 制 ABTS浓度 为 0.5 mmol/L,pH值 为 3时 降解 吲哚 120 h,降解 率 达到 60% ,而仅 用漆 酶无 ABTS作 用 在 相 同条 件 下 吲哚 的 降解 率 仅 为 30%.Qiu等 ¨ 研 究 了 不 同介 体 对漆 酶催 化 氧 化染 料 结 晶紫 和孔 雀 石 绿 的脱 色效 果 ,发现漆 酶/ABTS体 系脱 色作 用较 强 ,对 结 晶紫 和孔 雀石 绿 的脱 色 率 分 别 为 61.9%和
青霉素G酰化酶在磁性复合载体上的固定化及其酶学性质

青霉素G酰化酶在磁性复合载体上的固定化及其酶学性质屈冠群;曹雪荣;王雷;薛屏【摘要】利用凝胶-溶胶方法对磁性Fe3O4微粒表面进行功能化修饰,制备了表面含氨丙基的磁性复合载体,并通过戊二醛交联制备固定化青霉素G酰化酶(PGA).结果表明,在37℃时,固定化酶水解青霉素G钾盐,制备6-氨基青霉烷酸的表观活性为1 886 IU/g,表观米氏常数K'm=140 mmol/L,最大反应速度Vmax=0.45 mmol/min,水解反应最佳温度T=50℃,最佳pH=7.0~8.0.固定化酶具有一定的热稳定性和耐酸碱性,在pH=6.0~9.0且T<50℃时活性稳定.固定化酶经10次间歇操作使用,可保持初始催化活性的82%.%The magnetic composite support with a saturation magnetization value of 27.2 A · m2 · kg-1 was prepared via the sol-gel.The amino groups existing on the magnetic composite carrier could couple penicillin G acylase (PGA) by cross-linking with glutaraldehyde to form the immobilized enzyme.The catalytic performances of the immobilized PGA for hydrolyzing penicillin G potassium to produce6aminopenicillanic acid were studied.The apparent activity of the immobilized PGA was 1886 IU/g.The optimal temperature and the optimal pH were 50 ℃ and 7.0~8.0 for the hydrolysis reaction, respectively.The apparent Michaelis constant K'm and Vmax of the immobilized PGA were 240 mmol/L and 0.45 mmol/min, respectively.It was found that the thermal stability and the durability on acidic or basic medium of PGA immobilized the magnetic composite support increased greatly compared with those of the free enzyme, and its activity keeps 82.0% of its original activity afterused 10 cycles.The immobilized PGA can be sedimentated fleetly in magnetic field and separated facilely from the product in applications.【期刊名称】《宁夏大学学报(自然科学版)》【年(卷),期】2011(032)001【总页数】5页(P57-61)【关键词】磁性复合载体;固定化青霉素G酰化酶;催化活性;酶学性质【作者】屈冠群;曹雪荣;王雷;薛屏【作者单位】宁夏大学能源化工自治区重点实验室,宁夏银川,750021;宁夏大学能源化工自治区重点实验室,宁夏银川,750021;宁夏大学能源化工自治区重点实验室,宁夏银川,750021;宁夏大学能源化工自治区重点实验室,宁夏银川,750021【正文语种】中文【中图分类】O6436-氨基青霉烷酸(6-APA)是生产各种半合成青霉素的关键中间体.利用固定化青霉素G酰化酶(penicillin G acylase,PGA)催化水解青霉素G制备6-氨基青霉烷酸,反应条件温和,产率高,同时避免了毒性物质的使用,因而受到了广泛的关注[1—3].然而,可溶性酶直接用于催化过程,酶与产物难以分离且不可重复使用,造成使用成本较高.因此,青霉素酰化酶的固定化技术一直是酶工业化应用领域研究的重要课题.无机载体用于青霉素酰化酶的固定化,其突出的优势是载体材料可以重复使用,不存在材料的后处理问题.近年来,介孔分子筛材料固定化青霉素酰化酶的研究受到了广泛重视[4—5],该材料通过物理吸附制备的固定化酶再活性高,但操作稳定差,其原因是使用过程中酶分子出现脱落[6].笔者用溶胶-凝胶方法将无定形SiO2包裹于Fe3O4纳米粒子表面,用3-氨丙基三乙氧基硅烷硅与SiO2硅羟基反应制得表面含氨丙基磁性复合载体,再利用戊二醛交联获得了共价键结合的固定化青霉素G酰化酶,并研究了氨丙基磁性复合载体对青霉素G酰化酶的固定化作用和固定酶的酶学性质.结果表明,磁性载体制备的固定化酶,在磁场的作用下能够快速从反应体系中分离、回收[7—8],因而操作过程易实现自动化控制.1 实验1.1 试剂与仪器青霉素G酰化酶(PGA,1 062IU/mL,浙江顺风海德尔公司);青霉素G钾盐(PGK,河北制药厂);考马斯亮蓝(G-250,国药集团化学试剂有限公司);3-氨基丙基三乙氧基硅烷(美国Acros公司,优级纯);正硅酸乙酯(上海化学试剂厂,分析纯);FeCl2·4H2O(上海化学试剂厂,分析纯);FeCl3· 6H2O (天津瑞金特化学品有限公司,分析纯),其他试剂均为分析纯.D/Max-2200PC X-射线粉末衍射仪(日本RigaKu公司);JSM-6360LV扫描电子显微镜(日本JEOL公司);7304振动样品磁强计(美国Lake Shore公司).1.2 氨丙基磁性复合载体的制备Fe3O4磁粉的制备采用共沉淀法.将0.43g FeCl2·4H2O和1.18g FeCl3·6H2O置于100mL的三口瓶中,加入20mL去离子水进行溶解.搅拌下滴入φ=28%浓氨水至溶液的pH=9,水浴加热至90℃熟化2h,磁场下分离出固体产物Fe3O4.Fe3O4用去离子水洗至淋洗液为中性,60℃真空干燥12h.取0.5g上述Fe3O4磁粉,装入盛有30mL无水乙醇的三颈烧瓶中进行超声处理,使Fe3O4在无水乙醇中得到充分分散;20min后滴入3.0mL浓氨水并在超声波中分散10min.然后将三颈烧瓶转移至40℃恒温水浴槽中,逐滴加入2.42mL正硅酸乙酯,此时体系中有溶胶形成;机械搅拌30min,加入0.28mL 3-氨基丙基三乙氧基硅烷,此时溶胶在60℃下熟化2h形成凝胶.磁场中分离出固体,用去离子水洗涤后于60℃真空干燥12h,得到氨丙基磁性复合载体,用NH2-(CH2)3-SiO2-Fe3O4表示.1.3 固定化酶的制备和水解活性的测定取0.1g干态磁性复合载体,用去离子水润湿,加入4.60mL用pH=7.8的磷酸盐缓冲溶液稀释的青霉素G酰化酶溶液和0.2mLφ=25%的戊二醛,于30℃水浴摇床中振荡72h.磁场中分离出固定化酶,收集溶液,并用考马斯亮蓝染色法测定其中的酶蛋白量.固定化酶用pH=7.8磷酸盐缓冲溶液洗涤至用考马斯亮蓝G-250检测洗涤液中无蛋白质成分.固定化酶存于4℃冰箱中备用,用PGA/NH2-(CH2)3-SiO2-Fe3O4表示.固定化酶装入25mL 37℃恒温的反应器中,加入2mL pH=7.8的磷酸盐缓冲溶液和8mL去离子水,测定起始溶液的pH值.搅拌速度为150r/min下,将恒温37℃的10mL w=4%的青霉素G钾盐水溶液移入反应器,pH计监测下用标准NaOH溶液滴定水解产生的苯乙酸,使反应体系的pH=7.8.记录反应前10min所消耗NaOH溶液(c=0.100 1mol/L)的体积,以每分钟催化青霉素G水解生成1μmol的6-APA所需的酶量定义为一个单位(IU).固定化酶的表观活性AIME (IU/g)[9]为式中:cNaOH为NaOH的浓度(mol/L);VNaOH为消耗NaOH的体积(mL);m为载体干质量(g);t为反应时间(min).固定化酶的活力回收率RIME(%):1.4 固定化酶操作稳定性考察用间歇操作方式考察固定化酶的操作稳定性,每次反应的底物均为0.400g.将0.200g NH2-(CH2)3-SiO2-Fe3O4固定化酶装入37℃循环水加热的间歇式反应器中,加入pH=7.8的磷酸盐缓冲溶液后,将37℃溶有0.400g青霉素G钾盐的水溶液加入反应器,滴入0.100 1mol/L的NaOH溶液,控制反应体系的pH=7.8,直到反应液的pH值在1min内不再发生变化时终止反应.准确记录反应进行的时间和所消耗NaOH溶液的体积.每次反应后,固定化酶用磷酸盐缓冲溶液洗涤后,再次装入反应器,重复使用10次.2 结果与讨论2.1 磁性复合载体的结构表征磁性复合载体NH2-(CH2)3-SiO2-Fe3O4的X-射线粉末衍射图(XRD)见图1.由图1可知,载体中Fe3O4粒子的结晶状态很好,其(311),(220),(400)和(440)等晶面衍射峰峰形尖锐,且各衍射峰的2θ与Fe3O4衍射峰的峰位相一致.图中2θ在20°~28°出现了宽化的衍射峰,这是无定形SiO2的衍射峰,说明NH2-(CH2)3-SiO2-Fe3O4复合载体表面存在SiO2包层.制备过程中正硅酸乙酯和3-氨基丙基三乙氧基硅烷在Fe3O4粒子表面发生了水解和缩合反应,说明在Fe3O4粒子表面形成了SiO2包层的同时,氨丙基基团移植于磁性复合载体表面.图1 复合载体的XRD图扫描电子显微镜观察磁性复合载体NH2-(CH2)3-SiO2-Fe3O4的形貌见图2.由图2可知,载体是由粒径接近100nm的粒子组成,颗粒之间有团聚和粘连.磁性测定结果表明,制备的Fe3O4和NH2-(CH2)3-SiO2-Fe3O4均具有超顺磁性能,即在外磁场存在下有磁性,外磁场撤除时磁性消失.制备的Fe3O4饱和磁化强度为66.2A·m2/kg,功能化NH2-(CH2)3-SiO2-Fe3O4的饱和磁强度为27.2A·m2/kg.NH2-(CH2)3-SiO2-Fe3O4的磁响应强度高于磁性聚合载体[10],在外加磁场存在作用下,其能够被很好地磁化,制备的固定化酶极易从反应溶液中的分离.图2 NH2-(CH2)3-SiO2-Fe3O4的SEM照片NH2-(CH2)3-SiO2-Fe3O4复合载体含有氨基,其可以与醛中的羰基发生亲核加成反应生成席夫碱(Schiff base).戊二醛分子中含有两个醛基,它们分别与载体上的氨丙基和酶分子中的氨基发生Schiff反应,使酶分子与载体形成共价结合(图3),从而实现青霉素G酰化酶的固定化,固定化酶的活力回收率为42%.37℃下制备的固定化酶PGA/NH2-(CH2)3-SiO2-Fe3O4水解青霉素G钾盐的表观活性为1 866IU/g,呈现出高的催化活性.图3 NH2-(CH2)3-SiO2-Fe3O4上戊二醛交联固定酶的示意图2.2 水解反应的最适pH值与温度酶的催化活性受反应体系pH值的影响很大,溶液的酸碱性可以改变酶活性中心有关基团的解离状态,同时还会影响底物的解离及反应体系中其他成份的解离,大大影响酶催化反应速度.固定反应温度为37℃,磁性固定化酶PGA/NH2-(CH2)3-SiO2-Fe3O4用于催化水解青霉素G钾制备6-氨基青霉烷酸(6-APA),以不同pH值的磷酸盐缓冲溶液配制w=2%的底物溶液,绘制pH值与活性关系曲线(图4,图中数据取3次实验的平均值).由图4可知,固定化酶的最适pH=7.0~8.0,游离酶水解反应的最适pH=8.0.与游离酶相比,固定化酶对反应体系的pH值变化不敏感,在较宽的pH值范围内均具有高的催化活性.固定pH=7.8,固定化酶PGA/NH2-(CH2)3-SiO2-Fe3O4和游离酶PGA水解青霉素G的催化活性与反应温度之间的关系如图5所示.由图5可知,固定化酶和游离酶水解反应的最适温度不一致,前者为50℃,后者为45℃;同时,在低温(20~45℃)时,固定化酶活性下降幅度高于游离酶;在较高温度(50~55℃)时,固定化酶的活性比较稳定,而游离酶的活性迅速下降,在55℃反应时,前者保留最高活性的97.0%,而后者仅为51.6%.固定化酶在较高的反应温度下具有较好的催化活性,这有利于其工业化应用.图4 介质pH值对催化活性的影响图5 反应温度对催化活性的影响2.3 表观米氏常数与最大反应速度的测定以不同浓度的青霉素G钾盐溶液作底物,在37℃下测定固定化酶和游离酶对其水解的初速度的影响.以底物浓度的倒数为横坐标,反应初速度的倒数为纵坐标,做Lineweaver-Burk图[11],研究PGA/NH2-(CH2)3-SiO2-Fe3O4的酶学行为(图6).由图6数据可以计算出,游离酶的米氏常数Km=8.2mmol/L,最大反应速度vmax=1.02mmol/min,PGA/NH2-(CH2)3-SiO2-Fe3O4固定化酶的表观米氏常数K′m=240mmol/L,vmax=0.47mmol/min.固定化酶的表观米氏常数高于游离酶,说明固定化酶对底物的亲和力小于游离酶,这可能是在固定化酶的周围形成了能与底物产生立体影响的扩散层所造成的.图6 固定化酶和游离酶的Lineweaver-Burk图2.4 固定化酶的稳定性固定化青霉素酰化酶用于水解青霉素G钾盐,除生成6-APA外,同时还有酸性较强的苯乙酸生成.工业上通过滴入一定浓度的碱溶液来控制反应体系的pH值,但在实际操作中,反应体系的pH值时常会出现过高或过低的现象,这就要求固定化酶对酸碱有一定的稳定性.将1mL原酶液和0.2g固定化青霉素酰化酶分别置于0.1mol/L不同pH值的磷酸盐缓冲溶液中,于30℃水浴中恒温24h.游离酶用0.1mol/L pH=7.8磷酸盐缓冲溶液调节溶液pH=7.8,用碱滴定法测定37℃下水解2%青霉素G钾的活性.固定化酶先用pH=7.8磷酸盐缓冲溶液洗涤后再测活性(图7).结果表明,PGA固定于NH2-(CH2)3-SiO2-Fe3O4磁性载体,在pH值为6.0~9.0的介质中放置24h后,其表观活性保持在初始活性的90%以上,固定化酶对酸碱的稳定性优于游离酶.图7 固定化酶和游离酶对酸碱的稳定性将固定化酶和游离酶分别置于0.1mol/L pH=7.8的磷酸缓冲溶液中,在不同温度保温2h后,测定它们的水解活性(图8).由图8可知,PGA固定于NH2-(CH2)3-SiO2-Fe3O4载体,热稳定性有显著的提高,在20~40℃经2h保温处理后,表观活性没有出现衰减,经45℃2h热处理后,活性有所下降,但下降幅度远小于游离酶,经60℃2h热处理后,固定酶仍保持其初始活性的66%;而游离酶的活性已基本丧失了.PGA经NH2-(CH2)3-SiO2-Fe3O4固定化后热稳定性得到了大幅度的提高,可能是由于酶分子通过戊二醛与载体上氨丙基共价结合,增强了酶构型的牢固程度,当处于热处理环境时,酶蛋白分子的展开受到阻碍,导致酶活性中心的破坏大大减少.固定化酶的操作稳定性在很大程度上反映了固定化载体性能的优劣,它是决定固定化载体能否工业化应用最为关键的因素之一.采用碱滴定操作工艺考察固定化酶的操作稳定性,每次水解青霉素G钾盐为0.400g,结果见图9.图8 固定化酶和游离酶的热稳定性由图9可知,PGA/NH2-(CH2)3-SiO2-Fe3O4经连续10次间歇操作使用,催化活性有所下降.经第5次重复使用后,活性下降幅度减小且趋于稳定,在第10次使用后,表观活性为初始活性的82.0%.图9 固定化酶的使用稳定性3 结论NH2-(CH2)3-SiO2-Fe3O4磁性复合载体固定青霉素G酰化酶,酶与载体共价结合.固定化酶水解青霉素G钾盐制备6-氨基青霉烷酸的活性达1 886IU/g,且酶的热稳定性和耐酸碱性均得到明显的增强.固定化酶PGA/NH2-(CH2)3-SiO2-Fe3O4在磁场的作用下,能够快速有效地与产物分离,且在使用过程中不出现流失现象.参考文献:[1] WANG Zhilong,WANG Li,XU Jianhe,et al.Enzymatic hydrolysis of penicillin G to 6-aminopenicillanic acid in cloud point system with discrete countercurrent experiment[J].Enzyme and Micro Technol,2007,41(1/2):121-126.[2]张业旺,谭强,刘瑞江,等.青霉素酰化酶制备6-APA的研究进展[J].中国抗生素杂志,2008,33(7):385-389.[3]周成,王安明,王华,等.青霉素酰化酶的固定化与应用新进展[J].中国抗生素杂志,2008,33(5):257-262.[4]LÜYongjun,GUO Yianglong,WANG Yanqin,et al.Immobilized penicillin G acylase on mesoporous silica:The influence of pore size,pore volume and mesophases[J].Microporous Mesoporous Materials,2008,114(1/3):507-510.[5] XUE Ping,XU Fang,XU Lidong.Epoxy-functionalized mesostructured cellular Foams as effective support for covalent immobilization of penicillin G acylase[J].Appl Surf Science,2008,255(5):1625-1630.[6]薛屏.Co-MCM-48和Co-MCM-41介孔分子筛对青霉素酰化酶的固定化作用[J].宁夏大学学报:自然科学版,2006,27(3):243-247.[7] NAGAO D,YOKOYAMA M,SAEKI S,et al.Pareparation of composite particles with magnetic silica core and fluorescent polymer shell [J].Colloid Polym Sci,2008,286(8/9):959-964.[8] SEN T,SEBASTIANELLI A,BRUCE J I.Mesoporous Silca-Magnetite nanocomposite:Fabrication and Applications in Magnetic Bioseparations [J].J Am Chem Soc,2006,128(22):7130-7131.[9] XUE Ping,LU Guanzhong,GUO Yanglong,et al.A novel support of MCM-48molecular sieve for immobilization of penicillin G asylase[J].J Mol Catal B:Enzym,2004,30(2):75-81.[10] XUE Ping,SONG Xiaodan,CAO Xuerong.An efficient synthesis of ampicillin on magnetically separable immobilized penicillin G acylase [J].Chin Chem Lett,2010,21(4):765-768.[11]韩辉,徐冠珠.颗粒状固定化青霉素酰化酶的研究[J].微生物学报,2001,41(2):204-208.。
酶的固定化方法

酶的固定化方法1. 基本介绍酶的固定化技术是将活性酶分子吸附到不溶性载体上的技术,这些载体包括有机支架,金属合金,无机型号,复合支架,生物大分子和石墨。
与溶液型酶相比,固定化酶具有良好的耐热性,耐久性和稳定性。
可以在恒定的温度和pH值下多次重复使用,这使得固定化酶可以广泛应用于生物工程,食品技术和保健产品的制备中。
2. 固定化酶的优势(1)保持酶活性。
固定化酶能够有效地防止反应补充的游离酶的出现,充分保持其最初的功能和活性,极大地提高了反应中酶的活性和稳定性;(2)提高回收率。
固定化酶具有彼此独立的结构,可以在反应中迅速回收,特别是对于产物特性复杂的反应;(3)可扩展性强。
固定化酶可以根据应用环境的不同和操作条件的可控性,调整载体的参数;(4)可以重复使用。
固定化酶可以多次使用,可以充分利用其过程效率,减少反应次数,降低成本,提高产物纯度;(5)灵活性好,操作更加简单。
当需要调节反应中的酶功效时,可以通过简单的调节载体参数来控制。
3. 固定化酶的技术原理固定化酶主要是通过生物相容性,物理锁定,化学结合和选择性结合四种技术原理。
(1)生物相容性原理。
根据酶的物理化学性质,通过将酶与具有吸附效果的固定化载体搅拌至溶解,使酶外部改变,从而结合到固定体上,形成固定化酶。
(2)物理锁定原理。
通过将因子与特定形状的载体结合,物理力把酶和载体牢牢地结合在一起,形成固定化酶。
(3)化学结合原理。
通过改变因子的外部,形成含有非共价或共价结合的表面带正或负电荷,从而使酶能够结合至具有与之相匹配的电荷的固定体上,形成固定化酶。
(4)选择性结合原理。
通过给载体表面施加疏水或疏水性物质,形成选择性的活性基团,使载体具有低特异性,从而将酶与相应特异性表面结合,形成固定化酶。
4、固定化酶的方法固定化酶有多种固定化方法,如电冻定,脂质包覆,杂化,冻胶,结合支架和表面修饰等。
(1)电冻定:电冻定是一种通过电泳技术将酶通过载体电泳固定在离心管内壁上的一种方法。
简述酶的固定化方法

简述酶的固定化方法酶是一种细胞的特殊物质,它能够触发各种特定的化学反应,是维持机体正常功能的关键因素。
酶可以通过自然发生或人工合成的方式获得,但是因为其有机物质性质和活性位点的稳定性比较低,它对外界环境敏感,因此,对酶的稳定性进行改善是提高酶功效比较有效的方法之一。
其中,酶固定化方法可以大大改善酶的稳定性,从而提高其活性,使它能够持续发挥作用。
酶固定化方法是指将蛋白质固定在固定支架上的技术,目的是增加酶稳定性,防止它失去活性,提高其发挥的功能。
它通常可以通过物理和化学方法将酶结合到模板上,使它能够更好地承受外界因素的攻击。
一般来说,酶固定化方法可以分为物理固定化和化学固定化两种方法。
一种非常常见的物理固定化方法是离子交换,它是很多固定化酶的主要技术。
它的原理是,将可逆的分子键稳固地结合在离子交换型固定支架上,以酶本身与支架上的离子来形成相互作用。
可以通过这种方式将酶稳定地固定在支架上,从而改善其稳定性。
另一种比较常用的化学固定化方法就是聚合键固定法,它能够通过化学键稳定地将酶和基体结合起来,从而有效地防止活性位点的破坏。
它是将一种特定的有机键,如超醛凝胶定化剂,结合到支架上,在支架上形成层状的有机膜,将酶结合到这个层状结构上;或者使用其他的水性凝胶定化剂,使酶形成胶状物质,将酶结合到这种胶状物质上,从而实现固定化。
此外,酶固定化还可以通过细胞固定化技术,通过把细胞固定在支架上,辅以适当的因子来促进细胞内酶的生成,从而实现酶固定化。
总之,酶固定化方法是运用技术将酶结合到固定支架上,使酶具有更高的稳定性,从而提高其活性,更好地发挥功能的一种有效的技术手段。
目前,已经有许多不同的酶固定化技术可用,如物理固定化和化学固定化;但是,在实际应用中,根据酶的性质,合理选择酶固定化的方法和固定支架材料,以获得最佳的发挥效果,是实施酶固定化的重要前提。
酶固定化技术目前在环境污染控制、食品加工、医药制剂和其他领域有着广泛的应用,为酶的有效利用和更大的发展提供了强有力的保证。
酶和辅酶的固定化及辅酶再生的研究

酶和辅酶的固定化及辅酶再生的研究酶和辅酶的固定化及辅酶再生是生物化学领域中的一个重要研究方向。
酶是一类催化生物反应的蛋白质,而辅酶则是一种辅助酶催化反应的小分子有机物。
固定化是将酶或辅酶固定在固体载体上,以增强其稳定性和重复使用性的过程。
辅酶再生则是指在催化反应过程中,通过添加适当的物质,使辅酶得以再次使用,从而提高反应效率和降低成本。
固定化酶和辅酶的研究具有重要的实际意义。
首先,固定化可以提高酶和辅酶的稳定性,使其在恶劣条件下仍能保持催化活性,从而延长其使用寿命。
其次,固定化还可以实现酶或辅酶的可控释放,使其在特定的时间和空间内发挥作用,从而提高反应的选择性和效率。
常见的固定化方法包括物理吸附、共价结合和包埋等。
物理吸附是将酶或辅酶通过静电作用或氢键等吸附在载体表面,这种方法简单易行,但稳定性较差。
共价结合是通过化学反应将酶或辅酶与载体共价结合,这种方法固定效果好,但操作相对复杂。
包埋是将酶或辅酶包裹在聚合物或凝胶中,形成固定化结构,这种方法稳定性较好,但扩散性较差。
辅酶再生是固定化酶和辅酶的关键问题之一。
在催化反应中,辅酶通常会被还原为其活性形式,然后再次参与反应。
辅酶的再生可以通过添加辅酶前体物质、催化剂或调节剂等途径实现。
具体的再生机制取决于酶或辅酶的特性和反应的类型。
酶和辅酶的固定化及辅酶再生不仅在生物化学研究中有着重要的应用,也在工业上具有广泛的应用前景。
通过固定化和再生技术,可以降低生产过程中的废弃物产生,提高反应效率和产量,从而实现绿色和可持续的生产方式。
因此,对于酶和辅酶的固定化及辅酶再生的研究具有重要意义,并且具有广阔的发展前景。
固定化酶球形高分子载体的设计与应用

固定化酶球形高分子载体的设计与应用
薛屏;王居兰;李鹏
【期刊名称】《石油化工》
【年(卷),期】2010(039)001
【摘要】高分子微球具有一定的化学和机械稳定性,能抵抗微生物和酸碱的作用,是优良的固定化酶载体材料.针对制备高活性、高稳定性固定化酶对载体材料的性能要求,评述了高分子微球的组成和功能性基团的可设计性、粒径与形态可控性、多孔和大比表面积等结构性质, 概括了载体结构性质对固定化酶催化活性的影响规律,提出了对不同性质的生物酶"量体裁衣",设计制备特效的载体材料是高分子微球固定化酶研究的发展趋势.同时介绍了固定化青霉素酰化酶和固定化脂肪酶在工业催化领域的应用.
【总页数】6页(P7-12)
【作者】薛屏;王居兰;李鹏
【作者单位】宁夏大学能源化工重点实验室,宁夏银川,750021;宁夏大学能源化工重点实验室,宁夏银川,750021;宁夏大学能源化工重点实验室,宁夏银川,750021【正文语种】中文
【中图分类】TQ426.97
【相关文献】
1.智能型高分子载体的设计与制备及其固定化酶的研究进展 [J], 陈霞;刘潇;赵光辉;崔彦君;李彦锋
2.高分子载体材料对青霉素酰化酶的固定化作用 [J], 薛屏;卢冠忠;郭杨龙;王筠松
3.高分子膜载体固定化木瓜蛋白酶 [J], 夏葵;曾虹燕;姜和;王亚举;廖凯波
4.高分子载体对米曲霉氨基酰化酶的固定化研究 [J], 李民勤;王道宾;周菊岩;何炳林
5.高分子膜载体固定化木瓜蛋白酶吸附动力学 [J], 夏葵;曾虹燕;杨常桥;王橙;赵芳芳
因版权原因,仅展示原文概要,查看原文内容请购买。
浙科版高二生物选修1_新课导入:酶的固定化

导入一
我们通常使用的 高果糖浆,是用 葡萄糖制造的, 它采用了什么技 术呢?
我们日常使用的发酵粉是活的还是死的呢? 它是通过什么技术制造的呢?
导入二
在制造葡萄酒的过 程中,由于菌种产 生的酶非常敏感易 失活,使得菌种难 以剂等条件 容易失活,溶液中的酶很难回收,提高了生产 成本,还可能影响产品质量。
那么我们能否采取一些方法避免这些情况的发 生呢?今天我们就来学习酶的固定化技术解决 这些实际问题。
结束
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5)随着固定化技术的发展,出现固定化菌体 。1973年, 日本首次在工业上应用固定化大肠杆菌菌体中的天门冬氨酸 酶,由反丁烯二酸连续生产L-天门冬氨酸。
(6)在固定化酶和固定化菌体的基础上,70年代后期出现了 固定化细胞技术。 1976年,法国首次用固定化酵母细胞生产 啤酒和酒精,1978年日本用固定化枯草杆菌生产淀粉酶,开 始了用固定化细胞生产酶的先例。
➢天然高分子衍生物: 纤维素 葡聚糖凝胶 琼脂糖 甲壳质 氨基酸共聚物
亲和性好,机械性能差
➢合成聚合物: 聚丙烯酰胺 聚苯乙烯 尼龙
机械性能好,但有疏水结构
亲水载体优于疏水载体
可供共价结合于载体的功能团包括: 氨基:N端α-氨基、赖氨酸残基的ε-氨基 羧基:C端羧基、门冬β-羧基、谷氨酸γ-COOH 巯基:半胱氨酸-SH 羟基:酪氨酸、丝氨酸、苏氨酸的-OH 苯环:苯丙氨酸、酪氨酸 咪唑基:组氨酸 吲哚基:色氨酸
根据酶与载体结合的化学键不同,结合法可分为 离子键结合法 共价键结合法
1. 离子键结合法 (ion binding)
通过离子键使酶与载体结合的固定化方法称为离子键结合法。 通过酶分子与载体之间的静电引力相结合
载体: 某些不溶于水的离子交换剂。
DEAE—纤维素
TEAE—纤维素
DEAE—葡聚糖凝胶
(7)1982年,日本首次研究用固定化原生质体生产谷氨酸 ,取得进展。
二、固定化酶的优缺点:
固定化酶同自由酶相比,具有以下优点:
可反复使用,在
绝大多数情况下
提高了酶的稳定
性,有利于工艺
1
的连续化和自动
化,节约劳动力
优点
产物纯度高,
极易将固定
化酶与底物、
2
产物分开
酶反应过程可以
严格控制,有利
于工艺自动化和 微电脑化
固定化酶可重复使用——操作稳定性
酶在固定化后其活力可以缓慢释放, 酶的稳定 性比天然状态高, 可重复多次使用.
例:将0.5g DEAE 纤维素固定化壳聚糖酶与10mL 1%壳聚糖溶 液在60℃下连续反应10 次每次反应时间为6h 每次反应后 分别测定酶活力
结果如图所示: 固定化酶的活力基本保持稳定活力损失 15% ,由此可见该固定化酶具有良好的操作稳定性。
✓ 避免那些可能导致酶蛋白高级结构破坏的条件。 ✓ 由于酶蛋白的高级结构是凭借氢键、疏水键和离
子键等弱键维持,所以固定化时要采取尽量温和 的条件,尽可能保护好酶蛋白的活性基团。
固定化应该有利于生产自动化、连续化。 ✓ 载体能抗一定的机械力。
固定化酶应有最小的空间位阻。 酶与载体必须结合牢固,利于固定化酶的回收及反
酶的固定化
酶:
在水溶液中-不稳定 一次性使用-难回收,难连续化生产 用于医药/化学分析-纯度要求高 产物的分离纯化困难 。。。。
---要求将酶变成不溶性 ---实际上将酶限制在一定空间 固定化
固定化酶的研究
固定酶具有催化活性
1916年,美国科学家发现 ,酶和载体结合以后,在水 中呈不溶解状态时,仍然具 有生物催化活性。
酵母细胞——多孔陶瓷、多孔塑料——酒精、啤酒发酵 活性污泥微生物——硅藻土、多孔玻璃、多孔陶瓷、多孔
塑料——废水处理 霉菌——多孔塑料、金属丝网——生产有机酸、酶 植物细胞——中空纤维——色素、香精、药物等 动物细胞——容器壁、微载体、中空纤维——功能蛋白质
等药物
多孔陶瓷 porous ceramics
3
酶的使用效
率提高,适
4
合于多酶反
应
缺点:
酶固定化时酶 的活力有所损 失.
长期生产,易污 染,载体易降解, 酶易失活
增加了固定化的成 本,使工厂开始投 资大
只能用于可溶性 的底物和小分子 底物,对大分子 底物不适宜
三、固定化酶制备
基本原则:
必须注意维持酶的催化活性及专一性。
✓ 酶与载体的结合部位不应当是酶的活性部位(酶 活性中心的氨基酸残基不发生变化)
复使用。 固定化酶应有最大的稳定性,所选载体不与废物、
产物或反应液发生化学反应。 固定化酶成本要低,以利于工业使用。
酶的固定化方法
吸附法(包括电吸附法) 结合法(无机多孔材料) 交联法(双功能试剂) 包埋法(微胶囊法)
(一) 吸附法
应用实例:固定化乳糖酶-连续生产低乳糖奶
乳糖不耐症
固定化乳糖酶
酶生物反应器
✓与固定化酶技术相配套的是 酶生物反应器
✓同一般的化工容器一样,需要对酶反应 器温度和pH等条件进行严格的控制; ✓不同的是,酶反应器必须进行无菌操作。
固定化酶研究历史
(1) 1916,Nelson和Griffin发现蔗糖酶结合于骨炭末上 仍具有活力,但未引起人们重视。 (2) 1953,Grubhofer和Schloith将聚氨基聚苯乙烯树脂 重氮化后与淀粉酶、蛋白酶结合——最早固定化酶 (3) 60年代后期,固定化技术迅速发展起来。1969年,日 本的千烟一郎首次在工业上生产应用固定化氨基酰化酶从DL氨基酸连续生产L-氨基酸,实现了酶应用史上的一大变革。 (4)在1971年召开的第一次国际酶工程学术会议上,确定 固定化酶的统一英文名称为Immobilized enzyme。
DEAE:二乙氨基乙基 TEAE:四乙氨基乙基
+ -+
+-+ -
-
-
+++++
++ -+
-
--
-
-+ -+ +
+++++
制备方法: 在一定PH、温度、离子强度等条件下,将酶液与载体
混和搅拌几个小时,或将酶液缓慢流过处理好的离子交换 柱,使酶结合于离子交换剂上而制得。
特点: 优点:条件温和,操作简便,活力损失小,结合量大。 缺点:由于离子键结合力弱,酶与载体之间结合不牢 固,在pH、离子强度等条件改变时,酶易脱离。
O
H2N
E
H2N
NH2 +
O
H2N
EN
N
N
O N
EN
N
H2N
E
N
N
O
NE N
例:采用天然高分子聚合物几丁质作载体,以戊二醛为交 联剂,通过化学交联反应将纤维素酶固定在几丁质上,在 戊二醛浓度1.25%,pH值4.0时固定纤维素酶,该固定化 酶的半衰期为60天。用于降解壳聚糖,效果明显。
交联法反应条件比较激烈,固定化的酶活回收率一般较低, 但是尽可能降低交联剂浓度和缩短反应时间将有利于固定化 酶比活的提高。
单独使用交联法所得到的固定化酶颗粒小、机械性能差,酶 活低,故常与其他方法联用
酶分子之间共பைடு நூலகம்交联和与水不溶性载体共价偶联
酶分子: (a)酶分子之间用双功能基团的化学交联试剂相互交联成水不溶性的固定化酶 (b)酶分子被偶联到水不溶性载体上形成水不溶性的固定化酶
交联法的形式
交联法有2种形式
酶直接交联法 酶辅助蛋白交联法
1、酶直接交联法
在酶液中加入适量多功能试剂,使其形成不溶性衍生物 。固定化依赖酶与试剂的浓度、溶液pH和离子强度、温 度和反应时间之间的平衡。
操作简单,但固定化过程条件控制相对比较困难、制备 的固定化酶活力回收率相对较低、形成的固定化酶机械 强度不足。
2、酶辅助蛋白交联(共交联法)
先将酶吸附在不溶于水的载体上,再用双功能试剂 戊二醛与酶蛋白的氨基之间交联起来,形成酶网包围在 载体表面。
常用载体:硅胶、离子交换树脂。
(四) 包埋法(entrapping method)
应用实例1:固定化青霉素酰化酶,只要改变pH值等条件, 就可以生成不同的产物。
应用实例2:制造人工肾:利 用固定化脲酶透析液和活性 炭一起制成的体外循环装置 ,大大提高了疗效。
45
➢ 是指将酶或含酶微生物包裹在多孔的载体中。 凝胶包埋法
2. 共价键结合法(covalent binding)
通过共价键将酶与载体结合的固定化方法称为共价键结合法。
将酶分子上非活性部位功能团与载体表面功能基团进行共价 结合的方法。
非
E
水
溶
E
性
载
E
体
E
优点:酶与载体结合牢固,酶不易脱落
缺点:反应条件较激烈,酶易失活,同 时,制作手续亦较繁琐。
常用载体
Ceramic balls
porous glass
细菌屋
经过石英砂固定化 酶柱的淀粉溶液
淀粉溶液
载体 活性炭 多孔玻璃 氧化铝 碳酸钙凝胶 纤维素
麸素 硅胶
固定化酶 α -淀粉酶、β -淀粉酶、蔗糖转化酶、葡萄糖淀粉酶 核糖核酸酶、木瓜蛋白酶、脂肪酶、葡萄糖氧化酶 葡萄糖氧化酶 亮氨酸氨肽酶 胰蛋白酶、核糖核酸酶 Β-淀粉液化酶 磷酸化酶
最普遍的基团是:氨基、羧基以及苯环
共价键结合法制备固定化酶的“通式”
载体上引 进活泼基 团
活化该活 泼基团
该活泼基 团再与酶 分子上某 一基团形 成共价键
载体活化方法
重氮法
载体活化 方法
烷基 化法
叠氮法
溴化 氢法
共价结合法与离子结合法或物理吸附法相比:
优点:酶与载体结合牢固,一般不会因底物浓度高或 存在盐类等原因而轻易脱落。 缺点:
交联法使用的交联剂是戊二醛、己二 胺、双偶氮苯等水溶性化合物。
OH(CH2)3CHO+E
-CH=N-E-N=CH(CH2)3CH=N-E-N=CHN CH
(CH2)3 CH N -CH=N-E-N=CH(CH2)3CH=N-E-N=CH-
戊二醛有2个醛基,这2个醛基都可与酶或蛋白质的游离氨 基反应,形成席夫(Schiff)碱,而使酶或菌体蛋白交联 ,制成固定化酶或固定化菌体。
