蛋白质组学ppt
合集下载
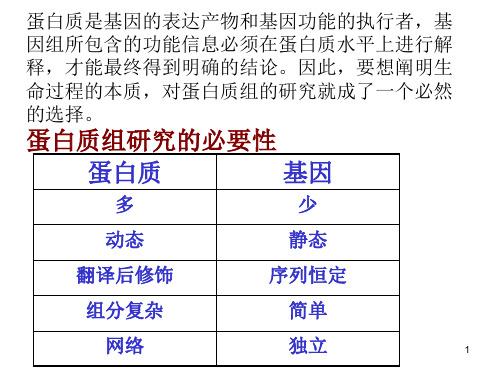
蛋白质组学PPT课件

代谢性疾病蛋白质组学研究通过对糖尿病、肥胖症等代谢 性疾病相关蛋白质的分析,发现了一些与代谢过程密切相 关的关键蛋白质。这些蛋白质涉及糖代谢、脂肪代谢等多 个方面,为药物研发和个体化治疗提供了新的思路和靶点 。同时,对代谢性疾病蛋白质组学的研究也有助于深入了 解疾病的发病机制,为疾病的预防和治疗提供科学依据。
蛋白质组学揭示基因表达 的复杂性
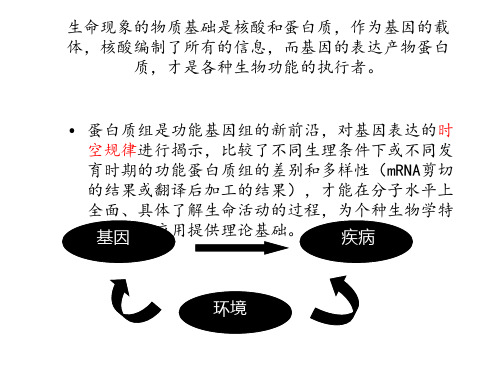
蛋白质组学研究关注基因表达的最终产物蛋白质,揭示了基因表达的复杂性和多样性 。蛋白质的表达和功能受到多种因素的影响 ,如翻译后修饰、蛋白质相互作用等,这些
因素在基因组学研究中难以全面考虑。
蛋白质组学与代谢组学的关系
代谢组学为蛋白质组学提供上下文
代谢组学研究生物体内小分子代谢物的变化,为蛋白质组学提供了上下文和背景。蛋白 质的功能和表达往往与代谢物的变化相互关联,了解代谢物的变化有助于更深入地理解 Nhomakorabea02
蛋白质组学研究技术
蛋白质分离技术
双向凝胶电泳技术
通过改变电泳的pH值和电场强度, 将复杂的蛋白质混合物分离成多 个有序的蛋白质带,以便后续的 鉴定和分析。
蛋白质芯片技术
将蛋白质固定在固相支持物上, 通过与特定的配体或抗体相互作 用,实现对蛋白质的快速、高通 量筛选和检测。
蛋白质免疫沉淀技
术
利用抗体与目标蛋白质的特异性 结合,将目标蛋白质从复杂的混 合物中分离出来,常用于蛋白质 相互作用的研究。
详细描述
癌症蛋白质组学研究通过对癌症细胞和正常细胞蛋白 质表达谱的比较,发现了一系列与癌症发生发展相关 的关键蛋白质。这些蛋白质涉及细胞信号转导、细胞 周期调控、细胞凋亡等多个方面,为癌症治疗提供了 潜在的药物靶点。
案例二:神经退行性疾病蛋白质组学研究
蛋白质组学-PPT课件

iTRAQ 结构
iTRAQ包括三部分:报告部分、肽反应部分、平 衡部分。 1、报告部分:有八种,因此iTRAQ可同时标记8 组样品。 2、肽反应部分:能与肽N端及赖氨酸侧链发生共 价连接而标记上肽段,几乎可以标记所有蛋白质。 3、平衡部分:保证iTRAQ标记的同一肽段的质荷 比相同。
辉骏生物:fitgene/
辉骏生物:fitgene/
免费服务热线:400-699-1663
2:蛋白质组学研究内容
2.1:蛋白质的表达模式 (1)生理、病理或不同发育状态下蛋白质组表达差异蛋白质信息库。 (2)蛋白质及其组成质点的分离、分析、鉴定。 2.2:蛋白质的功能模式 (1)蛋白质结构分析。 (2)蛋白之间相互作用,翻译后修饰,细胞定位等。
3: 化学标记法—iTRAQ
简介:
iTRAQ试剂是可与氨基酸末端氨基及赖氨酸侧链氨基连接的胺标记同重元素。在质谱图 中,任何一种iTRAQ试剂标记不同样本中的同一蛋白质表现为相同的质荷比。 在串联质谱 中,信号离子表现为不同质荷比(113-119,121)的峰,因此根据波峰的高度及面积,可以 鉴定出蛋白质和分析出同一蛋白质不同处理的定量信息。
辉骏生物:fitgene/
免费服务热线:400-699-1663
1:双向电泳
基于2D-PAGE 的经典定量分 析方法。 1、样品准备 和定量:抽提 对照组和各种 不同实验组的 蛋白质。 2、蛋白质分 离:蛋白质经 过2D-PAGE分离 后染色(银染、 考染等)。 3、蛋白质的 定性与定量分 析:通过与对 照组相Image Master 7.0分 析出实验组中 差异点,质谱 鉴定差异点蛋 白质,同时应用 软件分析出其 表达量的变化。
辉骏生物:fitgene/
蛋白质组学ppt
电转印到膜上
图像分析
Western blot检测
选择目标蛋白斑点,胶内酶切
质谱分析(MALDI/TOF或ESI/MS/MS)
获得肽质量指纹谱或肽序列标签
数据库检索鉴定蛋白质
Western blot、 免疫组化验证 蛋白质并确定 其定位
根据氨基酸序 列合成寡核苷 酸探针,克隆 基因
蛋白质功能研究,包 括蛋白质生物活性、 抗体制备、蛋白质相 互作用等方面
7
3.2.3 蛋白质组研究技术
一、双向凝胶电泳技术 二、液相色谱技术 三、生物质谱技术与蛋白质鉴定 四、蛋白质相互作用的研究技术
8
一、双向凝胶电泳技术 (一)2-DE的概念 two dimensional gel electrophoresis
• 2-DE是指第一向的固相pH梯度(immobilized pH gradient,IPG)等电聚焦电泳与第二向SDSPAGE组成的分离系统,也称双向聚丙烯酰胺凝 胶电泳,简称2-DE。等电聚焦电泳是基于蛋白质 等电点(pI)的差异进行分离,SDS-PAGE则是 根据蛋白质分子量(Mw)的不同进行分离。
22
(三)双向凝胶电泳图谱的计算机分析 • 细胞或组织样本经2-DE分离后,得到一张含有成
百上千个蛋白质斑点的凝胶电泳图谱。凝胶图谱 分析包括确定蛋白质斑点的位置、大小、染色深 浅、pI和分子量;图谱间的比较、差异蛋白质斑 点的确定;图谱质量的优化、数据的储存管理、 数据库分析等内容。借助先进的计算机技术和生 物信息学工具,能客观、有效地从电泳图谱中提 取到有价值的信息。
记等
19
(一)考马斯亮蓝染色
考马斯亮蓝染色是最常用的蛋白质染色 方法。考马斯亮蓝R-250化学名为三苯基甲 烷,R代表红蓝色。考马斯亮蓝R-250与蛋 白质的碱性基团可逆结合,染色线性范围 可达1~55μg,灵敏度为30~100ng蛋白质 。考马斯亮蓝染色的最大优点是染色重复 性好,操作简便,不影响后续的质谱鉴定 ,灵敏度比常用的氨基黑高100倍,但低于 银染色和荧光染色,不能满足对低丰度蛋 白质的检测要求,样品用量大。
蛋白质组学PPT课件

功能蛋白质组学 结构蛋白质组学
.
11
人类蛋白质组学研究进展
2001年成立国际人类蛋白质组组织(HUPO), 2003.12.15启动两个首批行动计划 1.人类肝脏蛋白质组计划(HLPP)由中国军事医学科学
院副院长贺福初院士领导,16国80多个实验室参加。 中国第一次领导重大国际协作计划。 2. 人类血浆蛋白质组计划(HPPP)由美国科学家牵头, 13国47个实验室参加。
双向电泳后的凝胶
经染色后蛋白呈现二维
分布图: 水平方向反映出蛋
白在pI上的差异, 垂直方向反映出它
聚焦后凝 胶放置在 SDS凝胶 上,进行 第二向电 泳
们在分子量上的差别。
第二向电泳: SDS-PAGE
pH9
.
pH9
pH3
分子量大 分子 量小
pH3
18
(1)等电聚焦 凝胶电泳 ( IFE)
利用载体两 性电解质在电场 作用下沿电场方 向在凝胶内形成 一个连续而稳定 的pH梯度。
根据一定的配方计算后,将适宜的IPG试剂添加至混 合物中用于凝胶聚合,在聚合中缓冲基团通过乙烯键共 价聚合至聚丙烯酰胺骨架中而形成pH梯度。通过这种方 式生成的IPG不会发生电渗作用,因而可以进行特别稳 定的IEF分离达到真正的平衡状态。
.
5
第一节 蛋白质组及蛋白质组学基本概念
.
6
什么是蛋白质组?
蛋白质组(proteome):
PROTEOME = PROTE in +genOME Proteins expressed by a genome.
是指“特定细胞、组织乃至机体作为一个 生命单元中所有蛋白质的集合,即生命体中携 带的基因信息在某一时段所表达的全部蛋白质。
蛋白质组学PPT课件
蛋白质组定义
1,基因组表达的全部蛋白质。 2,在一种细胞/组织内存在的全部蛋白 质。
Proteome
• 1994 M.Wilkins and K.W.Williams
•
Macquarie University in Sydney
• Total Proteins Complement of a Genome
环境
ቤተ መጻሕፍቲ ባይዱ
REAL COMPLEXITY…
IS IN CELLULAR ROTEOMES • BEYOND THE GENOME… • Tissue Specific Expression • Alternate Splicing, (1/3 of all genes) • Post-Translational Modifications
Functional
Proteomics
• During human development, cell express different proteins
• Normal and cancer cells express different proteins
• Cell treated with and without drug express different proteins
– Types and Level:
– Signal Sequence cleavage – Glycosylation
– Phosphorylation – Farnylation – Isoprenylation – Acetylation
• All combine > 100-1000 fold increase in complexity
蛋白质组学总结ppt课件

如有可能,可加入强变性剂:
8 mol/L 尿素、 10% TCA 或 2% SDS。
但在上述条件时,仍有些蛋白酶保持一定活性,所以 需要加入蛋白酶抑制剂防止蛋白降解。
13
四、通过沉淀分离蛋白 分离策略: 沉淀蛋白质,使之与其它成份分开,再重悬溶解蛋白 质。 附带作用: 浓缩较稀的样品(如植物、尿液等)。 注意: 某些蛋白会由于重悬造成一定的丢失。
11
二、剧烈的裂解方法 用于难以破碎的细胞,如固体组织内的细胞,或具有 坚硬细胞壁的细胞,比如酵母。 1)超声裂解法。 2)弗氏压碎法。 3)研磨法。 4)机械匀浆法。 5)玻璃珠匀浆法。
12
三、用蛋白酶抑制Байду номын сангаас防止蛋白裂解 细胞裂解,蛋白酶释放出来,必须加以抑制。
蛋白酶在低温下无活性,所以尽量在低温制备。
一个细胞内的全套蛋白质,反映特殊阶段、环境、状
态下细胞或组织在翻译水平的蛋白表达谱。
2
2、技术路线与相关技术
技术路线
蛋白提取 样品 酶切消化 蛋白混合物
双向电泳 蛋白图谱 肽段 数据库 酶切消化
肽段混合物 双向电泳
质谱分析 数据库检索 质谱数据
3
第二章 蛋白质组研究方法
蛋白质组的技术基础 (三大支撑技术): 双向电泳(2-DE),可以分离数千种蛋白质。 生物质谱技术,精确测定多肽质量及序列。 计算机为基础的图像分析及相应数据库构建。
2 )冻融裂解:用液氮迅速冷冻细胞 (1-2 min) ,随后在
37℃ 融化(1-2 min) ,反复几次。
10
3 )去污剂裂解:主要用于组织细胞。含有去污剂的缓冲 液重悬细胞。 4 )酶裂解法:裂解植物、真菌和细菌等有细胞壁的细胞。 等渗缓冲液含有某种酶:
8 mol/L 尿素、 10% TCA 或 2% SDS。
但在上述条件时,仍有些蛋白酶保持一定活性,所以 需要加入蛋白酶抑制剂防止蛋白降解。
13
四、通过沉淀分离蛋白 分离策略: 沉淀蛋白质,使之与其它成份分开,再重悬溶解蛋白 质。 附带作用: 浓缩较稀的样品(如植物、尿液等)。 注意: 某些蛋白会由于重悬造成一定的丢失。
11
二、剧烈的裂解方法 用于难以破碎的细胞,如固体组织内的细胞,或具有 坚硬细胞壁的细胞,比如酵母。 1)超声裂解法。 2)弗氏压碎法。 3)研磨法。 4)机械匀浆法。 5)玻璃珠匀浆法。
12
三、用蛋白酶抑制Байду номын сангаас防止蛋白裂解 细胞裂解,蛋白酶释放出来,必须加以抑制。
蛋白酶在低温下无活性,所以尽量在低温制备。
一个细胞内的全套蛋白质,反映特殊阶段、环境、状
态下细胞或组织在翻译水平的蛋白表达谱。
2
2、技术路线与相关技术
技术路线
蛋白提取 样品 酶切消化 蛋白混合物
双向电泳 蛋白图谱 肽段 数据库 酶切消化
肽段混合物 双向电泳
质谱分析 数据库检索 质谱数据
3
第二章 蛋白质组研究方法
蛋白质组的技术基础 (三大支撑技术): 双向电泳(2-DE),可以分离数千种蛋白质。 生物质谱技术,精确测定多肽质量及序列。 计算机为基础的图像分析及相应数据库构建。
2 )冻融裂解:用液氮迅速冷冻细胞 (1-2 min) ,随后在
37℃ 融化(1-2 min) ,反复几次。
10
3 )去污剂裂解:主要用于组织细胞。含有去污剂的缓冲 液重悬细胞。 4 )酶裂解法:裂解植物、真菌和细菌等有细胞壁的细胞。 等渗缓冲液含有某种酶:
蛋白质组学及技术介绍通用课件

详细描述
蛋白质组学技术可以对蛋白质相互作用进行系统研究,发现新的药物靶点,并对药物作用过程中蛋白 质的应答变化进行监测,从而对新药进行有效的筛选和评价。同时,蛋白质组学还可以用于研究药物 的作用机制,解析药物在体内的生物过程,为新药的研发提供重要的理论支持。
生物进化研究
总结词
蛋白质组学在生物进化研究中的应用主要表 现在对不同物种间蛋白质结构和功能的比较 分析,揭示生物进化的规律和机制。
动物实验伦理
减少动物使用
尽量采用其他替代方法,减少动物的使用数量和痛苦。
优化实验方案
在必须使用动物的情况下,应优化实验方案,尽量减少动物的痛苦 和死亡。
严格遵循法律法规
遵守国家和地区的动物保护法律法规,确保实验的合法性。
数据共享与知识产权保护
数据共享
鼓励在学术领域内共享数据,促进科研合作和知识进步。
详细描述
蛋白质组学通过对不同物种间相似蛋白质的 同源性进行分析,可以发现物种间的亲缘关 系和进化历程。同时,蛋白质组学还可以通 过对蛋白质结构和功能的比较分析,发现物 种间在适应环境变化过程中产生的蛋白质变 异和进化机制。这些研究对于深入理解生物
进化的过程和机制具有重要意义。
04
蛋白质组学研究展望
通过测定蛋白质的氨基酸序列,确定蛋白质的组成和 结构。
质谱分析
通过测量蛋白质离子的质量和电荷比值,推断蛋白质 的分子量和肽链组成。
数据库搜对,确定蛋白质的身份。
蛋白质定量技术
同位素标记技术
01
通过同位素标记目标蛋白质,利用其与未标记蛋白质在质谱中
鉴定蛋白质之间的相互作用关系,了解蛋白 质的功能网络。
蛋白质修饰分析
研究蛋白质的翻译后修饰,如磷酸化、糖基 化、乙酰化等,以揭示其调控机制。
蛋白质组学技术可以对蛋白质相互作用进行系统研究,发现新的药物靶点,并对药物作用过程中蛋白 质的应答变化进行监测,从而对新药进行有效的筛选和评价。同时,蛋白质组学还可以用于研究药物 的作用机制,解析药物在体内的生物过程,为新药的研发提供重要的理论支持。
生物进化研究
总结词
蛋白质组学在生物进化研究中的应用主要表 现在对不同物种间蛋白质结构和功能的比较 分析,揭示生物进化的规律和机制。
动物实验伦理
减少动物使用
尽量采用其他替代方法,减少动物的使用数量和痛苦。
优化实验方案
在必须使用动物的情况下,应优化实验方案,尽量减少动物的痛苦 和死亡。
严格遵循法律法规
遵守国家和地区的动物保护法律法规,确保实验的合法性。
数据共享与知识产权保护
数据共享
鼓励在学术领域内共享数据,促进科研合作和知识进步。
详细描述
蛋白质组学通过对不同物种间相似蛋白质的 同源性进行分析,可以发现物种间的亲缘关 系和进化历程。同时,蛋白质组学还可以通 过对蛋白质结构和功能的比较分析,发现物 种间在适应环境变化过程中产生的蛋白质变 异和进化机制。这些研究对于深入理解生物
进化的过程和机制具有重要意义。
04
蛋白质组学研究展望
通过测定蛋白质的氨基酸序列,确定蛋白质的组成和 结构。
质谱分析
通过测量蛋白质离子的质量和电荷比值,推断蛋白质 的分子量和肽链组成。
数据库搜对,确定蛋白质的身份。
蛋白质定量技术
同位素标记技术
01
通过同位素标记目标蛋白质,利用其与未标记蛋白质在质谱中
鉴定蛋白质之间的相互作用关系,了解蛋白 质的功能网络。
蛋白质修饰分析
研究蛋白质的翻译后修饰,如磷酸化、糖基 化、乙酰化等,以揭示其调控机制。
蛋白质组学及技术介绍PPT通用课件.ppt

拖尾"point streaking") 。
3.二相SDS-PAGE
丙烯酰胺/甲叉双丙烯 酰胺溶液
分离胶缓冲液
10%(w/v)过硫酸铵 溶液
(30.8%T,2.6%C):30%(W/V)丙烯酰胺和 0.8%甲叉双丙烯酰胺的水溶 液。将 300g 丙烯酰胺和 8g 甲叉双丙烯酰胺溶解于去离子水中,最后用去离
研究 内容
蛋白质的研究内容主要有两方面:
1、结构蛋白质组学:主要是蛋白质表达模型的研究,包括蛋白质氨基酸序列 分析及空间结构的解析种类分析及数量确定; 2、功能蛋白质组学:主要是蛋白质功能模式的研究,包括蛋白质功能及蛋白 质间的相互作用。
研究 内容
蛋白质组学可分为三个主要领域: 1、蛋白质的微特性以供蛋白质的规模化鉴定和他们的后翻译饰; 2、“差异显示”蛋白质组学供蛋白质水平与疾病在广泛范围的有力应用比 较; 3、应用特定的分析技术如质谱法(包括串联质谱法、生物质谱法)或酵母 双杂交系统以及其他蛋白质组学研究新技术研究蛋白质-蛋白质相互作用。
该方法所研究的蛋白均是在体内经过翻译后修饰的,并且是可 分离的天然状态的相互作用蛋白复合物,能够反映正常生理条件下的 蛋白质间相互作用
蛋白质相互作用
2、酵母双杂交系统:
该系统利用真核细胞调控转录起始过程中,DN A结合结构域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域(activation domain, AD)启动所调节的基因的转录这一原理,将己知蛋白X和待研究蛋白Y的基 因分别与编码AD和BD的序列结合,通过载体质粒转入同一酵母细胞中表 达,生成两个融合蛋白。若蛋白X和Y可以相互作用,则AD和BD在空间上 接近就能形成完整的有活性的转录因子,进而启动转录,表达相应的报告 基因;反之,如果X和Y之间不存在相互作用,报告基因就不会表达。这样, 通过报告基因的表达与否,便可确定是否发生了蛋白质的相互作用。
3.二相SDS-PAGE
丙烯酰胺/甲叉双丙烯 酰胺溶液
分离胶缓冲液
10%(w/v)过硫酸铵 溶液
(30.8%T,2.6%C):30%(W/V)丙烯酰胺和 0.8%甲叉双丙烯酰胺的水溶 液。将 300g 丙烯酰胺和 8g 甲叉双丙烯酰胺溶解于去离子水中,最后用去离
研究 内容
蛋白质的研究内容主要有两方面:
1、结构蛋白质组学:主要是蛋白质表达模型的研究,包括蛋白质氨基酸序列 分析及空间结构的解析种类分析及数量确定; 2、功能蛋白质组学:主要是蛋白质功能模式的研究,包括蛋白质功能及蛋白 质间的相互作用。
研究 内容
蛋白质组学可分为三个主要领域: 1、蛋白质的微特性以供蛋白质的规模化鉴定和他们的后翻译饰; 2、“差异显示”蛋白质组学供蛋白质水平与疾病在广泛范围的有力应用比 较; 3、应用特定的分析技术如质谱法(包括串联质谱法、生物质谱法)或酵母 双杂交系统以及其他蛋白质组学研究新技术研究蛋白质-蛋白质相互作用。
该方法所研究的蛋白均是在体内经过翻译后修饰的,并且是可 分离的天然状态的相互作用蛋白复合物,能够反映正常生理条件下的 蛋白质间相互作用
蛋白质相互作用
2、酵母双杂交系统:
该系统利用真核细胞调控转录起始过程中,DN A结合结构域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域(activation domain, AD)启动所调节的基因的转录这一原理,将己知蛋白X和待研究蛋白Y的基 因分别与编码AD和BD的序列结合,通过载体质粒转入同一酵母细胞中表 达,生成两个融合蛋白。若蛋白X和Y可以相互作用,则AD和BD在空间上 接近就能形成完整的有活性的转录因子,进而启动转录,表达相应的报告 基因;反之,如果X和Y之间不存在相互作用,报告基因就不会表达。这样, 通过报告基因的表达与否,便可确定是否发生了蛋白质的相互作用。
微生物蛋白质组学ppt课件

■ 互补与互助
— 在后基因组时代,蛋白质组研究和基因组研究依然是形影相随的两个重要领 域。基因组与蛋白质组之间既为互相补充又能互相帮助。
— mRNA是介于基因和蛋白质之间的中间产物。因为mRNA既是基因的产物, 又比蛋白质要容易分析,所以,研究mRNA的表达模式也是了解基因组和蛋 白质组的一个重要途径。由此专门形成了一个新的研究领域:转录组。研究 转录组的主要手段是基因芯片技术、SAGE(基因表达序列分析)技术。
羟肉桂酸)中,基质吸收激光提供的能量而蒸发,携带部分样品分子进入 气相,并将一部分能量传递给样品分子使其离子化。
飞行时间质谱(TOFMS)由离子源(S)引出极、漂移区(D)和检测器组成。 当离子在离子源内形成后在离子源内电场E的作用下进入无场漂移区。在理想状 态下,所有进入漂移区的离子具有相同的动能(KE). 测定离子在漂移区内的飞行时间即可计算出它的质荷比。
蛋白质分离 技术双Fra bibliotek电泳和差异凝胶电泳
■ 双向电泳(Two dimension elctrophresis,2DE)是根据不同蛋白质 等电点和分子量的不同利用第一向等电聚焦和第二向SDS-PAGE电泳 将蛋白质混合物中的各种蛋白分离开。 ■ 差异凝胶电泳(differential gel electrophoresis,DIGE)是在2DE基 础上建立的蛋白质分离技术。该方法将待比较的两个样品蛋白质分别 用不同的荧光染料(Cy2、Cy3、Cy5)进行标记后,等量混合再进行双 向电泳。由于荧光染料的发光波长不同,可以在一块凝胶上检测两个 样品,并通过蛋白点不同荧光信号间的比率确定蛋白量的差异。
离子源
引出极 漂移管D
压加 速 电
+ +
+
S
D
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
从局部入手研究蛋白质组的各个功能亚群体。 从局部入手研究蛋白质组的各个功能亚群体。
将多个亚群体组合起来, 将多个亚群体组合起来,逐步描绘出接近于生 命细胞的“全部蛋白质”的蛋白质组图谱。 命细胞的“全部蛋白质”的蛋白质组图谱。
发展进展
各国政府支持, 各国政府支持,国际著名研究和商业机构 加盟: 加盟: 1996年澳大利亚建立了世界上第一个蛋白 1996年澳大利亚建立了世界上第一个蛋白 质组研究中心( 质组研究中心(Australia Proteome Facility,APAF) Analysis Facility,APAF)
临床样本都是各种细胞或组织混杂, 临床样本都是各种细胞或组织混杂, 而且状态不一, 而且状态不一,如肿瘤中癌变的上皮类 细胞总是与血管、基质细胞等混杂。 细胞总是与血管、基质细胞等混杂。
激光捕获显微切割(laser 激光捕获显微切割(laser capture microdissection, microdissection,LCM)
蛋白质组学(proteomics) 蛋白质组学(proteomics)
指应用各种技术手段来研究蛋白质组的一门新兴 科学, 科学,其目的是从整体的角度分析细胞内动态变 化的蛋白质组成成份、表达水平与修饰状态, 化的蛋白质组成成份、表达水平与修饰状态,了 解蛋白质之间的相互作用与联系, 解蛋白质之间的相互作用与联系,揭示蛋白质功 能与细胞生命活动规律。 能与细胞生命活动规律。
样品预分级的主要方法
蛋白质溶解性:可溶性蛋白、 蛋白质溶解性:可溶性蛋白、非溶性蛋白等 蛋白质定位:膜蛋白、核蛋白等 蛋白质定位:膜蛋白、 蛋白质细胞器定位:线粒体、高尔基体、 蛋白质细胞器定位度蛋白质的上样量和检测灵 敏度。 敏度
组织水平上的蛋白质组样品制备
Celera公司投资上亿美元独自启动了全 Celera公司投资上亿美元独自启动了全 面鉴定和分类汇总人类组织、 面鉴定和分类汇总人类组织、细胞和体 液中的蛋白质及其异构体, 液中的蛋白质及其异构体,构建新一代 的蛋白质表达数据库的工作。 的蛋白质表达数据库的工作。
1997年召开了第一次国际“蛋白质组学”会议 年召开了第一次国际“蛋白质组学” 年召开了第一次国际
负
染
能专门提高PAGE胶上蛋白质的回收率,但不能用于膜 上染色。 结果表现为胶面着色而蛋白质点透明。 速度快(5~15min),蛋白质的生物活性能保持:一旦 用络合剂如EDTA或Tris/甘氨酸转移缓冲液来络合金属 离子就可进行提取来转移蛋白质。 它主要适用于蛋白质显色、完整蛋白质的胶上被动提取 以及质谱分析。 该技术主要包括金属盐染料、锌-咪唑染料等的使用。
Genomics (基因组学) Post-genomic science (后基因组时代)
Functional genomics (功能基因组学)
转录组学) Proteomics (蛋白质组学) Metabolomics (代谢组学) Structural genomics (结构基因组学)
Aim - 3D structures of all protein folds !
2003 成 立 了 中 国 人 类 蛋 白 质 组 组 织 ( CHHUPO ) , 并 分 别 于 2003 年 9 月 、 2004年 8月以及 月以及2005年 8月召开了中国蛋白 年 月以及 年 月召开了中国蛋白 质组学首届、 第二届及第三届学术大会, 质组学首届 、 第二届及第三届学术大会 , 2004年 10月在中国北京召开了第三届国际 年 月在中国北京召开了第三届国际 蛋白质组学会议。 蛋白质组学会议。
Transcriptomics(
主要内容
第一节 第二节 第三节
蛋白质组学的概念及发展进展 蛋白质组表达模式的研究方法 蛋白质组功能模式的研究方法
第一节 蛋白质组学的概念及发展进展 蛋白质组学的概念及发展进展
蛋白质组和蛋白质组学的概念
蛋白质组( ):PROTEins + genOME,意 蛋白质组(proteome): ): , 思是Proteins expressed by a genome(基因组表达的 思是 ( 所有蛋白质)。 所有蛋白质)。 1994年由 年由Williams和Wilkins提出,是一个动态的概念, 提出, 年由 和 提出 是一个动态的概念, 指的是不同细胞在不同时相表达不同的蛋白质。 指的是不同细胞在不同时相表达不同的蛋白质。
基因组
转录组
蛋白组
♦ The study of proteins expressed by genomes ♦ Completion of the sequencing of the 1st draft of human genome
indicates there are approximately 250,000 proteins in the human genome ♦ Only 2-5% of proteins in human genome have been identified
新型非凝胶技术
液相色谱法 liquid chromatography,LC , 毛细管电泳 capillary electrophoresis,CE ,
(三)常见蛋白质显色技术
考马斯亮蓝染色
常见显色方法比较
考染和银染的比较 考染和银染的比较
有机染料和银染
考染灵敏度为30~100ng,线性范围是20倍;银染 的线性范围是40倍,灵敏度是考染的100倍。 胶体考马斯亮蓝染色技术可实现PAGE的无背景 染色,其极限灵敏度为8~10ng,但这种染液会对 8~10ng 蛋白质进行修饰而影响质谱分析的结果。 胺基黑常用于转印至聚偏二氟乙烯(PVDF)和/ 或硝酸纤维素膜上的蛋白质的染色。 银染的缺点是:对某些种类的蛋白质染色效果差, 对其后的蛋白质测序和质谱分析造成影响。 这两种染色技术都可减少胶内蛋白质产量。
科技部已将疾病蛋白质组研究列入我国“ 科技部已将疾病蛋白质组研究列入我国“973” 计划项目和“ 计划项目; 计划项目和“863”计划项目;国家自然科学基 计划项目 金委员会也将“蛋白质组研究”列为重点项目。 金委员会也将“蛋白质组研究”列为重点项目。 我国在鼻咽癌、白血病、 我国在鼻咽癌、白血病、肝癌和肺癌蛋白质组 研究方面取得了较大的进展。 研究方面取得了较大的进展。
蛋白质组: 蛋白质组:
对应于基因组的所有蛋白质构成的整体, 对应于基因组的所有蛋白质构成的整体,不是 局限于一个或几个蛋白质。 局限于一个或几个蛋白质。 同一基因组在不同细胞、 同一基因组在不同细胞、不同组织中的表达情 况各不相同 。 在空间和时间上动态变化着的整体。 在空间和时间上动态变化着的整体。
第二节 蛋白质组表达模式的研究方法
主要研究目标
研究蛋白质组组成成分、差异和功能
(一)蛋白质组研究中的样品制备
通常可采用细胞或组织中的全蛋白质组 分进行蛋白质组分析。 分进行蛋白质组分析。 也可以进行样品预分级, 也可以进行样品预分级,即将细胞或组 织中的全体蛋白质分成不同部分, 织中的全体蛋白质分成不同部分,分别 进行研究。 进行研究。
胶体扩散染料
主要用于高灵敏度检出电转印至硝酸纤维素和 PVDF膜上的蛋白质,不用于胶内染色。 最好的胶体金染色的灵敏度与PAGE胶内的银 染类似。 这种技术主要包括印度墨水染料、胶体金属染 料等。
有机荧光团染料
包括共价结合和非共价结合的荧光团染料两类。后者最为常 用,其典型代表是已经商品化的SYPRO Red、 Orange、 Ruby等荧光染料。 这三种染料可对SDS-PAGE胶内蛋白质进行一步染色,约 30~60min完成,灵敏度为2~10ng。染色后的凝胶用标准的 实验室300nm紫外透射仪进行照像保存,其线性范围为3个 数量级。 这三种染料的电泳染色结果与在酵母中通过SAGE所获得的 基因表达水平的动态范围相匹配。 在Tris/甘氨酸转印缓冲液中染色后,蛋白质可被转印至膜上 并进行免疫染色或Edman测序来鉴定蛋白质。
金属螯合染料
这是一类与现代蛋白质组学研究相兼容的、相对较新 的蛋白质显色试剂,其设计专门与常用微量化学表征 过程兼容。它们不包含戊二醛、甲醛或Tween-20等, 很容易和集成化蛋白质组学平台(包括自动化凝胶染 色仪、图像分析工作站、机器人剪切仪器、蛋白质酶 解工作站和质谱仪等)相结合。 其中SYPRO Ruby也是一种基于钌的金属发光染料。
功能蛋白质组学 (functional proteomics)的提出 的提出
功能蛋白质组: 功能蛋白质组:细胞在一定阶段或与某一生理 现象相关的所有蛋白质。 现象相关的所有蛋白质。 介于对个别蛋白质的传统蛋白质化学研究和以 全部蛋白质为研究对象的蛋白质组学之间。 全部蛋白质为研究对象的蛋白质组学之间。
美国国立癌症研究院(NCI)投资1 000万 美国国立癌症研究院(NCI)投资1 000万 美元建立肺、直肠、乳腺、 美元建立肺、直肠、乳腺、卵巢肿瘤的蛋 白质组数据库。 白质组数据库。 NCI和FDA共同投资 NCI和FDA共同投资数百万美元建立癌症不同 阶段的蛋白质组数据库。 阶段的蛋白质组数据库。 英国建立三个蛋白质组研究中心对已完成 或即将完成全基因组测序的生物体进行蛋 白质组研究。 白质组研究。
蛋白质组学
背 景
基因数量有限性和基因结构的相对稳定性 VS 生命现象的复杂性和多变性 从genomic到proteome
对蛋白质的数量、结构、性质、相互关系和生 物学功能进行全面深入的研究已成为生命科学 研究的迫切需要和重要任务。
The era of ‘omics’-based science
蛋白质组研究包括两个方面: 蛋白质组研究包括两个方面:
Proteomics
表达蛋白组学
The study of global changes in protein expression
蛋白质组功能模式
The systematic study of proteinprotein interactions through the isolation of protein complexes
