高考化学一轮综合复习第2章化学物质及其变化课时4氧化还原反应的综合应用——配平、计算及滴定题型冲关练习
高考化学一轮复习 第2章 化学物质及其变化 第4节 氧化还原反应教案 新人教版

学习资料第四节氧化还原反应考纲定位要点网络1。
了解氧化还原反应的本质.2.了解常见的氧化还原反应。
根据化学式判断元素化合价。
3。
掌握常见氧化还原反应的配平和相关计算。
4。
能正确书写氧化还原化学方程式和离子方程式.氧化还原反应的概念与本质知识梳理1.氧化还原反应的有关概念(1)本质和特征(2)相关概念及其关系(3)常见的氧化剂和还原剂①常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物等.如:②常见还原剂常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。
如:③元素化合价处于中间价态的物质既有氧化性,又有还原性元素化合价处于中间价态的物质氧化产物还原产物Fe2+Fe3+FeSO错误!(H2SO3/SO2) SO错误!SH2O2O2H2O其中Fe2+、3232主要表现还原性,22主要表现氧化性.2.氧化还原反应与四种基本反应类型间的关系图示[辨易错](1)有单质参加或有单质生成的化学反应一定是氧化还原反应. ()(2)金属阳离子一定只具有氧化性. ( )(3)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。
()(4)某元素从游离态变为化合态,该元素可能被氧化也可能被还原。
( )(5)H2O2是一种绿色氧化剂,只有氧化性没有还原性。
()(6)在Cl2+2NaOH===NaCl+NaClO+H2O反应中,1 mol Cl2反应转移2 mol e-。
()[答案](1)×(2)×(3)×(4)√(5)×(6)×3.两种电子转移的表示方法(1)双线桥法:标变价―→画箭头―→标得失―→定数目。
示例:C与浓硫酸反应:(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得到”“失去”字样。
示例:Cu与浓硝酸反应:[深思考]对于MnO2+4HCl(浓)错误!MnCl2+Cl2↑+2H2O的反应(1)用双线桥表示电子转移的方向和数目。
2022年新教材高考化学一轮复习第2章物质及其变化第4讲氧化还原反应的基本概念和规律集训

第4讲氧化还原反应的基本概念和规律一、选择题:每小题只有一个选项符合题意。
1.(2021·河北省选择考模考)化学与生活密切相关。
下列叙述不涉及氧化还原反应的是( )A.牙膏中添加氟化物用于预防龋齿B.绿化造林助力实现碳中和目标C.氯化铁用于蚀刻金属眼镜架D.可降解包装材料的完全降解有利于减少白色污染解析:选A。
A.牙齿表面含有Ca5(PO4)3OH,使用含氟牙膏,会发生反应:Ca5(PO4)3OH(s)+F-(aq)Ca5(PO4)3F(s)+OH-(aq),使Ca5(PO4)3OH转化为更难溶的氟磷酸钙Ca5(PO4)3F,最终在牙齿表面形成难溶性的Ca5(PO4)3F,因此可预防龋齿,在转化过程中所有元素化合价均没有发生变化,因此不涉及氧化还原反应,A符合题意;B.绿化造林,通过绿色植物的光合作用将CO2转化为有机物,同时释放氧气,反应过程中元素化合价发生了变化,因此涉及氧化还原反应,B不符合题意;C.氯化铁具有强氧化性,能够与金属眼镜架中的一些金属如Cu发生氧化还原反应,产生FeCl2、CuCl2,C不符合题意;D.可降解包装材料完全降解一般变为CO2、H2O等,在该转化过程中元素化合价发生变化,有电子转移,因此涉及氧化还原反应,D不符合题意。
2.(2021·潍坊高三模拟)含元素碲(Te)的几种物质存在如图所示转化关系。
下列说法错误的是( )A.反应①利用了H2Te的还原性B.反应②中H2O做氧化剂C.反应③利用了H2O2的氧化性D.H2Te2O5转化为H2Te4O9发生了氧化还原反应解析:选D。
反应①中H2Te被O2氧化生成Te,利用了H2Te的还原性,故A正确;反应②中Te与H2O反应生成H2TeO3,Te元素化合价升高,做还原剂,则H2O为氧化剂,应有H2生成,故B正确;反应③中H2TeO3→H6TeO6,Te元素化合价升高,发生氧化反应,则H2O2做氧化剂,体现氧化性,故C正确;H2Te2O5转化为H2Te4O9时不存在元素化合价的变化,未发生氧化还原反应,故D错误。
高考化学一轮复习第二章化学物质及其变化第3节氧化还原反应课件

[典题示例] (2016·上海卷)O2F2 可以发生反应:H2S
+4O2F2===SF6+2HF+4O2,下列说法正确的是( ) A.氧气是氧化产物 B.O2F2 既是氧化剂又是还原剂 C.若生成 4.48 L HF,则转移 0.8 mol 电子 D.还原剂与氧化剂的物质的量之比为 1∶4
答案:D
氧化还原反应中电子转移数目的分析 1.基本方法:先标出熟悉元素的化合价,再根据化 合物中正负化合价的代数和为零的原则求解其他元素的 化合价。
2.熟记常见元素的化合价:一价氢、钾、钠、氟、 氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、 五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐 全;铜汞二价最常见。
(4)某元素从游离态变为化合态,该元素可能被氧化 也可能被还原。( )
(5)置换反应都是氧化还原反应,化合反应不都是氧 化还原反应。( )
答案:(1)× (2)× (3)× (4)√ (5)√
2.元素由化合态变为游离态,该元素一定被还原 吗?有单质参加或生成的反应一定是氧化还原反应吗?
答案:某元素由化合态变为游离态时,该元素不一定
3.明确一些特殊物质中元素的化合价。 CuFeS2:Cu+2 价 Fe+2 价 S-2 价 K2FeO4: Fe+6 价 Li2NH、LiNH2、AlN:N-3 价 Na2S2O3:S+2 价 MnO+2 :Mn+5 价 C2O24-:C +3 价 HCN:C+2 价 N-3 价 CuH:Cu+1 价 H-1 价 FeOn4-:Fe+(8-n)价 Si3N4:Si+4 价 N-3 价
高三化学一轮复习 2_9 氧化还原反应的配平及计算教学设计

第二章化学物质及其变化第九课时氧化还原反应的配平及计算〖复习目标〗(1)掌握常见氧化还原反应的配平和相关计算。
(2)能利用得失电子守恒原理进行相关计算。
〖教学重点〗常见氧化还原反应的配平和相关计算〖教学难点〗利用得失电子守恒原理进行相关计算〖教学过程〗【知识精讲】1、氧化还原方程式的书写及配平(1)推断反应物和产物根据氧化还原反应的原理,即氧化反应和还原反应同时发生,以及归中原理判断氧化剂和还原剂,氧化产物和还原产物。
(2)配平氧化还原反应的实质是反应过程中发生了电子转移,而氧化剂得电子总数(或元素化合价降低总数)必然等于还原剂失电子总数(或元素化合价升高总数),根据这一原则可以对氧化还原反应的化学方程式进行配平。
氧化还原反应化学方程式的配平步骤为:①标好价:正确标出反应前后化合价有变化的元素的化合价。
②列变化:列出元素化合价升高和降低的数值。
③求总数:求元素化合价升高和降低的总数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。
④配系数:用观察法配平其他各物质的化学计量数。
⑤细检查:利用“守恒”三原则(即质量守恒、得失电子守恒、电荷守恒),逐项检查配平的方程式是否正确。
(3)缺项补项在配平中缺项,一般通过质量守恒可以判断,更多时候考查H和O的缺项,如左边O多,可以采用O+2H+→H2O或O+H2O→2OH-;左边少O,可以H2O→2H++O或2OH-→H2O+O。
(4)抓住一个关键,掌握三个原则①一个关键准确判断并标出变价元素的化合价,求出化合价升降数及其最小公倍数,进而求得氧化剂、还原剂的化学计量数。
②三个原则a、反应前后各元素的原子个数相等。
b、氧化剂得电子总数与还原剂失电子总数相等。
c、反应前后各带电微粒所带电荷总数相等(离子反应)(5)配平的基本方法①全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
②自变从右边配:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
高考化学一轮复习第章化学物质及其变化第讲氧化还原反应课件新人教版

4.(2021·衡水模拟)现有下列三个反应:
①Cl2+FeI2===FeCl2+I2 ②2Fe2++Br2===2Fe3++2Br- ③Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O 下列说法正确的是( ) A.①②③中的氧化产物分别是 I2、Fe3+、CoCl2
√B.氧化性:Co2O3>Cl2>Fe3+
3.依据产物中元素价态的高低判断 (1)相同条件下,不同氧化剂作用于同一种还原剂时,氧化产物价态高的其 氧化性强。例如:
2.(2019·高考北京卷)下列除杂试剂选用正确且除杂过程不涉及氧化还原反
应的是( )
选项
物质(括号内为杂质)
除杂试剂
A
FeCl2 溶液(FeCl3)
Fe 粉
√B
NaCl 溶液(MgCl2)
C
Cl2(HCl)
NaOH 溶液、稀 HCl H2O、浓 H2SO4
D
NO(NO2)
H2O、无水 CaCl2
FeOn4-:Fe[+(8-n)]
Si3N4:Si(+4)、N(-3)
CuCl:Cu(+1)
Mg2B2O5·H2O:B(+3) MnO(OH):Mn(+3) VO+ 2 :V(+5) VO2+:V(+4)
S4O62-:S(+52) NaBH4:B(+3)、H(-1) Fe3O4:Fe(+2、+3) LiFePO4:Fe(+2)
C.根据反应①一定可以推理得到 Cl2+FeBr2===FeCl2+Br2 D.在反应③中,当有 1 mol Co2O3 参加反应时,有 1 mol HCl 被氧化
解析:三个反应中元素化合价升高所得的产物是 I2、Fe3+、Cl2,故 I2、 Fe3+、Cl2 是氧化产物,A 错误;氧化还原反应中,氧化剂的氧化性强于氧 化产物的氧化性,在反应①中,氧化性:Cl2>I2,在反应②中,氧化性: Br2>Fe3+,在反应③中,氧化性:Co2O3>Cl2,所以氧化性强弱顺序是 Co2O3 >Cl2>Br2>Fe3+,B 正确;根据氧化性强弱顺序:Cl2>Br2>Fe3+,Cl2 和 FeBr2 反应时,氯气优先氧化 Fe2+,再氧化 Br-,C 错误;在反应③中,当 有 1 mol Co2O3 参加反应时,生成 1 mol Cl2,有 6 mol HCl 参加反应,其中 2 mol HCl 被氧化,D 错误。
2022届新高考化学一轮复习 第2章 第4讲 氧化还原反应的配平与简单计算 课件

化合价降低,降低5e-×1 化合价升高,失去5e-×3
②2
0 P4+
9 KOH+
3 H2O=
3
+ K53PO4+
5
-3 PH3↑
化合价降低,得到3e-×5
3.氧化还原反应方程式的配平方法
(3)缺项配平法:化学方程式所缺物质往往是酸、碱或水;如果是离子方程式,所缺物质往往是H+、OH-或水。可以根 据质量守恒先写出所缺物质,再根据化合价升降守恒配平。如果无法确定所缺项,可先依据化合价的升降守恒将现有 的某些物质配平,然后再根据质量守恒确定所缺物质的化学式及其化学计量数(系数)。
1.根据题目流程和条件,书写相关的反应方程式。 (1)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为______________________________。
答案: (1)2Co(OH)3+SO32-+4H+===2Co2++SO42-+5H2O
条件 酸性条件下 碱性条件下
补项原则 缺H(氢)或多O(氧)补H+,少O(氧)补H2O(水) 缺H(氢)或多O(氧)补H2O(水),少O(氧)补OH-
3.氧化还原反应方程式的配平方法
(1)将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫 色(Bi3+无色)。配平该反应的离子方程式: ____NaBiO3+_____Mn2++_____===_____Na++_____Bi3++______+______。
(5)查守恒:检查质量、电荷、电子是否守恒
实例:配平下列化学方程式
第二步:列得失
化合价降低,得到5e- ×2
第一步:标变价
【高考化学第一轮复习】第二章 化学物质及其变化 氧化还原反应

或失去电子的难易,与得失电子的多少无关。如: Na、Mg、Al的还原性强弱依次为Na>Mg>Al;浓 HNO3、稀HNO3的氧化性强弱依次为:浓HNO3> 稀HNO3;
(2)同一元素相邻价态间不发生氧化还原反应。
例2 已知反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2; ②2FeCl2+Cl2===2FeCl3; ③I2+SO2+2H2O===H2SO4+2HI。 下列粒子的还原能力由强到弱顺序正确的是
5.钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O===2Fe(OH)2; ②4Fe(OH)2+O2+2H2O===4Fe(OH)3; ③2Fe(OH)3===Fe2O3+3H2O。
下列说法正确的是( AD )
A.反应①、②中电子转移数目相等 B.反应①中氧化剂是氧气和水 C.与铜质水龙头连接处的钢质水管不易发生腐蚀 D.钢铁在潮湿的空气中容易发生电化学腐蚀
高考化学考点突破复 习 【教育教学】 【教学课件】【教育培训】【课文教育】【课文教学】
学海导航2013届高三化学一轮复习
第5讲 氧化还原反应
考点1 有关氧化还原反应的概念 氧化还原反应的分析要掌握如下原则: 1.从化合价变化入手,准确判断氧化剂、还原剂、 氧化产物和还原产物。 2.氧化性、还原性的强弱是判断反应能否发生及 反应先后顺序的依据。 3.对于一个氧化还原反应,有化合价升高必然有 化合价降低,升高总数等于降低总数。 4.升降总数相等(氧化剂得电子总数等于还原剂失 电子总数)是氧化还原方程式配平和计算的依据。
1.配平依据原则:在氧化还原反应中,元素得电 子的总数=元素失去电子的总数 或化合价升高的总数=化合价降低的总数 2.配平方法:一标二列三求四配五观六查 具体地说,就是标出反应前后元素的化合价、列 出化合价的升降情况、求化合价升降的最小公倍 数、根据所求的最小公倍数配出化合价发生变化 的物质的系数、用观察法配出所含元素化合价未 发生变化的物质的系数、用质量守恒和电荷守恒 检查所配结果是否正确。
高考化学一轮总复习课件-氧化还原反应方程式的配平及计算

-2
第二步:列得失, H2 S +
+5
HNO3
失去 2e-
得到(5-2)e-
0
+2
S
NO↑
第三步:求总数,从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计
量数。
-2
H2 S
失去2e-×3
0
S
+5
+
HNO3
得到3e-×2
+2
NO↑
故H2S的化学计量数为3,HNO3的化学计量数为2。 第四步:配系数,先配平变价元素,再利用原子守恒配平其他元素。
第2步
—
按“氧化剂+还原剂——还原产物+氧化产物”写出方程式,根据 得失电子守恒配平上述四种物质
第3步
—
根据电荷守恒和反应物的酸碱性,在方程式左边或右边补充H+、 OH-或H2O等
第4步 — 根据质量守恒配平反应方程式
[示例] KMnO4能与热的经硫酸酸化的 Na2C2O4反应,生成Mn2+和CO2,该反应的离 子方程式是 ____________________________________ ____________________ ____________________________________ ______________________________。
3H2S+2HNO3===3S↓+2NO↑+4H2O 第五步:查守恒,其他原子在配平时相等,最后利用O原子守恒来进行验证。
1.正向配平类 (1)__4__HCl(浓)+__1__MnO2==△===__1__Cl2↑+__1__MnCl2+__2__H2O (2)__5__KI+_1___KIO3+__3__H2SO4===__3__I2+__3__K2SO4+___3_H2O (3)__2__MnO4-+_1_6__H++_1_0__Cl-===__2__Mn2++__5__Cl2↑+__8__ H2O 2.逆向配平类 (1)__3__S+__6__KOH==△===__2__K2S+__1__K2SO3+__3__H2O (2)__2__P4+__9__KOH+__3__H2O===__3__K3PO4+__5__PH3 (3)__2__Cl2+__2__Ca(OH)2===__1__CaCl2+__1__Ca(ClO)2+__2__H2O
高考化学一轮总复习第二章化学物质及其变化专题讲座相互竞争的离子反应和氧化还原反应
专题讲座相互竞争的离子反应和氧化还原反应反应物间一对多的化学反应常有“平行反应”和“竞争反应”两类,平行反应主要指多个反应相互间没有影响可同时进行;而竞争反应是指由于反应能力不同,多个反应按一定的先后顺序逐次进行。
竞争反应主要包括两种基本题型:一是一种氧化剂(还原剂)与多种还原剂(氧化剂)反应,如把Cl2通入含I-、Br-、Fe2+的溶液中,按照还原能力由强到弱的顺序,I-优先反应,其次是Fe2+,最后是Br-;二是一种酸(碱)与多种碱性(酸性)物质反应,如把盐酸逐滴加入到含有NaOH、Na2CO3的混合溶液中,按照碱性由强到弱的顺序,NaOH优先反应,然后是Na2CO3,此类竞争反应的先后顺序即是其有效顺序。
在实际问题中有部分看似平行的反应,由于物质的性质而出现了“有效”和“无效”两种可能性,准确地确定有效反应就成了解题的关键。
1.复分解反应之间的竞争。
若某一溶液中同时存在几个可能的复分解反应,则生成更难溶解或更难电离的物质的反应将优先进行。
2.氧化还原反应之间的竞争。
若某一溶液中同时含有多种还原性(氧化性)物质,则加入一种氧化剂(还原剂)时,优先氧化(还原)还原性(氧化性)强的物质。
3.氧化还原反应与非氧化还原反应之间的竞争。
一般情况下,氧化还原反应优先于非氧化还原反应发生。
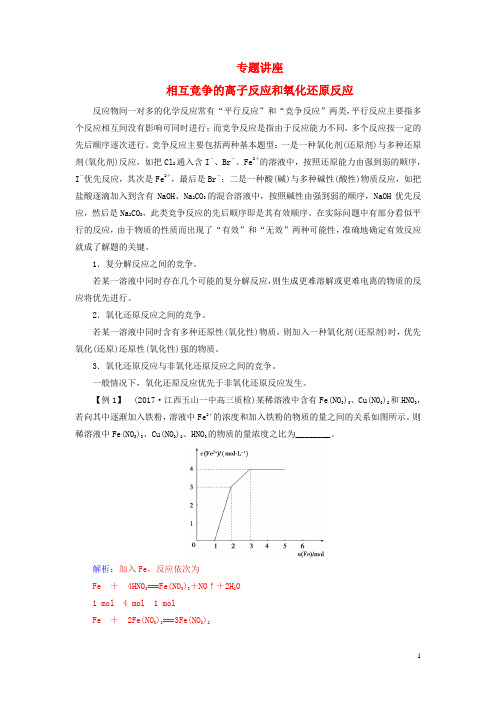
【例1】(2017·江西玉山一中高三质检)某稀溶液中含有Fe(NO3)3、Cu(NO3)2和HNO3,若向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。
则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为________。
解析:加入Fe,反应依次为Fe +4HNO3===Fe(NO3)3+NO↑+2H2O1 mol 4 mol 1 molFe +2Fe(NO3)3===3Fe(NO3)21 mol2 mol3 molFe +Cu(NO3)2===Fe(NO3)2+Cu1 mol 1 mol 1 mol由上可知c[Fe(NO3)3]∶c[Cu(NO3)2]∶c(HNO3)=1∶1∶4。
高考化学一轮复习课件:第2章+第5节+氧化还原反应的规律、配平与计算

则与 1 mol Cr3+反应所需 PbO2 的物质的量为( )
A.3.0 mol
B.1.5 mol
C.1.0 mol
D.0.75 mol
解析:选 B。1 mol Cr3+反应可生成 0.5 mol Cr2O27-,失去 3 mol 电子,1 mol PbO2 得到 2 mol 电子生成 Pb2+,根据得失电子守 恒可知,1 mol Cr3+反应失去 3 mol 电子需 1.5 mol PbO2。
题组三 缺项配平类
3.(1)____ClO- 3 +____Fe2++____===____Cl-+____Fe3++____
(2)____ClO
-
+
____Fe(OH)3
+
____===__4
+
______H2O
(3)____MnO
-
4
+
____H2O2
+
____===____Mn2
2.守恒法解题的思维流程 (1)应用电子守恒解题的一般步骤——“一、二、三”。 ①“一找各物质”:找出氧化剂、还原剂及相应的还原产物和 氧化产物。 ②“二定得失数”:确定一个原子或离子得失电子数(注意化学 式中的原子个数)。 ③“三列关系式”:根据题中物质的物质的量和得失电子守恒 列出关系式。 n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价 原子个数×化合价变化值。
考点三 守恒思想在化学计算中的应用
1.守恒法解题的指导思想 对于氧化还原反应的计算,要根据氧化还原反应的实质——反 应中氧化剂得到的电子总数与还原剂失去的电子总数相等,即 得失电子守恒。利用守恒思想,可以抛开繁琐的反应过程,可 不写化学方程式,不追究中间反应过程,只要把物质分为初态 和终态,从得电子与失电子两个方面进行整体思维,便可迅速 获得正确结果。
[推荐学习]2019年高考化学一轮综合复习 第2章 化学物质及其变化 课时4 氧化还原反应的综合应用
![[推荐学习]2019年高考化学一轮综合复习 第2章 化学物质及其变化 课时4 氧化还原反应的综合应用](https://img.taocdn.com/s3/m/af1e081967ec102de2bd896b.png)
课时4 氧化还原反应的综合应用——配平、计算及滴定1.已知a M 2++b O 2+4H +===c M 3++d H 2O ,则化学计量数c 的值为( )A .1B .2C .3D .4解析 根据质量守恒可得a =c ;根据电荷守恒可得2a +4=3c ,解得c =4,选项D 正确。
答案 D2.含有a mol FeBr 2的溶液中,通入x mol Cl 2。
下列各项为通入Cl 2过程中,溶液内发生反应的离子方程式,其中不正确的是( ) A .x =0.4a,2Fe 2++Cl 2===2Fe 3++2Cl -B .x =0.6a,2Br -+Cl 2===Br 2+2Cl -C .x =a,2Fe 2++2Br -+2Cl 2===Br 2+2Fe 3++4Cl -D .x =1.5a,2Fe 2++4Br -+3Cl 2===2Br 2+2Fe 3++6Cl -解析 根据氧化还原反应的先后顺序知,Cl 2先氧化Fe 2+,然后再氧化Br -。
x =0.4a 时,Cl 2不能完全氧化Fe 2+,只能发生反应2Fe 2++Cl 2===2Fe 3++2Cl -,A 项正确;当x =0.6a 时,Cl 2能将Fe 2+完全氧化后,又能氧化a5的Br -,故B 错误;x =a 时,Cl 2氧化Fe 2+后又能氧化a mol的Br -,C 正确;x =1.5a 时,Cl 2能将Fe 2+、Br -完全氧化,D 正确。
答案 B3.FeS 与一定浓度的HNO 3反应,生成Fe(NO 3)3、Fe 2(SO 4)3、NO 2、N 2O 4、NO 和H 2O ,当NO 2、N 2O 4、NO 的物质的量之比为1∶1∶1时,实际参加反应的FeS 与HNO 3的物质的量之比为( ) A .1∶6 B .1∶7 C .2∶11D .16∶25解析 设参加反应的FeS 的物质的量为a mol ,被还原的HNO 3的物质的量为b mol ,根据得失电子守恒有:a ×(1+8)=b 4×1+b 4×2+b4×3,b =6a ,又因为起酸性作用的HNO 3的物质的量为3n [Fe(NO 3)3]=3×(a -a3×2)mol=a mol ,故实际参加反应的FeS 与HNO 3的物质的量之比为a ∶(a +b )=1∶7。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时4 氧化还原反应的综合应用——配平、计算及滴定
1.已知a M 2+
+b O 2+4H +
===c M 3+
+d H 2O ,则化学计量数c 的值为( )
A .1
B .2
C .3
D .4
解析 根据质量守恒可得a =c ;根据电荷守恒可得2a +4=3c ,解得c =4,选项D 正确。
答案 D
2.含有a mol FeBr 2的溶液中,通入x mol Cl 2。
下列各项为通入Cl 2过程中,溶液内发生反应的离子方程式,其中不正确的是( ) A .x =0.4a,2Fe 2+
+Cl 2===2Fe 3+
+2Cl -
B .x =0.6a,2Br -
+Cl 2===Br 2+2Cl -
C .x =a,2Fe 2+
+2Br -
+2Cl 2===Br 2+2Fe 3+
+4Cl -
D .x =1.5a,2Fe 2+
+4Br -
+3Cl 2===2Br 2+2Fe 3+
+6Cl -
解析 根据氧化还原反应的先后顺序知,Cl 2先氧化Fe 2+
,然后再氧化Br -。
x =0.4a 时,Cl 2不能完全氧化Fe 2+
,只能发生反应2Fe 2+
+Cl 2===2Fe 3+
+2Cl -
,A 项正确;当x =0.6a 时,Cl 2能将Fe 2+
完全氧化后,又能氧化a
5的Br -,故B 错误;x =a 时,Cl 2氧化Fe 2+
后又能氧化a mol
的Br -
,C 正确;x =1.5a 时,Cl 2能将Fe 2+
、Br -
完全氧化,D 正确。
答案 B
3.FeS 与一定浓度的HNO 3反应,生成Fe(NO 3)3、Fe 2(SO 4)3、NO 2、N 2O 4、NO 和H 2O ,当NO 2、N 2O 4、NO 的物质的量之比为1∶1∶1时,实际参加反应的FeS 与HNO 3的物质的量之比为( ) A .1∶6 B .1∶7 C .2∶11
D .16∶25
解析 设参加反应的FeS 的物质的量为a mol ,被还原的HNO 3的物质的量为b mol ,根据得失电子守恒有:a ×(1+8)=b 4×1+b 4×2+b
4×3,b =6a ,又因为起酸性作用的HNO 3的物质的量
为3n [Fe(NO 3)3]=3×(a -a
3×2)mol=a mol ,故实际参加反应的FeS 与HNO 3的物质的量之比为a ∶(a +b )=1∶7。
答案 B
4.(1)已知Fe(OH)3能与次氯酸盐发生如下反应(未配平):Fe(OH)3+ClO -
+OH -
―→FeO n -4+Cl -
+H 2O 。
①已知有10.7 g Fe(OH)3参加反应,共转移了0.3N A 个电子,则n =________,FeO n -
4中铁元素的化合价为________。
②根据所学的知识,推测FeO n-4能和下列________(填序号)物质反应。
A.KMnO4B.SO2
C.H2S D.O2
(2)一定条件下,向含硝酸的废水中加入CH3OH,将HNO3还原成N2。
若该反应消耗32 g CH3OH,
转移6 mol 电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
解析(1)①10.7 g Fe(OH)3的物质的量为0.1 mol,所以如果1 mol Fe(OH)3参加反应,则转移3 mol电子,Fe的化合价升高3价,为+6价,n=2;②根据信息可知FeO n-4为强氧化剂,能与还原剂SO2、H2S反应。
(2)32 g CH3OH的物质的量为1 mol,1 mol的CH3OH转移6 mol 的电子,升高6价,1 mol的
HNO3化合价降低5价,所以还原剂与氧化剂的物质的量之比为5∶6。
答案(1)①2+6 ②BC(2)5∶6
5.(2016·河北衡水中学二模,26)实验室用下列方法测定某水样中O2的含量。
(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方
程式为___________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为
___________________________________。
然后用Na2S2O3标准溶液滴定生成I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是
____________________________________________;
……
⑦取下锥形瓶,向其中加入2~3滴________作指示剂;
⑧用0.005 mol·L-1Na2S2O3溶液滴定至终点。
滴定终点的现象是
__________________________________________________。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,已知水样的体积为20 mL,则此水样
中氧(O2)的含量为________mg·L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将________(填“偏大”、“偏
小”或“不变”)。
答案(1)①2Mn2++O2+4OH-===2MnO(OH)2
②MnO(OH)2+2I-+4H+===Mn2++I2+3H2O
(2)①排出装置内的空气,避免空气中的O2的干扰
⑦淀粉溶液⑧滴最后一滴标准液,溶液恰好由蓝色变为无色,且半分钟内不恢复原色
(3)①7.8②偏大。
