合金与晶体的区别
第3讲:金属与合金的晶体结构

纯金属结晶的条件 就是应当有一定的 过冷度(克服界面能)
T
过冷度
T= T0 - Tn
T0
理论结晶温度
}T
ቤተ መጻሕፍቲ ባይዱTn
开始结晶温度
t
冷却曲线
3、 过冷现象
金属的实际结晶温度Tn低于理论结晶温 度T0的现象。 过冷度△T= T0-Tn,过冷是结晶的必要 条件。
同一金属,结晶时冷却速度越大,过冷 度越大,金属的实际结晶温度越低。
多晶体:这种实际上由许多晶粒组成的晶体称为多晶体。 其中每个小晶体的外形
多为不规则的颗粒,通 常称为晶粒。 晶粒与晶粒之间的界面
称为晶界。
晶粒(单晶体)
二、晶体的缺陷
晶体中原子完全为规则排列时,称为理想晶体。
实际上,金属由于多种原因的影响,内部总是存在着大 量缺陷。
根据晶体缺陷的几何特点,常分为:
一个空间格架,这种抽象的,用于描述原子在晶体中排列 形式的几何空间格架就叫晶格。
晶格中的每个点称为结点。晶格中各种不同方位的原子面 称为晶面。
2、晶胞 组成晶格的最基本几何单元称为晶胞。实际上整个晶格就是 由许多大小、形状和位向相同的晶胞在空间重复堆积而成 的。
3、晶格常数 晶胞的各棱边长为a、b、c和棱边夹角α、β、γ。其中,
2、 长大
晶体的长大过程是液体中原子迁移到固体表面, 使液—固界面向液体中推移的过程。
两种长大方式 —— 平面生长 与 树枝状生长。
平面长大
树枝状长大
三、晶粒大小对金属力学性能的影响
1、概念
1) 晶粒度——衡量晶粒大小的尺度,常以单位截面上晶粒数目或 晶粒的平均直径来表示。
2) 形核率——指单位时间、单位体积中所形成的晶核数目。 3) 长大速度——指单位时间内晶核向周围长大的平均线速度。
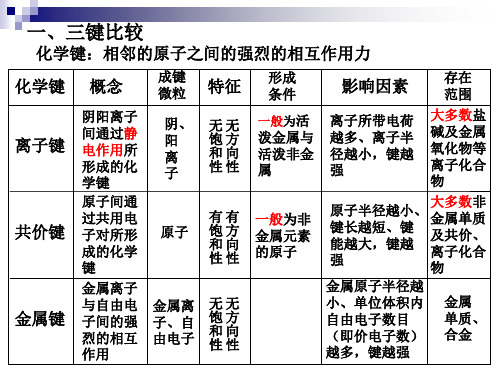
离子化合物金属单质合金四大晶体比较类型金属晶体离子晶体
考点:本题考查了晶体的结构与性质
(2008广东) 镁、铜等金属离子是人体内多种酶的辅因子。工业
上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,
得到金属镁。
(1) 以MgCl2为原料用熔融盐电解法制备镁时,
常加入NaCl、KCl或CaCl2等金属氯化物,
存在:共价单键为σ 键,共价双键 和叁键中通常含一个σ 键
π 键: 原子轨道以“肩并肩”的方式重叠 电子云以两核所成平面呈镜像对称
存在:共价双键和叁键中
共价键类型:
非极性键
2. 按键的极性分 极性键
键的极性强弱判断:
同种元素原子间共用电子对 不发生偏移
不同种元素原子间共用电子对 发生偏移
成键原子吸引电子能力差异越大,键的极性越强
具有分子间氢键的分子晶体,分子间作用力显著增大, 熔沸点升高。
*共价键:
成键本质:成键原子相互接近时,原子轨道发生重叠,自旋 方向相反的未成对电子形成共用电子对,两原子 核间电子云密度增加,体系能量降低。
共价键类型: 1. 按成键方式分
σ 键: 原子轨道沿核间连线方向以“头碰 头”的方式重叠 电子云呈轴对称。 其中s-sσ 键无方向性。
⑵原子晶体 原子半径越小、键长越短、键能越大,共价键 越强,晶体熔沸点越高、硬度越大。
⑶金属晶体 金属原子半径越小、单位体积内自由电子数目越 多,金属键越强,晶体熔沸点越高、硬度越大。
⑷分子晶体
组成和结构相似的分子晶体,相对分子质量越大,分 子间作用力越大,熔沸点越高;
相对分子质量相近的分子晶体,分子极性越大,分子 间作用力越大,熔沸点越高;
② 微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相
金属材料的结构与结晶

只有当溶质原子尺寸较小,溶剂晶格间隙较大时
才能形成间隙固溶体。
例:Fe和C形成间隙固溶体。
间隙固溶体溶解的溶质数量是有限的。
图2-12(b)
图2-12(a)
(2)臵换固溶体:溶质原子占据晶格结点位臵而形 成的固溶体。 (图2-12b)
两组元原子尺寸相近时,易形成臵换固溶体。可形
成有限固溶体和无限固溶体。 例:Cr和Ni等合金元素溶入铁中形成的固溶体为臵
立方晶格中的某些晶面立方晶格中的某些晶面100100面面110110面面111111面面立方晶格中的某些晶向立方晶格中的某些晶向111111向向110110向向在同一晶格的不同晶面和晶向上原子排列的疏密在同一晶格的不同晶面和晶向上原子排列的疏密不同因此原子结合力也就不同从而在不同的不同因此原子结合力也就不同从而在不同的晶面和晶向上显示出不同的性能这就是晶体具晶面和晶向上显示出不同的性能这就是晶体具有各向异性的原因
1.晶格:描述原子在晶体中排列方式的空间几何格架。 2.晶胞:反映晶格特征的最小单元。
3. 晶格参数:
晶胞棱边的长度和棱边夹角α、β、γ。
4. 三种典型的金属晶体结构 面心立方晶格、体心立方晶格、密排六方晶格。 面心立方晶格类型的金属有Cu、Al、Ni等,具有良
好的塑性; 密排六方晶格的金属有 Mg、Zn、Be等
Fe3C组成的机械混合物。
机械混合物的性质,基本上是各组成相性能的
平均值。
35 钢的显微组织
机械混合物P
将黑色部分放大,看到指纹状结构。其中白色
基体是Fe与C形成的固溶体, 含碳0.0218% 体 心立方晶格(称为铁素体F), 黑色条纹为 渗
碳体(Fe3C)。
黑色部分是F与Fe3C形成的机械混合物,称为
晶体结构晶格

1.铁碳相图 (Fe-Fe3 C相图) (1) Fe-Fe3 C相图的组元
● Fe —— α –Fe、δ -Fe (bcc) 和γ -Fe (fcc) 强度、硬度低,韧性、塑性好。
● Fe3 C —— 熔点高,硬而脆,塑性、韧性几乎为零。
导入
金属材料简介 1. 金属材料分为黑色金属(钢铁材料)和有色金 属。汽车上各种结构零件,钢铁材料约占80%。 2. 汽车工程材料不断向轻量化发展,各种新的汽 车工程材料相继被推出并应用于汽车工业之中。
3. 重点介绍金属材料特别是钢铁材料的性能、结 构、牌号及在汽车上的应用。
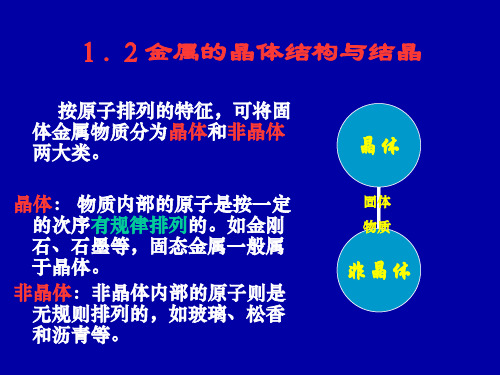
材料按照原子(离子或分子)在三维空间排列 方式的不同,可分为晶体与非晶体两大类。
这种溶质原子溶入溶剂晶格而仍保持溶剂晶格 类型的金属晶体叫做固溶体。
置 换 固 溶 体
Z
Z 置换原子
间 隙 固 溶 体
间隙原子
Y Y
X X
晶格畸变
小原子置换引起的 晶格畸变
间隙原子引起的 晶格畸变
固溶强化
形成固溶体使金属强度和硬度提高,而塑性下降的现象.
正常晶格
晶格畸变
2.金属化合物 是指合金各组元的原子按一定的整数比
匀晶相图
L+A
共晶相图
L
D
E
A
G 共析相图
A+ A+F S Fe3CⅡ F P ( F+ Fe3C )
P
Q P+F P+Fe3CⅡ
1148℃
C( A+Fra biblioteke3C )Ld
金属的晶体结构和结晶
组元3
组元2
合金的晶体结构比纯金属复杂,根据组成合金的组元 相互之间作用方式不同,可以形成固溶体、金属化合物和 机械混合物三种结构。
1.固溶体
(1)固容体的类型 间隙固溶体:当溶质原子很 小时,只能处于溶剂原子的 间隙中,称为间隙固溶体。 如图1-10a所示。如C、H、 O等原子易形成间隙固溶体。 图1-10a 间隙固溶体 置换固溶体:当溶质和溶剂 的原子直径较接近时,只能 替代一部分溶剂原子而占据 溶剂晶格中的某些结点位置, 称为置换固溶体。 如图1-10b 所示。 如Fe-Ni、Cu-Ni等。 图1-10b 置换固溶体
(2)固溶强化
固溶强化:通过溶入某 种溶质元素形成固溶体 而使金属的强度、硬度 升高的现象。
1-10c 间隙固溶体晶格畸变
如图1-10c、1-10d所示。
1-10d 置换固溶体晶格畸变
2.金属化合物
金属化合物:即由两组元的原子按一定的数量比相 互化合而形成的一种新的具有金属特性的物质。 金属化合物具有与各组元完全不同的复杂晶体 结构,通常具有较高的熔点和硬度,且脆性较大。 碳钢中的Fe3C、合金钢中的TiC、WC、VC等均 属于金属化合物。 Fe3C的晶格如图1-11b所示。
时间
2.过冷
过 冷:即熔融金属冷却到平衡的凝固点以下 而没有发生凝固的现象。 过冷度: 理论结晶温度与实际结晶温度的差值 称为过冷度。 即: ΔT=T0-Tn 式中 ΔT——过冷度(℃); T0 ——金属的理论结晶温度(℃); Tn ——金属的实际结晶温度(℃)。 金属的过冷度不是恒定值,它与冷却速度有关。 冷却速度越快过冷度也越大。
1.2金属的晶体结构与结晶
按原子排列的特征,可将固 体金属物质分为晶体和非晶体 两大类。
第二章 金属与合金的晶体结构与结晶

第二章 金属与合金的晶体结构与结晶第一节 金属的晶体结构自然界的固态物质,根据原子在内部的排列特征可分为晶体与非晶体两大类。
晶体与非晶体的区别表现在许多方面。
晶体物质的基本质点(原子等)在空间排列是有一定规律的,故有规则的外形,有固定的熔点。
此外,晶体物质在不同方向上具有不同的性质,表现出各向异性的特征。
在一般情况下的固态金属就是晶体。
一、晶体结构的基础知识(1)晶格与晶胞为了形象描述晶体内部原子排列的规律,将原子抽象为几何点,并用一些假想连线将几何点连接起来,这样构成的空间格子称为晶格(图2-1)晶体中原子排列具有周期性变化的特点,通常从晶格中选取一个能够完整反映晶格特征的最小几何单元称为晶胞(图2-1),它具有很高对称性。
(2)晶胞表示方法不同元素结构不同,晶胞的大小和形状也有差异。
结晶学中规定,晶胞大小以其各棱边尺寸a 、b 、c 表示,称为晶格常数。
晶胞各棱边之间的夹角分别以α、β、γ表示。
当棱边a b c ==,棱边夹角90αβγ===︒时,这种晶胞称为简单立方晶胞。
(3)致密度金属晶胞中原子本身所占有的体积百分数,它用来表示原子在晶格中排列的紧密程度。
二、三种典型的金属晶格1、体心立方晶格晶胞示意图见图2-2a。
它的晶胞是一个立方体,立方体的8个顶角和晶胞各有一个原子,其单位晶胞原子数为2个,其致密度为0.68。
属于该晶格类型的常见金属有Cr、W、Mo、V、α-Fe等。
2、面心立方晶格晶胞示意图见图2-2b。
它的晶胞也是一个立方体,立方体的8个顶角和立方体的6个面中心各有一个原子,其单位晶胞原子数为4个,其致密度为0.74(原子排列较紧密)。
属于该晶格类型的常见金属有Al、Cu、Pb、Au、γ-Fe等。
3、密排六方晶格它的晶胞是一个正六方柱体,原子排列在柱体的每个顶角和上、下底面的中心,另外三个原子排列在柱体内,晶胞示意图见图2-2c。
其单位晶胞原子数为6个,致密度也是0.74。
属于该晶格类型常见金属有Mg、Zn、Be、Cd、α-Ti等。
青海大学《材料概论》真题库

第二章1、材料科学与工程的四个基本要素(材料的成分)、(组织结构)、(合成加工)、(性质与使用性能)。
2、材料的组织是指材料(内部)的微观形貌。
3、材料中原子、分子之间的结合键分为(化学键)和(物理键)两类。
其中化学键包括(离子键)、(共价键)、(金属键)。
物理键包括(分子键)、(氢键)。
4、固体物质按原子排列方式的不同以三种形式存在(晶体)、(非晶体)、(准晶体)。
5、化学键中的(离子键)和(金属键)没有方向性和饱和性。
6、金刚石为(原子)晶体。
7、简述晶体和非晶体的区别。
晶体是内部质点在三维空间成周期性重复排列的固体,具有长程有序,并成周期性重复排列.非晶体是内部质点在三维空间不成周期性重复排列的固体,具有近程有序,但不具有长程有序.8、分别将晶体、晶格、晶胞填入相对应的图形下面。
(晶体)(晶格)(晶胞)9、写出体心立方晶体结构的特征参量,并简述如何得到的。
晶胞原子数:2配位数:8致密度:68%p1410、晶体缺陷根据其几何形态特征分为:(点缺陷)、(线缺陷)、(面缺陷)。
11、天然矿物原料按工业用途的不同分为(金属矿物)、(非金属矿物)、(燃料矿)。
12、钛白粉属于氧化物无机化工原料中的(化工颜料)。
13、三大有机合成材料指的是(合成树脂)、(合成橡胶)、(合成纤维)。
14、材料的制备方法可分为(气相法)、(液相法)、(固相法)三大类。
15、溶胶-凝胶法属于(液相法)方法,其制备过程包括(溶液)、(溶胶)、(凝胶)、(材料)。
16、材料的成型特性主要表现为(可流动性)和(可塑性变形性)。
根据其特性可将成形方法分为(自由流动性)、(受力流动成型)、(受力塑性变形)和其他成形。
17、固体加热时有三个重要的热效应:(吸热)、(传热)、(膨胀)。
18、物质的介电强度(越大),它作为绝缘体的质量越好。
19、物质在磁场的作用下都会表现出一定的磁性。
按照对磁场的影响可将物质分为(抗磁性物质)、(顺磁性物质)、(铁磁性及亚铁磁性物质)。
《合金的晶体结构》课件

PART 02
合金的晶体结构类型
REPORTING
面心立方晶体结构
总结词
具有高度对称性的晶体结构
详细描述
面心立方晶体结构是一种常见的合金晶体结构,其特点是每个原子被其他8个原 子所包围,形成了一个稳定的结构。这种结构在金属元素中较为常见,如铜、 镍和铝等。
体心立方晶体结构
总结词
具有较高硬度和强度的晶体结构
《合金的晶体结构》 ppt课件
REPORTING
• 合金的晶体结构概述 • 合金的晶体结构类型 • 合金的晶体结构形成机制 • 合金的晶体结构表征方法 • 合金的晶体结构应用
目录
PART 01
合金的晶体结构概述
REPORTING
合金的定义与分类
总结词
合金是由两种或两种以上的金属或非金属元素熔合在一起形成的具有金属特性的物质。根据合金的特性,可以将 合金分为固溶体、金属化合物和混合物等类型。
详细描述
合金是由两种或两种以上的金属或非金属元素熔合在一起形成的具有金属特性的物质。这些元素可以是金属、非 金属或半金属元素,如铁、碳、硅等。根据合金中元素的种类和含量,可以将合金分为固溶体、金属化合物和混 合物等类型。
合金的晶体结构特点
ห้องสมุดไป่ตู้总结词
合金的晶体结构是指合金中各元素原子在三维空间中 的排列方式。合金的晶体结构与纯金属的晶体结构不 同,其特点是原子排列复杂、晶体缺陷多、晶体结构 类型多样。
详细描述
体心立方晶体结构的每个原子被其他8个原子所包围,形成了一个紧密的结构。 这种结构在金属元素中较为常见,如铬、钼和钨等。由于其较高的硬度和强度, 体心立方晶体结构的合金常用于制造耐磨和耐高温的部件。
密排六方晶体结构
金属与合金晶体结构与特征

金属与合金的晶体结构和特征
间隙半径
若在晶胞空隙中放入刚 性球, 则能放入球的最大 半径为空隙半径。体心 立方晶胞中有两种空隙。 四面体空隙 其半径为: r四=0.29r原子 八面体空隙 其半径为: r八=0.15r原子
金属与合金的晶体结构和特征
2、面心立方晶格( FCC)
原子排列方式 常见金属 原子个数 原子半径 配位数 致密度 间隙半径
金属与合金的晶体结构和特征
原子排列方式
金属原子分布在立方体的八个角上和六个面的中心。面 中心的原子与该面四个角上的原子紧靠。
面心立方晶胞的特征: 晶格常数:a=b=c, α=β=γ=90°
金属与合金的晶体结构和特征
金属与合金的晶体结构和特征
常见金属
具有这种晶格的金属有: 铝(Al)、铜(Cu)、镍(Ni)、金(Au)、 银(Ag)、γ- 铁( γ-Fe, 912℃~1394℃)等。
金属与合金的晶体结构和特征
原子半径
金属与合金的晶体结构和特征
配位数
12
金属与合金的晶体结构和特征
致密度
0.74(74%)
金属与合金的晶体结构和特征
第二节 金属的晶体结构
金属与合金的晶体结构和特征
➢布拉菲点阵 7个晶系, 14种点阵。
➢大 部 分 ( 2/3) 的 金属属于三种典型 的晶体结构。
金属与合金的晶体结构和特征
一、 典型晶体结构及其几何特征
在元素周期表一共约有110种元素,其中80多种是金 属,占2/3。而这80多种金属的晶体结构大多属于三 种典型的晶体结构。它们分别是: 1、体心立方晶格(BCC) 2、面心立方晶格(FCC) 3、密排六方晶格(HCP)
工程材料学_第一章-金属学基础知识

晶向(crystal direction) :
通过晶体中任意两个原子中心连线来表示晶体结构的空间的各 个方向。 晶胞原子数:一个晶胞内包含的原子数目。
原子半径:晶胞中原子密度最大的方向上相邻两原子之间
平衡距离的一半,与晶格常数有一定的关系。 配位数:晶格中任一原子处于相等距离并相距最近原子数
的性能、塑性变形及其组织 转变均有极为重要的作用 。
通过冷塑性变形,提高位错
密度使得金属强度、硬度提
高的方法称为加工硬化。
面缺陷-晶界与亚晶界
大角度晶界---晶界
小角度晶界---亚晶界
大角度晶界---晶界
小角度晶界---亚晶界
小角度晶界---亚晶界
大角度晶界---晶界
金属的晶体结构
合金与合金的相结构
•单相合金组织(homogeneous structure )与多相合金组织 (Heterogenous structure):显微组织为单相的称为单相组织,为 多相的称为多相组织。
•合金组织的相:构成合金组织的各个相称为合金组织的相。 • 相结构:相组成物的晶体结构称为合金的相结构
二、合金的相结构
点位置的异类原子
线缺陷
位错( dislocation ):晶格的一部分相对
于另一部分发生的局部滑移现象,或者说 局部原子发生有规律的位置错排现象
面缺陷
晶界( grain boundary ) 亚晶界( sub-boundary )
点缺陷
置换原子
间隙原子
化合物离子晶体两种常见的缺陷
晶格空位
(1)晶面(crystal face)和晶向( crystal directions ):
晶向指数(indices of directions)和晶面指数(indices of crystal-plane)是分
金属的晶体结构合金的晶体结构

2.1 合金的晶体结构
➢ 合金中的各种相是组成合金的基本单元,而合金 组织则是合金中各种相的综和体。
➢ 一种合金的力学性能不仅取决于它的化学成分, 更取决于它的显微组织。
➢ 金属通过热处理可以在不改变化学成分的前提下 获得不同的组织,从而获得不同的力学性能。
2.1 合金的晶体结构
二、合金晶体结构的类型
由于溶剂晶格的间隙有限,所以间隙固溶体只能 是有限溶解溶质原子。
2.1 合金的晶体结构
➢固溶体的性能
由于溶质原子的溶入,固溶体发生晶格畸变,变 形抗力增大,使金属的强度、硬度升高的现象称为固 溶强化。它是强化金属材料的重要途径之一。
2.1 合金的晶体结构
2、金属化合物 金属化合物是合金组元间发生相互作用而生
位错线的密度可用单位体积 内位错线的总长度表示。位 错密度愈大,塑性变形抗力 愈大。因此,目前通过塑性 变形,提高位错密度,是强 化金属的有效途径之一。
2.1 金属的结构
(3)面缺陷ቤተ መጻሕፍቲ ባይዱ
面缺陷即晶界和亚晶界。 ➢ 晶界:晶粒之间原子无规
则排列的过渡层,又称大角 度晶界。 ➢ 亚晶界:晶粒内部亚组织 之间的边界,一系列刃型 位错所形成的小角度晶界。
晶界和亚晶界处表现出有较高的强度和硬度。 晶粒越细小晶界和亚晶界越多,它对塑性变形的阻碍作用就越大, 金属的强度、硬度越高。
2.1 合金的晶体结构
一、基本概念
1、合金 是由两种或两种以上的金属元素或金属与非金属
组成的具有金属特性的物质。
例:碳钢是铁和碳组成的合金。
2、组元 组成合金的最基本的、独立的物质称为组元,简
第二章 金属的晶体结构与结晶
第一节 金属的结构 第二节 合金的晶体结构
金属晶体结构

T 度 温
ΔT=T0—Tn
T0 Tn
时间t
2、结晶的过程 晶核的形成和长大过程
3、金属结晶后的晶粒大小
一般来说,晶粒愈细,强度和硬度愈 高,同时塑性和韧性也愈好。
晶粒大小控制:
晶核数目: 多—细(晶核长得慢也细)
冷却速度: 快—细(因冷却速度受限,故 多加外来质点)
晶粒粗细对机械性能有很大影响,若 晶粒需细化,则从上述两方面入手.
金属与合金的 晶体结构与结晶
2.1 金属的晶体结构
一、晶体与晶格
固体物质按其原子排列的特征,可分为晶体和 非晶体。
非晶体 原子作不规则的排列,如松香、玻璃、 沥青等。
晶体 原子则按一定次序作有规则的排列,如金 刚石、石墨及固态金属等。
两者的性能差异 :
晶体具有一定的凝固点和熔点,非晶体没有; 晶体具有各向异性,非晶体各向同性等。
2、面心立方晶格 ba))每原个子体分心布立在方各晶个胞结中点仅及包上含下两4个个原正子六。方 c面)的致中密心度,0另.74外在六方柱体中心还有三个
3、密排六方晶格
原子。 b)每个密排六方晶胞中包含6个原子。
c)致密度0.74
属于这类晶格的金属有:α-Fe、Cr、V、W、Mo等。
属于这类晶格的金属有:γ-Fe、Al、Cu、Pb等。 属于这类晶格的金属有:Mg、Zn等。
2.1.1 晶体结构的基础知识
晶体中原子在空间是按一定规律堆砌排列的。
晶格 为了便于表明晶体内部原子排列的规 律,有必要把原子抽象化,把每个原子看成一个 点,这个点代表原子的振动中心。把这些点用直 线连接起来,便形成一个空间格子,叫做晶格。
结点 晶格中每个点叫结点。
结点
晶胞
晶胞 晶格的最小单元叫做晶胞,它 能代表整个晶格的原子排列规律。
金属学及热处理习题参考答案(1-9章)

第一章金属及合金的晶体结构一、名词解释:1.晶体:原子(分子、离子或原子集团)在三维空间做有规则的周期性重复排列的物质。
2.非晶体:指原子呈不规则排列的固态物质。
3.晶格:一个能反映原子排列规律的空间格架。
4.晶胞:构成晶格的最基本单元。
5.单晶体:只有一个晶粒组成的晶体。
6.多晶体:由许多取向不同,形状和大小甚至成分不同的单晶体(晶粒)通过晶界结合在一起的聚合体。
7.晶界:晶粒和晶粒之间的界面。
8.合金:是以一种金属为基础,加入其他金属或非金属,经过熔合而获得的具有金属特性的材料。
9.组元:组成合金最基本的、独立的物质称为组元。
10.相:金属中具有同一化学成分、同一晶格形式并以界面分开的各个均匀组成部分称为相。
11.组织:用肉眼观察到或借助于放大镜、显微镜观察到的相的形态及分布的图象统称为组织。
12.固溶体:合金组元通过溶解形成成分和性能均匀的、结构上与组元之一相同的固相。
二、填空题:1.晶体与非晶体的根本区别在于原子(分子、离子或原子集团)是否在三维空间做有规则的周期性重复排列。
2.常见金属的晶体结构有体心立方晶格、面心立方晶格、密排六方晶格三种。
3.实际金属的晶体缺陷有点缺陷、线缺陷、面缺陷、体缺陷。
4.根据溶质原子在溶剂晶格中占据的位置不同,固溶体可分为置换固溶体和间隙固溶体两种。
5.置换固溶体按照溶解度不同,又分为无限固溶体和有限固溶体。
6.合金相的种类繁多,根据相的晶体结构特点可将其分为固溶体和金属化合物两种。
7.同非金属相比,金属的主要特征是良好的导电性、导热性,良好的塑性,不透明,有光泽,正的电阻温度系数。
8.金属晶体中最主要的面缺陷是晶界和亚晶界。
9.位错两种基本类型是刃型位错和螺型位错,多余半原子面是刃型位错所特有的。
10.在立方晶系中,{120}晶面族包括(120)、(120)、(102)、(102)、(210)、(210)、(201)、(201)、(012)、(012)、(021)、(021)、等晶面。
机械工程材料 第二章 金属的晶体结构与结晶

2-3 根据组元数, 一般分为二元相图、三元相图。 三元相图
Fe-C二元相 图
2-3 同素异构转变 有些物质在固态下其晶格类型会随温度变化而发生变化,这 种现象称为同素异构转变。 锡,四方结构的白锡在13℃下转变为金刚石立方结构的灰 锡。 同素异构转变同样也遵循形核、长大的规律,但它是一个 固态下的相变过程,即固态相变。 除锡之外,铁、锰、钴、钛等也都存在着同素异构转变。
位错密度增加,能提高金属强度。
2-1
(3)面缺陷
呈面状分布的缺陷,主要是晶界和亚晶界。 晶体缺陷产生晶格畸变,使金属的强度、硬度提高,韧性下降。
2-1
二、合金的晶体结构 1.合金的基本概念
合金:两种或两种以上的金属与金属,或金属与非金属经一定方法合成的 具有金属特性的物质。 例如,钢和生铁是Fe与C的合金,黄铜是Cu和Zn的合金。 组元:组成合金最基本的物质。可以是元素,也可以是化合物。 黄铜的组元是铜和锌;青铜的组元是铜和锡。铁碳合金中的Fe3C,镁硅合 金中的Mg2Si。 合金系:组元不变,当组元比例发生变化,可配制出一系列不同成分、不 同性能的合金,这一系列的合金构成一个“合金系统”,简称合金系。
2-1
(2)金属化合物
合金组元间发生相互作用而形成一种具有金属特性的物质。
1.正常价化合物:如Mg2Si, Mg2Sn, Mg2Pb, Cu2Se等。
2.电子化合物:不遵守原子价规律,但有一定的电子浓度的化合物。
如Cu3Al, CuZn3, Cu5Zn8等。
3.间隙化合物:由过渡族金属元素与碳、氮、氢、硼等原子半径较
通常在钢中加入铝、钒,向铸铁液中加入硅铁合金。
(3)机械振动、超声振动、电磁搅拌: 使结晶过程中形成的枝晶折断裂碎,增加晶核数,达到细化晶粒的目的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
合金
制作合成,是由两种或两种以上的金属与金属或非金属经一定方法所合成的具有金属特性的物质。
一般通过熔合成均匀液体和凝固而得。
根据组成元素的数目,可分为二元合金、三元合金和多元合金。
人类生产合金是从制作青铜器开始,世界上最早生产合金的是古巴比伦人,6000年前古巴比伦人已开始提炼青铜(红铜与锡的合金)。
中国也是世界上最早研究和生产合金的国家之一,在商朝(距今3000多年前)青铜(铜锡合金)工艺就已非常发达;公元前6世纪左右(春秋晚期)已锻打(还进行过热处理)出锋利的剑。
常将两种或两种以上的金属元素或以金属为基添加其他非金属元素通过合金化工艺(熔炼、机械合金化、烧结、气相沉积等等)而形成的具有金属特性的金属材料叫做合金。
但合金可能只含有一种金属元素,如钢。
(钢,是对含碳量质量百分比介于0.02%至2.00%之间的铁合金的统称)
这里我们需要注意,合金不是一般概念上的混合物,甚至可以是纯净物,如单一相的金属互化物合金,所添加合金元素可以形成固溶体、化合物,并产生吸热或放热反应,从而改变金属基体的性质。
合金的生成常会改善元素单质的性质,例如,钢的强度大于其主要组成元素铁。
合金的物理性质,例如密度、反应性、杨氏模量、导电性和导热性可能与合金的组成元素尚有类似之处,但是合金的抗拉强度和抗剪强度却通常与组成元素的性质有很大不同。
这是由于合金与单质中的原子排列有很大差异。
少量的某种元素可能会对合金的性质造成很大的影响。
例如,铁磁性合金中的杂质会使合金的性质发生变化。
不同于纯净金属的是,多数合金没有固定的熔点,温度处在熔化温度范围间时,混合物为固液并存状态。
因此可以说,合金的熔点比组分金属低。
参见低共熔混合物。
常见的合金中,黄铜是由铜和锌的合金;青铜是锡和铜的合金,用于雕象、装饰品和教堂钟。
一些国家的货币都会使用合金(如镍合金)。
根据合金中含量较大的主要金属的名称而分类称作某某合金,如铜含量高的为铜合金,其性能主要保持铜的性能。
