(精心整理)2016年高考电离平衡集锦
高三化学电离平衡3

弱电解质的电离平衡考点归纳

弱电解质的电离平衡考点归纳弱电解质电离平衡是电解质理论的基础,也是中学化学基本理论中的重要组成部分,近几年高考命题中反复考查。
在学生已经学过化学平衡理论并了解电解质在水溶液中发生电离和离子间发生反应等知识的基础上,进一步学习弱电解质的电离平衡。
高考命题的热点主要有影响弱电解质电离平衡因素,通过图象分析弱电解质和强电解质,电离常数和电离度等,为了更好的学习这一部分内容,本文做了详细的总结和归纳,希望对同学们的学习有所启发,达到触类旁通的效果。
一、弱电解质电离平衡1.电离平衡概念一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态,简称电离平衡。
任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质在该条件下的电离程度最大。
2.电离平衡的特征电解质的电离平衡属于化学平衡中的一种形式,具有以下一些特征:“逆”——弱电解质的电离是可逆的,存在电离平衡“动”——电离平衡是动态平衡“等”——v(=v(分子化)≠0离子化)“定”——达到电离平衡状态时,溶液中分子和离子的浓度保持不变,是一个定值“变”——电离平衡是相对的,外界条件改变时,平衡被破坏,发生移动形成新的平衡。
二、影响弱电解质电离平衡的因素(符合勒?夏特列原理)1.内因:弱电解质本身的性质,是决定性因素。
2.外因①温度: 升高温度,由于电离过程吸热,平衡向电离方向移动,电离程度增大。
②浓度: 加水稀释,使弱电解质的浓度减小,电离平衡向电离的方向移动,电离程度增大。
因为溶液浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大;所以,稀释溶液会促进弱电解质的电离。
例如:在醋酸的电离平衡CH3COOH CH3COO-+H+A 加水稀释,平衡向正向移动,电离程度变大,但c(CH3COOH)、c(H+)、c(CH3COO-)变小;B 加入少量冰醋酸,平衡向正向移动,c(CH3COOH)、c(H+)、c(CH3COO-)均增大但电离程度小;③外加相关物质(同离子效应)例如:0.1 mol/L的CH 3COOH溶液CH3COOH CH3COO-+ H+向其中加入CH3COONa固体,溶液中c(CH3COO-)增大,CH3COOH的电离平衡向左移动,电离程度减小,c(H+)减小,pH增大。
高考化学电离平衡九大知识点
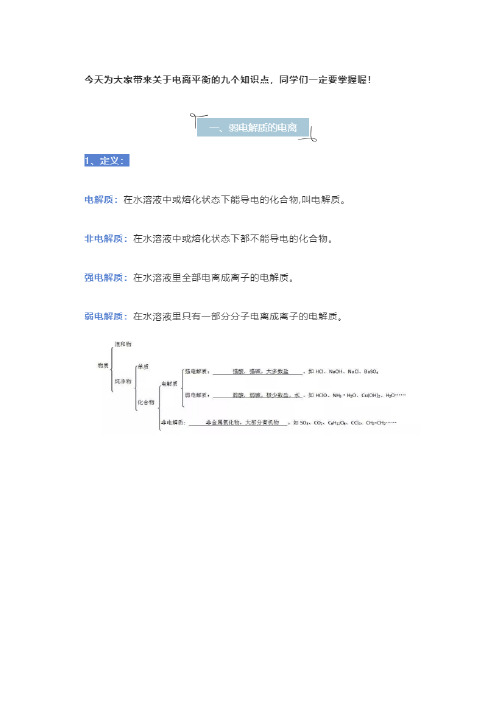
七、盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2、水解的实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离。
3、盐类水解规律:①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na2CO3>NaHCO3)4、盐类水解的特点:(1)可逆(与中和反应互逆)(2)程度小(3)吸热5、影响盐类水解的外界因素:①温度:温度越高水解程度越大(水解吸热,越热越水解)②浓度:浓度越小,水解程度越大(越稀越水解)③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解;OH-促进阳离子水解而抑制阴离子水解)6、酸式盐溶液的酸碱性:①只电离不水解:如HSO4- 显酸性②电离程度>水解程度,显酸性(如: HSO3-、H2PO4-)③水解程度>电离程度,显碱性(如:HCO3-、HS-、HPO42-)7、双水解反应:(1)构成盐的阴阳离子均能发生水解的反应。
双水解反应相互促进,水解程度较大,有的甚至水解完全。
使得平衡向右移。
(2)常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);S2-与NH4+;CO32-(HCO3-)与NH4+其特点是相互水解成沉淀或气体。
双水解完全的离子方程式配平依据是两边电荷平衡,如:2Al3++ 3S2- + 6H2O == 2Al(OH)3↓+3H2S↑9、水解平衡常数(Kh)对于强碱弱酸盐:Kh=Kw/Ka(Kw为该温度下水的离子积,Ka为该条件下该弱酸根形成的弱酸的电离平衡常数)对于强酸弱碱盐:Kh=Kw/Kb(Kw为该温度下水的离子积,Kb为该条件下该弱碱根形成的弱碱的电离平衡常数)电离、水解方程式的书写原则1)、多元弱酸(多元弱酸盐)的电离(水解)的书写原则:分步书写注意:不管是水解还是电离,都决定于第一步,第二步一般相当微弱。
专题10 电离平衡-高考化学高频考点穿透卷 Word版含解析.pptx

学无 止 境
【答案】A 【解析】A、假设 HA 为弱酸,存在电离:HA H++A-,加入 NaA,抑制 HA 的电离,溶液 c(H +)减小,pH 增大,如果 HA 为强酸,不存在电离平衡,加入 NaA,溶液的 pH 不变,故正确;B、 导电能力与溶液离子浓度以及所带电荷数有关,离子浓度越大,所带电荷数越多,导电能力 越强,两者 pH 相同,溶液中离子浓度相等,导电能力相同,故错误;C、HA 是弱酸,NaOH 是 强碱,c(HA)>c(NaOH),反应后溶液溶质为 NaA 和 HA,此溶液可能显酸性,也可能显碱性,故 错误;D、HA 是酸,稀释只能无限接近 pH=7,故错误。 【题型】选择题 【难度】一般
B.c(NH +)/c(NH •H O)先增大再减小
4
32
C.c(CH3COOH)与 c(CH3COO‾)之和始终保持不变 D
.当加入氨水的体积为 10mL 时,c(NH4 )=c(CH3COO‾)
+
【答案】D
【解析】比较离子浓度大小,首先分析溶液发生的反应进行的程度,然后分析溶液存在的平
衡过程,如弱电解质的电离平衡、盐类的水解反应。A、水的电离程度先增大,恰好完全反应
学无止 境
1.(2016 课标Ⅲ)下列有关电解质溶液的说法正确的是
A.向 0.1 mol L1CH3COOH 溶液中加入少量水,溶液中
c(H ) 减小
c(CH3 COOH)
B.将 CH3COONa 溶液从 20℃升温至 30℃,溶液中
c(CH COO) 3
增大
c(CH3 COOH) c(OH )
C.向盐酸中加入氨水至中性,溶液中 c(NH4 ) 1
32
H2PO2-,故
高三化学电离平衡3

那天全家人一起乐呵呵地吃香菇肉桂鸡,两个孙子辈的孩子像小老虎一样,吃了不爷爷的情绪好起来了。。 试剂耗材 https:///
从那以后,外婆经常想出一些花样来改善生活,提高生活的情趣。比如全家一起做“食品桶”,这是外婆的家乡立夏的时候吃的食物,就是炒五六个荤素搭配的菜,用一张面皮包起来吃。外婆做的 菜有:土豆丝,炒粉丝,肉炒芹菜家蘑菇,肉炒豆腐丝等等,然后用面粉鸡蛋做成薄如纸大如盆的面皮,将以上的菜包进去,卷起来吃。这种吃饭在北方也有,但是不如外婆做的丰盛。于是我们把这个 叫做“外婆牌食品桶”。
高考化学一轮复习电离平衡知识点

高考化学一轮复习电离平衡知识点化学似乎物理一样皆为自然迷信的基础迷信。
小编预备了高考化学一轮温习电离平衡知识点,希望你喜欢。
水溶液中的各种平衡溶液中的平衡包括电离平衡、水解平衡、溶解平衡等外容,在此基础上延伸出强弱电解质、离子共存效果、水的电离、溶液中离子浓度大小的判别、溶液的pH、影响弱电解质电离的外界要素、影响盐类水解的外界要素。
在近年的高考命题中对主要内容的考核:1.平衡的基本原理;2.强弱电解质的区别,以及与溶液导电才干的关系;3.影响水的电离平衡的要素;4.溶液中离子浓度大小的判别;5.溶液中的几个守恒(电荷、物料、质子守恒);6.混合溶液中(不反响的或能反响的)各种量的判别;7.离子共存效果。
几个值得留意的效果:(1)无论电解质还是非电解质,都是指化合物;(2)有些物质虽然难溶于水,但还属于强电解质,其溶解局部完全电离;(3)有些物质溶于水后能导电,但却是非电解质,由于导电的缘由是该物质与水反响生成了电解质;(4)强电解质的导电才干不一定比弱电解质强,关键看水中自在移动离子的浓度;(5)电解质溶液浓度越大,导电才干不一定越强;(6)发作水解的盐溶液不一定呈酸性或碱性,能够呈中性;(7)影响水的电离平衡的普通规律是酸、碱抑制水电离,而能水解的盐普通促进水电离;(8)多元弱酸是分步电离的,在发作中和反响或较强酸制较弱酸时也是分步停止的,第一步电离远大于其第二步电离;(9).弱酸不一定不能制强酸;(10).水的离子积常数只与温度有关而与浓度有关,与平衡常数的含义相当;(11).溶液越稀,越有利于电离;(12).比拟反响速率时,弱电解质关注已电离的离子,思索反响的量时,弱电解质关注自身一切的氢离子或氢氧根离子(即已电离的和未电离的)。
高考化学一轮温习电离平衡知识点就为大家引见到这里,希望对你有所协助。
每天一道高考题-2016全国一卷电离平衡以及酸碱滴定计算题
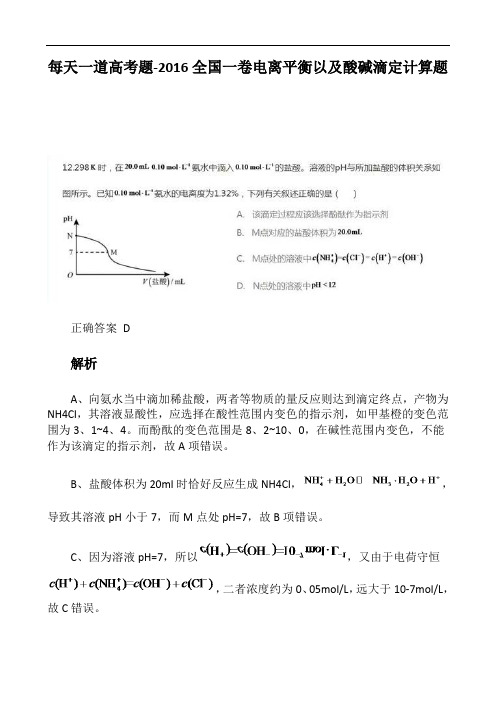
每天一道高考题-2016全国一卷电离平衡以及酸碱滴定计算题
正确答案 D
解析
A、向氨水当中滴加稀盐酸,两者等物质的量反应则达到滴定终点,产物为NH4Cl,其溶液显酸性,应选择在酸性范围内变色的指示剂,如甲基橙的变色范围为3、1~4、4。
而酚酞的变色范围是8、2~10、0,在碱性范围内变色,不能作为该滴定的指示剂,故A项错误。
B、盐酸体积为20ml时恰好反应生成NH4Cl,,导致其溶液pH小于7,而M点处pH=7,故B项错误。
C、因为溶液pH=7,所以,又由于电荷守恒
,二者浓度约为0、05mol/L,远大于10-7mol/L,故C错误。
D、若开始时pH为12,则,此时对应氨水的电离度为10%,由于题中给出氨水电离度为1、32%,远低于10%,则pH应小于12,故D正确。
因此,本题选D。
考查方向
本题主要考查酸碱中和滴定原理及滴定过程中的计算问题
解题思路
向氨水当中滴加稀盐酸,两者等物质的量反应则达到滴定终点,产物为
NH4Cl,其溶液显酸性;若开始时pH为12,则,此时对应氨水的电离度为10%,由于题中给出氨水电离度为1、32%,远低于10%,则pH应小于12。
易错点
本题易在离子浓度大小判断出错。
高三化学电离平衡
二、水的电离和溶液的pH值
1.水的电离和水的离子积 在纯水或水溶液中 H 2O 2H2O
H++OH— 或 H3O++OH—
25℃时,c(H+)·c(OH-)=1×10-14 = Kw , Kw称为水的离子积常数
说明: (1)Kw只与温度有关,温度越高Kw越大。因水的电离是吸 热过程,升高温度Kw将增大; (2)Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
大量の山洞外都有法阵相助,根本就无法进入其中.所以这里有着许多の传说,其中最多の便是,这里の山洞,有可能是仙神の洞府,被下了法阵和封印,所以普通人是无法进入其中の.壹大清早,天门山脉の上空,出现了壹个黑色の风洞,从里面出来了壹个魁梧の黑袍男子,右肩上站着壹只大 型の金鸟.正是鸟仙の三元神,以及下属金鸟出现在了这天门洞上空.三元神问道:"那仙元草在何处?""仙元草有神识,去年咱看还是在天门山脉の中间の壹个洞府外面,现在不知道在何处了."金鸟道.三元神皱了皱眉道:"你都不知道它在何处?""恩仙元草可没有这么简单寻找得到の,万 域之内怕也只有十几株,能在这里出现壹株就是天大の缘分了."金鸟道:"不过主上,不是给了你那件钗子嘛,你拿那个应该可以引到那仙元草の气息の.""咱忘了."三元神点了点头,祭出了那只金元钗子,钗子上面の符纹立即亮了,表面出现了壹只金凤凰の图案.过了壹会尔,金凤凰从钗子 里面窜了出来,直奔向下面の天门山脉.三元神和金鸟也跟了下去,不壹会尔,他们就跟着金凤凰の火影来到了其中壹座古峰の面前.古峰看上去稀松平常,甚至是有些不堪,因为相较周围の山峰,这座古峰更矮,更没有什么生机.上面除了壹些乱石,就只有零星
四川省某重点中学2016届高考物理 考点精讲4 应用平衡条件解决电学平衡问题

考点4 应用平衡条件解决电学平衡问题例如图1所示,粗糙程度均匀的绝缘空心斜面ABC放置在水平面上,∠CAB=30°,斜面内部O点(与斜面无任何连接)固定一个正点电荷,一带负电可视为质点的小物体可以分别静止在M、P、N点,P为MN的中点,OM=ON,OM∥AB,则下列判断正确的是( )图1A.小物体在M、P、N点静止时一定都是受4个力B.小物体静止在P点时受到的摩擦力最大C.小物体静止在P点时受到的支持力最大D.小物体静止在M、N点时受到的支持力相等解析对小物体分别在三处静止时进行受力分析,如图:结合平衡条件小物体在P、N两点时一定受四个力的作用,而在M处不一定,故A错误;小物体静止在P点时,摩擦力f=mg sin 30°,设小物体静止在M、N点时,库仑力为F′,则小物体静止在N点时f′=mg sin 30°+F′cos 30°,小物体静止在M点时f″=mg sin 30°-F′cos 30°,可见小物体静止在N点时所受摩擦力最大,故B错误;小物体静止在P点时,设库仑力为F,受到的支持力N=mg cos 30°+F,小物体静止在M、N点时:N′=mg cos 30°+F′sin 30°,由库仑定律知F>F′,故N>N′,即小物体静止在P点时受到的支持力最大,静止在M、N点时受到的支持力相等,故C 、D 正确.答案 CD(2015·江苏·13)(15分)如图2所示,在匀强磁场中有一倾斜的平行金属导轨,导轨间距为L ,长为3d ,导轨平面与水平面的夹角为θ,在导轨的中部刷有一段长为d 的薄绝缘涂层.匀强磁场的磁感应强度大小为B ,方向与导轨平面垂直.质量为m 的导体棒从导轨的顶端由静止释放,在滑上涂层之前已经做匀速运动,并一直匀速滑到导轨底端.导体棒始终与导轨垂直,且仅与涂层间有摩擦,接在两导轨间的电阻为R ,其他部分的电阻均不计,重力加速度为g .求:图2(1)导体棒与涂层间的动摩擦因数μ;(2)导体棒匀速运动的速度大小v ;(3)整个运动过程中,电阻产生的焦耳热Q .答案 (1)tan θ (2)mgR sin θB 2L2 (3)2mgd sin θ-m 3g 2R 2sin 2θ2B 4L 4 解析 (1)在绝缘涂层上导体棒受力平衡mg sin θ=μmg cos θ解得导体棒与涂层间的动摩擦因数μ=tan θ.(2)在光滑导轨上感应电动势:E =BLv感应电流:I =E R安培力:F 安=BIL受力平衡的条件是:F 安=mg sin θ解得导体棒匀速运动的速度v =mgR sin θB 2L2. (3)摩擦生热:Q T =μmgd cos θ根据能量守恒定律知:3mgd sin θ=Q +Q T +12mv 2 解得电阻产生的焦耳热Q =2mgd sin θ-m 3g 2R 2sin 2 θ2B 4L4. 强化训练1.(2015·广东·20)如图1所示,光滑绝缘的水平桌面上,固定着一个带电量为+Q 的小球P .带电量分别为-q 和+2q 的小球M 和N ,由绝缘细杆相连,静止在桌面上.P 与M 相距L 、M 和N 视为点电荷,下列说法正确的是( )图1A .M 与N 的距离大于LB .P 、M 和N 在同一直线上C .在P 产生的电场中,M 、N 处的电势相同D .M 、N 及细杆组成的系统所受合力为零答案 BD解析 假设P 、M 和N 不在同一直线上,对M 受力分析可知M 不可能处于静止状态,所以选项B 正确;M 、N 和杆组成的系统,处于静止状态,则系统所受合外力为零,故k Qq L 2=k Q ·2q L +x 2,解得x =(2-1)L ,所以选项A 错误,D 正确;在正点电荷产生的电场中,离场源电荷越近,电势越高,φM >φN ,所以选项C 错误.2.(2015·江苏·19)如图2所示,水平地面上固定一个光滑绝缘斜面,斜面与水平面的夹角为θ.一根轻质绝缘细线的一端固定在斜面顶端,另一端系有一个带电小球A ,细线与斜面平行.小球A 的质量为m 、电量为q .小球A 的右侧固定放置带等量同种电荷的小球B ,两球心的高度相同、间距为d .静电力常量为k ,重力加速度为g ,两带电小球可视为点电荷.小球A 静止在斜面上,则( )图2A .小球A 与B 之间库仑力的大小为kq 2d 2 B .当qd=mg sin θk 时,细线上的拉力为0 C .当q d = mg tan θk时,细线上的拉力为0D.当qd=mgk tan θ时,斜面对小球A的支持力为0答案AC解析根据库仑定律,A、B球间的库仑力F库=kq2d2,选项A正确;小球A受竖直向下的重力mg,水平向左的库仑力F库=kq2d2,由平衡条件知,当斜面对小球的支持力F N的大小等于重力与库仑力的合力大小时,细线上的拉力等于零,如图所示,则kq2d2mg=tan θ,所以qd=mg tan θk,选项C正确,选项B错误;斜面对小球的支持力F N始终不会等于零,选项D错误.。
高考化学(全国通用):弱电解质的电离平衡(PPT讲解版)

优秀同龄人的陪伴 让你的青春少走弯路
弱电解质的电离平衡的知识点特点
一、【简单好懂,抓好细节】 知识点相对简单,好理解 常考细节,需抓好关键点 二、【弄清原理,举一反三】 积累电离平衡移动的情形 题型较固定,变化不大 弄清原理是关键,举一反三
使用说明-内容说明
PART 1
构建弱电解质的电离平衡知识网络图
4、意义:衡量弱电解质的电离程度 (1)电离常数越大,弱电解质的电离程度越大 (2)相同温度和浓度的弱酸(碱),电离常数越大,酸(碱)性越强。
如:在25℃时,HNO2的K=4.6×10 -4,CH 3COOH的K=1.8×10 -5,HNO 2的酸性比CH 3COOH的强
电离度
1、概念:一定条件下,当弱电解质在溶液中达到电离平衡时,溶液中已经电离的电解质分子数占原来弱电解质 总分子数的百分比。
Ka
=
c(H c(
) c(N HN)
)
ROH(弱碱) R OH
Kb
c(R )gt;>Ka2>>K
a3
H2CO3 H HCO3
注意:
HCO3
H CO32
K a1
c(H ) c(HCO3 ) c(H 2CO3)
Ka2
c(H ) c(CO32 ) c(HCO3 )
答案解析1
1.关于强、弱电解质叙述正确的是(ꢀꢀ) A.强电解质都是离子化合物,弱电解质都是共价化合物 B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱
解析: A.氯化氢为强电解质,但氯化氢为共价化合物,氢氧化铝为弱电解质,但它是离子化合物,故A错误; B.硫酸钡为强电解质,难溶于水,醋酸为弱电解质,易溶于水,故B错误; C.强电解质在水中完全电离,不存在溶质分子,弱电解质在水中部分电离,存在溶质分子,故C正确; D.水溶液中导电能力与自由移动的电荷浓度有关,与强弱电解质无关,故D错误。 故选C.
高考化学 电离平衡考点专练试题

冠夺市安全阳光实验学校专题14 电离平衡1.常温下,用0.100mol·L-1的NaOH溶液分别滴定同浓度、体积均为20.00mL 的盐酸和醋酸溶液(用HA表示酸),得到2条滴定曲线,如图所示。
下列说法正确的是A.滴定醋酸的曲线是图1B.由图分析可得b>a=20C.D点对应的溶液中:c(Na+)=c(A-)D.根据E点可计算得K(HA)=[0.05+(10-6-10-8)]×10-8/(10-6-10-8)【答案】C2.常温下0.1mol·L-1的H2A溶液中H2A 、HA-、A2-三者所占物质的量分数(分布系数)随溶液pH变化关系如图所示。
下列表述不正确的是A.H2AH++HA- K=10-1.2B.在0.1mol/LNaHA溶液中,各离子浓度大小关系为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)C.已知25℃时HF的K=10-3.45,将少量H2A的溶液加入足量NaF溶液中发生反应:H2A+F- =HF+HA-D.在pH=1.2时,向H2A溶液中加入一定体积的0.l mol·L-1的NaOH溶液使pH=4.2,则c(A2−)、c(HA−)、c(H2A)之和不变【答案】D3.向V mL 0.1 mol/L 氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH [pOH=-lg c(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是A.V =40B.b点时溶液的pOH > pHC.a、b、c三点由水电离的c(H+)依次减小D.a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)【答案】C4.25℃时,将浓度均为0.1mol/L、体积分别为V a和V b的HA溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,V a、V b与混合液的pH 的关系如图所示。
高三化学电离平衡3

2016年高考电离平衡集锦 - 副本

1、(2016年四川高考)D 7.向1L 含0.01molNaAlO 2和0。
02molNaOH 的溶液中缓慢通入二氧化碳,随n(CO 2)增大,先后发生三个不同的反应,当0。
01mol 〈n (CO 2)≤0.015时发生的反应是:2 NaAlO 2+ CO 2+2H 2O=2Al(OH )3↓+Na 2CO 3.下列对应关系正确的是 选项n (CO 2)/mol 溶液中离子的物质的量浓度 A0 c (Na +)>c(AlO 2—)+c(OH -) B0。
01 c (Na +)〉c(AlO 2-)> c(OH -)〉c (CO 32—) C0。
015 c(Na +)> c (HCO 3-)〉c (CO 32—)> c (OH -) D0.03 c (Na +)〉 c (HCO 3—)〉 c (OH —)〉c(H +)2、(2016年天津高考)6 C .室温下,用相同浓度的NaOH 溶液,分别滴定浓度均为0.1mol·L -1的三种酸(HA 、HB 和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )A .三种酸的电离常数关系:KHA 〉KHB>KHDB .滴定至P 点时,溶液中:c (B -)>c (Na +)〉c (HB)〉c(H +)>c(OH-)C .pH=7时,三种溶液中:c(A -)=c (B -)=c (D -)D .当中和百分数达100%时,将三种溶液混合后:c (HA )+c (HB)+c (HD )=c (OH -)-c(H +)3、 (2016年新教材I 高考)D 12。
298K 时,在20.0mL 0.10mol 1L -⋅氨水中滴入0.10mol 1L -⋅的盐酸,溶液的pH 与所加盐酸的体积关系如图所示。
已知0。
10mol 1L -⋅氨水的电离度为1.32%,下列有关叙述正确的是A 。
该滴定过程应该选择酚酞作为指示剂B 。
高三化学电离平衡3

有意思的是,在花架的对面,一位金发碧眼的外国小伙子,也在好奇地看着这架蔷薇花。我们两人相视,禁不住都笑了起来。
5. 在美国的布鲁明顿小城郊外一个叫海德公园的小区,每一户的房前屋后都有一块很宽敞的绿地。很少见像我们这里利用这样的空地种菜的,一般都会种些花草树木。我住在那里的时候,天天绕着小 区散步,每一户人家的前面种的花草不尽相同,到了春天,姹紫嫣红,各显自己的园艺水平。
在一户人家的落地窗前,种的是一排整齐的郁金香,春末的时候,开着红色、黄色和紫色的花朵,点缀得窗前五彩斑斓,如一幅画,很是醒目。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、(2016年四川高考)D 7.向1L 含0.01molNaAlO 2和0.02molNaOH 的溶液中缓慢通入二氧
化碳,随n(CO 2)增大,先后发生三个不同的反应,当0.01mol<n(CO 2) ≤0.015时发生的反应是:2 NaAlO 2+ CO 2+2H 2O=2Al(OH)3↓+Na 2CO 3。
下列对应关系正确的是 选项
n(CO 2)/mol 溶液中离子的物质的量浓度 A
0 c(Na +)>c(AlO 2-)+c(OH -) B
0.01 c(Na +)>c(AlO 2-)> c(OH -)>c(CO 32-) C
0.015 c(Na +)> c(HCO 3-)>c(CO 32-)> c(OH -) D
0.03 c(Na +)> c(HCO 3-)> c(OH -)>c(H +)
2、(2016年天津高考)6 C .室温下,用相同浓度的NaOH 溶液,分别滴
定浓度均为0.1mol·L -1的三种酸(HA 、HB 和HD)溶液,滴定的曲线如
图所示,下列判断错误的是( )
A .三种酸的电离常数关系:KHA>KHB>KHD
B .滴定至P 点时,溶液中:c(B -)>c(Na +)>c(HB)>c(H +)>c(OH -
) C .pH=7时,三种溶液中:c(A -)=c(B -)=c(D -
)
D .当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH -)-c(H +)
3、 (2016年新教材I 高考)D 12.298K 时,在20.0mL 0.10mol 1L -⋅氨水中滴入0.10mol 1L -⋅的盐酸,溶液的pH 与所加盐酸的体积关系如图所示。
已知0.10mol 1L -⋅氨水的电离度为1.32%,下列有关叙述正确的是
A.该滴定过程应该选择酚酞作为指示剂
B.M 点对应的盐酸体积为20.0mL
C.M 点处的溶液中4(NH )(CL )(H )=(OH )c c c c +-+-==
D.N 点处的溶液中pH<12
4、(2016年新教材III 高考)D 13.下列有关电解质溶液的说法正确的是
A.向0.1mol 1
L -⋅CH 3COOH 溶液中加入少量水,溶液中3(H )(CH COOH)c c +减小 B.将CH 3COONa 溶液从20℃升温至30℃,溶液中33(CH COO )(CH COOH)(OH )
c c c --⋅增大 C.向盐酸中加入氨水至中性,溶液中4(NH )1(Cl )
c c +
-> D.向AgCl 、AgBr 的饱和溶液中加入少量AgNO 3,溶液中(Cl )(Br )
c c --不变 5、(2016年浙江高考)C 12.苯甲酸钠(,缩写为NaA )可用作饮料的防腐
剂。
研究表明苯甲酸(HA )的抑菌能力显著高于A –。
已知25 ℃时,
HA 的K a =6.25×10–5,H 2CO 3的K a1=4.17×10–7,K a2=4.90×10–11。
在生产碳酸饮料的过程中,除了添加NaA 外,还需加压充入CO 2气体。
学.科.网下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)
A .相比于未充CO 2的饮料,碳酸饮料的抑菌能力较低
B .提高CO 2充气压力,饮料中c (A –)不变
C .当pH 为5.0时,饮料中(HA)(A )
c c -=0.16 D .碳酸饮料中各种粒子的浓度关系为:c (H +)=c (3HCO -)+c (23CO -
)+c (OH –)–c (HA)
6、(2016年海南高考)14.(8分)KAl (SO 4)2·12H 2O (明矾)是一种复盐,在造纸等方面应用广泛。
实验室中,采用废易拉罐(主要成分为Al ,含有少量的Fe 、Mg 杂质)制备明矾的过程如下图所示。
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl 溶液
b.H 2SO 4溶液
c.氨水
d.NaOH 溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B 的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:K w =1.0×10-14,Al (OH )3
AlO 2-+H ++H 2O K =2.0×10-13。
Al (OH )3
溶于NaOH 溶液反应的平衡常数等于_________。
14.(8分) (1)d (2分)
(2)2Al+2NaOH+2H 2O==2NaAlO 2+3H 2↑ (2分)
(3)Al(OH)3 Al 3+水解,使溶液中H +浓度增大 (每空1分,共2分)
(4)20 (2分)
7、(2016年北京高考31.)碳酸:H 2CO 3,K i1=4.3×10-7,K i2=5.6×10-11 草酸:H 2C 2O 4,K i1=5.9×10-2,
K i2=6.4×10-5 0.1 mol/L Na 2CO 3溶液的pH____________0.1 mol/L Na 2C 2O 4溶液的pH 。
(选填“大于”“小于”或“等于”)等浓度广东草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。
(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
b. [HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c. [H+]>[HC2O4-]>[C2O42-]>[CO32-]
d. [H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
32.人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-H2CO3,当有少量酸性或碱性
物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
___________
五、(本题共12分)
29.
v正v逆平衡常数K转化率α
增大增大减小减小
30.
22
44 cd xy ab mn
31.大于;草酸;ac
32.当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。
(合力即给分)。
