氢氧化亚铁的制备专题
氢氧化亚铁的制备.

4. 打开a处止水夹,用洗耳球从b处鼓气,使 试管Ⅱ中的氢氧化钠溶液被轻轻压入试管 Ⅰ中,即可在试管Ⅰ中看到白色絮状沉淀 生成。白色可在相当长的时间内不改变。 5. 从a处用洗耳球向试管Ⅰ中鼓入空气,振 荡,可看到白色絮状沉淀变成灰绿色, 最后变成红褐色。
改进Ⅴ
1. 向烧杯中加入无锈光亮的铁丝团或铁钉, 再加入1:4的稀硫酸,盖上一个表面皿, 给烧杯加热,待反应完全后,停止加热, 冷却待用。
3. 称取3.4g固体氯化铵置于洁净的烧杯 中,再加入28.5mL浓氨水,搅拌,溶解后, 移至50mL的容量瓶中,加入经煮沸过的、 冷却的蒸馏水稀释到刻度备用。 4. 在漏斗上放置一张折叠好的滤纸,用煮沸 过的蒸馏水润湿滤纸,并使之紧贴在漏斗 内壁,赶去滤纸和漏斗壁之间的气泡,再 注入较多的经煮沸的蒸馏水,使漏斗颈内 充满水形成水柱,这样既可加快过滤速度, 又可排除漏斗颈中的空气,防止Fe2+被氧 化。
氢氧化亚铁的制备
【实验目的】
1. 使学生掌握氢氧化亚铁制备的方法; 2. 使学生掌握产生氢氧化亚铁时的现象及 其转化为氢氧化铁时的现象。
【实验原理】
+2价铁离子与碱反应,生成白色絮状的氢氧化 亚铁沉淀,氢氧化亚铁在空气中不稳定,又迅 速变成灰绿色,最后变成红褐色的氢氧化铁沉 淀。反应的离子方程式及化学方程式为: Fe2++2OH- = Fe(OH)2↓ 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
3. 氢氧化亚铁的制备
取1支5mL针筒,将针头插入盛有硫酸亚铁的 针筒内,抽取2mL-3mL硫酸亚铁溶液,排出 空气,将此溶液通过胶帽,注入盛有氢氧化 钠溶液的针筒内,立即有白色沉淀生成(如图 7-30II所示)。
高中化学复习知识点:氢氧化亚铁的制备
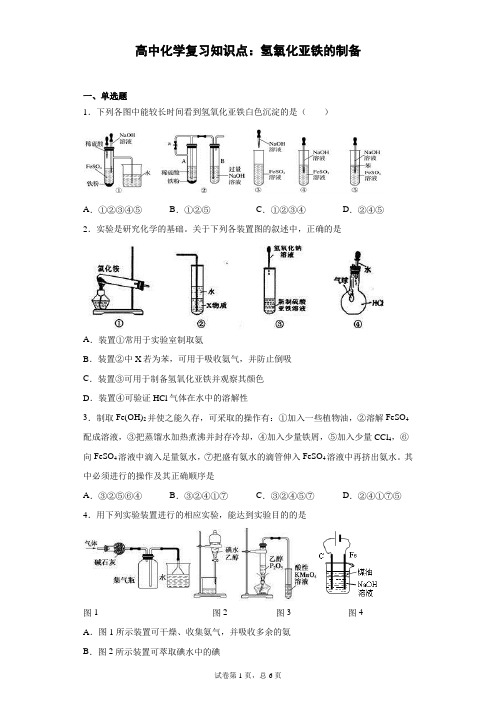
高中化学复习知识点:氢氧化亚铁的制备一、单选题1.下列各图中能较长时间看到氢氧化亚铁白色沉淀的是()A.①②③④⑤B.①②⑤C.①②③④D.②④⑤2.实验是研究化学的基础。
关于下列各装置图的叙述中,正确的是A.装置①常用于实验室制取氨B.装置②中X若为苯,可用于吸收氨气,并防止倒吸C.装置③可用于制备氢氧化亚铁并观察其颜色D.装置④可验证HCl气体在水中的溶解性3.制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并封存冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中再挤出氨水。
其中必须进行的操作及其正确顺序是A.③②⑤⑥④B.③②④①⑦C.③②④⑤⑦D.②④①⑦⑤4.用下列实验装置进行的相应实验,能达到实验目的的是图1 图2 图3 图4A.图1所示装置可干燥、收集氨气,并吸收多余的氨B.图2所示装置可萃取碘水中的碘C.图3所示装置可证明乙醇发生消去反应生成了乙烯D.图4所示装置可制备Fe(OH)2并能较长时间观察其颜色5.利用下列装置(部分仪器已省略),能顺利完成对应实验的是A.制硝基苯B.制氢氧化亚铁C.实验室制乙烯D.石油的蒸馏6.下列实验能达到目的的是()A.A B.B C.C D.D7.某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。
下列分析正确的是A.X可以是稀硫酸或稀硝酸或稀盐酸B.实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入XC.反应一段时间后可在烧瓶中观察到白色沉淀D.反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在8.下列实验符合操作要求且能达到实验目的的是()A.I可用于制备氢气并检验其可燃性B.II可用于除去CO2中的HClC.Ⅲ可用于配制一定物质的量浓度的NaOH溶液D.IV可用于制备氢氧化亚铁并长时间保存9.用下列各实验装置进行相应的实验,能达到实验目的的是A.用图甲装置证明SO2与NaOH溶液发生了反应B.用图乙装置检验某混合气体是否由SO2和CO2混合而成C.用图丙装置制备Fe(OH)2并能较长时间观察其颜色D.用图丁装置干燥、收集氯化氢,并吸收多余的氯化氢10.用下列实验装置进行相应实验,能达到实验目的的是A.用图1装置蒸发CuCl2溶液获得无水CuCl2B.用图2装置可证明非金属强弱:Cl>C>SiC.用图3装置制备少量白色的Fe(OH)2沉淀D.用图4装置进行已知浓度的NaOH溶液测定未知浓度的盐酸二、综合题11.某化学兴趣小组在实验室探究过渡金属元素化合物的性质I、铁及其化合物(1)向FeSO4溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了图①装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。
专题14 氢氧化亚铁、高铁酸盐的制备实验探究 -备战2024年高考化学考点微专题(解析版)

微专题14 氢氧化亚铁、高铁酸盐的制备1.(2019·浙江·高考真题)某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
Array请回答:(1) 仪器1的名称________。
装置5的作用________。
(2) 实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。
请为装置作一处改进,使溶液能进入4中________。
(3) 装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。
从实验操作过程分析没有产生白色沉淀的原因________。
【答案】(1) 滴液漏斗(分液漏斗)液封,防止空气进入装置4(2)在装置2、3之间添加控制开关(3)装置4内的空气没有排尽【解析】该装置制备Fe(OH)2白色沉淀的思路是在排尽空气的气氛中,先将铁屑和稀硫酸反应得到FeSO4,再利用气体产生的气压把FeSO4溶液压至装置4中与NaOH反应,得到Fe(OH)2,注意所需试剂也需要加热除掉溶解氧。
(1)观察仪器1特征可知是分液漏斗或者滴液漏斗,该反应需要置于无氧环境,注意这里跟防倒吸无关,可知装置5的作用是液封,防止空气进入装置4。
(2)实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。
如此操作,不行的原因在于仪器1产生的H2从左侧导管溢出,那么没有足够的压强不能将FeSO4溶液挤出,因而在装置2、3之间添加控制开关即可。
(3)灰绿色沉淀产生的原因是Fe(OH)2被空气氧化,因为装置4中空气没有完全排尽。
2.(2022·北京东城·统考二模)以相同的流速分别向经硫酸酸化和未经酸化的浓度均为0.1mol·L-1的FeSO4溶液中通入O2.溶液中pH随时间的变化如下图所示。
已知:0.1mol·L-1Fe3+生成Fe(OH)3,开始沉淀时pH=1.5,完全沉淀时pH=2.8下列说法不正确的是A.由图1可知,酸化的FeSO4溶液中发生反应:4Fe2++O2+4H+=4Fe3++2H2OB.图2中,t=0时刻,FeSO4溶液pH=5.7是由于Fe2+发生了水解反应C.由图2可知,未酸化的FeSO4溶液中发生反应生成Fe(OH)3的同时还生成了H+D.若向FeSO4溶液中先加入过量NaOH溶液再通入O2,pH先增大后明显减小【答案】D【解析】A.由图1可知,向酸化的FeSO4溶液中通入氧气,溶液的pH值未超过1.4,则亚铁离子被氧化为铁离子,还没开始沉淀,即发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O,A正确;B.由于未加硫酸酸化,但t=0时刻,FeSO4溶液pH=5.7,则说明是亚铁离子水解导致的,其水解方程式为:Fe2++2H2O Fe(OH)2+2H+,B正确;C.由图2的曲线变化趋势可知,溶液中的反应使其pH值下降,根据氢氧化铁的沉淀范围可知,氧气将亚铁离子氧化为氢氧化铁沉淀,同时生成氢离子,该反应为:4Fe2++O2+10H2O =4Fe(OH)3↓+8H+,C正确;D.根据所给条件可知,若向FeSO4溶液中先加入过量NaOH溶液再通入O2,发生的反应为:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O= 4Fe(OH)3,所以加入氢氧化钠后,溶液的pH会增大,通入氧气后,由于消耗水,溶液中氢氧根离子浓度会继续增大,D错误;故选D。
氢氧化亚铁的制备教学设计

氢氧化亚铁的制备教学设计一、教学目标:1.了解氢氧化亚铁的性质、用途及制备方法;2.掌握氢氧化亚铁的制备实验步骤和操作技巧;3.提高学生的实验观察、实验记录和实验报告的能力。
二、教学内容:1.氢氧化亚铁的性质和用途;2.氢氧化亚铁的制备方法;3.氢氧化亚铁的实验操作和实验记录。
三、教学过程设计:1.导入通过引入生活中与氢氧化亚铁相关的一些现象,如铁器的生锈等,引发学生对氢氧化亚铁的认识与兴趣。
2.知识讲解介绍氢氧化亚铁的化学性质和用途,包括其强还原性、防锈性和用作催化剂的特点。
通过示意图或实物展示,让学生对氢氧化亚铁有直观的了解。
3.实验步骤演示(1)准备器材:铁粉、氢氧化钠、蒸馏水、玻璃棒、玻璃试管、试管架、酒精灯等。
(2)实验操作:a.取一只干净的干燥玻璃试管,加入适量的铁粉。
b.用玻璃棒将铁粉压实,使其堆积均匀。
c.将试管放置在试管架上,点燃酒精灯,用火焰加热试管底部。
d.当试管底部开始变红时,加入适量的氢氧化钠固体,继续加热并观察试管内颜色的变化。
e.等到试管底部呈深红色时,取下试管,进行冷却。
4.实验记录学生在实验过程中进行实验记录,包括观察现象、实验步骤、试剂用量等细节。
5.讨论分析学生根据实验结果,结合理论知识,讨论可以得出氢氧化亚铁的制备反应方程式及反应机理。
6.实验总结学生通过实验结果,总结出制备氢氧化亚铁的关键条件和操作技巧,并进一步加深对氢氧化亚铁的理解和认识。
四、教学评估:1.课堂讨论:通过学生的参与讨论和回答问题,评估学生对氢氧化亚铁制备方法的理解和掌握程度。
2.实验报告:学生根据实验结果和实验记录,撰写实验报告,评估学生的实验观察、实验记录和实验报告的能力。
五、教学延伸:引导学生进一步了解氢氧化亚铁在工业生产中的应用,如用作染料工业的催化剂等,并进行相关实例分析。
六、教学反思:在教学中,要引导学生发现氢氧化亚铁制备实验中的关键点,并培养其实验操作的技能。
同时,要注重学生对实验原理的理解和实验结果的分析能力。
制备氢氧化亚铁的方程式

制备氢氧化亚铁的方程式最近,氢氧化亚铁(Fe(OH)2)在科学界备受关注,因为它具有重要的应用价值。
它可以用于吸收有害物质,清理污水,保护河流湖泊和海洋免受环境污染,还可以用作抗菌剂,用于生物治疗。
因此,本文将重点介绍制备氢氧化亚铁的方程式及其合成过程。
制备氢氧化亚铁的第一步是溶解铁粉异质水解。
在此过程中,铁粉容易地溶于酸、碱、硝酸或盐介质中。
在此试验中,采用饱和氢氧化钠溶液将铁粉溶解。
铁粉溶解后,形成酸性溶液,其中含有Fe2+和OH-离子。
第二步是进行氢氧化还原反应。
在此反应中,Fe2+离子通过氢氧化钠溶液与氢氧化钠结合,形成氢氧化亚铁(Fe(OH)2)。
氢氧化还原反应的反应方程式为:2Fe2+ + 2OH- + 4H2O ---> Fe(OH)2 + 4H+ + 2e-在此反应中,铁粉在氢氧化钠溶液中被氧化为铁原子,然后,铁原子结合到水分子中形成氢氧化亚铁。
第三步是通过沉淀方法从溶液中沉积出氢氧化亚铁。
在此过程中,在溶液中加入适量的铵离子,使氢氧化亚铁沉淀出来,形成铁氧化物。
反应方程式如下:Fe(OH)2 + 2NH4+ ---> [ Fe(NH4)2 (OH)2 ]最后,利用沉淀方法将[Fe(NH4)2(OH)2]的氢氧化亚铁从溶液中沉淀出来。
综上所述,制备氢氧化亚铁的方程式为:2Fe2+ + 2OH- + 4H2O --->Fe(OH)2 + 4H+ + 2e-。
在此反应中,Fe2+离子通过氢氧化钠溶液与氢氧化钠结合,形成氢氧化亚铁(Fe(OH)2)。
利用沉淀方法将[Fe(NH4)2(OH)2]的氢氧化亚铁从溶液中沉淀出来,最终完成制备氢氧化亚铁的过程。
此外,氢氧化亚铁还具有重要的应用,可用于清理污水,保护河流湖泊和海洋免受环境污染,还可以用作抗菌剂,用于生物治疗。
从上述内容可见,制备氢氧化亚铁的过程不仅十分复杂,而且需要严格控制条件,以得到较高纯度的氢氧化亚铁产品。
因此,在开展类似实验时,必须采取有效的措施,以确保试验室安全并且在过程中必须做到保持重复性。
氢氧化亚铁的制备 (2)

氢氧化亚铁的制备 2. 氢氧化钠溶液的配制
用蒸馏水配制50mL 20%的氢氧化钠溶液,煮 沸后,抽入到100mL针筒内,排尽空气,用胶 帽封口,备用。
3. 氢氧化亚铁的制备
取1支5mL针筒,将针头插入盛有硫酸亚铁的 针筒内,抽取2mL-3mL硫酸亚铁溶液,排出 空气,将此溶液通过胶帽,注入盛有氢氧化 钠溶液的针筒内,立即有白色沉淀生成(如图 II所示)。
氢氧化亚铁的制备
改进4 1. 如图所示,向试管Ⅰ中加入过量还原铁粉 和少量铜粉,然后加入适量稀硫酸;向试管Ⅱ 中加入适量氢氧化钠溶液,用止水夹夹住a处。
氢氧化亚铁的制备
2. 为了提高反应速率和排除溶液中的氧,给 试管Ⅰ、Ⅱ同时加热,煮沸。试管Ⅰ中生 成的氢气通过氢氧化钠溶液,从b处排出。
氢氧化亚铁的制备
氢氧化亚铁的制备
4. 氢氧化亚铁的氧化
将盛有白色絮状沉淀的针 胶帽去掉,抽入少量空气, 不断振荡,可看到白色沉 淀逐渐变成灰绿色,经多 次抽气、排气、振荡后, 沉淀变为红褐色。
氢氧化亚铁的制备 改进3
制取Fe(OH)2的实验装置
注意:做该 实验时,在 滴入硫酸亚 铁溶液之前, 滴液漏斗颈 中应充满不 含空气的硫 酸亚铁溶液。
5. 从a处用洗耳球向试管Ⅰ中鼓入空气,振 荡,可看到白色絮状沉淀变成灰绿色, 最后变成红褐色。
氢氧化亚铁的制备 改进5
氢氧化亚铁的制备
方法归纳
制备氢氧化亚铁的关键: 1.需要创造的条件: 无Fe3+的环境;无O2的环境 2.可以采取的措施: (1)排除溶液中的Fe3+ →加铁粉; (2)驱逐溶液中的溶解氧:加热煮沸; (3)隔绝空气: 反常规操作、油封、滴管的使用、 试剂瓶装满等
氢氧化亚铁的制备
微题型29 氢氧化亚铁、高铁酸钾制备实验探究(解析版)

微题型29 氢氧化亚铁、高铁酸钾制备实验探究时间:30分钟1.Fe(OH)2的制备实验是实验研究的热点,某化学学习小组设计了下列方法制备氢氧化亚铁。
方法一:用如图所示装置(夹持仪器省略)制备氢氧化亚铁。
实验步骤如下:I.检查装置气密性后,关闭K2、K5,打开K1、K3、K4,使装置A中产生的气体进入装置B中,排尽B中空气。
II.待B中空气排尽后,关闭K3,打开K2,将A中溶液压入B中并观察现象。
III.关闭K1、K2,打开K5,使C中气体通入B中并观察现象。
回答下列问题:(1)仪器a的名称是___________,B中长玻璃管的作用___________。
(2)H2O2的电子式___________。
(3)装置A中金属离子的检验方法___________。
(4)步骤III装置B中的现象是___________,其发生反应的化学方程式为___________。
方法二:用铁和石墨作电极材料,通过电解法制备氢氧化亚铁,装置如图所示。
(1)铁与电源的___________(填“正”或“负”)极相连。
(2)阴极发生的电极反应方程式___________。
(3)在标准状况下,当阴极产生11.2L 气体时,理论上生成___________g Fe(OH)2。
【答案】方法一:(1)恒压分液漏斗平衡气压或辅助排除装置B中的空气(2)(3)取少量装置A烧瓶中的液体于洁净试管中,滴加几滴KSCN溶液,无血红色出现,再滴加H2O2溶液变为血红色,则证明存在Fe2+(4)白色沉淀逐渐变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3方法二:(1)正极(2)2H2O+2e-=H2↑+2OH-(3)45【分析】本实验制备氢氧化亚铁,方法一:因为氢氧化亚铁容易被氧气氧化,因此先用装置A产生的H2排除装置B中的空气,然后关闭K3,打开K2,将A中FeSO4压入装置B中,发生Fe2++2OH-=Fe(OH)2↓,观察现象;方法二:利用电解原理产生氢氧化亚铁,根据电解原理,铁单质应作阳极,阳极反应式为Fe-2e-=Fe2+,阴极反应式为2H2O+2e-=H2↑+2OH-,总电极反应式为Fe+2H2O通电Fe(OH)2↓+H2↑,据此分析解答。
氢氧化亚铁和氢氧化铁的制取

氢氧化亚铁和氢氧化铁的制取课题:氢氧化亚铁和氢氧化铁的制取摘要:氢氧化亚铁与氢氧化铁都是重要的无机化合物,本文介绍了两者的主要性质,并讨论了它们的制取方法。
以铁和氢氧化钠为原料,采用催化反应的方法,可在一定的pH值和温度条件下,形成氢氧化铁以及相应的氢氧化亚铁。
另外,采用碱溶解法、湿法法等,也可以制取氢氧化铁和氢氧化亚铁。
本文还介绍了高化氢氧化铁、氢氧化铁凝胶等制备过程。
关键词:氢氧化亚铁,氢氧化铁,催化,碱溶解,高化IntroductionHydrated ferric oxide and ferrous hydroxide are important inorganic compounds. They have a variety of physical and chemical properties, and have a wide range of applications in chemical production and life. This paper introduces the main properties of the two, and discusses their preparation methods, so as to provide references for the production of ferric hydroxide and hydrous ferric oxide.1 Properties of Hydrated Ferric Oxide and FerrousHydroxideHydrated ferric oxide, chemical formula is Fe(OH)3, is an amorphous white-gray powder. The structure is three-dimensional, the crystals are in a rhombic crystal system,and its Mohs hardness is up to 4-4.5. Under normaltemperature and pressure, it has a melting point of 630-650 °C, a boiling point of 7000-9000 °C and specificgravity of 5.28-5.32 g/cm3. Soluble in acids and ammonium salts, insoluble in water, almost insoluble in ethanol,alkali and other organic solvents. The lattice constants area = 5.35 Å and c = 6.41 Å.Ferrous hydroxide, chemical formula Fe(OH)2, is an amorphous light grey powder. Its structure is three-dimensional and of rhombic crystal system. Under normal temperature and pressure, it has melting point at 667℃,boiling point of 6500-7000℃ and specific gravity of 4.19g/cm3. It is soluble in acids and alkalis, almost insolublein water, ethanol, and other organic solvents. The lattice constants are a = 4.9680 Å and c = 4.7144 Å.2 Method of Preparing Hydrous Ferric Oxide and Ferrous Hydroxide2.1 Catalytic Reaction MethodThe catalytic reaction method is to use iron and sodium hydroxide as raw materials, under the condition of thecertain pH value and temperature, the reaction of ferrous hydroxide and sodium hydroxide is carried out, and the products of ferrous hydroxide and hydrous ferric oxide are formed. First, the iron and sodium hydroxide are weighed according to the molar ratio of 1:3, and then the solution is stirred evenly and heated to 100℃. Under the basic condition, the reaction progresses rapidly, and the reaction reaches the end after 1.5h. Finally, the products are cooled, filteredand washed with deionized water, and then dried to obtain the products.2.2 Alkali Dissolution MethodAlkali dissolution method is to use a large amount of strong alkali, such as caustic soda and caustic potash, as the dissolution agent to obtain the correspondingproducts.The method is as follows: about 20 g of iron oxideis divided into two parts, one of which is added to the aqueous solution of caustic soda at a concentration of 26.9%, and the other is added to the aqueous solution of caustic potash at a concentration of 35.3%. After three hours of stirring at about 60℃, the reaction is over. Then use filter paper to filter out insoluble substances, and wash with deionized water repeatedly to obtain the product. After drying, the products are hydrous ferric oxide and ferrous hydroxide.2.3 Wet ProcessUsing FeCl2, FeCl3 and NaOH as raw materials, FeOH2 andFe(OH)3 can be obtained by wet process. The reacting system needs to be controlled at the alkaline side. The molar ratio of Fe2+ and Fe3+ is 1:1, and the molar ratio of Fe3+ and NaOH is 1:3. The production method is as follows: firstly, prepare the FeCl2 and FeCl3 aqueous solution in the beaker according to certain concentration. Then slowly add a certain concentration of NaOH aqueous solution to the FeCl2, FeCl3 aqueous solution, and use the magnetic stirrer to make the FeCl2 and FeCl3 aqueous solution evenly dispersed in the NaOH aqueous solution. After stirring for 1 hour at the same temperature, the reaction is over and the products formed are hydrous ferric oxide and ferrous hydroxide. After cooling andfiltration, the product of the reaction is obtained bywashing with deionized water and drying.2.4 Preparation of High-Metallized Ferric HydroxideHigh-metallized ferric hydroxide has higher Ferric hydroxide content and better stability. Its preparationmethod is as follows: firstly, prepare the FeCl2, FeCl3 aqueous solution and the NaOH aqueous solution with certain concentration. Then, slowly add NaOH aqueous solution toFeCl2, FeCl3 aqueous solution, add FeCl2, FeCl3 aqueous solution and NaOH aqueous solution in the ratio of 1:3:3, and add the average particle diameter 0.3-3μm ferric hydroxide into the mixture solution. After stirring, the molar ratio of Fe2+ with NAOH should be controlled to be 1:[2~2.5], and the reaction time should be 1-2h. After the reaction is completed, it can be obtained after cooling, filtering and washing with deionized water.2.5 Preparation of Ferric Hydroxide GelThe preparation of ferric hydroxide gel includes two steps. The first step is the preparation of ferric hydroxide. Please refer to the catalytic reaction method in the above paragraph 2.1 for details. The second step is to add the ferric hydroxide solution obtained in the first step into a neutral gelator solution, and evenly mix them, and stir for 30 minutes. Then, the obtained gel is washed with deionizedwater several times and dried for a certain time to obtainthe finished product. Experiments have shown that thegelation rate of ferric hydroxide was up to 70%.ConclusionThat's all for this article. In summary, hydrated ferric oxide and ferrous hydroxide have many important physical and chemical properties, and they have high application value in chemical production and life. This paper mainly introducesthe properties of hydrated ferric oxide and ferrous hydroxide, and discusses their preparation methods. By catalytic reaction, alkali dissolution, wet process and other methods, hydrous ferric oxide and ferrous hydroxide can be prepared.In addition, this paper also introduces the preparation process of high-metallized ferric hydroxide and ferric hydroxide gel, so as to provide references for thepreparation of the two products.。
用硫酸亚铁制备氢氧化亚铁

用硫酸亚铁制备氢氧化亚铁1.引言1.1 概述硫酸亚铁是一种重要的无机化合物,是通过将硫酸与亚铁粉末反应得到的。
它具有广泛的应用领域,特别是在化学实验室和工业生产中。
而氢氧化亚铁则可通过将硫酸亚铁溶液与碱反应得到。
本文将介绍使用硫酸亚铁制备氢氧化亚铁的方法,这是一种常用的实验室制备方法。
首先将详细介绍制备硫酸亚铁的步骤和实验条件。
然后,将介绍制备氢氧化亚铁的方法,包括反应的化学方程式和实验过程。
最后,将总结实验结果并讨论可能的应用领域。
通过本文的阅读,读者将了解到硫酸亚铁和氢氧化亚铁的制备方法,并了解到其在实验室和工业中的应用。
同时,读者也可以了解到实验过程和实验条件,以便在需要的时候可以进行类似的实验。
此外,本文还将提供可能的应用领域,为读者进一步的研究和应用提供参考。
1.2文章结构文章结构部分的内容可以包括如下内容:文章结构部分旨在介绍本文的整体结构和各个部分的内容安排,以便读者能够更好地理解文章的逻辑和组织架构。
本文分为引言、正文和结论三个部分。
引言部分将对本文进行概述,介绍硫酸亚铁和氢氧化亚铁的相关背景知识,以及本文的研究目的。
正文部分包括了制备硫酸亚铁和制备氢氧化亚铁的方法。
在制备硫酸亚铁的方法中,将介绍所采用的实验步骤、原材料和操作条件,以及反应机理和反应过程。
在制备氢氧化亚铁的方法中,同样会给出实验步骤、原材料和操作条件,并解释反应机理和反应过程。
结论部分将总结本次实验的结果,对实验数据进行归纳和分析,并提出可能的应用领域。
通过实验结果的总结,可以对制备硫酸亚铁和氢氧化亚铁的方法进行评估和比较,指出其优缺点及存在的问题,并展望其在实际应用中的潜力和前景。
以上就是本文的结构安排,通过这样的结构安排,读者可以清晰地了解文章内容的组成和逻辑关系,有助于读者更好地理解和阅读文章。
1.3 目的本文旨在介绍用硫酸亚铁制备氢氧化亚铁的方法和过程,并探讨其可能的应用领域。
通过实验和理论分析,我们将深入了解硫酸亚铁和氢氧化亚铁的性质、制备方法和反应机理,为进一步研究和应用提供基础。
实验室制备氢氧化亚铁的改进方法

实验室制备氢氧化亚铁的改进方法氢氧化亚铁(Fe(OH)2)是一种重要的无机化合物,具有广泛的应用和研究价值。
在实验室中制备氢氧化亚铁的方法有很多种,但是传统的方法往往存在繁琐、耗时、产率低等问题。
因此,本文将针对实验室制备氢氧化亚铁的传统方法进行改进,以提高制备效率和产率。
1.传统方法分析在传统方法中,通常采用铁盐与氢氧化物反应制备氢氧化亚铁,常见的反应有硫酸亚铁和氢氧化钠反应、硫酸亚铁和氢氧化铵反应等。
这些方法存在着以下问题:a.产率低:传统方法往往需要较长的反应时间才能获得较高的产率,且产率仍然比较低。
b.产物纯度低:传统方法中产生的氢氧化亚铁常常含有杂质,需要进行进一步的纯化处理。
c.实验操作复杂:传统方法中需要多次反应和纯化步骤,操作繁琐且易出错。
2.改进方法为了解决传统方法存在的问题,我们可以尝试以下改进方法:a.改进反应条件:通过热处理、催化剂辅助等方式改进反应条件,提高反应速率和产率。
b.优化纯化步骤:通过适当的溶剂提取、结晶和过滤等方法优化纯化步骤,提高产物纯度。
c.简化操作流程:尝试将多步反应流程简化为单步反应,减少操作步骤,提高操作效率。
3.具体改进方案a.改进反应条件为了提高氢氧化亚铁的产率和纯度,可以尝试引入一定量的催化剂,如氢氧化钠、氢氧化铵等,通过提高反应温度和压力等手段,加速反应速率。
同时,可以尝试在无水条件下进行反应,以减少产物的杂质物质。
b.优化纯化步骤在反应完成后,可以使用适当的有机溶剂提取产物,将溶解的氢氧化亚铁溶液在低温下缓慢结晶,得到较高纯度的产品。
过滤后,氢氧化亚铁可以通过真空干燥或空气干燥等方式得到固体产物。
c.简化操作流程可以尝试将多步反应流程简化为单步反应,例如直接将硫酸亚铁和氢氧化钠混合搅拌反应,然后通过优化纯化步骤得到较高纯度的氢氧化亚铁产物。
4.实验验证为了验证改进方法的有效性,可以设计一系列实验进行验证。
首先,可以分别采用传统方法和改进方法进行实验,并对比其产率和产物纯度。
制备氢氧化亚铁现象

制备氢氧化亚铁现象
制备氢氧化亚铁是一种常见的化学实验,在实验室中通常采用
以下步骤进行制备:
1. 首先,我们需要准备氢氧化钠(NaOH)和硫酸亚铁(II)
(FeSO4)这两种化学品。
氢氧化钠是一种强碱,而硫酸亚铁(II)是
一种含铁的化合物。
2. 将适量的氢氧化钠固体溶解在一定量的蒸馏水中,搅拌均匀,制备氢氧化钠溶液。
3. 接下来,将适量的硫酸亚铁(II)固体溶解在另一定量的蒸馏
水中,搅拌均匀,制备硫酸亚铁(II)溶液。
4. 然后,将制备好的氢氧化钠溶液缓慢地加入硫酸亚铁(II)溶
液中,同时用玻璃棒轻轻搅拌。
在这个过程中,会观察到溶液的颜
色发生变化,从无色逐渐变成绿色,最终变成棕红色。
5. 混合溶液中生成的沉淀即为氢氧化亚铁,化学式为Fe(OH)2。
将沉淀过滤、洗涤并干燥,即可得到氢氧化亚铁的固体产物。
制备氢氧化亚铁的化学方程式如下:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4。
需要注意的是,在实验过程中,要注意化学品的安全使用,佩戴好防护眼镜和手套,避免溅到皮肤和眼睛,并且在通风良好的环境下进行实验,以避免有害气体的吸入。
同时,实验后要妥善处理废弃物品,并清洗实验器皿,确保实验室的安全和整洁。
氢氧化亚铁的制备

氢氧化亚铁的制备:因Fe(OH)2在空气中易被氧化,4Fe(OH)2+O2+2H2O===4Fe(OH)3,故Fe(OH)2在水中不能稳定存在,在实验室制取Fe(OH)2时,一定要用新制的亚铁盐和先加热驱赶掉O2的NaOH 溶液,且滴管末端要插入试管内的液面以下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2的接触。
关于Fe(OH)2制备的方法很多,核心问题有两点,一是溶液中溶解的氧必须除去,二是反应过程必须与O2隔绝。
1、操作方法:在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴煤油,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,观察现象。
另外,为使氢氧化亚铁的制备成功,先将硫酸亚铁溶液加热,除去溶解的氧气。
实验现象:滴入溶液到硫酸亚铁溶液中有白色絮状沉淀生成。
白色沉淀放置一段时间,振荡后迅速变成灰绿色,最后变成红褐色。
注:白色沉淀:Fe(OH)2;灰绿色沉淀:Fe(OH)2和Fe(OH)3的混合物;红褐色沉淀:Fe(OH)3方法的改进:可在液面上滴加苯或者油进行液封,可有效防止氧的溶解。
【典例】Ⅰ.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是___________________________________________________________Ⅱ.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ中加入的试剂是________。
(2)在试管Ⅱ中加入的试剂是________。
实验室制备氢氧化亚铁方程式

工业制法氢氧化亚铁的制造通常是向亚铁盐溶液中添加碱金属氢氧化物,由于容易被氧化,所以必须在惰性气氛(例如氮气、氩气)中进行。
纯Fe(OH)2虽是白色的,但被氧化时则从绿色变为深绿色。
制法1:用煮沸充分去掉溶解于其中的空气后的水,来配制硫酸亚铁和氢氧化钠的稀水溶液。
将硫酸亚铁溶液装入小口瓶里,向其中注加氢氧化钠水溶液,使正好成为满满一瓶。
液量不足时,可以添加除掉空气的水,然后密封暂时放置。
当氢氧化亚铁在瓶底部沉淀出来之后,用虹吸管慢慢地将上层澄清液抽出,然后沿着瓶壁慢慢地注加煮沸过的水。
要反复进行这个操作,直至洗净SO4离子为止。
如果洗涤时间过长,沉淀就有水解的危险,因此操作要快。
可以将制得的含有白色沉淀的溶液上层澄清液舍弃,在氩气或氮气流中过滤,然后干燥。
迅速装入带塞的玻璃瓶中,密封储存。
制法2:选用纯硫酸亚铁FeSO4·7H2O结晶(尽可能选择颗粒大的、透明的),在预先通氮气的条件下用煮沸冷却过的不含氧气的水溶解,以大约1.6mol/L的浓度为宜。
准备约10L浓氢氧化钠水溶液。
这种溶液用不含氧的水配制。
在搅拌下,向硫酸亚铁溶液滴加氢氧化钠溶液,沉淀沉降之后,用虹吸管将上层澄清液吸出,用无氧水反复洗涤。
过滤后在室温下干燥。
整个操作过程都要在纯氮气中进行。
只要与空气接触,接触处就变色。
实验室制法原理①制取硫酸亚铁用硫酸铜溶液和铁反应,生成硫酸亚铁和铜,反应方程式如下:CuSO4+Fe==FeSO4+Cu (反应类型属于置换反应)②制取氢氧化亚铁用制得的硫酸亚铁溶液和氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,过滤便得氢氧化亚铁,反应方程式如下:FeSO4+2NaOH==Fe(OH)2↓+Na2SO4 (反应类型属于复分解反应)方法在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴煤油,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,观察现象。
另外,为使氢氧化亚铁的制备成功,先将硫酸亚铁溶液加热,除去溶解的氧气。
微专题14 氢氧化亚铁、高铁酸盐的制备实验探究-高考化学考点微专题

微专题14 氢氧化亚铁、高铁酸盐的制备实验探究近几年高考对以铁及其化合物为载体的知识考查较多,其中有关铁及其化合物的实验的考查尤甚,有关铁及其化合物的实验涉及面甚广,物质类别方面有单质,氧化物,氢氧化物和盐,性质方面有制备,检验,分离,提纯,性质验证和实验探究等,其中氢氧化亚铁、高铁酸盐的制备实验探究是高考的重点。
下面对氢氧化亚铁、高铁酸盐的制备实验探究进行整理总结:一、制备Fe(OH)2常用的三种方法(1)有机覆盖层法将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。
(2)还原性气体保护法用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。
(3)电解法用铁做阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖苯(或煤油),如图3所示。
二、高铁酸盐的制备工业制法工业上先制得高铁酸钠,然后在低温下向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。
制备高铁酸钠的两种方法的主要反应原理如下:1.湿法制备:2Fe(OH)3+3NaClO-+4NaOH-=2Na2FeO4+3NaCl-+5H2O;2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;2.干法制备:2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑注意:干法制备的反应有时会写成以下形式FeSO4 +2Na2O2=Na2FeO4++Na2SO4这是反应条件不同而形成不同反应过程导致的。
3.其他制法:Fe2O3+3Na2O2=2Na2FeO4+Na2O2Fe(NO3)3 + 16NaOH + 3Cl2= 2Na2FeO4 + 6NaCl + 6NaNO3 + 8H2O10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O;电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;【专题精练】一、氢氧化亚铁的制备1.用下面三种方法均可制得Fe(OH)2白色沉淀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【复习目标】
1. 掌握氢氧化亚铁制备的方法、及注意事项; 2. 总结氢氧化亚铁防氧化的方法;
1.为什么生成的Fe(OH)2容 易变色?
2.在那个环节可能出现问题?
用常规方法得不到白色沉淀的原因分析:
• 内因——Fe(OH)2很不稳定,极易被氧化; Fe(OH)2具有很强的还原性
4. 打开a处止水夹,用洗耳球从b处鼓气,使 试管Ⅱ中的氢氧化钠溶液被轻轻压入试管 Ⅰ中,即可在试管Ⅰ中看到白色絮状沉淀 生成。白色可在相当长的时间内不改变。 5. 从a处用洗耳球向试管Ⅰ中鼓入空气,振 荡,可看到白色絮状沉淀变成灰绿色, 最后变成红褐色。
改进5
H2SO4
改进6
制备氢氧化亚铁的关键: 1.需要创造的条件: 无Fe3+的环境;无O2的环境 2.可以采取的措施: (1)排除溶液中的Fe3+ →加铁粉; (2)驱逐溶液中的溶解氧:加热煮沸; (3)隔绝空气: 反常规操作、油封、滴管的使用、 试剂瓶装满等
改进3 注意:做该 实验时,在 滴入硫酸亚 铁溶液之前, 滴液漏斗颈 中应充满不 含空气的硫 酸亚铁溶液。
制取Fe(OH)2的实验装置
改进4 1. 如图所示,向试管Ⅰ中加入过量还原铁粉 和少量铜粉,然后加入适量稀硫酸;向试管Ⅱ 中加入适量氢氧化钠溶液,用止水夹夹住a处。
2. 为了提高反应速率和排除溶液中的氧,给 试管Ⅰ、Ⅱ同时加热,煮沸。试管Ⅰ中生 成的氢气通过氢氧化钠溶液,从b处排出。 3. 待反应完全后,停止加热,静置冷却,在 试管Ⅰ中获得浅绿色的硫酸亚铁溶液。 此时整个实验系统处于还原性气氛中。
3. 氢氧化亚铁的制备
取1支5mL针筒,将针头插入盛有硫酸亚铁的 针筒内,抽取2mL-3mL硫酸亚铁溶液,排出 空气,将此溶液通过胶帽,注入盛有氢氧化 钠溶液的针筒内,立即有白色沉淀生成(如图 7-30II所示)。
4. 氢氧化亚铁的氧化 将盛有白色絮状沉淀的针 胶帽去掉,抽入少量空气, 不断振荡,可看到白色沉 淀逐渐变成灰绿色,经多 次抽气、排气、振荡后, 沉淀变为红褐色。
• 外因——空气中有O2; 溶液中可能有溶解氧; 溶液中可能有少量的Fe3+
改进1
改进2
1. 硫酸亚铁溶液制备
在100mL针筒内 放入适量无锈铁 丝,抽取50mL经 煮沸的1:6的硫 酸溶液,排尽空 气,用胶管和弹 簧夹封住管口
2. 氢氧化钠溶液的配制 用蒸馏水配制50mL 20%的氢氧化钠溶液,煮 沸后,抽入到100mL针筒内,排尽空气,用胶 帽封口,备用。
