化学平衡图像大全
化学平衡图像

C%
T2 P2 T1 P2 T1 P1 0
t
强化练习:
4、在密闭容器中进行下列反应:
M(g)+N(g) R(g)+ 2L,在不同条件下R的百分 含量R%的变化情况如下图,下列叙述正确的是( C )
A、正反应吸热,L是气体 B、正反应吸热,L是固体 C、正反应放热,L是气体 D、正反应放热,L是固体或液体
化学平衡图像
一.常见图像分类
1.反应速率————时间曲线
时 间 图
2.物质的量(浓度)—时间曲线 3.百分含量—压强或温度—时间曲线
B%
T2 P2 T1 P2 T1 P1
4.百分含量—温度—压强—时间曲线
0
Z% P1 P2
t
5.百分含量——压强——温度曲线
T
根据图像中表现的关系 联想外界条件(浓度、 二、化学平衡图像问题的解题步骤 与所学规律相对比,作o 压强、温度)的改变对 A 100 出符合题目要求的判断 C 转 化学反应速率和化学平 化 1、看懂图像 率 o 10 C 衡的影响规律
5.百分含量——压强——温度曲线
例、可逆反应mA(g)+nB(g) pC(g);△H<0中m、n、p 为系数,且m+n>p。分析下列各图, 在平衡体系中A的 质量分数与温度t℃、压强P,关系正确的是( ) B
化学平衡移动(图像)

实验数据作出下列关系图下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化
剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
√C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
√D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催
化剂效率较高
1.下列图象中,不能表示反应A2(g)+ 3B2(g) 2AB3(g)(△Q>0)平衡体系 的是…( D )
V(逆)
V(逆)
0 ⑤增大压强
t
0
⑥减小压强
t
增大压强时,正逆反应速率都
增大,但
增大程度相同 ,减小压强时,正逆反应速率都 减小 ,但 减小程度相同 ,故平衡 不 移动。
2、压强变化对化学平衡的影响
结论: mA(g)+nB(g) pC(g)+qD(g)
对于有气体参与的反应:
(1)若m+n==p+q : 增大压强,平衡往气体分子数减少的方向移动 ;
二、速率-时间图:可用于:
பைடு நூலகம்
1) 已知引起平衡移动的因素,判断反应是
吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。
v v正
•引起平衡移动的因素是
v逆
t1
t2
增大反应物浓度,平衡 t 将向 正 方向移动。
v v正
•引起平衡移动的因素是 减小生成物浓度,平衡
v逆
t1
t2
t 将向 正 方向移动。
1、以mA(g)+nB(g) 为例
qC (g);
若增大压强,或升高温度,重新达到平
衡v正、v逆变化如图,则△Q_<__0, m+n__>_q
化学平衡图像

pC(g) +qD(g)
A B t1 t2
T1 T2 t
T1
T2 t
1、T1 < T2 ( > = < ) 正反应是 放热 反应 (放热、吸热)
2、T1 > T2 ( > = < ) 正反应是 放热 反应 (放热、吸热)
可逆反应 mA(g) + nB(g)
A 转 化 率 B%
pC(g)+qD(g)
A.增大A的浓度
B.缩小容器的容积
A的转化率
C.加入催化剂
D.升高温度
a
b
t
随堂测试:
3 、右图表示外界条件 ( 温度、压强 ) 的变 化对下列反应的影响: L(固)+G(气) 2R(气),(正反应为吸热反应),在图中,Y轴是 指( B ) A.衡混合气中R的体积分数 Y B.平衡混合气中G的体积分数 C.G的转化率 100kpa D.L的转化率 10kpa
X或Y t1 t2 t3 t
题组一
1
题组二
2
题组三
3
题组四
4
5
题组五
6
7
题组一 浓度—时间图像 1. 已知 NO2 和 N2O4 可以相互转化:
2NO2(g) N2O4(g)(正反应为放热反应 )。现将
一定量 NO2 和 N2O4 的混合气体通入一体积为 1 L 的恒温密闭容器中, 反应物浓度随时间变化 关系如图所示,回答下列问题: (1) 图中共有两条曲线 X 和 Y,其中曲线
题组一
1
题组二
2
题组三
3
题组四
4
5
题组五
6
7
题组三 恒温线(或恒压线)图像
化学竞赛—化学平衡图像

2Z(g)
(正反应放热)
v(逆) v v(正) v(逆) v(正) v(逆) t1 v(正)
t2
t3
t4
t5
t6
t
上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3 、t5时刻外界条件有所改变,但都没有改变各物质的初 始加入量。下列说法中正确的是 ( ) A.t2时加入了催化剂 B.t3时降低了温度 C.t5时增大了压强 D.t4~t5时间内转化率最低
1 1 2 1 1 2
0
t
3. 对于热化学方程式:
SO3(g) SO2(g)+1/2O2(g) △H>0的描述有如下 四个图像,其中正确的是(y轴表示SO2的含量)
y 300℃ 500℃ 300℃ y 500℃ y
y
500℃ 300℃
500℃ 300℃
A
B
C
D
三、某物质的转化率(或含量)-温度(或压强)的 图像
V(逆)
0
V吸热
②降低温度
t
V放>V吸 平衡向放热反应方向移动 其他条件不变,降低温度平衡向放热反应方向移动。
使用催化剂对化学平衡的影响
V ′ V逆= V′ 正 V
V正 V逆 0
V正
V逆 V′= V′ 正 逆
使用正催化剂
t
0
使用负催化剂
t
催化剂同等程度的改变正、逆反应速率 (V正=V逆) 使用催化剂,对化学平衡无影响。
pC(g)+qD(g); △H=QkJ/mol
等温线
判断:
1.01107Pa 1.01106Pa 1.01105Pa 0
Q 0
m+n p+q
T1
化学平衡图像
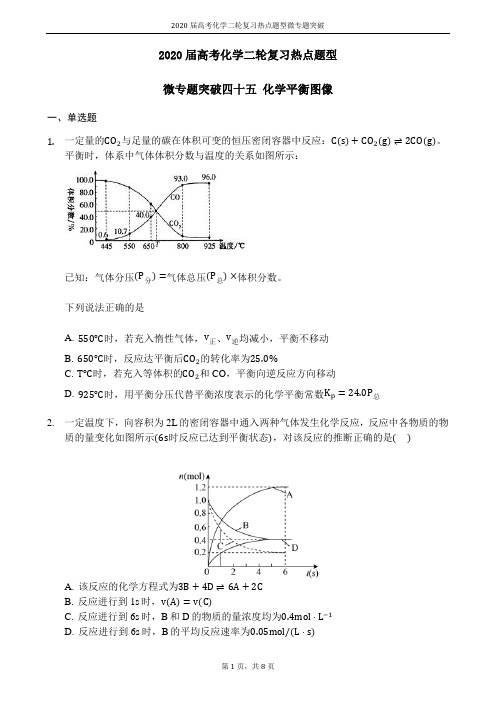
2020届高考化学二轮复习热点题型微专题突破2020届高考化学二轮复习热点题型微专题突破四十五化学平衡图像一、单选题1.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A. 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B. 650℃时,反应达平衡后CO2的转化率为25.0%C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0P总2.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是()A. 该反应的化学方程式为3B+4D⇌6A+2CB. 反应进行到1s时,v(A)=v(C)C. 反应进行到6s时,B和D的物质的量浓度均为0.4mol⋅L−1D. 反应进行到6s时,B的平均反应速率为0.05mol/(L⋅s)3.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)()A. B.C. D.4.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A. B.C. D.5.下列叙述与图象对应符合的是()A. 对于达到平衡状态的N2(g)+3H2(g)⇌2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动B. 对于反应2A(g)+B(g)⇌C(g)+D(g)△H<0,p2>p1,T1>T2C. 该图象表示的化学方程式为:2A=B+3CD. 对于反应2X(g)+3Y(g)⇌2Z(g)△H<0,y可以表示Y的百分含量6.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是()A. 可能是减小了反应物的浓度,反应物X2转化率一定减小B. 可能是加入了催化剂,反应物X2百分含量(X2%)将增大2020届高考化学二轮复习热点题型微专题突破C. 可能是缩小了容器的体积,但该反应的平衡常数保持不变D. 可能是升高了温度,该反应的平衡常数一定减小7.反应:2X (g)+Y(g)⇌2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示,下列判断正确的是()A. P1>P2T1>T2△H<0B. P1>P2T1<T2△H<0C. P1<P2T1>T2△H>0D. P1<P2T1<T2△H>08.在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g)△H=?,符合图(a)所示的关系,其中w(C)为C的质量分数,由此推断关于图(b)的说法正确的是()A. P3>P4,y轴表示A的转化率B. P3<P4,y轴表示B的体积分数C. P3<P4,y轴表示混合气体的平均相对分子质量D. P3>P4,y轴表示混合气体的密度9.图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是()A. B.C. D.10.某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g)⇌pC(g)的速率和平衡的影响图像如下,下列判断正确的是()A. 由图1可知,T1<T2,该反应正反应为吸热反应B. 由图2可知,该反应m+n<pC. 图3中,表示反应速率v(正)>v(逆)的是点3D. 图4中,若m+n=p,则a曲线一定使用了催化剂11.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH<0下列分析中正确的是()A. 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响B. 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂12.某密闭容器中发生如下反应:2X(g)+Y(g)⇌Z(g);△H<0如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是()A. t3时降低了压强B. t5时提高了温度C. t1−t2时该反应的平衡常数小于t6时反应的平衡常数D. t6时刻后反应物的转化率最低二、填空题13.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10−4.请回答:(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字2020届高考化学二轮复习热点题型微专题突破母序号).14.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(2)CrO42−和Cr2O72−在溶液中可相互转化。
化学选修4《化学平衡》化学平衡图像共28页

11、用道德的示范来造就一个人,显然比用法律来约束他更有价值。—— 希腊
12、法律是无私的,对谁都一视同仁。在每件事上,她都不徇私情。—— 托马斯
13、公正的法律限制不了好的自由,因为好人不会去做法律不允许的事 情。——弗劳德
14、法律是为了保护无辜而制定的。——爱略特 15、像房子一样,法律和法律都是相互依存的。——伯克
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!28Fra bibliotek
化学平衡图像及等效平衡

练习3
右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应 速度和化学平衡的变化情况,ab过程中改变 的条件可能是 ;bc过程中改变的条件可能 是 ; 若增大压强时,反应速度变化情况 画在c—d处.
V正
V逆
升温
减小[SO3]
三、x% – t 图
x% (或用φ(C) 表示) 可以表 示反应物、生成物在反应体系中的 物质的量百分数(体积分数)、或 表示反应物的转化率等; t表示时间;
V
V正 V逆
A t
V正
V逆 D t
V正
B t
V正
C t
说明
上述图象的特点是有一速 率改变,随后正逆反应速率再 发生变化,直至两者相等建立 新的平衡。是改变某一物质浓 度而引起化学平衡移动的特征。
二、v – t 图
练习2
练习2
在密闭容器,一定条件下进行反应, mA(g)+nB(g) pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过 程均如图所示,则对该反应叙述正确的是(BD ) A.正反应是吸热反应 B.逆反应是吸热反应 C.m+n>p+q D.m+n<p+q
例3:下列图线分别有哪些含义?
V V V V
V正 V逆 A
t
V正 V逆
V逆 V正
V逆 V正
t
B
t
C
D
t
A.升温时,正、逆反应速率均增大,但吸热反应方 向的速率增得更多,正反应为吸热反应; 或气体反应时增压,正逆反应速率均增大,但气体 体积大的增大得更多,正反应为气体缩小的反应。 C与A 正、逆相反。
化学反应速率与化学平衡——图像专题(共52张)
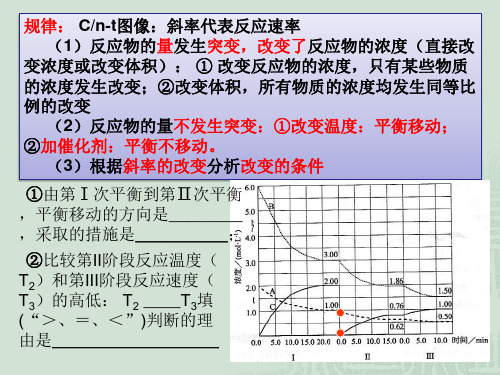
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例: c
0.3
0.2
0.1
1)写出化学反应方程式:
C
A+2B 3C
A 2)求反应物的转化率:
B
A的转化率=33.3%
t B的转化率=66.7%
练:
0c.4
0.3 0.2 0.1
1)写出化学反应方程式:
5A 3B+2C
B A
2)求反应物的转化率:
C
t
A的转化率=62.5%
v
v正
v
v正 v逆
v逆
T1
T2
•正反应吸_热
T
•正反应_吸热 T
C%
A%
450℃
•正反应_放热
T
P1
•m+n_< p+q
P
二、速度-时间图:可用于:
1) 已知引起平衡移动的因素,判断反应是吸热 或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。
v
v正
1.引起平衡移动的因素是
v逆
增大反应物浓度,平衡 将向 正反应 方向移动。
t1
t2 t
v v正
2.引起平衡移动的因素是 减小生成物浓度 ,平衡
v逆
v
v正 v逆
由于v正、v逆相同程 度的增大,t1时的改变因
素可能是 a.加入(正)催化
剂 b.当m+n=p+q时增大压
t1
t 强。平衡没有移动。
三、某物质的转化率(或百分含量)-时间-
温度(或压强)图:
•的A对于反应mA(g)+nB(g)
转化率
T1 T2
pC(g)+qD(g)
B的 转 化率
P1 P2
将向 正反应方向移动。
t1
t2 t
3.已知对某一平衡改变温度时有如下图变化,则 温度的变化是 升高 (升高或降低),平衡向正 反 应方向移动,正反应是 吸 热反应。
v
v
v正
v逆
v逆
v正
t1
t2 t
t1
t2 t
若对一正反应吸热的可逆反应平衡后降低温度,
画出平衡移动过程中的 v - t 图。
4.对于mA(g)+nB(g) pC(g)+qD(g),改变压强 时有如下图变化,则压强变化是 增大 (增大或
T
P
•正反应放_热 m+n_> p+q
•正反应_放热 m+n_< p+q
1.对于2A(g)+B(g) C(g)+3D(g)(正反应吸热) 有如下图所示的变化,图中Y轴可能表示:
A、D
Y
A、B物质的转化率
300℃ B、正反应的速率
200℃ 100℃
P
C、平衡体系中的A% D、平衡体系中的C%
五、其它:对于反应mA(g)+nB(g) pC(g)+qD(g)
•正反应吸_热 t
A%
C%
•m+n_< p+q t
T1
T2
•正反应放_热 t
P1
P2
•m+n_= p+q t
四、某物质的转化率(或百分含量)-温度 (或压强)图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)
A的
ห้องสมุดไป่ตู้A%
500℃
转 化
200℃
率
1.01*107Pa
1.01*106Pa
1.01*105Pa
减小),平衡向逆 反应方向移动,m+n < (>、<、
=)p+q。
v
v逆
v正
t1
t2 t
v
v逆
v正
t1
t2 t
若对以上反应已知m+n>p+q,平衡后降低压强时, 画出相关的 v – t 图。
5.对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所 示的变化,请分析t1时的改变因素可能是什么?并 说明理由。
