化学平衡的移动图像专题
化学平衡移动 及常见图像分析

V ( 正) V(逆) V(正) V ( 逆) V(逆)
V
V(正)
V(逆) V(正)
0
t1
③增大生成物浓度
t
0
t1
④减小反应物浓度
t
结论:增大生成物浓度或减小反应物浓度都会使平 V逆 > V正 平衡逆向移动 衡逆向移动 浓度引起平衡移动的v-t图分析
一、浓度的变化对化学平衡的影响 结论:其它条件不变的情况下
二、压强变化对化学平衡的影响
m A (g) + n B (g)
V V(正)
p C (g) + q D (g)
V V(正)
⑴当 m + n > p + q时,即正方向气体分子数目减少
V(正)
V(逆)
V(逆) V(逆)
V( 逆 )
0
①增大压强
t
0
V(正)
②减小压强
t
V正>V逆 平衡正向移动
①增大反应物浓度, V(正)>V(逆),平衡向正方向移动
②减小生成物浓度, V(正)>V(逆),平衡向正方向移动 ③增大生成物浓度, V(正)<V(逆),平衡向逆方向移动 ④减小反应物浓度, V(正)<V(逆),平衡向逆方向移动
注:浓度对化学平衡移动的几个注意点
① 改变固态和纯液态物质的量并不影响V正、V逆的 大小,所以化学平衡不移动。 ②只要是增大浓度,新平衡状态下的反应速率一 定大于原平衡状态;减小浓度,新平衡状态下的 速率一定小于原平衡状态。 ③反应物有两种或两种以上, 增加一种物质的浓 度, 该物质的平衡转化率降低, 而其他物质的转 化率提高。
V逆 > V正 平衡逆向移动
压强引起平衡移动的相关v-t图分析
m A (g) + n B (g)
化学反应速率与化学平衡——图像专题(共52张PPT)

(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
平衡移动:
(1)若V正在V逆的上方,平衡向正反应方向移动 (2)若V逆在V正的上方,平衡向逆反应方向移动 (3)若V正= V逆,平衡向不移动
3.速率----T/P图像
1、看图,说出反应起始时是从正反应;还是从逆反 应开始?升温后,化学平衡向什么方向移动?
V mol·(L·s)-1
V正
V逆
(1) v正、v逆均不为0,正、 逆反应同时反应开始。
(2)升温后,v正> v逆,平衡 向正反应方向移动。
T(温度 )
此图合理吗?为什么?
V 在V-T/P图像中,温度或压强改
1.含量——时间图像
③产率——时间图像
mA(g)+nB(g) pC(g)+qD(g) ΔH
产 率
问答1、1、TT12与>TT12的相对大小 题案2、2、放是热吸反热反应应还是ΔH吸>0热反应
0
t1 t2
T2 T1
时间
看图技巧:
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
二、化学平衡图像
化
率
1.01107Pa
△H__<__ 0
1.01106Pa 看图技巧:
1.01105Pa (1)看图形趋势
0
T
温度 (2)“定一议二”
课堂练习
1、对于反应mA(g)+nB(g) 象填空:
pC(g)+qD(g),根据图
化学选修4第二章化学平衡移动图像

T o
B
T
o
C
P
o
D
P
例3:已知反应:H2O(g)+C(s)
下列图像符合该反应的是: ( C )
CO(g)+H2(g) △H>0
v v’逆
v v’逆 v’正 v’正
v v’逆
v v’逆 v’正 v’正 o D
o A
T
o B
T
o C
P
P
[例2] 下图表示可逆反应:
A(g) + B(g)
C(g),
当增大压强时,平衡由a点移动到b点,正确的曲线是(
T1时A的 转化率
a1
转化率增大
温度降低
a2
T2时A的 转化率
T2
a2 →a1:转化率增大, 向正向移动
}
正向放热 逆向吸热
总结:温度曲线能判断出反应正向是放热还是吸热 o t
三、平衡移动图像:(两次平衡状态图像) 物质的量
1、过程图像
质量
浓度
转化率 百分比
特征:横轴:时间 (t),纵轴: n, m, c, a, φ , 曲线:温度曲线(T),压强曲线(P)
例1、已知反应: 2NO2 2NO + O2 △H>0 当改变下列 条件时,符合要求的图像是: v v 1、增大反应物浓度;( C ) V’逆 = V’正 V’逆 2、减小反应物浓度;( D ) V正 3、增大生成物浓度;( A ) V正 4、升高温度; ( F ) V’正 5、减小压强; ( E ) V逆 V逆 B ) 6、使用催化剂 ; ( o o
A t B t v
V’正 V正 V’逆 V逆 V逆 V’正 V逆
v
V正
v
V正
v
化学平衡移动(图像)

实验数据作出下列关系图下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化
剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
√C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
√D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催
化剂效率较高
1.下列图象中,不能表示反应A2(g)+ 3B2(g) 2AB3(g)(△Q>0)平衡体系 的是…( D )
V(逆)
V(逆)
0 ⑤增大压强
t
0
⑥减小压强
t
增大压强时,正逆反应速率都
增大,但
增大程度相同 ,减小压强时,正逆反应速率都 减小 ,但 减小程度相同 ,故平衡 不 移动。
2、压强变化对化学平衡的影响
结论: mA(g)+nB(g) pC(g)+qD(g)
对于有气体参与的反应:
(1)若m+n==p+q : 增大压强,平衡往气体分子数减少的方向移动 ;
二、速率-时间图:可用于:
பைடு நூலகம்
1) 已知引起平衡移动的因素,判断反应是
吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。
v v正
•引起平衡移动的因素是
v逆
t1
t2
增大反应物浓度,平衡 t 将向 正 方向移动。
v v正
•引起平衡移动的因素是 减小生成物浓度,平衡
v逆
t1
t2
t 将向 正 方向移动。
1、以mA(g)+nB(g) 为例
qC (g);
若增大压强,或升高温度,重新达到平
衡v正、v逆变化如图,则△Q_<__0, m+n__>_q
高二化学平衡移动图像问题专项训练题(附答案)

高二化学平衡移动图像问题专项训练题一、单选题1.在不同条件下进行化学反应2A(g) B(g) + D(g), B、 D起始浓度均为0,反应物A的浓度-1序号0 20 40 50①800 1.0 0.67 0.50 0.50②800 x 0.50 0.50 0.50③800 y 0.75 0.60 0.60④820 1.0 0.25 0.20 0.20下列说法不正确的是( )A.①中B在0~20min平均反应速率为8.25x10-3mo1·L-1min-1B.②中K=0.25,可能使用了催化剂C.③中Y=1.4mo1·L-1D.比较①、④可知,该反应为吸热反应2.烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1L)。
下列分析不正确的是( )A.乙烯气相直接水合反应的ΔH<0B.图中压强的大小关系为:p1>p2>p3C.图中a点对应的平衡常数K=5/16D.达到平衡状态a、b所需要的时间:a>b3.升高温度,下列各项的值可能减小的是( )A.化学反应速率vB.NaCl的溶解度SC.化学平衡常数KD.弱酸的电离平衡常数K a4.在恒容密闭容器中进行反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔΗ在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见图中曲线①②③ ),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )A.该反应的ΔΗ>0B.氢碳比:① <② <③C.其他条件不变的情况下,增大容器的体积可提高CO 2的转化率D.若起始时CO 2浓度为2mol·L -1,H 2浓度为4mol·L -1,在图中曲线③ 氢碳比条件下进行反应,则400K 时该反应的平衡常数数值约为1.75.在某容积一定的密闭容器中,有下列可逆反应:()()()A g +B g xC g H 僔未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数( )A. 34P >P ,y 轴表示C 的转化率B. 34P <P ,y 轴表示B 的体积分数C. 34P <P ,y 轴表示混合气体的密度D. 34P >P ,y 轴表示混合气体的平均摩尔质量6.在一恒温、恒容密闭容器中发生反应:()()()()50~804180~200Ni s +4CO g Ni CO g ,H<0垐垐垎V 噲垐垐℃℃利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是( ) A. 增加Ni 的量可提高CO 的转化率,Ni 的转化率降低℃ B. 缩小容器容积,平衡右移,H V 减小C. 反应达到平衡后,充入CO 再次达到平衡时,CO 的体积分数降低D. 当()()44v Ni CO =v CO ⎡⎤⎣⎦正正时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态7.以下自发反应可以用熵判据来解释的是( ) A. ()()()222N g +2O g ==2NO g H=+67.7kJ/mol VB. ()()()23CaO s +CO g ==CaCO s H=-175.5kJ/mol VC. ()()()()434332NH CO s ==NH HCO s +NH g H=+74.9kJ/mol VD. ()()()2222H g +O g ==2H O l H=-285.8kJ/mol V 8.工业上以CH 4为原料制备H 2的原理为CH 4(g)+H 2O(g)4CO(g)+3H 2(g) ΔΗ>0。
化学平衡图像专题完整各类型图像

or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。
化学平衡图像专题

2Z(g)(正反应放热)
v(逆) v v(正) v(逆) v(正) v(逆) t1 v(正)
上图表示该反应的速率(v)随时间(t)变化的关系, t2、t3、t5时刻外界条件有所改变,但都没有改变各物 质的初始加入量。下列说法中正确的是 ( A ) A.t2时加入了催化剂 B.t3时降低了温度 C.t5时增大了压强 D.t4~t5时间内转化率最低
练习题
1、mA(s)+nB(g) qC(g);ΔH<0的可逆反应, 在一定温度下的密闭容器中进行,平衡时B的体积 分数V(B)%与压强(P)关系如下图所示,下列叙述正 确的是( B、C ) A、m+n<q 平衡线
B、n>q
C、X点时的状态,V正>V逆 D、X点比Y点混和物的 正反应速率慢
【例】相等物质的量的X气体和Y气体混合后,一定条件下发生 nZg。保持压强不变,经时间t, 反应:Xg+Yg Z气体在反应混合物中的体积分数与温度T的关系如图Ⅰ所示。 1 此反应的正反应方向是填吸热或放热 反应。 2 此反应在时间t内达化学平衡时的温度是( ) 若保持T1不变此时间为t1,请在图Ⅱ上描绘出Z%与时间t 的关系曲线。 3 其他条件不变,在T<T1的某一温度时,该反应能否建立 平衡填能或不能 4 若在T2时增大压强,达新平衡时Z%将增大,则化学方程式 中n的取值为 。
平衡点
V(逆)
T
v
对于反应mA(g)+nB(g) v正
pC(g)+qD(g) v v正 v逆
v逆
T1 T2
•应吸热
A%
T
450℃
•正反应放热
T
P1
•m+n<p+q
P
化学反应速率与化学平衡——图像专题(共52张)
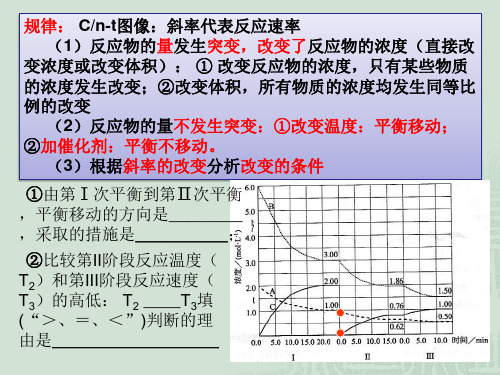
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
化学平衡图像专题超详细版PPT课件

由于v正、ห้องสมุดไป่ตู้逆相
v
v正 v逆
同程度的增大,t1时
的改变因素可能是 a.
加入(正)催化剂 b. 当
t1
t m+n=p+q时增大压强。
平衡没有移动。
第十页,共31页。
速率-时间图
V
t1:A t2:B t3:C 正反应为放热反应
正反应气体物质的量增大
V正
V逆
V正
V正
V正
V逆
0
V逆
V逆
t
t1
t2
t3
1、确定t1、t2、t3时刻的操作: A、降温 B、加压 C、浓度减小
若对以上反应已知m+n>p+q,平衡后降低 压强时,画出相关的v – t图。
第八页,共31页。
对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放 热)有如下图所示的变化,请分析引起平衡移动
的因素可能是什么?并说明理由。
v
v逆
v正
由于v正、v逆均有不
同程度的增大, 引起平衡移
动的因素可能是 a. 升高温
1)写出化学反应方程式:
C A
B
t
A+2B 3C
A的转化率=33.3% B的转化率=66.7%
2)求反应物的转化率:
第四页,共31页。
c
练: 0.4
0.3
B
0.2
A
0.1
C
t
1) 写出化学反应方程式: 5A 3B+2C
2) 求反应物的转化率: A的转化率=62.5%
第五页,共31页。
二、速度-时间图: 可用于:
应物起始的物质的量相同,下列关于该反应的示意图不正 确的是( C )
化学平衡移动的图像专题

1 / 4§2.3化学平衡(第三课时)化学平衡移动的图像专题训练一、化学平衡图像题的分析方法与思路 1.化学平衡图像题的主要特点:该类题目的主要特点是通过多种图像,对化学反应速率和化学平衡的有关知识、 规律进行分析考察,题目特别注重对知识综合应用能力和分析判断能力的考查。
2.解题的方法及思路(1)看懂图像:一看 面(图像形状,横、纵坐标的含义),二看线(走向,变化趋势),三看点(起点、终点、交点、拐点),四看是否需作辅助线(等温线、等压线、平衡线等),五看量的变化(浓度的变化,温度变化) (2)联想规律:外界条件的改变对化学反应速率和化学平衡移动的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,做出符合题目要求的判断。
3.解化学平衡图像题的原则:“先拐先平衡,数值大”原则:含量与时间变化关系的图像中,先出现拐点的则先到达平衡,说明该曲线表示的温度较大或压强较高。
a A(g)+bB(g) cC(g)图1图2在图1中,P1P2 ,a+b c (填“<”“>”) 在图2中T1T2,正反应为反应(吸热或放热)(2)“定一议二”原则:在含量与温度、压强变化图像中,先确定一个量不变,再讨论另外两个量的关系。
即定温看压强或定压看温度变化,由曲线的高低走势,结合平衡移动原理和指定的可逆反应,确定平衡的移动方向,反应的热效应,反应两边气体体积的大小等。
mA(g)+nB(g) qC(g)+qD (g )图3 图4图3中正反应为反应,m+n p+q ;图4中,正反应为反应,m+n p+q 。
二、图像的常见类型:1.物质的量(或浓度)———时间图象:例1:某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时 间变化的关系如所示,则该反应的化学方程式为,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、 _________。
2.速率-时间图:【例2】对于mA(g)+nB(g) pC(g)+qD(g),能引起如图5平衡移动的因素可能是: 能引起如图6平衡移动的因素可能是:【例3】把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是 ;t2~t3速率变化的主要原因是。
化学平衡图像专题ppt课件

⑴确定t1、t2、t3时刻的操作:
A、浓度减小
B、加压
C、降温
⑵该反应正向是 放 (吸、放)热反应; ⑶气体物质的量增大 (增大、减少)的反应。
v
V(正) V(逆)
V(正) V(逆)
V(逆) V(正)
V(正) V(逆)
t1 t2
t3
7
t
看图技巧:
1、改变条件使平衡移动的瞬间曲线是连 续的,则是物质浓度发生改变 2、改变条件使平衡移动的瞬间曲线出现 断点,则是温度改变或是压强改变 3、改变条件反应速率变化但是平衡不移 动,则是使用催化剂或是反应前后气体 系数不变的反应中压强改变
C%
答问 11、、TT11与>TT22的高低
案题 2、2是、放放热热反反应应还是吸热反应
T2C
T1C
看图技巧:
先拐先平数值大
0 t1 t2 时间
12
物质产率——时间曲线
mA(g)+nB(g) pC(g)+qD(g)
产 率
问答题:1、T2>T1
1、T1与T2的相对大小
2案、该2反、应吸是热放反热反应应还是吸热反应
5、五看量的变化如浓度、温度、转化率、物 质的量斜率的变化等。
4
二、想规律:依据图像信息,利用平衡 移动原理,分析可逆反应的特征
三、先拐先平,温高压大 四、定一议二
5
一、速率—时间图像 1.计算平衡浓度
例:在容积固定为2L的密闭容器中,充入X、Y气体各2mol,
发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,
第二章 化学反应速率与化学平衡
第三节化学平衡 第三课时
平衡图像
1
复习回顾
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)不论恒温恒容,还是恒温恒压容器,加入稀有气体,平衡皆 发生移动。 (× )
提示:恒温恒容,加入稀有气体平衡不移动。
(4)起始加入原料的物质的量相等,则各种原料的转化率一定 相等。 ( × )
提示:由于转化的物质的量不一定相等,故转化率不一定相等。
(5)通过改变一个条件使某反应向正反应方向移动,转化率一定 增大。 (× )
5.百分含量——压强/温度曲线
例5、可逆反应mA(g)+nB(g) pC(g);△H<0中m、n、 p为系数,且m+n>p。分析下列各图, 在平衡体系中A 的质量分数与温度t℃、压强P,关系正确的是( B )
定 一 议 二
5. 图中表示外界条件(t、p)的变化对下列 反应的影响:L(固)+G(气) 2R(气); △H>0 y 轴表示的是( B ) (A) 平衡时,混合气中R的百分含量
(1)v正>v逆:平衡向 正反应 方向移动。
(2)v正=v逆:反应达到平衡状态,不 发生平衡移动。 (3)v正<v逆:平衡向 逆反应 方向移动。
5.判断正误(正确的打“√”,错误的打“×”)。
(1)温度改变,化学平衡一定发生移动。
(2)只要v(正)增大,平衡一定正向移动。
(√ )
( × )
提示:平衡正向移动,条件 v(正)>v(逆)。v(正)增大,不一定 存在 v(正)>v 逆。
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g) x(g)+3y(g) 功),下列叙述错误的是( 2c(g);H1<0 2z(g);H2>0 )
进行相关操作且达到平衡后(忽略体积改变所作的
A.等压时,通入惰性气体,c的物质的量不变
取5等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器 中,发生反应:2NO2(g) N2O4(g), H <0 反应相同时间后,分别测定体系中NO2的百分量(NO2%), 并作出其随反应温度(T)变化的关系图。下列示意图中, 可能与实验结果相符的是
(3)脱碳:从脱硝、脱硫后的烟气中获取二氧化碳,用二氧 化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化 学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3。 取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3), 分别加入温度不同、容积相同的恒容密闭容器中,发生上述反 应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应 温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的 ΔH3________0(填“>”、“<”或“=”)。
(B) 平衡时,混合气中G的百分含量
(C) G的转化率
(D) L的转化率
练习题
1、mA(s)+nB(g) qC(g);ΔH<0的可逆反应, 在一定温度下的密闭容器中进行,平衡时B的体积 分数V(B)%与压强(P)关系如下图所示,下列叙述正 确的是( B、C ) A、m+n<q 平衡线
B、n>q
C、X点时的状态,V正>V逆 D、X点比Y点混和物的 正反应速率慢
CO2 浓度
T1 T2
T3
T4 T5
温度
某科研小组研究:在其他条件不变的情况下,改变起始时反应
物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实 验结果如右图所示:(图中T表示温度,n表示物质的量) “等于”或“无法确定”)。 ②比较在a、b、c三点所处的平衡状态中,反应物N2的转化
C%
T2 P2 T1 P2 T1 P1 0
t
强化练习:
4、在密闭容器中进行下列反应:
M(g)+N(g) R(g)+ 2L,在不同条件下R的百分 含量R%的变化情况如下图,下列叙述正确的是( C )
A、正反应吸热,L是气体 B、正反应吸热,L是固体 C、正反应放热,L是气体 D、正反应放热,L是固体或液体
2、当三个变量同时出现的
“定一议二”
1.反应速率———时间曲线
例1. 判断下列图象中时间t2时,对于不同的反应 可能发生了哪一种条件的变化?
(A)
(B)
(C)
强化练习: 1.对可逆反应:N2(g)+3H2(g) 2NH3(g) ;△H<0 ,达平衡后外界条件改变有下图所示 的图象,试分析t1、t2、t3时外界条件如何改 变?
甲
0
t
0
t
4.百分含量—温度——压强—时间曲线
例4. 对于 m A (g) + n B (g) k C (g) △H=QkJ/mol,有如图所示的变化,则: p1 < p2 ; ①.p1与 p2 的关系是 ②.m + n 与k的关系是 m + n > k ; T 1 > T2 ③.T1 与 T2的关系是 ; Q< 0 ④.Q与 0 的关系是 。
【例 4】
若反应 CO(g)+H2O(g)
CO2(g)+H2(g)
ΔH<0
的逆反应速率与时间的关系如图所示:
(1)反应在 t1、t3、t7 时都达到了平衡,若 t2 时只改变了一种 外界条件,试判断改变的条件可能是 t6 时逆反应速率与时间的关系曲线。 。 (2)若 t4 时降压,t6 时增大反应物的浓度,请在图中画出 t4~
B.等压时,通入z气体,反应器中温度升高 C.等容时,通入惰性气体,各反应速率不变 D.等容时,通入z气体,y的物质的量浓度增大
特点:
物质浓度(C) 百分含量(A%) 转化率(A)
①.图象中一定将出现平行于横坐标的直线,表示反应 达到平衡状态,也可以叫做“平台”。 ②.在化学平衡图象中,先出现平台的曲线表示先达到 平衡,反应快,则说明温度较高或压强较大也可能 使用催化剂。
解图像技巧:
1、有平台的“先拐先平,先拐数值(P/T)大”
3.某可逆反应为:A(g)+B(g) nC(g),下图中的甲、 乙、丙分别表示在不同条件下,生成物C在反 应混合物 中的体积分数 C%与反应时间t的关系。
C% a b 0 t C% T1 T2
C%
P1 P2
丙 乙 ⑴若图甲中的a、b两条曲线分别表示有催化剂和无催化 剂的情况,则曲线 a 表示的是有催化剂时的情况。 ⑵若乙图中用T1和T2两温度表示体系的变化情况,则此 吸 热反应。 可逆反应的正反应是_____ ⑶若图丙中的P1、P2两条曲线分别表示在不同压强时的情 况,则n应满足的条件 n>2 。
3.百分含量—压强或温度—时间曲线
例3、图中a曲线表示一定条件下的可逆反应: X(g) + Y(g) 2Z(g) + W(s) ; △H =QkJ/mol 的反应过程。若使a曲线变为b曲 线,可采取的措施是( A D ) A、加入催化剂 B、增大Y的浓度 C、降低温度 D、增大体系压强
强化练习:
①图像中T2和T1的关系是:T2 _______T1(填“高于”、“低于”、
率最高的是_______(填字母)。
(2)①低于 ②c
(2011天津、6)向绝热恒容密闭容器中通入SO2和NO2, 一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达
到平衡,正反应速率随时间变化的示意图如右所示。由图 可得出的正确结论是 A.反应在c点达到平衡状态 B.反应物浓度:a点小于b点
化学平衡的移动 图像专题
1.解答化学平衡移动题目的一般思路
正、逆速率不变:如容积不变,充入稀有气体,平衡不移动
改 变 条 件 正、逆速率改变
程度相同 使用催化剂 气体体积无变化 平衡不移动 v正=v逆 的反应改变压强
程度不同 浓度 压强 v正≠v逆 温度
平衡移动
勒夏特列原理
3.化学平衡移动方向与化学反应速率的关系
2.物质的量(浓度)——时间曲线
例 2 、某温度下,在体积为 5 L的容器中,A、B、 C三种物质物质的量随着时间变化的关系如图所示, 则该反应的化学方程式为_________________ 2A 3B + C
2.今有反应x(g) + y(g) 2z(g) △H<0 ,若反应 开始经t1秒后达到平衡,又经t2秒后由于反应条件的 改变使平衡破坏到t3时又达到平衡(如图所示),试 分析,从t2到t3曲线 变化的原因是(D ) A.增大了x或y的浓度 B.使用了催化剂 C.增加反应体系压强 D.升高反应的温度
(2013浙江27)为研究温度对(NH4)2CO3捕获CO2效率的影响, 在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中, 并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测的容 器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下, 保持其它初始实验条件不变,重复上述实验,经过相同时间测得 CO2气体浓度,得到趋势图(见图1)。则: ①⊿H3 0(填>、 =或<)。 ②在T1~T2、T4~T5二个温度区间内,容器内CO2气体浓度呈 现如图1所示的变化趋势,其原因是 。
提示:若增加某一反应物的物质的量使平衡右移,则其转化率会 减小。
一.常见图像分类
1.反应速率————时间曲线
时 2.物质的量(浓度)————时间曲线 间 图 3.百分含量——压强或温度——时间曲线
4.百分含量——温度——压强——时间曲线 5.百分含量——压强/温度曲线
横坐标——时间(t)
时间图
纵坐标——反应速率(v)
