化学平衡移动的图像专题
化学平衡移动 及常见图像分析

V ( 正) V(逆) V(正) V ( 逆) V(逆)
V
V(正)
V(逆) V(正)
0
t1
③增大生成物浓度
t
0
t1
④减小反应物浓度
t
结论:增大生成物浓度或减小反应物浓度都会使平 V逆 > V正 平衡逆向移动 衡逆向移动 浓度引起平衡移动的v-t图分析
一、浓度的变化对化学平衡的影响 结论:其它条件不变的情况下
二、压强变化对化学平衡的影响
m A (g) + n B (g)
V V(正)
p C (g) + q D (g)
V V(正)
⑴当 m + n > p + q时,即正方向气体分子数目减少
V(正)
V(逆)
V(逆) V(逆)
V( 逆 )
0
①增大压强
t
0
V(正)
②减小压强
t
V正>V逆 平衡正向移动
①增大反应物浓度, V(正)>V(逆),平衡向正方向移动
②减小生成物浓度, V(正)>V(逆),平衡向正方向移动 ③增大生成物浓度, V(正)<V(逆),平衡向逆方向移动 ④减小反应物浓度, V(正)<V(逆),平衡向逆方向移动
注:浓度对化学平衡移动的几个注意点
① 改变固态和纯液态物质的量并不影响V正、V逆的 大小,所以化学平衡不移动。 ②只要是增大浓度,新平衡状态下的反应速率一 定大于原平衡状态;减小浓度,新平衡状态下的 速率一定小于原平衡状态。 ③反应物有两种或两种以上, 增加一种物质的浓 度, 该物质的平衡转化率降低, 而其他物质的转 化率提高。
V逆 > V正 平衡逆向移动
压强引起平衡移动的相关v-t图分析
m A (g) + n B (g)
化学平衡移动以及图像PPT课件

度,也不能改变速率,所以V(正)仍等于V(逆),
平衡不移动。
第7页/共54页
二、压强对化学平衡的影响:
N2 十 3H2
2NH3
实验 压强(MPa) 1 5 10 30 60 100 数据: NH3 % 2.0 9.2 16.4 35.5 53.6 69.4
NH3%随着压强的增大而增大,即平衡向 正反应的方向移动。
0 t1 t2 t 程式,升高温度平衡向逆
反应方向移动,与图示相符;增大压强平衡
向正反应方向移动,与图示不相符。故此题
中引起平衡移动的因素是升高温度。 第32页/共54页
一、速度-时间图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下 图所示的变化,请分析t1时的改变因素可能 是什么?并说明理由。
0
v逆
t1
t2
t 将向 正 方向移动。
第29页/共54页
一、速度-时间图:
•已知对某一平衡改变温度时有如下图变化,
则温度的变化是
升(升高高或降低),平衡
向 反正应方向移动,正反应是 热吸反应。
v
v正
v逆
0
t1
t2
t
第30页/共54页
一、速度-时间图:
•对于mA(g)+nB(g) pC(g)+qD(g),改变压强 时有如下图变化,则压强变化是 增大 (增 大或减小),平衡向 逆 反应方向移动,m+n < (>、<、=)p+q。
第28页/共54页
一、速度-时间图:可用于:
1) 表示反应速率的变化和化学平衡的移动。 2) (已知反应)判断引起平衡移动的因素。
化学选修4第二章化学平衡移动图像

T o
B
T
o
C
P
o
D
P
例3:已知反应:H2O(g)+C(s)
下列图像符合该反应的是: ( C )
CO(g)+H2(g) △H>0
v v’逆
v v’逆 v’正 v’正
v v’逆
v v’逆 v’正 v’正 o D
o A
T
o B
T
o C
P
P
[例2] 下图表示可逆反应:
A(g) + B(g)
C(g),
当增大压强时,平衡由a点移动到b点,正确的曲线是(
T1时A的 转化率
a1
转化率增大
温度降低
a2
T2时A的 转化率
T2
a2 →a1:转化率增大, 向正向移动
}
正向放热 逆向吸热
总结:温度曲线能判断出反应正向是放热还是吸热 o t
三、平衡移动图像:(两次平衡状态图像) 物质的量
1、过程图像
质量
浓度
转化率 百分比
特征:横轴:时间 (t),纵轴: n, m, c, a, φ , 曲线:温度曲线(T),压强曲线(P)
例1、已知反应: 2NO2 2NO + O2 △H>0 当改变下列 条件时,符合要求的图像是: v v 1、增大反应物浓度;( C ) V’逆 = V’正 V’逆 2、减小反应物浓度;( D ) V正 3、增大生成物浓度;( A ) V正 4、升高温度; ( F ) V’正 5、减小压强; ( E ) V逆 V逆 B ) 6、使用催化剂 ; ( o o
A t B t v
V’正 V正 V’逆 V逆 V逆 V’正 V逆
v
V正
v
V正
v
化学反应速率和化学平衡--图像专题

V正
V正= V逆
平衡状态Ⅰ
V逆
0
t1
t2
t(s)
练习4:反应X(g)+3Y(g)
2Z(g)
△H<
0在不同温度、
不同压强(P1>P2)下,达到平衡时,混合气体中Z的体积
分数随温度变化曲线为(
Z% Z%
B
)
Z%
P2
P1
P1
P2
P2
P1
T
T
T
A
B
C
下列图象中,不能表示反应
A2(g)+3B2(g) 的是…( D )
右图是反应速率与反应进程的关系图,请回答:
(1)处于平衡状态的时间段
t0~t1,t2~t4,t5~t6 是_________________________
(2)t1、t3、t4时刻体系中分
ν
ν逆 ν正 ν逆 ν正
别是什么条件发生了变化? t1:升温; t0 t1 t2 t 3 t4 t3:加催化剂; t4:减压 (3)下列各时间段,氨的体积分数最高的是( A ) A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
t5 t6 t
2.浓度(C)-时间(t)图
例2:
①反应类型为:可逆反应 ②方程式为: 2A ③反应物的转化率:
2B+C
50%
④化学反应速率: V(A)=0.1mol/(L.min) 曲线的起点、转折点及变化趋势
练习2:
现有正反应放热的可逆反应(所有物质为气态),
反应开始后变化如图所示: X、Y (1)该反应的反应物是______;
X+Y Z (2)化学方程式为_________________
化学平衡图像专题

2Z(g)(正反应放热)
v(逆) v v(正) v(逆) v(正) v(逆) t1 v(正)
上图表示该反应的速率(v)随时间(t)变化的关系, t2、t3、t5时刻外界条件有所改变,但都没有改变各物 质的初始加入量。下列说法中正确的是 ( A ) A.t2时加入了催化剂 B.t3时降低了温度 C.t5时增大了压强 D.t4~t5时间内转化率最低
练习题
1、mA(s)+nB(g) qC(g);ΔH<0的可逆反应, 在一定温度下的密闭容器中进行,平衡时B的体积 分数V(B)%与压强(P)关系如下图所示,下列叙述正 确的是( B、C ) A、m+n<q 平衡线
B、n>q
C、X点时的状态,V正>V逆 D、X点比Y点混和物的 正反应速率慢
【例】相等物质的量的X气体和Y气体混合后,一定条件下发生 nZg。保持压强不变,经时间t, 反应:Xg+Yg Z气体在反应混合物中的体积分数与温度T的关系如图Ⅰ所示。 1 此反应的正反应方向是填吸热或放热 反应。 2 此反应在时间t内达化学平衡时的温度是( ) 若保持T1不变此时间为t1,请在图Ⅱ上描绘出Z%与时间t 的关系曲线。 3 其他条件不变,在T<T1的某一温度时,该反应能否建立 平衡填能或不能 4 若在T2时增大压强,达新平衡时Z%将增大,则化学方程式 中n的取值为 。
平衡点
V(逆)
T
v
对于反应mA(g)+nB(g) v正
pC(g)+qD(g) v v正 v逆
v逆
T1 T2
•应吸热
A%
T
450℃
•正反应放热
T
P1
•m+n<p+q
P
化学平衡图像及等效平衡

练习3
右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应 速度和化学平衡的变化情况,ab过程中改变 的条件可能是 ;bc过程中改变的条件可能 是 ; 若增大压强时,反应速度变化情况 画在c—d处.
V正
V逆
升温
减小[SO3]
三、x% – t 图
x% (或用φ(C) 表示) 可以表 示反应物、生成物在反应体系中的 物质的量百分数(体积分数)、或 表示反应物的转化率等; t表示时间;
V
V正 V逆
A t
V正
V逆 D t
V正
B t
V正
C t
说明
上述图象的特点是有一速 率改变,随后正逆反应速率再 发生变化,直至两者相等建立 新的平衡。是改变某一物质浓 度而引起化学平衡移动的特征。
二、v – t 图
练习2
练习2
在密闭容器,一定条件下进行反应, mA(g)+nB(g) pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过 程均如图所示,则对该反应叙述正确的是(BD ) A.正反应是吸热反应 B.逆反应是吸热反应 C.m+n>p+q D.m+n<p+q
例3:下列图线分别有哪些含义?
V V V V
V正 V逆 A
t
V正 V逆
V逆 V正
V逆 V正
t
B
t
C
D
t
A.升温时,正、逆反应速率均增大,但吸热反应方 向的速率增得更多,正反应为吸热反应; 或气体反应时增压,正逆反应速率均增大,但气体 体积大的增大得更多,正反应为气体缩小的反应。 C与A 正、逆相反。
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
化学课件《化学平衡——化学平衡图像》优秀ppt 人教课标版

v
V(正)
V(正)
V(逆)
V(逆)
时间 t
练习6:
已知反应: 3A( g ) + B( g )
C( s ) + 4D( g )
下图中a、b 表示一定条件下,D的体积分数随时间t的
0.4
(2)反应的化学方程式是:
0.3
______2_A_____2_B__+_C_______
0.2 0.1
(3)8min后,若将容器的体
积缩小一半,c(A)将___增_大____
c(B)将___增_大____c(C)将__增__大___ 0
(填增大、减小、不变);
B A
C 时间(min)
平衡将向___逆_____反应方向移动;达到新的平衡时混 合气体的相对平均分子质量是_____增__大____ , A的转化率 ____减_小____。
A. N2(g) + 3H2(g)
2NH3(g) △H < 0
B. H2(g) + I2(g)
2HI(g) △H < 0
C. 2SO3(g)
2SO2(g) + O2(g) △H > 0
D. 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) △H < 0
练习5:
对于达到平衡的可逆反应: X + Y W + Z 增大压 强则反应速率的变化图象如图所示。据此分析 X、Y、 W、Z的聚集状态是
谢谢
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
化学平衡移动原理及图像分析_图文

D.达到平衡后,增加A的质量有利于化学平衡向正反应方向 移动
真题集训把脉高考
题组1 化学反应进行的方向
B
2.(2011·高考海南卷)氯气在298 K、100 kPa时,在1 L水中可 溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。 请回答下列问题: (1)该反应的离子方程式为 ____________________________________________________; (2)估算该反应的平衡常数 __________________________________________(列式计算); (3)在上述平衡体系中加入少量NaOH固体,平衡将向________ 移动; (4)如果增大氯气的压强,氯气在水中的溶解度将________(填 “增大”、“减小”或“不变”),平衡将向________移动。
A
B
3.可逆反应mA(s)+nB(g)
eC(g)+fD(g),反应过程中保持
其他条件不变,C的体积分数在温度(T)和压强(P)的条件下
随时间(t)变化如下图所示,下列叙述正确的是( B )
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>e+f
化学平衡移动原理及图像分析_图文.ppt
教材回顾夯实双基
构建双基
反应方向
正
体积缩小 体积扩大
放热反应
吸热反应
减弱
体验高考
B
思考感悟 某一可逆反应,一定条件下达到平衡状态,若化学反应速率改 变了,平衡一定发生移动吗?相反,若平衡发生移动了,化学 反应速率一定改变吗? 【提示】 化学平衡移动的本质是由v(正)=v(逆)改变为v(正) ≠v(逆),此时平衡就会发生移动。因此速率改变,平衡不一定 移动,如加催化剂会同等程度地改变正逆反应速率,对于反应 前后气体分子数不变的可逆反应,改变压强会同等程度改变正 逆反应速率等,这些条件的改变只能改变反应速率大小,但不 能使平衡发生移动;相反,平衡移动,说明反应速率一定改变了。
高中化学新人教版选择性必修一:第二章 微专题1 化学平衡图像 同步课件(73张)

D. 图③表示压强对可逆反应2(g) + 2 B(g) ⇌ 3 C(g) + (g)的影响,且甲的
压强大
[答案] B
[解析] 当其他条件不变时,升高温度,正、逆反应速率均加快,降低温度,
正、逆反应速率均减慢,与图像不符,故A错误;2 SO2 (g) + O2 (g) ⇌
温度T的关系如图所示。则下列说法中正确的是(
)
A. 该反应的H>0
B. 若该反应在T1 、T2 时的平衡常数分别为K1 、K 2 ,则K1 <K 2
C. 在T2 时,若反应体系处于状态D,则此时一定有正 <逆
D. 在T3 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
[答案] D
达到平衡后,改变某一条件,下列示意图正确的是 (
) C
[解析] 题给反应为气体总体积减小的放热反应,升高温度,平衡逆向移动,
平衡常数减小,A选项错误;同理,升高温度,平衡逆向移动,CO的转化率
减小,B选项错误;通常情况下,平衡常数只与温度有关,与物质的量无关,
C选项正确;增加N2 的物质的量,平衡逆向移动,NO的转化率减小,D选项错
不变,则增大压强反应速率加快,平衡不移动,催化剂只加快反应速率,
不影响平衡移动,图像符合,故B正确;题给反应为放热反应,升高温度
平衡向逆反应方向移动,题图Ⅲ中乙先达到平衡,则温度高于甲,CO的转
化率低,图像符合,故C正确;催化剂只改变反应速率,不影响平衡移动
,图像不符合,故D错误。
2. [2021河北邯郸高二月考] 化学中常用图像直观地描述化学反应的进程或
图不符合,C错误;达平衡后,升高温度,化学平衡逆向移动,由 =
化学平衡移动的图像专题

1 / 4§2.3化学平衡(第三课时)化学平衡移动的图像专题训练一、化学平衡图像题的分析方法与思路 1.化学平衡图像题的主要特点:该类题目的主要特点是通过多种图像,对化学反应速率和化学平衡的有关知识、 规律进行分析考察,题目特别注重对知识综合应用能力和分析判断能力的考查。
2.解题的方法及思路(1)看懂图像:一看 面(图像形状,横、纵坐标的含义),二看线(走向,变化趋势),三看点(起点、终点、交点、拐点),四看是否需作辅助线(等温线、等压线、平衡线等),五看量的变化(浓度的变化,温度变化) (2)联想规律:外界条件的改变对化学反应速率和化学平衡移动的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,做出符合题目要求的判断。
3.解化学平衡图像题的原则:“先拐先平衡,数值大”原则:含量与时间变化关系的图像中,先出现拐点的则先到达平衡,说明该曲线表示的温度较大或压强较高。
a A(g)+bB(g) cC(g)图1图2在图1中,P1P2 ,a+b c (填“<”“>”) 在图2中T1T2,正反应为反应(吸热或放热)(2)“定一议二”原则:在含量与温度、压强变化图像中,先确定一个量不变,再讨论另外两个量的关系。
即定温看压强或定压看温度变化,由曲线的高低走势,结合平衡移动原理和指定的可逆反应,确定平衡的移动方向,反应的热效应,反应两边气体体积的大小等。
mA(g)+nB(g) qC(g)+qD (g )图3 图4图3中正反应为反应,m+n p+q ;图4中,正反应为反应,m+n p+q 。
二、图像的常见类型:1.物质的量(或浓度)———时间图象:例1:某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时 间变化的关系如所示,则该反应的化学方程式为,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、 _________。
2.速率-时间图:【例2】对于mA(g)+nB(g) pC(g)+qD(g),能引起如图5平衡移动的因素可能是: 能引起如图6平衡移动的因素可能是:【例3】把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是 ;t2~t3速率变化的主要原因是。
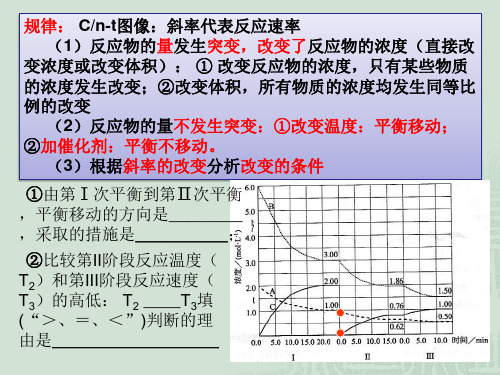
整理版----化学平衡图像专题
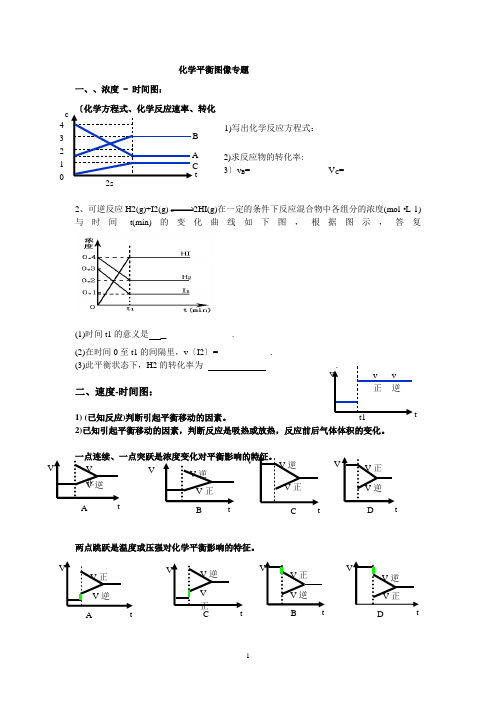
化学平衡图像专题一、、浓度 - 时间图:1)写出化学反应方程式:2)求反应物的转化率:3〕v B = V C =2、可逆反应H2(g)+I2(g)2HI(g)在一定的条件下反应混合物中各组分的浓度(mol ·L-1)与时间t(min)的变化曲线如下图,根据图示,答复(1)时间t1的意义是_ .(2)在时间0至t1的间隔里,v 〔I2〕= .(3)此平衡状态下,H2的转化率为 .二、速度-时间图:1) (已知反应)判断引起平衡移动的因素。
2)已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
一点连续、一点突跃是浓度变化对平衡影响的特征。
两点跳跃是温度或压强对化学平衡影响的特征。
A t 4 3 210A V 正 V 逆 VB V 逆V 正 V CV 正 V 逆 V D V 正 V 逆 V V 正 V 逆 A V V 逆 V 正 V V 正V 逆 CV V 逆V 正 D V v 逆t1 vv正例:右图表示在密闭容器中反应:2SO2+O22SO3+Q 到达平衡时 ,由于条件改变起反应速度和化学平衡的变化情况,ab 过程中改变的条件可能是 _;bc 过程中改变的条件可能是 _; 假设增大压强,反应速度变化情况画在c —d处.在密闭容器,一定条件下进行反应,mA(g)+nB(g)pC(g)+qD(g);假设增大压强或升高温度,重新到达平衡,变化过程均如下图,则对该反应表达正确的选项是〔 A .正反应是吸热反应B .逆反应是吸热反应C .m+n>p+qD .m+n<p+q三、某物质的转化率(或百分含量)-时间-温度/压强)图 解题思路:1、先从拐点向横轴作垂线:先拐先平,温度、压强均高。
2、再从拐点向纵轴作垂线: ①分析温度、压强升高时,转化率或含量的变化 ② 判断平衡移动的方向例:对于反应mA(g)+nB(g) pC(g)+qD(g)P1 P2; m+n p+qT1 T2;正反应 热v 逆t1t2 t v v 正 t A 的转化率 T1T2tT1 T2 t B% T2P2 T1P2T1P11、在密闭容器中进行以下反应:M(g)+ N(g) R(g)+2L此反应符合右图,以下表达正确的选项是( )A.正反应吸热,L是气体B.正反应吸热,L是固体C.正反应放热,L是气体D.正反应放热,L是固体或液体2、反应2X(g)+Y(g)2Z(g)(正反应为放热反应)在不同(T1和T2)温度及不同压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间t的关系如下图。
化学平衡图像专题ppt课件

为了规范事业单位聘用关系,建立和 完善适 应社会 主义市 场经济 体制的 事业单 位工作 人员聘 用制度 ,保障 用人单 位和职 工的合 法权益
一、速率—时间图像 1.计算平衡浓度
例:在容积固定为2L的密闭容器中,充入X、Y气体各2mol, 发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡, 以Y的浓度改变表示的反应速度与时间t的关系如图所示,
练 习
可逆反应mA(s)+nB(g) pC(g)+qD(g)。反应中,当其 它条件不变时,C的质量分数与温度(T)和压强(P) 的关系如上图,根据图中曲线分析,判断下列叙述中正
确的是( D )
(A)达到平衡后,若使用催化剂,C的质量分数增大 (B)化学方程式中一定有n>p+q (C)平衡后,增大A的量,有利于平衡正向移动 (D)平衡后,若升高温度,则平衡向逆反应方向移动
变式练习
• 下列反应符合下图T-v变化曲线的是
• A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 • B.N2O3(g) NO2(g)+NO(g);ΔH>0 • C.3NO2(g)+H2O(l) 2HNO3(aq)+NO(g);ΔH<0 • D.2CO(g) CO2(g)+C(s);ΔH<0
•正反应放热
T
P1
P
•m+n<p+q
为了规范事业单位聘用关系,建立和 完善适 应社会 主义市 场经济 体制的 事业单 位工作 人员聘 用制度 ,保障 用人单 位和职 工的合 法权益
百分含量(转化率或产率)——压强(温度)平衡图像
mA(s)+nB(g) qC(g);ΔH<0的可逆反应,在一定温 度下的密闭容器中进行,平衡时B的体积分数V(B)%与
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 / 4§2.3化学平衡(第三课时)化学平衡移动的图像专题训练一、化学平衡图像题的分析方法与思路 1.化学平衡图像题的主要特点:该类题目的主要特点是通过多种图像,对化学反应速率和化学平衡的有关知识、 规律进行分析考察,题目特别注重对知识综合应用能力和分析判断能力的考查。
2.解题的方法及思路(1)看懂图像:一看 面(图像形状,横、纵坐标的含义),二看线(走向,变化趋势),三看点(起点、终点、交点、拐点),四看是否需作辅助线(等温线、等压线、平衡线等),五看量的变化(浓度的变化,温度变化) (2)联想规律:外界条件的改变对化学反应速率和化学平衡移动的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,做出符合题目要求的判断。
3.解化学平衡图像题的原则:“先拐先平衡,数值大”原则:含量与时间变化关系的图像中,先出现拐点的则先到达平衡,说明该曲线表示的温度较大或压强较高。
a A(g)+bB(g) cC(g)图1图2在图1中,P1P2 ,a+b c (填“<”“>”) 在图2中T1T2,正反应为反应(吸热或放热)(2)“定一议二”原则:在含量与温度、压强变化图像中,先确定一个量不变,再讨论另外两个量的关系。
即定温看压强或定压看温度变化,由曲线的高低走势,结合平衡移动原理和指定的可逆反应,确定平衡的移动方向,反应的热效应,反应两边气体体积的大小等。
mA(g)+nB(g) qC(g)+qD (g )图3 图4图3中正反应为反应,m+n p+q ;图4中,正反应为反应,m+n p+q 。
二、图像的常见类型:1.物质的量(或浓度)———时间图象:例1:某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时 间变化的关系如所示,则该反应的化学方程式为,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、 _________。
2.速率-时间图:【例2】对于mA(g)+nB(g) pC(g)+qD(g),能引起如图5平衡移动的因素可能是: 能引起如图6平衡移动的因素可能是:【例3】把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是 ;t2~t3速率变化的主要原因是。
[答案]反应是放热反应,温度升高使化学反应速率提高;盐酸物质的量 浓度变小使化学反应速率降低。
3.速率—压强(或温度)图象【例4】符合如图的反应为( )。
A.N2O3(g)NO2(g)+NO(g) B.3NO2(g)+H2O(l )2HNO3(l )+NO(g) C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) D.CO2(g)+C(s)2CO(g) 4.含量-时间图【例5】在A (g )+B (g )=C (g )+D (g )的反应体系中,C 的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q 与P ,则正反应是放热反应的图为( )A .BCD 5.转化率-时间图【例6】对于可逆反应:m A(g)+n B(g)x C(g)ΔH =?,在不同温度及压强(P 1,P 2)条件下,反应物A 的转化率如下图所示,下列判断正确的是 ( ) A .ΔH >0,m +n >x B .ΔH <0,m +n >x C .ΔH >0,m +n <x D .ΔH <0,m +n <x 6、温度(T )类【例5】反应X(g)+3Y(g) 2Z(g)(正反应为放热反应),在不同温度、不同压强(p 1>p 2)下达到平衡时,混合气体中Z 的百分含量随温度变化的曲线应为图中的 ( )【基础达标】1.下图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断()A .正反应是放热反应B .若A 、B 是气体,则D 是液体或固体C .逆反应是放热反应.D .A 、B 、C 、D 均为气体2.一定温度下,在2L 的密闭容器中,X 、Y 、Z 三种气体的物质的 量随时间变化的曲线如右图所示,下列描述正确的是( )A .反应开始到10s ,用Z 表示的反应速率为0.158mol/(L·s )B .反应开始时10s ,X 的物质的量浓度减少了0.79mol/LC .反应开始时10s ,Y 的转化率为79.0%D .反应的化学方程式为:X(g)+Y(g)Z(g)P A% 500 ℃ 200 ℃1.01*107 Pa 1.01*106 Pa A的转 化 率T图5 图6图 2 氢气发生速率变化曲线例 4 曲线图 左逆右正2 / 43.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)2C(g) ΔH <0。
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是( )A .图I 研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高B .图Ⅱ研究的是压强对反应的影响,且乙的压强较高C .图Ⅲ研究的是温度对反应的影响,且甲的温度较高D .图Ⅳ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 4.反应2X(g)+Y(g) 2Z(g);△H <0。
在不同温度和压强下,产物Z 的物质的量(n 2)与反应时间(t )的关系如图所示,下列判断正确的( ) (第4题图) A 、T 1<T 2,P 1<P 2 B 、T 1<T 2,P 1>P 2 C 、T 1>T 2,P 1>P 2 D 、T 1>T 2,P 1<P 2 5.对气体反应:mA +nBeC 温度(T )、压强(P )、时间(t )与生成物的体积百分数C%的关系如右图,下列结论正确的是( )A . 正反应是放热反应B . m +n <eB . 正反应是吸热反应 D . m +n >e6.如下图所示,反应2SO 2(g )+O 2(g )2SO 3(g );△H <0,在不同温度、不同压强(P 1>P 2)下达到平衡时,混合气中SO 3的体积φ(SO 3)随温度变化的曲线应为( )A .BC D7. 如图所示是温度和压强对X +Y2Z 反应影响的示意图。
图中横坐标表示温度,纵坐标表示平衡混合气体中Z 的体积分数。
下列叙述正确的 是( )A .上述可逆反应的正反应为放热反应B .X 、Y 、Z 均为气态C .X 和Y 中只有一种为气态、Z 为气态D .上述反应的逆反应的ΔH >08. 在密闭容器中进行下列反应:M(g) + N(g)R(g) + 2L 此反应符合右图,下列叙述正确的是( )A .正反应吸热,L 是气体 B .正反应吸热, L 是固体 C .正反应放热,L 是气体D .正反应放热 ,L 是固体或液体 9.已知可逆反应:下列各图表示上述可逆反应建立平衡的过程及改变某一条件后建立起新的平衡过程的曲线:(1)A 图改变的条件是。
(2)B 图改变的条件是。
(3)C 图改变的条件是。
(4)D 图改变的条件是 (5)E 图改变的条件是10 有可逆反应△H=Q ,试根据下图回答:(1)压强P 1比P 2_____________填(大、小) (2)(a+b)比(c+d)_____________(填大、小) (3)温度T 1℃比T 2℃____________(填高、低)(4)Q 值是_____________(填正、负) 11. 密闭容器中mA (g )+nB (g )pC (g ),反应达到平衡,经测定增大压强P 时,A 的转化率随P 而变化的曲线如图。
则:(1)增大压强,A 的转化率____,平衡____移动,达到平衡后,混合物中C 的质量分数________。
(2)上述化学方程式中的系数m 、n 、p 的正确关系是____,再加入B ,则平衡________。
(3)当降低温度时,C 的质量分数增大,则A 的转化率____,正反应是____热反应。
11.已知2A (g )+B (g )2C (g ),向容积为1L 的密闭容器中加入0.050 mol A 和0.025mol B ,在500℃时充分反应,达平衡后测得c (C )=0.040 mol·L-1。
(1)能说明上述反应已经达到化学平衡状态的是(填写序号)。
a.v(C)=2v(B) b.容器内压强保持不变 c.v逆(A)=2v 正(B) d.容器内气体的密度保持不变 (2)500℃时,上述反应的化学平衡常数K=(3)已知:K (300℃)>K (350℃),该反应是(填“放”或“吸”)热反应;若反应温度升高,A 的转化率(填“增大”、“减小”或“不变”)。
(4)某温度下,A 的平衡转化率(a )与体系总压强(P )的关系如图所示,平衡状态由a 变到b 时,化学平衡常数K (A ) K (B ) (填“>”、“<”或“=”)。
【知能提升】1..2A(g)+2B(g) 2 C(g)+D(g)(正反应为吸热反应),下列各图是温度(或压强)对应的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是()2.在容积固定的4L密闭容器里,进行可逆反应:X(气)+2Y(气)2Z(气),并达到平衡,在此过程中,以Y的浓度改变表示的反应运率v(正)、v(逆)与时间t的关系如右图。
则图中阴影部分面积表示()A.X的浓度减少B.Y的物质的量减少C.Z的浓度增加D.X的物质的量减少3. 在一定温度下发生反应:I2(g)+H2(g)2HI(g);△H<0并达平衡。
HI的体积分数V(HI)随时间变化如图曲线(II)所示。
若改变反应条件,在甲条件下V(HI)的变化如曲线(I)所示。
在乙条件下V(HI)的变化如曲线(III)所示。
则甲条件、乙条件分别是()①恒容条件下,升高温度②恒容条件下,降低温度③恒温条件下,缩小反应容器体积④恒温条件下,扩大反应容器体积⑤恒温恒容条件下,加入适当的催化剂A.①⑤,③B.②⑤,④C.③⑤,②D.③⑤,④4. 在可逆反应A2(g)+2B2(g) 2AB2(g)(正反应为放热反应)趋向平衡时,图中符合勒夏特列原理的是()5. 可逆反应:mA(s)+nB(g) qC(g), △H<0在一定温度的密闭容器中进行,B的体积百分含量(V B%)与压强关系如右图所示,下列叙述正确的是()A、m+n<qB、n>qC、n<qD、x点V逆>V正6.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到化学平衡B.该反应在T2温度时达到化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动7.对于可逆反应:A2(g)+3B2(g)2AB3(g)(正反应放热),下列图象中正确的是()A B C D8. 在容积固定的密闭容器中存在如下反应:A(g)+3B(g)C(g),(正反应为放热反应);某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图。
