第五章__吸收
生理学第五章消化和吸收

如环境许可,大脑皮层即发出冲动使排便中枢兴奋 增强,产生排便反射,使乙状结肠和直肠收缩,肛 门括约肌舒张。
残余物质排出
同时腹肌和膈肌收缩,腹压增加,促进粪便排出体 外。
06
消化和吸收的调节与控制
神经调节在消化和吸收中的作用
交感神经和副交感神经对消化腺和消化道平滑肌的调节
交感神经兴奋时,抑制消化腺分泌和消化道平滑肌收缩;副交感神经兴奋时,促进消化 腺分泌和消化道平滑肌收缩。
生理学第五章消化和吸收
目
CONTENCT
录
• 消化系统概述 • 口腔消化 • 胃内消化 • 小肠内消化和吸收 • 大肠内消化和吸收 • 消化和吸收的调节与控制
01
消化系统概述
消化系统的组成
消化道
包括口腔、咽、食管、胃、小肠、大肠和肛门,是食物消化和吸 收的主要场所。
消化腺
包括唾液腺、胃腺、肝脏、胰腺和肠腺,分泌消化液,参与食物 的消化。
营养物质的吸收过程
碳水化合物的吸收
碳水化合物在小肠内被分解为单糖,如葡萄糖和 果糖等,通过主动转运或易化扩散的方式被吸收 进入血液。
脂肪的吸收
脂肪在小肠内被分解为甘油和脂肪酸,通过淋巴 途径进入血液循环。
蛋白质的吸收
蛋白质在小肠内被分解为氨基酸和多肽,通过主 动转运或易化扩散的方式被吸收进入血液。
维生素和矿物质的吸收
水溶性维生素通过主动转运或易化扩散的方式被 吸收,脂溶性维生素则与脂肪一起通过淋巴途径 进入血液循环。矿物质如钙、铁和锌等主要通过 主动转运的方式被吸收。
05
大肠内消化和吸收
大肠的结构和功能
结构
大肠包括盲肠、结肠、直肠和肛门四 部分,是消解质, 形成、贮存和排泄粪便。
第五章__三氧化硫的吸收..

第五章 三氧化硫的吸收吸收即指使用浓硫酸吸收转化气中SO 3的过程该过程是制酸过程中第三个化学变化过程。
5.1 基本原理二氧化硫转化为三氧化硫之后,气体进入吸收系统用发烟硫酸或浓硫酸吸收,制成不同规格的产品硫酸。
吸收过程可用下式表示:SO 3(g )+H 2O(l)=H 2SO 4(l) △H 298O =-134.2kJ (1—5—1)接触法生产的商品酸,通常有大于92.5%浓硫酸,大于98%浓硫酸、含游离SO 3>20%标准发烟硫酸,含游离SO 365%高浓度发烟硫酸(近年来这种发烟硫酸在化学工业等部门应用愈来愈广泛)。
三氧化硫的吸收,实际上是从气相中分离SO 3分子使之尽可能完全地转化为硫酸的过程。
该过程与净化系统所述的SO 3去除,在机理上是不同的。
采用湿法净化时,炉气中SO 3先形成酸雾,然后再从气相中清除酸雾液滴。
而在这里是采用吸收剂——硫酸直接将分子态SO 3吸收。
5.1.1 影响发烟硫酸吸收过程的主要因素吸收系统生产发烟硫酸时,首先将净转化气送往发烟硫酸吸收塔,用于产品酸浓度相近的发烟硫酸喷淋吸收。
用发烟硫酸吸收SO 3的过程并非单纯的物理过程,属化学吸收过程。
一般情况下,该吸收过程属于气膜扩散控制,吸收速率取决于传质推动力、传质系数和传质面积的大小,即: G =kF •Δp式中 G —一吸收速率;k ——吸收速率常数;F ——传质面积:Δp ——吸收推动力。
在气液相逆流接触的情况下,吸收过程的平均推动力可用下式表示。
()()()()'2"1"2'1'2"1"2'1lg 3.2p p p p p p p p p -----=∆ 式中 p 1’、p 2’——分别为进出口气体中SO 3分压,Pa ;p 1”、p 2”——分别为进出口发烟硫酸液面上SO 3的平衡分压,Pa 。
当气相中SO 3含量及吸收用发烟硫酸含量一定时,吸收报动力与吸收酸的温度密切相关。
化工原理答案-第五章--吸收

第五章 吸收 相组成的换算【5-1】 空气和2的混合气体中,2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少?解 因摩尔分数=体积分数,.02y =摩尔分数 摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解3, 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少?解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982skg m ρ=代替。
溶液中3的量为 /311017n kmol -=⨯溶液的体积 /.33101109982 V m -=⨯溶液中3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 . 3998200105058218s sc x kmol m M ρ==⨯=../ 3与水的摩尔比的计算//1170010610018X ==. 或 ..00105001061100105x X x ===--. 【5-3】进入吸收器的混合气体中,3的体积分数为10%,吸收率为90%,求离开吸收器时3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为122111Y Y Y Y Y η-===-被吸收的溶质量原料气中溶质量解 原料气中3的摩尔分数0.1y = 摩尔比 (11)10101111101y Yy ===-- 吸收器出口混合气中3的摩尔比为 () (2)11109011100111Y Y η=-=-⨯=()摩尔分数 (22)200111=0010981100111Y yY ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3NH ,查得20℃时溶液上方3NH 的平衡分压为798。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。
遥感第五章 散射和吸收
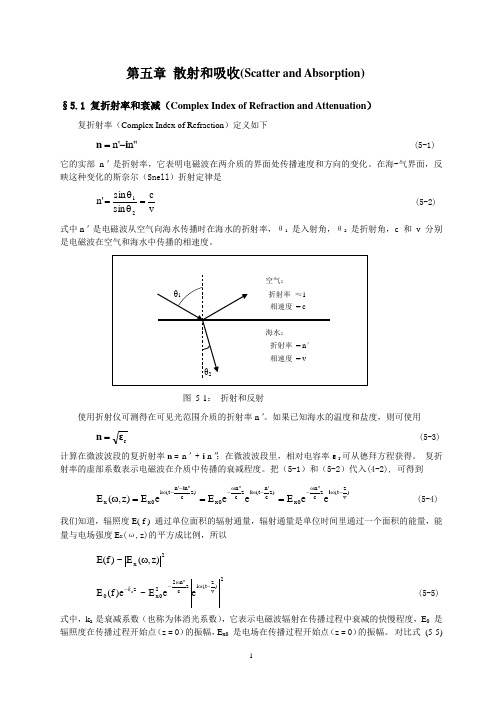
第五章 散射和吸收(Scatter and Absorption )§5.1 复折射率和衰减(Complex Index of Refraction and Attenuation )复折射率(Complex Index of Refraction )定义如下"n 'n i n -= (5-1)它的实部n ’是折射率,它表明电磁波在两介质的界面处传播速度和方向的变化。
在海-气界面,反映这种变化的斯奈尔(Snell )折射定律是vc sin sin 'n 21=θθ= (5-2) 式中n ’是电磁波从空气向海水传播时在海水的折射率,θ1 是入射角,θ2 是折射角,c 和 v 分别是电磁波在空气和海水中传播的相速度。
图 5-1: 折射和反射使用折射仪可测得在可见光范围介质的折射率n ’。
如果已知海水的温度和盐度,则可使用 r εn = (5-3)计算在微波波段的复折射率n = n ’+ i n ”;在微波波段里,相对电容率εr 可从德拜方程获得。
复折射率的虚部系数表示电磁波在介质中传播的衰减程度。
把(5-1)和(5-2)代入(4-2), 可得到)v z t (z c "n 0x )z c 'n t (z c "n 0x )z c "n 'n t (i 0x x e e E e e E e E )z ,(E -ωω--ωω---ω===ωi i i (5-4)我们知道,辐照度E( f ) 通过单位面积的辐射通量,辐射通量是单位时间里通过一个面积的能量,能量与电场强度E X (ω,z )的平方成比例,所以2x )z ,(E ~)f (E ω 2)v z t (i z c "n 220x z 0e e E ~e )f (E -ωω--a k (5-5)式中,k a 是衰减系数(也称为体消光系数),它表示电磁波辐射在传播过程中衰减的快慢程度,E 0 是辐照度在传播过程开始点(z = 0)的振幅,E x0 是电场在传播过程开始点(z = 0)的振幅。
化工原理28气体吸收
煤气中的芳烃,可采用洗油吸收方法回收芳烃获得粗苯.
二、吸收操作分类
*物理吸收与化学吸收 *等温吸收与非等温吸收 *单组分吸收与多组分吸收 *定态吸收与非定态吸收(过程参数是否随时间而变) 本章讨论所作的基本假定: 单组分、低浓度、连续定态逆流、等温物理吸收
三、吸收操作的经济性
吸收操作费用主要包括: ①气、液两相流经吸收设备的能量消耗; ②溶剂的挥发损失和变质损失;
=
0
dz dz dz
—d —PA = - —d P—B
dz
dz
—d C—A= - —d —CB
dz
dz
DAB = DBA = D
若选择固定的,垂直扩散方向的截面为基准,观察 扩散传质的速率。对于定态分子扩散则有
NA= JA
同理有
NB= JB
由以上讨论可知,等摩尔逆向扩散过程传质速率的大小主
要是分子扩散的贡献。
有总体流动时的传质速率: 对于B组分有: NB = JB+NBM =0
即: JB= - NBM
且
NAM
PA
——— = ———
NBM
PB
JB= -NBM = - JA
对于A组分,其传递速率 :
即:
NA = JA + NAM = JA + NBM PA / PB NA =(1+ PA / PB)JA
NA=
dCA JA= - DAB———
dZ 式中:
JA— 组分A沿Z方向的扩散通量kmol/m2 ·s; CA— 组分A在混合物中摩尔浓度kmol/ m3 ; DAB—组分A在A、B混合中的扩散系数,m2/s 。
同理,对B组分的扩散可表示为
dCB JB= - DBA———
第5章-吸附和吸收处理空气原理与方法

4.吸附传质机理与数学模型
传质速度是决定吸附性能的重要因素之一; 传质速度由以下机理决定:
在吸附剂颗粒外流体边界层内的对流传质; 在吸附剂颗粒内部被吸附物质的分子扩散; 在吸附点进行的吸附反应。
吸附时,气体先通过气膜到达颗粒表面,然后才 向颗粒内扩散,脱附时则逆向进行。
进行预处理,以防堵塞。
5.1吸附材料处理空气的机理和方法
1.基本知识和概念
几个名词
吸附现象:相异二相界面上的一种分子积聚现象。 吸附(adsorption):把分子配列程度较低的气相
分子浓缩到分子配列程度较高的固相中。 吸附剂(adsorbent):使气体浓缩的物质。 吸附质(adsorbate) :被浓缩的物质。 例如: 硅胶(吸附剂),水蒸汽(吸附质)
适用范围:多分子层吸附,0.05<p/p0<0.35。
微孔吸附
与吸附质分子大小相当的微孔,其周壁的吸引 力使吸附剂分子填充微孔而产生吸附作用。
对于给定的吸附剂和吸附质,吸附平衡与温度 无关,可用吸附势表示:
q
W W (Es )
Es
RT
ln
p ps
3. 常用吸附剂的类型和性能
极性吸附剂(亲水性):硅胶、多孔活性铝、 沸石等铝硅酸盐
气体吸收是用适当的液体吸收剂来吸收气体或 气体混合物中的某种组分的一种操作。
气体被吸收的程度,取决于气体的分压力。 液体除湿剂对水蒸汽有很强的吸收能力。 大量吸收水分后,吸收液的浓度变稀,除湿能
力也随之降低,为连续吸湿,需将稀溶液加热 浓缩(再生)。水分蒸发,溶液浓缩后,重复 使用。
二、液体吸收剂的性能要求
计算公式和浓度方程
第5章第3节《吸收作用》教学设计(第1课时)生物北师大版七年级上册

3.教师强调吸收作用在植物生长中的重要性,提醒学生关注生活中的生物学现象,激发学生的学习兴趣。
4.布置课后作业,巩固所学知识,为下一节课的学习做好准备。
五、作业布置
1.请学生完成课本第5章第3节后的习题,巩固吸收作用的相关知识,特别是对植物细胞吸水、失水原理的理解。
(2)无机盐对植物生长具有重要作用,如氮、磷、钾等元素是植物生长的主要营养元素。
(三)学生小组讨论
1.教师将学生分成小组,针对以下问题进行讨论:
(1)植物吸收作用的主要器官是什么?为什么?
(2)植物细胞吸水、失水的原理是什么?
(3)无机盐对植物生长有何作用?
2.学生在小组内分享观点,展开讨论,教师巡回指导,解答学生的疑问。
3.各小组汇报讨论成果,教师点评并总结。
(四)课堂练习
1.教师针对本节课的内容设计练习题,包括选择题、填空题和简答题,以检验学生对知识的掌握程度。
2.学生独立完成练习题,教师对学生的答案进行批改,及时给予反馈。
3.针对学生普遍存在的问题,教师进行针对性的讲解,巩固知识点。
(五)总结归纳
1.教师引导学生回顾本节课所学内容,总结吸收作用的定义、过程、原理及无机盐的作用。
(2)注重培养学生的生物学思维,引导学生运用所学知识解决实际问题。
(3)课后总结教学经验,不断提高自身的教育教学水平。
四、教学内容与过程
(一)导入新课
1.教师通过展示一颗植物从种子到成熟植株的生长过程图片,引导学生观察并思考:植物是如何从土壤中吸收水分和养分的?这个过程对植物生长有何意义?
2.学生分享观察到的现象,教师总结并引出本节课的主题——吸收作用。
(2)新课讲解:结合课本内容,详细讲解植物吸收作用的概念、过程及意义,突出重点,突破难点。
第五章吸收解析

0.014g)。
10
影响吸收过程的因素有温度、总压、气液相组成。 在一定温度下达到平衡时,溶液的浓度随气体压力
的增加而增加。如果要使一种气体在溶液中达到某 一特定的浓度,必须在溶液上方维持较高的平衡压 力。 气体的溶解度与温度有关,一般来说,温度下降则 气体的溶解度增高。 气体在液相中的溶解度,随温度和吸收质在气相的 组成而变化。下图为SO2、NH3、HCl的气液相平衡 关系。
系服从亨利定律: PA* = E xA
式中 PA*—与稀溶液相平衡的吸收质气相平衡分压; xA—吸收质在溶液中的摩尔分数;
E—亨利系数,Pa。 吸收质在稀溶液上方的气相平衡分压与其在液相中
5
吸收设备与吸收操作
连续接触(也称微分接触):气、液 两相的浓度呈连续变化。如填料塔。
溶剂 溶剂
规整填料
散装填料
塑料丝网波纹填 塑料鲍尔环填
料
料
级式接触:气、液两相逐级接 触传质,两相的组成呈阶跃变 化。 如板式塔。
气体
气体
a 微分接触
b 级式接触
图9-2 填料塔和板式塔
6
吸收操作的分类
物理吸收(physical absorption):吸收过程溶质与溶剂不发 生显著的化学反应,可视为单纯的气体溶解于液相的过程。 如用水吸收二氧化碳、用水吸收乙醇或丙醇蒸汽、用洗油 吸收芳烃等。
溶解度/[g(NH3)/1000g(H2O)] 溶解度/[g(SO2)/1000g(H2O)]
500
0 oC
10 oC 20 oC 30 oC 40 oC 50 oC
200 150 100 50
0 oC 10 oC
20 oC 30 oC 40 oC
50 oC
化工原理第四版课件(第五章吸收)

第五章:吸收 概述气液相平衡吸收过程的传质速率吸收塔的计算填料塔第一节:概述一、吸收吸收的定义:吸收是利用气态均相混合物中各组分在吸收剂中溶解度的差异来实现分离的单元操作。
吸收的目的:I.回收或捕获气体混合物中的有用物质,以制取产品II.除去工艺气体中的有害成分,使气体净化,以便进一步加工处理III.除去工业放空尾气中的有害气体,以免环境污染。
二、工业吸收了解工业生产中吸收及解吸过程、所需条件和典型设备例子工业上从合成氨原料混合气体中回收CO2乙醇胺脱硫法•需要解决的问题1.选择合适的溶剂2.提供适当的传质设备3.溶剂的再生三、溶剂的选择1.对溶质较大的溶解度;2.良好的选择性;3.温度变化的敏感性;4.蒸汽压要低;5.良好的化学稳定性;6.较低的黏度且不易生泡;7.廉价、无毒、易得、不易燃烧等经济和安全条件。
四、吸收的分类按有无化学反应:物理吸收和化学吸收按溶质气体的浓度:低浓度和高浓度吸收按溶质气体组分的数目:单组分和多组分吸收按有无热效应:等温和非等温吸收本章只讨论低浓度、单组分、等温的物理吸收过程。
五、吸收操作的经济性(费用)气液两相流经设备的能量损耗;溶剂的挥发及变质损失;溶剂的再生费用。
√六、吸收设备第二节:气液相平衡一、平衡溶解度恒温、恒压下,相互接触的气液两相的浓度不变时,气液两相之间的浓度关系。
气液两相组成的浓度分别用物质的摩尔分数来表示,即y= n i /Σn y 、x= n i /Σn x:气液两相中惰性组分的量不变,溶质与惰性组分摩尔比。
yy Y −=1xx X −=11.气体的溶解度气体在溶液中的溶解平衡是一个动态平衡,该平衡的存在是有条件的;平衡时气相中溶质的分压——平衡分压(或饱和分压),液相中溶质的浓度——平衡浓度(或饱和浓度),也即是气体在溶液中的溶解度;气体的溶解度是一定条件下吸收进行的极限程度;温度和压力对吸收操作有重要的影响;加压和降温对吸收有利;升温和降压对解吸有利。
化工原理第五章吸收(传质理论之一)超详细讲解

p*A= CA/ H 或 C*A= H pA 即 C*A ∝ pA C(A—CA液=相nAA的/V物)质. 的量浓度(实际浓度)—kmol/m3 C*A—液相A的平衡浓度(与分压为pA的气相平衡)
H—溶解度系数—kmol/(m3*Pa) or kmol/(m3*atm), H↑, CA*↑,即 吸收体系的溶解度系数越大,气体越易溶。
VNH3后=VB*(VNH3后/VB)
若能求出每份惰性组分空气含NH3的分数VNH3残/ V空 气,则吸收后残存的VNH3残可求。
而 VNH3后/ V空气= (VNH3残/V后总)/ (V空气/V后总)=yA2/ yB2 =yA2/(1-yA2)=5%/(1-5%)=5/95 (份NH3/份空气)
上例用比摩尔分率计算: VNH3=VB(YA1-YA2) 吸收前: YA1= yA1/yB2=yA1/(1-yA1 )=0.2/0.8=0.25 吸收后:YA2=yA2/yB2=yA2/(1-yA2)=0.05/0.95=0.053
被吸收NH3的体积: VNH3=80*(0.25-0.053) =15.8 m3
真正的分子扩散距离δ<δg, δl。
对气膜:用pB/pT对δg加以较正:
g
pB P
kg-气膜吸收分系数
NA
Dg Ap
RT g
Dg PT
RT g pB
A( p pi ) =kgA(p-pi)
kg
Dg PT
RT g pB
对液膜:用CS /(CA+CS)=CS /CT 对δl 加以较正:
注意:
1 吸收达平衡时:YA*=mXA或 XA*= YA/m,但两方程的意 义不同,YA*与YA不同。
生理学消化吸收ppt课件

上一页 下一页
5-2 机械性消化
三、胃运动与胃排空(gastric empty)
(二)胃排空
1.胃排空的机制
2.影响胃排空的因素
四、小肠运动
㈠小肠运动的类型(图) ㈡小肠运动的调节 ㈢回盲瓣(回盲括约肌)
上一页 下一页
上一页 下一页
神经分泌
返回
第二节 机械性消化
一、消化道平滑肌的生理特性 二、咀嚼和吞咽
(一)咀嚼的意义 (二)吞咽反射
三、胃运动与胃排空
(一)胃运动 1.胃运动的形式 容受性舒张 蠕动(peristalsis)
紧张性收缩
上一页 下一页
5-2 机械性消化
三、胃运动与胃排空
2、胃运动的调节
(1)外来神经 迷走神经→Ach+M受体 紧张 交感神经→NE+β2受体 舒张
胃腺 胃底腺 主细胞→酶
壁细胞→盐酸、内因子
幽门腺
上一页 下一页
5-3 化学性消化
二、胃液
㈡胃液的性状、成分和作用
1.盐酸
(1)盐酸的生成
(2)盐酸的作用
2.胃蛋白酶原
3.黏液
(1)可溶性粘液
(2)不溶性粘液(粘液-碳酸氢盐屏障图)
4.内因子ห้องสมุดไป่ตู้
上一页 下一页
返回
5-3 化学性消化
(三)胃液分泌的调节 1.非消化期胃液的分泌 2.消化期胃液的分泌 3.影响胃液分泌的因素
血管
上一页 下一页
5- 1
三 、 胃 肠 激 素 (gastrointestinal hormone)
(1、一形)态、特胃征肠(道开内放分型泌细细胞胞图,闭合型细胞) 2、分泌方式(内分泌图、旁分泌图 、神经分泌图 )
初一生物上册第五章第一节光合作用吸收二氧化碳释放氧气

二.光合作用利用二氧化碳作为原料 1.P121想一想,议一议 (1)分析实验前后柳树苗和土壤的重要发生了怎 样的变化?海尔蒙特是怎样解释这种现象的?
(2)海尔蒙特所做的实验与植物的光合作用有什 么联系呢?
(3)想一想,水是对实验产生作用的唯一因素吗? 海尔蒙特是否忽略了什么?
2.P122插图 (1)我们看到,普利斯特利实验其实是由四个小的 实验构成的,试着分析这样设计的意图是什么?
4、下列哪一项不是光合作用的意义( D )
A、为动植物和人提供营养和食物来源 B、为动植物和人提供能量来源 C、为动植物和人提供呼吸需要的氧气来源
D、为动植物和人提供呼吸需要的二氧化碳来源
5、在“检验光合作用释放的气体”的实验中,使带
火星的木条猛烈燃烧的是A
A、氧气 C、氧气和二氧化碳
B、二氧化碳 D、氮气
时取下,脱色漂洗滴加 碘液,发现B、D部分变 蓝色,A、C部分未变蓝 色.该实验证明植物进 行光合作用需要:
A.水和二氧化碳 B.叶绿素和阳光 C.水和阳光 D.水和叶绿素
五.光合作用原理在农业生产上的应用
1.充分利用光照 (1)合理密植 (2)进行套种(立体种植) 2.增加二氧化碳的浓度 六.分析实验结果
如何设计检验二氧化碳是否真是光合作用 的原料?
小组讨论:
1、应选择什么作为该实验的变量? 2、除这个变量外,其他条件应怎样? 3、如何设计对照组?提示:氢氧化 钠溶液有吸收空气中二氧化碳的作用。 (可使用少许25%氢氧化钠溶液,使 空气中的二氧化碳被吸收)
(二)设计实验证明植物光合作用需要二氧化碳。
普利斯特利的实验
点燃的蜡烛或小白鼠与绿色植物分别从对方那里得 到了什么?
资料分析
一个人一天平均吸入25千克的空气(约含5千克的 氧气)消耗其中的约1千克的氧(不含动物呼吸及燃烧所 消耗的),当空气中氧的含量下降到7%--8%时,人就会昏 迷、窒息、甚至死亡。可是自然界中并没有出现这样的 现象,为什么?
第五章__三氧化硫的吸收

第五章 三氧化硫的吸收吸收即指使用浓硫酸吸收转化气中SO 3的过程该过程是制酸过程中第三个化学变化过程。
5.1 基本原理二氧化硫转化为三氧化硫之后,气体进入吸收系统用发烟硫酸或浓硫酸吸收,制成不同规格的产品硫酸。
吸收过程可用下式表示:SO 3(g )+H 2O(l)=H 2SO 4(l) △H 298O =-134.2kJ (1—5—1)接触法生产的商品酸,通常有大于92.5%浓硫酸,大于98%浓硫酸、含游离SO 3>20%标准发烟硫酸,含游离SO 365%高浓度发烟硫酸(近年来这种发烟硫酸在化学工业等部门应用愈来愈广泛)。
三氧化硫的吸收,实际上是从气相中分离SO 3分子使之尽可能完全地转化为硫酸的过程。
该过程与净化系统所述的SO 3去除,在机理上是不同的。
采用湿法净化时,炉气中SO 3先形成酸雾,然后再从气相中清除酸雾液滴。
而在这里是采用吸收剂——硫酸直接将分子态SO 3吸收。
5.1.1 影响发烟硫酸吸收过程的主要因素吸收系统生产发烟硫酸时,首先将净转化气送往发烟硫酸吸收塔,用于产品酸浓度相近的发烟硫酸喷淋吸收。
用发烟硫酸吸收SO 3的过程并非单纯的物理过程,属化学吸收过程。
一般情况下,该吸收过程属于气膜扩散控制,吸收速率取决于传质推动力、传质系数和传质面积的大小,即: G =kF •Δp式中 G —一吸收速率;k ——吸收速率常数;F ——传质面积:Δp ——吸收推动力。
在气液相逆流接触的情况下,吸收过程的平均推动力可用下式表示。
()()()()'2"1"2'1'2"1"2'1lg 3.2p p p p p p p p p -----=∆ 式中 p 1’、p 2’——分别为进出口气体中SO 3分压,Pa ;p 1”、p 2”——分别为进出口发烟硫酸液面上SO 3的平衡分压,Pa 。
当气相中SO 3含量及吸收用发烟硫酸含量一定时,吸收报动力与吸收酸的温度密切相关。
物理光学-第5章 光的吸收、色散和散射

§5-2 介质的吸收与色散
不过,一般吸收和选择吸收的区别是相对的、有条件的。任何物质,在 一个波段范围内表现为一般吸收,在另一个波段范围内就可能表现为选 择吸收,例如,普遍光学玻璃,对可见光吸收很弱,是为一般吸收;而 在紫外红外波段,则表现出强烈的吸收,亦即选择吸收。任一介质对光 的吸收都是由这样两种吸收组成的 。 描述光波通过介质时的衰减特性。) 。)之间有如 吸收系数和消光系数 η(描述光波通过介质时的衰减特性。)之间有如 下的关系 复折射率:复折射率的实部就是通常所说的折射率, 复折射率:复折射率的实部就是通常所说的折射率,其虚部则是描述线 性吸收的参量。 性吸收的参量。
v=
dn dλ
在实际工作中,选用光学材料时应注意其色散的大小,例如,同样是 一块三棱镜,若是用作分光元件,则采取色散大的材料(火石玻璃); 若是用来改变光路的方向,如光学仪器中的转像棱镜等,则需用色散 小的材料(冕玻璃等)。
§5-2 介质的吸收与色散
实际上由于随变化的关系较复杂,无法用一个简单的函数表示出来,而 且这种变化关系随材料而异。因此一般都是通过实验测定随变化的关系, 并作成曲线,这种曲线就是色散曲线。 色散曲线的波长缩短时,折射率增大;且波长愈短,折射率增加的幅度 也愈大。这种波长变小,折射率变大的色散一般称之为正常色散。 除色散曲线外,还可利用经验公式求出不同波长时的折射率。在正常色 散区这种经验公式最早是由科希于1836年通过实验总结得出的,其公式 B C 为 n = A+ 2 + 4
§5-2 介质的吸收与色散
一般吸收: 一般吸收:有些媒质,在一定波长范围内,吸收系数不随 波长而变(严格说来是随波长的变化可以忽略不计),这 种吸收就称为一般吸收。 选择吸收: 选择吸收:有些媒质,在一定波长范围内,吸收系数随波 长而变,这种吸收就称为选择吸收。 例:
第五章 消化与吸收

肠壁的神经支配及其对内在神经丛活动的影响示意图
支配肠道的植物性神经系统
五.胃肠激素
(一)胃肠内分泌细胞 ◆内分泌细胞:单个、不均匀分布在黏膜上皮 细胞之间。 ◆胃肠激素:胃肠道内分泌细胞所分泌激素的 总称,与神经系统共同调节消化器官的活动。 ◆脑-肠肽:即由消化道和脑部肽能神经系统 释放的肽类激素。
分泌主要是由食物直接刺激胃而引起的。
6. 鱼类胃内消化较哺乳类慢,肉食性的鱼类 胃的排空时间需2-5天,原因是鱼类胃的蠕动 极弱,没有使食糜充分搅和的能力,胃酸和 消化酶仅能浸渗食物的表层进行消化,且环 境未能达到消化酶的适宜温度。
7. 鱼类的消化酶种类与食性有关。肉食性鱼 类的蛋白酶较多,非肉食性的鱼类蛋白酶 较少,而糖酶如淀粉酶、糖元分解酶、麦 芽糖酶等较多。
比格犬
头期胃液分泌是由动物进食或食物的 形状、颜色、气味的刺激作用于头部的 感受器引起的。
迷走神经是唯一能使胃液分泌的传出 神经,切断支配胃的迷走神经,胃液不 分泌。
特点:分泌延续时间长,胃液的分泌量大, 胃蛋白酶含量高,消化力强。
头期刺激胃液分泌的调节
2. 胃期(60%)
食物直接刺激胃粘膜而引起的分泌。 分泌特点:分泌量大,消化力弱。
(二)胃肠道激素及其作用
1.调控消化道运动、消化腺分泌 2.营养作用 3.对其他激素分泌的调控
第二节 摄食
一. 摄食方式 滤食(鲢),吸食(蚊子),采食和捕食 (大多数草食,肉食和杂食性动物)
二. 动物采食的调控 摄食中枢——下丘脑外侧区 饱中枢——下丘脑腹内侧区
鱼类的口和咽没有明显界限,出现鳃的部位 为咽,前方为口腔,一般合称为口咽腔。
第三节 口腔消化
一.唾液的分泌 (一)唾液的成分及生理作用
第5章气体吸收

内流体做层流流动,主要依靠分子扩散传递 物质,浓度变化大,因此,传质阻力主要集 中在气膜和液膜双膜内。
气体溶质从气相主体到液相主体,共经历 了三个过程,即对流——溶解——对流
三、 吸收速率
吸收速率是指单位时间内通过单位传质面积
所吸收的吸收质的量。 增大吸收系数、增加气液传质面积、提高吸 收过程推动力(选择吸收剂、降低吸收温度、 提高系统压力),均能提高吸收速率,强化 吸收过程。
废气吸收填料塔流程
废气吸收填料塔结构图
2、吸收剂的Leabharlann 择 (1)溶解度 吸收剂对混合气体中被吸收组分 的溶解度要尽可能大 (2)选择性 吸收剂对于要吸收组分有很好的 吸收能力, (3)挥发性 要求吸收剂的挥发性能力差 (4)粘性 吸收剂的粘度低 (5)其它 所选收剂还应尽可能无毒,不易燃、 化学性能稳定,无腐蚀、不发泡、冰点及比热 尽可能低,价廉易得等优点。
三、气体吸收的分类
1、根据吸收过程有无化学反应,可将吸收
操作可分为物理吸收和化学吸收。 2、根据吸收过程中吸收剂吸收组分数目的 不同,可分为单组分吸收和多组分吸收 3、根据吸收体系中液相中的温度是否有显著 变化,可将吸收分为等温吸收和非等温吸收。
第二节 吸收的基本原理
一、气-液相平衡关系
3、温度的影响
低温操作可以增大气体在液体中的溶解度,
对气体吸收有利 但温度太低时,对吸收又是不利的。所以要 选择一个适宜的吸收温度。
4、压力
增加吸收塔系统的压力,但过高地增加气体
系统压力,会使动力消耗增大,设备耐压性、 密封性增强,设备要求高,使设备投资和日 常性生产费用加大。 一般能在常压下进行吸收操作的就不要无故 地提高压力。
三、工业上常用的解吸方法
第五章吸收

第五章吸收5.1 概述5.1.1化工生产中的传质过程传质分离过程:利用物系中不同组分的物理性质或化学性质的差异来造成一个两相物系,使其中某一组分或某些组分从一相转移到另一相,即进行相际传质,并由于混合物中各组分在两相间平衡分配不同,则可达到分离的目的。
以传质分离过程为特征的基本单元操作:气体吸收, 液体蒸馏, 固体干燥, 液-液萃取, 结晶, 吸附, 膜分离等。
本章介绍气体吸收。
5.1.2相组成表示法1.质量分数与摩尔分率(质量分数与摩尔分数)质量分数:是指在混合物中某组分的质量占混合物总质量的分率。
摩尔分率:摩尔分率是指在混合物中某组分的摩尔数n A占混合物总摩尔数n的分率。
气相:液相:质量分数与摩尔分率的关系为:=2.质量比与摩尔比质量比:是指混合物中某组分A的质量与惰性组分B(不参加传质的组分)的质量之比。
摩尔比:是指混合物中某组分A的摩尔数与惰性组分B(不参加传质的组分)的摩尔数之比。
质量分数与质量比的关系为摩尔分率与摩尔比的关系为3.质量浓度与摩尔浓度质量浓度定义为单位体积混合物中某组分的质量。
摩尔浓度是指单位体积混合物中某组分的摩尔数。
质量浓度与质量分数的关系为摩尔浓度与摩尔分率的关系为4.气体的总压与理想气体混合物中组分的分压压力不太高(通常小于500kPa),温度不太低时,总压与某组分的分压之间的关系为摩尔比与分压之间的关系为摩尔浓度与分压之间的关系为5.1.3气体吸收过程吸收操作的依据:是混合物各组分在某种溶剂(吸收剂)中溶解度(或化学反应活性)的差异。
一个完整的吸收分离流程包括吸收和解吸两部分。
能耗主要在解吸过程。
5.1.4气体吸收过程的应用(1)分离混合气体以获得一定的组分或产物;(2)除去有害组分以净化或精制气体;(3)制备某种气体的溶液;(4)工业废气的治理;实际吸收过程往往同时兼有净化和回收等多重目的。
5.1.5吸收剂的选用在选择吸收剂时,应从以下几方面考虑:(1)溶解度;(2)选择性;(3)溶解度对操作条件的敏感性;(4)挥发度;(5)黏性;(6)化学稳定性;(7)腐蚀性;(8)其它等要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章 吸收相组成的换算【5-1】 空气和CO 2的混合气体中,CO 2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少?解 因摩尔分数=体积分数,.02y =摩尔分数 摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解lgNH 3, NH 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少?解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982s kg m ρ=代替。
溶液中NH 3的量为 /311017n k m o l-=⨯ 溶液的体积 /.33101109982 V m -=⨯溶液中NH 3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 .3998200105058218s s c x kmol m M ρ==⨯=../ NH 3与水的摩尔比的计算 //1170010610018X ==.或 ..00105001061100105x X x ===--. 【5-3】进入吸收器的混合气体中,NH 3的体积分数为10%,吸收率为90%,求离开吸收器时NH 3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为 122111Y Y Y Y Y η-===-被吸收的溶质量原料气中溶质量解 原料气中NH 3的摩尔分数0.1y = 摩尔比 (11101)01111101y Y y ===-- 吸收器出口混合气中NH 3的摩尔比为()...211109011100111Y Y η=-=-⨯=()摩尔分数 (22200111)=0010981100111Y y Y ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3 NH ,查得20℃时溶液上方3NH 的平衡分压为798Pa 。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。
总压为100kPa 。
解 液相中3NH 的摩尔分数/.//1170010511710018x ==+气相中3NH 的平衡分压 *.0798 P kPa =亨利系数 *./.07980010576E p x ===/ 液相中3NH 的浓度 /./.333110170581 101109982n c kmol m V --⨯===⨯/ 溶解度系数 /*./../(3058107980728H c p k m o l m k P a===⋅液相中3NH 的摩尔分数 //1170010511710018x ==+./气相的平衡摩尔分数 **.0798100y p p ==// 相平衡常数 * (079807610000105)y m x ===⨯ 或 //.76100076m E p === 【5-5】空气中氧的体积分数为21%,试求总压为.101325kPa ,温度为10℃时,31m 水中最大可能溶解多少克氧?已知10℃时氧在水中的溶解度表达式为*.6331310p x =⨯,式中*p 为氧在气相中的平衡分压,单位为kPa x ;为溶液中氧的摩尔分数。
解 总压.101325 p k P a = 空气中2O 的压力分数 .021A p p ==/体积分数 空气中2O 的分压 *..021101325 A p kPa =⨯亨利系数.6331310E k P a =⨯ (1) 利用亨利定律*A p Ex =计算与气相分压..021101325A p kPa =⨯相平衡的液相组成为 *. ..62602110132564210 331310A p x kmol O kmol E ⨯===⨯⨯./溶液 此为1kmol 水溶液中最大可能溶解.6264210kmol O -⨯ 因为溶液很稀,其中溶质很少1kmol 水溶液≈1kmol 水=18 kg 水10℃,水的密度 .39997k g m ρ=/故 1k m o l 水溶液≈.3189997m /水 即.3189997m 水中最大可能溶解.664210kmol -⨯氧故 31m 水中最大可能溶解的氧量为 (642642109997)3571018kmol O --⨯⨯=⨯...4222357103211410O 114O kg g --⨯⨯=⨯=(2) 利用亨利定律*AA c p H=计算 () (536)9997== 167610/33131018ssH kmol m kPa EM ρ-≈⨯⋅⨯⨯ 31m 水中最大可能溶解的氧量为*(..)(.).5432021101325 16761035710A A c p H kmol O m --==⨯⨯=⨯/ 溶液 ...4222357103211410114kg O g O --⨯⨯=⨯=【5-6】含NH 3体积分数 1.5%的空气-NH 3混合气,在20℃下用水吸收其中的NH 3总压为203kPa 。
NH 3在水中的溶解度服从亨利定律。
在操作温度下的亨利系数80E kPa =。
试求氨水溶液的最大浓度,33NH /kmol m 溶液。
解 气相中3NH 的摩尔分数.0015y = 总压203p kPa =,气相中3NH 的分压*.2030015A p py kPa ==⨯ (1) 利用亨利定律*p Ex =计算与气相分压p 相平衡的液相中NH 3的摩尔分数为 *..20300150038180A p x E ⨯===3NH 水溶液的总浓度 ./3998218ssc kmol m M ρ≈=水溶液中3NH 的最大浓度 .99820038118A c cx ==⨯. ./33211kmol NH m =溶液 (2) 利用亨利定律*AA c p H=计算 .,3998280==0.693 kmol/(m kPa)8018s s E kPa H EM ρ=≈⋅⨯()*(.)..3320300150693211 kmol NH /m A A c p H ==⨯=溶液【5-7】温度为20℃,总压为0.1MPa 时,CO 2水溶液的相平衡常数为m=1660。
若总压为1MPa 时,相平衡常数m 为多少?温度为20℃时的亨利系数E 为多少MPa ?解 相平衡常数m 与总压p 成反比,.'01 时 1660,1p MPa m p MPa === 时.''01= 1660=1661p m mp =⨯ 亨利系数 ''166 E mp m p MPa ===【5-8】用清水吸收混合气中的NH 3,进入吸收塔的混合气中,含NH 3体积分数为6%,吸收后混合气中含NH 3的体积分数为0.4%,出口溶液的摩尔比为30012 kmol NH kmol ./水。
此物系的平衡关系为*.076Y X =。
气液逆流流动,试求塔顶、塔底的气相传质推动力各为多少?解 已知.1006y =,则()/./..111100609400638Y y y =-== 已知.20004y =,则()./..32000410004=40210Y =-⨯ 已知10.012X =,则*10.760.0120.00912Y =⨯= 已知20X =,则*20Y =塔顶气相推动力 *3222 4.0210=Y Y Y -∆=-⨯塔底气相推动力 *1110.06380.009120.0547Y Y Y ∆=-=-= 【5-9】CO 2分压力为50kPa 的混合气体,分别与CO 2浓度为./3001kmol m 的水溶液和CO 2浓度为.3005kmol m /的水溶液接触。
物系温度均为25℃,气液相平衡关系*.5166210p xkPa =⨯。
试求上述两种情况下两相的推动力(分别以气相分压力差和液相浓度差表示),并说明CO 2在两种情况下属于吸收还是解吸。
解 温度25℃t =,水的密度为/3s 997kg m ρ= 混合气中CO 2的分压为50p kPa = 水溶液的总浓度/39718ssc kmol m M ρ≈=水溶液 (1) 以气相分压差表示的吸收推动力①液相中CO 2的浓度.32001 A c kmol CO m =/水溶液 液相中CO 2的摩尔分数././4001=180********A x c c -==⨯与液相平衡的气相平衡分压为*...55416621016621018051030p x kPa -=⨯=⨯⨯⨯=气相分压差表示的推动力 *503020p p p k P a ∆=-=-=(吸收)② 液相中CO 2的浓度30.05kmol m /A c =水溶液 液相中CO 2的摩尔分数40.05/9.02710997/18A x c c -===⨯与液相平衡的气相平衡分压为*...554166210166210902710150p x kPa -=⨯=⨯⨯⨯=气相分压差表示的推动力*15050100p p p kPa ∆=-=-= (解吸) (2) 以液相浓度差表示的吸收推动力 与气相250CO p kPa =分压平衡的液相组成为 *..5550166210166210p x ==⨯⨯ 平衡的液相浓度①液相中CO 2的浓度./32001 A c kmol CO m =水溶液 液相浓度差表示的推动力为*...3001666001000666kmol /m A A c c c ∆=-=-= (吸收)②液相中CO 2的浓度320.05 CO /A c kmol m =水溶液 液相浓度差表示的推动力为*.../300500166600333A A c c c kmol m ∆=-=-= (解吸)吸收过程的速率【5-10】如习题5-10附图所示,在一细金属管中的水保持25℃,在管的上口有大量干空气(温度25℃,总压101.325kPa)流过,管中的水汽化后在管中的空气中扩散,扩散距离为l00mm 。
试计算在稳定状态下的汽化速率,()2kmol m s ⋅/。
解 25℃时水的饱和蒸气压为.32895kPa从教材表5-2中查得,25℃,.101325kPa 条件下,H 2O 在空气中的分子扩散系数././2420256025610D cm s m s -==⨯。
扩散距离.m 10001Z mm ==,总压101.325 p kPa =水表面处的水汽分压 .132895A p kP a = 空气分压 ..1110132532895B A p p p =-=-.9804 k P a =管上口处有大量干空气流过,水汽分压20A p = 空气分压.2101325B p kPa = 空气分压的对数平均值为 ...ln ln.2121328959981013259804B B Bm B B p p p kPa p p -=== 水的汽化速率习题5-10附图()12A A A BmD p N p p RTZ p =⨯⨯- ()()..../ (472025610101325)32895034510831429801998kmol m s --⨯=⨯⨯-=⨯⋅⨯⨯【5-11】 用教材图5-10(例5-4附图)所示的装置,在温度为48℃、总压力为.101325kPa 条件下,测定CCl 4蒸气在空气中的分子扩散系数。
