九年级化学计算题练习题汇总
九年级化学化学计算题题20套(带答案)及解析
九年级化学化学计算题题20套(带答案)及解析一、中考化学计算题1.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。
请计算:第一次第二次第三次第四次加入澄清石灰水100100100100的质量/g生成沉淀的质量0.4m 1.0 1.0/g(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
【答案】0.8 10.6%【解析】【分析】第一次生成沉淀0.4g,而第三次不到0.4g的3倍,则第二次应该为0.4g的二倍,所以m=0.4g×2=0.8g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠溶液中溶质的质量分数。
【详解】由分析可知,m=0.4g×2=0.8g设原Na2CO3溶液中溶质的质量分数为x。
106100=10g?x 1.0gx=10.6%答:(1)表中的m的值为 0.8。
(2)原Na2CO3溶液中溶质的质量分数是10.6%。
2.将含有杂质(不溶于水)的氯化钡样品12.5g放入39.6g水中充分搅拌,完全溶解后过滤。
取20g滤液与足量的稀硫酸完全反应,得到4.66g沉淀。
请计算:①配制的氯化钡溶液中溶质的质量分数。
②样品中氯化钡的质量分数。
【答案】20.8%;83.2%【解析】【详解】①设参加反应的氯化钡的质量为x 。
2244BaCl +H SO =BaSO +2H 208233x4Cl.66g208233=x 4.66gx= 4.16g则配制的氯化钡溶液中溶质的质量分数为 :4.16g20g×100%=20.8% ②由于20g 溶液中含有4.16g 氯化钡,则可设样品中氯化钡的质量为y 。
则4.16g y=20g-4.16g 39.6gy=10.4g样品中氯化钡的质量分数为:10.4g12.5g×100%=83.2%答:①氯化钡溶液中溶质的质量分数为20.8% ②样品中氯化钡的质量分数为83.2%。
【化学】九年级化学化学计算题题20套(带答案)

20套(带答案)【化学】九年级化学化学计算题题一、中考化学计算题1.某纯碱样品中含有少许氯化钠。
现称量该样品放入烧杯中,再向此中加入必定溶质质量分数的稀盐酸至100g时恰巧完整反响。
此时烧杯内的物质质量为111g。
试计算:1)碳酸钠中钠元素、碳元素、氧元素的质量比为__________;(化为最简比)2)反响后生成的气体质量为_________g;(3)恰巧完整反响时所得溶液中溶质的质量分数________。
(计算结果精准到0.1%)【答案】23:6:24。
;14.9%【分析】【剖析】【详解】(1)碳酸钠化学式为Na2CO3,此中钠元素、碳元素、氧元素的质量比=23×2:12×1:16×3=23:6:24;2)碳酸钠和盐酸反响生成氯化钠、水和二氧化碳,依据质量守恒定律,生成二氧化碳气体的质量=+100g-111g=g;3)假定样品中碳酸钠质量为x,生成的氯化钠质量为y,则有:==解得,故样品中氯化钠质量,反响后溶液中溶质为氯化钠,故恰巧完整反响时所得溶液中溶质的质量分数,其总质量=×100%≈14.9%。
2.将必定质量的NaCl和Na2SO4固体混淆物完整溶于水后,加入必定质量分数的BaCl2溶液208g,恰巧完整反响,过滤,获得积淀,经测定滤液中含氯元素的质量为(不考虑过滤过程中物质质量的损失)。
计算:(1)所加BaCl溶液的溶质质量分数_______。
2(2)原固体混淆物中NaSO的质量________。
24(3)原固体混淆物中NaCl的质量__________。
【答案】10%【分析】【剖析】由题可知生成硫酸钡的质量是23.3g,依据化学方程式列比率求出Na242SO的质量,BaCl的质量,由化学式求出BaCl2中氯元素的质量,可得出原固体混淆物中NaCl中氯元素的质量,进而求得NaCl的质量;【详解】设BaCl2的质量是xg,Na2SO4的质量是yg,Na2SO4+BaCl2=2NaCl+BaSO4↓142208233yx,BaCl溶液的溶质质量分数==10﹪2BaCl中氯元素的质量=2原固体混淆物中NaCl中氯元素的质量=21.原固体混淆物中NaCl的质量3.某同学向必定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反响过程中溶液的pH与加入的稀盐酸的关系如图1所示。
初三化学化学计算题题20套(带答案)含解析

初三化学化学计算题题20套(带答案)含解析一、中考化学计算题1.我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:方案一: 取10g 石灰石粉末样品置于下图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g方案二:另取10g 同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g相关资料:当地石灰石含有的主要杂技为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发生化学反应.计算出两种方案测得的石灰石中碳酸钙的质量分数:(1)方案一中碳酸钙的质量分数是_______________________;(2)方案二中碳酸钙的质量分数是_______________________.(精确到0.1%)比较两方案测量的结果,分析两方案误差较大的可能原因?______【答案】42.7% 97% 石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大.【解析】【分析】【详解】(1)生成二氧化碳的质量为10g-8.12g=1.88g设生成1.88g 二氧化碳需碳酸钙的质量为x32CaCO CaO +10044x 1.88CO g高温 10044=x 1.88gx=4.27g石灰石样品中碳酸钙的质量分数为4.27g100%=42.7% 10g⨯(2)混合物的总质量减少了4.27g说明生成了4.27g二氧化碳设样品中的碳酸钙的质量为y3222CaCO+2HCl=CaCl+H O+CO10044y 4.27g↑10044=y 4.27gy=9.7g石灰石样品中碳酸钙的质量分数为9.7g100%=97% 10g⨯石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大。
2.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。
九年级化学计算题

九年级化学计算题
题目:现有一定质量的锌粉加入到盛有200g稀硫酸的烧杯中,恰好完全反应,反应后烧杯内物质总质量为209.8g。
求:(1)生成氢气的质量;(2)稀硫酸中溶质的质量分数。
解析:
1. 计算氢气质量
- 根据质量守恒定律,反应前物质的总质量等于反应后物质的总质量。
反应前锌粉和稀硫酸的总质量,反应后是烧杯内剩余物质和氢气的总质量。
- 设生成氢气的质量为公式。
- 反应前锌粉和公式稀硫酸的总质量,反应后烧杯内物质总质量为公式,则公式,因为锌与稀硫酸反应公式
,所以公式。
- 生成氢气的质量公式,由于锌粉的质量在计算氢气质量时不需要单独求出,根据质量守恒定律,公式
,所以公式。
2. 计算稀硫酸中溶质的质量分数
- 设稀硫酸中溶质公式的质量为公式。
- 根据化学方程式公式,可得公式
(公式的相对分子质量为公式,公式的相对分子质量为公式)。
- 解得公式。
- 稀硫酸中溶质的质量分数公式。
人教版九年级化学上册期末考试计算题专项练习-附带答案

人教版九年级化学上册期末考试计算题专项练习-附带答案可能用到的相对原子质量:C:12 H:1 O:16 N:14 Ca:40 S:32 Mg:24 Mn:55一、计算题。
1.空气中氧气的体积分数约为21%,氮气的体积分数约为78%.小江老师让同学往集气瓶装入半瓶水,再用排水法收集集气瓶的氧气,发现瓶中的氧气也能使带火星的木条复燃。
请计算:(1)本实验中瓶内氧气约占瓶总体积的百分比是(结果保留整数)(2)另一同学需要 2.5g氮气(氮气密度为 1.25g/L),理论上她大致需要空气多少升?(结果保留一位小数)。
2.现有200升空气,问其中含有氧气多少升,氮气多少升?氧气与氮气的质量比为多少?(写成分数)(已知氧气的密度为1.429克/升,氮气的密度为1.250克/升)3.学生体育测试后,常会感到肌肉酸痛,这是因为运动后产生了乳酸的原因。
乳酸的化学式为C x H6O3,已知乳酸的相对分子质量为90。
请计算:(1)C x H6O3中x=。
(2)乳酸中碳、氢、氧三种元素的质量比为(填最简整数比)。
(3)乳酸中氧元素的质量分数为(结果精确到0.1%)(4)180g乳酸中含碳元素多少g?(写出计算过程)4.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。
现煅烧含有200kg碳酸钙的贝壳,最多可得到氧化钙多少千克?5.在通常情况下,氧气的密度是1.429克/升,空气的密度是1.293克/升。
①空气的成分按体积计算,氮气占,氧气占。
②则按质量分数计算,氧气占多少?③一个成年人每天需要氧气大约是8.4升,则相当于需要空气多少升呢?6.用如图所示的装置测定空气中氧气含量,集气瓶的容积为350mL,装置气密性良好,实验前止水夹关闭。
实验前预先在集气瓶中放入30mL水,烧杯中盛有足量水,用凸透镜引燃燃烧匙中的红磷,冷却后打开止水夹,测得烧杯中的水少了64mL。
(1)请出红磷燃烧的符号表达式;(2)计算空气中氧气的体积分数。
初三化学计算复习题

初三化学计算复习题在初三化学学习中,计算题是不可或缺的一部分。
通过解决化学计算题,可以帮助学生巩固知识点,培养解决问题的能力。
本文将为你提供一些典型的初三化学计算复习题,帮助你更好地准备化学考试。
一、质量计算1. 甲烷(CH4)的相对分子质量是16克/摩尔,计算以下问题:(1) 8克的甲烷分子中含有几个碳原子?答:甲烷分子中只含有一个碳原子。
(2) 8克的甲烷分子中含有几个氢原子?答:甲烷分子中含有4个氢原子。
(3)甲烷中1克碳原子的质量占整个甲烷分子质量的百分比是多少?答:1克碳原子的质量占整个甲烷分子质量(16克)的百分比为6.25%。
2. 有一种化合物的化学式为H2SO4,计算以下问题:(1)该化合物的相对分子质量是多少?答:H2SO4的相对分子质量为98克/摩尔。
(2) 1克的该化合物中含有多少个氧原子?答:1克的H2SO4中含有0.32个氧原子。
(3)该化合物中含有多少克的氧元素?答:H2SO4中含有32克的氧元素。
二、物质的量计算1. 计算下列物质的物质的量:(1) 10克的氧气(O2)物质的量是多少?答:氧气的相对分子质量为32克/摩尔,因此10克的氧气物质的量是0.3125摩尔。
(2) 5克的二氧化碳(CO2)物质的量是多少?答:二氧化碳的相对分子质量为44克/摩尔,因此5克的二氧化碳物质的量是0.1136摩尔。
2. 计算下列物质的质量:(1) 0.5摩尔的甲烷(CH4)的质量是多少?答:甲烷的相对分子质量为16克/摩尔,因此0.5摩尔的甲烷的质量是8克。
(2) 0.25摩尔的硫酸(H2SO4)的质量是多少?答:硫酸的相对分子质量为98克/摩尔,因此0.25摩尔的硫酸的质量是24.5克。
三、溶液计算1. 计算以下问题:(1)有一溶液中含有20克的氯离子(Cl-),如果溶液的体积为500毫升,计算该溶液中氯离子的浓度。
答:氯离子(Cl-)的浓度等于质量除以体积,所以该溶液中氯离子的浓度为40克/升。
(word完整版)初三中考化学专题练习--计算题(含参考答案最新)
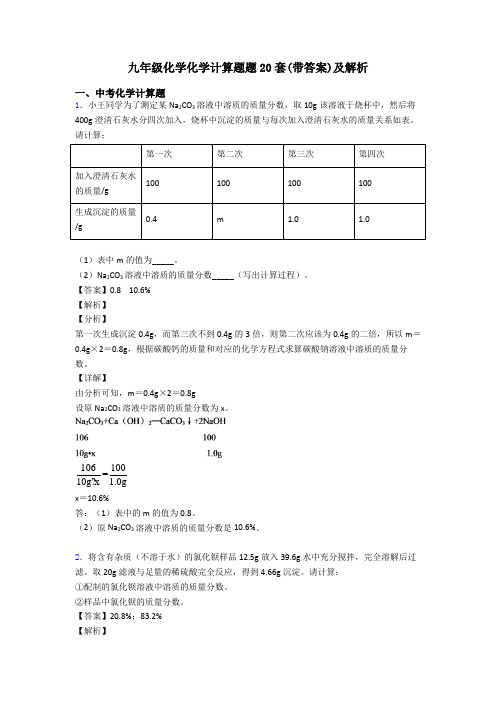
中考化学专题练习--计算题1.根据所示的实验和提供的数据、图像,回答下列问题:求:(1)a的质量 g。
(2)b点溶液质量。
(写出计算过程)(3)恰好完全反应后所得溶液中溶质质量分数。
(写出计算过程)2、实验室常用过氧化钠与水反应制取氧气,反应的化学方程式如下:2Na2O2+2H2O=4NaOH+O2↑,试计算:(1)15.6g过氧化钠与足量的水反应可以生成多少克氧气?(2)标准状况下,氧气的密度约为1.43g/L,多少空气中才可能含有这么多氧气。
(计算结果保留到0.1)3、某纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%。
为测定该产品中碳酸钠的质量分数,进行了以下实验:取11.0 g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0 g,再把100 g(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是________g。
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)。
(3)根据实验数据,在坐标纸上绘制出所加稀盐酸质量与生成气体质量关系的曲线。
(不要求写出计算过程,只画出曲线即可)4.工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。
请回答下列问题:(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是________g。
(2)计算氢氧化钠溶液的溶质质量分数。
(写出计算过程)(3)该工业盐酸中HCl的质量分数是_________。
5、钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。
某补钙药剂主要成分为碳酸钙,现将100g盐酸分成5等份,逐次加到用40g该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象。
请根据有关信息回答问题:序号第1次第2次第3次第4次第5次加入盐酸的质量/g 20 20 20 20 20剩余固体的质量/g 35 30 25 20 a(1)a的数值为________,该品牌补钙药剂中CaCO3的质量分数是_________。
九年级化学化学计算题专项训练100(附答案)含解析

56
152 64
m
n 3.2g
m = 56 m=2.8g, 3.2g 64
n = 152 n=7.6g, 3.2g 64
滤液 a 的质量=125g-(3.2g-2.8g)=124.6g;滤液 b 的质量=98g+5.6g-0.2g=103.4g;若将滤液 a 和 b 倒入同一烧杯并得到溶质质量分数为 8%的溶液,加水的质量=(15.2g+7.6g) 8%(124.6g+103.4g)=57g; (4)参加反应 10%稀硫酸的质量=9.8g 10%=98g,用 98%的浓硫酸配制 98g10%稀硫酸, 需加水的质量=98g-9.8g 98%=88g,即 88mL; (5)过滤操作需要用到的基本仪器有:铁架台、烧杯、玻璃棒和漏斗;在漏斗内放滤纸制 作过滤器。 【点睛】 在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
(l)原固体混合物中碳酸钠的质量分数 4.8g÷
=10.6g;混合物中碳酸钠的质量
分数为 10.6g÷12.6g×100%≈84.1%; (2)设盐酸中溶质的质量为 x,生成二氧化碳质量为 y
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
106 73
44
10.6g x
y
106 = 73 = 44 10.6g x y
(3)用同浓度的硫酸,与一瓶未变质、部分变质、或全部变质(杂质都是 Na2CO3)的烧碱样品 反应,需要硫酸的质量都相等.其原因是:__(从钠元素质量守恒的角度解释).
y=
44 9.0g 混合物中的碳酸钙质量为 9.0g× 5 =7.5g
6 所以 100 (4.0g-m) +m=7.5g,m=1.25g。
九年级化学化学计算题题20套(带答案)含解析
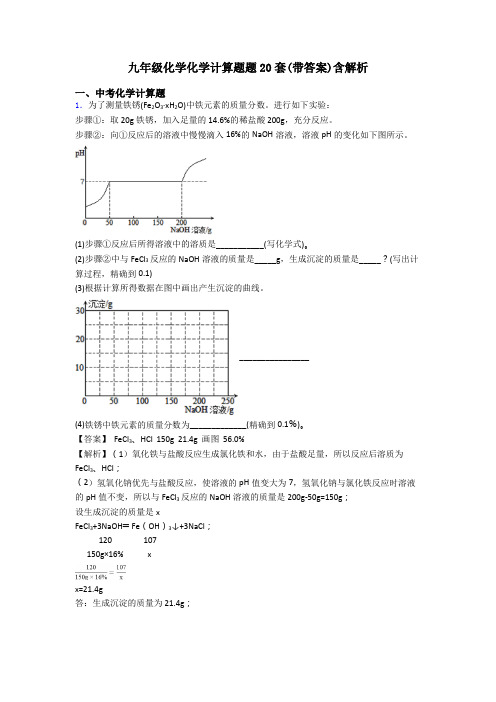
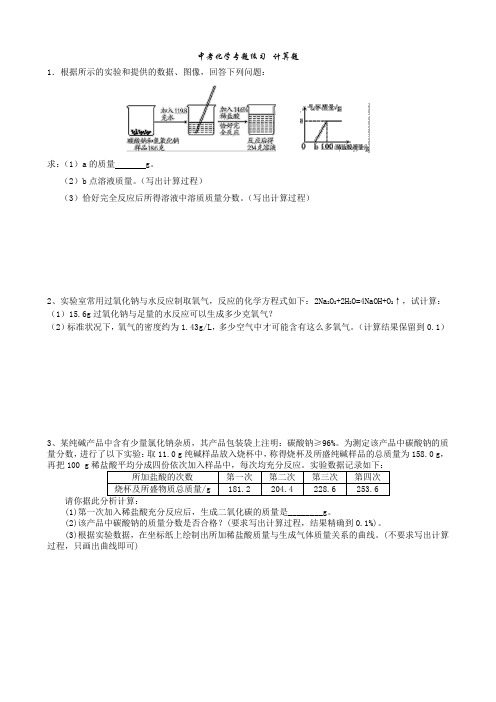
九年级化学化学计算题题20套(带答案)含解析一、中考化学计算题1.为了测量铁锈(Fe2O3·xH2O)中铁元素的质量分数。
进行如下实验:步骤①:取20g铁锈,加入足量的14.6%的稀盐酸200g,充分反应。
步骤②:向①反应后的溶液中慢慢滴入16%的NaOH溶液,溶液pH的变化如下图所示。
(1)步骤①反应后所得溶液中的溶质是___________(写化学式)。
(2)步骤②中与FeCl3反应的NaOH溶液的质量是_____g,生成沉淀的质量是_____?(写出计算过程,精确到0.1)(3)根据计算所得数据在图中画出产生沉淀的曲线。
________________(4)铁锈中铁元素的质量分数为_____________(精确到0.1%)。
【答案】 FeCl3、HCl 150g 21.4g 画图 56.0%【解析】(1)氧化铁与盐酸反应生成氯化铁和水,由于盐酸足量,所以反应后溶质为FeCl3、HCl;(2)氢氧化钠优先与盐酸反应,使溶液的pH值变大为7,氢氧化钠与氯化铁反应时溶液的pH值不变,所以与FeCl3反应的NaOH溶液的质量是200g-50g=150g;设生成沉淀的质量是xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107150g×16% xx=21.4g答:生成沉淀的质量为21.4g;(3)所以产生沉淀的曲线为;(4)所以铁锈中铁的质量分数为 =56%。
2.某化学兴趣小组对某铜锌合金样品进行探究实验,称取样品10.0 g,再用100.0 g稀硫酸溶液逐滴滴入,实验情况如图所示。
求:(1)铜锌合金中,Zn的质量分数是________。
(2)所用稀硫酸溶液中溶质的质量分数是__________?【答案】65% 19.6%【解析】试题分析:(1)铜锌合金与稀硫酸反应,其中只有锌与硫酸反应,故固体减少的量即为锌的质量=10g-3.5g=6.5g,则Zn%=6.5g/10g×100%=65%(2)解:设所用稀硫酸中溶质的质量分数为xZn+H2SO4=ZnSO4+H2↑65 986.5g 50gx65/98=6.5g/50gxx=19.6%答:锌的质量是65%;所用稀硫酸中溶质的质量分数为19.6%考点:合金、化学方程式计算3.某炼铝工厂想测定铝土矿中A12O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应,且不含铝元素),进行如下实验,第一步反应的物质质量关系如坐标图所示:(1)上述实验过程中发生反应的化学方程式是_____;(2)根据已知条件列出求解第一步实验铝土矿中参加反应的A12O 3质量(x)的比例式_____ (3)铝土矿样品中A12O 3的含量_____;(4)坐标图中B 点所示溶液中溶质的化学式是_____;(5)在第二步实验结束后所得溶液中溶质的质量分数是_____(6)用1700t 此铝土矿冶炼得到540t 的铝,则在冶炼中,铝土矿的利用率是_____。
初三化学考试 计算题25道(附答案)

25基础计算1.在一个实验室中发现一橡胶球可以漂浮在0.5mol/L的NaCl溶液表面,求该NaCl溶液的密度。
答案:1.018g/mL。
解析:根据阿威休斯定律得到:Fb=FgρVg=m*gρ=m/V=(Vg*g)/V=(Fg/Ag*g)/V=(4πr^3/3*g)/[(4/3)*π*r^3]=3/4*r*g=7.35*10^-5*g其中,Ag为橡胶球跟水接触的面积,r为橡胶球半径,g为重力加速度。
因此,NaCl溶液的密度为:ρNaCl=ρwater+ρball=1.000g/mL+7.35*10^-5*g/mL=1.018g/mL。
2.一种饱和食盐水的密度为1.20g/mL,问在哪个温度下它的浓度为26%。
答案:56.8°C。
解析:首先,要知道饱和食盐水在不同温度下的密度变化情况,参考表格得出如下数据:温度(°C)密度(g/mL)01.091101.078201.064301.049401.033501.015600.996700.975800.951900.9241000.895然后,根据浓度的定义可知:浓度=质量/总质量总质量=质量/浓度因为食盐水是饱和的,所以其浓度为100%。
设实验时食盐水的质量为m,则总质量为m/1.20,其中1.20为食盐水的密度。
根据题意,浓度为26%,所以食盐的质量为0.26*(m/1.20)。
由此0.26*(m/1.20)=m/(1.20+Δρ)其中Δρ为实验时食盐水的密度与需要求的密度的差值。
将参考表格中的数据代入上式计算,得到Δρ为0.325g/mL。
解方程得出:Δρ=0.325=0.26*m/(1.20+Δρ)m=68.45g因此,实验时食盐水的质量为68.45g。
而在哪个温度下其密度为1.20*0.26=0.312g/mL呢?查表可得,在56.8°C时,食盐水的密度约为0.312g/mL,因此答案为56.8°C。
初中化学九年级上计算题汇总(附参考答案与试题解析)

初中化学九年级上计算题汇总一.计算题(共50小题)1.用容积为45mL的试管给液体加热时,最多可盛液体的体积数是多少?若用容积为180mL的酒精灯给物质加热,则酒精灯内的酒精不超过多少毫升?2.甲同学用托盘天平称量10.2g食盐时(1g以下用游码),称后发现砝码放在左盘,食盐放在了右盘,所称食盐的实际质量是g。
3.甲学生用量筒量取液体,量筒摆放平稳,面对刻度,他先俯视读数为48mL,倾倒出部分液体后,又仰视读数为40mL,则该同学实际倒出的液体的体积是8mL(用“>”“<”“=”填空)。
4.小红同学用托盘天平称量物质的质量,砝码质量为25g,游码示数为2.8g。
(1)若称量时正确放置,则物质的质量为g。
(2)若称量后发现砝码的位置放反了,则物质的实际质量为g。
5.某同学用托盘天平称量固体物质时;把固体物质放在右盘,砝码放在左盘,称得固体物质的质量为10.8g(1克以下用游码),如果按正确的方法称量,这位同学所称固体的实际质量是多少克?6.小明做实验时要称8.3g的氯化钠固体,但他称时把药品和砝码放反了,他称药品时0.1g以下用游码,则他称到的氯化钠固体的实际质量为g;他量取水时先俯视读数为18mL,倒出一部分水后仰视读数为5mL,则他实倒出的水13mL,(填“大于”或“小于”或“等于”或“不确定”)。
7.某同学在称量46.5g(5g以下用游码)食盐时刚好将食盐与砝码放反了,其他操作完全正确,则所称量的食盐的实际质量是g。
8.体积50L的空气中含氧气的质量是多少g?(已知氧气的密度是1.43g/L.精确到0.1g)9.小明发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃。
那么,使带火星的木条复燃的氧气的浓度最低值是多少呢?小明对此展开探究:第一组实验:取5支集气瓶,编号为①②③④⑤,分别装入其总容积10%、20%、30%、40%、50%的水。
用排水法收集氧气恰好把5只瓶子中的水排去,将带火星的木条依次插入①~⑤号瓶中,记录实验现象。
最新初三化学化学计算题题20套(带答案)

最新初三化学化学计算题题20套(带答案)一、中考化学计算题1.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算物质的质量分数2.将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量Fe x C)与足量稀硫酸反应,得到0.48gH2(Fe x C与稀硫酸反应不产生H2)。
若将相同质量的粗还原铁粉在氧气流中完全反应,得到0.22gCO2.试通过计算确定:(1)此粗还原铁粉中单质铁的质量_____(2)此粗还原铁粉中杂质Fe x C的化学式。
_____【答案】13.44g Fe 2C 【解析】 【分析】 【详解】若将14.06g 还原铁粉(含少量Fe x C )在氧气流中加热,得到0.22gCO 2,碳元素的质量=0.22g ×1244=0.06g (1)将相同质量的还原铁粉与足量硫酸反应,得到0.48gH 2,设消耗铁的质量为x 。
2442Fe +H SO =FeSO +562x0H .48g562=x 0.48gx=13.44gFe x C 的质量=14.06g ﹣13.44g=0.62g ; Fe x C 的中铁元素的质量=0.62g ﹣0.06g=0.56g则:56x 0.56g=120.06gx=2所以化学式为Fe 2C3.食盐是维持人体正常生理活动必不可少的物质.人体细胞中约含有NaCl 0.9%,一般成年人每日需NaCl 的量为4.5g ~9g .(1)某病人因食盐摄入量不足,需要补充溶质质量分数约为0.9%的生理盐水,医生通过诊断需为他注射200g 生理盐水,则该病人每天可补充食盐约___g .(2)若用50g 溶质质量分数为18%的氯化钠溶液配制溶质质量分数为0.9%的生理盐水,需加水___g .(3)小明想检验某瓶生理盐水的氯化钠含量是否合格,他从该瓶生理盐水中取出65g 溶液,然后加入足量硝酸银溶液,充分反应后过滤、洗涤、干燥,得到1.435g 沉淀.请你通过计算帮助小明判断这瓶生理盐水的氯化钠含量是否合格____. 【答案】⑴1.8 ⑵950⑶设该生理盐水的溶质质量分数为0.9%,故此生理盐水的氯化钠含量合格。
九年级化学化学计算题专项训练100(附答案)

九年级化学化学计算题专项训练100(附答案)一、中考化学计算题1.某化学兴趣小组的同学在实验室配制溶质质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
下图表示用该氢氧化钠溶液与10g某稀盐酸发生反应时溶液温度的变化情况。
试计算稀盐酸中溶质的质量分数。
【答案】14.6%【解析】试题分析:由于中和反应放热,故随着反应的进行,溶液的温度逐渐升高,直至反应恰好完全,溶液温度达到最高,故根据图示可判断,当加入氢氧化钠那溶液的质量为20g时,反应恰好完全解:分析图知与10g稀盐酸恰好完全反应的氢氧化钠质量为:20g×8%=1.6g设稀盐酸中溶质的质量为xNaOH+HCl=NaCl+H2O40 36.51.6g x40:1.6g=36.5:xx=1.46g稀盐酸中溶质的质量分数为:1.46g/10g=14.6%答:稀盐酸中溶质的质量分数为14.6%考点:根据化学方程式计算2.某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图(1)纯碱恰好完全反应时,生成CO2的质量为___g(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)____________(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?____________【答案】4.4g 11.7% 16.3%【解析】【分析】(2)根据题意可知:已知量为二氧化碳的质量,未知量为样品中含杂质的质量分数。
解题思路为:可根据反应中二氧化碳与碳酸钠的质量关系求出碳酸钠的质量。
进一步可求出样品中含氯化钠的质量分数。
(3)根据题意可知:已知量为二氧化碳的质量,未知量为所得溶液中溶质的质量分数。
解题思路为:所得溶液为氯化钠溶液,可根据反应中二氧化碳与氯化钠的质量关系求出生成氯化钠的质量。
(化学)九年级化学化学计算题题20套(带答案)

(化学)九年级化学化学计算题题20套(带答案)一、中考化学计算题1.有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:(1)样品中金属铜的质量是____g。
(2)所用稀硫酸的溶质质量分数____(写出计算过程)。
【答案】19.519.6%【解析】混合物中只有锌能够和稀硫酸反应生成氢气,题目给出了氢气的质量,所以可以根据氢气的质量和对应的化学方程式求算参加反应的锌的质量和消耗的稀硫酸中溶质的质量,进而求算铜的质量和硫酸中溶质的质量分数。
设参加反应的锌的质量为x,所消耗的硫酸中的溶质的质量为y。
Zn+ H2SO4 = ZnSO4 + H2↑65 98 2x y 0.4g659820.4x y g==x=13gy=19.6g混合物中铜的质量为32.5g-13g=19.5g所以稀硫酸中溶质的质量分数为19.6g0010019.600 100g⨯=答:(1)样品中金属铜的质量是19.5g。
(2)所用稀硫酸中溶质的质量分数为19.6%。
2.现有l00g 8%的NaOH溶液,通过计算回答下列有关问题:(1)若用该溶液吸收CO2,最多可以生成Na2CO3多少克?____(写出详细计算过程)(2)当NaOH全部转化成为Na2CO3后,Na2CO3还会继续与CO2、H2O发生反应:Na2CO3+CO2+H2O=2NaHCO3,直至Na2CO3完全反应完。
请在如图画出利用l00g8%的NaOH 溶液吸收CO2与生成NaHCO3的曲线。
____(3)现有三种溶液:①100g8%NaOH溶液、②100g8%NaOH溶液吸收CO2转化为Na2CO3溶液、③100g8%NaOH溶液吸收过量CO2转化为NaHCO3溶液,分别用相同质量分数的硫酸与上述三种溶液恰好完全反应,需要的硫酸的质量_____(选填“相等”或“不相等”),原因是_____。
九年级化学计算题专项练习

九年级化学计算题专项练习1、电解水时,常在水中加入硫酸使反应容易进行,硫酸本身并不被分解。
现用45g溶质质量分数为8%的硫酸溶液进行电解水的实验,一段时间后,产生lg氢气。
计算:(1)被电解的水的质量。
(2)电解后的硫酸溶液的溶质质量分数。
2、已知某Fe2O3样品中铁元素的质量分数为63%(杂质不含铁元素),求此氧化铁样品中的质量分数。
3、为防止汶川地震灾区的病菌传播,防疫人员大量使用了“漂白粉”来杀菌消毒,“漂白]。
请计算:粉”的有效成分为次氯酸钙[化学式为:Ca(ClO)2(1)次氯酸钙中钙、氯、氧三种元素的质量比;(2)次氯酸钙中氯元素的质量分数;(3)若灾区饮用水每50 kg至少需要漂白粉250 g,则消毒一桶水(约20 kg)至少需加漂白粉多少克。
4、在6吨尿素里含氮元素________吨,它跟________吨硝酸铵所含氮元素质量相等。
15、最近,在我国各大城市举办以“珍爱生命,拒绝毒品”为主题的全国禁毒展览,从大麻叶中提取的一种毒品,叫大麻酚,它的化学式为C21H26O2在空气中焚烧生成二氧化碳和水。
(1)则该物质的相对分子质量为。
(2)该物质中碳、氢、氧三种元素的质量比为。
6、某学习小组取氯酸钾与二氧化锰的混合物共3.3 g,加热该混合物t时间后,冷却,称量剩余固体质量,重复以上操作,依次称得4个加热时间后剩余固体的质量,记录数据如下:请仔细分析实验数据,回答下列问题:(1)表中a值为_________,完全反应后产生氧气的质量为_________g .(2)该混合物中氯酸钾的质量是多少?二氧化锰的质量是多少?7、实验室用C还原CuO,生成的气体通入足量澄清石灰水,得到10g白色沉淀,求参加反应的C和CuO的质量?8、化学课上,老师提供信息“10 g CuO用氢气还原一段时间后,程得残留固体质量为8.4 g”,要求学生编制成化学计算题并求解。
现摘取部分学生自编自解题中所设未知量的求解表达式,请你参照示例(1)在相关表达式右边短线上用文字简述x表示什么?(1)16/1.6 g=18/x x=18×1.6 g/16示例:x表示反应后生成水的质量(2)x=1.6 g×80/16÷10 g×100%____________________________(3)x=10 g×2/80-2×1.6 g/16____________________________9、黑火药是我国古代四大发明之一。
初三化学计算练习题

初三化学计算练习题在初三化学学习中,计算是一项重要的技能。
通过练习化学计算题,可以提升我们的计算能力,并巩固对化学知识的理解和应用。
本文将为大家提供一些初三化学计算练习题,旨在帮助大家更好地掌握化学计算的方法和技巧。
1. 浓度计算题(1) 一瓶100mL的NaOH溶液中含有4g的NaOH,请计算该溶液的质量浓度。
(2) 一瓶500mL的盐酸溶液的质量浓度为0.5mol/L,请计算该溶液中盐酸的质量。
(3) 一瓶500mL的硝酸溶液的质量浓度为1.5g/mL,请计算该溶液的质量浓度。
2. 摩尔计算题(1) 4g的氧气与1g的氢气反应生成水,请计算生成的水的质量。
(2) 2mol的NaOH与1mol的HCl反应生成水和氯化钠,请计算生成的氯化钠的摩尔数。
(3) 一瓶200mL的盐酸溶液的浓度为0.02mol/L,请计算该溶液中盐酸的摩尔数。
3. 化学方程式计算题(1) 燃烧10g的甲烷,计算生成的二氧化碳的质量。
(2) 一定体积的烷烃燃烧完全产生水和二氧化碳,如果该体积的烷烃中有6g的碳,计算生成的水的质量。
(3) 一定质量的铁和硫磺反应生成硫化铁,请计算反应过程中硫磺的质量。
4. 溶液的稀释计算题(1) 一瓶200mL浓度为0.2mol/L的盐酸溶液,需要将其稀释为0.1mol/L的溶液,请计算需要加入多少毫升的水。
(2) 一瓶500mL浓度为0.5g/mL的硝酸溶液,需要将其稀释为0.1g/mL的溶液,请计算需要加入多少毫升的水。
(3) 一瓶100mL浓度为2mol/L的氢氧化钠溶液,需要将其稀释为0.5mol/L的溶液,请计算需要加入多少毫升的水。
通过以上的练习题,我们可以锻炼化学计算的能力,掌握化学计算的基本方法和技巧。
希望同学们能够通过不断的练习,提高化学计算的水平,为进一步学习化学打下坚实的基础。
这些练习题只是初三化学计算的一部分,大家可以根据自己的学习进度和需要,选择适合自己的练习题来进行训练。
最新九年级化学化学计算题题20套(带答案)

最新九年级化学化学计算题题20套(带答案)一、中考化学计算题1.为测定某H2SO4溶液的溶质质量分数,现取200g硫酸溶液置于烧杯中,不断加入一定质量分数的BaCl2溶液,反应过程中杯中溶液的质量与加入BaCl2溶液的质量关系如图所示。
请回答:(1)反应生成沉淀的质量为_____g;在Q点时溶液中的离子为_____(用符号)。
(2)在反应过程中,杯中溶液的pH_____(填“变大”、“不变”或“变小”)。
(3)原硫酸溶液的溶质质量分数是多少_____?【答案】23.3 H+、Cl﹣、Ba2+变大 4.9%【解析】【详解】(1)由图中信息可知,P点时氯化钡和硫酸恰好完全反应,反应前后的质量差即为反应生成沉淀硫酸钡的质量,则生成的硫酸钡的质量是200g+100g﹣276.7g=23.3g,故填23.3;Q点的氯化钡溶液过量,溶液中的溶质为盐酸和氯化钡,在Q点时溶液中的离子为H+、Cl ﹣、Ba2+,故填H+、Cl﹣、Ba2+;(2)反应的过程中硫酸不断被消耗,生成盐酸,随氯化钡溶液的加入,溶剂增加,溶液的酸性不断变弱,所以pH会不断变大,故填变大;(3)设氯化钡质量为x。
2244BaCl+H SO=BaSO+2HCl98233x23.3g98233=x23.3gx=9.8g原硫酸溶液的溶质质量分数为:9.8g200g×100%=4.9%答:硫酸溶液的溶质质量分数为4.9%。
2.化学兴趣小组取26g石灰石样品(杂质不参加反应,也不溶于水)放在烧杯中,向其中加入90g稀盐酸,恰好完全反应,反应后烧杯中物质的总质量为105g,计算:(1)生成二氧化碳的质量是____。
(2)反应后所得溶液的溶质质量分数是____。
【答案】(1)11克 (2) 26.7% 【解析】试题解析:由质量守恒定律可以知道反应前的各物质的总质量等于反应后各物质的总质量的,所以二氧化碳的质量=26+90-105=11克,反应后的溶质是CaCl 2,而溶液的质量等于105克减去石灰石中的不反应的杂质的质量,设:石灰石中CaCO 3质量为X ,生成的CaCl 2质量为Y ,CaCO 3+ 2HCl==CaCl 2 + CO 2↑ + H 2O 100 111 44 X Y 11克列比例式:100:X=44::11克 解得:X=25克 111:Y=44:11克 解得:Y="27.75" 克反应后所得溶液的溶质质量分数=27.75/105-(26-25)×100%≈26.7% 考点:质量守恒定律及其根据化学方程式的计算 溶液的相关计算3.请根据如图所示的实验过程和提供的数据计算。
九年级化学上册计算题(相对分子质量,化合价等)

九年级化学计算专题训练1一.计算题1.造纸是我国古代四大发明之一,它有效地推动了人类文明的发展。
回收农田产生的秸秆作为造纸原料,可以减少焚烧秸秆带来的环境污染。
秸秆的主要成分是纤维素[(C6H1005)n],纤维素中C、H、O三种元素的质量比为______(用最简整数比表示)。
2.一个青少年正常情况下每天约需0.8g钙。
若每天从食物中得到0.6g钙,其余,由钙片补充,则每天需吃含葡萄糖酸钙[(C6H11O7)2Ca]的质量分数为85%的钙片_______g。
(保留两位小数)3.不同年龄段的群体每天钙的适宜摄入量不同,哺乳期妇女每日推荐摄入量为l200mg。
下图为某保健品说明书的一部分,请问答:钙尔奇(D)成分:复方制剂,碳酸钙1.5克∕片,维生素D3 125国际单位∕片辅料:微晶纤维素、硬脂酸、……适应症:用于妊娠和哺乳期妇女、更年期妇女、老年人等的钙补充剂。
……(1)维生素D3的化学式为C27H44O,则维生素D3分子中C,H,O的质量比是___________。
(2)每片药片含钙___________mg。
4.在硫化钠、亚硫酸钠和硫酸钠的混合物中,硫的质量分数为16%,则氧的质量分数为__ 5.明矾[KAl (SO4)m]可用作净水剂,在该物质中m的值是_______。
6.微型录音录像磁带所用的磁粉,其主要成分的化学组成为的化合物,已知其中钴(Co)的化合价为+2价,铁元素只有+2价和+3价,则x的值________。
7.1998年中国十大科技成果之一是合成纳米氮化镓。
已知镓(Ga)原子的结构示意图为,氮原子的结构示意图为,则氮化镓的化学式是()。
8.已知NH4NO3和KH2PO4固体混合物中氮元素的质量分数为28%,则混合物中KH2PO4的质量分数为()9.有一种氮的氧化物,氮和氧的质量比为7∶4,则此氮的氧化物的化学式为__________。
10.已知某种化合物R由氢、氧两种元素组成,对这种化合物进行测定可知:化合物中氢元素的质量分数为5.88%,相对分子质量为34,请通过计算写出化合物R的化学式()11.尿素是常用的一种化肥,其化学式为CO(NH2)2,根据其化学式进行计算A.尿素的相对分子质量____B.尿素中氮元素的质量分数是____C.60克尿素中含有氮元素多少克?D.多少克碳酸氢铵(NH4HCO3)中所含的氮元素与60克尿素中所含的氮元素质量相等?12.发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染。
初三化学计算题专题复习汇总

初中化学计算题专题复习(一)有关化学式计算题类型:第一种类型:标签型化学式计算题:1、在现代生活中,人们越来越注重微量元素的摄取。
碘元素对人体健康有至关重要的作用。
下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
请回答下列问题:(1)由食用方法和贮藏指南可推测碘酸钾(KIO 3)的化学性质之一是;(2)计算碘酸钾(KIO 3)中,钾元素、碘元素、氧元素的质量比;(3)计算碘酸钾(KIO 3)中,碘元素的质量分数是多少?;(计算结果精确到0.01,下同)(4)计算1kg 这样的食盐中,应加入 g碘酸钾(用最高含碘量计算)第二种类型:叙述型化学式计算题:1、蛋白质是由多种氨基酸[丙氨酸:CH 3CH(NH 2)COOH等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算:(1)丙氨酸分子中氮原子与氧原子的个数比。
(2)丙氨酸的相对分子质量。
(3)丙氨酸中碳、氢、氧、氮元素的质量比。
2、抗震救灾,众志成城。
用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C 3O 3N 3Cl 3),又称高氯精。
下列有关高氯精的说法不正确的是()A .高氯精由4种元素组成B .高氰精中C 、O 、N 、Cl 的原子个数比为1∶1∶1∶1C .高氯精中C 、N 两种元索的质量比为12∶14 D.高氯精中氯元素的质量分数为25%第三种类型:综合型化学式计算题:1、青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH 2)2]。
若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g 。
(1)30g 尿素中含氮元素多少克?(2)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克?(3)请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄人多少克下列食物才能满足你对蛋白质的需求(可以只摄取一种食物,也可同时摄取几种食物)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
焦岱初中1某工厂排岀的废液中含有AgN0 3、Zn ( NO3) 2、Cu ( NO 3) 2三种物质•为了分离并回收金属银和铜,设计了如下实验方案:(1 )反应①中与铜粉反应的物质是(2) 反应②中发生反应的化学方程式是(3) 从固体丫中得到金属铜的方法有:物理方法: •化学方法:2、向一定量NaOH溶液中,滴加稀HCI,所加盐酸的量与溶液pH的变化如图所示:⑴当加入稀HCI的体积为 ___________ m l时,稀HCI与NaOH溶液恰好完全反应;⑵向上述加了12ml稀盐酸后的NaOH溶液滴加紫色石蕊试液,溶液显_______________ 色;⑶当加入8mL稀盐酸后,溶液中的溶质有3、把12.5g的大理石放入盛有34.4g稀盐酸的烧杯中,恰好完全反应后,烧杯中物质的总质量比反应前减少了4.4g •求大理石中碳酸钙的质量分数是多少?4、为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6 %的碳酸钠溶液直至过量,有关的变化如右图所示:根据题中有关信息和图像分析回答下列问题:0 5 加瞪醴钠清港质量您(1 )原废液中的溶质成分有 _____________________________ (用化学式回答) (2) A点处溶液中溶质的质量?(通过计算回答)5、50g某稀硫酸中滴加某氯化钡溶液73.3g恰好完全反应,经过滤、洗涤、烘干得到23.3g白色沉淀•试回答:(1) _________________________________ 在过滤操作中需要的玻璃仪器有 ; (2 )反应后所得溶液中溶质的质量分数. 6、 现有氯酸钾和二氧化锰的混合物共 26.5g ,待反应不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g求:⑴制取氧气的质量;⑵剩余固体中含有的物质各为多少g ?7、 将一定质量的金属锌投入到 100g 稀硫酸中恰好完全反应,放岀气体的质量与反应时间的关系如图所示•试求:(2) 所用硫酸溶液中溶质的质量分数.8、 10g 氯酸钾与二氧化锰的混合物加热,完全反应后,质量减少 3.2g ,则原混合物中二氧化锰的质量是多少?9、 实验用2.45g 的氯酸钾和0.2g 的二氧化锰最多可制取多少克的氧气? 10、 实验室用含杂质的锌与稀盐酸反应制取氢气,取8 g 含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入74.2 g 稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82 g 。
计算:⑴杂质的质量 __________ g 。
(2)反应后所得溶液的溶质质量分数(请写岀计算过程)。
11、 实验室有一瓶久置且瓶盖破损的氢氧化钠固体,现取该固体 10g ,加入50g 一定质量分数的盐酸至完全反应后,称得剩余溶液质量为 58.9g ,求变质后生成物质的质量分数.12、 硫酸铜溶液可以作过氧化氢分解的催化剂•现取一定溶质质量分数的过氧化氢溶液 68g 倒入锥形瓶中,向其中 加入11.6g 硫酸铜溶液,使过氧化氢完全分解,得到78g 硫酸铜溶液.(1 )完全反应后生成 H 2的质量为___ g ;求:(1)产生氧气的质量.(2 )所用过氧化氢溶液的溶质质量分数.13、向盛有26.4g 硫酸钠和碳酸钠混合物的烧杯中加入 218g 稀硫酸,恰好完全反应,固体全部消失,烧杯内物质总质量减少了 4.4g .(化学反应方程式为 NaCO+fSQ — NmSO+fO+COf ),请计算:(1) 原混合物中碳酸钠的质量. (2 )反应后所得溶液中溶质的质量分数.14、某补钙剂说明书的部分信息如右下图所示。
现将有20片该药剂制成的粉末与 40g 盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6g 。
(1) ______________________________ 青少年缺钙出现的疾病是 。
(2) 该品牌补钙剂每片含的 CaCQ 质量为多少? (3)该盐酸中溶质的质量分数是多少?(精确到 0.1% )。
15、某纯碱样品中含 有少量氯化钠,取该样品 11g ,全部溶液在100g 水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A 点时,过滤,得到滤液 242g ,计算:(1)反应生成沉淀的质量 m 为 g .(2) 滤液中溶质的质量分数.16、 实验室常用石灰石和稀盐酸制取二氧化碳, 现取含碳酸钙80%勺石灰石12.5g 和94.4g 稀盐酸恰好完全反应(石 灰石中的杂质不溶于水,也不与稀盐酸反应)。
求: (1 )生成二氧化碳的质量;(2)恰好完全反应后所得溶液中溶质的质量分数。
17、 称取5.8g 某生铁样品放入94.6g 稀盐酸中,恰好完全反应(生铁样品中的杂质不 溶于水也不与盐酸发生反应),产生0.2g 氢气。
试计算反应后所得溶液中溶质的质量分数。
18、 某纯碱样品中含有少量氯化钠。
现称取该样品 12g ,完全溶于60g 水中,加入63. 4g 稀盐酸,恰好完全反应,最后称得烧杯中溶液的质量为131g 。
"XX"牌钙片 有效成分:CaCO 3#-S : I00gioo九年级化学计算题练习题汇总计算:(1)完全反应后生成 CO 的质量; (2)反应后所得溶液的溶质质量分数。
19、某氢氧化钙粉末中含有碳酸钙杂质•现取样品15g 于锥形瓶中并加适量水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示. (1 )生成二氧化碳的质量是 _______________ g ;(2)加入60g 稀盐酸后所得溶液中含有的溶质是 ___________________ 、 _____________ (填化学式); (3 )计算样品中碳酸钙的质量分数(写岀计算过程,结果精确到0.1%).20、某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取 30g 该溶液,向其中逐滴加入溶质质量分数为 10%勺氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO+2NaOH=NSQ+Mg( OH2J(1) _____________________________________________________________________ 配制100g 溶质质量分数为10%勺NaQH 溶液,需NaQH 的质量为 ___________________________________________________ g . (2) 计算MgSQ 溶液中溶质的质量分数(列式计算).21、某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠固体样品,进行如图所示的实验.沉淀质里/eIMOOOt渤I请根据以上信息计算(结果保留到小数点后两位):(1 )反应生成沉淀的质量为 _______________(2 )样品中氯化钠的质量.(3)滤液中溶质的质量分数.参考答案一、综合题1、【考点】金属的化学性质;书写化学方程式.【专题】金属与金属材料.【分析】根据在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能把位于其后的金属从其盐溶液中置换出来进行分析.【解答】解:(1)银的活动性排在铜之后,所以反应①中与铜粉反应的物质是硝酸银;(2 )反应②中发生的反应是硝酸铜和铁反应生成硝酸亚铁和铜,化学方程式是:Fe+Cu ( NG) 2=Fe ( NO) 2+Cu;(3)通过推导可知,固体丫中含有铁、铜,所以从固体丫中得到金属铜的方法有:用磁铁吸弓I;在混合物中加入足量的稀硫酸,然后过滤、洗涤、干燥.故答案为:(1)硝酸银;(2)Fe+Cu ( NQ) 2=Fe ( NQ) 2+Cu;(3)用磁铁吸引;在混合物中加入足量的稀硫酸,然后过滤、洗涤、干燥.【点评】本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.二、计算题2、.⑴ 10 ⑵红⑶ NaQH NaCl3、【考点】根据化学反应方程式的计算.【专题】有关化学方程式的计算.【分析】分析所发生的反应,可发现反应后总质量减轻是由于生成了气体二氧化碳, 因此,可知恰好完全反应时放岀二氧化碳的质量为 4.4g ;然后利用二氧化碳的质量,根据反应的化学方程式,分别计算恰好完全反应时碳酸钙的质 量,最后使用质量分数的计算公式,求岀石灰石中碳酸钙的质量分数即可.【解答】解:由于该反应会生成二氧化碳气体,所以反应后减小的质量即为二氧化碳的质量;设恰好完全反应时,消耗碳酸钙的质量为 x ,CaCG+2HCI —CaCL+HO+COf 1004.4g答:大理石中碳酸钙的质量分数为80%【点评】根据化学方程式进行计算时, 只能使用纯净物的质量进行计算, 而不能把混合物的质量直接代入化学方程式进行计算.4、 HCI 和 CaCI 2 1.2g5、 【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算. 【分析】(1)根据过滤操作所用仪器分析解答;(2)根据硫酸和氯化钡反应生成硫酸钡沉淀和氯化氢,利用沉淀的质量求岀生成氯化氢的质量及质量分数. 【解答】解:(1 )在过滤操作中需要的玻璃仪器有烧杯、漏斗、玻璃棒;(2 )设生成氯化氢的质量为 xBaCW+H t SO — BaSQ j +2HCI ,233 7323.3gx 44大理石中碳酸钙的质量分数:解得:x=10gSH X 100%=80%233x=7.3g反应后所得溶液的溶质质量分数X 100%=7.3% 答案:(1)烧杯、漏斗、玻璃棒;(2)反应后所得溶液的溶质质量分数为7.3%.6、( 6 分) (1) 4.4 (2) 80% (3) 10.5%【解】生成二氧化碳的质量为:100 g + 12.5 g - 108.1 g = 4.4 g ......... ( 1 分)设:样品中碳酸钙的质量为x,生成氯化钙的质量为CaCO + 2HCI = CaCI 2 + H 20 + CO21100 111x解得:x = 10 g y = 11.1 g(2)样品中碳酸钙的质量分数为:(3)烧杯中溶液质量为108.1g-(12.5g-10g)=105.6g 44y 4.4 g 10 g /12.5 g =80% ......... (3分).... (2 分)所得溶液的溶质质量分数为:11.1 g /105.6g = 10.5% 答:略7、【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算.【专题】综合计算(图像型、表格型、情景型计算题).【分析】根据图中数据可以判断生成氢气的质量;根据氢气的质量可以计算稀硫酸中硫酸的质量,进一步可以计算所用硫酸溶液中溶质的质量分数. 【解答】解:(1)由图中可知,完全反应后生成H2的质量为0.4g .故填:0.4 .(2)设所用硫酸溶液中溶质的质量为Zn+H2SQ—Zn SO+Hd,98 2x 0.4gx=19.6g ,12 6 g所用硫酸溶液中溶质的质量分数为:W 弓X 100%=19.6%,答:所用硫酸溶液中溶质的质量分数为19.6% .【点评】本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.8、【考点】根据化学反应方程式的计算.【专题】有关化学方程式的计算.【分析】根据质量守恒定律,由反应前后固体减少的质量为反应放岀氧气的质量;再利用产生氧气的质量计算参加反应的氯酸钾的质量,混合物质量与氯酸钾质量差即为二氧化锰的质量.【解答】解:根据质量守恒定律,反应放岀氧气的质量为 3.2g设氯酸钾的质量为xMn032KCIQ3 △2KCI+3Q2 f245 96x 3.2g245 二96x3.2?x=8.17g原混合物中二氧化锰的质量=10g - 8.17g=1.83g答:原混合物中二氧化锰的质量是 1.83g .【点评】由于二氧化锰在反应中为催化剂,反应前后质量不变,本题也可以由氧气质量计算反应生成氯化钾的质量, 而由反应后固体求岀二氧化锰的质量.9、【考点】根据化学反应方程式的计算.【专题】有关化学方程式的计算.【分析】根据化学方程式计算所要计算的物质的量即可,注意0.2g的二氧化锰与计算无关•注意过程的完整性【解答】解:用2.45g氯酸钾最多可制取(指完全反应)氧气的质量设为x.2KCIO3 ■2KCI+3O2 f245962.45g x245Z45呂96=Xx=0.96g答:2.45g氯酸钾最多可得到0.96g氧气.【点评】根据方程式计算反应物或者生成物的质量时,一要注意方程式必须要正确, 免无效其次过程中数据使用要正确, 的劳动.10、解:生成Hb 的质量为:8 g + 74.2 g —82 g = 0.2 g设锌的质量为x,生成ZnSO的质量为yZn+ fSQ===Z nSQ+ Hb f65 161 2x y 0.2 g65 : 2 = x : 0.2 g x = 6.5 g杂质的质量二8 g — 6.5 g = 1.5 g161 : 2= y : 0.2 g y = 16.1 g16上反应后溶液的溶质质量分数= 「匕x 100%= 20%答:(1)杂质的质量为1.5 g ; (2)反应后所得溶液的溶质质量分数为20%。
