MSC组织再生功能检测资料
msc基因功能 -回复

msc基因功能-回复MSC(Multipotent Stromal Cells)是一种广泛存在于人体组织中的多能干细胞,具有多种重要的生物学功能。
它们可以自我更新并分化为多种细胞类型,如骨细胞、脂肪细胞和软骨细胞等,因此在组织再生和修复中起到重要的作用。
此外,MSC还具有免疫调节能力以及促进血管生成和抗炎作用等重要功能。
本文将详细介绍MSC的基因功能,并逐步回答相关问题。
第一部分:MSC的基因特征1. MSC的来源及鉴定方法MSC主要存在于骨髓、脐带血和脂肪组织中,而骨髓MSC是最常用的来源。
它们可以通过一系列细胞表面标记物的检测来鉴定,如CD73、CD90、CD105阳性,同时CD34、CD45和HLA-DR阴性。
2. MSC的基因表达特征MSC具有一系列与干细胞相关的基因表达特征。
通过转录组学研究,发现MSC高度表达干细胞相关因子,如OCT4、NANOG和SOX2等。
此外,MSC还表达多能干细胞标记物,如OCT4A、Rex1和Nucleostemin 等。
第二部分:MSC的自我更新和分化功能1. MSC的自我更新能力MSC具有高度自我更新的能力,可以不断分裂并产生大量的干细胞后代。
这种能力与MSC维持在骨髓内的数量和功能有关。
2. MSC的多向分化潜能MSC可以分化为多种细胞类型,如骨细胞、脂肪细胞和软骨细胞等。
这种多向分化潜能使得MSC在骨骼系统、皮肤组织等多种组织再生和修复中发挥重要作用。
第三部分:MSC的免疫调节功能1. MSC的免疫抑制作用MSC能够抑制多种免疫细胞的活化和增殖,如T细胞、B细胞、自然杀伤细胞等。
这种免疫抑制作用可用于治疗自身免疫性疾病和移植排斥反应等。
2. MSC的免疫调节分子MSC通过分泌一系列免疫调节分子来实现免疫调节功能,如转化生长因子β(TGF-β)、干扰素γ(IFN-γ)、间充质素-1(IL-1)和可溶性HLA (sHLA)等。
第四部分:MSC的血管生成和抗炎作用1. MSC的血管生成能力MSC可以促进新血管的生成,这在组织再生和损伤修复过程中至关重要。
msc干细胞代数

msc干细胞代数
一、干细胞概述
干细胞是一类具有自我更新和分化潜能的细胞,被誉为生命的种子。
它们存在于各种组织中,如骨髓、脂肪和脐带血等。
干细胞研究是现代生物医学领域的重要方向,为疾病治疗、组织再生和生物学基础研究提供了新的可能。
二、MSC干细胞的特点
MSC(Mesenchymal Stem Cells,间充质干细胞)是干细胞家族中的一员,具有以下特点:
1.广泛来源:MSC可以从多种组织中分离获得,如骨髓、脂肪、脐带血等。
2.自我更新能力:MSC具有稳定的自我更新能力,可不断分化为多种细胞类型。
3.多向分化潜能:MSC可以分化为多种组织细胞,如成骨细胞、软骨细胞、脂肪细胞等。
4.低免疫原性:MSC具有较低的免疫原性,移植时不易引发免疫排斥反应。
三、干细胞的应用领域
1.疾病治疗:干细胞疗法为许多难治性疾病提供了新的治疗手段,如心肌梗死、肝硬化、神经系统疾病等。
2.组织再生:干细胞在组织工程中具有广泛应用,如修复损伤的皮肤、血管、骨骼等。
3.再生医学:通过干细胞疗法,有望实现器官移植无需依赖供体,缓解器官短缺问题。
四、干细胞研究的挑战与展望
1.干细胞分离和培养:目前,干细胞的分离和培养技术尚不成熟,导致干细胞数量和质量受限。
2.安全性和有效性:干细胞疗法的安全性和有效性仍需大量研究证实。
3.伦理问题:干细胞研究涉及到伦理道德问题,如胚胎干细胞来源于堕胎胎儿等。
4.法规政策:各国对干细胞研究的法规政策不同,制约了干细胞研究的进展。
总之,MSC干细胞具有广泛的应用前景,但目前仍面临诸多挑战。
国际干细胞学会msc定义共识

国际干细胞学会msc定义共识国际干细胞学会(International Society for Cellular Therapy,简称ISCT)发布了一项关于间充质干细胞(mesenchymal stromal cells,MSC)的定义共识。
MSC是一类具有自我更新、多向分化和免疫调节能力的成体干细胞,被广泛应用于再生医学和免疫治疗等领域。
在这个定义共识中,ISCT提出了三个关键特征,用于界定MSC。
首先,MSC必须能够附着在塑料培养皿上,并形成纤维样结构。
其次,MSC必须具备特定的表面标记,包括CD105、CD73和CD90阳性,同时CD45、CD34、CD14或CD11b、CD79a或CD19以及HLA-DR阴性。
最后,MSC必须能够在体外条件下分化为成骨细胞、软骨细胞和脂肪细胞。
根据ISCT的定义共识,MSC是一种成体干细胞,主要存在于人体的骨髓、脂肪组织、胎盘和其他组织中。
这些细胞具有良好的增殖能力和多向分化潜能,可以分化为多种不同的细胞类型,如骨细胞、软骨细胞和脂肪细胞。
此外,MSC还具有免疫调节功能,可以调节免疫反应、抑制炎症反应,并促进组织修复和再生。
由于MSC具有广泛的应用前景,越来越多的研究和临床试验正在探索其在再生医学和免疫治疗中的应用。
例如,MSC可以用于治疗骨关节疾病和组织损伤,如骨折、软骨损伤和脊髓损伤。
此外,MSC还可以用于治疗自身免疫性疾病和移植排斥反应,如类风湿关节炎、系统性红斑狼疮和移植物抗宿主病(graft-versus-host disease,GVHD)等。
然而,尽管MSC具有潜在的治疗效果,但其机制尚不完全清楚。
目前,研究人员认为,MSC通过多种途径发挥其作用。
首先,MSC可以分泌多种细胞因子和生长因子,如表皮生长因子、血管内皮生长因子和基质金属蛋白酶等,促进组织修复和再生。
其次,MSC可以调节免疫反应,通过抑制炎症因子的产生和调节免疫细胞的功能,减轻炎症反应和免疫损伤。
间充质干细胞膜 纳米材料

间充质干细胞(MSC)是一种多能干细胞,具有自我更新和分化为多种细胞类型的能力。
它们可以从各种组织中分离出来,如骨髓、脂肪和脐带等。
MSC 在组织修复和再生方面具有巨大的潜力,因为它们可以迁移到受损组织并分化为所需的细胞类型。
纳米材料是指尺寸在 1 至 100 纳米之间的材料。
这些材料具有独特的物理、化学和生物学性质,使其在生物医学领域中具有广泛的应用前景。
例如,纳米材料可以用于药物输送、诊断和治疗等方面。
MSC 膜纳米材料是将 MSC 与纳米材料结合起来的一种新型材料。
这种材料具有 MSC 的生物学功能和纳米材料的特殊性质,可以用于组织工程、药物输送和治疗等方面。
例如,MSC 膜纳米材料可以用于修复受损的组织。
MSC 可以分化为所需的细胞类型,如成骨细胞、软骨细胞和脂肪细胞等,从而促进组织修复。
同时,纳米材料可以提供支架和信号分子,促进细胞的生长和分化。
此外,MSC 膜纳米材料还可以用于药物输送。
纳米材料可以作为药物的载体,将药物输送到特定的细胞或组织中。
MSC 可以通过其归巢能力将药物输送到受损组织中,从而提高药物的治疗效果。
总之,MSC 膜纳米材料是一种新型的生物材料,具有广阔的应用前景。
它可以用于组织工程、药物输送和治疗等方面,为生物医学领域带来新的机遇。
msc干细胞代数

MSC干细胞代数引言干细胞是一类具有自我更新和分化能力的细胞,可以分化为多种不同类型的细胞。
其中,骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一类来源广泛且具有广泛应用前景的干细胞。
MSCs可以从多种组织来源获取,例如骨髓、脂肪组织、胎盘等,其具有多能性和免疫调节功能,已被广泛应用于再生医学和临床治疗。
MSC干细胞的特性自我更新能力MSCs具有自我更新能力,可以不断分裂产生新的MSCs,从而维持其数量。
这种自我更新能力使得MSCs能够长期存在于体内,为组织修复和再生提供持续的细胞来源。
多向分化潜能MSCs具有多向分化潜能,可以分化为多种不同类型的细胞,包括成骨细胞、软骨细胞、脂肪细胞等。
这种多向分化潜能使得MSCs在组织工程和再生医学中具有广泛的应用前景。
免疫调节功能MSCs具有免疫调节功能,可以抑制免疫反应和炎症反应。
这种免疫调节功能使得MSCs在治疗自身免疫性疾病和移植排斥反应等方面具有重要作用。
MSC干细胞的应用领域组织工程MSCs在组织工程中具有重要作用。
通过将MSCs与生物材料结合,可以构建出具有骨、软骨、脂肪等特性的组织工程构建物。
这些构建物可以用于修复和再生受损组织,如骨折、软骨损伤等,为患者提供更好的治疗效果。
再生医学MSCs在再生医学中也有广泛的应用。
通过将MSCs注射到受损组织或器官中,可以促进组织的修复和再生。
例如,在心脏病治疗中,将MSCs注射到心肌组织中可以促进心肌再生,改善心脏功能。
免疫治疗由于MSCs具有免疫调节功能,因此在免疫治疗中也有重要应用。
MSCs可以用于治疗自身免疫性疾病,如类风湿性关节炎、系统性红斑狼疮等。
此外,MSCs还可以用于治疗移植排斥反应,提高移植器官的存活率。
MSC干细胞的研究进展MSC干细胞的分离和培养目前,MSCs的分离和培养方法已经相对成熟。
通过骨髓抽取、脂肪组织抽取等方法,可以获得MSCs的原始细胞。
随后,通过培养和筛选,可以得到纯度较高的MSCs细胞群。
msc cd44指标

MSC CD44指标1. 概述CD44是一种细胞表面分子,属于整合素超家族。
它在多种细胞类型中广泛表达,并且在许多生物学过程中发挥重要作用。
MSC(间充质干细胞)是一类具有自我更新能力和多向分化潜能的成体干细胞,也被称为骨髓间质干细胞。
近年来,研究人员发现CD44在MSC中的表达与其功能密切相关,因此MSC CD44指标成为评估MSC质量和功能的重要指标。
2. MSC CD44的结构和功能CD44是一种跨膜糖蛋白,由一个细胞外结构域、一个跨膜结构域和一个细胞内结构域组成。
其细胞外结构域含有多个糖基化位点,可以与适配蛋白(如适配素、透明质酸等)相互作用,从而参与细胞-基质相互作用、信号传导、细胞黏附、迁移和增殖等生物学过程。
在MSC中,CD44主要通过与透明质酸(Hyaluronan)相互作用,调节细胞与基质之间的相互作用和信号传导。
透明质酸是一种常见的基质分子,在MSC的外周和骨髓间质中广泛存在。
CD44通过结合透明质酸,可以参与细胞迁移、干细胞自我更新、增殖和分化等过程。
此外,CD44还能够与其他信号通路蛋白相互作用,如Wnt、TGF-β、EGFR等,进一步调节MSC的功能。
3. MSC CD44在疾病中的作用近年来的研究表明,MSC CD44在多种疾病中发挥重要作用。
以下是几个示例:3.1 癌症CD44在肿瘤干细胞中高度表达,并被认为是肿瘤干细胞标记物之一。
肿瘤干细胞具有自我更新和多向分化潜能,是肿瘤发展和转移的关键驱动力。
CD44通过与透明质酸结合,在癌细胞迁移、侵袭和转移过程中发挥重要作用。
因此,MSC CD44指标可以作为评估肿瘤干细胞特性和预测肿瘤发展的重要指标。
3.2 免疫系统疾病CD44在免疫系统中广泛表达,并参与调节免疫细胞的活化、增殖和迁移。
在自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮等)中,CD44的异常表达与免疫细胞功能紊乱密切相关。
因此,MSC CD44指标可以用于评估MSC在治疗自身免疫性疾病中的潜力和效果。
MSC功能和应用

• 化疗药物(环磷酰胺)损伤大鼠卵巢,导致大鼠卵巢功能受损(卵巢滤 泡变小),给予腹腔注射间充质干细胞后,通过旁分泌机制,分泌的细 胞生长因子(VEGF、IGF-1、HGF)直接修复损伤的卵巢组织,使得 损伤的卵巢功能得到恢复。
• 间充质干细胞也能阻断化疗药物(白消安)对雄性大鼠精子发生功能的 损伤,有效地恢复雄性大鼠的生育功能。
03
肿瘤常规治疗“三足鼎立”
放疗
化疗 手术
• 常见的毒副作用:
• 1.骨髓抑制:骨髓中血细胞前体活性下降,血流里的红细胞和白细 胞都源于骨髓中的干细胞,血液中红细胞寿命短,需要不断补充, 放化疗都是针对快速分裂的细胞,因而常常导致正常骨髓细胞受损, 造成骨髓抑制。
• 2.口腔、肠道溃疡:化疗药物对口腔黏膜上皮细胞具有直接损伤作 用,化疗后骨髓造血功能受抑制,破坏口腔黏膜组织更新,中性粒 细胞减少,引起口腔黏膜损坏。
Thank You
放映结束 感谢各位的批评指导!
谢 谢!
让我们共同进步
给大鼠腹腔放射性照射(放疗)后,大鼠出现腹泻、血便、肠粘连、肠溃 疡和疤痕组织增生、肠黏膜的绒毛组织收到严重破坏而不能自我恢复;但 是,给予间充质干细胞治疗后,肠绒毛组织修复良好、溃疡愈合,而且不 出现肠粘连,大鼠的存活率明显提高。注射的间充质干细胞也能迁移到照 射部位,促进放射性照射导致的皮肤烧灼伤的愈合。
应用
心梗、中风等各种炎症 GVHD、类风湿性关节炎、 自身免疫性肝炎、移植排斥 各种炎症 移植排斥
02
临床研究: 对可能有效的治疗方法的安全性及有效性作出评价。(未用 于人体) 临床应用: 指任何在人体(病人或健康志愿者)进行药物的系统性研究, 以证实或揭示试验药物的作用、不良反应及/或试验药物的 吸收、分布、代谢和排泄,目的是确定试验药物的疗效与安 全性。临床试验一般分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期临床试验。(试 验对象是病人)
MSC检定规程模板药典

委托检查检查项目和规程检品名称:委托单位名称(公章):委托单位地址:联系人和联系电话:日期:第5代细胞1 鉴别实验1.1 细胞形态检定原则:在倒置显微镜下观测,细胞应贴壁生长,呈长梭形。
1.2 STR图谱鉴别检定原则:应体现人旳16个等位基因,为单一细胞来源。
1.3流式细胞仪检测细胞表面标记物按照BD公司旳人间充质干细胞分析试剂盒(BD货号562245)阐明进行。
检定原则:CD73、CD90、CD105≥95%;CD11b、CD19、CD34、CD45、HLA-DR≤2%。
1.4种属间细胞污染检查(PCR法)检定原则:应为人源细胞,无种属间交叉污染。
1.5染色体核型分析检定原则:参照正常中国人体细胞旳G显带带型原则,染色体数量应为46 XX或者46 XY,染色体构造应无缺失、反复、倒位、易位。
2 细菌、真菌检查取细胞培养上清液样品, 参照《中华人民共和国药典》无菌检查法(通则1101)进行检查,应为阴性。
3 分支杆菌检查取至少107个活细胞样品用培养上清制备细胞裂解物, 参照《中华人民共和国药典》无菌检查法(通则1101)进行检查,应为阴性。
4 支原体检查4.1培养法取细胞培养上清液样品, 参照《中华人民共和国药典》(通则3301)进行检查,应为阴性。
4.2 DNA荧光染色取细胞培养上清液样品, 参照《中华人民共和国药典》(通则3301)进行检查,应为阴性。
5细胞内、外病毒因子检查5.1细胞形态观测及血吸附实验细胞接种于细胞培养瓶中,参照《中华人民共和国药典》第三部生物制品生产检定用动物细胞基质制备及检定规程进行,细胞持续培养2周逐日镜检,细胞形态正常,无病变,血吸附实验阴性。
5.2体外不同批示细胞接种培养法检测病毒因子细胞接种于细胞培养瓶中,按照体外不同批示细胞接种培养法(中国药典三部生物制品生产检定用动物细胞基质制备及检定规程)进行。
细胞形态正常,血吸附实验阴性,血凝实验阴性。
5.3动物体内接种法5.3.1乳鼠脑内及腹腔接种取细胞悬液注射于出生24小时内旳乳鼠腹腔和脑内,按照中国药典三部生物制品生产检定用动物细胞基质制备及检定规程中规定,21天后乳鼠应至少有80%健存。
MSC
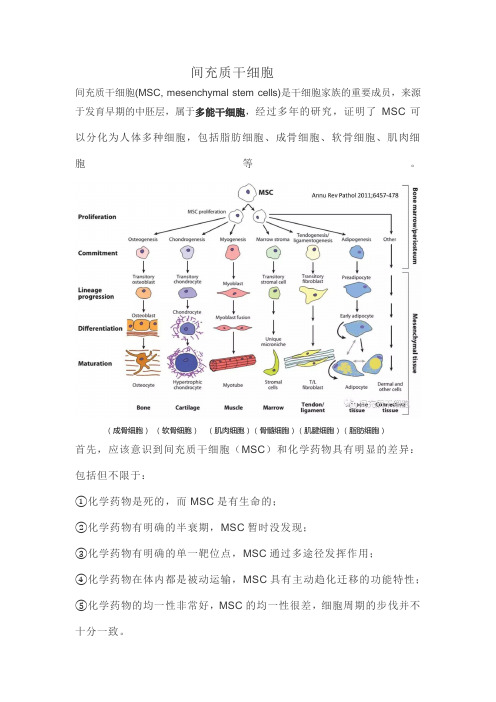
间充质干细胞间充质干细胞(MSC, mesenchymal stem cells)是干细胞家族的重要成员,来源于发育早期的中胚层,属于多能干细胞,经过多年的研究,证明了MSC可以分化为人体多种细胞,包括脂肪细胞、成骨细胞、软骨细胞、肌肉细胞等。
(成骨细胞)(软骨细胞)(肌肉细胞)(骨髓细胞)(肌腱细胞)(脂肪细胞)首先,应该意识到间充质干细胞(MSC)和化学药物具有明显的差异:包括但不限于:①化学药物是死的,而MSC是有生命的;②化学药物有明确的半衰期,MSC暂时没发现;③化学药物有明确的单一靶位点,MSC通过多途径发挥作用;④化学药物在体内都是被动运输,MSC具有主动趋化迁移的功能特性;⑤化学药物的均一性非常好,MSC的均一性很差,细胞周期的步伐并不十分一致。
其次MSC至少具有两个重要的功能:免疫抑制和组织修复(1)MSC免疫抑制功能是非特异性的,能跨种属发挥抑制功效,比如人MSC能抑制大小鼠的T淋巴细胞的增殖活化。
(2)MSC组织修复机制总结起来有下面几条:①分化为成熟的组织器官细胞,代替受伤的细胞;②通过和细胞融合,拯救受伤的细胞;③分泌细胞因子促进组织器官的干祖细胞增殖;④通过特殊的纳米隧道管(tunneling nanotubes,TNTs),向受伤的细胞输送线粒体和其他物质;⑤分泌外泌体或微小囊泡,通过膜融合进入受伤的细胞胞内。
大量的研究显示MSC分泌多种营养性因子或生长因子,通过旁分泌作用促进多种细胞的存活。
常见的分泌因子见下图。
1、免疫调节因子:HGF:肝细胞生长因子,TGF-β1:转化生长因子PGE2:前列腺素E2,IDO:(吲哚胺2,3双加氧酶)是一种免疫调节酶2、趋化因子:RANTES:趋化细胞因子,具有诱导附近反应细胞定向趋化的能力.SDF-1α:基质细胞衍生因子MIP-1α:趋化因子的一种MCP-1:人单核细胞趋化因子3、营养因子:HGF:肝细胞生长因子NGF:神经生长因子FGF-2:成纤维细胞生长因子PDGF-AA:血小板衍生生长因子-AAPDGF-BB:血小板衍生生长因子- BB EGF:表皮细胞生长因子4、血管再生因子:VEGF165:血管内皮生长因子FGF-2:成纤维细胞生长因子EGF:表皮细胞生长因子PDGF:血小板衍生生长因子5、抑制疤痕因子:HGF:肝细胞生长因子FGF-2:成纤维细胞生长因子6、抗凋亡因子:VEGF165:血管内皮生长因子FGF-2:成纤维细胞生长因子HGF:肝细胞生长因子脐带间充质干细胞和骨髓间充质的区别?骨髓间充质:1.随着年龄的老化,干细胞数目显著降低、增殖分化能力大幅度衰退;2.制备过程不容易质控;3.移植给异体可能引起免疫反应;4.取材时对患者有损伤,患者有骨髓疾病时不能采集,即使是健康供者,亦不能抽取太多的骨髓。
MSC体内外促组织修复试验方法

MSC的组织修复作用在机体组织损伤修复过程中,MSC是一种重要的参与组织再生的细胞。
在组织损伤引起的特殊信号作用下,MSC 迁徙至损伤部位,在局部增殖,并依据不同的损伤信息而沿着不同的途径分化。
MSC 易于分离培养,体外增殖能力旺盛,因此,MSC 是一种实用的组织修复种子细胞。
目前关于MSC的组织再生功能有两种理论:其一,将体外扩增的M5C 移植到组织损伤部位,在局部微环境作用下,定向分化为某一特定类型功能细胞,直接参与组织损伤修复过程; 其二,移植于损伤部位的细胞,分泌多种生物活性物质,包括细胞趋化、生长、营养因子等,以改善组织损伤部位再生微循环,促进宿主组织中残存的干/祖细胞增殖分化,MSC间接参与了组织修复过程。
MSC 改善组织再生微环境,表现为细胞所分泌的生物活性物质具备的多种功能,包括: (1)趋化周阔的宿主干/祖细胞迁徙至损伤那位; (2)促进干/祖细胞的增殖分化; (3)抑制受损伤功能细胞的凋亡; (4)促进毛细血管新生;(5)激活周围细胞金属硫蛋白酶活性,抑制瘢痕形成; (6)调节免疫细胞功能,抑制炎性反应。
目前,关于MSC组织再生功能的检测还没有一个明确的标准。
在体外检测中,只能通过检测MSC分化为受损组织细胞的能力和MSC分泌修复组织损伤有关细胞因子、抗炎因子、营养因子等来鉴定MSC的组织再生功能,这是判定MSC组织再生功能的基础,但是这样的评判也存在很大缺陷的,MSC在体外的培养环境和在体内微环境中存在很大差别,微环境下细胞之间的接触作用,损伤细胞释放的因子对MSC的刺激作用和趋化作用等可能都对MSC分泌的细胞因子种类和剂量有影响。
因此,通过在各种适应症模型治疗时,对MSC在微环境中的组织再生功能的相关指标进行检测是必要的。
体外试验:一、检测MSC分化为受损组织细胞的能力:体外诱导MSC分化为骨细胞、软骨细胞、脂肪细胞、胰岛β细胞、神经细胞、肝细胞、心肌细胞、血管内皮细胞、肌肉细胞、脊髓基质细胞等。
体内模型MSC组织再生功能检测指标

MSC的组织修复作用已有实验证实,尽管MSC可以归巢到心肌梗死、肾脏损伤部位,但外源的MSC在梗死部位存活率很低甚至不存在。
很可能是因为局部微环境条件苛刻,MSC生长需要的条件不足,如炎症,氧压,细胞毒性,胞外基质缺乏等。
在肾脏损伤中,外源的MSC移植后再受损肾脏部位的数量和比例几乎是微不足道的,但是肾脏的保护作用和功能恢复作用及动物的存活率是显著的,因此外源MSC分化为受损细胞并代替原来的细胞的推测还需要几乎被否定,MSC 的旁分泌机制很可能是MSC治疗效果的关键机制。
MSC的旁分泌机制是通过MSC分泌细胞保护蛋白组和组织修复作用来促进血管新生、抗炎、抗纤维化作用,组织修复作用包括抗凋亡和促有丝分裂作用。
此外MSC分泌的细胞小体对受损组织修复有重要作用。
MSC组织修复机制促血管生成因子:MSC分泌的 HGF(肝细胞生长因子)↑、VEGF(血管内皮生长因子)↑、TGF-1(转化生长因子)↑、bFGF(成纤维细胞生长因子)↑、PDGF(血小板衍生因子)↑、内皮素(endothelin)↑、表皮调节蛋白(epiregulin)↑等。
抗炎性作用:MSC分泌的抗炎性因子有IL-10↑、bFGF↑、TGF-α↑、Bcl-2↑,MSC的抗炎性作用还表现在抑制T细胞、NK细胞、B细胞的增殖和抑制中性粒细胞产生H2O2。
抗纤维化作用:纤维化逆转作用:组织金属蛋白酶抑制剂(TIMP-1)↓、TGF-β↓的表达MSC移植后,心肌梗塞大鼠心脏的1型和3型胶原表达显著降低,组织金属蛋白酶抑制剂(TIMP-1)、TGF-β表达显著降低。
促细胞分裂增殖的因子:HGF(肝细胞生长因子)↑、IGF-1(胰岛素样生长因子)↑、EGF(上皮细胞生长因子)↑、bFGF(成纤维细胞生长因子)↑、PDGF(血小板衍生因子)↑,AKT1是一种蛋白激酶,在细胞生存、增殖和代谢活动中发挥重要作用。
抗细胞凋亡作用:MSC分泌的VEGF↑、IGF-1↑、SDF-1α↑具有抗细胞凋亡的作用。
uc-msc鉴定标准。

uc-msc鉴定标准。
UC-MSC鉴定标准是一项对乌克兰胎盘间充质干细胞(umbilical cord-derived mesenchymal stem cells,简称UC-MSC)进行鉴定的方法和标准。
UC-MSC是从新鲜胎盘中提取的一种多潜能干细胞,具有广泛的应用前景,可用于再生医学和治疗各种疾病。
UC-MSC的鉴定标准主要包括以下几个方面:1.细胞来源:鉴定UC-MSC时首先要明确其来源,即胎盘间充质。
乌克兰的UC-MSC通常是从新鲜的胎盘中提取的,因此需要确保UC-MSC 的来源可追溯,并且胎盘的获取符合法律和伦理的要求。
2.表型特征:UC-MSC的鉴定还需要对其表型特征进行评估。
一般应包括细胞形态、表面标记物的表达、增殖能力、分化潜能等方面的特征。
例如,UC-MSC常表达CD73、CD90、CD105等表面标记物,同时不表达CD34、CD45等造血和免疫细胞的特异性标记物。
3.免疫调节能力:UC-MSC具有重要的免疫调节作用,能够通过分泌细胞因子调节免疫细胞的活性。
因此,鉴定UC-MSC时还需要评估其免疫调节能力,包括抑制T细胞激活和增殖、调节巨噬细胞、NK细胞等免疫细胞的活性等。
4.功能鉴定:UC-MSC也具有多潜能的分化能力,可以分化成多种细胞类型,如成骨细胞、软骨细胞、脂肪细胞等。
因此,鉴定UC-MSC 时还需要评估其多向分化潜能,并且对分化的特征进行鉴定。
以上是UC-MSC鉴定标准的主要内容。
通过对UC-MSC的鉴定,可以确保提取的细胞符合质量要求,并且满足临床应用的需要。
乌克兰的UC-MSC鉴定标准是保证其质量和安全性的重要保障,也为其在再生医学领域的应用提供了有力的支持。
MSC功能及应用

•
化疗药物(环磷酰胺)损伤大鼠卵巢,导致大鼠卵巢功能受损(卵巢滤
泡变小),给予腹腔注射间充质干细胞后,通过旁分泌机制,分泌的细 胞生长因子(VEGF、IGF-1、HGF)直接修复损伤的卵巢组织,使得
损伤的卵巢功能得到恢复。
•
间充质干细胞也能阻断化疗药物(白消安)对雄性大鼠精子发生功能的 损伤,有效地恢复雄性大鼠的生育功能。
•
2.口腔、肠道溃疡:化疗药物对口腔黏膜上皮细胞具有直接损伤作 用,化疗后骨髓造血功能受抑制,破坏口腔黏膜组织更新,中性粒 细胞减少,引起口腔黏膜损坏。
自我增殖 多向分化 潜能
低免疫原性 分泌 无MHC限制 众多细胞因子 性
免疫调节 损伤修复
损伤趋化作 用“归巢” 功能
由于间充质干细胞分泌多种营养因子及G-CSF、M-CSF、GM-CSF,体外 实验证明间充质干细胞能促进造血干细胞的造血克隆形成能力;这提示间 充质干细胞治疗能提高患者的骨髓造血能力。动物实验更是直接证明间充 质干细胞能够恢复受损后的骨髓基质功能,促进骨髓损伤后的造血恢复。 给大鼠腹腔放射性照射(放疗)后,大鼠出现腹泻、血便、肠粘连、肠溃 疡和疤痕组织增生、肠黏膜的绒毛组织收到严重破坏而不能自我恢复;但 是,给予间充质干细胞治疗后,肠绒毛组织修复良好、溃疡愈合,而且不 出现肠粘连,大鼠的存活率明显提高。注射的间充质干细胞也能迁移到照 射部位,促进放射性照射导致的皮肤烧灼伤的愈合。
移植物抗宿主病
•移植物抗宿主反应是一种特异的免疫现象,发生在移植手术后,是由于移
植物组织中的免疫细胞通过第六号染色体HLA抗原识别出“非我“,对受 者发动攻击的反应,其中皮肤、肝及肠道是主要的靶目标。
•GVHD的发生却大大降低了移植的成功率,GVHD是引起异基因HSCT后
一种pbmc和msc共培养的方法及其应用

一种pbmc和msc共培养的方法及其应用1. 引言PBMC(外周血单个核细胞)和MSC(间充质干细胞)是目前研究较为广泛的细胞类型之一。
PBMC是体内免疫系统的主要组成部分,具有免疫调节和抗肿瘤等功能;而MSC则具有自我更新、多向分化和免疫调节等特性。
PBMC和MSC共培养能够发挥两者的协同效应,有望在疾病治疗和再生医学领域发挥重要作用。
2. 共培养方法(1)PBMC和MSC分离:从人体外周血中分离PBMC和从骨髓、脂肪组织等源头分离MSC,并进行细胞计数和鉴定。
(2)细胞培养:将PBMC和MSC分别培养至适当的浓度和状态,如PBMC可采用RPMI-1640培养基,MSC可采用DMEM/F12培养基,并添加适当的生长因子和补充物。
(3)共培养体系建立:将PBMC和MSC以一定比例混合,常用比例为1:1或2:1,将混合细胞悬液转移到共培养培养基中。
(4)培养条件调节:调整培养条件如温度、湿度、CO2浓度等,提供适宜的生长环境。
(5)共培养时间:根据具体实验设计,共培养时间可在数小时至数天不等。
(6)细胞采集:根据实验需要,采集共培养体系中的细胞,如细胞上清液、细胞沉淀等。
3. 共培养方法的应用(1)免疫治疗:PBMC和MSC共培养后,PBMC的活性和功能会得到调节和改善。
共培养体系中的MSC具有免疫抑制作用,可抑制PBMC 的过度激活和炎症反应,从而在免疫治疗中发挥作用。
例如,在移植物抗宿主病(GVHD)的治疗中,共培养的PBMC和MSC可通过调节免疫应答,减轻移植物对宿主组织的攻击。
(2)组织再生:PBMC和MSC共培养后,MSC的多向分化能力可以促进组织再生和修复。
共培养体系中的MSC可分化为成骨细胞、软骨细胞等,同时PBMC中的细胞因子也能促进MSC的分化和增殖。
这一方法在骨折修复、软骨修复等领域具有潜在应用前景。
(3)肿瘤治疗:PBMC和MSC共培养后,MSC的免疫调节能力可增强PBMC对肿瘤细胞的攻击。
间充质干细胞(MSCs)的分离方法研究

间充质干细胞(MSCs)的分离方法研究摘要:间充质干细胞(mesenchymal stem cell, MSCs)是一种来源于中胚层的成体干细胞, 具有多向分化能力,如具有向骨、软骨、脂肪、肌肉、肌腱、血管内皮细胞及神经星形胶质细胞分化的潜能。
并且MSC体外较易分离培养、扩增,细胞免疫原性低,易于转染并能长期表达外源基因等特点,故已成为组织工程、基因治疗和再生医学中的研究热点。
目前,对MSCs 的分离、纯化、培养还没有统一的方法。
MSCs的分离技术和方法主要有4种:贴壁法、流式细胞仪分离法、密度梯度离心法和免疫磁珠法。
本研究对传统的分离方法进行一些改进,联合利用密度梯度离心法和差异贴壁法,旨在体外分离培养血管MSCs ,并将其经定向分化诱导为成骨细胞、脂肪细胞和血管内皮细胞,并与骨髓MSC定向分化为血管内皮细胞进行比较,以观察血管来源MSC在血管内皮细胞分化及血管损伤修复中的优势,为临床血管病变性疾病的干细胞治疗提供更为合适的细胞来源。
关键词:间充质干细胞(MSCs),组织工程,流式细胞仪,差速贴壁培养法,定向分化,传代培养,CD13、CD29,多向分化1,资料与方法间充质干细胞(mesenchymal stem cell, MSCs)是一种来源于中胚层的成体干细胞, 具有多向分化能力,如具有向骨、软骨、脂肪、肌肉、肌腱、血管内皮细胞及神经星形胶质细胞分化的潜能。
MSC体外较易分离培养、扩增,细胞免疫原性低,易于转染并能长期表达外源基ha因等特点,故已成为组织工程、基因治疗和再生医学中的研究热点。
MSC存在于体内多种组织,人们已经从骨、脂肪、脐血及脐带等多种组织中成功分离培养出间充质干细胞,但血管组织中MSC的分离培养及功能研究未见报道。
骨髓是MSC分离培养的主要组织来源,但由于 MSCs还可以存在于人类、鸟类、啮齿类等生物的脂肪、血管等多种组织中,具有高度增殖、自我更新及组织再生和修复功能。
在体外成功分离培养血管MSC,并得到大量纯化的MSCs 是研究其分化机制、基因调控、以及在临床血管损伤修复应用等方面的前提。
间充质干细胞-2022年学习材料

MSC与基因治疗:-*趋化能力-基因改造后使其携带抗肿瘤基因并大量迁移至肿-瘤病灶。-多向分化一一基因工程 造,MSC的组织修复功能得到进一步-的提高。-*有效的基因治疗要要求:--可以通过一种载体将基因转运向靶细 ;-这种基因转移过程必须具有靶向性;-转入的基因可以在靶细胞内或靶细胞周围表达;-基因的表达产物必须有效且 达时间必须足够长;-整套系统在体内必须具有安全性。-*问题:MSc可通过免疫抑制作用而促进肿瘤生长;注射的 细-胞在体内的迁移路径在各个器官中的分布值得深入探究。
间充质-干细胞-MSC
关于间充质干细胞-01-02-03-04-基本-主-临床-安全-特征-能-应用
间充质干细胞mesenchymal stem cells,MSC-京-间充质千细胞是一种具有自我复制能力和 多向分化潜能的成体干细胞,在不同诱导条件-下可分化为软骨、骨、骨骼肌、肌腱、脂肪、-神经及肾脏实质的细胞等 间充质干细胞可以-接受移植,而它们会成长为何种类型的细胞取-决于其被注入的部位,而且免疫原性弱,是组-织工 理想的种子细胞来源。此外,间充质干-细胞易于外源基因的转染和表达,在细胞治疗-和基因治疗中也有着广泛的应用
间充质干细胞mesenchymal stem cells,MSC-泰-一目前对于骨髓间充质干细胞的研-究最 清楚,此外MSC还存在于胎盘-、羊水、脐静脉内皮下层、外周血及-肝脏、脂肪、肌肉、皮肤、脐带等多-种组织中 其中脐带来源的间充质干-细胞质量高、纯净、数量多。
骨髓间充质干细胞是存-在于骨髓腔内的多潜能干-细胞,可在体内外分化为各-种类型的细胞,如脂肪细-胞、骨细胞 神经细胞,-也有人将其诱导分化为胰-岛素分泌细胞等。可为临-床组织工程中软骨组织的-损伤修复、神经系统的损 伤修复及糖尿病等的干细-原代骨髓间充质干细胞-胞移植治疗提供种子细胞。-形态较为均一,呈圆形、-三角形。培 5~7天细胞-后以集落方式生长,呈梭-形,有粗大突起伸出。
msc的培养方法总汇

msc的培养方法总汇MSC(主动子细胞)是一种常见的培养方法,用于研究和生产细胞系。
本文将总结MSC的培养方法,并提供一些有关培养MSC的实用技巧。
一、基本培养条件1. 培养基:常用的MSC培养基包括DMEM/F12、α-MEM和RPMI 1640等。
这些培养基通常会添加10-20%的胎牛血清(FBS)或人血清。
此外,还可以添加一些辅助因子,如L-谷氨酸、抗生素和抗真菌药物等。
2. 温度和湿度:MSC的培养通常在37℃下进行,湿度保持在95%以上。
3. CO2浓度:将CO2浓度保持在5%~10%可以提高MSC的生长速度和细胞增殖率。
4. 培养皿:培养MSC可使用培养皿、培养瓶或多孔板等。
根据需求选择合适的培养器具。
二、细胞传代1. 细胞密度:在细胞达到80%-90%的密度时,进行细胞传代。
过高的密度可能导致细胞凋亡或细胞间粘连。
2. 细胞分离:可以使用胰酶、胆酸酯酶等消化酶将MSC从培养器具上分离下来。
分离过程需要控制时间和酶的浓度,以避免损伤细胞。
3. 细胞计数:使用细胞计数仪准确计数MSC的数量,以便进行下一步的传代或实验。
4. 细胞接种:将适量的MSC接种至新的培养器具中,并添加新的培养基。
三、细胞鉴定1. 表面标记物:使用流式细胞术或免疫细胞化学染色等技术,检测MSC表面的标记物,如CD73、CD90和CD105等。
2. 三向分化:MSC具有多向分化潜能,可以分化为成骨细胞、软骨细胞和脂肪细胞。
通过特定的培养条件和染色方法,可以确定MSC 的分化潜能。
3. 基因表达:使用实时荧光定量PCR等技术,检测MSC中特定基因的表达水平,以评估其多向分化潜能和干细胞特性。
四、细胞扩增与冻存1. 细胞扩增:通过适当的培养条件和传代方法,可以扩增MSC的数量。
需注意控制细胞密度和培养时间,避免细胞过度增殖或老化。
2. 细胞冻存:将MSC冻存可用于长期保存和后续实验。
在冻存前,使用适当的细胞冻存液和冷冻容器,遵循正确的冷冻和解冻步骤。
关于msc临床应用的几点思考

关于msc临床应用的几点思考干细胞(Mesenchymal Stem Cells,MSC)作为一种具有修复和再生能力的细胞类型,在临床应用领域备受关注。
在过去的几年里,MSC的研究和应用取得了重要进展,但是也面临着一些挑战和问题。
本文将从几个方面对MSC在临床应用中的一些思考和展望进行探讨。
首先,MSC来源的选择对于其临床应用至关重要。
目前,常用的MSC来源包括骨髓、脂肪组织、胎盘等,不同来源的MSC具有不同的特点和潜能。
因此,在选择MSC来源时需要综合考虑其来源的易得性、稳定性以及治疗效果等因素,以便更好地实现临床应用的效果。
其次,MSC的培养及扩增技术也是影响其临床应用效果的关键因素。
有效的培养和扩增技术可以提高MSC的纯度和数量,从而更好地满足临床治疗的需要。
因此,在未来的研究中,需要不断探索更加高效和稳定的MSC培养及扩增技术,为临床应用提供可靠的技术支持。
另外,MSC在临床应用中的治疗效果和安全性是我们需要关注的重点。
虽然MSC具有很大的治疗潜力,但是其具体治疗效果和长期安全性仍然需要更多的研究和验证。
因此,在未来的临床实践中,需要建立更加系统和全面的评估体系,确保MSC的应用是安全有效的。
此外,MSC在不同疾病治疗中的机制研究也是我们需要关注的方向。
了解MSC在不同疾病治疗中的作用机制,可以帮助我们更好地设计和选择合适的治疗方案,提高治疗效果。
因此,未来的研究需要更多地关注MSC与各种疾病之间的相互作用,为临床应用提供更有力的科学依据。
综上所述,MSC作为一种重要的干细胞类型,在临床应用中具有广阔的前景和潜力。
但是,要实现MSC在临床上的有效应用,我们需要不断加强研究,解决其面临的挑战和问题,为患者带来更多的治疗选择和希望。
希望未来的研究能够为MSC在临床应用中的发展和应用提供更多的支持和保障。
【2055字】。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MSC组织再生功能检测在机体正常的组织损伤修复过程中,MSC是一种重要的参与组织再生的细胞库。
在组织损伤引起的特殊信号作用下,MSC 迁徙至损伤部位,在局部增殖,并依据不同的损伤信息而沿着不同的途径分化。
MSC 易于分离培养,体外增殖能力旺盛,因此,MSC 是一种实用的组织修复种子细胞。
目前关于MSC的组织再生功能有两种理论:其一,将体外扩增的M5C 移植到组织损伤部位,在局部微环境作用下,定向分化为某一特定类型功能细胞,直接参与组织损伤修复过程; 其二,移植于损伤部位的细胞,分泌多种生物活性物质,包括细胞因子和细胞生长因子等,以改善组织损伤部位再生微循环,促进宿主组织中残存的干/祖细胞增殖分化,MSC间接参与了组织修复过程。
MSC 改善组织再生微环境,表现为细胞所分泌的生物活性物质具备的多种功能,包括: (1)趋化周阔的宿主干/祖细胞迁徙至损伤那位; (2)促进干/祖细胞的增殖分化; (3)抑制受损伤细胞的凋亡; (4)促进毛细血管新生;(5)激活周围细胞金属硫蛋白酶活性,抑制瘢痕形成; (6)调节免疫细胞功能,抑制炎性反应。
目前,关于MSC组织再生功能的检测还没有一个明确的标准。
在体外检测中,只能通过检测MSC分化为受损组织细胞的能力和MSC分泌修复组织损伤有关细胞因子、抗炎因子、营养因子等来鉴定MSC的组织再生功能,这是判定MSC组织再生功能的基础,但是这样的评判也存在很大缺陷的,MSC在体外的培养环境和在体内微环境中存在很大差别,微环境下细胞之间的接触作用,损伤细胞释放的因子对MSC的刺激作用和趋化作用等可能都对MSC分泌的细胞因子种类和剂量有影响。
因此,通过在各种适应症治疗时,对MSC在微环境中的组织再生功能的相关指标进行检测是必要的。
《干细胞制剂质量控制和临床前研究指导原则(试行)》相关法规中,细胞制剂的质量检验里面对生物学效力试验的有关规定虽然没有明确规定干细胞制剂组织再生能力的标准,但规定涵盖了干细胞制剂的组织再生能力。
法规内容:生物学效力试验可通过检测干细胞分化潜能、诱导分化细胞的结构和生理功能、对免疫细胞的调节能力、分泌特定细胞因子、表达特定基因和/或蛋白等功能,判断干细胞制剂与治疗相关的生物学有效性。
对间充质干细胞,无论何种来源,应进行体外多种类型细胞(如成脂肪细胞、成软骨细胞、成骨细胞等)分化能力的检测,以判断其细胞分化的多能性(multipotency)。
对未分化的胚胎干细胞和iPS细胞,须通过体外拟胚胎体形成能力,或在SCID鼠体内形成畸胎瘤的能力,检测其细胞分化的多能性(pluripotency)。
除此以外,作为特定生物学效应试验,项目申请者应提供与其治疗适应症相关的生物学效应检验内容及结果。
我对间充质干细胞组织再生能力的理解,包括两方面:1、间充质干细胞在体外定向诱导生成组织细胞及组织的能力。
2、间充质干细胞在各种适应症中发挥的组织细胞再生或分泌组织细胞再生相关因子的能力。
第一方面间充质干细胞在体外定向诱导生成组织细胞及组织的能力,我们可以在体外进行检测,但是第二方面间充质干细胞在各种适应症中发挥的组织细胞再生或分泌组织细胞再生相关因子的能力,就需要在各种适应症动物模型中去检测,目前,我们可以通过跟踪做各种适应症的其他小组的治疗进程,与他们协作,在各种适应症治疗过程中,检测组织细胞再生的相关指标,来取得我们想要的检测结果。
目前,涉及自体或异体MSC 的临床试验项目,已经获得美国国家食品药物监督管理局批准。
这些项目包括: ( I )异体MSC 用于造血干细胞移植后移植物抗宿主病的治疗; (2)异体MSC 治疗克隆氏病; (3) 自体MSC治疗多发性硬化症; (4)MSC 治疗肝脏纤维化; (5 ) 自体MSC 用于急性脊髓损伤; (6)MSC 用于骨折后骨不连; (7)MSC治疗半月板损伤; ( 8) 心脏缺血性疾病的治疗。
上述临床试验分别接人1—3期,在国内,相关的实验及临床研究亦获得广泛开展,多家单位已经开展了自体或异体MSC 细胞治疗项目.用于包括骨修复、心肌梗死、外周血管病等多种疾病的预防或治疗研究。
目前间充质干细胞在体外定向诱导的组织细胞包括:骨细胞、软骨细胞、脂肪细胞、胰岛β细胞、神经细胞、肝细胞、心肌细胞、血管内皮细胞、肌肉细胞、脊髓基质细胞等。
中国科学院上海生命科学研究院研究员时玉舫最新研究发现,当组织损伤发生时,受损部位往往释放大量的“创伤信号”,并伴有多种炎症性细胞浸润和炎症因子分泌。
在“创伤信号”的作用下,间充质干细胞会被募集或动员至受损部位,发挥调控炎症反应和促进组织修复的作用。
组织修复相关因子:HGF、SDF1、BDNF血管形成PCR检测VEGF、PDGF间充质干细胞具有很高的可塑性、可移植性,可用作心肌、神经元等的修复,当组织损伤发生后,通过各种途径引入的间充质干细胞会定向归巢至损伤处,发挥治疗作用,有助于损伤组织修复。
但间充质干细胞参与组织修复的过程是复杂的,其作用机制主要表现在归巢至受损部位,局部微环境的定向正确分化和抑制宿主的免疫反应等。
间充质干细胞植入宿主体内进行组织修复需要明确几个问题:1、MSC如何有效的归巢至损伤部位;2、MSC在微环境作用下如何正确定向分化;3、MSC与宿主的免疫排斥反应。
损伤组织释放一系列的趋化因子(CK)损伤组织细胞表达特异性受体或配体引导MSC黏附至损伤部位血管损伤后释放SDF-1Msc表达CXCR4 CXCR1SDF-1对表达CXCR4的MSC有趋化作用抗凋亡,促血管再生作用MSC牙周组织修复外伤和炎症造成的关节软骨缺损,软骨组织工程包括种子细胞的选择、组织支架的应用及培养环境的构造。
MSC牙周组织修复不同时间点检测:1、左侧下颌骨定位荧光标记阳性MSC细胞的存在(切片DAPI染色);2、HE染色观察到牙周组织有肉芽组织生成;3、HE染色观察缺损区有无骨组织生成;4、急性炎症趋化MSC向炎症部位归巢;5、检测MSC分化为骨细胞成熟标志物OPN和I型胶原;6、MSC的旁分泌作用,营养作用、支持作用、免疫调节作用、抗瘢痕形成作用、促血管形成作用。
胰腺MSC修复坏死胰腺组织造模:处理胰腺组织,造胰腺组织坏色模型:开腹结扎胰腺组织,7-8小时后,胰尾局部组织变黑坏死,周围有炎性细胞浸润。
治疗:在胰腺未损伤部位植入胰腺DAPI标记的胰腺MSC细胞。
检测指标:观察胰腺组织外观是否趋于正常,切片胰岛细胞是否趋于正常;DAPI标记的阳性MSC在胰腺组织是否存在,数量多少;治疗组和未治疗组的动物成活率对比;骨髓MSC通过分泌TCG-β来抑制T淋巴细胞的增殖。
MSC用于心脏缺血性疾病的治疗MSC分泌的人分泌型卷曲相关蛋白2(sfrp2)是一种分泌型糖蛋白,调控细胞增殖和凋亡,在缺血性脑中风模型中起细胞保护作用。
在大鼠脑中风MSC治疗中,MSC静脉注射或移植至脑受损缺血部位,引起体内内皮细胞和星形细胞表达生长和营养因子,分泌的IGF-1和脑衍生神经营养因子(BDNF)可以明显降低大鼠长期的认知功能和动作技能的修复。
同时损伤部位检测到类胰岛素生长因子(IGF-1)、bFGF、EGF、VEGF因子表达水平均较对照组升高。
提示评价MSC治疗心脏缺血性疾病时检测如下因子:IGF-1、BDNF、bFGF、EGF、VEGF、Sfrp2等。
在小鼠心肌炎模型中,MSC移植可以减少心肌层CD68+细胞的增加和减少单核细胞趋化蛋白(MCP-1)的表达。
在损伤黑质体AD-MSC移植治疗中,黑质纹状体的功能恢复机制包括:一小部分MSC 分化为多巴胺神经细胞,另一种是通过分泌脑源性神经营养因子(BNDF)、神经胶质细胞营养因子(GDNF)和神经生长因子(NGF)来间接调整氧化应激诱导的神经炎。
在低氧环境中,MSC释放HGF和IGF-1刺激心脏祖细胞,促进心脏祖细胞(CPC)的成熟、增殖和分化。
在体外,BM-MSC分泌到培养上清(CM)中的因子促进了神经前体细胞(NPC)的增殖和胶质纤维酸性蛋白(GFAP)的表达。
在脑脊髓炎中,MSC条件培养上清中关键的治疗因子包括HGF、bFGF、BNDF和PDGF。
Akt-MSC与MSC相比,分泌跨膜蛋白2 (Sfrp2)显著升高。
Sfrp2在缺血性脑中风模型中其细胞保护作用。
在体内脑中风实验研究中,输注的MSC中仅有3%的MSC表达神经细胞表面标志物。
CM神经保护机制依赖于分泌的组织抑制剂:颗粒蛋白酶前体和金属蛋白酶-1(TIMP-1)MSC治疗潜能的机制是通过MSC分泌细胞保护蛋白组和组织修复作用来促进血管新生、抗炎、抗纤维化作用、促细胞新陈代谢作用,组织修复作用包括抗凋亡和促有丝分裂作用。
细胞保护基因Akt-1Akt-1重组基因的MSC培养上清具有促进肾小管微血管新生、抗肾小管细胞凋亡、提高肾脏功能、提高生存率的作用。
AKT/蛋白激酶 B信号作用通道调控细胞增殖和生长,参与包括细胞凋亡和葡萄糖代谢在内的细胞过程。
虽然在其他通道构成部分中也发现了激发突变的现象,而以前却不知道有激发癌症的AKT点突变。
在乳腺癌、结肠癌和卵巢癌中发现一种AKT1基因复发突变(recurring mutation,生物通编者译),这种突变AKT1基因诱导肿瘤细胞增殖,并帮助癌细胞抵抗某些治疗剂。
AKT1是一种蛋白激酶,在细胞生存、增殖和代谢活动中发挥重要作用。
有趣的是,其它调控这些网络的蛋白在肺癌、前列腺癌、结肠癌和脑癌中也有突变现象。
AKT1中的这种突变明显证实AKT1与癌症形成有关。
MSC培养上清通过调节肾脏细胞过表达Lnc2基因来抑制细胞凋亡,同时也提高了细胞生长因子的表达。
LncRNAs代表了一大类功能性RNA分子,它们在人类癌症中起着重要的作用。
MSC治疗大鼠中风试验中,一部分MSC分化为脑神经细胞,凋亡神经细胞数量减少,并伴随bFGF因子水平升高,提示bFGF与脑保护和修复有关。
在大鼠脑中风MSC治疗中,MSC静脉注射或移植至脑受损缺血部位,引起体内内皮细胞和星形细胞表达生长和营养因子,检测到类胰岛素生长因子(IGF-1)、bFGF、EGF、VEGF 因子表达水平均较对照组升高。
MSC静脉注射或移植至脑受损缺血部位,引起体内内皮细胞和星形细胞表达生长和营养因子。
分泌的IGF-1和脑衍生神经营养因子(BDNF)可以明显降低大鼠长期的认知功能和动作技能的修复。
MSC通过旁分泌作用促进创伤愈合部位血管新生。
TNF-α是一种促炎性因子。
促炎性因子包括IL-1β、IL-6、TNF-α、INF-γ、一氧化氮合酶等。
MSC移植后,在急性肾损伤大鼠模型中,检测到的抗炎性因子包括IL-10 、bFGF、TGF-α、Bcl-2等的上调,促炎性因子IL-1β、TNF-α、INF-γ、一氧化氮合酶的降低。
