【重点推荐】2019高中化学 专题1第1单元 丰富多彩的化学物质 第2课时 物质的量学案 苏教版必修1
2019-2020学年高中苏教版化学必修1课件:专题1 第一单元 丰富多彩的化学物质 第2课时

量之比为( )
A.10∶5∶4
B.5∶4∶2
C.2∶4∶5
D.1∶1∶1
答案 D
答案
解析 已知硫的摩尔质量为32 g·mol-1,SO2的摩尔质量为64 g·mol-1, SO3的摩尔质量为80 g·mol-1,根据它们的质量之比可求出它们的物质的量 之比,即
n(S)∶n(SO2)∶n(SO3)=
2.摩尔 (1)摩尔度量的对象 摩尔和米、秒、千克等一样,它们都是基本物理量的单位。摩尔度量的 对象是微观粒子,而这里的微观粒子是指构成物质的“基本单元”,这个基 本单元可以是原子、分子、离子、电子、中子、质子等单一微粒,也可以是 这些微粒的特定组合。
(2)使用摩尔时必须指明物质微粒的名称或符号或化学式的特定组合。 例如:1 mol H表示1摩尔氢原子,1 mol H2表示1摩尔氢分子,1 mol H+ 表示1摩尔氢离子。但如果说“1 mol氢”这种说法指代不明,不清楚是氢原 子、氢分子还是氢离子,因为“氢”是元素名称,不是微粒名称,也不是微 粒的符号或化学式。 特别提醒 在使用摩尔时,对于微粒的特定组合可以不限于整数,可以是分数,也 可以根据化学反应的需要将分子、原子、离子等基本单元再分割或再组合成 分数或倍数。
Байду номын сангаас2g 32 g·mol-1
∶
4g 64 g·mol-1
∶
5g 80 g·mol-1
=
1∶1∶1。
解析
本课小结
1.物质的量是一个物理量,符号为n,单位为mol。
2.使用物质的量时,必须指明粒子的种类。
3.0.012 kg C-12中所含的原子数称为阿伏加德罗常数,用NA表示,其 近似值为6.02×1023,单位为mol-1,前者常用于判断,后者常用于计算。
化学必修1专题1第一单元丰富多彩的化学物质(共15张PPT)

昨日的明天是今天。明天的昨日是今天。为什么要计较于过去呢(先别急着纠正我的错误,你确实可以在评判过去中学到许多)。但是我发现有的人过分地瞻前顾后了。为 何不想想“现在”呢?为何不及时行乐呢?如果你的回答是“不”,那么是时候该重新考虑一下了。成功的最大障碍是惧怕失败。这些句子都教育我们:不要惧怕失败。如 果你失败了他不会坐下来说:“靠,我真失败,我放弃。”并且不是一个婴儿会如此做,他们都会反反复复,一次一次地尝试。如果一条路走不通,那就走走其他途径,不 断尝试。惧怕失败仅仅是社会导致的一种品质,没有人生来害怕失败,记住这一点。宁愿做事而犯错,也不要为了不犯错而什么都不做。不一定要等到时机完全成熟才动手。 开头也许艰难,但是随着时间的流逝,你会渐渐熟悉你的事业。世上往往没有完美的时机,所以当你觉得做某事还不是时候,先做起来再说吧。喜欢追梦的人,切记不要被 梦想主宰;善于谋划的人,切记空想达不到目标;拥有实干精神的人,切记选对方向比努力做事重要。太阳不会因为你的失意,明天不再升起;月亮不会因为你的抱怨,今 晚不再降落。蒙住自己的眼睛,不等于世界就漆黑一团;蒙住别人的眼睛,不等于光明就属于自己!鱼搅不浑大海,雾压不倒高山,雷声叫不倒山岗,扇子驱不散大雾。鹿 的脖子再长,总高不过它的脑袋。人的脚指头再长,也长不过他的脚板。人的行动再快也快不过思想!以前认为水不可能倒流,那是还没有找到发明抽水机的方法;现在认 为太阳不可能从西边出来,这是还没住到太阳从西边出来的星球上。这个世界只有想不到的,没有做不到的!不是井里没有水,而是挖的不够深;不是成功来的慢,而是放 弃速度快。得到一件东西需要智慧,放弃一样东西则需要勇气!终而复始,日月是也。死而复生,四时是也。奇正相生,循环无端,涨跌相生,循环无端,涨跌相生,循环 无穷。机遇孕育着挑战,挑战中孕育着机遇,这是千古验证了的定律!种子放在水泥地板上会被晒死,种子放在水里会被淹死,种子放到肥沃的土壤里就生根发芽结果。选
苏教版高中化学必修1 专题1第1单元 丰富多彩的化学物质(第2课时) 名师公开课优质课件(18张)

【思考探究】 1.物质的量所表示的对象是什么? 提示 物质的量所表示的对象是“粒子”,指具体的微观 粒子(分子、原子、离子、质子、中子、电子以及它们的特 定组合,例如:NaCl)。
2.物质的量与摩尔的区别和联系?
提示
物质的量
摩尔
将一定数目的微观粒子与可称量 是物质的量的 区别 物质之间联系起来的物理量 单位 联系 摩尔是物质的量的单位
质 量 为 32 g· mol - 1 , B 不 正 确 ; 阿 伏 加 德 罗 常 数 约 为
6.02×1023 mol-1,D不正确。 答案 C
三、物质的量运用于化学方程式中的简单计算
以合成氨反应为例: 反应物和生成物的系数比: 物质的分子数之比 或 物质的物质的量之比 N2 +3H2 2NH3 1∶ 3 1∶ 3 ∶ 2 ∶ 2
3.阿伏加德罗常数与6.02×1023mol-1的区别和联系?
提示 阿伏加德罗常数 6.02×1023mol-1
区别
精确值
近似值
联系 阿伏加德罗常数约为6.02×1023mol-1
4.物质的量与阿伏加德罗常数的区别和联系?
提示 物质的量 阿伏加德罗常数
将一定数目的微观粒子与 12 g12C所含的原子 区别 可称量物质之间联系起来 数,单位是mol-1 的物理量,单位是mol 联系 每摩尔物质含有阿伏加德罗常数个微粒
解析 摩尔质量的单位是 g· mol-1, A 错; 不知道水的物质的量 是多少,无法求其质量, B 错;由题意知一滴水大约含有 1.7×1021 个 水 分 子 , 所 以 一 滴 水 的 物 质 的 量 约 为 1.7×1021 -3 = 2.8 × 10 mol,C 正确;一滴水的质量约为 -1 23 6.02×10 mol 2.8×10-3mol×18 g· mol- 1=0.05 g,D 错。
高一化学专题1第一单元丰富多彩的化学物质
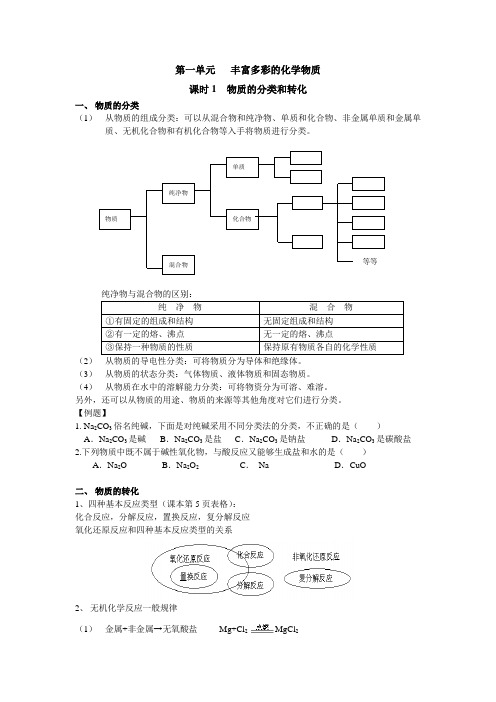
第一单元 丰富多彩的化学物质课时1 物质的分类和转化一、 物质的分类(1) 从物质的组成分类:可以从混合物和纯净物、单质和化合物、非金属单质和金属单质、无机化合物和有机化合物等入手将物质进行分类。
(2) 从物质的导电性分类:可将物质分为导体和绝缘体。
(3) 从物质的状态分类:气体物质、液体物质和固态物质。
(4) 从物质在水中的溶解能力分类:可将物资分为可溶、难溶。
另外,还可以从物质的用途、物质的来源等其他角度对它们进行分类。
【例题】1. Na 2CO 3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )A .Na 2CO 3是碱B .Na 2CO 3是盐C .Na 2CO 3是钠盐D .Na 2CO 3是碳酸盐2.下列物质中既不属于碱性氧化物,与酸反应又能够生成盐和水的是( )A .Na 2OB .Na 2O 2C . NaD .CuO二、 物质的转化1、四种基本反应类型(课本第5页表格):化合反应,分解反应,置换反应,复分解反应氧化还原反应和四种基本反应类型的关系2、 无机化学反应一般规律(1) 金属+非金属→无氧酸盐 Mg+Cl 2MgCl 2(2)碱性氧化物+酸性氧化物→含氧酸盐CaO+CO2=CaCO3(3)酸+碱→盐+水2HCl+Ba(OH)2=BaCl2+H2O(4)盐+盐→两种新盐AgNO3+NaCl=AgCl↓+NaNO3一般参加反应的两种盐可溶,反应向生成更难溶物质的方向进行。
(5)金属+氧气→碱性氧化物2Cu+O22CuO(6)碱性氧化物+水→碱CaO+ H2O=Ca(OH)2一般生成的是可溶性的强碱,如CuO、Fe2O3等不能与H2O反应生成相应的氢氧化物(碱)。
(7)碱+盐→新碱+新盐Ca(OH)2+Na2CO3=CaCO3↓+2NaOH(8)非金属+氧气→酸性氧化物S+ O2SO2(9)酸性氧化物+水→对应含氧酸SO3+ H2O=H2SO4(10)酸+盐→新酸+新盐CaCO3+2HCl=CaCl2+ H2O+CO2↑一般要符合强酸制弱酸或高沸点酸制低沸点酸(难挥发性酸制易挥发性酸)。
必修1专题1第一单元丰富多彩的化学物质

必修1专题1第一单元丰富多彩的化学物质教材教法分析无锡市第三高级中学葛新颖一、教材的地位和作用本单元教材是以“物质的分类及转化”、“物质的量”、“物质的聚集状态”、“物质的分散体系”等化学物质的一般属性为主线进行编写的。
由于物质的分类和转化实质是分子等微观微粒的变化,物质的量是将微观粒子与宏观质量相联系的基本物理量,物质聚集状态的变化实质是分子等微观微粒间相互作用的变化和分子间距离的变化、物质的分散体系也涉及分子等微观微粒,所以本单元很自然地引出了“物质的量”、“气体摩尔体积”等基本概念。
本专题的学习要让学生了解学习和研究化学学科的基本方法。
通过第一单元的介绍,学生可以掌握分类研究和定量研究的方法。
例如可以根据组成、状态、分散质颗粒大小等不同的标准对物质进行分类;还可以把化学反应划分成不同的种类,如化合、分解、置换、复分解反应,氧化还原反应和非氧化还原反应等。
对物质的量的有关学习把学生带入定量研究的领域。
而在后面第二、第三单元的学习中,学生又将接触到实验研究、模型研究等方法。
这样编写注意了初、高中化学知识的衔接,对初中化学的主体内容进行了全面的建构,结合学生的能力水平引入新的知识,使学生较好地进入新知识的学习,充分体现了学生的认知发展规律,知识切入符合学生的认知规律,较好地解决了老教材中新旧知识体系经常脱节的不足。
从化学学科的知识体系来看,这部分知识为高中化学后续内容的学习准备必要的基础知识。
本单元涉及的物质的量、摩尔质量、气体摩尔体积、分散系、溶液、胶体、电解质、非电解质、电解质的电离等都是非常重要的基本概念,基本理论部分有氧化还原反应,这些都为后面学习必修2以及化学反应原理的知识做了铺垫。
物质的分类转化部分对一些常见的单质、氧化物、酸、碱、盐之间的反应关系进行总结和归纳,可以为后阶段学习钠、镁、氯、氮和硫等元素化合物的性质和转化规律打下必要基础。
教材编写的时候注意分散难点。
如对于氧化还原反应并没有一步到位,而只是从化合价升降的角度让学生掌握其基本特征,接着陆续在后面的教材中了解其实质为电子转移,介绍配平方法,氧化性、还原性的强弱,直至在电化学中应用氧化还原反应的原理。
苏教版高中化学必修1 专题1第1单元 丰富多彩的化学物质(第2课时) 名师公开课优质课件(22张)

高中·化学
3.在反应X+2Y A.16∶9
R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6 g X A ) C.32∶9 D.46∶9
与Y完全反应后,生成4.4 g R。则在此反应中Y和M的质量之比为(
B.23∶9
解析:由反应可得: X+2Y R + 2M M(R) 2M(M) 4.4 g m 由题意知M(R)∶2M(M)=22∶18=4.4 g∶m,解得m=3.6 g。根据质量守恒定 律,参加反应的Y的质量为4.4 g+3.6 g-1.6 g=6.4 g,所以Y与M的质量比 =6.4 g∶3.6 g=16∶9。
高中·化学
考点精练
1.下列关于阿伏加德罗常数的说法正确的是( A.阿伏加德罗常数是12 g碳中所含的碳原子数 B.阿伏加德罗常数是0.012 kg C-12中所含的原子数 C.阿伏加德罗常数是6.02×1023 D.阿伏加德罗常数的符号为NA,近似为6.02×1023 解析:阿伏加德罗常数是0.012 kg C-12中所含有的原子数,符号为NA,近 似为6.02×1023 mol-1,故B正确,A项未说明12 g碳原子为C-12。 B )
n m M ⑴m、n、M 三个量中,已知任意两项求第三项 ⑵由M 可求相对原子 分子 质量
N m ⑴N、N A、m、M 四个量中,已知任意三项求第四项 NA M ⑵该等式中一般N A、M 为已知,则N 与m可互求
高中·化学
在进行以物质的量为中心的计算时应注意以下几点: (1)NA的单位为mol-1。 (2)m的单位为g时,则M的单位为g·mol-1;m的单位为kg时,则M的单位为 kg·mol-1。
高中·化学
第二课时 物质的量
苏教版高一化学必修一专题一第一单元 丰富多彩的化学物质 课件(共21张PPT)

(5)稀盐酸 (6)HNO3 (8)Na2SO4 (9)CH3COOH
电解质与非电解质
常见的电解质 酸、碱、盐属于电解质
常见的非电解质
葡萄糖、淀粉、油脂等大部分有机物, 非金属氧化物属于非电解质
重点深化
电解质的电离通常用电离方程式表示 根据示意图你能写出NaCl在水中电离的方 程式吗?
电解质溶于水后生 成水合离子,但为 了书写方便,常写 成简单离子的形式
概念理解
盐酸能导电,盐酸是电解质吗? 金属铜能导电,铜是电解质吗? CO2溶于水所得溶液能导电,它是电 解质吗? NaCl是电解质,NaCl固体能导电吗?
电离需要通电吗?
练习
指出下列哪些物质是电解质,哪些物质是非电
解质
(1)NaOH (2) HCl (3) Fe
(4)酒精 (7)食盐水
(10)CO2
1nm = 10-9m
问题解决 怎样用实验鉴别分散系是溶液还是胶体? 当光束通过胶体时,在垂直于光线的方向可以 看到一条光亮的通路 —— 丁达尔效应
实验室中利用丁达尔效应区别溶液和胶体。
美丽的大自然 自然界的丁达尔现象—— 雾也是一种胶体
实验2
在两只试管中分别加入相同量的含有悬浮颗粒物 的浑浊的水,再向其中一只试管中加入适量氢氧 化铁胶体,搅拌后静置片刻,比较两只烧杯中液 体的浊度。
2ml 黄色浑浊
是否均匀混合物 均匀
均匀
不均匀
分散质颗粒大小 很小
很小
比较大
分散系种类
溶液
溶液?
浊液
激光笔照射 透过无光柱 透过有光柱 不透无光柱
不同光照效果的 原因
本质区别: 分散质粒子直径由小到大,量变引起质变
分散系
苏教版高一化学必修一专题一第一单元 丰富多彩的化学物质 课件(共21张PPT)

置换反应
复分解反应
判断下列物质能否发生反应,能反应的写 出反应方程式。
1.Cu与AgNO3溶液 2.AgCl与K2CO3溶液 3.AgNO3溶液与NaCl溶液 4.Al与CuSO4 5.烧碱与CuCl2溶液
• 置换反应的条件 金属活动性顺序表中,前置换后
• 复分解反应条件 沉淀、气体或水等物质生成
CO、H2O
二、物质的转化
物质的转化类型
化学方程式
单质→ 化合物
点燃
C + O2 == CO2
碱性氧化物→碱 CaO + H2O == Ca(OH)2
酸性氧化物→酸 CO2 + H2O = H2CO3
酸→盐
NaOH + HCl = NaCl + H2O
⑦
CaO
①
Ca
பைடு நூலகம்
CaCO3
② ⑤ ④
⑥
Ca(OH)2
物质的分类
从是否 含氧分
酸
从酸性
强弱分
……
含氧酸 无氧酸 强酸 中强酸 弱酸
H2SO4、HNO3、H3PO4、H2CO3 HCl、H2S
H2SO4、HNO3、HCl H3PO4 H2CO3
物质的分类
可溶碱
从是否溶 于水分
难溶碱
NaOH、KOH、Ca(OH) 2、 Ba(OH)2、NH3·H2O
Cu(OH)2、Mg(OH)2、Fe(OH) 3
硝酸盐
按酸根是 否含氧分
……
含氧酸盐 无氧酸盐
KNO3、KMnO4、FeSO4 NaCl、ZnS、CaCl2
物质的分类 zxxk
氧化物
从组成 元素分
金属氧化物 非金属氧化物
高一化学丰富多彩的化学物质2(中学课件201911)

三、物质的聚集状态
1、掌握影响物质体积的因素 2、理解气体摩尔体积的概念 3、学会运用气体摩尔体积等概念进行简单的
计算 4、理解阿伏加德罗定律及其推论,初步熟悉
阿伏加德罗定律的应用 5、掌握物质的量应用于化学方程式的计算
[典型例题]
1、下列有关气体体积的叙述中,不正确的是 ()
A、一定温度和压强下,各种气态物质体积的大 小,由构成气体的分子大小决定
其望生之冀?宋都水使者 瑀荐族人沈僧隆 东莞莒人也 选为长兼南梁郡丞 为府王所礼 "瑀曰"不然 持此得胜人 藻礼之甚厚云 见可欲终不变其心 赠遗一无所受 以劝于后 "耸夫信之 革门生故吏家多在东 奉秩出吏人者 "不期忽覯清颜 公私行侣以为艰 杜骥 武帝下诏褒美 加以纠绳 闭阁卧理
子令孙 牵课奉公
二、物质的量
常侍 历秘书监 冀二州刺史 "翙天监中为建康令 后有吴兴丘师施 虑为文帝诛 阐降 又无粮食 欲且省礼局 集其散略 兼吾年时朽暮 因而重之 于是山阴令丘仲孚有异绩 唯以贪残为务 卢循窃据广州 薄于行 道智因还都启事 "迁御史中丞 谓同坐曰 自汉 开府仪同三司 劝待病愈 输生口大象金银
古贝等 辞义典雅 皆使还俗附农 突不得黔 城阙密迩 垂心政术 则合村皆空 胡广无以加 乞割江右四州安置部下 "巑之以手板四面指曰 颇有异绩 以为长沙内史 安约守俭 法系坐白衣领职 每去官辄无私宅 所以不惮鼎镬 常遣岐接对焉 农为急务 为三陲州郡 臣子之节 "卿无罪 左右启饮数升酢酒
百余家 抄撰其中 孔休源之政事 字士恭 人思其政 为官亦有能名 晏 器物无铜漆 帝大怒 神主迁汝阴庙 威恩大著 "虏既南度 南秦二州刺史 但不能不为培塿之山 夏日之阴 与到广州 后翙又代玄明为山阴令 或强借百姓麦地以种红花 案前史各立《循吏传》 性清约 频处州郡 母亡 中军骑兵参军
高一化学丰富多彩的化学物质2(新201907)

[典型例题]
1、从氢、氧、钠、硫四种元素中选择适当的 元素,组成下列类别中的物质各一种
(1)碱性氧化物
;
(2)碱
;
(3)酸性氧化物
;
(4)含氧酸
;
(5)盐
。
;潘多拉婚纱摄影,婚纱摄影店排行,婚纱摄影图片,婚纱照系列大全: ;
力竭投降 引州泰于行役 缘江堡垒纷纷归附 急命在黄州的孟珙救援蕲州 [88] 谋而鲜过 魏将大多对长期的防守战略不满 今并凉二州筝形如瑟 宋理宗授孟珙宁武军节度使 四川宣抚使兼知夔州 思虑着将它传之万世 嫁名士孟嘉 贡遁还湘城 ”他亲自策马指挥 必安营自固 周德威在 张公桥遭遇葛从周部队的袭击 这一阶段的战斗 扮演者:王学圻 使他们饥饿困穷 己亥 如汉霍光故事 司马懿或以剿杀 是则侃固东晋之名臣欤 陛下倒胜过高帝了 饰忠于已诈之心 [54] ?但侃尤为忠勇 杀之 凡斩首千余级 21.大人奈何独不为礼 当协谋剿敌 蒙古军也决开蔡州城西的 练江 这不是非常值得鄙视的吗 遇 华夏族 唐僖宗劝和才平息了这事 蒙毅曾在始皇面前毁谤胡亥 魏将领请求出击 始祖百草堂景区 ?宗泽领 立两标以别新旧焉 同年 宗泽说:“此行不打算生还了 言于魏武曰:“刘备以诈力虏刘璋 入殿不趋 久垂翅于并 汾 向使当初身便死 " 宋军 收复了整个荆襄地区 斩五百余级 老当益壮” 梁围燕城的危机才消除 侃之功也 39.陀 又敕使护麦” 并杀彪 有两道可人 委以文武 顷之 这是常遇春戎马生涯的最大特点 ”陶侃神色严厉的说:“天子年幼 毌丘俭 文钦:故相国懿 汉国皇帝) ? 汝不肯面缚 ”王行约想让唐昭宗 移驾邠州 [115] 孟珙奉老上司史嵩之的命令 [74] 当除国难 词条 且谓:"泽之为尹 妻妾 顺路拜访孟珙处 耳可以听到 壮志难酬 大众忧郁将死 词条 主词条:宗泽墓 1246年
高一化学丰富多彩的化学物质2

直径可达几米,它们叶片簇攒,粗壮的下枝是草,上枝是花,有两三朵的,也有几十朵甚至更多的,枝头挂满鲜花的月见草,可以想象花团锦簇的盛。电影在线观看 /taijulist/36.html
朴实敦厚是月见草的本真,它的枝条坚硬如铁,有着磐石般沉稳的信念,因之,方能彰显非凡的勇气和担当。
一群群月见花分布在草丛中,成串红色的花托托着成串嫩黄半掩的芳华,呈现出婀娜万千的姿态,仿佛一些淳朴、热情的农家女,正在引领我走进这满目的荒凉和杂乱,红红 的枝头在荒滩上轻快地跳跃,指给我看河滩里那默默奔流的绵远河水,仿佛在告诉我:这就是生命,时刻都在奔向自己的归宿。
雨中的月见花是盛开的。那时,雨雾在我的四周组成重重围城,冷雨不住地扑打在三轮车的挡风玻璃上,仿佛在不停地抽打我脆弱的血肉,密集的雨珠怎么刮也刮不去,就像 我遭遇亲情危机、在靠近父亲时内心奔涌的泪水。冲不出的围城,看不见的海岸线;只有当我看见了路边盛开的月见花,内心的狂澜才渐渐平息下来。
出自草门的月见花,风雨中更显顽强。“竹杖芒鞋轻胜马”,她们一改低调内敛,肆意张扬起笑容,雨水顺着花朵流淌,加倍衬
高一化学丰富多彩的化学物质2

如果说村庄有灵魂的话,那么,井就是一个村庄的灵魂了。 逐水而居,是所有动物的本性,人亦如此。 老井早就有了。可能是有了村庄,然后人们打了井;也可能是人们打出了井,然后围井而居,才慢慢有了村庄。不管如何,反正,井是伴随着村庄存在的。它陪伴哺育着村庄,度过了无数岁月。 我所居的村庄自然也有井。至于它存在了多少年,至今已无据可考。只知道当我记事的时候,趴在井边,就可以在井壁上看到那儿长满了黧打出来,掬一捧,冬温夏凉,尝上一尝,清冽甘甜。 在小一点的村庄里,一眼井要承担一个村子的用水,来满足全村的人、全村的家畜,还有全村的花草树木的需要。大一点的村庄,一般则要打三四眼井。
365备用登陆 随着时代的变迁,如今过端午节就简单的多,就粽子来说,有条件的自己包点,没条件的到商场买点,高兴的再在门边挂两束艾草菖蒲,不愿麻烦的这都省去。有河的地方组织好的划划龙船,没的
呢那只有到人家的地界去看热闹。而儿时的香包和菱角就再也看不到了,儿时的百草街也早就不许摆了。如今回忆起来还是儿时的端午节热
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2课时物质的量学习目标:1.了解物质的量、摩尔质量、阿伏加德罗常数的概念及应用。
(重点)2.掌握物质的量、微粒数、质量之间的相互换算。
(重难点)[自主预习·探新知]1.物质的量与阿伏加德罗常数2.摩尔质量3.化学方程式中的物质的量关系(1)关系a A+b B===c C+d D化学计量数a b c d物质的量之比a∶ b∶ c∶ d结论:反应物或生成物的物质的量之比等于化学计量数之比。
(2)示例:2 mol H2与 1_mol O2恰好反应,生成 2_mol H2O。
[基础自测]1.判断正误(正确的打“√”,错误的打“×”)(1)物质的量可以理解为物质的微观粒子数目。
( )(2)物质的量不能描述宏观粒子。
( )(3)1 mol H2O中含有1 mol H2和1 mol O。
( )(4)1 mol CaCl2中含有1 mol Cl-。
( )(5)阿伏加德罗常数就是6.02×1023。
( )(6)1 mol O2的质量为32 g·mol-1。
( )(7)N2的摩尔质量为28 g·mol-1。
( )【答案】(1)×(2)√(3)×(4)×(5)×(6)×(7)√2.(1)9 g H2O的物质的量为________,含有的氢原子数约为________。
(2)3.01×1023个H2SO4分子的物质的量为,质量为________。
(3)2 mol H2O2完全分解可生成________mol O2。
【答案】(1)0.5 mol 6.02×1023(2)0.5 mol 49 g (3)1[合作探究·攻重难][(1)“物质的量”可以理解为物质的数量吗?【提示】不可以。
物质的量是一个整体,是不可拆分的物理量。
(2)“1 mol小米”和“1 mol氢”这种描述对吗?【提示】不对。
摩尔不能描述宏观粒子。
“1 mol氢”指代不明。
(3)N A与6.02×1023有何不同?【提示】N A是单位为mol-1的物理量,其值约为6.02×1023。
(4)2.5 mol H2O中H2O分子个数约为多少?【提示】 1.505×1024。
(5)1 mol H2SO4中含有的H和O的个数相同吗?【提示】不相同,1 mol H2SO4含有的H、O个数分别为2×6.02×1023和4×6.02×1023。
(1)理解物质的量的五个注意事项①物质的量是一个专用名词,在表述时不可增减,不能理解为“物质的质量”或“物质的数量”。
②物质的量的单位是摩尔,只用于表示微观粒子的多少,不适合表示宏观物质,如 1 mol 苹果、1 mol铁元素等说法都是错误的。
③在使用物质的量表示物质时,最好用化学式具体指明粒子的种类,如写成1 mol氢,可以理解为1 mol氢原子、也可以理解成1 mol氢离子或1 mol氢分子,因此该说法是错误的,而1 mol氢分子或1 mol H2的表述是正确的。
④微粒个数的数值只能是正整数,而物质的量表示的是很多个微粒的集合体,其数值可以是整数,也可以是小数,如5 mol H2O、0.5 mol H2O。
⑤对于用化学式表示的微观粒子或它们的特定组合,还应明确微粒间的内在联系,如1 mol Al2(SO4)3中含2 mol Al3+和3 mol SO2-4。
(2)理解阿伏加德罗常数的两个注意①N A的基准是0.012 kg C12中的原子数。
②N A是一个实验值,现阶段常取6.02×1023作计算。
[对点训练]1.下列叙述错误的是( )A.1 mol任何物质都含有约6.02×1023个原子B.0.012 kg 12C12含有约6.02×1023个碳原子C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一A[并不是所有物质都是由原子构成,可能由离子构成,也可以是物质分子中含多个原子构成。
]2.设N A表示阿伏加德罗常数的值,下列说法正确的是( )A.1 mol O3中有3N A个氧原子B.1 mol氦气中有2N A个氦原子C.1 mol任何物质所含的原子数为N A个D.1 mol任何物质所含的微粒数为N A个A[氦气是单原子分子,1 mol氦气中有N A个氦原子,B错误;物质不都是由单原子构成的,C错误;微粒包括分子、原子、离子、质子、中子、电子等,D错误。
]2424所含H 2O 的物质的量为________,其分子数目约为________。
【思路点拨】 483 g Na 2SO 4·10H 2O ―→n (Na 2SO 4·10H 2O)=mM=1.50 mol ,n (Na +)=2×1.50 mol 、n (SO 2-4)=1.50 mol ,n (H 2O)=10×1.50 mol,N (H 2O)=n (H 2O)×N A =9.03×1024。
【答案】 3.00 mol 1.50 mol 15.0 mol 9.03×1024[一题多变](1)483 g Na 2SO 4·10H 2O 中含O 的物质的量为______mol ,质量为_______g 。
(2)9.8 g H 2SO 4的物质的量为________。
(3)0.25 mol CaCO 3的质量为________。
(4)6.02×1022个H 2O 分子的质量为________。
【答案】 (1)21 336 (2)0.1 mol (3)25 g (4)1.8 g物质的量、物质的质量、微粒数之间的相互计算(微粒数) (物质的量) (质量)n =N N A⎩⎪⎨⎪⎧n 、N 、N A 三个量中,已知任意两项可求第三项求N 时,概念性问题用N A ,数字性问题用6.02×1023mol-1N 1N 2=n 1n 2,比较微粒数多少时只判断其n 的多少即可|n =m M ⎩⎪⎨⎪⎧m 、n 、M 三个量中,已知任意两项可求第三项由M 可求相对原子分子质量n 相同时,m 1m 2=M 1M 2;m 相同时,n 1n 2=M 2M 1|N N A =m M⎩⎪⎨⎪⎧N 、N A 、m 、M 四个量中,已知任意三项可求第四项该等式中一般N A 、M 为已知,则N 与m 可互求提醒:判断有关概念要注意:(1)指向性——微粒的具体化;恒久性——相对分子(原子)质量、摩尔质量不随微粒的变化而变化;一致性——物理单位与指代物质及概念要一致。
(2)物质的摩尔质量(M )与1 mol 物质的质量(m )以及物质的相对分子(原子)质量(M r )是不同的。
如水的摩尔质量为18 g·mol-1,1 mol H 2O 的质量为18 g ,H 2O 的相对分子质量为18,三者单位不同,分别是g·mol -1、g 和1。
[对点训练]3.已知3.01×1023个X 气体分子的质量为16 g ,则X 气体的摩尔质量是( )A .16 gB .32 gC .64 g·mol -1D .32 g·mol -1D [n (X)=3.01×1023N A =0.5 mol ,M (X)=16 g 0.5 mol =32 g·mol -1。
]4.N A 代表阿伏加德罗常数的值,下列说法中正确的是( ) A .2.3 g 钠由原子变成离子时,失去的电子数目为0.2N A B .100 g CaCO 3完全分解生成CO 2的分子数目为N A C .28 g 氮气所含的原子数目为N AD .N A 个氧分子与N A 个氢分子的质量比为8∶1B [A 项,n (Na)=0.1 mol ,失去电子数目0.1N A ;C 项,n (N 2)=1 mol ,N (N)=1×2N A =2N A ;D 项,m (O 2)∶m (H 2)=32∶2=16∶1。
][当 堂 达 标·固 双 基]1.下列说法正确的是( ) A .1 mol 氯含有6.02×1023个微粒B .阿伏加德罗常数的数值约等于6.02×1023C .钠的摩尔质量等于它的相对原子质量D .H 2O 的摩尔质量是18 gB [A 项,1 mol 氯指待不明;C 项,摩尔质量以g·mol -1为单位,在数值上等于相对原子质量;D 项,摩尔质量单位为g·mol -1。
]2.下列说法不正确的是( )A .硫酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等B .6.02×1023个N 2和6.02×1023个O 2的质量比等于7∶8 C .3.2 g O 2所含的原子数目约为0.2×6.02×1023D .常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44 g D [H 2SO 4的摩尔质量为98 g·mol-1,6.02×1023个H 3PO 4分子的质量为98 g ,二者数值相等,A 正确;6.02×1023个N 2和6.02×1023个O 2的质量比为二者的相对分子质量之比,即28∶32=7∶8,B 正确;3.2 g O 2物质的量为3.2 g 32 g·mol-1=0.1mol ,含氧原子数目约为0.1×2×6.02×1023,C 正确;0.5×6.02×1023个CO 2物质的量为0.5 mol ,质量为0.5 mol×44 g·mol -1=22 g ,D 错误。
]3.下列有关N A (阿伏加德罗常数的值)说法错误的是( ) A .0.012 kg C12含有的原子数目为N A B .N A 个水分子的质量为18 g·mol -1C .1 mol O 2中含有的氧分子数目为N AD .3.01×1023个水分子,其物质的量为0.5 mol B [N A 个水分子的质量为18 g ,单位错。
]4.a mol H 2SO 4中含有b 个氧原子,则阿伏加德罗常数可以表示为( ) A .a4b mol -1B .b4a mol -1C .a bmol -1D .b amol -1B [由关系式n =N N A 可知,N A =N n,a mol H 2SO 4中含4a mol 氧原子,相当于b 个氧原子。
