2019精选医学第一章卤化反应.doc
第一章:卤化反应

~70%
O CH3 SO2Cl2/CCl4 r.t.,2h
O CH3 Cl
83~85%
N
。 1.Cl3CCOCCl3/THF/- 78 CH3 2. HCl/H2O 3. NaHCO3/H2O O O Me + CH3 Cl
Cl
90%*
9%*
碱催化机理
C C H O OH C C O X X OH 慢 (-H2O) C C O X2 快 ( -X ) C C X O
Br C R1 C O H
OAc NBS/DMSO AcOCH2 O OgluAc4 OAc Br O AcOCH2 O OgluAc4 r.t
(90%)
4、与卤化氢的加成
PhCH2 gas,HBr CH CH2 。 AcOH/ 0 , 12h PhCH2 CH CH3 Br KI/H3PO4 80。3h ,
R H
X2 高 / 温
h/过氧化物
R X
反应活性:叔C-H>仲C-H>伯C-H(C.稳定性)
Cl2/CH2Cl2
h
降冰片烷
Cl
外向型(exo) 70~95%
2、苄位、烯丙位的卤取代
X2 h 或 他 其 引 剂 发 X
(X=Cl, Br)
O h N X 或 由 自 基 引 剂 发 O
O N +X O
C C X O
酮的卤取代反应
CH3COCH2CH2CH3
Br2/KClO3/ h 。 H2O/ 40~45 6h
CH3CO CH CH2CH3 Br 53% + CH2 CO CH2CH2CH3 Br 32%
2、烯醇酯、烯胺醚的卤取代反应
CH2 C OAc H源自AcOCH2Br H NBS/diox 。 85 ,45min C O H
药物合成反应第1章卤化反应

2. 卤化氢对炔烃的加成: 离子型加成:与烯烃的情况类似
五、不饱和烃的硼氢化-卤解反应 硼氢化反应:硼氢化物对π 键加成的反应。 反应历程:经过烯烃的硼氢化反应,再通过卤解
反应转化成卤代饱和烃或烯烃。
1、烯烃的硼氢化-卤解反应 常用的硼氢化试剂:二硼烷(B2H6)、BH3/THF和BH3/ Me2S(TMS)等; ①烯烃的硼氢化反应
π键 :原子轨道重叠部分对键轴所在的某 一平面具有反对称性时所形成的键。
p原子轨道的角度分布剖面图:
z(或y)
+
x
-
y(或z)
注:其中+、-号不表示正、负电荷,而是表示原子轨道角度分布图形 的对称关系
若两原子成键是由p轨道重叠形成的,且形成的是σ 键,则成键图形为:
-
++ -
如果形成的是π键, 则:
3R-CH=CH2 + 1/2B2H6 → (RCH2CH2)3B ②卤解反应:用碘、溴素等将硼基置换出来,得到相
应的碘代烷或溴代烷。
2、炔烃的硼氢化-卤解反应 常用的硼氢化试剂:儿茶酚硼烷(由儿茶酚和BH3/THF 制得);
反应机理:
第二节 烃类的卤取代反应
一、 脂肪烃的卤取代反应 1. 饱和脂肪烃的卤取代反应 反应条件:高温、紫外光照或过氧化物引发 反应历程:自由基反应 烷基氢原子的活性: 叔C-H> 仲C-H > 伯 C-H
CH3
CO OH
CH2I CO
OH
O CH2OCCH3
CO OH
I2/CaO
CH3COOK
CH3OH/CaCl2
DMF
O
O
O
催眠镇静药巴比妥中间体二乙基丙二酸二乙酯的制 备:
第一章 卤化反应2

二. 卤化氢对不饱和烃的加成反应
(1)反应通式
可用于制备单卤素取代的饱和烃
R1 R2
C C
R3 R4
+ HX
R1 H R3 C C R2 X R4
二. 卤化氢对不饱和烃的加成反应
反应机理 ①离子对机理:形成开放式碳正离子(尤其在苄位、烯丙位 等,此碳正离子更为稳定),它主要得到同向加成产物(35); ②三分子协同反应机理:亲核试剂从氯加成的相反方向对 烯烃和卤化氢的复合物进攻,得到对向加成产物(36) 产物符合马氏法则,卤素加到取代多的一侧
R3
R X X 4 (4) syn
同向加成产物
1. 卤素对烯烃的加成 (3)影响因素:(a)烯烃结构
当双键上有苯基取代基时,开放式碳正离子与苯 环共轭而稳定,增加了同向加成的几率: (1)烯烃上取代基性质:使哪种过渡态稳定,相对 应的产物就多
Br2/CCl4 Br H R C H CH3 C Br CH3+ R Br Br C H C H CH3
(3) 影响因素 (a) 反应物、卤化剂等的影响
2.卤化氢对炔烃的加成
炔烃和卤化氢的机理及立体化学与烯烃的情况相 似。同样,为了减少溶剂分子参与的副反应,在 反应介质中加入含卤素负离子的添加剂可得到较 好效果。
三. 不饱和烃和次卤酸(酯)、N-卤代酰胺的反应
(1)反应通式 次卤酸对烯烃加成生成β-卤醇;次卤酸酯为卤化 剂生成β-卤醇或其衍生物
R H
CH C
R=H R=OCH3
88% 63%
12% 37%
1. 卤素对烯烃的加成 (3)影响因素:(b)不同卤素的影响 氯的极性比溴小,不易形成桥氯正离子, 同向加成的倾向更明显;而溴极化能力强, 易形成桥型溴正离子,以对向加成为主。
第一章卤化反应HalogenationReaction

卤化氢对烯烃加成,得到卤素取代的饱和烃。
1.卤化氢与烯烃的离子型亲电加成 (1)反应历程:
R1
R3
CC
R2
R4
δ+δHX
δX R1 R3 CHC R2 HR4
R1 R3
R2
CC X HR4
Organic Reactions for Drug Synthesis
(2)影响反应定位方向的主要因素
a.活性中间体碳正离子的稳定性 氢原子加到能形成最稳定的碳正离子的那个双键碳原
Organic Reactions for Drug Synthesis
例1.
C6H5 H
CC
H
COOC2H5
Br2 / CCl4
Br
C6H5
C
H C
H Br COOC2H5
C6H5 H CC
H Br COOC2H5
C6H5
Br H CC
H Br COOC2H5
主要产物
Organic Reactions for Drug Synthesis
一、 卤素对烯烃的加成反应
概述
烯烃和卤素加成,得到1,2-二卤代物。
X
CC X2
CC X
❖氟与烯烃的加成在有机合成上无实用意义。 ❖碘与烯烃的反应不容易发生,应用亦很少。 ❖氯、溴与烯烃的加成是精细化工领域普遍应用 的单元反应技术之一,我们将重点介绍。
Organic Reactions for Drug Synthesis
I2
光引发下的自由基反应 碘与烯烃的反应不容易发生。(原因:C-I键不稳定,
碘加成反应是一个可逆过程。
H 3CCCC H 3 I2,hν HH
I
第一章 卤化反应优秀课件

第一章 卤化反应
Halogenation Reaction
2013/09
反应
卤化反应的应用
1、人造血
2、杀虫剂-米勒1939年发现并合成了高效有机杀虫剂DDT, 于1948年获得诺贝尔生理与医学奖
3、冷冻剂:氟里昂CF2Cl2
4、发泡剂
5.、药物
DDT
如:氟尿嘧啶注射液
【适应症】:本品的抗瘤谱较广,主要用于治疗 消化道肿瘤,或较大剂量氟尿嘧啶治疗绒毛膜上 皮癌。亦常用于治疗乳腺癌、卵巢癌、肺癌、宫 颈癌、膀胱癌及皮肤癌等。
(2)亲电取代
① 芳烃的卤取代反应: ➢ 芳烃氢原子被卤素原子取代的反应,
属于最常见的芳烃亲电取代。
σ-络合物
然后很快失去一个质子或L-,恢复到稳定 的芳环结构,完成亲电卤取代反应。
2. 亲核反应:亲核取代
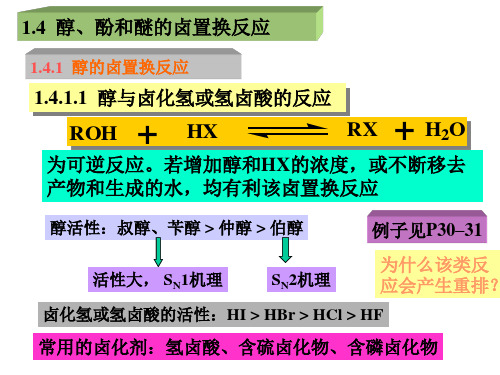
醇羟基的卤置换反应、 羧羟基的卤置换反应、 卤化物的卤素交换反应 磺酸酯的卤置换反应 反应历程: ➢ 单分子亲核取代反应(SN1) ➢ 双分子亲核取代反应(SN2)
OCH2CH2N
C2H5 C2H5
·HCl
I
胺碘酮盐酸盐
定义:
有机化合物分子中引入卤素原子(X), 建立碳—卤键的反应称卤化反应。
用途:
➢ 制备具有特定活性的含卤有机药物 ➢ 制备官能团转化的中间体 ➢ 提高反应选择性,引入卤素原子作为保
护基、阻断基等,提高合成反应中的化 学或区域选择性
第一节 卤化反应机理
卤化反应的机理类型:
亲电加成 不饱和烃的卤加成反应 亲电取代 芳烃和羰基α位的卤取代反应 亲核取代 卤置换反应 自由基反应 饱和烃、苄位和烯丙位的卤取
代反应、某些不饱和烃的卤加 成反应等
第一章卤化反应

转1800C
R3 C X R4
• ③位阻的影响
• 无位阻,机会均等,形成外消旋混合物; • 有位阻:
Me C16H30 Br2/AcOH AcONa/Et2O HO
Me HO H Br
Me C16H30 Br HO H Br
(84~85%)
对于环烯、桥卤正离子在位阻小的一面形成:
2X .
CH2 CH CH2 + HX
CH2
CH
CH2
X2
CH2
CH
CH2 X
X
CH3 CH3
Br2 125
hν
oC,2h
CH2 Br CH2 Br
(48~53%)
(3)影响因素 ①a位亚甲基一般比a位甲基容易取代:
CH3(CH2)2 NBS (PhCO)2O2 CH2 CH CH CH3 CCl4 △ .2h Br CH3(CH2)2 CH CH CH CH3
• ②缺p芳杂环不利于卤代
• 4. 应用特点 • ①制备卤代芳烃
• • • • •
②氟代反应 反应剧烈,低温、稀释。 ③氯代反应 HOCl、CH3CO2Cl、Cl2O、S2Cl2、 O2Cl2、tBuOCl
• • • •
④溴代反应 加入I2可加速反应,因I2Br-比Br3-容易生成 其他溴化剂:NBS、HOBr、CF3CO2Br Lewis酸可加速反应
① 桥型卤正离子或离子对的过渡态形式
Q
Q R1 R3 C C R4 R2 X Q R1 R3 C C R4 R2 X Q R2 R3 C C R4 R1 X
(3)
R1 R2 R1 R2 R3 QX C C R4 R1
R3 C C R4 X
[医学]药物合成1卤化反应
![[医学]药物合成1卤化反应](https://img.taocdn.com/s3/m/06945b76482fb4daa48d4b21.png)
R1 C
R2
R3 H
C R4 Nu
R1 C
R2 Nu
R3 C H R4
(syn)
R1
R3
CC
R2 Nu H R4
H Cl
R1 C
R2
R3 C
R4
Nu
2019/8/1
(anti)
R1
H R3
CC R2 Nu R4
Nu=X,AcO,et al.
烯烃的结构:重排
2. 卤化氢对炔烃的加成: 离子型加成:与烯烃的情况类似
X
CH Br2/CCl4
C
2~5C
X
H CH3
H
Br
CH3
C
C
+
HBr
X
CH3 H
Br C
C Br
H
X=H X=OCH3
(88%) (63%)
(12%) (37%)
Ph CH CH CH3
Cl2 CH3Cl2/0C
H Cl
CH3
C
C
Ph
Cl
H
CH3
Cl
H
C
C
Ph
Cl H
E Z
2019/8/1
(55%~56%) (62%~63%)
Cl2/NaOH/H2O 15~20C,0.5h
(99%~100%)
t-BuOCl
(72%~99%)
2. N-卤代酰胺为卤化剂:
N-溴(氯)代乙酰胺(NBA,NCA) N-溴(氯)代丁二酰亚胺(NBS, NCS)
OH
C
RC
NH X C
Nu
CC X
Nu CC X
N u = H 2 O ,R O H ,D M S O ,D M F P h C HC H 2 2 N 5 C B ,S 3 /5 H m 2 iO n P h C H (O H )C H 2 B r (82%)
1-卤化反应

C
:OH
δ X—X
C X
C O
b,主要影响因素 (1)催化剂 可为质子酸,也可是Lewis酸. (2)碱 需适当的碱( B:)参与,以帮助脱 去质子,该步决定了烯醇化速度,未质 子化的酮可作为有机碱发挥碱的作用. (3)酮的结构 若仅有一个α-氢,产物单纯.
O2N
COCH 3
Br2, phCl 26~28℃
3.主要影响因素
溶剂:在CCl4,CHCl3,CS2和CH3COOEt中,Br2, 溶剂 Cl2与无位阻的烯烃迅速反应. 在亲核性溶剂(H2O,RCOOH,ROH etc)中,产 物中有其它加成物生成,此时在介质中添加无机卤 化物,可提高邻二卤化物的产率.
eg.
Me C H 无添加剂 加LiCl C
Ca(OH)2 +
2 HI
CaI2 +
2 H2O
CH2I C=O OH I2, CaO CHCl3, MeOH 2~4℃, 1h O OH
O
O
O CH2OCOCH3 C=O O KOAc, DMF, 5h rt~30~50℃ O OH
二,醛的α-卤代反应 (自学) 三,羧酸及其衍生物α-卤代反应
羧酸:α-卤代不似醛酮容易,因α-活性较 小.一般需加催化剂如:S, P或PCl3等. 羧酸衍生物: 酰卤,酸酐,氰,丙二酸及其酯的α-氢 活性升高,可直接与卤素作用进行α-卤 代.故羧酸的α-卤代常先转化成酰氯或酸 酐,然后再卤化.
+
通式:加成—消除机理
Slow 加成 H E
+ E+
E π-络合物
+
+
σ-络合物(碳正离子) Fast E
_
第一章卤化反应

第二节 卤取代反应
❖ 1、不饱和烃的卤取代反应 ❖ 2、芳烃的卤取代反应 ❖ 3、羰基化合物的卤取代反应(烯醇和烯胺
衍生物)
一、不饱和烃的卤取代反应
❖ 烯键上氢原子活性很小,直接卤取代或 与有机金属化合物发生氢-金属交换均 少见。常用炔烃的硼氢化-卤解反应来制 备卤代烯烃。
❖ 炔烃比较活泼,利用卤取代反应可以得 到1-卤代炔烃。
❖ 烯烃的硼氢化常用的试剂为二硼烷(B2H6), BH3/THF和BH3/Me2S(DMS)。
❖ 炔烃的硼氢化试剂常用儿茶酚硼烷。
❖ 属顺式硼氢化加成机理,硼原子优先处于位 阻较小的位置。
❖ 若硼原子连接的碳原子为手性中心,在置换 过程中发生构型反转现象。
?????? ??????
碳碳键 旋转
同向消除 对向消除
氟西汀
C (C2)4H OC3 H NO2CC2HNH2H
氟康唑
Cl
Br CH3
CH3
CHCH2CH2N
CHCH2CH2N
CH3
CH3
N
N
氯苯那敏
抗过敏药扑尔敏
溴苯那敏
双氯灭痛
第一节 应
❖ 卤素的活性次序为F>Cl>Br>I
❖ 氟的活性最高,和烯烃反应剧烈,在加成的 同时伴有取代、聚合等副反应,故合成应用 价值很小。
❖ 氟代化合物一般不用卤加成的方法得到,而 常用卤取代反应,或选用含氟的原料。
❖ 碘对烯烃的加成产物不稳定,可消除碘分子 得到原来的烯烃,故是一个可逆反应。
❖ 氯和溴对烯烃的加成是合成上重要的卤 加成反应,其氯代或溴代产物为重要的 中间体。
❖ 为亲电加成机理:
❖ 以对向加成机理为主,同向加成的比例 可因所用卤素及烯烃上的取代基不同而 不同。
卤化反应一

O
CH3
SO2Cl2 /CCl4
r.t. 2h
O CH3
Cl
O CH3CH2CCH3
2mol Br2 / HBr
O CH3CCCHBr
Br
酸催化卤代机理
H O CC
H
OH CC H H2O
HX O
- H+ 烯醇化
O
H O CC
XX
CC
CC
+ HX
X
X
碱催化卤代机理
O CC H
E
有利 E (恢复芳香性)
机理
+ X2
AlCl3
X ( X = Cl, Br)
快 + Cl Cl
Cl 快
H
ClAlCl3
δδ Cl Cl
AlCl3 慢
Cl + HCl + AlCl3
1. 氟取代反应
MeO
MeO 1) CH3COOF/ CH2Cl2/ CFCl3/ -75℃
MeO +
2)H2O F
2. MeOH 85%
CH3(CH2)4CHCH(OCH3)2 Br
HCl/H2O 95%
CH3(CH2)4CHCHO Br
CH3
NO2
O
HN
N Br
+
O
N
O
COOH
H
4. 碘取代反应
H3CO H3CO
CH2OH I2 / Hg(OAc)2 CH2Cl2
OCH3
H3CO H3CO
CH2OH
I OCH3
I CF3COOI
I
HO
HO
NaI / t-BuOCl
1-卤化反应

(1)环正离子中间体机理(反式加成)
E
+
C=C
+ E Y
+
-
Y-
Y
C-C
E
环正离子中间体机理表明:该亲电加成反应 是分两步完成的反式加成。首先是试剂带正电荷 或带部分正电荷部位与烯烃接近,与烯烃形成环 正离子,然后试剂带负电荷部分从环正离子背后 进攻碳,发生SN2反应,总的结果是试剂的二个 部分在烯烃平面的两边发生反应,得到反式加成 的产物。
+
卤化试剂
X2
X
X
F2, XeF2,XeF4, CF3OF, HF· Py, ......
Cl2, CuCl2, PCl5, NCS/HCl, ......
I2, ......
与混合卤素加成
+
Y
XY
X
混合物
见文献: Richard C. Larock,《Comprehensive
Organic Transformations — A Guide to
教学目的
1.了解卤化反应定义及其在合成上的应用; 2.了解卤化反应分类以及一些新的卤化试剂 的应用; 3.掌握卤加成、卤取代及卤置换反应的机理 以及反应条件。 4.熟悉各种卤化反应的选择性。
新 进 展
1.不饱和烃的硼氢化-卤解反应的立体化学; 2.羰基的α-卤取代反应:酸催化、碱催化及通 过烯胺; 3.卤素之间的置换反应 4.新型的卤化试剂
苯环亲电取代反应的一般模式
+ E+
亲电试剂
E+
p -络合物
+
H E
E
+ H+
-络合物
第一章 卤化反应

69%
O
少量
三、不饱和烃和次卤酸(酯)的加成
R1 R2 X R3 X R4 OH H2O R1 R2 OH R3 X R4 OH R1 R2 X OH R3 R4
例 1
Cl2/NaOH/H2O HgCl2/15~20
70~73%
OH Cl
用次氯酸的水溶液,可制备β-卤醇。
例 2
用 ROX(次卤酸酯)作卤化剂, 同于HOX的反应,产物为β-卤醇衍生物。
当苄位、烯丙位上有推电子基取 代,可增加碳自由基稳定性。
CH2CH2 COOH NBS
Br CHCH2COOH
59%
66%
Ph3C
CH2CH =CH2
NBS / CCl4 hv /4 h , [ Ph3C C CH CH2 ] H
H [ Ph3C C
CH =CH2 ] Ph3C
C CH CH2Br H
70%
苄位、烯丙位的卤取代
X2 h 或其他 引发剂 X
(X=Cl, Br)
O h N X 或自由基 引发剂 O
O N +X O
O C C CH +X 或 N O O C C C + HX 或 NH O
O C C C + X2 或 NX O O C C C X + X 或 N O
卤化剂
卤素、N—卤代酰胺、次卤酸酯、
例 2 化合物(5)的溴加成反应主要得到 对向(反式)加成产物(6);而当苯
环上有甲氧基取代时,同向(顺式)
加成产物(7)的相对比例可增至37%。
X
Br2/CCl4 H 2~5 H CH3
Br H X C C CH3 + X H Br
第一章卤化反应-第三节

醇和氯化亚砜置换反应机理:(如图)
C OH
SOCl2
O C O S Cl
O O
SNi
O
O
O C O S Cl O O S Cl
C
Cl 构 型 保 持
Py HCl
Cl
SN2 无溶剂 -SO2
C
Cl C 构 型 反 转
SN1
C Cl
C Cl
外消旋
反应中若加入有机碱(如吡啶等)作为催化剂, 或醇本身分子内存在氨基等碱性基团,因能与反 应中生成的氯化氢结合,有利于提高反应速率。 如抗精神病药氯丙嗪中间体(32)等的制备。
(CH3)2NCH2CH2OH SOCl2 r.t. (CH3)2NCH2CH2Cl HCl (32)
在SOCl2和DMF或HMPA(催化剂)合用时,其氯 化剂的实际形式为(111)或(112)。由于它们具有 活性大、反应迅速、选择性好以及能有效地结合 反应中生成的HCl等优点,故特别适宜于某些特 殊要求的醇羟基氯置换反应,亦可作为良好的羧 羟基氯置换试剂。
伯 醇
-
X R OH2
过渡态
X R + H2O
伯醇常用Lucas试剂(浓HCl+ZnCl2反应)
浓 HCl CH3(CH2)2CH2Cl CH3(CH2)2CH2OH ZnCl2
SN1:
ROH + HX ROH2
+ +
快
+
ROH2 + X
+
-
慢 快
R + H2O RX
R +X
-
X R O P X HX O H P X X
R-OH + PX3
《药物合成反应》第一章 卤化反应

精品课程
药物合成反应
材料与化学工程系
药物合成反应
医药工业与制药工程
• 医药行业是按国际标准划分的15类国际化 产业之一,被称为“永不衰落的朝阳产业”
• 包括医药工业和医药商业
• 医药工业按原材料来分,又可分为化学制 药业、中药业、生物制药业及医疗器械业
药物合成反应
医药工业发展前景
• 随着社会的的现代化发展要求,对药的品 种、质量、效果等相应地提出了越来越高 的要求
• 随着中国步入老龄化社会,对医药的需求 带来相当大的机会
• 医药产业已成为世界经济强国竞争的焦点, 世界上许多国家都把建立制药学科视为国 家强盛的现状
• 中国医药工业的现状
药物合成反应
一 不饱和烃卤加成反应 1.卤素对烯烃的加成
(加成)
药物合成反应
F2:加成反应激烈,副产物多,实用性小; I2:C-I键不稳定,易消除,不实用; Cl2和Br2常用,重要,资源丰富,且活泼
程度适中,反应相对易控制; Cl2来自于氯碱工业,Br2来自于海洋。
药物合成反应
• (2)反应机理(两种机理,形成两类产品) • 以anti为主,但比例影响因素较多
• 在1999年制药工程专业招生时,全国共有 34所高等院校设置制药工程专业,其中医 药类院校13所,理工类院校12所,综合性 大学9所,招生人数为1165人。
• 2004年5月,国内已有121所高校设置了制 药工程专业,
药物合成反应
分布状况
• 制药工程专业在各省市的分布不是十分均衡的
• 最多的江苏省有10所以上的高校设置了制药工程 专业,但是全国却有近1/5的省、自治区则没有设 置该专业。
卤化反应

立体化学问题
H CH3 + Br2
H CH3
顺式
(a)
H CH3 Br Br H CH3
Br H CH3
(a)
H CH3
+ Br
(b) (b)
H Br CH3
H CH3 Br
CH3 Br H H Br
CH3
CH3 H Br Br H
CH3
环卤鎓离子也可以形成在氯或碘的加成中,但是氯的电负性较
+
C
CH 3
H
Cl
H C
CH 3 OAc
CH3-CH=CH 2 I2/KIO3CH 3-CH-CH 2I
93%
H2SO4/H2O OH
I2/AcOAg/Et2O
H
OAc I H
2. 卤素与烯烃的自由基加成 需要光或自由基引发剂催化。 光卤加成反应特别适用于双键上具有吸电子的烯烃、芳环。
例2:
H2C CHCN
EtO O
t-BuOCl/ROH
EtO O
Cl Cl ROH
OR
EtO O
三、N-卤代酰胺与烯烃的加成
1. 是制备β -卤醇的又一重要方法。 反应历程与次卤酸(酯)与烯烃的亲电加成类似。
2. 特点: 卤正离子由质子化的N-卤代酰胺提供,
— OH等负离子来自反应溶剂(H2O、ROH、DMSO、 DMF)。
CH3COOK
CH3OH/CaCl2
DMF
O
O
O
3.将卤素原子作为保护基、阻断基,用于提高反应的选择性
卤化反应的类型
不饱和烃的卤加成 饱和烷烃、芳香环上的卤取代
第一章 卤化反应 1.4
3
o
95%
BrH 2 C BrH 2 C CH 2 Br CH 2 Br
N aI/M e 2 C O 63%
90 h
磺酸酯的卤置换效果更好!!!
1.6.2 芳香重氮盐化合物的卤置换反应
A rN 2 X H X/C uX 注意:一价铜 ArX
+
N2
例子见书 Page47
NH 2 1. E tO C S K /2. H C l 2 OH N O Et Cl
BF 4
Et 3 OBF
HO
4
CO 2 Me
Br CO 2 Me
HO OSiR Br
3
Et 4 N B r o CH 2 Cl 2 /-15 20 min Br
OSiR Br CO 2 Me
1卤化反应0909

Cl
+ CH3CH CH C2H5 + CH3CH CH C2H5
Cl
OCOCH3
33%* 21%*
13%* 8%*
I2/AcOAg/Et2O
H OAc I
H
80%
1.1.1.5 卤素与烯烃的自由基加成
机理(略)
Cl
Cl Cl2/hv
Cl -HCl
Cl Cl
Cl 60~70oC
Cl Cl
Cl Cl
H3C H3C
B-r25/~I20(。 Fe)
CH3 CH3
Br
94~97%
CH3
Br
O CH3 Br
CH3 Br2 / Fe O CH3
CH3 Br2 / hv O CH3
H2 C
Br O CH3
OH Br2 Br H2O
B:-
OH Br
Br
OH
OH
OH
Br
N Br
O N Cl
O NBS: N-Bromo-succinimide
O NCS: N-chloro-succinimide
Ph
CH
CH2
NBS/H2O 25 , 35min
Ph CH CH2Br
OH
82%
难溶于水, 不易用次 卤酸水溶液
OH
21
18 20 O 12 CH3
HO
17 OH
11
13
19CH3 9
2 1 10
8
16 14 15
H
H
3
5
7
O
4
6
氢化可的松(Hydrocortisone)
Dalton反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章卤化反应Halogenation Reaction概述•不饱和烃的卤加成反应•烃类的卤取代反应•羰基化合物的卤取代•醇、酚和醚的卤置换反应•羧酸的卤置换反应•其它官能团化合物的卤置换反应第一节不饱和烃的卤加成•不饱和烃和卤素的加成反应(X-X)•不饱和羧酸的卤内酯化反应(X-OR)•不饱和烃和次卤酸(酯)、N-卤代酰胺的反应(X-OH、X-OR、X-Nu) •卤化氢对不饱和烃的加成反应(H-X)•不饱和烃的硼氢化-卤解反应(BH3-H)一、不饱和烃与卤素的加成反应(X-X)卤素与烯烃加成卤素与烯烃加成-机理(1)有稳定碳正离子的基团(供电子基团)可增加离子对形式机理,增加同向加成产物比例。
(2) Cl的极化性比溴小,不易形成桥氯正离子,同向加成更明显。
(3)立体空间结构受底物空间构型和位阻的影响。
(4)加成过程中可能有重排、消除反应发生,以正离子稳定性为动力。
(邻基参与重排)(5)亲核性溶剂影响加成产物,提高卤负离子浓度有利影响加成主产物。
(6)添加氧化剂将卤负离子氧化为分子,可影响加成产物。
(7)过硫酸氢钾(oxone)与氯化钠或溴化钠可迅速释放出Cl和Br,原位反应。
(8)除离子型加成外,自由基加成适合含吸电子基团的双键。
卤素与炔烃加成二、不饱和羧酸的卤内酯反应(X-OR)三、不饱和烃和次卤酸(酯)、N-卤代酰胺的反应(X-OH、X-OR、X-Nu)次卤酸及其酯为卤化剂N-卤代酰胺为卤化剂包括:N-溴(氯)代乙酰胺(NBA、NCA) N-溴(氯)代丁二酰亚胺(NBS、NCS)次卤酸及其酯为卤化剂(1)卤化剂(X-OH) :烯烃→β-卤醇(马氏定位)(2)次卤酸具有氧化性,需要新鲜制备。
方法:将Cl2或Br2在中性或含汞盐的碱性水溶液反应而成。
也可以采用次氯酸盐在中性或弱酸性条件下进行。
(3)次卤酸酯(ROX), 机理与次卤酸相同,可在非水溶液中进行,得到β-卤醇衍生物。
N-卤代酰胺为卤化剂(1)加成反应相似于卤素加成反应,提供卤正离子,负离子来自于溶剂(2)NBS/DMSO可生成β-溴醇或α-溴酮(3)在N-卤代酰胺和不饱和烃的反应中,添加卤负离子可生成1,2-不同卤素取代产物。
四、卤化氢对不饱和烃的加成反应(H-X)卤化氢对烯烃的加成(1)反应活性和立体选择性取决于烯烃结构和卤化氢活性。
提高负离子浓度有利。
(2)反应机理:离子对机理(同向加成)、三分子协同反应机理(对向加成)。
(3)烷基重排和溶剂分子参与(4)自由基加成反应卤化氢对炔烃的加成五、不饱和烃的硼氢化-卤解反应烯烃→(硼氢化)→(卤解)→加成产物(反马氏定位)试剂:B2H6,BH3/THF, BH3/Me2S等(1)烯烃硼氢化得到三烷基硼烷,在卤解得到卤代烷,置换过程中发生构型反转。
(2)炔烃硼氢化得到烯基硼烷,再得到溴代烯烃(3)硼烷取代基可影响烯烃产物的顺、反构型。
第二节烃类的卤取代反应•脂肪烃的卤取代反应•芳烃的卤取代反应一、脂肪烃的卤取代反应饱和脂肪烃的卤取代反应光卤取代反应,卤化剂:卤素、N-卤代仲胺烯丙位和苄位碳原子上卤取代反应-知识点(1)苄位和烯丙位上有推电子取代基,可增加自由基稳定性,易发生卤取代反应。
(2)开链烯烃中,烯键α位亚甲基活性大于α位甲基活性(3)可发生双键移位或重排,使得自由基更稳定(4)NBS(NCS)作为卤化剂具有选择性高、副反应少等优点。
二、芳烃的卤取代反应反应机理和主要条件芳烃亲电取代反应历程:δ-络合物中间体亲电试剂:(1)被极化的卤素分子(2)其它形式的亲电试剂(3)卤化剂提供的卤正离子(4)催化剂作用下极化的卤素分子卤化剂活性:Cl2>BrCl>Br2>ICl>I2常用路易斯酸:AlCl3、SbCl5、FeCl3、FeBr3、SnCl4、TiCl4、ZnCl2反应溶剂:稀HAc、稀HCl、CHCl3或其它卤代烃氯、溴卤取代反应•Cl2 对芳基卤取代比较容易(一级反应),用路易斯酸催化反应更快,其它可释放氯正离子的亲电试剂:HOCl、CH3CO2Cl。
•Br2 (二级反应)必须用另一分子溴来极化溴分子,再进行正常溴代反应,反应中加入I2可提高反应速度。
(HAc为溶剂)其它溴化剂包括NBS、HOB等。
路易斯酸可以催化溴分子生成溴正离子。
氯、溴卤取代反应-知识点(1)芳环上取代基电子效应和卤代定位规律(2)芳环上供电子基团使卤化反应更容易,控制条件可得到单卤、双卤产物。
(3)芳环上吸电子基团一般用路易斯酸催化,反应温度高。
或选用活性较大的卤化剂。
(4) 含多余π电子的杂环卤代反应甚易,次序为:吡咯>呋喃>噻吩>苯。
(5)缺π电子的芳杂环,卤取代相当困难。
碘取代反应单独用I2对芳烃进行碘取代反应效果不好,a.加入氧化剂或碱性缓冲物质b.与HI形成难溶于水的碘化物的金属氧化物c.采用强碘化剂提高碘正离子浓度均有效。
第三节羰基化合物的卤取代反应醛和酮的α-卤取代反应烯醇和烯胺衍生物的卤化反应羧酸衍生物的α-卤取代反应一、醛和酮的α-卤取代反应1. 酮的α-卤取代反应卤化剂:卤素分子、N-卤代酰胺、次卤酸酯、硫酰卤化物等。
溶剂:四氯化碳、氯仿、乙醚、醋酸等。
一般说来、羰基化合物在酸或碱催化下,转化为烯醇才能和亲电的卤化剂进行反应。
酮的α-卤取代反应-催化机理酸催化机理:碱催化机理:羰基α-位取代基的影响•酸催化,若α位上具有推电子取代基,有利烯醇的稳定化,卤取代反应比较容易。
若α位上具有吸电子基团,卤化反应受阻。
•碱催化(相反)若α位上具有推电子取代基,降低α氢活性;若α位上具有吸电子取代基有利于α氢质子脱去而促进反应。
特殊卤化剂试剂:•四溴环己二烯酮•5,5-二溴代-2,2-二甲基-4,6-二羰基-1,3-二噁烷和5,5-二溴代丙二酰脲•三氯氰尿酸(TCC)•CuX2/AlCl3•I2/CaO2.醛的α-卤取代反应酸/碱催化,醛基碳原子和α-碳原子上的氢都可以被卤素取代,而且能产生其它缩合等副反应。
二、烯醇和烯胺衍生物的卤化反应•烯醇酯的卤化反应•烯醇硅烷醚的卤化反应•烯胺的卤化反应1.烯醇酯的卤化•转化方法:醋酐或醋酸异丙烯酯在酸催化下将不对称酮转化为烯醇醋酸酯,反应得到两个烯醇酯异构体混合物。
以取代较多的烯醇酯为主(热力学)。
•可以先分离两个烯醇酯异构体,在进行卤化,常用卤化剂为卤素、N-卤代酰胺等。
•I2/AcOTl 可得到α-碘代酮。
2.烯醇硅烷醚的卤化反应•烯醇硅烷醚β-碳原子的亲核性比烯醇酯更强,卤化反应也更容易。
•可选择不同条件来获得主要产物分别为动力学控制或热力学控制的烯醇硅烷醚。
•常用卤化剂:卤素、SO2ClF、I2/AcOAg/R3NHF。
3.烯胺的卤化反应•酮的烯胺衍生物的亲核能力比母体结构强,且区域选择性常不同于母体羰基化合物或其烯醇衍生物,常用与不对称酮的选择性α-卤代反应。
•卤化剂:卤素、六氯丙酮三、羧酸衍生物的α-卤取代反应•属于亲电取代机理。
酰卤、酸酐、腈、丙二酸及其酯的α-氢原子活性较大,可直接卤化。
其它羧酸可转化为酰卤再卤化。
•强碱作用可生成活性较大的烯醇β-碳负离子,然后温和卤化。
•常用卤化剂:卤素、N-卤代酰胺等。
第四节醇、酚和醚的卤置换反应醇的卤置换反应酚的卤置换反应醚的卤置换反应一、醇的卤置换反应卤化氢或氢卤酸为卤化剂(HX)卤化亚砜为卤化剂(SOCl2、SO2Cl2)卤化磷为卤化剂(PX3、PX5)有机磷卤化剂(PR3)其它卤化剂卤化氢或氢卤酸为卤化剂•醇羟基活性:烯丙基醇>苄醇>叔醇>仲醇>伯醇(与碳正离子稳定性有关)•氢卤酸或卤化氢的活性:HI>HBr>HCl>HF•取代过程中可能出现重排副产物。
亲核取代机理卤化亚砜为卤化剂卤化磷为卤化剂有机磷卤化剂其它卤化剂二、酚的卤置换反应•酚羟基活性小,卤化剂HX、SOCl2 均不理想。
一般必须采用PX5或POX3(兼作溶剂)合用,且剧烈的条件。
•缺π电子杂环上羟基的卤置换反应相对容易。
三、醚的置换反应•醚在HX作用下生成卤代烃和醇。
第五节羧酸的卤置换反应羧羟基置换•卤化磷、卤化亚砜为卤化剂•草酰氯为卤化剂•三苯膦卤化物为卤化剂•其它卤化剂羧酸的脱羧置换反应羧酸的卤置换卤化磷、卤化亚砜为卤化剂•卤置换反应活性:脂肪羧酸>芳香羧酸芳环上:供电子取代基>未取代>吸电子取代基卤化磷•PCl5活性大,适合活性较小的羧酸转化为酰卤,尤其适用具有吸电子基芳酸或芳香多元酸。
副产物POCl3可分馏除去。
•PX3活性略小,适用脂肪酸的卤置换,副产物亚磷酸可与酰氯分离。
•POCl3活性更小,主要与活性大的羧酸盐反应很少应用。
•PCl5活性大,适用于吸电子基芳酸•PBr3/PCl3活性较小,一般用于脂肪羧酸氯化亚砜•由羧酸制备酰氯最常用有效试剂。
优点:沸点低、易蒸馏回收、副产物为HCl和SO2,产品易纯化。
操作简单,对其它官能团影响小。
•除去本身可作溶剂外,苯、石油醚、二硫化碳等也可为溶剂。
•少量吡啶、DMF、ZnCl2可作为催化剂。
草酰氯为卤化剂•分子中具有对酸敏感的官能团或酸性下易发生构型变化的羧酸,一般不宜用无机酸酰氯为卤化剂,须在中性条件下进行卤置换反应。
采用草酰氯和羧酸或其盐之间的交换反应。
三苯膦卤化物为卤化剂•羧酸与PPh3/CCl4一起加热生成相应的酰卤,不经分离继续和胺反应生成酰胺,利用这个方法可合成肽类化合物。
其它卤化剂•α,α-二氯甲基醚•氰尿酰氯•六氟环氧丙烷•四甲基-α-卤代烯胺羧酸的脱羧置换反应•汉斯狄克反应:羧酸银盐和Br或I反应,脱去CO2,生成少一个碳原子的卤代烃。
•克利斯托反应:羧酸、过量HgO和卤素直接反应,光照条件更优。
•柯齐反应:羧酸、LiCl、Pb(OAc)4加热脱羧,生成少一个碳原子的卤代烃。
没有重排等副反应。
Hunsdriecker(汉斯狄克)反应:第六节其它官能团化合物的卤置换反应•卤化物的卤素交换反应•磺酸酯的卤置换反应•芳香重氮盐化合物的卤置换反应一、卤化物的卤素交换•有机卤化物与无机卤化物之间进行卤原子交换反应。
•大多属于SN2机理。
卤素的亲核能力取决于在不同溶剂中的溶剂化程度。
质子溶剂中I的亲核能力最大,F的亲核能力最小,而在非质子溶剂中F可变成很强的亲核试剂。
•常用溶剂:DMF、丙酮、四氯化碳、二硫化碳或丁酮等非质子性溶剂。
卤化物的卤置换常用催化剂•Ni或NiBr2.3H2O催化Br/I和Cl/I的交换反应,由此制备某些用其它方法难以得到的碘代烷。
•SnCl4可直接将溴代烷转化为氯代烷;•BBr3可将氯代烷转化为溴代烷;•BiBr3(BiCl3)可分别将仲、叔和烯丙位、苄位碘(溴)代烷转化为溴(或氯)代烷,且不会发生重排和脱卤副反应。
