有机合成项目总结汇总
有机合成知识点总结大学

有机合成知识点总结大学一、碳-碳键的构建有机合成中最基本的反应是碳-碳键的构建。
碳-碳键的构建反应包括以下几种:1. 亲核加成反应亲核加成反应是有机合成中最为基本和常见的反应之一,利用碱或亲核试剂与电子不足的双键结构发生加成反应,构建新的碳-碳键。
常见的亲核试剂有水、醇、醚、胺等,通过与双键结构发生加成反应,构建出碳-碳键。
例如:烯烃与水发生加成反应生成醇,烯烃与醇醚生成醚,烯烃与胺发生加成反应生成胺。
亲核加成反应在合成醇、醚、胺等有机化合物中有着广泛的应用。
2. 云母反应云母反应是一种碳-碳键构建的重要手段,利用碱金属作为催化剂,使芳香烃和卤代烃发生反应,形成新的碳-碳键。
云母反应是有机化合物合成中最重要的反应之一,通过云母反应可以合成出许多重要的有机化合物,如苯、甲苯、邻甲基苯酚、密苯二氧醇等。
3. 消除反应消除反应是有机合成中另一种常见的碳-碳键构建手段,通过消除反应可以将一个或多个基团从有机分子中去除,从而形成新的碳-碳键。
消除反应包括β-消除,α-消除,氢氟酸消除等,通过这些消除反应可以构建出新的碳-碳键结构,制备出多种有机化合物。
4. 分子内环化反应分子内环化反应是一种特殊的碳-碳键构建反应,利用分子内的官能团发生反应,形成新的碳-碳键。
分子内环化反应在合成环烷烃、环醚、环酮等有机化合物中有着广泛的应用,是有机合成中的重要手段之一。
二、碳-氢键的官能团转化除了碳-碳键的构建,有机合成中还涉及到碳-氢键的官能团转化。
碳-氢键的官能团转化是通过一系列化学反应将碳-氢键上的氢原子转化为其他官能团的过程,常见的官能团转化方式包括以下几种:1. 氧化反应氧化反应是一种常见的碳-氢键官能团转化方式,通过氧化剂(如过氧化氢、高锰酸钾等)将碳-氢键上的氢原子氧化成羟基或醛基。
氧化反应在有机合成中有着广泛的应用,可以将碳-氢键转化为羟基和醛基,构建出多种重要的有机化合物。
2. 还原反应还原反应是一种将有机化合物中的功能团还原为碳-氢键的反应,通过还原剂(如亚硫酸钠、氢气、氢化钠等)将功能团还原为碳-氢键。
高一化学必修2有机化合物合成方法总结精编

高一化学必修2有机化合物合成方法总结
精编
一、醇的合成方法
1. 羟基化合物的合成:群醇和烷基锂反应生成醇;烷基卤化物经醇钠法生成醇。
2. 醚的合成:醇和酸的酯化反应生成醚;醇和烷基卤化物反应生成醚。
二、酮和醛的合成方法
1. 酮的合成:醇和酸的酯化反应生成酮;醇和醛的缩合反应生成酮。
2. 醛的合成:烷基卤化物和水合肼氨反应生成肼盐,再氧化为醛。
三、羧酸和酯的合成方法
1. 羧酸的合成:醇和酸酐反应生成羧酸;卤代烃和盐酸反应生成羧酸。
2. 酯的合成:酸和醇酯化反应生成酯;酸和烷基卤化物醚化反应生成酯。
四、胺和酰胺的合成方法
1. 胺的合成:卤代烃和氨缩合反应生成胺;硝基化合物还原生成胺。
2. 酰胺的合成:酰氯和胺反应生成酰胺;酰氯和铵盐反应生成酰胺。
总结:
有机化合物的合成方法多样,其中醇、酮和醛、羧酸和酯、胺和酰胺的合成方法较为常见。
了解这些合成方法有助于学生掌握有机化合物的制备过程和反应规律,进而提高化学实验操作能力和理论知识水平。
以上是高一化学必修2有机化合物合成方法总结精编,希望对你有所帮助。
大学有机化学有机合成全面总结

OH
α -氰 醇
α -羟 基 酸
应用范围:醛、甲基脂肪酮 、C8以下环酮
2. 增加二个碳原子的反应
R MgX + CH2 CH2 O
R CH2CH2 H3O+ RCH2CH2OH OMgX
3. 增加多个碳原子的反应
① R-C CH NaNH2 R-C CNa R/X R-C C-R/
其中:R/ 为伯卤代烃 X 为Cl、Br、I
H2O / OH- PX3 Mg
NH3 R-NH2
R-MgX
R-X
① ②
CO2 H3O+
R-COOH
H3O+
NaCN
R-CN
R-NH2 R-NHR
[H]
R-CH2NH2
R-X
R-NR2
2. 羧酸及其衍生物的转换
R-COCl
NH3
R-CONH2
R/OH
R-COOH
NH3
R-COOR/
R/OH
(RCO)2O
H2SO4 H2O
① (BH3)2 ② H2O2 /
OH-
R-CH-CH3(符合马氏规则) OH
R-CH2CH2OH(反马氏规则)
[H]
② R-C=O H(R/) [ O ]
R-CH-OH H(R/)
[ H ] = LiAiH4 、NaBH4 、 H2 / Ni、Pt、Pd等
③ R-COOR/ [ H ] R-CH2OH + R/OH [ H ] = LiAiH4 、C2H5OH + Na 、 H2 / Ni、Pt、Pd等
R-NH2
● 碳环的合成
① 双烯合成(D-A反应)
X△
-X
有机化学合成总结

有机化学合成总结1.饱和脂肪烃(1).偶联反应(2).醛、酮还原(3).烯烃、炔烃还原2. 不饱和脂肪烃 一、烯烃合成 (1).醇脱水(2).卤代烷脱卤化氢(3).邻二卤化合物脱卤化氢(4).炔的还原RORR-XR-R RCCRRCH 2-CH 2RRCH=CHR RCH 2-CH 2RCH=CH 2R RCH2-CH 2-OHR-CH 2CH2XR-CH=CH 2R-CHX-CH 2XR -CH=CH 2(5).Wittig 反应二、炔烃合成 (1)从其它炔烃(2)通过二卤消除反应3.卤代烃(1)烷烃的卤代(2)不饱和烃和卤化氢或卤素加成(3)从醇制备C CR1R2RHCOR1R2R-CH=P(Ph)3R-C C-R 1R-CR1XCH R-C CR 1R-C-C-R 1X H H XRX RHX 2R-CH-CH 2XR-CH=CH 2R-CH=CH 2R-CH CH 2X X X 2RXROHX-G(4)卤素的置换 4.醇(1) 烯烃水合C-CH 2OH H RHR-CH=CH 2OH 2(2)硼氢化-氧化(3).醛,酮,羧酸及其酯还原(4) 从格利雅试剂RCl NaIRI R-CH 2CH 2OHR-CH=CH 2(BH 3)2C-CH 2OHH RHR-CH=CH 2R-CH 2OHRCHOR-COOH RCOOR 1RROR ROHR-CH 2-OHRMgXCH 2O RH R1ORMgX R 1CHOR 1MgX RCHORR2R1ORMgX R 1R 2CO R 1MgXRR2CO(5)卤烃水解5.醚(1)从醇去水(2)威廉森合成法6.酚的合成(1)从芳卤衍生物(2)从芳磺酸(3)重氮盐水解7.醛酮(1).醇的氧化和脱氢(2).炔烃的水合R-CH2OH R-CH2XOHR-O-RR-O-R1RXRONa OHNO2NO2ClNO2NO2SO3Na OHNH2OHR-C-R'OHHR-C-R'OR-C C-R R-C-CH2RO(3).同碳二卤化合物水解CH 3OCX 2CH 3(4).傅-克酰基化反应(5).芳烃侧链的氧化(6).β-二羰基化合物8.醌(1)二元酚氧化(2).苯胺氧化9.羧酸及其衍生物和取代酸R(Ar)OR(Ar)COClCHOCH 3OHOHOOOO NH 2CH 3O CH 2R CH 3O CH 2O OC 2H 5RXCH 3O CHR 1R 2CH 3OCH 2OOC 2H 5R 1XR 2X一、酸(1).从伯醇或醛制备(2).从烃氧化(3).从格利雅试剂制备(4).腈水解(5).苯甲酸制备6.β-二羰基化合物二、羟基酸(1).从羟(基)腈水解R C O HR-CH 2OH R C OOHCOOHRR-MgX R-COOH CO2R-CN R-COOH CH 3CCl3COOH RCHO HCN R C COOHOHHHO O CH 2R C 2H 5O O CH 2O OC 2H 5RX O H O CHR 1R 2C 2H 5O O CH 2O OC2H5R 1X R 2X(2).从卤代酸水解(3).雷福尔马茨基反应ZnBrCH 2COOC 2H 5R-CHORCHCH 2COOHOH9. 含氮化合物一、硝基化合物 (1)芳烃和硝酸反应:二、胺类化合物(1).从硝基化合物还原(2).氨的烷基化(3).腈和酰胺的还原(4).醛酮的还原胺化(5).霍夫曼酰胺降级反应(6).盖布瑞尔合成法Cl-CH 2COOHCH 2-COOHOHNO 2NO2NH 2RNH 2RXR 2NHR-CNR-CH 2NH 2R-CH 2-NH-R 1R-CHONH 2-R 1R 1CONH 2RNH 2NHORNH 2RX。
有机合成实验工作总结报告

有机合成实验工作总结报告
实验目的,通过有机合成实验,掌握有机合成的基本原理和技术,提高有机合
成实验操作技能。
实验原理,有机合成是指通过一系列化学反应,将简单的有机化合物转化为复
杂的有机分子的过程。
有机合成实验通常包括反应物的准备、反应条件的选择、反应的进行和产物的分离纯化等步骤。
实验步骤:
1. 反应物的准备,首先需要准备好反应所需的有机化合物和试剂,保证其纯度
和质量。
2. 反应条件的选择,根据反应的特性和要求,选择适当的反应条件,包括温度、溶剂、催化剂等。
3. 反应的进行,将反应物按照一定的摩尔比例加入反应容器中,控制反应条件,观察反应的进行。
4. 产物的分离纯化,通过适当的分离技术,如萃取、结晶、蒸馏等,将产物从
反应混合物中分离出来,并进行纯化。
实验结果与分析:
在本次实验中,我们成功合成了目标产物,并通过NMR、IR等手段对产物进
行了表征和分析。
结果表明,产物的结构符合预期,纯度较高。
实验总结:
通过本次有机合成实验,我们深入理解了有机合成的基本原理和技术,掌握了
有机合成实验操作技能。
同时,也意识到了实验中反应条件的选择和产物的分离纯化对实验结果的影响,为今后的有机合成实验打下了良好的基础。
总之,有机合成实验是化学专业学生必不可少的实验环节,通过实践操作,我们能够更好地理解有机合成的原理和技术,提高实验操作技能,为将来的科研工作和实际应用打下坚实的基础。
精细有机合成 总结

第1章 绪论/1、精细化工及相关行业的概念初始原料:煤、石油、天然气、生物有机质(农林副产) 基础有机原料:乙烯、丙烯、丁二烯、苯、(甲苯)、二甲苯、(乙炔、萘)、合成气(CO + H2)等。
2.2 亲电取代反应→ 2.2.3 芳香族亲电取代定位规律→(1)影响定位的主要因素 2.2.3 芳香族亲电取代定位规律 (1) 影响定位的主要因素■ 已有取代基的性质: ①极性效应 ②空间效应■ 亲电试剂的性质——也包括: ①极性效应 ②空间效应 ■ 反应条件:主要-温度、催化剂和溶剂。
上述因素中,最重要的是已有取代基的极性效应。
芳香取代反应中,苯系亲电取代反应研究的最多,也最重要。
2.2 亲电取代反应→ 2.2.3 芳香族亲电取代定位规律→(2)两类定位基 (2)两类定位基已有取代基 Z 对新取代基 E 的定位作用有两种:■第一类定位基 邻、对位定位基:-O-、-N(CH3)3、-NH2、-OH 、-OCH3、-NHCOCH3、-OCOCH3、-F 、-Cl 、-Br 、 -I 、 -CH3、-CH2Cl 、-CH2COOH 、-CH2F 等。
■第二类定位基间位定位基:-N+(CH3)3、-CF3、 -NO2、-C≡N 、 -SO3H 、-COOH 、-CHO 、-COOCH3、-COCH3、-CONH2、-N+H3、-CCl3。
上节回顾 2.2 亲电取代反应芳香族亲电取代反应历程大多数亲电取代反应是按照经过σ配合物中间产物的两步历程进行的。
其通式如下:2.3 亲核取代反应→ 2.3.2 反应影响因素→(4)溶剂的影响 (4)溶剂的影响SN1反应的第1步是一个中性的化合物离解为两个带有不同电荷的离子,因此极性溶剂有利于反应的进行。
SN2反应中,因为极性溶剂与亲核试剂可以形成氢键,亲核试剂与反应物形成过渡态时,必须首先消耗能量破坏氢键,所以反应在不形成氢键的溶剂中进行,反应速度较快。
2.4 消除反应→ 2.4.3 影响消除反应的因素→(2)反应条件的影响■ 温度的影响:提高温度有利于消除反应。
有机合成项目总结

实验操作过程
实验操作:按照实验方案进 行实验操作,记录实验数据
试剂准备:准备所需的化学 试剂和仪器设备
实验设计:根据项目需求, 设计实验方案和步骤
数据分析:对实验数据进行 分析和处理,得出实验结果
实验优化:根据实验结果, 对实验方案进行优化和改进
实验报告:撰写实验报告, 总结实验结果和经验教训
数据记录与分析
提高有机合成效率 降低生产成本 提高产品质量 保护环境,减少污染 促进行业发展,提高企业竞争力
实验设计及方法
实验目的:确 定有机合成项 目的目标产物
和反应条件
实验方法:采 用化学合成、 生物合成、物 理合成等方法
实验步骤:包 括反应物制备、 反应条件优化、 产物分离纯化
等
实验结果:分 析实验数据, 评估实验效果, 确定最佳反应 条件和产物纯
产物的应用:在工业生产、科 学研究等领域的应用
产物的创新点:与现有产品的 区别和创新点,如新的合成方 法、新的应用领域等
合成策略的创新性
采用新型催化剂,提高反应效 率
设计新颖的反应路线,简化合 成步骤
利用绿色化学原理,减少环境 污染
开发新型合成方法,提高产品 质量和稳定性
实验技巧与经验总结
实验设计:合理设计实验步骤,提高实验效率 实验操作:熟练掌握实验操作技巧,提高实验成功率 数据分析:准确分析实验数据,得出可靠结论 问题解决:善于发现和解决实验过程中遇到的问题,提高实验质量
实验过程中遇到的问题与挑战
反应条件控制:需要精确控制温度、压力等条件,确保反应顺利进行
产物分离:需要采用合适的分离方法,如蒸馏、萃取等,以获得纯度高的产物
反应时间控制:需要精确控制反应时间,避免反应过度或反应不完全
有机合成总结

每个行业都有自己的基本功,有机合成的基本功就是对有机化学反应的理解掌握与灵活运用。那么对有机化学反应的理解掌握应从那方面入手?你在大学里学到的有机合成知识,只是入门的东西,远远达不到高手的水平,学了四年化学,基本上不理解化学。遇到问题还是束手无策,不知从何处下手。这不是你的问题,而是大学教育体制的问题,在大学阶段应该打下坚实的基本功,然后才能专,而我们的大学在这方面还做的远远不够。下面我推荐几本有机合成方面的书籍希望能够达到上述的目的:
中和萃取法:是工业过程和实验室中常见的方法,它利用酸碱性有机化合物生成离子时溶于水而母体分子状态溶于有机溶剂的特点,通过加入酸碱使母体化合物生成离子溶于水实现相的转移而用非水溶性的有机溶剂萃取非酸碱性杂质,使其溶于有机溶剂从而实现杂质与产物分离的方法。
成盐法:对于非水溶性的大分子有机离子化合物,可使有机酸碱性化合物在有机溶剂中成盐析出结晶来,而非成盐的杂质依然留在有机溶剂中,从而实现有机酸碱性化合物与非酸碱性杂质分离,酸碱性有机杂质的分离可通过将析出的结晶再重结晶,从而将酸碱性有机杂质分离。对于大分子的有机酸碱化合物的盐此时还可以采用水洗涤除去小分子的酸碱化合物已经成盐且具有水溶性的杂质。对于水溶性的有机离子化合物,可在水中成盐后,将水用共沸蒸馏或直接蒸馏除去,残余物用有机溶剂充分洗涤几次,从而将杂质与产品分离。
下面推荐的几本杂志,主要是关于如何运用有机化学反应的。
anicsynthesis(80vol.)
anicProcessResearch&Development.
这是美国化学会出版的一本有机合成杂志,主要讲述一些化工产品的工艺研究,书中的反应均用在大规模的制备上,对产业化的研究很有帮助,这些反应具有很强的实用性,对理解化学反应的应用很有帮助。
有机合成总结

精心整理有机合成心得(1)-引言灵活的头感觉最深刻的是关键要有一个灵活的头脑和丰富的有机合成知识,搞了十余年药物研发,只有有机合丰富的有机合成知识是靠大量的阅读和高手交流得到的。
二者缺一不可,脑是天生的,也就没有创充其量只是有机合成匠人,成不了高手,成知识而没有灵活的头脑把知识灵活的应用,一个有机合成高手在头脑中掌握的有机化学只能做无米之炊。
造性。
只有灵活的头脑而没有知识,个以上,并能灵活的加以运用,熟悉其中的原理(机理),烂熟于胸,就像国学300反应最少应大师烂熟四书五经一样,看到了一个分子结构,稍加思索,其合成路线应该马上在脑中浮现出来有机合成心得)-基本功的训每个行业都有自己的基本功有机合成的基本功就是对有机化学反应的理解掌握与灵活运用么对有机化学反应的理解掌握应从那方面入手?你在大学里学到的有机合成知识,只是入门的西,远远达不到高手的水平,学了四年化学,基本上不理解化学。
遇到问题还是束手无策,不知然而是大学教育体制的问题在大学阶段应该打下坚实的基本功何处下手。
这不是你的问题下面我推荐几本有机合成方面的书籍希望能够才能专而我们的大学在这方面还做的远远不够到上述的目的有机化学反应的理解掌握方面的书籍sadvancedorganicchemistry1.Marc化2.Carey,F.A.;Sundberg,R.J.:Advancedorganicchemistry3.MichaelB.Smith:O rganicsynthesisrock:Comprehensiveorganictransformation黄宪:新编有机合成化56李长轩:有机合成设两本书是从官能团转变的角度讨论有机合成的前三本书是从机理方面来讨论有机合成的4认真精作为案头书。
6本书是讨论有机合成路线设计的。
以上几本书应该随时放在自己的身边,第读,达到记忆理解,把反应分类记忆理解,这时你可能感觉很枯燥乏味,不要紧,经过一段时间的可以说您已经打下合成研究再回过头来阅读,就会感觉耳目一新,有新的理解。
有机合成项目总结汇总
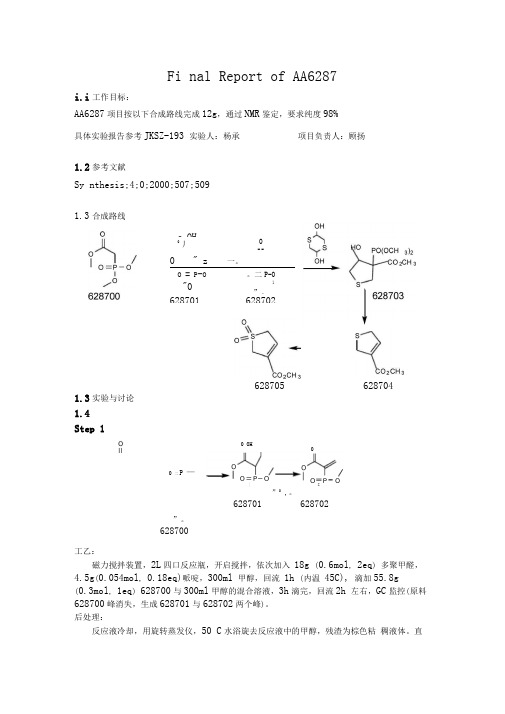
Fi nal Report of AA6287i.i 工作目标:AA6287项目按以下合成路线完成12g ,通过NMR 鉴定,要求纯度98%具体实验报告参考JKSZ-193 实验人:杨承项目负责人:顾扬1.2参考文献Sy nthesis;4;0;2000;507;509 1.3合成路线1.3实验与讨论 1.4 Step 1”。
628700工乙:磁力搅拌装置,2L 四口反应瓶,开启搅拌,依次加入 18g (0.6mol , 2eq ) 多聚甲醛,4.5g (0.054mol , 0.18eq)哌啶,300ml 甲醇,回流 1h (内温 45C), 滴加55.8g(0.3mol , 1eq ) 628700与300ml 甲醇的混合溶液,3h 滴完,回流2h 左右,GC 监控(原料628700峰消失,生成628701与628702两个峰)。
后处理:反应液冷却,用旋转蒸发仪,50 C 水浴旋去反应液中的甲醇,残渣为棕色粘稠液体。
直c OH丿0 II0 " z一。
O = P -O。
二P-0"0 1”。
6287016287026287056287040 二P —| I”0 ,。
6287016287020 OH接往后反应。
备注:甲醛和甲醇混合液回流,冷凝水需要用冰水原料GC 谱图::?P r-li 2CJC9-02-1S. 1JH6.22-Jtzzzez-Ter =pu= 1:i匚 二::'\l " I\¥ '-'\M6:37\:W90213 AA62S7O0,吃曹内齐PJ ft i.250 £b Inis- 15 Eic -250 . • 加匸 」丨• 2S0亠■ ■ • . 30*0. 52 ■ D. 2530G 20&260-34Q22H 20D180Z 160-"14&M皿 M6n-4Q 2a:|J 
有机合成个人工作总结有机合成是有机化学领域的重要研究方向,在过去的一段时间里,我积极参与了有机合成的实验工作,并取得了一些成果。
现在我将对我的个人工作进行总结。
首先,我在有机合成实验中掌握了多种有机合成反应的操作技能,比如取代反应、加成反应、酯化反应等。
通过不断的实践和研究,我对这些反应的原理和机理有了更深入的理解,能够熟练地操作各种反应条件,并且能够根据实验需求做出相关反应的优化设计。
其次,在实验中,我深入研究了一些有机合成的反应机制和合成路线,通过对相关文献的梳理和实验的验证,不断探索出一些新的合成方法和新领域的应用。
在此过程中,我积累了一定的实验技术和研究经验,对有机合成领域的发展方向有了更清晰的认识。
除此之外,我还积极参与了实验室的团队合作工作,和其他同事共同研究实验方案,进行实验数据的交流和讨论,共同解决实验中的问题。
通过这种合作模式,我不仅提高了自己的实验技能,还锻炼了团队合作的能力,更好地适应了实验室的工作环境。
总的来说,我在有机合成的工作中不断学习和成长,通过实验积累了丰富的实验经验和研究成果,在今后的工作中,我将继续努力,深入研究有机合成领域,为科学研究做出更大的贡献。
有机合成是有机化学领域中最为重要的研究方向之一,它为我们提供了各种各样的有机分子,这不仅对药物研发、材料科学和农药研究等领域具有重要意义,同时也为我们提供了更多关于化学反应机理和原理的深入理解。
在我近期的有机合成工作中,我积极参与了实验室的有机合成研究,并取得了一些成果。
首先,通过参与实验室的各项研究,我掌握了许多重要的有机合成技术,包括取代反应、加成反应、环化反应、氧化还原反应等。
我逐渐熟练掌握了这些反应的操作技能,也理解了不同反应条件对产物的影响,对于如何选择最佳的反应条件进行优化设计有了更深入的认识。
其次,我对有机合成反应向来持着浓厚的兴趣,并且深入研究了一些反应的机理和合成路线。
通过对相关文献的综合分析和自身的实验验证,我尝试找出合成路线中不足的地方并进行改进。
有机合成知识点总结

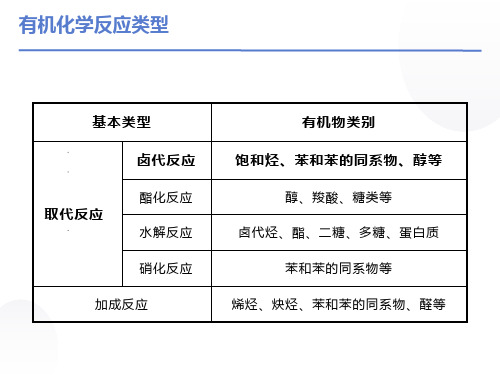
有机合成知识点总结1.有机反应的类型有机合成中常见的反应类型包括取代反应、加成反应、消除反应和重排反应等。
其中,取代反应是通过一个原子或官能团替换另一个原子或官能团的反应,常见的有氯代反应、氢代反应和硝基代反应等。
加成反应是指两个或多个分子之间发生加成反应形成一个新的分子,如烯烃的加成反应、醛酮的加成反应等。
消除反应是指一个分子中的两个原子或官能团结合成一个新的分子,如醇的脱水反应、脱羧反应等。
重排反应是指一个分子中的原子或官能团内部重新排列形成一个或多个新的分子。
2.有机合成的基本策略有机合成的基本策略包括合成途径的选择、合成路线的设计和合成步骤的优化等。
在合成途径的选择方面,化学家需要选择合适的反应类型和反应条件,以在尽可能少的步骤内合成目标化合物。
在合成路线的设计方面,化学家需要根据目标化合物的结构和性质,设计出合适的合成路线,确定各个合成步骤的顺序和条件。
在合成步骤的优化方面,化学家需要考虑反应的选择性、收率和原料的可获得性等因素,以最大程度地提高合成效率。
3.保护基团和去保护在有机合成中,由于目标化合物中的一些官能团对某些反应条件具有敏感性,容易发生副反应或者失活,因此需要采取保护基团的策略来保护这些官能团。
保护基团的引入通常需要使用特定的保护试剂和条件。
而在合成的后续步骤中,需要去除保护基团,回复原有的官能团,这就是去保护反应。
保护基团和去保护反应是有机合成中非常重要的策略之一。
4.立体化学在有机合成中,立体化学是一个非常重要的知识点。
有机化合物的立体结构对其化学性质和生物活性有着重要影响。
因此,合成化学家需要考虑控制合成过程中的立体构型和手性度,以获得特定的目标化合物。
在有机合成中,常见的手性合成策略包括手性诱导剂的使用、手性催化剂的应用和手性直接合成等。
5.活化基团和功能团的互变在有机合成中,有时需要在某些官能团上引入新的官能团,或者将一个官能团转化为另一个官能团,这就需要采用活化基团和功能团的互变策略。
有机合成,工作总结

有机合成,工作总结篇一:有机合成阶段性总结有机合成阶段性总结【有空就会更新】★★★xiejianwu(金币+2,VIP+0):不错,好经验,值得鼓励!枫叶子XX(金币+1,VIP+0):支持原创!有机合成小结三个月了,一直忙的没有时间来这里见见老朋友叙叙旧,今天又一个课题提前二十五天结题,我的转正申请也经过了主管的批准,终于有时间来这里逛一会了,心情不错就想把最近在工作中遇到的问题和产生的一些想法给大家汇报一下。
来到这里,对于一个陌生的环境我还是有点不适应,所以接到的第一个题没有什么难度,其中遇到了一个比较弱的问题,不过也没有什么不好意思,所以也给大家说说,就是整个路线中要一个席夫碱作中间体,就是在席夫碱的纯化上出了些问题。
这个席夫碱是一个氨基酸酯和一个酮反应合成的,其中有一个反应物总是会留到最后反应不完需要过柱纯化。
在整个反应过程中我是用TLC(硅胶板)检测的,杂质和产品分的很好,所以反应结束后我就准备用硅胶柱过柱纯化,但最后总是拿不到纯品,里面始终有酮,这个问题一开始我一直以为是收产品的锥形瓶被前面收到的酮给污染了(在TLC上酮在前面,产品在后面),重复分离一次后还是老样子,看来不是污染的事。
这是怎么回事?反应很好就是拿不到纯品,就好像星星就在指尖却怎么也够不着,整个一天就这么想这个问题。
后来想反正最后要在酸性条件下脱去酮的保护,要不就这么一锅投下去吧,不分离了,就在这么一瞬间我突然想到了硅胶的酸性,是不是硅胶的酸性也可以这样把席夫碱分解了?这样问题总算是找到了答案。
现在看来,当时出这样的问题很不应该。
接下来就接到了一个在其它实验室做了几个月但没有结果的题(不要误会,不是我接的,我们组有个牛人),这个课题在我们的手里也做了两个多月才交货。
目标产物的合成要九步,前七步很简单,就是在倒数第二步的一个关环反应上出了问题,怎么也不能把这个环给关上,和前面他们一样,LCMS中根本就没有产品的信号,最后一次,我们把条件做到了最优,结果还是不行。
化学合成项目总结(优秀5篇)

化学合成项目总结(优秀5篇)化学合成项目总结篇1化学合成项目总结:基于项目经验的分析和总结一、项目背景和目标在本项目中,我们的目标是开发一种新的化学合成方法,以高效、高选择性地合成一种具有广泛应用价值的化学物质。
这项研究的成功将为化学合成领域带来新的技术突破,有助于满足市场对相关产品的需求。
二、项目内容和实施过程本项目的主要任务包括:1.确定合适的合成路线:通过对相关文献的研究和对目标化学物质的化学结构的分析,我们确定了若干条可能的合成路线。
2.合成实验设计:在确定了合成路线后,我们进行了合成实验的设计,包括所需的试剂、反应条件等。
3.合成实验实施:在实验室内,我们按照预定的合成路线和实验设计进行了合成实验,并收集了实验数据。
4.数据分析:我们对实验数据进行了分析,验证了合成的有效性,并对合成方法进行了优化。
在项目实施过程中,我们遇到了一些困难,例如试剂的选择和配比的控制、反应条件的优化等。
通过反复试验和调整,我们最终成功地解决了这些问题。
三、项目成果和创新点本项目的主要成果包括:1.成功开发了一种新的化学合成方法,具有高效、高选择性的特点。
2.通过实验验证了该合成方法的可行性,并确定了最佳的反应条件和试剂配比。
3.合成了一种具有广泛应用价值的化学物质,为相关领域的发展提供了新的物质基础。
本项目的主要创新点在于我们开发了一种新的化学合成方法,相对于传统的合成方法,具有更高的效率和更佳的选择性。
此外,我们还通过对实验数据的分析,优化了合成条件,提高了合成方法的稳定性和可靠性。
四、项目总结和展望本项目成功地开发了一种新的化学合成方法,具有高效、高选择性的特点,合成了一种具有广泛应用价值的化学物质。
在项目实施过程中,我们积累了丰富的实践经验,对于化学合成领域的发展具有一定的推动作用。
在未来,我们将继续深入研究相关领域,探索更多的化学合成方法和技术,以满足市场对化学物质不断增长的需求。
同时,我们也希望与更多的同行进行交流和合作,共同推动化学合成领域的发展。
化学有机合成知识点及总结
固态:碳原子数特别多的烃类物质,如石蜡、沥青、;稠环芳香烃,如萘、蒽;酚类物质,如苯酚;饱和高级脂肪酸;脂肪;糖类物质;TNT;高分子化合物等。
液态:碳原子数大于4的烃类,如己烷、环己烷、苯等;绝大多数卤代烃;醇类;醛类;低级羧酸类;油酸酯类;硝基苯;乙二醇;丙三醇。
气态:碳原子数小于或等于4的烃类(如甲烷)、一氯甲烷、新戊烷、甲醛。
酚、醇、醛、葡萄糖等
还原反应
醛、酮等
聚合反应
加聚反应
烯烃等
缩聚反应
苯酚与甲醛;多元醇与多元羧酸;氨基酸等
与浓硝酸的颜色反应
蛋白质
与FeCl3溶液显色反应
苯酚等Leabharlann 常见重要官能团的检验方法官能团
试 剂
判断依据
碳碳双键或 碳碳三键
溴的CCl4溶液
橙红色(或红棕色)褪去
酸性KMnO4溶液
紫色褪去
卤素原子
NaOH溶液,AgNO3和稀硝酸的混合液
有机推断题的突破口
反应条件
反应物类别(官能团)、反应类型
浓硫酸/△
稀硫酸/△
NaOH水溶液/△
NaOH醇溶液/△
H2、催化剂
O2/Cu、加热
Cl2(Br2)/Fe
Cl2(Br2)/光照
有机推断题的突破口
根据反应中的特殊条件进行推断
(1)根据反应中的特殊条件进行推断 ①NaOH水溶液,加热——发生卤代烃、酯类的水解反应。 ②NaOH醇溶液,加热——发生卤代烃的消去反应,生成烯烃。 ③浓H2SO4,加热——发生醇消去、酯化、成醚、苯环的硝化反应等。 ④溴水或溴的CCl4溶液——发生烯、炔的加成反应,酚的取代反应。液溴才是苯的取代 ⑤O2/Cu(或Ag)——醇的氧化反应。 ⑥新制Cu(OH)2悬浊液或银氨溶液——醛氧化成羧酸。 ⑦稀H2SO4,加热——发生酯的水解,淀粉、蔗糖的水解。 ⑧H2、催化剂——发生烯烃(或炔烃)的加成,芳香烃的加成,醛还原成醇的反应。
有机合成小结

有机合成小结有机合成小结第一部分碳架的构造1.碳碳键的形成碳碳单键:1.金属有机化合物与卤代烷的偶联反应;2.金属有机化合物与羰基,氰基的加成反应;3.金属有机化合物与环氧化合物的开环反应;4.各类缩合反应;5.炔烃,芳环,酮,酯,β-二羰基化合物烷基化和酰基化反应(Friedel Crafts反应)6.酮的双分子还原;7.环加成反应;8.烯烃的羰基化反应9.卡宾插入或类卡宾插入(如Simmons-Smith反应)碳碳双键:10.Wittig反应;11.羟醛缩合;醛的缩合;酮的缩合;12.Clasin-Schmit缩合(插烯反应)13.Horner-Emmons反应;14.Wurtz反应2.碳链的切断和缩短1.芳环侧链氧化(与苯环链接的碳上含有H);2.烯烃,炔烃,邻二醇的氧化切断生成醛、酮、酸(如臭氧氧化烯烃,高锰酸钾氧化烯烃或炔烃等)3.卤仿反应;3.成环或开环三元环:1.烯烃与卡宾的反应2.1,3-二卤代物脱X的反应;五元环:1.1,6-二元醛酮的分子内缩合2.己二酸脱羧成环六元环:1.Diels-Alder反应2.苯环的还原3.Michael加成+羟醛缩合(Robinson成环反应)更多碳原子数的环:1.卡宾插入;2.分子内的羟醛缩合;4.碳架的重排1.Wagner-Meerwein重排;2.频那醇重排3.异丙苯氧化重排4.Baeyer-Villiger重排5.Clasin重排6.Fries重排7.Cope重排8.Favorsiki重排9.Smiles重排10.Von Richter重排11.Tiffenau-Demyanov重排12.二苯二乙醇重排5.杂环化合物的形成1.烯烃用过氧酸氧化成环2.烯烃用次卤酸加成消去成环第二部分官能团的生成烷烃、烯烃略炔烃:1.邻二卤代烃脱卤化氢2.邻氨基苯甲酸重氮化卤代烃:1.醇的卤代2.不饱和烃、三元环和卤化氢的加成3.不饱和烃,三元环与卤素的加成4.烯烃与次卤酸的加成5.环氧化合物与氢卤酸的加成6.芳烃和烷烃的卤代7.烯丙基化合物和苄式芳烃的卤代(NBS)8.卤素交换反应(Finkelstein反应)9.醛酮的阿尔法卤代10.与Lucas试剂反应醇:1.烯烃的催化水合2.烯烃的硼氢化-氧化3.烯烃的羟汞化还原4.烯烃与次卤酸的加成5.烯烃被碱性高锰酸钾、四氧化锇氧化6.环氧化合物的开环反应7.卤代烃的水解8.有机金属试剂与醛酮的加成(如Grignard试剂)9.醛酮的还原(如用Na与液氨还原)10.Cannizarro反应(醛酮的歧化反应)酚的制备1.芳磺酸盐碱溶法2.芳基卤代烃的水解3.芳烃的空气氧化4.芳胺的胺基重氮化醚的制备1.醇分子间脱水2.卤代烃与醇钠和酚钠的反应3.烯烃的羟汞化-去汞反应4.Williamson合成法5.醇与烯烃的加成6.醇与炔烃的加成7.烯烃的环氧化醛酮的制备1.醇的氧化2.邻二醇的高碘酸氧化(得到两分子醛或酮)3.烯烃的臭氧化4.烯烃的羰基合成反应(烯烃与一氧化碳和氢气在高压和催化剂作用下生成醛或者酮的反应)5.炔烃的水合6.炔烃的硼氢化氧化反应7.芳香族的酰基化反应8.偕二卤代烃的水解9.羟醛缩合10.安息香缩合11.频那醇重排12.Gattermann-Koch反应13.Reimer-Tiemann反应14.Vilsmer-Hacck反应15.Gattermann反应16.Hoesch反应17.Oppenauer氧化第三部分官能团的保护1.羰基可以先与醇缩合成缩醇参与反应体系后水解2.羟基可以先形成醚,酯缩醛等有机物加以保护3.酚羟基可以通过苯环上添加一些定位基防止被氧化官能团活化1.可以在逆合成分析加入酸酯基增加羰基阿尔法位的氢的活性2.使用TsCl酰化羟基增加-OR基团的离去性。
有机合成总结

R-C C-R/
② 武慈反应
R-X + R-X Na R-R 其中:R/ 最好为伯烷基
X 为Cl、Br、I
③ 铜锂试剂反应
R-X Li R-Li CuI R2CuLi R/X R-R/
其中:R/ 最好为伯烷基; R 一般无限制 X 为Cl、Br、I
④ 傅-克反应
烷基化:
R
+ R-X AlCl3
(或烯、醇)
X2
-X
FeX3 或Fe
H2SO4 + HNO3
-NO2 Fe + HCl
-NH2
H2SO4 ·SO3 或浓H2SO4
R-X AlCl3
O R-C-X AlCl3
-SO3H
-R O
-C-R
● 官能团的相互转化
1. 卤素、羟基、氨(胺)、羰基、羧基的转换
[O]
R-OH
O
=
[O]
R-C-
R-COOH
H2O / OH- PX3 Mg
O
R-C-CH3
X2 + NaOH 或 NaOX
CHX3↓ + R-COONa
R-CHCH3 OH
X2 + NaOH 或 NaOX
CHX3↓ + R-COONa
X 为Cl、Br、I
④ 脱羧反应
R-COONa + NaOH(CaO) △ R-H
⑤ 霍夫曼降解反应
O
R-C-NH2
Br2 + NaOH 或 NaOBr + NaOH
O
OH -
CH=CH-C-C(CH3)3
△
⑥ 格氏试剂与羰基化合物反应
= = =
有机合成经验总结(一)

有机合成经验总结(一)1. 有机化学的学习1)找本国内教科书学习好基本反应,不懂的地方不要死扣,主要加强印象,对于一些基本概念掌握好,如共振,octetrule,molecularorbital, Sn, E1等基本概念。
推荐邢其毅的有机化学。
不过先用不着看后面的章节如蛋白、糖等内容。
2)找本国外的有机化学原版书,如mcmurry或carey等人编的organic chemistry。
熟悉外文专业词汇的同时,加深理解,老外写的书都深入浅出,并不难理解(除了英文讨厌以外)。
正式入门先看两本书grossman的The art ofwriting reasonable organic reaction mechanisms或miller的writing reaction mechanisms in organicchemistry。
还有一本pushingelectrons。
学习机理的写法和深入了解电子转移的内涵。
不用记住里面的机理,主要学习从反应如何合理的推导机理。
3)阅读专题小册子,如国内超星上的亲核加成反应、饱和碳原子上的亲核取代反应历程等等按照基础反应特点介绍的小册子。
也有一些外文书籍,我就不写了。
4)看一本立体化学方面的入门书籍,推荐oxfordchemistry primer 系列Organic_Stereochemistry或longman公司出版的guide to organicstereochemistry。
国内有超星上有一本较早的翻译自法国的有机立体化学入门(作者可能为henrykargan记不太清),虽然有些观点较为过时,但写的较简单,适合初学者。
5)学习高等有机化学(主张中英文对照学习),carey或march 的advanced organicchemistry 是经典,国内好像都有中译本,虽然译本年代较早,但有助于英文版的学习。
学习是肯定不懂的地方很多,方法有两个一是在网上搜索不懂的概念(最好在专业英文网站找),二是找专题小册子。
有机合成经验总结,细节决定效率

有机合成经验总结,细节决定效率实验室工作有很多是经验性的,有很多细节是课本上没有的,但是在实验室实际应用中又非常重要,本文我总结了一些自己在多年的实验室工作经验,主要是一些个人习惯。
良好的实验室习惯的养成,往往会是一个很好的开始,它是避免人为反应失败的最大的利器,也是提高效率,避免人力浪费的很好的助力。
第一部分:反应操作1,原则上所有的反应都不能用塞子塞住,从而造成反应在狭小的密闭空间下反应,必须在出口处街上氮气球或者三通(特殊的如高压反应或sealed tube 反应除外),以免因反应放热或产生气体而发生冲料或者发生爆炸。
2,处理反应时选择合适的容器,最好在预估的所有体积的二到三倍之间,以免出现容器过满的状况。
3,任何反应若非会放出含H+之物质,均应尽可能在惰气(氮气或氩气)系统下操作,以避免不必要之副反应(side reaction)。
如必须于惰气系统下操作则以使用惰气气球系统为宜。
4,标准惰气系统反应处理方式是将反应器皿于烘箱中取出后迅速放入搅拌子并连接氮(氩)气出口之后迅速将反应所需设备组合起来,并用火焰干燥,然后抽真空再灌入氮(氩)气,并重复两次。
5,任何一未知反应,除非有极近似之反应作参考,否则应从0℃或室温开始尝试,若不反应再逐步升高其温度,反之若反应太快有副作用时,再降低其温度。
6,任何一未知反应于 set up 完成后30 分钟内即应检查反应进行之情况,我们可取适量之原液(Aliquots)以TLC,NMR,GC,IR 或其他适当的技巧检验之。
确定其反应进度后,才可决定是否在原条件下反应,切不可任意由其反应,或work-up 而不予检查。
7,检查反应时若发现超过 3 小时没有任何变化(反应)发生则可尝试逐渐升高温度10-30℃,然后再等十分钟后检查其变化,若再过一小时后仍无反应则再升高温度10-30℃,如此反复尝试直到反应发生为止。
8,任何一反应若需加热或反应中可能生热时必须加装冷凝管以确保物质不会挥发散失。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
------------------------------------------------------------精品文档--------------------------------------------------------
Final Report of AA6287
工作目标:1.1。
AA6287项目按以下合成路线完成12g,通过NMR鉴定,要求纯度98%具体实验报告参考JKSZ-193项目负责人:顾扬实验人:杨承
参考文献1.2
Synthesis;4;0;2000;507;509
合成路线1.3
OH OH OOSO HO S)PO(OCH23OOOHO CHCO32OPO
OPOOPO O S OO628703628700628702628701O SS O
CHCO32CHCO32628704628705
实验与讨论1.3
1.4Step 1
OH OOOOOO OOP OOPOPO O OO628700628702628701工艺:
磁力搅拌装置,2L四口反应瓶,开启搅拌,依次加入18g(0.6mol,2eq)多聚甲醛,4.5g(0.054mol,0.18eq)哌啶,300ml甲醇,回流1h(内温45℃),滴加55.8g(0.3mol,1eq)628700与300ml甲醇的混合溶液,3h 滴完,回流2h左右,GC监控(原料628700峰消失,生成628701与628702两个峰)。
后处理:
反应液冷却,用旋转蒸发仪,50℃水浴旋去反应液中的甲醇,残渣为
棕色粘稠液体。
直接往后反应。
甲醛和甲醇混合液回流,冷凝水需要用冰水。
备注:
原料GC谱图:
)628702峰是t=2.29min,628701峰是t=2.22min(:谱图GC反应液.
Step 2
OOOOO OPOOOP OO628702628701
工艺:
磁力搅拌装置,2L四口反应瓶,安装分水器,开启搅拌,加入600ml甲苯溶解的上一步得到的棕色粘稠液体,0.9g(催化量)的一水合对甲基苯磺酸,内温110℃回流5h左右,由分水器共分出300ml的甲苯和水,GC 监控(628701峰消失,只剩628702一个峰)。
不处理,直接往后。
)628702峰是t=2.248min(:谱图GC反应液.
Step 3
OHSO HO S)PO(OCH S23OHO CHCO32OOP
SCOCH O32628703628702628704
工艺:
继续上一步的反应,反应液冷却至50℃左右时,加入24g(0.158mol,0.526eq)2,5-二羟基-1,4-二噻烷,54ml(0.75mol,2.5eq)三乙胺,60℃加热1h,70℃加热1h,80℃加热2h,内温90℃加热回流1.5h,反应液颜色变深棕色。
GC监控(628702峰消失)。
后处理:
反应液冷却至室温,静置,上层无色,下层深棕色,下层有黑色固体颗粒沉淀,过滤,滤液用2mol/L(3x300ml)盐酸洗涤,洗涤液用二氯甲
烷(2x150ml)萃取,二氯甲烷相合并到有机相中。
备注:若按文献加热温度(50℃),最后得到的将是黄色粘稠液体,而不是黑色固体,冷藏过夜粘稠液体中会析出极少量产品。
.
628702峰消失)(只有甲苯峰,反应液GC谱图:
Step 4
O SS O COCH32COCH32628704628705
工艺:
强力搅拌装置,2L四口反应瓶,加入上一步所得的有机相,开启搅拌,冰盐浴控制内温度10℃以下,30min滴加276.6g(0.4mol,15eq)过硫酸氢钾复合盐和1200ml水的溶液,继续搅拌1h,TLC监控反应。
后处理:
反应液过滤,滤液静置分层,甲苯层分出,水层用二氯甲烷(2x150ml)萃取,合并有机相,无水硫酸钠干燥,旋干,得到黑色固体及少量油状液体的混合物,用20ml乙醇洗去油状液体,过滤,滤饼加入70ml乙醇,5g 活性炭,回流10min脱色,热过滤,得到深色透明液体,静置过夜,析出棕色针状晶体,过滤,母液,剩余的加热溶解,静置又析出棕色针状晶体,过滤,两次所得晶体合2/3旋去
并,用40ml乙醇重结晶,得到浅灰色针状晶体,过滤,母液旋去2/3,剩余的加热溶解,静置又析出浅灰色针状晶体,两次合并共得15.4g浅灰色针状晶体。
结论:
产物:15.4g浅灰色针状晶体
产率:26.85 %
纯度:99.35%
熔点:62-64℃
注意:
活性炭只能脱掉部分黑色物质,但还需重结晶至少两次,不然晶体颜色较深。
反应液TLC板层:
1. 628704原料加水,EA萃取点板
2. 混合点
3. 反应液EA萃取点板
Mobile phase: PE:EA=1:1(碘缸显628705色)123
产品TLC板层:
628705 棕色针晶体1.
混合点2.
3. 628705浅灰色针状晶体(碘缸显PE:EA=1:1 Mobile phase: 色)213
产品液相谱图:
甲醇/水=6/4
NMR:
1.5 结论以及生产期安排:
结论:
项目启动时间:2009-2-14,项目结束时间:2009-3-10。
生产安排:以制备产品AA6287 15g 为例,需要工作日4天。
放大5倍需要原料放大5倍,时间延长1天
放大10倍需要原料放大10倍,时间延长1天。
物料消耗:
6287生产15g产品消耗原料与辅料:
生产安排:。
