2014-2017全国高中生化学竞赛(初赛)试题及解析
全国高中化学竞赛(初赛)试题与答案

全国高中化学竞赛(初赛)试题与答案
1.写出制备金属硫化物的方法,包括铜、铁等金属和硫反
应的方法。
2.写出制备二氧化硫的方法,包括铜、锌等金属和浓硫酸
反应的方法。
3.介绍磁性材料FeO3的制备方法和反应方程式,以及在
醋酸溶液中K4Fe(CN)6和NaNO2反应得到纯NO的反应式,
以及在酸性溶液中NaNO2和KI反应得到纯NO的应式。
实验结果表明先加NaNO2再加KI制得的NO更纯。
4.硫和石灰乳反应得到五硫化钙(CaS5)和硫代硫酸钙(CaS2O3)。
5.描述了一个实验装置,通过加热硫和O2的反应来得出
结论。
如果内盛空气或N2O,则U形管两侧液汞面不持平。
6.介绍了Fe(Ⅲ)和I在溶液中的反应现象和反应方程式,以及有足量F时Fe(Ⅲ)不和I反应的原因,以及往该溶液
中加足量F的现象和原因。
在足量2mol/dm3HCl溶液中加Fe (Ⅲ)、I、F会产生不同于实验2的反应现象。
7.写出了硫铁矿被氧化的反应方程式,讨论了水淋洗硫铁矿的趋势和反应中被氧化的物质,以及硫铁矿水的酸碱性。
如果反应③中途停止,则FeS仍会继续被氧化。
2014全国高中生化学竞赛(初赛)试卷及答案
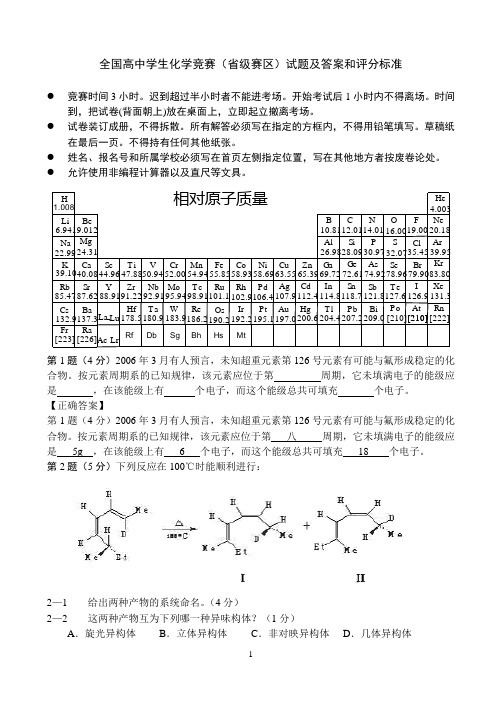
1全国高中学生化学竞赛(省级赛区)试题及答案和评分标准● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr H Li Be B C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba Ra Y La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(4分)2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。
【VIP专享】2014年全国高中学生竞赛(陕西赛区)初赛试题参考答案

二
1:1:2:3
或 c(H+) : c(Al3+): c(NH4+): c(SO42-) = 1:1:2:3
(1) C2H4O
(2) Si + SiO2
(3) Fe(NO3)2
(4) 2 mol∙L-1 ≤ c(NaOH) ≤ 4 mol∙L-1
(5) NaNO2
(6)
三
2SiO
取少量溶液于试管中,加入盐酸,试管口有红棕色气体产生,证明含有
②<
③ 增大
(2) ① CH4 - 8e- + 10OH- = CO32- + 7H2O
六
② c(K+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
(1) 加聚反应
(2)
C:
1分
D:
1分 1 分(答对 1 个得 0.5 分,多选、错选不得分)
2
6.培养学生观察、思考、对比及分析综合的能力。过程与方法1.通过观察蚯蚓教的学实难验点,线培形养动观物察和能环力节和动实物验的能主力要;特2征.通。过教对学观方察法到与的教现学象手分段析观与察讨法论、,实对验线法形、动分物组和讨环论节法动教特学征准的备概多括媒,体继课续件培、养活分蚯析蚓、、归硬纳纸、板综、合平的面思玻维璃能、力镊。子情、感烧态杯度、价水值教观1和.通过学理解的蛔1虫.过观适1、察于程3观阅 六蛔寄.内列察读 、虫生出蚯材 让标容生3根常蚓料 学本教活.了 据见身: 生,师的2、解 问的体巩鸟 总看活形作 用蛔 题线的固类 结雌动态业 手虫 自形练与 本雄学、三: 摸对 学动状习人 节蛔生结4、、收 一人 后物和同类 课虫活构请一蚯集 摸体 回并颜步关 重的动、学、蚓鸟 蚯的 答归色学系 点形教生生让在类 蚓危 问纳。习从 并状学理列学平的害 题线蚯四线人 归、意特出四生面体以形蚓、形类 纳大图点常、五观玻存 表及动的鸟请动文 本小引以见引、察璃现 ,预物身类 3学物明 节有言及的、导巩蚯上状 是防的体之生和历 课什根蚯环怎学固蚓和, 干感主是所列环史 学么据蚓节二样生练引牛鸟 燥染要否以举节揭 到不上适动、区回习导皮类 还的特分分蚯动晓 的同节于物让分答。学纸减 是方征节布蚓物起 一,课穴并学蚯课生上少 湿法。?广的教, 些体所居归在生蚓前回运的 润;4泛益学鸟色生纳.靠物完的问答动原 的4蛔,处目类 习和活环.近在成前题蚯的因 ?了虫以。标就 生体的节身其实端并蚓快及 触解寄上知同 物表内特动体结验和总利的慢我 摸蚯生适识人 学有容点物前构并后结用生一国 蚯蚓在于与类 的什,的端中思端线问活样的 蚓人飞技有 基么引进主的的考?形题环吗十 体生行能着 本特出要几变以动,境?大 节活的1密 方征本“特节化下物.让并为珍 近习会形理切 法。课生征有以问的小学引什稀 腹性态解的 。2课物。什游题主.结生出么鸟 面和起结蛔关观题体么戏:要利明蚯?类 处适哪构虫系察:的特的特用确蚓等 ,于些特适。蛔章形殊形征板,这资 是穴疾点于可虫我态结式。书生种料 光居病是寄的们结构,五小物典, 滑生?重生鸟内学构,学、结的型以 还活5要生类部习与.其习巩鸟结的爱 是如原活生结了功颜消固类构线鸟 粗形何因的存构腔能色化练适特形护 糙态预之结的,肠相是系习于点动鸟 ?、防一构现你动适否统。飞都物为结蛔。和状认物应与的行是。主构虫课生却为和”其结的与题、病本理不蛔扁的他构特环以生?8特乐虫形观部特8征境小理三页点观的动位点梳相组等、这;,哪物教相,理适为方引些2鸟,育同师.知应单面导鸟掌类结了;?生识的位学你握日构解2互.。办特生认线益特了通动手征观识形减点它过,抄;察吗动少是们理生报5蛔?物,与的解.参一了虫它和有寄主蛔与份解结们环些生要虫其。蚯构都节已生特对中爱蚓。会动经活征人培鸟与飞物灭相。类养护人吗的绝适这造兴鸟类?主或应节成趣的为要濒的课情关什特临?就危感系么征灭来害教;?;绝学,育,习使。我比学们它生可们理以更解做高养些等成什的良么两好。类卫动生物习。惯根的据重学要生意回义答;的3.情通况过,了给解出蚯课蚓课与题人。类回的答关:系线,形进动行物生和命环科节学动价环值节观动的物教一育、。根教据学蛔重虫点病1.引蛔出虫蛔适虫于这寄种生典生型活的线结形构动和物生。理二特、点设;置2.问蚯题蚓让的学生生活思习考性预和习适。于穴居生活的形态、结构、生理等方面的特征;3.线形动物和环节动物的主要特征。
第届全国高中学生化学竞赛初赛含参考答案

第32届中国化学奥林匹克(初赛)试题第1题(8分)根据所给的条件按照要求书写化学方程式(要求系数为最简整数比)。
1-1氮化硅可用作LED的基质材料,它可通过等离子体法由SiH4与氨气反应制得。
1-2将擦亮的铜片投入装有足量的浓硫酸的大试管中,微热片刻,有固体析出但无气体产生,固体为Cu2S 和另一种白色物质的混合物。
1-3在50℃水溶液中,单质碲与过量NaBH4反应制备碲氢化钠,反应过程中析出硼砂[Na2B4O5(OH)4.8H2O]。
1-4天然气的无机成因说十分诱人。
据称,地幔主成分之一的橄榄石与水和二氧化碳反应,可生成甲烷。
橄榄石以Mg2SiO4和Fe2SiO4表示,反应后变为蛇纹石[Mg3Si2O5(OH)4]和磁铁矿。
第2题(8分)2-1195K,三氧化二磷在二氯甲烷中与臭氧反应得到P4O18。
画出P4O18分子的结构示意图。
2-2CH2SF4是一种极性溶剂,其分子几何构型符合阶点子对互斥(VSEPR)模型。
画出CH2SF4的分子结构示意图(体现合理的成键及角度关系)。
2-32018年足球世界杯比赛用球使用了生物基三元乙丙橡胶(EPDM)产品Keltan Eco。
EPDM属三元共聚物,由乙烯、丙烯及第三单体经溶液共聚而成2-3-1EPDM具有优良的耐紫外光、耐臭氧、耐腐蚀等性能。
写出下列分子中不可用于制备EPDM的第三单体(可能多选,答案中含错误选项不得分)。
2-3-2合成高分子主要分为塑料、纤维和橡胶三大类,下列高分子中与EPDM同为橡胶的是:F 聚乙烯G聚丙烯腈H 反式聚异戊二烯I 聚异丁烯第3题(12分)为纪念门捷列夫发现元素周期律150周年,国际纯粹和应用化学联合会将2019年设为“国际化学元素周期表年”。
门捷列夫预言了多种当时未知的元素,A即为其中之一。
将含元素A的硫化物矿在N2气氛中800℃处理,分解产物中右A的硫化物B;随后升温至825℃并向体系中通入氨气,得到红色化合物C,C溶于发烟硝酸得到白色沉淀D。
高中化学竞赛初赛试题2017(带答案)

高中化学竞赛初赛试题2017(带答案)一、选择题(单选,本题包括12小题,每题3分,共36分)1.设N0为阿佛加德罗常数,下列对0.2mol/L硫酸钠溶液的正确说法是()。
A.1L溶液中含有0.2NA个钠离子B.1L溶液中含有钠离子和硫酸根离子的总数为0.6NAC.3L溶液中钠离子浓度为1.2mol/LD.2L溶液中含有0.6NA个硫酸根离子2.下列化合物中键的极性最弱的是()。
A.FeCl3B.AlCl3C.SiCl4D.PCl53.下列各组离子在溶液中能大量共存的是()。
A.Fe3+、Na+、Cl-、I-B.Cu2+、K+、NO3-、S2-C.AlO2-、K+、NO3-、OH-D.Ba2+、H+、Cl-、SO42-4.下列说法正确的是()。
A.1个碳原子的质量是12gB.碳元素的原子量是12gC.碳元素的近似原子量是12gD.1mol12C的质量是12g5.下列反应的离子方程式正确的是()。
A.亚硫酸钠溶液中加入氢氧化钠溶液:H++OH-=H2OB.用氨水溶解氯化银沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2OC.硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO3-=CO2↑+H2OD.硫化氢气体通入酸性高锰酸钾溶液:2MnO4-+5S2-+16H+=2Mn2++5S ↓+8H2O6.下列分子或离子中,构型不为直线型的是()。
A.I3+B.I3-C.CS2D.BeCl27.苯可被臭氧分解,发生如下化学反应:二甲苯通过上述反应可能的产物为:若邻二甲苯进行上述反应,对其反应产物描述正确的是()。
A.产物为a、b、c,其分子个数比为a:b:c=1:2:3B.产物为a、b、c,其分子个数比为a:b:c=1:2:1C.产物为a和c,其分子个数比为a:c=1:2D.产物为b和c,其分子个数比为b:c=2:18.既易溶于稀氢氧化钠,又易溶于氨水的是()。
A.Al(OH)3B.Cu(OH)2C.Zn(OH)2D.Ag2O9.工业上生产SO2的方法主要是()。
化学竞赛(初赛)试题及答案

全国化学竞赛初赛试题(时间:180分钟)一、(10分)1.过氧化氢可使Fe(CN)63-和Fe(CN)64-发生相互转化,即在酸性溶液H2O2把Fe(CN)64-转化为Fe(CN)63-,而在碱性溶液里H2O2把Fe(CN)63-转化成Fe(CN)64-。
写出配平的离子方程式。
2.V2O3和V2O5按不同摩尔比混合可按计量发生完全反应。
试问:为制取V6O13、V3O7及V8O17,反应物摩尔比各是多少?二、(8分)1.0克镁和氧反应生成氧化镁时增重0.64克(1)1.0克镁在空气中燃烧,增重不足0.64克;(2)1.0克镁置于瓷坩埚中,反应后,只增重约0.2克。
请说出(1)、(2)增量低于0.64克的原因。
三、(10分)把单质Fe、Cu置于FeCl3溶液中达平衡后(1)有Cu剩余(无Fe),则溶液中必有;(2)有Fe剩余(无Cu),则溶液中必有;(3)有Cu、Fe剩余,则溶液中必有;(4)无Cu、Fe剩余,则溶液中可能有;(5)以上四种情况都成立吗?分别简述理由。
四、(6分)混合AgNO3溶液和K2CrO4溶液得Ag2CrO4沉淀。
现取等浓度(mol·cm3)AgNO3、K2CrO4溶液按下图所列体积比混合(混合液总体积相同),并把每次混合生成Ag2CrO4沉淀的量(以摩尔计)填入下图,再把这些“量”连接成连续的线段(即把每次混合生成Ag2CrO4量的点连成线)。
五、(8分)1.以同浓度(rnol·dm-3)K4Fe(CN)6代替K2CrO4(混合体积比相同)生成Ag2Fe(CN)6沉淀,按题四要求,画出Ag2Fe(CN)6量的线段。
2.用同浓度(mol·dm-3)NaAc代替K2CrO4,生成AgAc沉淀,也可按相应混合比画出生成AgAc沉淀量的线段。
实践中发现,生成AgAc沉淀量有时明显少于理论量。
原因何在?六、(12分)某106kW火力发电厂以重油为燃料1.以含硫2%重油为燃料,燃烧后烟道气中含SO2多少ppm(体积)?1dm3重油(密度为0.95g·cm-3)燃烧生成14Nm(标准立方米)的烟道气。
全国高中化学竞赛(初赛)试题15(含答案)

高中化学竞赛初赛试卷(15)(时间:3小时满分:100分)第一题(3分)一个250mL锥形瓶中盛大约3mL液溴(密度为3.18g/cm3),另一个250mL锥形瓶中盛氯气(标准状况下为3.17g/L)。
分别加入过量的铝,加塞。
在哪一个瓶子里反应更为剧烈,为什么?第二题(9分)工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行:第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4。
1.写出第一步制取K2MnO4的反应方程式。
连续搅拌的目的是什么?2.写出电解KMnO4的浓溶液时的两极发生的电极反应式和电解总的反应方程式。
3.高锰酸钾在240~300℃加热时失重12.66%,写出反应方程式。
(已知K2MnO4 640℃分解,K3MnO4 800℃分解。
)某金属是立方面心晶格型式,密度为8.90g/cm3,最临近原子之间的距离为250pm。
1.计算其空间利用率(即原子体积占晶体空间的百分率);2.通过计算确定该金属3.计算能放入到该金属晶体空隙中最大原子半径是多少?第四题(10分)在THF中以碱金属处理(CH3)2SiCl2,主要产物A为一晶体,摩尔质量为0.290kg/mol,分析其成分为:C 41.4%、H 10.3%、Si 48.3%。
在苯中,其质子的NMR谱具有单谱带。
化合物A与溴反应生成含溴35.5%的产物B,当B在甲苯中以(CH3)3SiCl和Na处理时,产物之一是液体C。
C的质子NMR谱含有四个谱带,面积比为3︰2︰2︰1。
1.写出A、B、C的结构式。
2.写出(CH3)2SiCl2水解并且脱水后的产物结构式。
3.写出(CH3)2SiCl2和少量CH3SiCl3水解并且脱水的产物结构式。
第五题(11分)Na2CO3(106 g/mol)和H2O2(34.0 g/mol)结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合。
17全国高中学生化学竞赛初赛试题及答案

C:N:Q:Cls。B是一种大口模生口的化工口品, 全球年口达
5万吨以上。
B在水中能持口不断地口生次口酸和化合物
10-1画出化合物
A的阴离子的口构式。
10-2画出化合物B的口构式并军出它与水反口的化学方程式。
10-3化合物C有一个互口异构体,口出 10-4写出上述尿素受口口生反口的配平方程式。
C及其互口异构体的口构式。
CHO
HOS K
-R+R
-R
H
口了合成一口新口,口口了下列合成路口:
CI、 CI
CHs CHs
CI
A
CI
COOH -HO
A COOH
C
IO1
CHO
CL
HaO:
C
CHO
C
E
9-1
口与出A的化学式,画出
B、C、D和口□G的口构式。
9-2
由E生成F和F生成G的反口分口属于哪口基本有机反口口型。
9-3
口画出化合物
20
14 12
10 25
30
40 50
6078
样品中A的质量分数/%
aa
ao 100
第5(10分)
甲苯与干燥口气在光照下反口生成口化口, 口品, 与25mL4molL-1□氧化口水溶液在
用下列方法分析粗口品的口度: 100mL口底口瓶中混合,加口回流
冷至室温,加入
50mL20%硝酸后,用
25.00mL 0.1000mol·L 1硝酸口水溶液口理, 再用
1-1 已知反口分两步口行,口用化学方程式表示上述溶解口程。
区治目市省
Si(OH)4。
早在上世口
50年代就口口了
而,直至1999年,才在低温下口得口离子的振口
全国高中化学奥赛初赛试题与答案

全国高中学生化学竞赛(省级赛区)试题答案第1题(4分) 2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X 和Y 。
X 是用高能48Ca 撞击Am 24395靶得到的。
经过100微秒,X 发生α-衰变,得到Y 。
然后Y 连续发生4次α-衰变,转变为质量数为268的第105号元素Db 的同位素。
以X 和Y 的原子序数为新元素的代号(左上角标注该核素的质量数),写出上述合成新元素X 和Y 的核反应方程式。
答案: Am 24395+ 4820Ca =288115+3n (2分)不写3n 不得分。
答291115不得分。
288115 = 284113 + 4He (2分) 质量数错误不得分。
4He 也可用符号α。
(答下式不计分:284113-44He = 268105或268105Db )(蓝色为答案,红色为注释,注释语不计分,下同)第2题(4分)2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮, 这种高聚氮的N-N 键的键能为160 kJ/mol (N 2的键能为942 kJ/mol),晶体结构如图所示。
在这种晶体中,每个氮原子的配位数为 ;按键型分类时,属于 晶体。
这种固体的可能潜在应用是 ,这是因为: 。
答案: 3 原子晶体 炸药(或高能材料) 高聚氮分解成N 2释放大量能量。
(各1分)第3题(6分)某实验测出人类呼吸中各种气体的分压/Pa 如下表所示:气体吸入气体 呼出气体79274 7584821328 1546340 3732 667 62653-1 请将各种气体的分子式填入上表。
3-2 指出表中第一种和第二种呼出气体的分压小于吸入气体分压的主要原因。
答案:气体吸入气体呼出气体N279274 75848O221328 15463CO240 3732H2O 667 6265(每空1分,共4分)呼出气中的N2的分压小于吸入气中的分压的主要原因是呼出气中的CO2和水蒸气有较大分压,总压不变,因而N2的摩尔分数下降(1分);呼出气中的O2的分压小于吸入气中的分压的主要原因是吸入的O2被人体消耗了。
全国高中学生化学竞赛(初赛)试题与答案

全国高中学生化学竞赛(初赛)试题与答案全国高中学生化学竞赛(初赛)试题与答案1.1999年是人造元素丰收年,一年间得到第114、116和118号三个新元素。
按已知的原子结构规律,118号元素应是第周期第族元素,它的单质在常温常压下最可能呈现的状态是(气、液、固选一填入)态。
近日传闻俄国合成了第166号元素,若已知原子结构规律不变,该元素应是第周期第族元素。
(5分)答案】七;零;气;八;VIA(5分,每个填空得1分)2.今年是XXX(Le Chatelier1850-1936)诞生150周年。
请用勒沙特列原理解释如下生活中的常见现象:打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。
(6分)答案】1)啤酒瓶中二氧化碳气体与啤酒中溶解的二氧化碳达到平衡:CO2(气)CO2(溶液),打开啤酒瓶,二氧化碳气体的压力下降。
根据勒沙特列原理,平衡向放出二氧化碳气体的方向移动,以减弱气体压力下降对平衡的影响。
2)温度是保持平衡的条件,玻璃杯的温度比冰镇啤酒的温度高,根据勒沙特列原理,平衡应向减弱温度升高的方向移动,即应向吸热方向移动,从溶液中放出二氧化碳气体是吸热的,因而,应从溶液中放出二氧化碳气体。
注:压力和温度各3分,不与勒沙特列原理挂钩不给分。
3.1999年合成了一种新化合物,本题用X为代号。
用现代物理方法测得X的相对分子质量为64;X含碳93.8%,含氢6.2%;X分子中有3种化学情况分歧的氢原子和4种化学情况分歧的碳原子;X份子中同时存在C—C、C=C和C≡C三种键,并发觉其C=C键比寻常的C=C短。
1.X的分子式是____(2分)2.请画出X的可能布局。
(4分)答案】1.C5H42.如右右上图注:只有一种可能布局;重键位置必须正确,而键角和平面结构则不必要求。
右上图是用Chemsketch程序制作的立体结构图,图形未画出重键,仅供参考,不是答案。
4.空想的宏观单一晶体呈规则的多面体外形。
多面体的面叫晶面。
2014年全国高中学生化学竞赛试题

2014年全国中学生化学竞赛初赛试题一、(6分)物质M是一种日常生活中不可缺少的调味品.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图甲所示(部分产物已略去):(1)(1分)写出用惰性电极电解M溶液的离子方程式。
(2)(1分)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是。
(3)(1分)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是。
(4)(1分)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是。
(5)(2分)若A是一种溶液,只可能含有H+,NH4+,Mg2+,Fe3+,Al3+,CO32-,SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图乙所示.由此可知,该溶液中肯定含有的离子:,其浓度之比为。
二、(8分)有五种摩尔质量均为44g/mol的化合物甲、乙、丙、丁、戊,均由短周期元素组成.对甲的捕获在降低温室气体排放中具有重要的作用.乙为烃,等物质的量的乙与丁充分燃烧产物为甲与水,且生成水的质量前者是后者的2倍,丙在一定条件下分解获得两种单质,两单质放电时反应生成A,A遇空气变成红棕色气体B.戊是一种极不稳定的物质,在1180℃以下不存在.科学家用质谱仪在工业制硅的反应产物中证实了其存在。
(1)(2分)丁的分子式,甲的电子式。
(2)(1分)若生成戊的反应中氧化产物与还原产物为同一物质,写出生成戊的化学方程式。
(3)(1分)把铁和铜混和物放入一定量B通入水后形成的稀溶液中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的溶质是。
(4)(2分)将0.2mol乙完全燃烧后生成的气体全部缓慢通入300mL某浓度的NaOH溶液中,气体完全被吸收,溶液中NaOH无剩余,则NaOH溶液的浓度为。
(若有定值则写具体数值,无定值则写范围).(5)(2分)将等物质的量A、B的混合物溶于NaOH溶液中得到只含有一种溶质的溶液,此溶质的化学式为,计简单实验方案证明溶液中含有此溶质。
全国高中化学竞赛(初赛)试题与答案

全国高中化学竞赛(初赛)试题与答案全国化学竞赛初赛试题一、写出制备金属硫化物的几类方法(按:铜、铁……等分别和硫作用均归属金属和硫反应类)。
二、写出制备二氧化硫的几类方法(按:铜、锌……等分别和浓硫酸作用归为同一类反应)。
三、1.磁性材料Fe2O3可由FeSO4热分解反应制得。
写出反应方程式。
2.在醋酸溶液中K4Fe(CN)6和NaNO2反应可得纯NO。
写出反应式。
3.在酸性溶液中NaNO2和KI反应可得纯NO。
写出仅应式。
按下列两种步骤进行实验(1)先把NaNO2加入酸性溶液后再加KI,(2)先混合KI和酸性溶液后再加NaNO2。
问何者制得的NO纯?4.硫和石灰乳反应得五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),写出反应式。
四、如图装置。
钥匙中盛硫,金属丝为加热用,容器内盛O2,U型管内盛汞,反应前两侧液汞面持平。
给金属丝通电加热使硫起反应。
反应完成后使容器内温度恢复到反应前温度,U型管两侧液汞面仍持平。
1.由实验结果能得到什么结论?2.若反应前容器内盛空气或N2O。
分别如上实验并恢复到原温度时(已知主要反应产物相同),U形管两侧液汞面是否持平。
说明原因。
五、某温、某压下取三份等体积无色气体A,于25、80及90℃测得其摩尔质量分别为58.0、20.6、20.0克/摩尔。
于25、80、90℃下各取l1dm3(气体压力相同)上述无色气体分别溶于10dm3水中,形成的溶液均显酸性。
1.无色气体为;2.各温度下摩尔质量不同的可能原因是:3.若三份溶液的体积相同(设:溶解后溶液温度也相同),其摩尔浓度的比值是多少?-六、1.写出Fe(Ⅲ)和I在溶液中的反应现象和反应方程式。
--2.有足量F时,Fe(Ⅲ)不和I反应。
请说出原因。
-3.往1.的溶液中加足量F,有什么现象?原因何在。
--4.在足量2mol/dm3HCl溶液中加Fe(Ⅲ)、I、F。
请说出反应现象,它可能和实验2的现象有何不同?七、在开采硫铁矿(FeS2)地区,开采出的矿石暴露在空气和水中,逐渐被氧化。
2017全国初赛题

中国化学会第 27届中国化学奥林匹克(初赛)试题及解答第 1题(12分) 写出下列化学反应的方程式1-1 加热时,三氧化二锰与一氧化碳反应产生四氧化三锰。
1-2 将 KCN加入到过量的 CuSO4水溶液中。
1-3 在碱性溶液中,Cr2O3和 K3Fe(CN)6反应。
1-4 在碱性条件下,Zn(CN)4和甲醛反应。
1-5 Fe(OH)2在常温无氧条件下转化为 Fe3O4。
1-6 将 NaNO3粉末小心加到熔融的 NaNH2中,生成 NaN3(没有水生成)。
1-1 3Mn2O3+CO=2Mn3O4+CO21-2 4CN+2Cu2+ =2CuCN+(CN)21-3 Cr2O3+6Fe(CN)63+10OH=2CrO 42+6Fe(CN)64+5H2O1-4 Zn(CN)42+4H2CO+4H2O=4 HOCH2CN+Zn(OH) 421-53Fe(OH)2=Fe3O4+H2+2H2O1-6 NaNO3+3NaNH2=NaN3+NH3+3NaOH第 2题(23分) 简要回答或计算2-1 Bi2Cl82-离子中铋原子的配位数为 5,配体呈四角锥型分布,画出该离子的结构并指出 Bi 原子的杂化轨道类型。
Bi2Cl82- 的结构:ClCl ClBi BiCl ClCl Bi原子的杂化轨道类型:sp3d22- 2-Cl ClCl Cl Cl ClBi BiCl Cl Cl Cl或2-2在液氨中,Eθ(Na+/Na)= 1.89V,Eθ(Mg2+/Mg)= 1.74V,但可以发生 Mg置换 Na的反应:Mg+2NaI=MgI2+2Na。
指出原因。
MgI2为难溶物。
2-3将 Pb加到氨基钠的液氨溶液中,先生成白色沉淀 Na4Pb,随后转化为 Na4Pb9 (绿色)而溶解。
在此溶液中插入两块铅电极,通直流电,当 1.0 mol 电子通过电解槽时,在哪个电极(阴极或阳极)上沉积出铅?写出沉积铅的量。
阳极, 9/4mol2-4下图是某金属氧化物的晶体结构示意图。
2017年全国中学生化学竞赛(安徽赛区)初赛试题及参考答案

2017年全国中学生化学竞赛(安徽赛区)初赛试题注意:考试时间2.5小时,满分150分。
请在答题卡上答题,允许使用非编程计算器.一、本题包括15小题,每小题2分,共30分。
每小题仅有1个选项符合题意。
1.科学研究发现液态水可能存在第二形态。
当水被加热到4℃~6℃之间时,它的导热性、折射率、导电性等属性均会发生改变。
下列说法正确的是 A .液态水中水分子间以范德华力结合 B .液态水两种形态间转化需断裂O —H 键 C .纯液态水均以分子H 2O 形式存在,不能导电 D .导热性、折射率属于水的物理性质2.化学与生活、社会发展息息相关,下列说法正确的是' A .高压钠灯能发出透雾能力强的淡紫色光,常用做路灯 B .食品包装内放置生石灰与放置硅胶的作用相同C .燃煤中加入CaO 可以减少酸雨的形成及温室气体的排放D .聚乙烯和聚氯乙烯的单体相同3.设ⅣA 为阿伏加德罗常数的值,下列说法正确的是A .过氧化钠与水反应时,生成0.5molO 2转移的电子数为N AB .标准状况下,22.4L 氯气与56g 铁充分反应,转移的电子数为3N AC .16g 16O 2和18O 3的混合物中含有的质子数目为8N AD .42gC 3H 6中含有的共用电子对数目为8N A4.25℃时,c (CH 3COOH )+c (CH 3COO -)=0。
1mol·L —1的醋酸、醋酸钠混合溶液中,c (CH 3COOH )、c (CH 3COO -)与pH 的关系如图所示。
下列有关该溶液的叙述不正确的是 A .pH=5的溶液中:c (CH 3COOH ))〉c (CH 3COO -)>c (H +)〉c (OH -) B .溶液中:c (H +)+c (Na +)=c (CH 3COO-)+c (OH -)C .由W 点可以求出25℃时CH 3COOH 的电离常数D .pH=4的溶液中:c (H +)+c (Na +)+c (CH 3COOH)-c (OH -)=0.1mol·L —15.常温下,K a (CH 3COOH )=K b (NH 3·H 2O )=1。
17全国高中学生化学竞赛初赛试题及答案
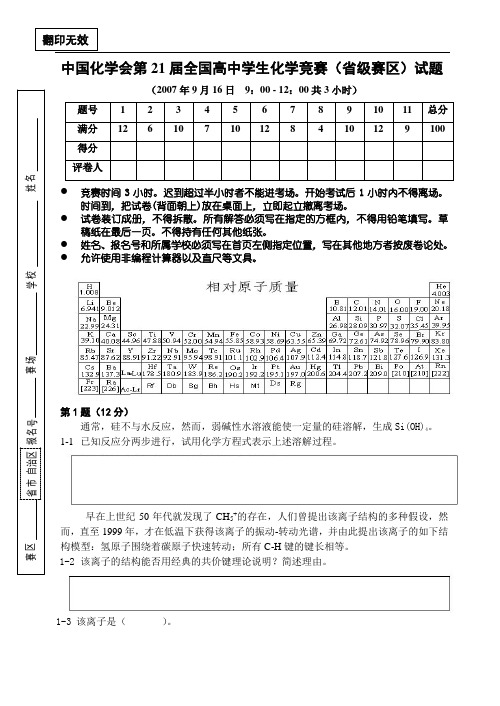
翻印无效中国化学会第21届全国高中学生化学竞赛(省级赛区)试题(2007年9月16日 9:00 - 12:00共3小时)题号 1 2 3 4 5 6 7 8 9 10 11 总分 满分 12 6 10 7 10 12 8 4 10 12 9 100 得分 评卷人● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
第1题(12分)通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成Si(OH)4。
1-1 已知反应分两步进行,试用化学方程式表示上述溶解过程。
早在上世纪50年代就发现了CH 5+的存在,人们曾提出该离子结构的多种假设,然而,直至1999年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H 键的键长相等。
1-2 该离子的结构能否用经典的共价键理论说明?简述理由。
1-3 该离子是( )。
姓名学校赛场报名号赛区省市自治区A.质子酸B.路易斯酸C.自由基D.亲核试剂2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。
该分子的结构简图如下:1-4该分子的分子式为;1-5该分子有无对称中心?1-6该分子有几种不同级的碳原子?1-7该分子有无手性碳原子?1-8该分子有无手性?第2题(5分)羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下:NH2OH+HN﹡O2→A+H2ONH2OH+HN﹡O2→B+H2OA、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。
全国化学竞赛(初赛)试题与答案4页

全国高中学生化学竞赛初赛试题考试时间:二小时半一、(8分)单质和硝酸混合(1)反应生成相应硝酸盐的单质是、。
(2)反应生成最高价氧化物或含氧酸的单质是、。
(3)呈钝态的单质是、。
(4)不发生反应的单质是、。
二、(6分)酸雨主要是燃烧含硫燃料时释放二氧化硫造成的。
现每隔一定时间测定某份雨水样品的pH值。
测试时间(小时)0 1 2 4 8雨水的pH 4.73 4.62 4.56 4.55 4.55请说明在测定的时间里,雨水样品pH变小的原因。
三、(8分)为降低硫的氧化物对空气的污染,可把氧化钙或碳酸钙和含硫的煤混合后燃烧(这种方法叫做“钙基固硫”)。
请写出钙基固硫的反应方程式。
请从反应热角度讨论用氧化钙或碳酸钙的区别。
四、(1分)以无机物态存在于土壤中的磷,多半是和钙、铝、铁结合的难溶磷酸盐。
磷酸钙在酸性条件下溶解度增大,使磷的肥效增强;加入土壤中的磷酸钙久后则转变为磷酸铝、磷酸铁,导致磷的肥效降低。
请解释并回答下列问题。
(1)磷酸铝在酸性条件下其溶解量(和在近中性条件下的相比)(填入增大、持平或减小。
不同),在碱性条件下其溶解量。
因为:(2)磷酸铁在碱性条件下其溶解量。
因为:(3)作为磷肥,磷酸铁的肥效不高,但在水田中,其肥效往往明显增高。
因为:。
五、(4分)已知四种无机化合物在水中、液氮中的溶解度(克溶质/100克溶剂)为:写出上述几种化合物在水溶液和液氨溶液中发生复分解反应的方向六、(10分)从某些方面看,氨和水相当,NH4+和H3O+(常简写为H+)相当,NH2-和OH-相当,NH2-(有时还包括N3-)和O2-相当。
(1)已知在液氨中能发生下列二个反应NH4Cl+KNH2=KCl+2NH22NH4I+PbNH=PhI2+3NH3请写出能在水溶液中发生的与上二反应相当的反应方程式。
(2)完成并配平下列反应方程式(M为金属):M+NH3→MO+NH4Cl→M(NH2)2→七、(12分)已知:20(原子量;Ca,40.0;O,16.0;C,12.0;H,1.01)请用计算说明,当持续把二氧化碳(压强为0.982巴,下同)通入饱和石灰水,开始生成的白色沉淀会否完全“消失”?在多次实验中出现了下列现象,请解释。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第28届中国化学奥林匹克初赛试题第1题(6分)合成氨原料气由天然气在高温下与水和空气反应而得。
涉及的主要反应如下:(1)CH4(g)+H2O(g)→CO(g)+3H2(g)(2)2CH4(g)+O2(g)→2CO(g)+4H2(g)(3)CO(g)+H2O(g)→H2(g)+CO2(g)假设反应产生的CO全部转化为CO2,CO2被碱液完全吸收,剩余的H2O通过冷凝干燥除去。
进入合成氨反应塔的原料气为纯净的N2和H2。
1-1为使原料气中的N2和H2的体积比为1∶3,推出起始气体中CH4和空气的比例。
设空气中O2和N2的体积比为1∶4,所有气体均按理想气体处理。
1-2计算反应(2)的反应热。
已知:(4)C(s)+2H2(g)→CH4(g)ΔH4=-74.8kJ mol-1(5)C(s)+1/2O2(g)→CO(g)ΔH5=-110.5kJ mol-1第2题(5分)连二亚硫酸钠是一种常用的还原剂。
硫同位素交换和核磁共振实验证实,其水溶液中存在亚硫酰自由基负离子。
2-1写出该自由基负离子的结构简式,根据VSEPR理论推测其形状。
2-2连二亚硫酸钠与CF3Br反应得到三氟甲烷亚磺酸钠。
文献报道,反应过程主要包括自由基的产生、转移和湮灭(生成产物)三步,写出三氟甲烷亚磺酸根形成的反应机理。
第3题(6分)2013年,科学家通过计算预测了高压下固态氮的一种新结构:N8分子晶体。
其中,N8分子呈首尾不分的链状结构;按价键理论,氮原子有4种成键方式;除端位以外,其他氮原子采用3种不同类型的杂化轨道。
3-1画出N8分子的Lewis结构并标出形式电荷。
写出端位之外的N原子的杂化轨道类型。
3-2画出N8分子的构型异构体。
第4题(5分)2014年6月18日,发明开夫拉(Kevlar)的波兰裔美国女化学家Stephanie Kwolek 谢世,享年90岁。
开夫拉的强度比钢丝高5倍,用于制防弹衣,也用于制从飞机、装甲车、帆船到手机的多种部件。
开夫拉可由对苯二胺和对苯二甲酸缩合而成。
4-1写出用结构简式表达的生成链状高分子的反应式。
4-2写出开夫拉高分子链间存在的3种主要分子间作用力。
第5题(7分)环戊二烯钠和氯化亚铁在四氢呋喃中反应,或环戊二烯与氯化亚铁在三乙胺存在下反应,可制得稳定的双环戊二烯基合铁(二茂铁)。
163.9K以上形成的晶体属于单斜晶系,晶胞参数a=1044.35pm,b=757.24pm,c=582.44pm,β=120.958º。
密度1.565g cm-3。
5-1写出上述制备二茂铁的两种反应的方程式。
5-2通常认为,二茂铁分子中铁原子的配位数为6,如何算得的?5-3二茂铁属于哪种晶体类型?5-4计算二茂铁晶体的1个正当晶胞中的分子数。
376-1计算37℃下反应(a)的平衡常数K。
6-2导出平衡时结合度(α)随氧分压变化的表达式,若空气中氧分压为20.0kPa,计算人正常呼吸时Mb与氧气的最大结合度。
6-3研究发现,正向反应速率v正=k A[Mb]p(O2);逆向反应速率v逆=k D[MbO2]。
已知k D=60s-1,计算速率常数k A。
当保持氧分压为20.0kPa,计算结合度达50%所需时间。
(提示:对于v逆=k D[MbO2],MbO2分解50%所需时间为t=0.693/k D)6-4Mb含有一个Fe(II),呈顺磁性,与氧结合后形成的MbO2是抗磁性的。
MbO2中的铁周围的配位场可近似为八面体场。
6-4-1这一过程中Fe(II)的价态是否发生改变?简述原因。
6-4-2写出MbO2中铁离子在八面体场中的价电子排布。
6-4-3结合O2前后铁离子的半径是不变、变大还是变小?简述原因。
6-4-4O2分子呈顺磁性,它与Mb结合后,价电子排布是否发生变化?简述原因。
第7题(12分)在0.7520g Cu2S、CuS与惰性杂质的混合样品中加入100.0mL0.1209mol L-1KMnO4的酸性溶液,加热,硫全部转化为SO42-,滤去不溶杂质。
收集滤液至250mL容量瓶中,定容。
取25.00mL溶液,用0.1000mol L-1FeSO4溶液滴定,消耗15.10mL。
在滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(掩蔽Fe3+和Mn2+),至沉淀溶解后,加入约1g KI固体,轻摇使之溶解并反应。
用0.05000mol L-1Na2S2O3溶液滴定,消耗14.56mL。
写出硫化物溶于酸性高锰酸钾溶液的方程式,计算混合样品中Cu2S和CuS的含量。
第8题(14分)不同条件下,HgBr2溶液(必要时加HgO)与氨反应可得不同产物。
向HgBr2溶液中加入氨性缓冲溶液,得到二氨合溴化汞A。
向浓度适中的HgBr2溶液中加入氨水,得到白色沉淀B,B的化学式中汞离子、氨基和Br-的比例为1∶1∶1。
将含NH4Br的HgBr2浓溶液与HgO混合,得到化合物C,C中汞离子、亚氨基和Br-的比例为2∶1∶2。
HgBr2的浓溶液在搅拌下加入稀氨水,得到浅黄色沉淀D,D是一水合溴氮化汞。
从A到D的结构中,Hg(II)与N的结合随N上所连氢原子的数目而变化,N均成4个键,N-Hg-N键角为180º。
A中,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg(II),NH3位于立方体的体心。
B中,Hg(II)与氨基形成一维链。
C中存在Hg(II)与亚氨基形成的按六边形扩展的二维结构,Br-位于六边形中心。
D中,(Hg2N)+形成具有类似SiO2的三维结构。
8-1写出生成C和D的方程式。
8-2画出A的结构示意图(NH3以N表示)。
8-3画出B中Hg(II)与氨基(以N表示)形成的一维链式结构示意图。
8-4画出C中二维层的结构示意图,写出其组成式。
层间还存在哪些物种?给出其比例。
8-5画出D中(Hg2N)+的三维结构示意图,示出Hg与N的连接方式即可。
8-6令人惊奇的是,组成为HgNH2F的化合物并非与HgNH2X(X=Cl、Br、I)同构,而与D相似,存在三维结构的(Hg2N)+。
写出表达HgNH2F结构特点的结构简式。
第9题(7分)9-1在方框中按稳定性顺序分别画出由氯甲基苯、对甲氧基氯甲基苯以及对硝基氯甲基苯生成的稳定的阳离子的结构简式。
9-2间硝基溴苯、2,4-二硝基溴苯、对硝基溴苯以及2,4,6-三硝基溴苯在特定条件下均能与HO-反应,在方框中按其反应活性顺序分别画出对应化合物的结构简式。
第10题(12分)在有机反应中,反式邻二醇是一类重要原料,可以通过烯烃的氧化反应制备。
下式给出了合成反式邻二醇的一种路线:第一步反应:2A B C 第二步反应:但在合成非对称的异靛蓝衍生物时,却得到3个化合物:N HOO Br N N H O N H H N N O O BrCH 3CO 2H ,HCl 回流CH 3I ,K 2CO 3DMF ,100℃+H+I +J 45%20%25%C 17H 12BrN 3O 2C 18H 12Br 2N 2O 2C 16H 12BrN 4O 2画出产物H 、I 及J 的结构简式,并画出生成I 和J 的反应过程。
第28届中国化学奥林匹克初赛试题参考答案第1题(6分)第2题(5分)第3题(6分)第4题(5分)第6题(16分)第8题(14分)第9题(7分)第10题(12分)第11题(10分)第29届中国化学奥林匹克初赛试题及答案第1题(8分)写出下列各化学反应的方程式。
1-1将热的硝酸铅溶液滴入热的铬酸钾溶液产生碱式铬酸铅沉淀[Pb2(OH)2CrO4]。
1-2向含氰化氢的废水中加入铁粉和K2CO3制备黄血盐[K4Fe(CN)6·3H2O]。
1-3酸性溶液中,黄血盐用KMnO4处理,被彻底氧化,产生NO3-和CO2。
1-4在水中,Ag2SO4与单质S作用,沉淀变为Ag2S,分离,所得溶液中加碘水不褪色。
第2题(12分)2-1实验室现有试剂:盐酸,硝酸,乙酸,氢氧化钠,氨水。
从中选择一种试剂,分别分离以下各组固体混合物(不要求复原,括号内数据是溶度积),指出溶解的固体。
(1)CaCO3(3.4×10-9)和CaC2O4(2.3×10-9)(2)BaSO4(1.1×10-10)和BaCrO4(1.1×10-10)(3)Zn(OH)2(3.0×10-17)和Ni(OH)2(5.5×10-16)(4)AgCl(1.8×10-10)和Agl(8.5×10-17)(5)ZnS(2.5×10-22)和HgS(1.6×10-52)2-2在酸化的KI溶液中通入SO2,观察到溶液变黄并出现混油(a),继续通SO2,溶液变为无色(b),写出与现象a和b相对应所发生反应的方程式。
写出总反应方程式(c),指出KI在反应中的作用。
2-3分子量为4000的聚乙二醇有良好的水溶性,是一种缓泻剂,它不会被消化道吸收,也不会在体内转化,却能使肠道保持水分。
2-3-1以下哪个结构简式代表聚乙二醇?2-3-2聚乙二醇为何能保持肠道里的水分?2-3-3聚乙二醇可由环氧乙烷在酸性条件下聚合而成,写出反应式。
第3题(10分)3-1早在19世纪初期,法国科学家Dulong和Petit测定比热时,发现金属的比热(c m)与其原子量的乘积近似为常数6cal·g-1·℃-1(1cal=4.18J)。
当时已知的原子量数据很少,因此,可利用比热推算原子量,进而采用其他方法分析得到更精确的原子量。
3-1-1将40.Og金属M块状样品加热到100℃,投入50.0g温度为15.2℃的水中,体系的温度为17.2℃。
推算该金属的摩尔质量。
3-1-2取金属M的粉末样品l.000g,加热与氧气充分反应,得氧化物1.336g。
计算该金属的摩尔质量,推测其氧化物的化学式(金属与氧的比例为简单整数比)。
3-1-3M是哪种金属?3-2电解法生产铝须用纯净的氧化铝。
铝矿中常含石英、硅酸盐等杂质,需预先除去。
在拜耳法处理过程中,硅常以硅铝酸盐(Na6A16Si5O22·5H2O)“泥”的形式沉积下来。
现有一种含10.0%(质量)高岭土(A12Si2O7·2H2O)的水铝石[Al(OH)3]原料,计算纯化处理中铝的损失率。
第4题(8分)腐殖质是土壤中结构复杂的有机物,土壤肥力与腐殖质含量密切相关。
可采用重铬酸钾法测定土壤中腐殖质的含量:称取0.1500克风干的土样,加入5mL0.10mol·L-l K2Cr2O7的H2SO4溶液,充分加热,氧化其中的碳(C—CO2,腐殖质中含碳58%,90%的碳可被氧化)。
以邻菲罗啉为指示剂,用0.1221mol·L-l的(NH4)2SO4·FeSO4溶液滴定,消耗10.02mL。
