药品不良反应监测报告表格
药品不良反应、事件报告表
国内有无类似不良反应(包括文献报道): 有 关联性 评价 报告人: 肯定
国外有无类似不良反应(包括文献报道): 有 可能 可能 可能无关 可能无关 待评价 待评价 是 是 是 是 否 不明 不明 无法评价 无法评价
很可能 很可能
报告单位: 肯定
1. 用药与不良反应的出现有无合理的时间关系? 2. 反应是否符合该药已知的不良反应类型? 不良反应分析 3. 停药或减量后,反应是否消失或减轻? 4. 再次使用可疑药品后是否再次出现同样反应?
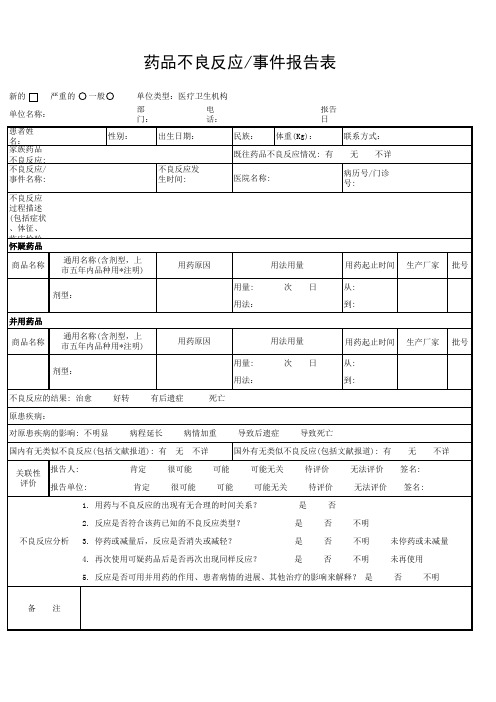
药品不良反应/事件报告表
新的 严重的 一般 单位类型:医疗卫生机构 部门: 性别: 无 不详 不良反应发生时间: 医院名称: 不良反应过程描述(包括症状、体征、临床检验等)及处理情况: 病历号/门诊号: 出生日期: 电话: 民族: 体重(Kg): 报告日期: 联系方式: 无 不详 单位名称: 患者姓名: 家族药品不良反应: 有 不良反应/事件名称:
既往药品不良反应情剂型,上 市五年内品种用*注明) 剂型: 用法: 并用药品 商品名称 通用名称(含剂型,上 市五年内品种用*注明) 剂型: 用法: 不良反应的结果: 治愈 原患疾病: 对原患疾病的影响: 不明显 病程延长 无 病情加重 不详 导致后遗症 导致死亡 无 签名: 签名: 不详 好转 有后遗症 死亡 用药原因 用量: 用法用量 次 日 用药起止时间 从: 到: 生产厂家 批号 用药原因 用量: 用法用量 次 日 用药起止时间 从: 到: 生产厂家 批号
否 否 否
未停药或未减量 未再使用 否 不明
不明
5. 反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释? 是
备 注
报告人职业:
报告人职务/职称:
报告人签名:
药品不良反应报告表

药品不良反应/事件报告表 报告人单位名称: 患者姓名: 家族药品不良反应: 就诊医院: 原患疾病: 部门 性别: 男口 女口 出生日期: 有口 无口 不详口 病历号(门诊号): 不良反应/事件名称: 电话 年 月 日 既往药品不良反应: 报告日期: 民族: 有口 年 月日 体重:(kg) 无口 不详口
联系方式: 不良反应发生时间: 年 月 日
不良反应过程描述(包括症状、体征、临床检验)及处理情况:
怀疑引起不良反应/事件的药品: 商品名称 通用名称 生产厂家 批号 剂型 用法用量 日剂量 用法 给药途径 用药起止时间 用药原因
并用 药品 不良反应的结果: 治愈口 好转口 有后遗症口 死亡口 直接死因: 对原患疾病的影响: 不明显口 病程延长口 病情加重口 导致后遗症口 表现: 国内、外有无类似不良反应(包括文献报道) 国内: 有口 无口 不详口 死亡时间: 年 月 日
导致死亡口
国外:
有口
无口
不详口
报告人: 肯定口 很可能口 可能口 可能无关口 待评价口 无法评价口 签名: 关联性 评价 报告单位:肯定口 很可能口 可能口 可能无关口 待评价口 无法评价口 签名: 1.用药与不良反应的出现有无合理的时间关系? 2.反应是否符合该药已知的不良反应类型? 不良反 3.停药或减量后,反应是否消失或减轻? 应分析 4.再次使用可疑药品后是否再次出现同样反应? 其他: 有口无口 是口否口不明口 是口否口不明口未停药或未减量口 是口否口不明口未再使用口 是口否口不明口
5.反应是否可用并用药的作用,患者病情的进展,其他治疗的影响来解释?
报告人
药品不良反应报告表 空表(供打印用)

药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
1.药品不良反映事件报告表

附表1制表单位:国家食物药品监督治理局药品不良反应/ 事件报告表新的□严峻□一样□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□单位名称:部门::报告日期:年月日◇不良反映/事件分析1.用药与不良反应/事件的出现有无合理的时间关系?有□无□2.反应是否符合该药已知的不良反应类型?是□否□不明□3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□◇严峻药品不良反映/事件是指有以下情形之一者:①引发死亡□②致畸、致癌或诞生缺点□③对生命有危险并能够致使人体永久的或显著的伤残□④对器官功能产生永久损伤□⑤致使住院或住院时刻延长□◇编码规那么:省(自治区、直辖市) 市(地域)县(区)单位年代流水号□□□□□□□□□□□□□□□□□□□注:省(自治区、直辖市)、市(地域)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一名如下填写:医疗机构一、军队医院二、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000◇注:通用名称一栏,第一次获准入口5年内的入口品种用*注明国家药品不良反映监测中心药品不良反映监测中心通信地址:北京市崇文区法华南里11号楼二层通信地址:邮编:100061 邮编:电话:(010)电话:传真:(010)传真:E – mail : E – mail:新的、严峻的药品不良反映/事件病例报告要求药品生产企业报告要求1.填报《药品不良反映/事件报告表》;2.产品质量查验报告;3.药品说明书(入口药品还须报送国外药品说明书);4.产品注册、再注册时刻,是不是在监测期内(入口药是不是为第一次获准入口5年内);5.产品状态(是不是是国家大体药物、国家非处方药、国家医疗保险药品、中药爱惜品种);6.国内上年度的销售量和销售范围;7.境外利用情形(包括注册国家、注册时刻);8.变更情形(药品成份或处方、质量标准、生产工艺、说明书变更情形);9.国内外临床平安性研究及有关文献报导情形;10.除第一、2项之外,其他项目一年之内如无变更,能够免报。
药品不良反应报告表范例

药品不良反应报告表范例 LELE was finally revised on the morning of December 16, 2020
药品不良反应 / 事件报告表
新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□
单位名称:部门:电话:报告日期:年月日
不良反应
分析
1.用药与不良反应的出现有无合理的时间关系有√无□
2.反应是否符合该药已知的不良反应类型是√否□不明□
3.停药或减量后,反应是否消失或减轻是√否□不明□未停药或未减量□
4.再次使用可疑药品后是否再次出现同样反应是□否□不明□未再使用√
5.反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释是□否√不明□
报告人职业(医疗机构):医生□药师□护士□其他□报告人职务职称(企业):报告人签名:。
药品不良反应监测报告表格
相关重要信息:吸烟史□ 饮酒史□ 妊娠期□ 肝病史□ 肾病史□ 过敏史□其他□
药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
用药原因
怀疑药品
并用药
品
不良反应/事件名称:
不良反应/事件发生时间: 年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
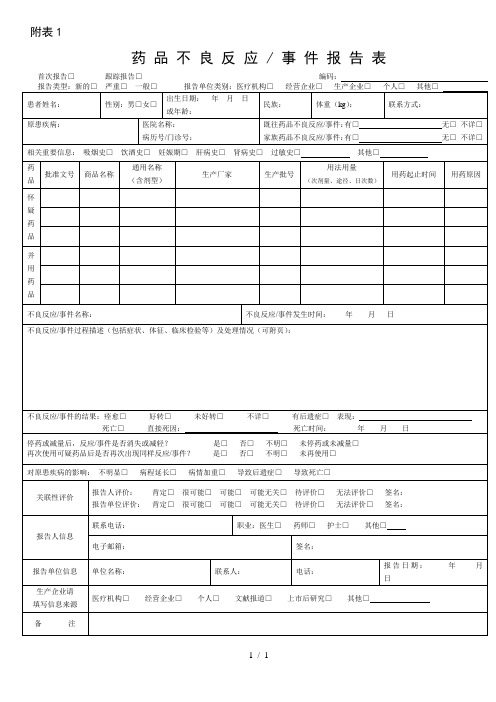
附表1
药 品 不 良 反 应 / 事 件 报 告 表
首次报告□ 跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□ 生产企业□ 个人□ 其他□
患者姓名:
性别:男□女□
出生日期:年 月 日
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院பைடு நூலகம்称:
病历号/门诊号:
既往药品不良反应/事件:有□无□不详□
关联性评价
报告人评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□其他□
药品不良反应报告表范例
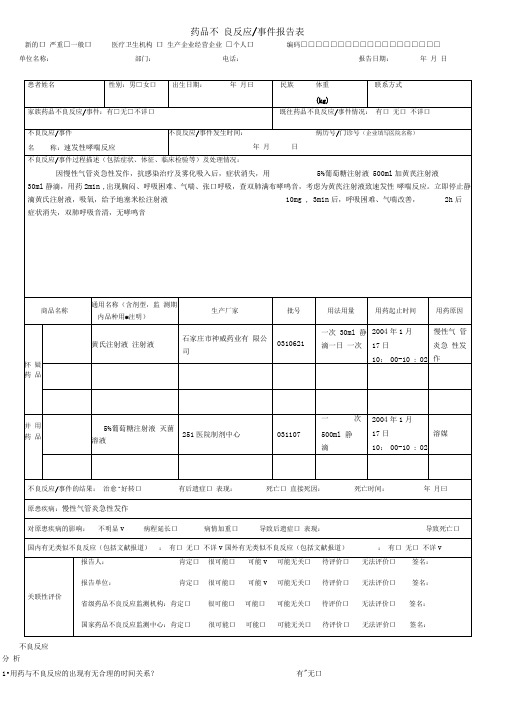
药品不良反应/事件报告表
新的口严重□一般口医疗卫生机构口生产企业经营企业□个人口编码□□□□□□□□□□□□□□□□□□□单位名称:部门:电话:报告日期:年月日
不良反应
分析
1•用药与不良反应的出现有无合理的时间关系?有"无口
是"
否口 不明口
未停药或未减量口 是口 否口 不明口 未再使用"
是口 否" 不明口
报告人签名:
2. 反应是否符合该药已知的不良反应类型?
3. 停药或减量后,反应是否消失或减轻?
4. 再次使用可疑药品后是否再次出现同样反应?
5. 反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?
报告人职业(医疗机构):医生口 药师口 护士口 其他口 报告人职务职称(企业)
是“否□不明口。
药品不良反应报告表

药品不良反应报告表药品不良反应报告表是一种用于记录药品不良反应情况的重要文档,它对于监测药品的安全性和有效性具有重要意义。
药品不良反应是指在正常用药剂量下,可能出现的与药物治疗目的无关的不良反应,包括药物毒性、药物过敏、药物滥用等。
及时、准确地记录和报告药品不良反应,有助于及时发现和评估药品的不良反应风险,保障患者用药安全。
药品不良反应报告表通常包括以下内容:1. 药品信息,包括药品通用名称、商品名、生产厂家等信息。
2. 患者信息,包括患者姓名、性别、年龄、病史等信息。
3. 不良反应描述,对患者出现的不良反应进行详细描述,包括症状、发生时间、持续时间、严重程度等。
4. 用药信息,包括药品名称、剂量、给药途径、用药频次、用药时间等信息。
5. 其他相关信息,如患者的基本疾病情况、合并用药情况等。
在填写药品不良反应报告表时,需要注意以下几点:1. 准确记录,对于患者出现的不良反应,应尽量准确地描述症状、发生时间和相关信息,避免遗漏或错误记录。
2. 及时报告,一旦发现患者出现不良反应,应及时填写药品不良反应报告表,并向医疗机构或药品监管部门进行报告。
3. 保护隐私,在填写患者信息时,应严格遵守患者隐私保护原则,确保患者个人信息的保密性。
4. 客观描述,在描述不良反应时,应客观、准确地描述症状和相关信息,避免主观臆断或夸大描述。
药品不良反应报告表的填写和报告工作,需要医务人员和药品监管部门的共同努力。
只有通过及时、准确地记录和报告药品不良反应情况,才能更好地保障患者用药安全,促进药品的合理使用和监管。
希望各医疗机构和医务人员能够重视药品不良反应的监测和报告工作,共同维护患者的用药安全和健康。
药品不良反应工作报告表

药品不良反应/事件报告表报告类型:新的口严重口一般口首次报告口跟踪报告口报告来源:医疗机构口药品经营企业口药品生产企业口其他口除非得到允许,报告表中的个人信息将予以保密。
严重药品不良反应/事件是指因使用药品引起以下损害情形之一的反应/事件:1)导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或永久的人体伤残或器官功能的损伤;5)导致住院或住院时间延长6)其他有意义的重要医学事件。
如,尽管事件不会立即危及生命或导致死亡和所列情况可能/或需住院,但为了预防出现任一上述需要进行治疗,通常也被认为是严重的。
关联性评价说明:肯定:用药及反应发生时间顺序合理;停药以后反应停止,或迅速减轻或好转;再次使用,反应再现,并可能加重(即激发试验阳性),同时有文献资料佐证,并已排除原患疾病等其他混杂因素影响。
很可能:无重复用药史,余同“肯定” ,或虽然有合并用药,但基本可排除合并用药导致反应发生的可能性。
可能:用药与反应发生时间关系密切,同时有文献资料佐证;但引发ADR/ADE 的药品不止一种,或原患疾病病情进展因素不能排除。
可能无关:ADR/ADE 与用药时间相关性不密切,反应表现与已知该药的ADR/ADE 不吻合,原患疾病发展同样可能有类似的临床表现。
待评价:报表内容填写不齐全,等待补充后再评价,或因果关系难以定论,缺乏文献佐证。
无法评价:报表缺项太多,因果关系难以定论,资料又无法补充。
其他说明合并用药:指发生此药品不良反应/事件时患者除怀疑药品外得其他用药情况,其中也包括患者自行购买的药品或中草药等。
报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应之间的关系。
我们会考虑风险是否普遍或严重,然后决定我们是否需要采取行动,例如在药品说明书中加入警示信息,更新药品如何安全使用的信息,如,限制使用剂量或在某些特定人群中限制使用。
极少数情况下,我们会把产品撤市,只有当我们认为产品的风险大于效益时。
药物不良反应事件报告表

2.不良反应的具体表现:
3.不良反应的体征及相关检验结果:
4.处理:
5.不良反应治愈或好转的时间:
商品名称
生产厂家
批号
用法用量
用药起止时间
用药原因
怀
疑
药
品
并
用
药
品
不良反应/事件的结果:治愈□好转□有后遗症□表现: 死亡□直接死因:
其他□具体描述:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现: 导致死亡□
报告人签名:
药物不良反应/事件报告表
单位名称:部门:电话:报告日期: 年 月 日
患者姓名性别:男□女□来自年龄:民族体重
(kg)
联系方式
家族药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名 称:
不良反应/事件发生时间:
年 月日
病历号/门诊号
原患疾病:
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
药品不良反应报告表

药品不良反应报告表患者姓名:性别:民族:体重:(kg)年龄:既往(家族)药品不良反应/事件情况(无或有;有请说明):原患疾病:病历号/门诊号:联系方式:不良反应/事件名称(注:不良反应的症状):不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:患者于年月日因使用了用法、用量厂家批号用药时间月日至月日,用药后(何)时出现了(不良反应的症状),(针对该药品不良反应的症状)时采取的措施(是否停药及相应的检查和观察生命体征变化),在月日时,的症状开始缓解或消失。
填报企业、医院名称(单位名称):报告人职业:报告人签名(手签存档):报告日期:年月日备注:1.严重病例应标明生命体征变化2.新的报告(药品说明书没有说明的即为新的)3.严重的报告(不良反应症状经过抢救者或导致住院或住院时间延长(住院时间是否达到48小时),病程延长5天以上的根据情况判定。
联系电话:66892008、88161283)规范《药品不良反应/事件报告表》填报为进一步规范药品不良反应病例报告的书写,加强报告质量控制,保证报告的规范性、完整性和真实性,不断提高药品不良反应信息利用度。
现将《药品不良反应/事件报告表》规范化填报提出以下要求:基本要求国家中心在数据库中利用检索统计的方法对数据加以整理、分析和利用。
要求报表填写人员保证基础数据的精准,避免错误出现,才能使国家中心检索的宏观数据准确。
1、内容应客观真实、完整准确,避免错别字、缺漏项的出现;2、避免使用报告表中未规定的符号、代号和不通用的缩写形;3、每一个病人填写一张报告表;4、尽可能详细地填写报告表中所要求的项目。
有些内容确实无法获得时,可填写“不详”;5、省中心对不规范的电子报表采用在线直接退回,并提示报表中存在的问题,而上报机构收到退回的电子报表要认真对待,及时完善报表内容。
主要存在问题一、报告单位填写:报告单位为上报报表的单位全称。
填写报告单位名称应统一、规范,务必做到经核实准确无误、一字不差,不可使用不规范简称,已在网上注册的填报单位必须与网报医院注册名称一致。
药品不良反应事件报告表

怀疑药品
并用药
品
不良反应/事件名称:
不良反应/事件发生时间: 年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
患者因患(原患疾病名称),于月日开始给予(药品通用名称),(给药途径),日次,一次(用法用量)。患者于月日点分(出现不良反应的时间)出现(不良反应的症状、体征),辅助检查结果:心率:次/分、血压:mmHg、呼吸:次/分、体温:℃(及其他相关检查结果如血常规、肝肾功能检查、心电图等)。月日点分,给予(出现不良反应后处置措施),患者于月日点分,不良反应症状(不良反应动态变化的症状、体征),患者于月日点分,不良反应症状(不良反应结果)。
不良反应/事件的结果:痊愈( )好转( )未好转( )不详( )有后遗症( )表现:
死亡( )直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是( )否( )不明( )未停药或未减量( )
再次使用可疑药品后是否再次出现同样反应/事件?是( )否( )不明( )未再使用( )
病的影响:不明显( )病程延长( )病情加重( )导致后遗症( )导致死亡( )
联系人:
电话:
报告日期:年 月 日
生产企业请
填写信息来源
医疗机构( )经营企业( )个人( )文献报道( )上市后研究( )其他( )
备注
1、请在所需项目的“( )”内插入“√”
2、不良反应事件名称:应填具体反应现象,例如:皮疹、胸闷
3、以上项目请务必填全
药品不良反应/事件报告表
首次报告( )跟踪报告( )报告科室:南区北区编码:
报告类型:新的( )严重( )一般( )报告单位类别:医疗机构( )经营企业( )生产企业( )个人( )其他( )
药品不良反应报告表
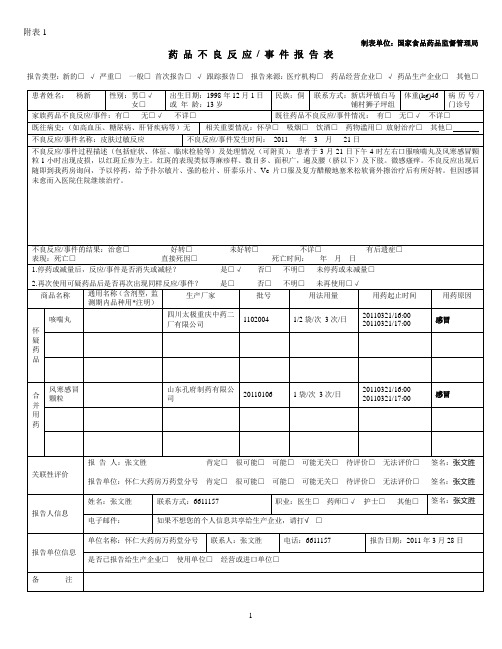
批号
用法用量
用药起止时间
用药原因
怀
疑
药
品
咳喘丸
四川太极重庆中药二厂有限公司
1102004
1/2袋/次3次/日
20110321/16:00____
20110321/17:00
感冒
合并用药
风寒感冒颗粒
山东孔府制药有限公司
20110106
1袋/次3次/日
20110321/16:00____
201103Leabharlann 1/17:00感冒关联性评价
报告人:张文胜肯定□很可能□可能□可能无关□待评价□无法评价□签名:张文胜
报告单位:怀仁大药房万药堂分号 肯定□很可能□可能□可能无关□待评价□无法评价□签名:张文胜
报告人信息
姓名:张文胜
联系方式:6611157
职业:医生□药师□√护士□其他□
签名:张文胜
电子邮件:
如果不想您的个人信息共享给生产企业,请打√□
报告单位信息
单位名称:怀仁大药房万药堂分号
联系人:张文胜
电话:6611157
报告日期:2011年3月28日
是否已报告给生产企业□使用单位□经营或进口单位□
备注
附表1
制表单位:国家食品药品监督管理局
药品不良反应/事件报告表
报告类型:新的□√严重□一般□首次报告□√跟踪报告□报告来源:医疗机构□药品经营企业□√药品生产企业□其他□
患者姓名: 杨新
性别:男□√
女□
出生日期:1998年12月1日
或年龄:13岁
民族:侗
联系方式:新店坪镇白马铺村狮子坪组
体重(kg)46
不良反应/事件的结果:治愈□好转□未好转□不详□有后遗症□
最新药品不良反应报告表

填写信息来源
医疗机构□ 经营企业□ 个人□ 文献报道□ 上市后研究□ 其他□
备 注
相关重要信息:吸烟史□ 饮酒史□ 妊娠期□ 肝病史□ 肾病史□ 过敏史□其他□
药品
批准文号
通用名称
(含剂型)
生产厂家
生产批号
用法用量
用药起止时间
用药原因
怀疑药品
月 日
月 日
月 日
月日
月 日
月 日
并用药
品
月 日
月 日
月 日
月 日
月 日
月 日
不良反应/事件名称:
不良反应/事件发生时间:年月日
不良反应/事件过程描述(包括症状、生命体征、临床检验等)及处理情况(可附页):
最 新药品不良反应报告表
首次报告□跟踪报告□编码:
报告类型:新的□ 严重□ 一般□报告单位类别:医疗机构□经营企业□ 生产企业□ 个人□ 其他□
患者姓名:
性别:男□女□
出生日期:年 月 日
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
病历号/门诊号:
既往药品不良反应/事件:有□无□ 不详□
家族药品不良反应/事件:有□无□ 不详□
患者因病来我院(门诊、住院)治疗,年月日时遵医嘱给予( g □、mg□、ug□、ml□或IU□)加溶媒ml(静滴□、肌注□、口服□或外用□),日次,约(天、小时、分钟)输入ml后,出现等症状,查体,诊断为药物不良反应,遵医嘱给予
等治疗,约(天、小时、分钟)后,症状(逐渐有所好转□、无明显好转□或进一步加重□)。此后(未再继续使用该药□、继续使用该药□)。
不良反应/事件的结果:痊愈□ 好转□ 未好转□ 不详□ 有后遗症□ 表现:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药 品 不 良 反 应 / 事 件 报 告 表
首次报告□ 跟踪报告□编码:
报告类型:新的□ 严重□一般□报告单位类别:医疗机构□经营企业□ 生产企业□ 个人□ 其他□患者姓名:性别:来自□女□出生日期:年 月 日
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院名称:
病历号/门诊号:
既往药品不良反应/事件:有□无□不详□
关联性评价
报告人评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□无法评价□签名:
报告单位评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:年 月 日
生产企业请
填写信息来源
医疗机构□ 经营企业□ 个人□ 文献报道□ 上市后研究□ 其他□
备注
THANKS !!!
致力为企业和个人提供合同协议,策划案计划书,学习课件等等
打造全网一站式需求
欢迎您的下载,资料仅供参考
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
家族药品不良反应/事件:有□无□ 不详□
相关重要信息:吸烟史□ 饮酒史□ 妊娠期□ 肝病史□ 肾病史□ 过敏史□其他□
药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
用药原因
怀疑药品
并用药
品
不良反应/事件名称:
不良反应/事件发生时间: 年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
