手性药物优秀课件
合集下载
手性药物HPLC分析课件

2003年世界销售额领先前10之一:
降血脂药辛伐他丁、PP胃T学习交酸流 分泌抑制剂艾美拉唑
17
一、概述
固定比例(非消旋体)对映体药物
为产生最佳疗效需要开发两种对映体 固定比例的非消旋混合物.
茚达立酮是以消旋体形式上市的抗高血压药.右旋体 利尿作用,但引起尿酸滞留, 左旋体排尿酸作用,因此 确定两者比例消除不良反应,达最佳疗效.
PPT学习交流
25
二、手性药物药学研究的基本思路
(一)合成过程中控制光学纯度
3. 消旋体的拆分
采用手性拆分试剂与外消旋的
中间体或终产品反应生成非对映异 构体,分离纯化得到所需的非对映 异构体,再去掉手性拆分试剂,从而 得到所需的手性药物.
PPT学习交流
26
二、手性药物药学研究的基本思路
(一)合成过程中控制光学纯度
一、概述
(5) 两个对映体具有完全相同的药理作用
如普罗帕酮的两个对映体具有相同 的抗心率失常作用. 无需使用单一对映体.
PPT学习交流
14
一、概述
对手性药物开发
消旋体药物? 单一対映体药物? 固定比例(非消旋体)对映体?
PPT学习交流
15
一、概述
消旋体药物
两种对映体药理性质和治疗作用类似或互补; 对映体在体内有明显的外消旋作用或不稳定; 缺少对映体选择性合成途径; 无治疗作用的对映体无毒性或毒性可忽略.
37
三、质量研究与质量标准
3. 分析方法专属性的验证
方法专属性的验证,可采用消旋 体或与对映异构体混和进样的方式 考察对映体间的分离度.
PPT学习交流
38
三、质量研究与质量标准
2.1 原料药
【性状】项下的比旋度是手性药物的 特征之一,可以说明药品的光学特征 和纯度.
chapter04手性药物参考PPT

•10
三、影响手性药物生产成本的主要因素
(1)起始原料的成本 (2)拆分试剂,化学或生物催化剂的成本 (3)化学收率和产物的光学纯度 (4)反应步骤的数量 (5)拆分或不对称合成在多步合成中的位置 (6)非目标立体异构体的转化利用
•11
§4.2 外消旋体拆分
普通化学合成得到的是外消旋体,必须经过光学拆分才 能得到光学纯异构体。
(S)-amine-CAS salt
pKa
通过发酵方式大量生产的氨基酸,均为L-氨基酸。利 用非对映异构体的相互转化可将价廉易得的L-氨基酸 转化成D-氨基酸。例如以L-脯氨酸(4-38)为原料生 产D-脯氨酸(4-39)。
HO COOH
H
HO COOH
这些政策和法规极大地推动着手性药物的研究和发 展。手性药物大量增长的时代正在来临,手性技术 的发展和日趋完善,为手性工业的建立和壮大奠定 了基础。
•5
(三)、手性药物的分类
1、对映体之间有相同的药理活性,且作用强度相近 如局部麻醉药布比卡因(bupivacaine,4-8)的 两个对映体具有相近的局麻作用,然而(S)-体 还兼有收缩血管的作用,可增强局麻作用,因此 作为单一对映体药物上市。
(R)-体也有毒副作用。
O
O
H
N
O
N
H
N
O
N
OO H
OO H
(R)
(S)
(4-5)
•4
(二)、手性药物的地位与发展趋势 1992年美国FDA发布手性药物指导原则,要求所有在
美国申请上市的外消旋体新药,生产商均需提供报告 说明药物中所含对映体各自的药理作用、毒性和临床 效果。这大大增加了NCE以混旋体形式上市的难度。 而对于已经上市的混旋体药物,可以单一立体异构体 形式作为新药提出申请,并能得到专利保护。
手性药物分析PPT课件

单向抑制作用:如果一个对映体是另一个对映体的代谢抑制剂,则 会发生单向抑制作用。
排泄
肾脏排泄的立体选择性主要表现在肾小管分泌、主动转运和肾代谢 过程,导致对映体间发生相互作用。
第7页/共50页
随着对手性药物药理活性研究的不断深入,人们已经认识并开始重视手性 药物对映体生理作用和代谢过程的差别。特别是1992年美国食品与药品监督 管理局(FDA)提出发展单一对映体生产计划和对映体药物纯度的鉴定规定 后,如何能快速而准确的分离和测定手性药物已成为医药界关注的重大课题。
对衍生化反应的要求
➢手性衍生化试剂具有高的化学和光学纯度,且在贮存中不发生改变 ➢手性衍生化试剂和反应产物具有高的稳定性 ➢ 衍生化反应过程中产物不发生消旋化现象 ➢ 待测手性药物具有易于衍生的集团,如氨基、羟基、羧基等 ➢ 反应条件温和、快速、简便 ➢ 衍生化反应生成的非对映体在色谱分离时应能显示高柱效
手性配体交换固定相
通过手性金属配合物与对映异构体作用形成非对映异构体金属 配合物而进行手性拆分。主要用于α-氨基酸及其类似药物的手性拆 分。
用于形成金属配合物的离子均为过渡金属离子Cu(Ⅱ)、Ni(Ⅱ)、 Cd(Ⅱ)、Zn(Ⅱ)和Hg(Ⅱ)。
商品配体交换柱有Chiralpak WH和WM等。
第24页/共50页
人α-酸性糖蛋白( α-AGP):多种类型药物 人血清白蛋白(HSA):多种类型药物 牛血清白蛋白(BSA):适于阴离子型手性化合物,如氨基酸及 其衍生物、芳香亚砜和香豆素类等 卵黏蛋白(OVM):用于胺类和羧酸化合物的手性拆分 纤维素二糖水解酶(CBH):适于分离多种类型的碱性药物。
第23页/共50页
生化测定布洛芬对映体,提高了检测灵敏度
第11页/共50页
排泄
肾脏排泄的立体选择性主要表现在肾小管分泌、主动转运和肾代谢 过程,导致对映体间发生相互作用。
第7页/共50页
随着对手性药物药理活性研究的不断深入,人们已经认识并开始重视手性 药物对映体生理作用和代谢过程的差别。特别是1992年美国食品与药品监督 管理局(FDA)提出发展单一对映体生产计划和对映体药物纯度的鉴定规定 后,如何能快速而准确的分离和测定手性药物已成为医药界关注的重大课题。
对衍生化反应的要求
➢手性衍生化试剂具有高的化学和光学纯度,且在贮存中不发生改变 ➢手性衍生化试剂和反应产物具有高的稳定性 ➢ 衍生化反应过程中产物不发生消旋化现象 ➢ 待测手性药物具有易于衍生的集团,如氨基、羟基、羧基等 ➢ 反应条件温和、快速、简便 ➢ 衍生化反应生成的非对映体在色谱分离时应能显示高柱效
手性配体交换固定相
通过手性金属配合物与对映异构体作用形成非对映异构体金属 配合物而进行手性拆分。主要用于α-氨基酸及其类似药物的手性拆 分。
用于形成金属配合物的离子均为过渡金属离子Cu(Ⅱ)、Ni(Ⅱ)、 Cd(Ⅱ)、Zn(Ⅱ)和Hg(Ⅱ)。
商品配体交换柱有Chiralpak WH和WM等。
第24页/共50页
人α-酸性糖蛋白( α-AGP):多种类型药物 人血清白蛋白(HSA):多种类型药物 牛血清白蛋白(BSA):适于阴离子型手性化合物,如氨基酸及 其衍生物、芳香亚砜和香豆素类等 卵黏蛋白(OVM):用于胺类和羧酸化合物的手性拆分 纤维素二糖水解酶(CBH):适于分离多种类型的碱性药物。
第23页/共50页
生化测定布洛芬对映体,提高了检测灵敏度
第11页/共50页
手性与手性药物 ppt课件

治疗帕金森病 29
(S)-Metolachlor (Novatis, 1996) 不对称合成最大的工业化例子(>10,000 吨/年)
H3CO
O
H3CO
N CH2Cl
O N CH2Cl
H3CO
O
H3CO
N CH2Cl
O N CH2Cl
aR, 1'S
aS, 1'S
2 active stereoisomers
ppt课件
2
手性
手性是三维物体的基本 属性。如果一个物体不 能与其镜像重合,该物 体就称为手性物体。
手性(chirality)这个词来 源于希腊字 “手”(cheir)。
ppt课件
手是手性的 — 右手与左
手成镜像。
3
从天文学到地球科学,从化 学到生物学,几乎处处都有 手性显身影。
ppt课件
4
太阳系的所有天 体(包括小行星) 都是按照右旋方 向旋转的,称为 右手定则。
aR, 1'R
aS, 1'R
2 inactive stereoisomers
O
H3CO
N
[Ir(COD)Cl]2 / L*
NH
ee 79% TON 1 000 000 TOF 30 000/s
1'S
O Cl
Cl
H3CO
O
H3CO
O
N CH2Cl
N CH2Cl
P
Fe PPh2
2
aR, 1'S
aS, 1'S
production 10 3 2 15
pilot 29 3 3 35
bench scale 20 6 1 27
(S)-Metolachlor (Novatis, 1996) 不对称合成最大的工业化例子(>10,000 吨/年)
H3CO
O
H3CO
N CH2Cl
O N CH2Cl
H3CO
O
H3CO
N CH2Cl
O N CH2Cl
aR, 1'S
aS, 1'S
2 active stereoisomers
ppt课件
2
手性
手性是三维物体的基本 属性。如果一个物体不 能与其镜像重合,该物 体就称为手性物体。
手性(chirality)这个词来 源于希腊字 “手”(cheir)。
ppt课件
手是手性的 — 右手与左
手成镜像。
3
从天文学到地球科学,从化 学到生物学,几乎处处都有 手性显身影。
ppt课件
4
太阳系的所有天 体(包括小行星) 都是按照右旋方 向旋转的,称为 右手定则。
aR, 1'R
aS, 1'R
2 inactive stereoisomers
O
H3CO
N
[Ir(COD)Cl]2 / L*
NH
ee 79% TON 1 000 000 TOF 30 000/s
1'S
O Cl
Cl
H3CO
O
H3CO
O
N CH2Cl
N CH2Cl
P
Fe PPh2
2
aR, 1'S
aS, 1'S
production 10 3 2 15
pilot 29 3 3 35
bench scale 20 6 1 27
第四章 手性药物

O H N OHH CH3
CH3O COOH
普萘洛尔 ER=130 以外消旋体上市
萘普生 ER=35 以单一异构体上市
• 3.对映体具有不同的药理活性 • 3.1一个对映体具有治疗作用,另 一个仅有副作用或毒性
治疗作用的对映体 (S)-体,镇咳 (S)-体,安眠镇痛 (-)-体,免疫抑制,抗 风湿 四咪唑 (S)-体,广谱趋虫 芬氟拉明 (S)-体,减肥 乙胺丁醇 (S,S)-体,抗结核 米安色林 (S)-体,抗忧郁 药物 羟基哌嗪 氯胺酮 青霉胺 毒副作用对映体 (R)-体,嗜睡 (R)-体,术后幻觉 (+)-体,致癌 (R)-体,呕吐 (R)-体,头晕,催眠 (R,R)-体,失明 (R)-体,细胞毒性
• 3.2 对映体活性不同,但作用互补
Cl Cl HO O O O CH3 HO O Cl O Cl O CH3
(R)-茚达立酮
(S)-茚达立酮
(R)-茚达立酮具有利尿的作用,但(R)-茚达立酮 可增加血中尿酸的浓度,而(S)-茚达立酮可促进尿酸的 排泄。二则可配合使用,最佳比例为1:4~1:8。
CHO H OH HO CH2OH D-甘油醛
CHO H CH2OH L-甘油醛
CHO OH CH2OH D-****糖
CHO HO H CH2OH L-****糖
OH O H OH OH OH OH OH H OH OH OH O OH
COOH H2N R LH H
COOH NH2 R D-
CHO
(R)-体:利尿作用
(S)-体:抗利尿作用
手性物的分类
• 1.对映体之间有相同的药理活性,且作用 强度相近 • 2. 对映体具有相同的药理活性,但强度不 同 • 3.对映体具有不同的药理活性
CH3O COOH
普萘洛尔 ER=130 以外消旋体上市
萘普生 ER=35 以单一异构体上市
• 3.对映体具有不同的药理活性 • 3.1一个对映体具有治疗作用,另 一个仅有副作用或毒性
治疗作用的对映体 (S)-体,镇咳 (S)-体,安眠镇痛 (-)-体,免疫抑制,抗 风湿 四咪唑 (S)-体,广谱趋虫 芬氟拉明 (S)-体,减肥 乙胺丁醇 (S,S)-体,抗结核 米安色林 (S)-体,抗忧郁 药物 羟基哌嗪 氯胺酮 青霉胺 毒副作用对映体 (R)-体,嗜睡 (R)-体,术后幻觉 (+)-体,致癌 (R)-体,呕吐 (R)-体,头晕,催眠 (R,R)-体,失明 (R)-体,细胞毒性
• 3.2 对映体活性不同,但作用互补
Cl Cl HO O O O CH3 HO O Cl O Cl O CH3
(R)-茚达立酮
(S)-茚达立酮
(R)-茚达立酮具有利尿的作用,但(R)-茚达立酮 可增加血中尿酸的浓度,而(S)-茚达立酮可促进尿酸的 排泄。二则可配合使用,最佳比例为1:4~1:8。
CHO H OH HO CH2OH D-甘油醛
CHO H CH2OH L-甘油醛
CHO OH CH2OH D-****糖
CHO HO H CH2OH L-****糖
OH O H OH OH OH OH OH H OH OH OH O OH
COOH H2N R LH H
COOH NH2 R D-
CHO
(R)-体:利尿作用
(S)-体:抗利尿作用
手性物的分类
• 1.对映体之间有相同的药理活性,且作用 强度相近 • 2. 对映体具有相同的药理活性,但强度不 同 • 3.对映体具有不同的药理活性
第13章-手性药物

用于手性药物制备的生物催化反应
氧化反应
氧化反应是向有机化合物分子中引入功能基团的重要反应之一,其在手性药 物的合成中具有重要的作用。 用于手性药物制备的催化氧化反应的酶主要有单加氧酶、双加氧酶和脱氢酶。
单加氧酶(mono-oxygenases)催化的氧化反应 单加氧酶主要有细胞色素P450类单加氧酶以及黄素类单加氧酶,前者以铁卟啉
手性药物
严格地说,手性药物是指分子结构中存在手性因素的药物。 通常所说的手性药物是指由具有药理活性的手性化合物组成的药物,其中只
含有效对映体或者以有效对映体为主。 药物的药理作用是通过其与体内的大分子之间严格的手性识别和匹配而实现 的,故不同对映体的药理活性有所差异。在许多情况下,化合物的一对对映体 在生物体内的药理活性、代谢过程、代谢速率及毒性等方面均存在显著的差异, 常出现以下几种不同的情况。
提取法
在天然产物中,存在大量可直接作为药物的手性化合物,如生物碱、维生素等。 这些化合物可通过萃取、沉淀、层析、结晶等手段提取得到,如从红豆衫的树 皮中提取对乳腺癌等有很好疗效的抗肿瘤手性药物紫杉醇。 然而,该法也有其缺陷。 首先,有些物质在自然界中的含量极低,其分离纯化十分困难;其次,自然界 往往只给我们提供一种异构体,其他构型的异构体可能不存在;此外,还有很 多手性化合物在自然界根本不存在或尚未被发现,无法通过提取法得到这些物 质。
动力学拆分法是利用两个对映体在手性试剂或手性催化剂作用下反应速度不 同而使其分离的方法。依手性催化剂的不同,动力学拆分又可分为生物催化动 力学拆分和化学催化动力学拆分。前者主要以酶或微生物细胞为催化剂,后者 主要以手性酸、手性碱或手性配体过渡金属配合物为催化剂。
色谱分离可分为直接法和间接法。直接法又分为手性固定相法和手性流动相 添加剂法。其中手性固定相法应用较多,已发展成为吨级手性药物拆分的工艺 方法。间接法又称为手性试剂衍生化法,是指外消旋体与一种手性试剂反应, 形成一对非对映异构体,再用普通的正相或反相柱分离之。
(ppt版)体内药物分析 手性药物HPLC法

第二十四页,共四十九页。
24
手性衍生 化法的特点 (yǎn shēnɡ)
优点
只需使用价格廉价、柱效较高的非手性柱 衍生化可提高(tí gāo)灵敏度
缺点
需要柱前衍生化,操作复杂 衍生化试剂要求高的光学纯度
衍生化反响速率重现性较差
第二十五页,共四十九页。
25
柱前衍生化-反相(fǎn xiānɡ)高效液相色谱 法
[]1D5 =0
pKa=3.86(25oC)
第七页,共四十九页。
7
药物分子的手性标记通常采用R/S序列标记法。
对映体的命名(mìng míng) R\S命名 〔1〕按次(序mì规ng 那mín么g)(原nà那me)么排出各取代基的顺序A>B>C>D
a. 原子序数大小规那么—序数大的原子优先 b. 同位素规那么—原子量大优先 c. 外推规那么—层层外推,
暗
亮
乳酸
第三页,共四十九页。
3
结论(jiélùn): 物质有两类:
〔1〕旋光性物质——能使偏振光振动面旋转的性质 (xìngzhì),叫做旋光性;具有旋光性的物质,叫做旋光性物质。
〔2〕非旋光性物质——不具有旋光性的物质,叫做 非旋光性物质。
旋光性物质使偏振光旋转的角度,称为旋光度,以 “ 〞表示。
pharmacokine-tics)。
第十二页,共四十九页。
12
手性药物光学异构体的药理作用大致有以下5种类型:
①一种光学异构体无治疗(zhìliá o)活性。
②生物活性强度不同的光学异体。
③生物活性强度相等的光学异构体。
④生物活性类型不同的光学异构体。 ⑤生物活性相反的光学异构体。
第十三页,共四十九页。
医学课件手性与手性药物

手性与手性药物
1953年,联邦德国Chemie制药公司研究了一种名为 “沙利度胺” 的新药,该药对孕妇的妊娠呕吐疗效极佳, Chemie公司在1957年将该药以商品名“反应停”正式推向市 场。 两年以后,欧洲的医生开始发现,本地区畸形婴儿的出 生率明显上升,此后又陆续发现12000多名因母亲服用反应停 而导致的海豹婴儿!这一事件成为医学史上的一大悲剧!
手性药物不仅具有技术含量高、疗效好、 副作用小的优点,而且与创制新药相比,开 发手性药物相对要风险小,周期短,耗资少, 成果大,不仅具有重大的科学价值,同时也 蕴藏着巨大的经济效益。
然而,就在“反应停”声名狼藉之际,1965年, 一名以色列医生偶然发现了“反应停”对于麻风结 节性红斑有很好的疗效。随后又发现,“反应停” 还有可能用于治疗多种癌症。 对人类而言,反应停究竟是祸,还是福? 现在我们知道,反应停是一种具有手性中心的 药物,其右旋体无毒,具有镇静作用;而左旋体虽 也可镇静,但它在体内的代谢产物具有很强的致畸 作用。 仅仅这一句话,这一个看似简单的结论,这样 一种广泛存在的“手性药物”,给人类带来了50年 的恐慌,50年的恩怨,还有50年不懈的研究。
研究表明,不同的对映体在人体内的药 理,代谢过程,毒性和疗效存在着显著差异, 大致有以下几个类别:
1 两种对映体的作用相同 这类药物的作用,往往是手性中心不涉及的 活性中心,属于静态类手性类药物。 多数Ⅰ类抗心律失常药的两种对映体具有类 似的电生理活性。 普罗帕酮、氟卡胺抗心律失常药的作用两种 对映体的作用是一致的。
1984年荷兰药理学家Ariens(阿利尼斯) 极力提倡手性药物以单一对映体上市,抨击 以消旋体形式进行药理研究以及上市。他的 一系列论述的发表,引起药物部门广泛的重 视。 2001年诺贝尔化学奖授予了3位美日科学 家,表彰他们在手性催化氢化反应和手性催 化氧化反应领域所做出的重大贡献。目前, 研究和发展新的手性技术,借此获得光学纯 的手性药物,已成为许多实验室和医药公司 追求的目标。
1953年,联邦德国Chemie制药公司研究了一种名为 “沙利度胺” 的新药,该药对孕妇的妊娠呕吐疗效极佳, Chemie公司在1957年将该药以商品名“反应停”正式推向市 场。 两年以后,欧洲的医生开始发现,本地区畸形婴儿的出 生率明显上升,此后又陆续发现12000多名因母亲服用反应停 而导致的海豹婴儿!这一事件成为医学史上的一大悲剧!
手性药物不仅具有技术含量高、疗效好、 副作用小的优点,而且与创制新药相比,开 发手性药物相对要风险小,周期短,耗资少, 成果大,不仅具有重大的科学价值,同时也 蕴藏着巨大的经济效益。
然而,就在“反应停”声名狼藉之际,1965年, 一名以色列医生偶然发现了“反应停”对于麻风结 节性红斑有很好的疗效。随后又发现,“反应停” 还有可能用于治疗多种癌症。 对人类而言,反应停究竟是祸,还是福? 现在我们知道,反应停是一种具有手性中心的 药物,其右旋体无毒,具有镇静作用;而左旋体虽 也可镇静,但它在体内的代谢产物具有很强的致畸 作用。 仅仅这一句话,这一个看似简单的结论,这样 一种广泛存在的“手性药物”,给人类带来了50年 的恐慌,50年的恩怨,还有50年不懈的研究。
研究表明,不同的对映体在人体内的药 理,代谢过程,毒性和疗效存在着显著差异, 大致有以下几个类别:
1 两种对映体的作用相同 这类药物的作用,往往是手性中心不涉及的 活性中心,属于静态类手性类药物。 多数Ⅰ类抗心律失常药的两种对映体具有类 似的电生理活性。 普罗帕酮、氟卡胺抗心律失常药的作用两种 对映体的作用是一致的。
1984年荷兰药理学家Ariens(阿利尼斯) 极力提倡手性药物以单一对映体上市,抨击 以消旋体形式进行药理研究以及上市。他的 一系列论述的发表,引起药物部门广泛的重 视。 2001年诺贝尔化学奖授予了3位美日科学 家,表彰他们在手性催化氢化反应和手性催 化氧化反应领域所做出的重大贡献。目前, 研究和发展新的手性技术,借此获得光学纯 的手性药物,已成为许多实验室和医药公司 追求的目标。
3.5.6-手性药物和不对称合成幻灯片(2)
甘油醛反应,不能催化(S)-甘油醛反应。
②用产物光学纯度OP表示:
在实验误差范围内,两种方法结果相等。 若ee或OP为90%,则对映体比例为95:5。
(3) 不对称合成的实施 不对称合成常通过三种方法达到合成的目的:
利用纯手性物为起始反应物之一;反应物若非手性 物,先引一个手性中心进入反应物,再进行合成反 应;利用手性试剂、手性溶剂、手性催化剂等促进 不对称合成。
例如:丙酮酸用硼氢化钠还原成2-羟基丙酸,得到 外消旋体。若先在丙酮酸中引入手性的胺, 变成酰胺后再用硼氢化钠还原,羰基处于手 性环境,硼氢化钠从羰基平面两边进攻的机 会不相等,就得到不等量的非对映体混合物, 分离后再水解掉引入的手性胺,就能得到需 要的对映异构体含量多的产物。
这里的关键是选择哪个胺(R-还是L-)才能得 到需要的2-羟基丙酸。
不对称合成反应,使用合适的手性条件,可使 产物光学纯度达到95%以上。
不对称合成反应广泛应用于有机化合物的构型测 定,阐明反应机理,以及研究酶催化活性等领域。
O H
N
OO
O N
H
(R)-(+)-构型是有效的,而(S)-(-)-构型是使婴儿致残、 致畸的异构体。
3.酶对反应物的选择
酶催化生物反应是先将有关分子通过各种键 合力吸附到酶表面的手性环境中。一般酶用三个键 合中心选择手性物, 发生作用。假如催化甘油醛的酶 的三个键合中心如下图排列的,一个适合-H,一 个适合-OH,另一个适合-CH2OH。这个酶只能识 别(R)-甘油醛,不能识别(S)-甘油醛,即只催化(R)-
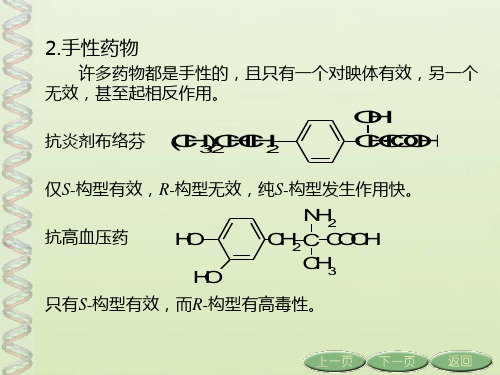
2.手性药物
许多药物都是手性的,且只有一个对映体有效,另一个 无效,甚至起相反作用。
O H
抗炎剂布络芬 (CH3)2 CHCH2
②用产物光学纯度OP表示:
在实验误差范围内,两种方法结果相等。 若ee或OP为90%,则对映体比例为95:5。
(3) 不对称合成的实施 不对称合成常通过三种方法达到合成的目的:
利用纯手性物为起始反应物之一;反应物若非手性 物,先引一个手性中心进入反应物,再进行合成反 应;利用手性试剂、手性溶剂、手性催化剂等促进 不对称合成。
例如:丙酮酸用硼氢化钠还原成2-羟基丙酸,得到 外消旋体。若先在丙酮酸中引入手性的胺, 变成酰胺后再用硼氢化钠还原,羰基处于手 性环境,硼氢化钠从羰基平面两边进攻的机 会不相等,就得到不等量的非对映体混合物, 分离后再水解掉引入的手性胺,就能得到需 要的对映异构体含量多的产物。
这里的关键是选择哪个胺(R-还是L-)才能得 到需要的2-羟基丙酸。
不对称合成反应,使用合适的手性条件,可使 产物光学纯度达到95%以上。
不对称合成反应广泛应用于有机化合物的构型测 定,阐明反应机理,以及研究酶催化活性等领域。
O H
N
OO
O N
H
(R)-(+)-构型是有效的,而(S)-(-)-构型是使婴儿致残、 致畸的异构体。
3.酶对反应物的选择
酶催化生物反应是先将有关分子通过各种键 合力吸附到酶表面的手性环境中。一般酶用三个键 合中心选择手性物, 发生作用。假如催化甘油醛的酶 的三个键合中心如下图排列的,一个适合-H,一 个适合-OH,另一个适合-CH2OH。这个酶只能识 别(R)-甘油醛,不能识别(S)-甘油醛,即只催化(R)-
2.手性药物
许多药物都是手性的,且只有一个对映体有效,另一个 无效,甚至起相反作用。
O H
抗炎剂布络芬 (CH3)2 CHCH2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
当分子中含有两个不同的手性碳原子时,分子应 有四种不同的空间排布(构型),两对对映体。
COOH H 2 Cl
COOH Cl 2 H
H 3 OH COOH
HO 3 H COOH
-7.10 (±) +7.10
(2R,3R) (2S,3S)
COOH H 2 Cl
COOH Cl 2 H
HO 3 H COOH
氯霉素的立体异构体中只有一个是抗菌的。 (+) -葡
萄糖在动物代谢中起重要作用,有营养价值,但其左旋 体(-)不能被动物代谢也不能被酵母发酵。
NO2
NO 2
HO C H H C N H C O C H C l2 C H2O H 1R ,2R (-) 氯 霉 素
NO2
H C l2C H C O H N
C OH CH
C H 2O H1 S , S (+ )NO 2
合霉素
H C OH
HO C H
H C N H C O C H C l2 C l2C H C O H N C H
C H 2O H
C H 2O H
1 S ,2 R (+ )
1R ,2 S (-)
CHO H OH HO H H OH H OH
CH2OH
D-葡萄糖
HOH
HO HO
HO
H H OH OH
H
β−D-吡喃葡萄糖
1.1 药物的手性:立体化学术语-2
分子的手性是由于分子中含有手性中心(chiral center)、手性轴(chiral axis)或手性面(chiral plane) 所致。
当药物分子中四面体碳原子上连接有4个互不相同 的基团时,该碳原子被称为不对称中心或手性中心。
b
c
S
b
a
手性硫
d
C
a
b
c
d
C
b
a
c
手性碳
b
N a
c
手性叔胺
b
N a
c
外消旋体:(racemate) 对映体的等量混合物
如用合成法得到的乳酸,其结构与肌肉乳酸和 发酵乳酸相同,但没有旋光性。
外消旋体的性质: a. 组成上 50%(+) 和 50% (-),无旋光性。 b. 物理性质发生变化,如(+), (-)乳酸m.p 53℃,而(±)
• 非对映体之间,彼此属于不同结构的化合物,所以物 理化学和生物学性质均不相同。
1.1 药物的手性:立体化学术语-4
• 对映体之间,除了使偏振光发生偏转的程度相同 而方向相反之外,其他理化性质相同。因此,对 映体又称为光学异构体。非对映体则包括了几何 异构体和具有光学活性但没有镜像关系的立体异 构体。
H 3 OH COOH
-9.30 (±) +9.30
(2R,3S)
(2S,3R)
含两个相同手性碳原子的分子
1800
COOH
COOH
COOH
COOH
H
OH
HO
H
H
OH
HO
H
H
OH
COOH
HO H COOH
HO 3 H COOH
H OH COOH
R,S meso S,R
(2R,3R) (±) (2S,3S)
0
药物的手性因素-2
a
O
a
b
C
C
O C
c
d
b
c
dd
c
b
a
a
b
(CH2)n
取代丙二烯 类手性轴
环芳香类 手性平面
内消旋体
非对映体
对映体
内消旋体:分子中具有对称面或对称中心,两个不对 称碳原子的旋光性恰好相反,相互抵消。内消旋体与 对映体具有不同的物理性质和光学活性。
1.1 药物的手性:立体化学术语-3
• 含有手性特征的药物称作手性药物。 • 对映体在对称的环境中,物理化学性质完全相同;但
在非对称的环境中,例如在偏振光中,对映体对偏振 光面旋转方向相反;在生物系统中与酶或受体相互作 用时,由于蛋白质分子的非对称性,与对映体的识别 方向和结合位点不同,导致生物活性的差异。
• 最常见的手性中心是碳原子,氮、硫和磷原子若 满足手性条件,也可成为手性中心,因而这些杂 原子构成的手性物质也会有两种不同的R和S构型, 形成对映体或非对映异构体。
• 其他的手性因素有手性平面、手性轴等,另外叔 胺和取代联苯具有不稳定的手性因素。
药物的手性因素-1
D
A
B
C
D
B
A
C
手性四面体
c
S
a
1. 对映体的各个基团在空间排列顺序不同,但空间相对关
系相同。故具有相同的m.p,b.p,密度等物性,只是对
偏光的旋光方向不同 ,旋光度相同。例如乳酸水溶液的
旋光度
[α] D 20=3.82° ( 水 )
2. 对映体的一般化学性质相同。如乳酸的pKa值3.79。但在
手性环境下与手性试剂、手性溶剂、催化剂表现出不同 的性质,反应具有立体化学的专一性。
分子中若含有n个手性中心,理论上将产生2n个立 体异构体(可产生内消旋分子时会减少异构体数),其 中有2n-1对对映体。在对映体之间,相应的手性原子的 绝对构型相反。那些不是对映体的立体异构体称为非对 映体(diastereomer, diastereoisomer )。
含两个不同手性碳原子的分子
1.1 药物的手性:立体化学术语-1
• 分子中的原子或原子团相互连接次序相同,但在空 间三维排列不同而引起的异构体称为立体异构体。
• 在空间上不能重叠,互为镜像关系的立体异构体称 为对映体(enantiomer)。这一对化合物就像人的 左右手一样,称为具有手性(chirality)。即 “手 性” 用来表征有旋光性的分子三维结构特征。
手性药物
主要内容
1. 手性药物的一般概念 2. 手性药物的研究意义 3. 手性药物的药代动力学 4. 手性药物的药效学 5. 手性药物的毒理学 6. 实际考虑因素 7. 手性药物的拆分及合成方法简介
1. 手性药物的一般概念
1.1 药物的手性 1.2 手性药物的表示方法 1.3 手性药物作用的立体选择性
m.p18℃。 c. 化学性质基本相同,在生理作用上,则各发挥其效
能,如合霉素。 d. 固态的外消旋体由于晶体间结合力不同,可有几种
不同的类型。
COOH H3C C H
OH
S-(+)-乳酸 mp 53℃
+3.82°
COOH
C H
CH3
OH
R-(-)-乳酸
mp 53℃
-3.82°
外消旋乳酸
±-乳酸 mp 18℃
• 当一个不对称分子不能与自己的镜像相重叠,并且 有使偏振光振动面旋转的性质时,称作手性分子。
CH3 H CH3
H
H
H
Cl
Cl
H
Cl
CH3 H Cl CH3
CC
H
Cl
COOH H2N C H
R
COOH H C NH2
R
费歇尔投影式
H2N H
H NH2
R COOH R COOH
返回幻灯片18
对映体性质比较
COOH H 2 Cl
COOH Cl 2 H
H 3 OH COOH
HO 3 H COOH
-7.10 (±) +7.10
(2R,3R) (2S,3S)
COOH H 2 Cl
COOH Cl 2 H
HO 3 H COOH
氯霉素的立体异构体中只有一个是抗菌的。 (+) -葡
萄糖在动物代谢中起重要作用,有营养价值,但其左旋 体(-)不能被动物代谢也不能被酵母发酵。
NO2
NO 2
HO C H H C N H C O C H C l2 C H2O H 1R ,2R (-) 氯 霉 素
NO2
H C l2C H C O H N
C OH CH
C H 2O H1 S , S (+ )NO 2
合霉素
H C OH
HO C H
H C N H C O C H C l2 C l2C H C O H N C H
C H 2O H
C H 2O H
1 S ,2 R (+ )
1R ,2 S (-)
CHO H OH HO H H OH H OH
CH2OH
D-葡萄糖
HOH
HO HO
HO
H H OH OH
H
β−D-吡喃葡萄糖
1.1 药物的手性:立体化学术语-2
分子的手性是由于分子中含有手性中心(chiral center)、手性轴(chiral axis)或手性面(chiral plane) 所致。
当药物分子中四面体碳原子上连接有4个互不相同 的基团时,该碳原子被称为不对称中心或手性中心。
b
c
S
b
a
手性硫
d
C
a
b
c
d
C
b
a
c
手性碳
b
N a
c
手性叔胺
b
N a
c
外消旋体:(racemate) 对映体的等量混合物
如用合成法得到的乳酸,其结构与肌肉乳酸和 发酵乳酸相同,但没有旋光性。
外消旋体的性质: a. 组成上 50%(+) 和 50% (-),无旋光性。 b. 物理性质发生变化,如(+), (-)乳酸m.p 53℃,而(±)
• 非对映体之间,彼此属于不同结构的化合物,所以物 理化学和生物学性质均不相同。
1.1 药物的手性:立体化学术语-4
• 对映体之间,除了使偏振光发生偏转的程度相同 而方向相反之外,其他理化性质相同。因此,对 映体又称为光学异构体。非对映体则包括了几何 异构体和具有光学活性但没有镜像关系的立体异 构体。
H 3 OH COOH
-9.30 (±) +9.30
(2R,3S)
(2S,3R)
含两个相同手性碳原子的分子
1800
COOH
COOH
COOH
COOH
H
OH
HO
H
H
OH
HO
H
H
OH
COOH
HO H COOH
HO 3 H COOH
H OH COOH
R,S meso S,R
(2R,3R) (±) (2S,3S)
0
药物的手性因素-2
a
O
a
b
C
C
O C
c
d
b
c
dd
c
b
a
a
b
(CH2)n
取代丙二烯 类手性轴
环芳香类 手性平面
内消旋体
非对映体
对映体
内消旋体:分子中具有对称面或对称中心,两个不对 称碳原子的旋光性恰好相反,相互抵消。内消旋体与 对映体具有不同的物理性质和光学活性。
1.1 药物的手性:立体化学术语-3
• 含有手性特征的药物称作手性药物。 • 对映体在对称的环境中,物理化学性质完全相同;但
在非对称的环境中,例如在偏振光中,对映体对偏振 光面旋转方向相反;在生物系统中与酶或受体相互作 用时,由于蛋白质分子的非对称性,与对映体的识别 方向和结合位点不同,导致生物活性的差异。
• 最常见的手性中心是碳原子,氮、硫和磷原子若 满足手性条件,也可成为手性中心,因而这些杂 原子构成的手性物质也会有两种不同的R和S构型, 形成对映体或非对映异构体。
• 其他的手性因素有手性平面、手性轴等,另外叔 胺和取代联苯具有不稳定的手性因素。
药物的手性因素-1
D
A
B
C
D
B
A
C
手性四面体
c
S
a
1. 对映体的各个基团在空间排列顺序不同,但空间相对关
系相同。故具有相同的m.p,b.p,密度等物性,只是对
偏光的旋光方向不同 ,旋光度相同。例如乳酸水溶液的
旋光度
[α] D 20=3.82° ( 水 )
2. 对映体的一般化学性质相同。如乳酸的pKa值3.79。但在
手性环境下与手性试剂、手性溶剂、催化剂表现出不同 的性质,反应具有立体化学的专一性。
分子中若含有n个手性中心,理论上将产生2n个立 体异构体(可产生内消旋分子时会减少异构体数),其 中有2n-1对对映体。在对映体之间,相应的手性原子的 绝对构型相反。那些不是对映体的立体异构体称为非对 映体(diastereomer, diastereoisomer )。
含两个不同手性碳原子的分子
1.1 药物的手性:立体化学术语-1
• 分子中的原子或原子团相互连接次序相同,但在空 间三维排列不同而引起的异构体称为立体异构体。
• 在空间上不能重叠,互为镜像关系的立体异构体称 为对映体(enantiomer)。这一对化合物就像人的 左右手一样,称为具有手性(chirality)。即 “手 性” 用来表征有旋光性的分子三维结构特征。
手性药物
主要内容
1. 手性药物的一般概念 2. 手性药物的研究意义 3. 手性药物的药代动力学 4. 手性药物的药效学 5. 手性药物的毒理学 6. 实际考虑因素 7. 手性药物的拆分及合成方法简介
1. 手性药物的一般概念
1.1 药物的手性 1.2 手性药物的表示方法 1.3 手性药物作用的立体选择性
m.p18℃。 c. 化学性质基本相同,在生理作用上,则各发挥其效
能,如合霉素。 d. 固态的外消旋体由于晶体间结合力不同,可有几种
不同的类型。
COOH H3C C H
OH
S-(+)-乳酸 mp 53℃
+3.82°
COOH
C H
CH3
OH
R-(-)-乳酸
mp 53℃
-3.82°
外消旋乳酸
±-乳酸 mp 18℃
• 当一个不对称分子不能与自己的镜像相重叠,并且 有使偏振光振动面旋转的性质时,称作手性分子。
CH3 H CH3
H
H
H
Cl
Cl
H
Cl
CH3 H Cl CH3
CC
H
Cl
COOH H2N C H
R
COOH H C NH2
R
费歇尔投影式
H2N H
H NH2
R COOH R COOH
返回幻灯片18
对映体性质比较
