欧盟医疗器械灭菌产品要求的标准清单
欧盟医疗器械标准

欧盟为消除各成员国间的贸易壁垒,逐步建立成为一个统一的大市场,以确保人员、服务、资金和产品(如医疗器械)的自由流通。
在医疗器械领域,欧盟委员会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。
这三个指令分别是:1.有源植入性医疗器械指令(AIMD,90/335/EEC),适用于心脏起搏器,可植入的胰岛素泵等有源植入性医疗器械。
AIMD于1993年1月1日生效。
过渡截止期为1994年12月31日,从1995年1月1日强制实施。
2.活体外诊断器械指令(IVD),适用于血细胞计数器,妊娠检测装置等活体外诊断用医疗器械。
该指令目前仍在起草阶段,可能于1998年末或1999年初正式实施。
3.医疗器械指令(Medical Devices Direc-tive,93/42/EEC),适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械,如无源性医疗器械(敷料、一次性使用产品、接触镜、血袋、导管等);以及有源性医疗器械,如核磁共振仪、超声诊断和治疗仪、输液泵等。
该指令已于1995年1月1日生效,过渡截止日期为1998年6月13日从1998年6月14日起强制执行。
上述指令规定,在指令正式实施后,只有带有CE标志的医疗器械产品才能在欧盟市场上销售。
医疗器械CE认证(Medical Devices Direc-tive,93/42/EEC)介绍MDD是目前欧洲可见到的最为全面的医疗器械方面的规定,在该指令中,共有23个条款和12个附录。
其重要部分包括在以下条款中:第1条款:本指令适用于医疗器械及其附件第第2条款:成员国必须确保投放其市场和使用的医疗器械是安全的。
第3条款:所谓“安全”的器械应满足附录1中的基本要求。
第4条款:带有CE标志的医疗器械可在欧盟自由流通。
特殊条款(附录和X)允许使用无CE标志客户定制产品及临床研究的产品。
第5条款:符合协调标准的医疗器械被认为满足基本要求。
欧盟MDR和IVDR提交资料清单

Description of manufacturing process and their validation and QC
制造过程的描述及其验证和质量控制
Post-market surveillance(PMS)
上市后监督
Installation, repair&service, and maintenance
产品描述(如:预期用途,各种种类/型号 的清单和描述,项目号、照片、图纸)。
1.目录表(版本状态,互相应用) 2.生产者的名称和地址
3.产品名称(所有的种类/型号)
Executive summary(option)
摘要(选项)
Declaration of conformity
符合性声明
Device description
安装,维修&服务,维护
Design change records(option)
设计更改记录(选项)
器械描述
4.器械样本的识别
Technical specification
技术规范
5.符合性声明
Previous and similar generation
以前的或类似器械的引用
6.其它文件,如证书,批准件
Labels and IFU(Instruction for use)
标签和使用说明书பைடு நூலகம்
7.适用标准清单 8.基本要求检查表(附录1)
告
,
Tissue or cells of animal or human ongin
动物源或人源的组织或细胞
附1.产品出厂检测报告。
包
括
Absorbed or locally dispersed substances
欧盟医疗器械法规MDR技术文件清单与要求
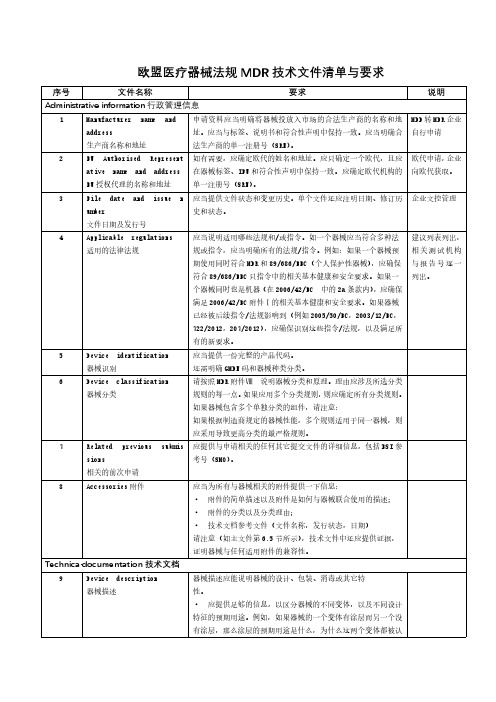
欧盟医疗器械法规MDR技术文件清单与要求序号文件名称要求说明Administrative information行政管理信息1Manufacturer name and address生产商名称和地址申请资料应当明确将器械投放入市场的合法生产商的名称和地址。
应当与标签、说明书和符合性声明中保持一致。
应当明确合法生产商的单一注册号(SRN)。
MDD转MDR企业自行申请2EU Authorised Represent ative name and addressEU授权代理的名称和地址如有需要,应确定欧代的姓名和地址。
应只确定一个欧代,且应在器械标签、IFU和符合性声明中保持一致。
应确定欧代机构的单一注册号(SRN)。
欧代申请,企业向欧代获取。
3File date and issue n umber文件日期及发行号应当提供文件状态和变更历史。
单个文件还应注明日期、修订历史和状态。
企业文控管理4Applicable regulations 适用的法律法规应当说明适用哪些法规和/或指令。
如一个器械应当符合多种法规或指令,应当明确所有的法规/指令。
例如:如果一个器械预期使用同时符合MDR和89/686/EEC(个人保护性器械),应确保符合89/686/EEC只指令中的相关基本健康和安全要求。
如果一个器械同时也是机器(在2006/42/EC中的2a条款内),应确保满足2006/42/EC附件Ⅰ的相关基本健康和安全要求。
如果器械已经被后续指令/法规影响到(例如2005/50/EC,2003/12/EC,722/2012,207/2012),应确保识别这些指令/法规,以及满足所有的新要求。
建议列表列出,相关测试机构与报告号逐一列出。
5Device identification 器械识别应当提供一份完整的产品代码。
还需明确GMDN码和器械种类分类。
6Device classification 器械分类请按照MDR附件Ⅷ说明器械分类和原理。
欧洲医疗器械领域标准

欧洲医疗器械领域标准一、医疗器械通用要求医疗器械通用要求是欧洲医疗器械法规中的基础性要求,主要包括以下几个方面:1. 医疗器械的设计、生产、检验、使用和销毁应符合安全和性能要求。
2. 医疗器械应配备有使用说明、维护和保养指南以及合格证明文件。
3. 医疗器械应当能够满足预期用途,并能够根据医疗需求进行调整和修改。
二、医疗器械标签和说明书医疗器械标签和说明书是向医护人员和患者提供有关医疗器械的重要信息。
它们应清晰、易于理解,并包含以下内容:1. 医疗器械的名称、型号和序列号。
2. 生产商名称、地址和联系方式。
3. 使用说明、操作方法和注意事项。
4. 医疗器械的性能参数和有效性评估结果。
5. 医疗器械的安全性数据和使用风险。
6. 医疗器械的保质期和使用寿命。
7. 医疗器械的包装和标识要求。
三、医疗器械安全性测试医疗器械安全性测试是确保医疗器械在使用过程中安全可靠的重要手段。
测试应包括以下方面:1. 物理性能测试,如尺寸、重量、形状等。
2. 化学性能测试,如成分分析、稳定性等。
3. 生物学性能测试,如细胞毒性、致敏性等。
4. 电磁兼容性测试,以确保医疗器械在使用过程中不会对其他设备产生干扰。
5. 环境适应性测试,以评估医疗器械在不同环境条件下的性能表现。
6. 灭菌过程验证,以确保医疗器械经过正确的灭菌程序后能够达到预期的消毒效果。
7. 安全性评估报告,详细记录测试结果和分析结论,为医疗器械的安全性提供有力支持。
8. 安全性监测,对已上市的医疗器械进行跟踪监测,及时发现和处理潜在的安全风险。
9. 不良事件报告制度,要求生产商、销售商和医疗机构及时报告医疗器械的不良事件,为改进产品质量和提高安全性提供依据。
中文版欧盟mdr法规

中文版欧盟mdr法规欧盟医疗器械法规(Medical Device Regulation, MDR)是欧洲联盟针对医疗器械领域制定的一份重要法规。
它于2017年5月发布,并于2020年5月正式生效。
本文将根据各项规定,为您详细介绍中文版欧盟MDR法规的内容。
第一部分:导言这一部分主要介绍了欧盟MDR法规的背景和目的,以及适用范围和基本定义。
MDR法规的目标是确保欧盟市场上的医疗器械的安全性、有效性和可靠性,以保障公众的健康和安全。
第二部分:一般要求1. 医疗器械分类和命名MDR法规对医疗器械进行了新的分类,以便更好地管理和监督不同风险等级的产品。
同时,对医疗器械的命名也有明确规定,以避免混淆和误导。
2. 表演的规定MDR法规要求制造商对其产品进行临床评价,并根据风险等级制定相应的技术文件和技术规格。
此外,MDR还提出了对制造商质量管理体系的要求,以确保其产品符合法规的要求。
3. CE标志的规定MDR法规明确了CE标志的使用规定,要求制造商在产品上正确使用并保持其可见性。
这是制造商将其产品引入欧盟市场的必要步骤。
第三部分:具体要求1. 临床评价和临床试验MDR法规对医疗器械的临床评价和临床试验进行了详细规定。
制造商需要对产品进行充分的临床评估,以确保其安全性和有效性符合要求。
2. 医疗器械监督和报告MDR法规明确了各方在市场监督和产品报告方面的责任。
制造商需要建立有效的市场监督和报告机制,并及时识别、评估和报告任何可能危害人类健康的事件。
3. 医疗器械技术文献和标签MDR法规要求制造商提供充分的技术文献和产品标签,以便医疗专业人员和最终用户正确使用和了解产品。
第四部分:认证和授权1. 医疗器械的市场准入MDR法规规定了医疗器械的市场准入程序,制造商需要满足一系列要求,包括提交技术文件、进行质量控制审核等。
只有通过认证的产品才能进入欧盟市场。
2. 第三方评估机构MDR法规对第三方评估机构的审核和授权进行了规定,确保其独立性和专业性。
欧盟,医疗器械标准

欧洲共同体理事会关于医疗器械的93/42/EEC指令1993年6月14日欧洲共同体理事会考虑到建立欧洲经济共同体的条约,特别是其第100a条;考虑到欧洲共同体委员会提交的议案;考虑到与欧洲议会合作;考虑到经济与社会委员会的意见;鉴于应在欧洲共同体内部市场范围内正式通过必要的措施;鉴于欧洲共同体内部市场是一个确保商品、人员、服务和资本自由流通的无内部边界的区域;鉴于各成员国有关医疗器械的安全、健康保护和工作特性的法律、法规和行政条款的内容和范围是不同的;鉴于各成员国之间对这类器械的认证和检验程序存在差异;鉴于这种差异在欧洲共同体内形成贸易壁垒;鉴于各国针对医疗器械的使用所制定的有关患者、使用者及其他人员的安全和健康保护的条款应予以协调,以保证此类器械在欧洲共同体内部市场自由流通;鉴于协调条款必须与成员国为管理直接或间接与这类器械有关的公共健康和医疗保险计划的资金筹措而采取的措施相区别;鉴于因而只要遵守欧洲共同体法律,这些条款并不影响各成员国实施上述措施的能力;鉴于医疗器械应向患者、使用者及第三方提供高水平的保护并达到制造商赋予其的性能水平;鉴于因此保持和提高各成员国已达到的保护水平是本指令的基本目的之一;鉴于在1965年1月26日欧洲共同体理事会关于使有关特许专卖药品的法律、法规或行政措施趋于一致的65/65/EEC指令中,某些医疗器械是用于施药的;鉴于在这种情况下,医疗器械投放市场通常由本指令管理,而药品投放市场由65/65/EEC指令管理;鉴于如果这种器械投放市场的方式使器械与药品构成一种规定只供组合使用且不能再次使用的整体,则这个单一整体产品应由65/65/EEC指令管理;鉴于必须将上述器械与包含某种物质,特别是当其单独使用时,按65/65/EEC指令可视为药物的医疗器械相区别;鉴于在这种情况下,若这种物质能配合医疗器械对人体产生辅助作用,则这类器械投放市场由本指令管理;鉴于这类物质的安全性、质量和有效性必须比照欧洲共同体理事会1975年5月20日关于使成员国有关分析标准、药物毒理学标准和临床标准及特许专卖药品试验协议的法律趋于一致的75/318/EEC指令规定的适当方法加以验证;鉴于本指令附录中的基本要求和其他要求,包括对“减小”或“降低”危险的任何引用,在解释和实施时必须考虑设计时的技术现状和实际做法及高水平的健康和安全相适应的技术与经济条件;鉴于按照1985年5月7日欧洲共同体理事会关于技术协调与标准化新方法的决议所规定的原则,有关医疗器械设计和生产的规定必须限于满足基本要求所必须的条款;鉴于因为这些要求是基本的,因此它们应取代各国相应的条款;鉴于实施基本要求应审慎考虑设计时的技术水平和与高水平的健康及安全保护相适应的技术、经济条件;鉴于1990年6月20日欧洲共同体理事会关于使成员国有关有源植入式医疗器械的法律趋于一致的90/385/EEC指令是新方法指令在医疗器械领域中的首次应用案例;鉴于为了使欧洲共同体的统一规定适用于所有医疗器械,本指令基本上是以90/385/EEC指令的条款为依据的;鉴于为此必须修订90/385/EEC指令,以便放入本指令规定的一般性条款;鉴于电磁兼容性问题是医疗器械安全的一个组成部分;鉴于就1989年5月3日欧洲共同体理事会关于使成员国有关电磁兼容的法律趋于一致的89/336/EEC指令而言,应包含这方面的专门规定;鉴于本指令应包括有关发射电离辐射的器械在设计和制造方面的要求;鉴于本指令既不影响1980年7月15日欧洲共同体理事会80/836/Euratom指令对有关保护公众和工人免受电离辐射危险的基本安全标准的指令进行修订所要求的授权,也不影响欧洲共同体理事会1984年9月3日对接受医疗检查和治疗的人员的辐射防护规定了基本措施的84/466/Euratom指令的实施;鉴于欧洲共同体理事会1989年6月12日关于采取措施鼓励改善工人工作中的安全和健康的89/391/EEC指令以及有关这一问题的专门指令应继续予以实施;鉴于为了证实符合基本要求并使这种符合得到验证,需要制定欧洲协调标准来防止与医疗器械的设计、制造和包装有关的危险;鉴于这类欧洲协调标准是由非官方机构制定的,应保持其非强制性的地位;鉴于为此欧洲标准化委员会(CEN)和欧洲电工标准化委员会(CENELEC)按照1984年11月13日欧洲共同体委员会与这两个机构之间签署的合作总指导原则,被认可为批准协调标准的主管机构;鉴于在本指令中,协调标准是受欧洲共同体委员会委托,由上述两机构之一,或两个机构共同根据欧洲共同体理事会1983年3月18日关于在技术标准和法规领域提供信息程序的83/189/EEC指令,依照上述总指导原则而批准的技术规范(欧洲标准或协调文件);鉴于对协调标准进行修订,欧洲共同体委员会应得到根据83/189/EEC指令建立的常设委员会的帮助;鉴于应采取的措施必须按欧洲共同体理事会87/373/EEC决定中规定的程序Ⅰ而规定;鉴于在特定领域,欧洲药典专著这类现有的形式应包括在本指令的范围内;鉴于因此有几部欧洲药典专著可视为等同于上述协调标准。
欧盟对医疗器械的法规要求及分类标准

D
02 欧盟医疗器械法规概述
医疗器械指令(MDD)
01
MDD是欧盟针对医疗器械的基本法规,规定了医疗器 械的定义、分类、基本要求、评估程序和市场监管等内 容。
02
MDD要求医疗器械必须符合安全性和性能的基本要求 ,并通过相应的符合性评估程序获得CE标志,才能在欧 盟市场销售和使用。
03
MDD还规定了医疗器械制造商、进口商和经销商的责 任和义务,包括建立质量管理体系、进行临床评估、报 告不良事件等。
体外诊断医疗器械法规(IVDR)
IVDR对体外诊断医疗器械的分类更加详细,要求制 造商提供更多的临床数据和性能评估报告,证明产品 的准确性和可靠性。
IVDR是欧盟针对体外诊断医疗器械的法规,于2017 年发布,2022年5月起强制执行。
IVDR还要求制造商建立严格的质量管理体系和生产 过程控制,确保产品的稳定性和一致性。同时, IVDR还规定了更加严格的市场监管措施,包括加强 不良事件报告和召回制度等。
技术文档应包括医疗器械的设计 、制造、性能、安全性、有效性 等方面的详细信息,以及相关的
试验、验证和评估结果。
技术文档应随时可供欧盟监管机 构检查,并应随着医疗器械的更
新和改进而不断更新。
上市后监管义务
制造商应对其已上市的医疗器械进行持 续的监管,以确保其在使用过程中的安
全性和有效性。
制造商应建立上市后监管计划,包括定 期收集和分析医疗器械的使用数据、不 良事件报告等信息,以及采取必要的纠
临床试验要求
对于高风险医疗器械,欧盟要求 进行临床试验以验证其安全性和
有效性。
临床试验必须在欧盟境内进行, 并符合欧盟相关法规和标准的要
求。
申请临床试验需要提交试验方案 、研究者资质、伦理委员会批准 等文件,并接受监管机构的审核
欧洲消毒剂验证的法规

欧洲消毒剂验证的法规
欧洲消毒剂验证的法规主要包括CE-MDR(Medical Device Regulation)和BPR(Biocidal Products Regulation)。
CE-MDR是欧盟新版医疗器械法规,于2020年正式施行,取代原有的
医疗器械指令(MDD)。
根据CE-MDR的规定,医用消毒剂属于体外诊断设备(IVDR)的一类,需要通过CE认证和IVDR认证才能在欧盟市场上销售和使用。
BPR是欧盟的生物杀灭剂法规,旨在确保消毒剂、洗手液等消毒产品
的活性物质和供应商符合相关规定,保障公众健康和环境安全。
对于要在欧盟销售的消毒产品,根据BPR法规需要满足两个条件:产品的活性物质和供应商必须在95清单中,清单可查询欧盟化学品管理局(ECHA)官方网站;产品经出口目的国主管部门授权。
如果要在多个欧盟国家销售,可以选择先完成一个国家的授权,再通过互认完成多国产品授权工作;也可以采取提交整个欧盟的授权方式。
对于消毒剂来说,满足这些法规是产品进入欧洲市场的必要条件。
不同法规的具体要求不同,厂商需要仔细了解并遵守相关规定,以确保产品能够顺利进入欧洲市场并获得认可。
1。
欧盟对灭菌技术的要求

Validated NIR acceptable on each container with MA identity test on composite
Classification and garbing for sampling area
Grade C (equivalent activity to compounding). No outdoor clothing. Grade C (equivalent activity to compounding). No outdoor clothing.
Background 背景
• Experience in industry in Reg Affairs and QA (as QP) prior to IMB 在进爱尔兰药品管理局前,有制药、法规与QA(QP)的经验 在进爱尔兰药品管理局前,有制药、法规与 的经验 • 10 Years IMB, experience in most technologies, EMEA IWG, and training. 爱尔兰药品管理局 年,有多种技术、EMEA 爱尔兰药品管理局10年 有多种技术、 IWG以及培训方面的经验 以及培训方面的经验 • Now a “virtual inspector” 现在是“事实上的检查员” 现在是“事实上的检查员” • So lets do a “virtual inspection” 好,我们来做当一回“检查员 我们来做当一回 做当一回“ ” • But lets talk about the solutions / strategies / positions; not just the problems. • 我们先来讨论战略位置 策略 解决方案,而不只是讨论问题 我们先来讨论战略位置 策略/解决方案 战略位置/策略 解决方案,
欧盟医疗器械无菌检测要求_概述及解释说明

欧盟医疗器械无菌检测要求概述及解释说明1. 引言1.1 概述随着人们对医疗质量和患者安全的要求越来越高,医疗器械无菌检测的重要性逐渐凸显。
无菌检测是一项关乎公众安全和健康的关键任务,其目的是确保使用的医疗器械不受微生物污染,以降低感染风险。
在欧盟范围内,有一系列严格的标准和规定来确保医疗器械在使用前满足无菌性要求。
1.2 文章结构本文将分为五个主要部分进行讨论。
首先,在引言部分将简要介绍本文的背景和目标。
接下来,在正文部分将详细介绍欧盟对医疗器械无菌性要求的概述,并深入解释无菌检测方法与标准。
然后,在解释说明欧盟医疗器械无菌检测要求部分,将详细讨论检测方法和技术应用,法规和指南相关解读,以及实施和执行情况介绍与分析。
最后,在结论及展望中总结已有研究成果和发现,展望未来的趋势和挑战,并提出相应的建议和改进措施。
1.3 目的本文的目的是全面概述欧盟对医疗器械无菌性要求,并解释说明相关要求及其实施情况。
通过对检测方法、技术应用、法规和指南等方面的解析与分析,旨在为读者提供一份综合而清晰的指导,以便更好地理解和遵守欧盟对医疗器械无菌性的要求。
此外,本文还将探讨已有研究成果和发现,并展望未来可能面临的趋势和挑战,从而为相关人员提供有价值的参考意见和改进措施。
2. 正文医疗器械无菌检测是确保医疗器械在生产和使用过程中不受到微生物污染的重要环节。
欧盟对医疗器械的无菌性有着明确的要求,旨在保障患者的安全和健康。
为了理解欧盟医疗器械无菌检测要求的核心内容,首先需要了解医疗器械的无菌性意义。
无菌性指的是物体完全没有存在微生物或微生物数量极少,足以防止任何感染。
对于使用在人体内或接触人体组织液体的医疗器械而言,无菌性尤为重要。
如果这些器械不符合相应的无菌要求,使用过程中可能引发严重感染和并发症。
欧盟针对医疗器械的无菌性要求包括多个方面。
首先,欧盟法规明确要求所有与人体内部直接或间接接触、用于诊断、治疗和预防类似动脉直径超过0.5毫米血管内部或伴随有切口进入软组织的医疗器械必须无菌。
欧盟医疗器械灭菌产品要求的标准清单

EN
ISO
13408-2(ISO
16
2011
13408-2:2003)/Y
YT0567.2
EN
ISO
13408-3(ISO
械灭菌过程的开发、确认和常规控制的要求
YT0567.6
EN ISO 14937
(ISO
21
2009
14937:2009)/GB
T19974
EN ISO 17664
(ISO
22
2004
17664:2004)/YY
T0802
EN
ISO
23 17665-1(ISO 2006
17665-1:2006)
Aseptic processing of health care products - Part 2: Filtration 医疗保健产品的无菌加工-第 2 部分:过滤
5 (ISO
2006
11607-2:2006)
EN ISO 11135-1/
ISO
6
2007
11135-1:2007/G
B18279:2000
EN
ISO
7 11137-1/ISO 2006
11137-1
Nam e
Sterilization - Steam sterilizers - Large sterilizers 灭菌蒸汽灭菌器-大型灭菌器 Sterilization of medical devices - Requirements for medical devices to be designated "STERILE" - Part 1: Requirements for terminally sterilized medical devices 医疗设备的灭菌 拟被认定为无菌的医疗设备的要求 第 1 部分:对最终灭菌设备的要求 Sterilization of medical devices - Requirements for medical devices to be designated "STERILE" - Part 2: Requirements for aseptically processed medical devices 医疗设备的灭菌 拟被认定为无菌的医疗设备的 要求 第 1 部分:无菌加工医疗器械的要求 Packaging for terminally sterilized medical devices Part 1: Requirements for materials, sterile barrier systems and packaging systems 最终灭菌医疗器械的 包装第 1 部分:材料、灭菌隔层和包装系统的要求 Packaging for terminally sterilized medical devices Part 2: Validation requirements for forming, sealing and assembly processes 最终灭菌医疗器械的包装 第 2 部分 成形、密封和装配过程的确认要求 Sterilization of health care products - Ethylene oxide Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices 医疗保健产品灭菌.环氧乙烷.第 1 部分:医疗器 械灭菌过程开发、确认和常规控制要求 Sterilization of health care products - Radiation - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices 医疗保健产品灭菌-辐射-第 1 部分:医疗器械灭 菌过程开发、确认和常规控制要求
欧洲的医疗器械标准

欧洲医疗器械标准一、通用安全和性能要求欧洲医疗器械标准(EU Directive)对医疗器械的通用安全和性能要求做出了规定,要求医疗器械必须满足相关要求,以确保其安全性和有效性。
这些要求包括:1. 医疗器械必须能够达到预定的性能指标,并且在使用过程中不会产生危害人体健康或增加感染的风险。
2. 医疗器械必须具备安全的使用性能,包括无菌、无热原、无毒性等。
3. 医疗器械的设计和制造必须考虑到易于清洁、消毒和保养,以及在使用过程中易于操作和控制。
4. 医疗器械必须能够经受常规使用过程中的各种应力作用,并能够在出现故障时发出警报。
二、医疗器械的设计和制造要求欧洲医疗器械标准对医疗器械的设计和制造要求做出了规定,以确保其符合通用安全和性能要求。
这些要求包括:1. 医疗器械的设计必须考虑到其预定用途和使用环境,并能够满足相关标准和法规的要求。
2. 医疗器械的制造必须采用高质量的材料和工艺,以确保其性能可靠、稳定和持久。
3. 医疗器械的制造必须遵循严格的质量控制程序,以确保每个生产环节的准确性和可靠性。
4. 医疗器械的制造必须进行严格的测试和检验,以确保其符合相关标准和法规的要求。
三、医疗器械的试验方法欧洲医疗器械标准对医疗器械的试验方法做出了规定,以确保其符合通用安全和性能要求。
这些试验方法包括:1. 物理性能试验:包括尺寸、重量、材料和构造等方面的试验。
2. 化学性能试验:包括成分分析、稳定性、毒性等方面的试验。
3. 生物学性能试验:包括细胞毒性、遗传毒性等方面的试验。
4. 电器安全性能试验:包括耐压、泄漏电流、接地等方面的试验。
5. 灭菌和消毒性能试验:包括对医疗器械进行灭菌和消毒的性能试验。
6. 临床试验:在欧盟范围内进行临床试验,以证明医疗器械的安全性和有效性。
7. 环境条件试验:包括对医疗器械进行温度、湿度、大气压力等环境条件的试验。
8. 电磁兼容性试验:包括对医疗器械进行电磁兼容性的试验。
9. 包装和标识的检验:包括对医疗器械的包装和标识进行检查和检验。
欧盟标准清单
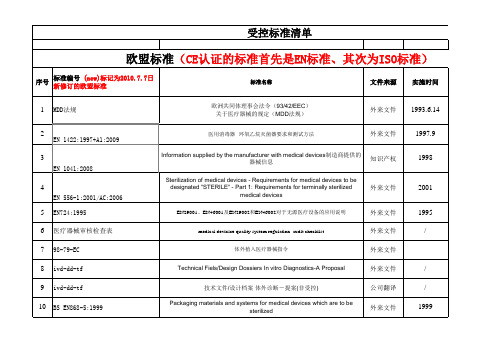
25 26 27 28 29 30 31 32 33 34 35 36 37 38 39
牙科 - 牙科医疗设备 - 牙科植入物 一次性使用无菌皮下注射器.第3部分:固定剂量免疫接种用自动报废注射器 无菌皮下注射器.第4部分:带防止重复使用特性的注射器 Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process (ISO 10993-1:2009) Biological evaluation of medical devices - Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity (ISO 10993-3:2003) Biological evaluation of medical devices - Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity (ISO 10993-3:2003) Biological evaluation of medical devices - Part 4: Selection of tests for interactions with blood (ISO 10993-4:2002, including Amd 1:2006) Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity (ISO 10993-5:2009) Biological evaluation of medical devices - Part 6: Tests for local effects after implantation (ISO 10993-6:2007) 医疗器械的生物学评价 第7部分:环氧乙烷灭菌残留量 Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products (ISO 10993-9:2009) Biological evaluation of medical devices - Part 10: Tests for irritation and delayedtype hypersensitivity (ISO 10993-10:2002, including Amd 1:2006) Biological evaluation of medical devices - Part 11: Tests for systemic toxicity (ISO 10993-11:2006) Biological evaluation of medical devices - Part 12: Sample preparation and reference materials (ISO 10993-12:2007) Biological evaluation of medical devices - Part 13: Identification and quantification of degradation products from polymeric medical devices (ISO 10993-13:1998)
欧盟,医疗器械标准

欧洲共同体理事会关于医疗器械的93/42/EEC指令1993年6月14日欧洲共同体理事会考虑到建立欧洲经济共同体的条约,特别是其第100a条;考虑到欧洲共同体委员会提交的议案;考虑到与欧洲议会合作;考虑到经济与社会委员会的意见;鉴于应在欧洲共同体内部市场范围内正式通过必要的措施;鉴于欧洲共同体内部市场是一个确保商品、人员、服务和资本自由流通的无内部边界的区域;鉴于各成员国有关医疗器械的安全、健康保护和工作特性的法律、法规和行政条款的内容和范围是不同的;鉴于各成员国之间对这类器械的认证和检验程序存在差异;鉴于这种差异在欧洲共同体内形成贸易壁垒;鉴于各国针对医疗器械的使用所制定的有关患者、使用者及其他人员的安全和健康保护的条款应予以协调,以保证此类器械在欧洲共同体内部市场自由流通;鉴于协调条款必须与成员国为管理直接或间接与这类器械有关的公共健康和医疗保险计划的资金筹措而采取的措施相区别;鉴于因而只要遵守欧洲共同体法律,这些条款并不影响各成员国实施上述措施的能力;鉴于医疗器械应向患者、使用者及第三方提供高水平的保护并达到制造商赋予其的性能水平;鉴于因此保持和提高各成员国已达到的保护水平是本指令的基本目的之一;鉴于在1965年1月26日欧洲共同体理事会关于使有关特许专卖药品的法律、法规或行政措施趋于一致的65/65/EEC指令中,某些医疗器械是用于施药的;鉴于在这种情况下,医疗器械投放市场通常由本指令管理,而药品投放市场由65/65/EEC指令管理;鉴于如果这种器械投放市场的方式使器械与药品构成一种规定只供组合使用且不能再次使用的整体,则这个单一整体产品应由65/65/EEC指令管理;鉴于必须将上述器械与包含某种物质,特别是当其单独使用时,按65/65/EEC指令可视为药物的医疗器械相区别;鉴于在这种情况下,若这种物质能配合医疗器械对人体产生辅助作用,则这类器械投放市场由本指令管理;鉴于这类物质的安全性、质量和有效性必须比照欧洲共同体理事会1975年5月20日关于使成员国有关分析标准、药物毒理学标准和临床标准及特许专卖药品试验协议的法律趋于一致的75/318/EEC指令规定的适当方法加以验证;鉴于本指令附录中的基本要求和其他要求,包括对“减小”或“降低”危险的任何引用,在解释和实施时必须考虑设计时的技术现状和实际做法及高水平的健康和安全相适应的技术与经济条件;鉴于按照1985年5月7日欧洲共同体理事会关于技术协调与标准化新方法的决议所规定的原则,有关医疗器械设计和生产的规定必须限于满足基本要求所必须的条款;鉴于因为这些要求是基本的,因此它们应取代各国相应的条款;鉴于实施基本要求应审慎考虑设计时的技术水平和与高水平的健康及安全保护相适应的技术、经济条件;鉴于1990年6月20日欧洲共同体理事会关于使成员国有关有源植入式医疗器械的法律趋于一致的90/385/EEC指令是新方法指令在医疗器械领域中的首次应用案例;鉴于为了使欧洲共同体的统一规定适用于所有医疗器械,本指令基本上是以90/385/EEC指令的条款为依据的;鉴于为此必须修订90/385/EEC指令,以便放入本指令规定的一般性条款;鉴于电磁兼容性问题是医疗器械安全的一个组成部分;鉴于就1989年5月3日欧洲共同体理事会关于使成员国有关电磁兼容的法律趋于一致的89/336/EEC指令而言,应包含这方面的专门规定;鉴于本指令应包括有关发射电离辐射的器械在设计和制造方面的要求;鉴于本指令既不影响1980年7月15日欧洲共同体理事会80/836/Euratom指令对有关保护公众和工人免受电离辐射危险的基本安全标准的指令进行修订所要求的授权,也不影响欧洲共同体理事会1984年9月3日对接受医疗检查和治疗的人员的辐射防护规定了基本措施的84/466/Euratom指令的实施;鉴于欧洲共同体理事会1989年6月12日关于采取措施鼓励改善工人工作中的安全和健康的89/391/EEC指令以及有关这一问题的专门指令应继续予以实施;鉴于为了证实符合基本要求并使这种符合得到验证,需要制定欧洲协调标准来防止与医疗器械的设计、制造和包装有关的危险;鉴于这类欧洲协调标准是由非官方机构制定的,应保持其非强制性的地位;鉴于为此欧洲标准化委员会(CEN)和欧洲电工标准化委员会(CENELEC)按照1984年11月13日欧洲共同体委员会与这两个机构之间签署的合作总指导原则,被认可为批准协调标准的主管机构;鉴于在本指令中,协调标准是受欧洲共同体委员会委托,由上述两机构之一,或两个机构共同根据欧洲共同体理事会1983年3月18日关于在技术标准和法规领域提供信息程序的83/189/EEC指令,依照上述总指导原则而批准的技术规范(欧洲标准或协调文件);鉴于对协调标准进行修订,欧洲共同体委员会应得到根据83/189/EEC指令建立的常设委员会的帮助;鉴于应采取的措施必须按欧洲共同体理事会87/373/EEC决定中规定的程序Ⅰ而规定;鉴于在特定领域,欧洲药典专著这类现有的形式应包括在本指令的范围内;鉴于因此有几部欧洲药典专著可视为等同于上述协调标准。
欧盟MDR和IVDR技术文档的要求

欧盟MDR关键要点讲解欧盟医疗器械监管体制(EUMDR)是欧盟逐步其医疗器械监管规则的结果。
该于2024年颁布,旨在加强对医疗器械的监管以保护公众的健康与安全。
以下是欧盟MDR的关键要点的详细解释:1.定义医疗器械:欧盟MDR对医疗器械的定义进行了明确和扩大。
医疗器械被定义为任何用于诊断、预防、监控、治疗或缓解疾病、损伤或残疾的设备、仪器、设施或产品,包括其附件和软件。
2.分类和风险评估:欧盟MDR为医疗器械建立了新的分类制度,并引入了更严格的风险评估要求。
根据其风险级别,医疗器械被分为四个等级:I类(低风险)、II类a(中低风险)、II类b(中高风险)和III类(高风险)。
高风险的医疗器械将受到更严格的审查。
3.临床评估和试验:欧盟MDR要求所有的医疗器械都必须进行临床评估和试验,以证明其安全性和有效性。
低风险的器械可以通过文献研究和现有的临床数据进行评估,而高风险的器械则需要进行更严格的实验室和临床试验。
4.医疗器械注册和认证:欧盟MDR引入了新的注册和认证要求,以确保医疗器械符合欧盟的安全和质量标准。
所有的医疗器械制造商都需要在欧洲医疗器械数据库(EUDAMED)上注册,并获取欧盟授予的CE标志。
此外,高风险的医疗器械还需要进行独立的第三方审核。
5.主管机关与市场监管:欧盟MDR确立了欧洲医疗器械监管委员会(MDCC)作为其主管机关,负责协调和监督医疗器械在欧盟市场的审查和监管。
该委员会由来自各个成员国的代表组成,将制定和执行医疗器械的监管政策。
6.透明度和追溯性:欧盟MDR要求制造商在整个供应链中保持透明度,并确保其产品的追溯性。
制造商需要提供详细的技术文件,并与供应商和分销商共享关于产品的信息,以便及时追溯和处理潜在的安全问题。
7.市场准入:欧盟MDR加强了对医疗器械市场准入的要求。
制造商必须符合一系列的技术和质量标准,并满足新的安全监控和报告要求。
此外,欧盟还将组织更多的市场检查和临床评估来确保医疗器械的安全性和有效性。
欧盟医疗器械指令的基本要求及协调标准

欧盟医疗器械指令的基本要求及协调标准欧盟医疗器械指令的基本要求及协调标准
医疗器械的基本要求是指令中的核心部分,在三个医疗器械指令的附录Ⅰ中均列出了该指令所适用的医疗器械的基本要求内容,这些基本要求项目涵盖了产品的各个方面,包括通用要求和针对不同种类医疗器械的特殊要求。
例如,在医疗器械指令(EC-Directive 93/42/EEC)附录Ⅰ中共有十四条基本要求,包括六条通用要求和八条特殊要求。
六条通用要求的主要内容是:(奥咨达医疗器械咨询)
1.器械必须是安全的。
器械带来的风险与受益比必须在可以接受的范围内。
2.器械在设计时必须考虑安全因素,应采用公认的技术。
将器械的风险消除或降低到最小,如无法排除风险则需设置保护措施,并将保护措施失效后的残余风险通知使用者。
3.器械必须达到制造商规定的性能。
4. 在器械的使用寿命内,器械的安全性和有效性必须得到保证。
(只专注于医疗器械领域)
5.器械的安全性和有效性必须在合理的运输、储存条件下不受影响。
6. 器械在使用中带来副作用必须在可接受的范围内。
欧盟医疗器械标准(二)2024

欧盟医疗器械标准(二)引言概述:欧盟医疗器械标准(二)主要涵盖了医疗器械的监管制度、分类和评估、技术文件要求、标识和包装以及市场监管等关键内容。
本文将分为五个大点来详细阐述这些内容,帮助读者更好地了解欧盟对医疗器械的标准和要求。
正文:一、医疗器械的监管制度1. 欧盟医疗器械监管机构的职责和作用2. 欧盟医疗器械监管的法律法规与指令3. 医疗器械的注册与许可制度4. 欧盟医疗器械的市场准入要求5. 医疗器械的监测和追溯体系二、医疗器械的分类和评估1. 医疗器械分类的原则和标准2. 欧盟医疗器械评估的程序和要求3. 医疗器械临床评价的指导原则4. 高风险医疗器械的特殊评估方法5. 新型医疗器械的技术评估和小型企业的特殊情况三、技术文件要求1. 医疗器械技术文件的结构和内容2. 医疗器械技术文件准备和更新的要求3. 技术文件中的临床评价和性能评估要求4. 技术文件的审评和审查程序5. 技术文件修改和变更管理的规定四、标识和包装1. 医疗器械的标识要求和标识内容2. 标志性标识和附加标识的要求3. 医疗器械包装的设计原则和要求4. 标识和包装的相关法规和指南5. 医疗器械标识和包装的监管和合规要求五、市场监管1. 欧盟医疗器械市场监管的目标和职责2. 医疗器械市场监管体系的建立和运行3. 医疗器械的风险管理和退市措施4. 医疗器械召回和报告的规定5. 市场监管措施的执行和处罚制度总结:欧盟医疗器械标准(二)从监管制度、分类和评估、技术文件要求、标识和包装、市场监管等五个大点详细说明了欧盟对医疗器械的标准和要求。
了解欧盟标准的适用范围和具体要求对从事医疗器械行业的企业和制造商来说至关重要,以确保他们的产品能够符合相关的法规和标准,进入欧盟市场并得到认可。
欧洲的医疗器械质量体系标准

欧洲的医疗器械质量体系标准欧洲的医疗器械质量体系标准涉及多个方面,包括法规、认证标准、质量管理体系等。
本文将介绍欧洲医疗器械质量体系标准的一般框架,以及其中一些重要的标准和认证程序。
在欧洲,医疗器械的质量体系标准主要由欧洲联盟制定和监管。
欧盟在医疗器械质量管理方面有一套严格的法规框架,其中最重要的是欧洲医疗器械指令(Medical Devices Directive, MDD)和欧洲医疗器械监管法规(Medical Devices Regulation, MDR)。
MDD于1993年发布,对医疗器械的生产、销售和使用提供了法律指导。
这一指令要求所有在欧洲市场销售的医疗器械必须符合特定的质量标准,并经过预先确定的程序认证。
MDD后来经过多次修订,其中包括将一些高风险类别的医疗器械纳入MDD的审查范围。
而MDR则于2017年发布,计划从2021年开始实施。
MDR在MDD的基础上进行了全面更新,强调更严格的质量控制和监管要求。
MDR要求所有的医疗器械都需要进行重新认证,审查程序变得更加复杂和严格。
这一法规还要求医疗器械制造商要对其产品质量管理体系进行全面的检查和审查。
除了指令和法规,欧洲还制定了一系列的标准和认证程序,以确保医疗器械的质量和安全。
ISO 13485是医疗器械质量管理体系的国际标准,被广泛应用于欧洲。
这一标准要求医疗器械制造商建立和维护有效的质量体系,以确保产品符合客户要求和适用的法规要求。
ISO 13485还对医疗器械的生命周期进行了管理,包括设计开发、生产、销售、安装和售后服务等各个阶段。
另外,欧洲还有针对特定类型医疗器械的标准,例如心脏起搏器、人工关节等。
这些标准通常由相关行业协会或国家标准化机构制定,并经过欧盟的认可。
这些标准在欧洲市场销售的相关医疗器械中具有法律效力,对产品性能、使用说明、安全指导等进行了详细规定。
此外,医疗器械的认证程序也是欧洲医疗器械质量体系中的重要组成部分。
欧盟mdr法规对医疗器械产品标签的要求 2023

【欧盟MDR法规对医疗器械产品标签的要求 2023】1. 介绍医疗器械作为一项重要的生命健康产品,其质量和安全性直接关系到人民群众的健康和生命安全。
欧盟作为全球医疗器械市场的重要一员,其相关法规对医疗器械产品标签的要求备受关注。
特别是即将于2023年全面实施的MDR(Medical Device Regulation)法规,对医疗器械产品标签的要求将更趋严格,这对医疗器械生产企业来说是一项严峻的挑战,也是一次推动行业进步的机遇。
2. MDR法规背景MDR法规是欧盟对医疗器械产品进行监管的重要法规之一。
其制定旨在加强对医疗器械产品的监管力度,提高产品质量和安全性,保障公众健康。
作为医疗器械行业的一次全面修订,MDR法规的实施对医疗器械生产企业、销售企业以及相关行业市场监管机构都将产生深远的影响。
3. MDR法规对医疗器械产品标签的要求3.1 标签内容要求根据MDR法规,医疗器械产品的标签必须包括产品的识别信息、使用说明、注意事项、生产企业信息等内容。
标签上的文字必须清晰、准确,易于理解,便于用户正确使用产品,避免因使用不当而造成意外伤害。
3.2 标签格式要求MDR法规对医疗器械产品标签的格式也做出了明确要求,包括标签的尺寸、字体大小、排版布局等。
标签上的信息必须能够清晰可见,且不易模糊、掉落;必须采用易于识别的字体和颜色;必须符合法规规定的标准格式。
4. MDR法规对医疗器械行业的影响MDR法规的实施,对于医疗器械生产企业来说将是一次严峻的挑战。
他们需要对现有产品标签进行全面检查,并根据法规要求进行调整和改进,以确保产品在2023年之前符合新的标签要求。
这对企业来说无疑会增加成本和工作量,但也将促使企业加强产品质量管理,提升产品竞争力。
另MDR法规的实施也将为医疗器械行业带来机遇。
符合法规要求的产品标签将提升产品品质和品牌形象,使企业在市场竞争中更具优势;另这也将促使企业加强技术创新和研发投入,推动整个行业向更高水平发展。
欧洲医疗标准目录
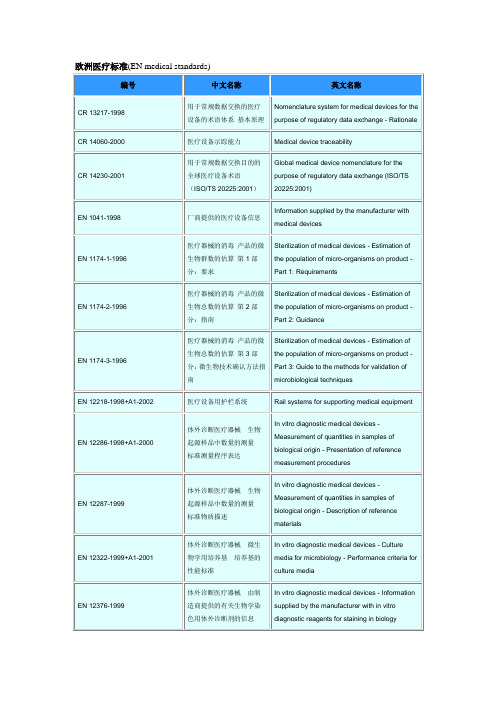
自检用体外诊断医疗设备的一般要求
General requirements for in vitro diagnostic medical devices for self-testing
EN 13612-2002+AC-2002
体外诊断医疗设备性能评估
Performance evaluation of in vitro diagnostic medical devices
EN 13726-3-2003
非活动医疗设备原创口敷料试验方法第3部分:防水性
Non-active medical devices - Test methods for primary wound dressings - Part 3: Waterproofness
EN 13726-4-2003
非活动医疗设备原创口敷料试验方法第4部分:合格性
CR 14060-2000
医疗设备示踪能力
Medical device traceability
CR 14230-2001
用于常规数据交换目的的全球医疗设备术语(ISO/TS 20225:2001)
Global medical device nomenclature for the purpose of regulatory data exchange (ISO/TS 20225:2001)
EN 14180-2003
医疗用消毒器甲醛和低温蒸气消毒器试验和要求
Sterilizers for medical purposes - Low temperature steam and formaldehyde sterilizers - Requirements and testing
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
EN ISO 11140-1 (ISO 11140-1:2005)/GB18282.1
2009
Sterilization of health care products - Chemical indicators - Part 1: General requirements医疗保健产品的灭菌-化学指示剂-第1部分:一般要求
4
EN ISO 11607-1(ISO 11607-1:2006)
2009
Packaging for terminally sterilized medical devices - Part 1: Requirements for materials, sterile barrier systems and packaging systems最终灭菌医疗器械的包装第1部分:材料、灭菌隔层和包装系统的要求
13
EN ISO 11737-1(ISO 11737-1:2006)/GBT19973.1-2005
2006
Sterilization of medical devices - Microbiological methods - Part 1: Determination of a population of microorganisms on products医疗器械灭菌-微生物方法-第1部分:产品上微生物群落的测定
EN无菌标准清单
No.
Standard No.
Ver.
Name
1
EN 285
2006+A2:2009
Sterilization - Steam sterilizers - Large sterilizers灭菌-蒸汽灭菌器-大型灭菌器
2
EN 556-1/YY/T0615.1
2001/AC:2006
Sterilization of medical devices - Requirements for medical devices to be designated "STERILE" - Part 1: Requirements for terminally sterilized medical devices医疗设备的灭菌拟被认定为无菌的医疗设备的要求第1部分:对最终灭菌设备的要求
12
EN ISO 11140-3(ISO 11140-3:2007, including Cor 1:2007)/GB18282.3
2009
Sterilization of health care products - Chemical indicators - Part 3: Class 2 indicator systems for use in the Bowie and Dick-type steam penetration test医疗保健产品的灭菌-化学指示剂-第3部分:用于BD类蒸汽渗透测试的二类指示物系统
8
EN ISO 11137-2/ISO 11137-2
2012
Sterilization of health care products - Radiation - Part 2: Establishing the sterilization dose医疗保健产品灭菌-辐射-第2部分:建立灭菌剂量
9
5
EN ISO 11607-2 (ISO 11607-2:2006)
2006
Packaging for terminally sterilized medical devices - Part 2: Validation requirements for forming, sealing and assembly processes最终灭菌医疗器械的包装第2部分成形、密封和装配过程的确认要求
22
EN ISO 17664 (ISO 17664:2004)/YYT0802
2004
Sterilization of medical devices - Information to be provided by the manufacturer for the processing of resterilizable medical devices医疗器械的灭菌制造商提供的处理可重复灭菌医疗器械的信息
18
EN ISO 13408-4(ISO 13408-4:2005)/YYT0567.4
2011
Aseptic processing of health care products - Part 4: Clean-in-place technologies医疗保健产品的无菌加工-第4部分:在线清洗技术
19
EN ISO 13408-5(ISO 13408-5:2006)/YYT0567.5
2011
Aseptic processing of health care products - Part 5: Sterilization in place医疗保健产品的无菌加工第5部分:现场消毒
20
EN ISO 13408-6(ISO 13408-6:2005)/YYT0567.6
23
EN ISO 17665-1(ISO 17665-1:2006)
2006
Sterilization of health care products - Moist heat - Part 1: Requirements for the development, validation and routine control of a sterilization process for medical devices医疗保健产品灭菌-湿热-第1部分:对医疗器械灭菌过程的开发、确认和常规控制的要求
EN ISO 11135-1/ISO 11135-1:2007/GB18279:2000
2007
Sterilization of health care products - Ethylene oxide - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices医疗保健产品灭菌.环氧乙烷.第1部分:医疗器械灭菌过程开发、确认和常规控制要求
3
EN 556-2/ YY/T0615.2
2003
Sterilization of medical devices - Requirements for medical devices to be designated "STERILE" - Part 2: Requirements for aseptically processed medical devices医疗设备的灭菌拟被认定为无菌的医疗设备的要求第1部分:无菌加工医疗器械的要求
7
EN ISO 11137-1/ISO 11137-1
2006
Sterilization of health care products - Radiation - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices医疗保健产品灭菌-辐射-第1部分:医疗器械灭菌过程开发、确认和常规控制要求
2011
Aseptic processing of health care products - Part 6: Isolator systems医疗保健产品的无菌加工-第6部分:隔离器系统
21
EN ISO 14937 (ISO 14937:2009)/GBT19974
2009
Sterilization of health care products - General requirements for characterization of a sterilizing agent and the development, validation and routine control of a sterilization process for medical devices医疗保健产品灭菌-灭菌因子的特性及医疗器械灭菌工艺的设定、确认和常规控制的通用要求
10
ENISO 11138-3/(ISO 11138-3:2006)/GB18281.3:2000
2009
Sterilization of health care products - Biological indicators - Part 3: Biological indicators for moist heat sterilization processes医疗保健产品灭菌-生物指示剂-第3部分:湿热灭菌用生物指示剂
14
EN ISO 11737-2(ISO 11737-2:2009)/GBT19973.2-2005
2009
Sterilization of medical devices - Microbiological methods - Part 2: Tests of sterility performed in the definition, validation and maintenance of a sterilization process医疗器械灭菌-微生物方法-第2部分:定义、确认和保持灭菌过程的无菌试验
15
EN ISO 13408-1 (ISO 13408-1:2008)/YYT0567.1
2011
Aseptic processing of health care products - Part 1: General requirements医疗保健产品的无菌加工-第1部分:通用要求
