热学课件1-2-1 阿马格分体积定律
合集下载
热力学第一定律(高中物理教学课件)完整版
例9.如图所示,固定容器及可动活塞P都是绝热的,中间 有一导热的固定隔板B,B的两边分别盛有气体甲和 乙.现将活塞P缓慢地向B移动一段距离,已知气体的温 度随其内能的增加而升高.则在移动P的过程中( C ) A.外力对乙做功;甲的内能不变 B.外力对乙做功;乙的内能不变 C.乙传递热量给甲;乙的内能增加 D.乙的内能增加;甲的内能不变
2.应用热力学第一定律解题的一般步骤: ①根据符号法则列出各已知量(W、Q、ΔU)的正 负; ②根据方程ΔU=W+Q求出未知量; ③再根据未知量结果的正负来确定吸放热情况、 做功情况或内能变化情况
二.热力学第一定律的应用
3. 气体状态变化的几种特殊情况:
①绝热过程:Q=0,则ΔU=W,不发生热传递,系统内 能的变化只与做功有关(分绝热膨胀和绝热压缩) ②等温过程: ΔU=0,则W=-Q,气体内能不变,外 界对气体做的功与气体吸收的热量等值异号(分等温膨 胀和等温压缩) ③等容过程:W=0,则ΔU=Q,气体不做功,系统内能 的变化只与热传递有关(分升温升压和降温降压) ④等压过程:等压膨胀,温度升高,内能增加,对外做 功,气体吸热;等压压缩,温度降低,内能减少,对内 做功,气体放热
解:根据热力学第一定律:U W Q 2.5105 J 1.2105 J Q
Q 1.3105 J, 气体向外界放热1.3105 J的功
二.热力学第一定律的应用
1.判断气体是否做功的方法: 一般情况下看气体的体积是否变化. ①若气体体积增大,表明气体对外界做功,W<0 ②若气体体积减小,表明外界对气体做功,W>0
例13. (多选)如图是某喷水壶。未喷水时阀门闭合,压 下压杆可向瓶内储气室充气;多次充气后按下按柄打开
阀门,水会自动经导管从喷嘴处喷出。储气室内气体可
2.应用热力学第一定律解题的一般步骤: ①根据符号法则列出各已知量(W、Q、ΔU)的正 负; ②根据方程ΔU=W+Q求出未知量; ③再根据未知量结果的正负来确定吸放热情况、 做功情况或内能变化情况
二.热力学第一定律的应用
3. 气体状态变化的几种特殊情况:
①绝热过程:Q=0,则ΔU=W,不发生热传递,系统内 能的变化只与做功有关(分绝热膨胀和绝热压缩) ②等温过程: ΔU=0,则W=-Q,气体内能不变,外 界对气体做的功与气体吸收的热量等值异号(分等温膨 胀和等温压缩) ③等容过程:W=0,则ΔU=Q,气体不做功,系统内能 的变化只与热传递有关(分升温升压和降温降压) ④等压过程:等压膨胀,温度升高,内能增加,对外做 功,气体吸热;等压压缩,温度降低,内能减少,对内 做功,气体放热
解:根据热力学第一定律:U W Q 2.5105 J 1.2105 J Q
Q 1.3105 J, 气体向外界放热1.3105 J的功
二.热力学第一定律的应用
1.判断气体是否做功的方法: 一般情况下看气体的体积是否变化. ①若气体体积增大,表明气体对外界做功,W<0 ②若气体体积减小,表明外界对气体做功,W>0
例13. (多选)如图是某喷水壶。未喷水时阀门闭合,压 下压杆可向瓶内储气室充气;多次充气后按下按柄打开
阀门,水会自动经导管从喷嘴处喷出。储气室内气体可
2024版大学物理热学ppt课件

供了理论指导。
02
热力学在环保领域的应用
通过热力学分析和优化,降低能源消耗和减少污染物排放,促进环境保
护和可持续发展。
03
热力学在新能源领域的应用
热力学原理在太阳能、风能、地热能等新能源的开发和利用中发挥重要
作用,推动能源结构的转型和升级。
THANKS
感谢观看
气体输运现象及粘滞性、热传导等性质
粘滞性
气体在流动时,由于分子间的动量交换,会 产生阻碍流动的粘滞力。气体的粘滞性与温 度、压强有关。
热传导
气体中热量从高温部分传向低温部分的现象 称为热传导。热传导是由于分子间的碰撞传 递能量实现的。气体的热传导系数与温度、
压强有关。
04 固体、液体与相 变现象
大学物理热学ppt课件
目录
• 热学基本概念与定律 • 热力学过程与循环 • 气体动理论与分子运动论 • 固体、液体与相变现象 • 热辐射与黑体辐射理论 • 热学在生活和科技中应用
01 热学基本概念与 定律
温度与热量
温度
表示物体冷热程度的物理量, 是分子热运动平均动能的标志。
热量
在热传递过程中所传递内能的 多少。
制冷机原理
利用工作物质在低温下吸热并在高温下放热,实现制冷效果的装置。制冷机通过消耗一定的机械能或电能, 将热量从低温物体传递到高温物体。常见的制冷机有冰箱、空调和冷库等。
热力学第二定律与熵增原理
热力学第二定律
热量不可能自发地从低温物体传递到高温 物体而不引起其他变化。热力学第二定律 揭示了自然界中能量转换的方向性和不可 逆性。它是热力学基本定律之一,对热力 学理论的发展和应用具有重要意义。
太阳能利用技术探讨
太阳能集热器
物理化学第1章 热力学第一定律

系统从环境吸热Q为正值,系统放热于环境Q为
负值。 ⑶单位: 常用单位为焦耳(J)或千焦耳(kJ)。
⒉功 ⑴定义和符号
系统与环境之间除热以外被传递的其他各种形式
的能量统称为功,用符号W表示。 ⑵正负值规定 系统对环境做功W为负值,系统从环境获得功W为 正值。
⑶单位:常用单位为焦耳(J)或千焦耳 (kJ)。
p( H 2 ) y( H 2 ) p总 =0.6427 108.9=70.00 kPa
p( N2 ) p总 p( H2 ) 38.89 kPa
四、阿马格分体积定律
由A、B、C组成的理想气体混合物
nRT (nA nB nC ) RT V p p
VA VB VC
⑶热力学能是系统的广度性质,具有加和性。
热力学能的微小变化dU可用全微分表示
通常,习惯将热力学能看作是温度和体积的函数,
即U=f(T,V),则
U U dU ( )V dT ( )T dV T V
理想气体的热力学能只是温度的函数。
1.3热力学第一定律
一、能量守恒与热力学第一定律
1.能量守恒定律
自然界的一切物质都具有能量,能量有各种各样形式, 并且能从一种形式转变为另一种形式,但在相互转变过 程中,能量的总数量不变。 2.热力学第一定律
本质:能量守恒定律。 常用表述:“第一类永动机是不可能造成的。” 第一类永动机是指不需要供给能量而可以连续不断做功
的机器。
二、封闭系统热力学第一定律的数学表达式
⑶恒容过程:变化过程中系统的体积始终恒定不变过程。
⑷绝热过程:系统与环境之间没有热交换的过程。 ⑸循环过程:系统由某一状态出发,经历一系列的变化,又 回到原状态的过程。
《热力学定律》人教版PPT精品课件1

Qab和Qac,则 ( C )
A.pb>pc,Qab>Qac B.pb>pc,Qab<Qac C.pb<pc,Qab>Qac D.pb<pc,Qab<Qac
《热力学定律》人教版PPT精品课件1
《热力学定律》人教版PPT精品课件1
18.(多选)一定量的理想气体从状态a开始,经历等温或等 压过程ab、bc、cd、da回到原状态,其p-T图像如图所示, 其中对角线ac的延长线过原点O.下列判断正确的是
11.AD [解析] 由状态a到状态b的过程是等温压缩过程,气体的温度不变,体积减小,故理想 气体的分子间平均距离减小,分子平均动能不变,气体的内能不变,因外界对气体做功,所以 气体要放出热量,选项A、D正确.由状态b到状态c的过程是等压膨胀过程,气体的体积增大, 温度升高,故理想气体对外做功,内能增加,分子平均动能增加,因气体的压强不变,故平均每 个分子在单位时间内与器壁碰撞的次数减少,选项B错误.由状态c到状态a的过程是等容降 压过程,气体的体积不变,温度降低,故分子间平均距离不变,分子平均动能减小,选项C错误.
B 6.关于物体内能的变化情况,下列说法中正确的是 () A.吸热的物体其内能一定增加 B.绝热压缩的物体其内 能一定增加 C.放热的物体其内能一定减少 D.体积膨胀的物体其内 能一定减少
6.B [解析] 对于吸热的物体,根据热力学第一定律ΔU=W+Q可知,其 内能不一定增加,还与做功情况有关,故A错误;对于绝热压缩的物 体,Q=0,外界对物体做功,W>0,根据热力学第一定律ΔU=W+Q,有ΔU>0, 其内能一定增加,故B正确;对于放热的物体,若外界对物体做功,而且 功的数值大于热量的数值,则根据热力学第一定律ΔU=W+Q可知,物 体的内能增加,故C错误;对于体积膨胀的物体,对外界做功,若物体从 外界吸热,而且热量的数值大于功的数值,则根据热力学第一定律 ΔU=W+Q可知,物体的内能增加,故D错误.
A.pb>pc,Qab>Qac B.pb>pc,Qab<Qac C.pb<pc,Qab>Qac D.pb<pc,Qab<Qac
《热力学定律》人教版PPT精品课件1
《热力学定律》人教版PPT精品课件1
18.(多选)一定量的理想气体从状态a开始,经历等温或等 压过程ab、bc、cd、da回到原状态,其p-T图像如图所示, 其中对角线ac的延长线过原点O.下列判断正确的是
11.AD [解析] 由状态a到状态b的过程是等温压缩过程,气体的温度不变,体积减小,故理想 气体的分子间平均距离减小,分子平均动能不变,气体的内能不变,因外界对气体做功,所以 气体要放出热量,选项A、D正确.由状态b到状态c的过程是等压膨胀过程,气体的体积增大, 温度升高,故理想气体对外做功,内能增加,分子平均动能增加,因气体的压强不变,故平均每 个分子在单位时间内与器壁碰撞的次数减少,选项B错误.由状态c到状态a的过程是等容降 压过程,气体的体积不变,温度降低,故分子间平均距离不变,分子平均动能减小,选项C错误.
B 6.关于物体内能的变化情况,下列说法中正确的是 () A.吸热的物体其内能一定增加 B.绝热压缩的物体其内 能一定增加 C.放热的物体其内能一定减少 D.体积膨胀的物体其内 能一定减少
6.B [解析] 对于吸热的物体,根据热力学第一定律ΔU=W+Q可知,其 内能不一定增加,还与做功情况有关,故A错误;对于绝热压缩的物 体,Q=0,外界对物体做功,W>0,根据热力学第一定律ΔU=W+Q,有ΔU>0, 其内能一定增加,故B正确;对于放热的物体,若外界对物体做功,而且 功的数值大于热量的数值,则根据热力学第一定律ΔU=W+Q可知,物 体的内能增加,故C错误;对于体积膨胀的物体,对外界做功,若物体从 外界吸热,而且热量的数值大于功的数值,则根据热力学第一定律 ΔU=W+Q可知,物体的内能增加,故D错误.
人教版高中物理《热力学第二定律》优秀PPT课件

四、永动机不可能制成 1、 第二类永动机
概念:从单一热源吸收热量,全部用来做功 而不引起其它变化。(马儿吃草全部消化吸收)
结果:无一例外地归于失败。 原因:违背了跟热现象相联系的宏观自然过 程具有方向性的规律(热力学第二定律)。
2、热力学第二定律的另一种表达:第二类永 动机是不可能造成的。
热力学第二定律得其他描述: 1、一切宏观自然过程的进行都具有方向性。 2、气体向真空的自由膨胀是不可逆的。
即:热量不可能从低温物体传到高温物体而不产 生其他影响。
在整个自然界中,无论是他有生命的还是
无生命的,所有的宏观自发过程都具有单 向性,都有一定的方向性,都是一种不可 空想会想出很多绝妙的主意,但却办不成任何事情。
不大可能的事也许今天实现,根本不可能的事也许明天会实现。 我成功因为我志在成功!
逆过程。如河水向下流,重物向下落,山 再冷的石头,坐上三年也会暖。
如果我们想要更多的玫瑰花,就必须种植更多的玫瑰树。
岳被侵蚀,人的一生从婴儿到老年到死亡 辛勤的蜜蜂永没有时间悲哀。汽车坐垫布莱克
推销产品要针对顾客的心,不要针对顾客的头。 若不给自己设限,则人生中就没有限制你发挥的藩篱。
等。
机械能与内能转化的方向性的进一步讨论
热机:是一种把内能转化为机械能的装置。(汽油 机、柴油机、蒸汽轮机、喷气发动机等)
自发地传给电冰箱,使其温度逐渐升高.
(2)开尔文表述:不可能从单一热源吸取热量,使之完全变成功,而不产生其他影响。 按此设想就可制成一种无功致冷机,它无需消耗功就能致冷。
通过摩擦而使功转变为热的过程是不可逆的。
B.热量不可能由高温物体传递给低温物体 按此设想就可制成一种无功致冷机,它无需消耗功就能致冷。
热学课件 热力学第二定律

果真可以,让海洋水温稍有降低,给出的热量足够人们用上千年。 例1:整个海水若温度降低0.1K,释放的热量够中国使用多少年?
解:海水大约1.36*1018m3, 质量为1.36*1021kg,水的比热容4.18*103J/kg K), 则海洋水温降低0.1K所释放的热Q= 1.36*1021*4.18*103*0.1=5.7*1023J, 2009年中国的能源消费总量为30亿吨标准煤,标准煤的燃烧值为:29MJ/kg, 总热量为:=2.9*107*3*1012 =8.7*1019J。够中国用 5.7*1023/(8.7*1019)=6551.7年!
Q
Q T0 T0
T>T0
反之TLeabharlann T0TTW
自动被压缩
W
T
所有宏观过程的 不可逆性都是等价的。 热力学第二定律的克劳修斯 表述: 热量不 能 自动地 由低温物体传向高温物体。
热力学第二定律的开尔文--普朗克表述: 其 唯一效果 是热全部变成功的过程是不可能的。
单热源热机是不可能制成的。 (热机的工质是做循环)
如果可以自动从低温热源吸热向高温热源放热
T1热库 Q2 反之 Q2 Q2 Q1 W
Q1- Q2 W
T2热库
T2热库
假设, 热可以自动从低温物体传向高温物体, 这将导致热可以自动转变成功。
气体向真空中绝热自 由膨胀的不可逆性
功变热的不可逆性
假设, 热可以自动转变成功,这将导致气体可以自动压缩。
W
T>T0
也就是说,只要违反其中的任一表述,必然会得到违反另一 种表述的结论。由此说明,两者都是等价的
反证I :若克氏表述不真,则开氏表述也不真。
T1 hot
自 发 从 低 温 吸 热 反 克
2第一章 热力学第一定律及其应用(1)

第一章 热力学第一定律
•
1-1
气体
一、气体基本实验定律 1、波义耳(R.Boyle)定律 在恒温条件下,一定量任何气体的体积 V均不其压力P成反比。 PV=常数 (n,T 恒定) 1-1
• 2. 盖-吕萨克(Ray-Lussac)定律 在恒压条件下,一定量任何气体的体 积均与其温度T成正比。 V/T=常数 (n,P 恒定) 1-2 • 3.阿伏加德罗(A.Avogado)定律 在相同温度、压力下,等体积的任何 气体均含有相同的分子个数。在相同 温度、压力下,任何气体的摩尔体积 相等。(101325Pa,273.15K, Vm=22.414dm3 )
综合上述两项修正,可得
(P a
2 Vm
)(V m b) RT
三、气体的液化及临界状态
• 同物质的P—Vm图曲线相似,都有临界点C。温度高于此 点时,将丌再存在通过加大压力使气体液化的可能。 • 临界温度 : 气体加压液化所允许的最高温度称为临界温度, 用TC表示。 • 临界压力:气体在临界温度下液化所需的最小压力称为临 界压力,用PC表示。 • 临界体积:气体在临界温度、临界压力下的摩尔体积称为 临界体积,用VC表示。TC、PC、VC总称为物质的临界参数, 是物质的特性常数。
B 1 k
B 1
在相同温度相同体积下
PB / P n B / n B y B
B
分压定律可写为
PB yB P
理想气体或实际气体均成立
2、阿马格特(Amagat)分体积定律
• 混合气体的总体积,等于各气体在相同温度、压力条件下 所占有的分体积之和。
V V1 V 2 V k V B
B 1
k
nB RT VB P
•
1-1
气体
一、气体基本实验定律 1、波义耳(R.Boyle)定律 在恒温条件下,一定量任何气体的体积 V均不其压力P成反比。 PV=常数 (n,T 恒定) 1-1
• 2. 盖-吕萨克(Ray-Lussac)定律 在恒压条件下,一定量任何气体的体 积均与其温度T成正比。 V/T=常数 (n,P 恒定) 1-2 • 3.阿伏加德罗(A.Avogado)定律 在相同温度、压力下,等体积的任何 气体均含有相同的分子个数。在相同 温度、压力下,任何气体的摩尔体积 相等。(101325Pa,273.15K, Vm=22.414dm3 )
综合上述两项修正,可得
(P a
2 Vm
)(V m b) RT
三、气体的液化及临界状态
• 同物质的P—Vm图曲线相似,都有临界点C。温度高于此 点时,将丌再存在通过加大压力使气体液化的可能。 • 临界温度 : 气体加压液化所允许的最高温度称为临界温度, 用TC表示。 • 临界压力:气体在临界温度下液化所需的最小压力称为临 界压力,用PC表示。 • 临界体积:气体在临界温度、临界压力下的摩尔体积称为 临界体积,用VC表示。TC、PC、VC总称为物质的临界参数, 是物质的特性常数。
B 1 k
B 1
在相同温度相同体积下
PB / P n B / n B y B
B
分压定律可写为
PB yB P
理想气体或实际气体均成立
2、阿马格特(Amagat)分体积定律
• 混合气体的总体积,等于各气体在相同温度、压力条件下 所占有的分体积之和。
V V1 V 2 V k V B
B 1
k
nB RT VB P
热力学第一定律ppt课件

变式训练
【例题】一定量的气体从外界吸收了2.6×105J的热量,内能增加了4.2 ×105J。问: ①是气体对外界做了功,还是外界对气体做了功?做了多少焦耳的功? ②如果气体吸收的热量仍为2.6×105J不变,但是内能只增加了1.6×105J,这一过 程做功情况怎样?
解:①根据ΔU = W + Q 得 W = ΔU - Q = 4.2 ×105J - 2.6×105J= 1.6×105J W为正值,外界对气体做功,做了1.6×105J 的功。 ②同理可得:W'=ΔU'- Q'=1.6 ×105J - 2.6×105J= - 1.0×105J W为负值,说明气体对外界做功(气体体积变大),做了1.0×105J 的功。
汽缸内有一定质量的气体,压缩气 体的同时给汽缸加热。那么,气体内能的 变化会比单一方式(做功或传热)更明显。 这是为什么呢?
压缩气体,内能增大,给气体加热内能也 是增大。两者叠加所以就更明显。
一方面表明,以不同的方式对系统做功时,
只要系统始末两个状态是确定的,做功的数量就
是确定的;
单纯地对系统做功做功: ΔU=W 焦
分析: ①确定研究对象:汽缸中的气体。
②明确气体状态变化过程。
③正确选取W与Q的正负。
解析:
(2)气体膨胀过程中气体(系统)对外界所做功,W是负值:
W2= F2L2=-9×10²×0.1 J =-900 J
系统向外放热:Q=-30J
气体内能的变化量:ΔU2= W2+Q2=-900 J - 30J =-930 J
【例题】如图,一台四冲程内燃机,活塞在压缩冲程某段时间内移动的距离为0.1 m, 这段过程活塞对气体的压力逐渐增大,其做的功相当于2×103N的恒力使活塞移动相同 距离所做的功(图甲)。内燃机工作时汽缸温度高于环境温度,该过程中压缩气体传 递给汽缸的热量为25J。 ⑵燃烧后的高压气体对活塞做功,气体推动活塞移动0.1m,其做的功相当于9×103N的 恒力使活塞移动相同距离所做的功(图乙),该做功过程气体传递给汽缸的热量为30J, 求此做功过程气体内能的变化量。
工程热力学全部课件pptx

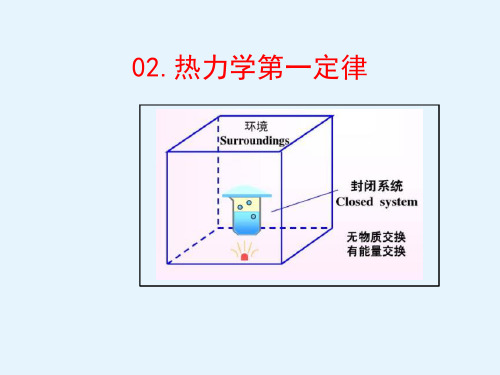
与外界没有物质和能量交 换的系统。
孤立系统
封闭系统
开放系统
热力学基本定律
热力学第零定律
如果两个系统分别与第三个系统处于热平衡状态,那么这两个系统也必定处于热平衡状态。
热力学第一定律
热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持 不变。
热力学第二定律
热力学循环
由一系列热力学过程组成的闭合路径,如卡诺循环、布雷顿循环 等。
02 热力学第一定律
能量守恒原理
1
能量不能自发地产生或消失,只能从一种形式转 换为另一种形式。
2
在一个孤立系统中,总能量始终保持不变。
3
能量转换过程中,各种形式的能量在数量上保持 平衡。
热力学第一定律表达式
Q = ΔU + W
其中,Δ(mv^2)/2表示系 统动能的变化量;
开口系统能量方程可表示 为:Q = ΔU + Δ(mv^2)/2 + Δ(mgh) + Δ(mΦ)。
Δ(mgh)表示系统势能的 变化量;
03 热力学第二定律
热力学第二定律表述
不可能从单一热源取热,使之完全转 换为有用的功而不产生其他影响。
热力学系统内的不可逆过程总是朝着 熵增加的方向进行。
具有加和性
理想气体基本过程
01
等温过程
温度保持不变的过程,如等温膨胀 和等温压缩
等容过程
体积保持不变的过程,如等容加热 和等容冷却
03
02
等压过程
压力保持不变的过程,如等压加热 和等压冷却
绝热过程
系统与外界没有热量交换的过程, 如绝热膨胀和绝热压缩
04
