玻璃工艺玻璃的着色和脱色
玻璃工艺学复习资料

玻璃⼯艺学复习资料第⼀章玻璃的定义与结构1、解释转变温度、桥氧、硼反常现象和混合碱效应。
转变温度:使⾮晶态材料发⽣明显结构变化,导致热膨胀系数、⽐热容等性质发⽣突变的温度范围。
⾮桥氧:仅与⼀个成⽹离⼦相键连,⽽不被两个成⽹多⾯体所共的氧离⼦则为⾮桥氧。
桥氧:玻璃⽹络中作为两个成⽹多⾯体所共有顶⾓的氧离⼦,即起“桥梁”作⽤的氧离⼦。
硼反常性:在钠硅酸盐玻璃中加⼊氧化硼时,往往在性质变化曲线中产⽣极⼤值和极⼩值,这现象也称为硼反常性。
混合碱效应:在⼆元碱玻璃中,当玻璃中碱⾦属氧化物的总含量不变,⽤⼀种碱⾦属氧化物逐步取代另⼀种时,玻璃的性质不是呈直线变化,⽽是出现明显的极值。
这⼀效应叫做混合碱效应。
2、玻璃的通性有哪些?各向同性;⽆固定熔点;介稳性;渐变性和可逆性;①.各向同性玻璃态物质的质点总的来说都是⽆规则的,是统计均匀的,因此,它的物理化学性质在任何⽅向都是相同的。
这⼀点与液体类似,液体内部质点排列也是⽆序的,不会在某⼀⽅向上发现与其它⽅向不同的性质。
从这个⾓度来说,玻璃可以近似地看作过冷液。
②.⽆固定熔点玻璃态物质由熔体转变成固体是在⼀定温度区域(软化温度范围)内进⾏的,(从固态到熔融态的转变常常需要经历⼏百度的温度范围),它与结晶态物质不同,没有固定的熔点。
③.介稳性玻璃态物质⼀般是由熔融体过冷⽽得到。
在冷却过程中粘度过急剧增⼤,质点来不及作有规则排列⽽形成晶体,因⽽系统内能尚未处于最低值⽽⽐相应的结晶态物质含有较⾼的能量。
还有⾃发放热转化为内能较低的晶体的倾向。
④.性质变化的渐变性和可逆性玻璃态物质从熔融状态到固体状态的过程是渐变的,其物理、化学性质变化是连续的和可逆的,其中有⼀段温度区域呈塑性,称“转变”或“反常”区域。
3、分别阐述玻璃结构的晶⼦学说和⽆规则⽹络学说内容。
答:(1)玻璃的晶⼦学说揭⽰了玻璃中存在有规则排列区域,即有⼀定的有序区域,这对于玻璃的分相、晶化等本质的理解有重要价值,但初期的晶⼦学说机械地把这些有序区域当作微⼩晶体,并未指出相互之间的联系,因⽽对玻璃结构的理解是初级和不完善的。
脱色在玻璃生产实践过程中的应用

1 实验材料及方法 1.1 玻璃成分设计
为使实验更接近生产实际,玻璃配合料成分设 计以某公司普通透明浮法玻璃为基础(如表 1 所示), 并在基础配合料上添加不同种类的脱色剂进行结果 对比。脱色剂包括:钴粉、碳酸钕、氧化铈、三氧 化二锑,均为分析纯。
幅度减少的要求,添加量在 3ppm 较为合适。而添 加碳酸钕含量在 0.07% 以内,色差较小,结合△ b
幅度减少的要求,添加量在 0.06% ~ 0.07% 较为合
适。
编号 0#
1-1# 1-2# 1-3# 1-4# 1-5#
表 2 添加物理脱色剂——钴粉
样品
Y L a* b* △ E*
玻璃样品 89.68 95.86 -1.12 0.24 -
Architectural & Functional Glass № 12 2019
脱色在玻璃生产实践过程中的应用
黄秀辉 (漳州旗滨玻璃有限公司,漳州 363401)
摘要:针对某公司普通透明浮法玻璃存在色差偏黄的问题,查找原因,并通过一系列的玻璃熔化实 验,对添加不同的物理脱色剂或添加化学脱色剂进行对比,寻找适合普通透明玻璃脱色的方法。最 终采用添加适量的物理脱色剂:钴粉,来达到消除、减弱玻璃色差问题的目的。
(燃烧重油)
配合料 90.63 96.26 -0.84 0.32 0.49
配合料 + 90.19 96.08 -0.85 -0.07 0.47
2ppm 钴粉
配合料 + 89.65 95.85 -0.92 -0.25 0.53
3ppm 钴粉
《玻璃工艺学》第9章着色与脱色

第9章 玻璃的着色和脱色9.1概述玻璃的着色在理论上和实践上都有重要意义。
它不仅关系到各种颜色玻璃的生产,也是一种研究玻璃结构的手段。
而且由于离子的电价、配位、极化等灵敏地影响到玻璃的颜色和光谱特性,因此可通过玻璃的着色来探讨玻璃的结构,以及随玻璃成分的递变和不同物理化学处理而发生的结构变化。
物质着色的基本原因是由于对光的吸收和对光的散射,以前者为常见。
物质吸收光的波长与呈现的颜色如表9-1所示。
表9-1被吸收光的颜色和观察到的颜色*吸 收 光 观 察 到 的颜 色吸 收 光 观 察 到 的颜 色 波长 / nm颜 色 波长/nm 颜 色 400 430 430~460 460~482 482~487 487~493 493~530紫 蓝 紫 紫 蓝 蓝 绿 蓝 蓝 绿 绿绿 黄 黄 黄 橙 橙 橙 红 红 玫 瑰530~559 559~571 571~580 580~587 587~597 597~620 620~675淡黄绿 黄 绿 黄 黄 橙 橙 红 橙 红紫 紫 蓝 紫 紫 蓝 蓝 绿 蓝 蓝 绿*被吸收光的颜色与观察到的颜色互称补色,互为补色的两种光合在一起就是白光。
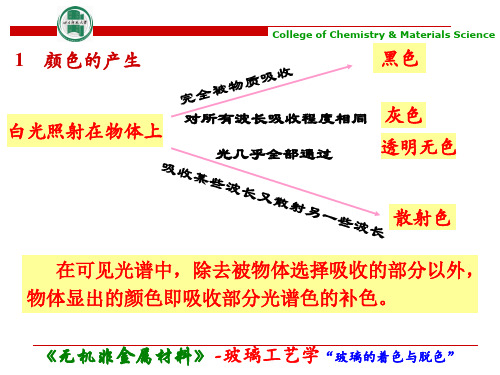
颜色的产生是物质与光作用的结果。
当白光照射到透明物质上时,如果物质全部吸收它,则呈黑色;如果对所有波长的吸收程度差不多时,就呈灰色;如果物质对光的吸收极小,使光几乎全部透过,物质就是无色透明的。
如果吸收某些波长的光,而透过另一部分波长的光,则呈现所有透过部分的光综合起来的颜色;如果它们吸收某些波长又强烈散射另一些波长的光,那么呈现全部散射光相综合的颜色。
根据物质结构的观点,物质对光的吸收是由于原子中电子(主要是价电子)受到光能的激发,从能量较低(1E )的“轨道”跃迁至能量较高(2E )的“轨道”,亦即由基态跳跃至激发态所致。
因此,只要基态和激发态之间能量差(νh E E =-12)处于可见光的能量范围时,相应波长的光就被吸收从而呈现颜色。
玻璃是如何脱色?

玻璃中的少量着色氧化物能促使出现可见的颜色,而且当产品的壁厚较大时更为明显。
根据技术文献的数据,在氧化条件下熔炼时,玻璃中不出现可见颜色时所允许存在的氧化物最高含量如下(96),CoO——0.0005NiO一0.0005ChO:-0.001CuO——0.01Fe20。
上述着色杂质中最重要的是氧化铁,它在优质无色晶质玻璃中的含量可能达到0.03—0.5%。
这种杂质是由砂子和石灰石带入玻璃液的。
由于Fe:Os含量平均为2—3%的坩埚的溶解,以及由于被成型设备和玻璃吹管的铁所污染的碎玻璃的使用,也会使大量的铁进入玻璃。
在使用纯原料的情况下,玻璃中的铁的总含量为原料带入杂质总含量的1/6.在/E产晶质玻璃时,这一点应当格外注意。
在熔制无澄清剂的玻璃时,色调将取决于熔炼条件。
与二价和三价铁共存所引起的黄一绿色相比,二价铁所引起的蓝一绿色着色更难被互补色补偿。
因此必须用添加诸如Ce0。
,As。
O。
,Sb。
O。
和Mn02之类氧化剂的方法,使玻璃中所含的绝大多数的铁变成三价态,这些氧化剂引起的脱色叫做化学脱色。
能与铁离子生成络合物的物质也属于化学脱色剂。
它们的着色能力与铁离子本身比起来要低得多。
氟化物和能与铁生成无色络合物的磷酸盐,及与砷和铁化合时也能生成无色络合物,并起活化作用的镧亦属此类。
但这种络合物在光的作用下要发生分解,从而使玻璃产生褐色着色(辐照变暗)。
用硒酸盐也可以脱色,但属于部分化学脱色,因为硒酸盐能把2价铁氧化成三价铁,而本身则变成了金属硒。
硒能形成附加的红色,以补偿铁离子引起的黄一绿色着色。
采用化学脱色方法可成功地降低玻璃颜色的强度,但要完全消除颜色是不可能的,因为生成的三价铁离子会产生黄一绿色色调。
为了消除这种色调,就要添加在玻璃中能对浅黄一绿色色调产生互补色的着色物质,也就是说添加能把玻璃着成红色或紫色的物质。
这种脱色方法称为物理脱色一,化学脱色为了进行化学脱色,在理论上要使用这样的氧化物,即在玻璃中能以几种氧化价态存在并能把二价铁氧化成三价铁。
平板玻璃的主要生产工艺介绍

平板玻璃的主要生产工艺介绍1、原料预加工。
将块状原料(石英砂、纯碱、石灰石、长石等)粉碎,使潮湿原料干燥,将含铁原料进行除铁处理,以保证玻璃质量。
2、配合料制备。
根据产品的不同,配合料的组成略有区别。
例如普通浮法玻璃的配合料(按照1重量箱即50公斤计算),需要消耗石英砂33.55公斤、石灰石2.96公斤、白云石8.57公斤、纯碱11.39公斤、芒硝0.55公斤、长石3.45公斤、碳粉0.03公斤。
3、熔制。
玻璃配合料在池窑或坩埚窑内进行高温(1550-1600度)加热,使之形成均匀、无气泡并符合成型要求的液态玻璃。
4、成型。
将液态玻璃加工成所要求形状的制品,如平板玻璃、各种器皿等。
5、热处理。
通过退火、淬火等工艺,消除或产生玻璃内部的应力、分相或晶化,以及改变玻璃的结构状态。
1.4玻璃生产的原料及成本构成介绍玻璃原料比较复杂,按其作用可分为主要原料与辅助原料。
主要原料构成玻璃的主体并确定了玻璃的主要物理化学性质,辅助原料赋予玻璃特殊性质和给生产工艺带来方便。
1.4.1玻璃的主要原料1、硅砂或硼砂:硅砂或硼砂引入玻璃的主要成分是氧化硅或氧化硼,它们在燃烧中能单独熔融成玻璃主体,决定了玻璃的主要性质,相应地称为硅酸盐玻璃或硼酸盐玻璃。
2、纯碱或芒硝:纯碱和芒硝引入玻璃的主要成分是氧化钠,它们在煅烧中能与硅砂等酸性氧化物形成易熔的复盐,起了助熔作用,使玻璃易于成型。
但如含量过多,将使玻璃热膨胀率增大,抗拉度下降。
3、石灰石、白云石、长石等:石灰石引入玻璃的主要成分是氧化钙,增强玻璃化学稳定性和机械强度,但含量过多使玻璃析晶和降低耐热性。
白云石作为引入氧化镁的原料,能提高玻璃的透明度、减少热膨胀及提高耐水性。
长石作为引入氧化铝的原料,它可以控制熔化温度,同时也可提高耐久性。
此外,长石还可提供氧化钾成分,提高玻璃的热膨胀性能。
4、碎玻璃:一般来说,制造玻璃时不是全部用新原料,而是掺入15%——30%的碎玻璃。
6-玻璃的着色与脱色
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
3 原因 玻璃对光的吸收是由于原子中的电子在接受光照 射后由较低的能级(E1)跃迁到较高的能级(E2)。 当E2-E1=可见光的能量时,就呈颜色。能量差 愈小、吸收光的波长愈长,呈现的颜色愈深。 颜色还同时采用亮度(透射或反射光的强度),是 颜色在“量”方面的特征。色调(是色玻璃透过的透 光中最显著的波长),是颜色质方面的特征。饱和度 (主波长在与白光混合中所占的百分数)。色调和饱 和度称为“色品” 。
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
配位数间的平衡
即与周围氧离子的配位数有关
[Fe3+O6] (淡红色) [Fe3+O4] (黄褐色) [Co2+O6] (粉红色) 着色离子浓度 [Co2+O4] (青色]
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
6.4.3 硫碳着色
1 硫碳在玻璃中的着色(掌握) “硫碳”着色玻璃,颜色棕而透红,色 似琥珀,广泛用于瓶罐玻璃和器皿玻璃。 碳的作用:还原剂作用,并不参加着色
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
《无机非金属材料》-玻璃工艺学“玻璃的着色与脱色”
College of Chemistry & Materials Science
玻璃着色方法

一、涂漆法
涂漆法是给玻璃上色的一种常用方法,需要用到特殊的油性玻璃漆。
首先,将玻璃器皿或物品擦洗干净,确保表面干燥无尘垢。
然后将油性玻璃漆搅拌均匀,再利用毛刷或喷涂器将漆均匀地涂在玻璃表面上。
大约30分钟后,玻璃表面的颜色会变得浓郁起来。
二、粘贴彩色胶纸法
这种方法非常简单,只需要买一些彩色的胶纸,然后剪成您需要的形状和大小,再粘贴在玻璃上即可,这是最容易和经济的方法之一。
在使用胶纸之前,用纸巾或棉球将玻璃表面擦干净,以免影响颜色粘度。
这种方法可以为玻璃器皿及各种装饰物增添气息。
三、涂抹彩色蜡笔法
这种方法最适合于玻璃上的细节着色。
首先,涂抹一层白色蜡笔作为底色,然后为您想要的颜色涂抹顶层,最后再在颜色表面轻轻地涂抹一层白色蜡笔,使颜色均匀。
最后,用纸巾轻轻地擦去表面多余的蜡笔,这样使颜色更加鲜明。
第五章玻璃的着色与脱色

④胶态硫硒化镉的形成
•主要由于熔体冷却时发生分相。由于硫化物
溶解度小,冷却时硫化物析出形成第二相并 长大成微晶体
•一般在含锌硅酸盐中加入硫化镉和硒粉熔制
而成 首先析出硫化锌,进一步降温,反应移 向硫化镉方向,硫化镉长大成为胶态颗粒, 产生黄色——镉黄玻璃 ZnS+CdO→ZnO+CdS
•热处理时硒离子进入CdS晶格,形成CdSCdSe混晶而成红色——硒红玻璃
二次显色温度一般略高于退火温度(600℃~800℃) 时间:保温时间延长颜色加深。
4. 其它着色方法 曝晒着色 在太阳光的紫外线照射下,玻璃结 构中或变价离子中的电子被激发引起。 被激电子被玻璃结构中某处捕获, 形成新的电子结构,即色心。 最常见的杂质铁,易产生曝光着色。
由于硫化物溶解度小冷却时硫化物析出形成第二相并长大成微晶体?一般在含锌硅酸盐中加入硫化镉和硒粉熔制而成首先析出硫化锌进一步降温反应移向硫化镉方向硫化镉长大成为胶态颗粒产生黄色镉黄玻璃znscdoznocds?热处理时硒离子进入cds晶格形成cdscdse混晶而成红色硒红玻璃显色需要使cdscdse长大成微晶体胶体实现着色因此需要热处理即显色
结构因素 2+ 3+ 结构因素对Fe /Fe 影响小。 24+ S 大多处于两个Si 之间, 似桥氧。 24+ 2S -Si 稳定性取决于阳离子对S 的极化作用 2网络外阳离子场强越大(极化作用越大)→S 4+ 2-Si 稳定性差→S 含量↓→色心浓度↓。
È S/SO4 Ó ± Ö × Ë · ¿
离子 3d层电子 颜色
Ti3+,Ti4+,V3+,V5+,Cr3+,Mn2+,Mn3+,Fe2+,Fe3+,Co2+,Ni2+,Cu2+,Cu+
玻璃工艺学知识要点2016分析

1、玻璃结构:是指离子或原子在空间的几何配置以及它们在玻璃中形成的结构形成体。
2、3T图:以温度T为纵坐标,冷却时间t或lg t为横坐标绘制温度-时间-转变率(T-T-T)图(简称3T图)。
3、离子的集聚作用:是离子使小型四面体聚集为大型四面体的作用。
4、混合碱效应:在R+离子含量不变,引进两种R+离子的玻璃比只含一种R+离子的玻璃的性能发生改变,当两种金属离子(R+)的数量接近时,其性能最佳。
5、离子着色:是指过渡金属离子在3d或4f轨道中de电子未被充满,容易产生d-d跃迁或f-f跃迁而引起光吸收,使玻璃着色。
6、主要原料:是指在玻璃中引入SiO2、Al2O3、B2O3、Na2O、K2O、CaO、MgO等各种组成氧化物的原料。
7、助熔剂:是指能降低玻璃熔制温度或加速玻璃熔制过程的原料。
8、玻璃成分:是指玻璃中所含有元素和化合物的种类和比例,又称为化学组成。
9、玻璃的成型:是将玻璃液制成为具有固定几何形状的玻璃制品的过程。
10、玻璃的热处理:是指在玻璃转变温度与软化温度之间所进行的热过程。
11、玻璃的表面抛光:是对不平整的玻璃表面进行处理,使之成为平整而光滑;或者是将玻璃毛坯制品经过处理,使之达到所规定的形状和尺寸,而且表面很光滑的加工过程。
12、夹层玻璃:是由两片或两片以上的玻璃用透明的弹性胶片牢固粘合而成的,具有透明、高机械强度、耐光、耐热、耐湿和耐寒等特性的深加工玻璃制品。
13、重金属氧化物玻璃:是指以氧化铅(PbO)、氧化铋(Bi2O3)、氧化锑(Sb2O3)、氧化碲(TeO2)以及其它在元素周期表中的第五、六主簇周期中具有高原子量的金属氧化物为基础组分而形成的玻璃。
14、光功能玻璃:是指在外场(电、光、磁、热、声、力等)作用下,利用玻璃本身光学性质(如折射率或感应电极化)发生变化的原理,去实现对入射光信号的探测、调制以及能量或频率转换作用的光学材料的统称。
15、离子的解聚作用:是离子使大型四面体分解为小型四面体的作用。
第8章-9章 玻璃的光学性质着色和脱色

从上述三种阳离子类型的特点,可以得出如下规律:
⑴ 最外层(或次外层)上含有未配对电子或“轨道”部分填充者, 电子容易在3d或4f“轨道”中发生跃迁,因此都是有色的。 ⑵ 最外层(或次外层)上的电子都已配对(包括全充满、全空)或 半充满者,都是无色的(或着色很弱)。
⑶ 在玻璃中凡是变价的阳离子,由于金属阳离子与周围氧离子 之间有电荷迁移,产生荷移吸收,因此在紫外或近紫外区有强 烈的吸收。
3. 稀土金属离子着色
稀土族(或镧系)是属于内过渡元素 特点是着色稳定,颜色鲜艳优美。
4f轨道:f-f 跃迁
4f亚层为(5S2)(5P6)电子壳所屏蔽,使4f亚层受邻近其 它原子的势场(配位场)影响较小。因此镧系元素在玻璃 中(或化合物中)的吸收光谱,基本保持自由离子的线状 光谱。
H5 F4
F5/2
3
980nm
525nm 545nm 658nm
1800nm 793nm
476nm
ET4
3
2
F7/2
4
I15/2
H6
Yb
3+
Er
3+
Tm
3+
Yb
图4-73 Er3+和Tm3+离子能级图以及980 nm泵浦下可能的能量转移机制
980nm
2
F7/2
3+
9.2.4
离子着色理论
在游离氧较少的酸性玻璃中,离 影响离子价态和光谱特性的因素 子趋向形成低价位和高配位;而在 碱性玻璃中,则趋向形成高价位, 熔制温度越高、熔制时间越长, 低配位。 越有利于高价氧化物的分解,使离 (1)玻璃的基础成分 子从高价转向低价。此外,气氛也 有重要的影响
器皿玻璃的脱色

技术信息资料器皿玻璃的脱色器皿玻璃的脱色:玻璃的脱色分为物理脱色和化学脱色二种:1、物理脱色:脱色剂有锰粉MnO2、硒粉Se、钴粉CoO、NiO、NdO、三氧化二钕Nd2O3;利用互补色的原理,在配合料中加入物理脱色剂,在玻璃中形成互补色,使玻璃对可见光的各个波段全面均匀地吸收,最后使得颜色为很浅的灰白色。
根据玻璃中杂质的颜色,可确定互补色,并以此来确定选择适合的脱色剂。
2、化学脱色:脱色剂有白砒As2O3、三氧化二砷Sb2O3、Na2S、氧化铈CeO2、硝酸盐、氟化物、卤化物等,一般在配合料中同时引入上述两种脱色剂;化学脱色剂借助脱色剂的氧化作用,使玻璃被有机物污染的黄色消除,使着色能力强的FeO变为着色能力较弱的Fe2O3。
用硒粉作脱色剂时,在原料中添加Na3SeO3或BaSeO3然后熔融,由于在氧化气氛中硒Se易变成SeO2而挥发,所以器皿玻璃的熔化一定要在中性或还原气氛中进行,硒粉对玻璃的脱色是随熔化温度、气氛及玻璃组成等因素变化,难以控制,除此之外,玻璃中的结石、条纹等造成的不均匀性也是影响玻璃透明度的原因,除内部因素外,玻璃表面的平整度也是影响玻璃透明度的重要因素之一。
3、器皿玻璃采用的复合澄清剂,可替As2O3、Sb2O3、CeO2起澄清、脱色、助熔作用,其用量按配合料中铁含量的高低进行适当调整,一般为配合料总量的0.8%~1%左右。
对铁含量高的玻璃有些采取加入氟化物,使Fe2+、Fe3+形成无色的FeF3_络离子,以减弱Fe的影响,玻璃的白度和透明度与玻璃的FeO·Fe2O3总含量多少有关;其含量越低,色泽效果越好;要提高脱色质量,关键是降低玻璃中FeO·Fe2O3的总含量,特别是氧化亚铁FeO的含量。
要获得色泽好的玻璃,必须保证玻璃中的总铁含量<0.033%,最好控制在0.015%以下,其中氧化亚铁FeO含量≤0.005%,FeO/Fe2O3比例波动在15%~30%。
玻璃的着色和脱色解析

b. 四面体配位(4配位) 高能轨道三个dxy dxz dyz 分裂能 Δ四=4/9 Δ八
低能轨道两个dx2-y2 dz2
c. 分裂能公式(八面体) 5
eq r4
3ห้องสมุดไป่ตู้R5
e--电子电荷 r--3d电子离原子核平均距离(离子半径)
颜色
弱黄 红 紫红
蓝
(2)胶粒浓度
影响色饱和度
(3)着色剂种类
四、硫、硒极其化合物着色
1. 单质着色
硒在中性条件下成淡紫红色,氧化条件紫色更美,氧化过分 无色(硒酸盐)。还原条件会生成无色碱硒化物和棕色硒化铁。
硫只在硼很高的玻璃中存在(蓝色),不实用。
2. 硫碳着色 (1) 着色机理
Fe3+为中心原子,被三个氧离子(O2-)和一个硫离子 (S2-)包围,成四面体结构。
黄绿→蓝绿 铜多偏蓝,铬多偏黄。
不可推测的混合色 (4)铬+锰 少量K2Cr2O7使紫色增强,再多则变灰色。
可制黑色和黑色透红外玻璃 (5)铁+锰 褐紫色和黄棕色,色调无规律。
三、金属胶体着色 1. 着色机理
金属(Au Ag Cu)以单质形式存在于玻璃中,形成晶体并 聚集而成胶粒,对光产生选择性吸收,使玻璃着色。
紫外吸收带进入可见光区产生淡黄色。 铈钛黄 不同基玻璃、比例可得黄、金黄、棕、蓝等色。
(9)钕 Nd3+紫红色,有双色效应 吸收峰复杂且稳定,可做校正分光光度计的标准玻璃。 固体激光材料。
4. 混合着色 可从透光曲线迭加推测混合色 (1)锰+钴 紫到蓝间颜色,锰调节色调。 (2)钴+铜 钴消除铜绿,铜消除钴红,得浅蓝→淡青 (3)铜+铬 以CuO:Cr2O3=1.5:1为中心(绿)得
玻璃着色方法

熔制玻璃时加入少量玻璃着色剂,可制得各种有色玻璃。
氧化铜(Ⅱ)或氧化铬(Ⅲ)产生绿色;氧化钴(Ⅱ)产生蓝色;二氧化锰产生紫色;二氧化锡或氟化钙产生乳白色;铀化合物产生黄绿荧光;胶态硒产生红玉色;胶态金产生红、红紫或蓝色;氧化亚铜产生红、绿或蓝色;亚铁化合物产生绿色,量多时为黑色;铁(Ⅲ)化合物产生黄色。
制玻璃时,由于原料中含有亚铁的杂质,常使玻璃带绿色,可加入少量二氧化锰或硒,使之变成无色玻璃。
玻璃的丝网印刷玻璃丝网印刷,就是利用丝网印版,使用玻璃釉料,在玻璃制品上进行装饰性印刷。
玻璃釉料也称玻璃油墨、玻璃印料,它是由着色料、连结料混合搅拌而成的糊状印料。
着色料由无机颜料、低熔点助熔剂(铅玻璃粉)组成;连结料在玻璃丝印行业中俗称为利板油。
印刷后的玻璃制品,要放火炉中,以520~600℃的温度进行烧制,印刷到玻璃表面上的釉料才能固结在玻璃上,形成绚丽多彩的装饰图案。
如果将丝印与其它加工方法并用的话,会得到更理想的效果。
例如利用抛光、雕刻、腐蚀等方法在印刷前或印刷后对玻璃表面进行加工处理,能够加倍地提高印刷效果。
1.玻璃制品蚀刻丝印长期以来,玻璃制品的蚀刻装饰,是在玻璃表层热涂蜡层及其它增固材料,作为抗蚀层,然后再在涂层上用针、小刀等刻出图案纹样,露出玻璃表面,然后在此部位上着氟氢酸进行腐蚀。
此工艺延续至今还有厂家应用,但其加工方法费时、费力、效率低下。
丝印蚀刻工艺,使玻璃制品的蚀刻装饰变得简便、省时、省力。
玻璃的蚀刻丝印,有热印及冷印两种方法。
热塑性蚀刻丝印,是将石蜡、沥青、硬脂酸等所配制的粘合剂,加入少量的抗蚀粉调制成抗蚀印料,通过热印丝网版,按设计图样,把印料刮印至玻璃表面,形成抗蚀膜的。
抗蚀膜上露出玻璃的部分,即是需要蚀刻的图案。
蚀刻采用氯氟酸进行,蚀刻后要用开水冲洗掉印在玻璃上的抗蚀层。
玻璃丝印蚀刻,也可以采用冷印方法进行。
抗蚀印料可使用特制的沥青漆加抗蚀粉,也可购买市售的抗依油墨。
印刷完成后,待抗蚀膜完全干燥,便可进行氢氟酸腐蚀了。
玻璃是如何脱色?

玻璃中的少量着色氧化物能促使出现可见的颜色,而且当产品的壁厚较大时更为明显。
根据技术文献的数据,在氧化条件下熔炼时,玻璃中不出现可见颜色时所允许存在的氧化物最高含量如下(96),CoO——0.0005NiO一0.0005ChO:-0.001CuO——0.01Fe20。
上述着色杂质中最重要的是氧化铁,它在优质无色晶质玻璃中的含量可能达到0.03—0.5%。
这种杂质是由砂子和石灰石带入玻璃液的。
由于Fe:Os含量平均为2—3%的坩埚的溶解,以及由于被成型设备和玻璃吹管的铁所污染的碎玻璃的使用,也会使大量的铁进入玻璃。
在使用纯原料的情况下,玻璃中的铁的总含量为原料带入杂质总含量的1/6.在/E产晶质玻璃时,这一点应当格外注意。
在熔制无澄清剂的玻璃时,色调将取决于熔炼条件。
与二价和三价铁共存所引起的黄一绿色相比,二价铁所引起的蓝一绿色着色更难被互补色补偿。
因此必须用添加诸如Ce0。
,As。
O。
,Sb。
O。
和Mn02之类氧化剂的方法,使玻璃中所含的绝大多数的铁变成三价态,这些氧化剂引起的脱色叫做化学脱色。
能与铁离子生成络合物的物质也属于化学脱色剂。
它们的着色能力与铁离子本身比起来要低得多。
氟化物和能与铁生成无色络合物的磷酸盐,及与砷和铁化合时也能生成无色络合物,并起活化作用的镧亦属此类。
但这种络合物在光的作用下要发生分解,从而使玻璃产生褐色着色(辐照变暗)。
用硒酸盐也可以脱色,但属于部分化学脱色,因为硒酸盐能把2价铁氧化成三价铁,而本身则变成了金属硒。
硒能形成附加的红色,以补偿铁离子引起的黄一绿色着色。
采用化学脱色方法可成功地降低玻璃颜色的强度,但要完全消除颜色是不可能的,因为生成的三价铁离子会产生黄一绿色色调。
为了消除这种色调,就要添加在玻璃中能对浅黄一绿色色调产生互补色的着色物质,也就是说添加能把玻璃着成红色或紫色的物质。
这种脱色方法称为物理脱色一,化学脱色为了进行化学脱色,在理论上要使用这样的氧化物,即在玻璃中能以几种氧化价态存在并能把二价铁氧化成三价铁。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)亮度brightness 垂直观察物的每单位投射面积上的光强。
(3)色调hue 色调主波长 指透过率最大的波长。
(4)色饱和度(纯度P)saturation 主波长在消色混合中所占的比例。 (2)(3)(4)是用于区别彩色的。 2. X-Y颜色图(自学)
?色品图中哪个区域的颜色饱和度最高?
3. 着色玻璃的分类 (1)光吸收型着色玻璃 离子着色 高能辐射着色
1802年生理学家汤麦斯·杨根据人眼的视觉生理特征提出了 新的三原色理论。他认为色光的三原色并非红、黄、蓝,而是 红、绿、紫。这种理论又被物理学家马克思韦尔证实。他通过 物理试验,将红光和绿光混合,这时出现黄光,然后掺入一定 比例的紫光,结果出现了白光。此后,人们才开始认识到色光 和颜料的原色及其混合规律是有区别的。
(8)铜
Cu0 红色、金星。 Cu+ 3d全充满,无 色。Cu2+天蓝色,与铬共用可制绿色 信号玻璃。
在钠硼玻璃中随钠的增多 绿→青绿→蓝
稀土金属 主要为f-f 跃迁,着色稳定。 (9)铈 Ce4+ 强烈吸收紫外线,可见光透过率高。
紫外吸收带进入可见光区产生淡黄色。
铈钛黄 不同基玻璃、比例可得黄、金黄、棕、蓝等 色。
反应平衡受到温度、气氛、时间等的影响。
·温度升高,利于高价离子分解 ·气氛 还原气氛利于高价离子降价 ·时间 时间延长,利于高价离子降价 d. 光照和热处理 ②非着色离子的影响 a. 阳离子场强
氧离子的有效电场q是可变的,受阳离子场强的作 用改变。高场强阳离子对氧的极化作用强,使q减小。 ∵Δ∝q,∴吸收光波长向长波方向移动。
把两种或多种色并置于一个圆盘上,通过动力令其快速 旋转,而看到的新的色彩。颜色旋转混合效果在色相方面与 加法混合的规律相似,但在明度上却是相混各色的平均值。 B:空间混合:
将不同的颜色并置在一起,当它们在视网膜上的投影小 到一定程度时,这些不同的颜色刺激就会同时作用到视网膜 上非常邻近的部位的感光细胞,以致眼睛很难将它们独立地 分辨出来,就会在视觉中产生色彩的混合。
用氧化亚锡(金属桥)防止。 玻璃-O2--1/2Sn4+-1/2Sn0-Au0-1/2Sn0-1/2Sn4+-O2--玻璃 3. 影响胶体着色颜色的因素 (1)胶粒大小 太小对光不散射,太大发生乳浊。
金胶粒大小(nm) <20 20~50
颜色
弱黄 红
(2)胶粒浓度
影响色饱和度
(3)着色剂种类
50~100 紫红
2Au+ + Sn2+ → 2Au0 + Sn4+
2Cu+ + Sn2+ → 2Cu0 + Sn4+
②光还原法(预先加入光还原剂Ce3+) 光:紫外线或X-射线 Au+ + Ce3+ → Au0 + Ce4+ Ag+ + Ce3+ → Ag0 + Ce4+
(3)金属原子的成核和长大(显色) 常与还原过程同时进行。胶体颗粒不可过大,可
第一篇 玻璃基础理论
第十一章 玻璃的着色和脱色 coluorate & decoluorate 一、概述
物质呈色主要为光吸收和光散射,而以吸收更常见。 白光投到透明的物体,颜色是其吸收光部分谱色的补色。
1. 描述颜色的参数 (1)三原色 目前常用标准基色量系统(XYZ系统)中的X-Y颜色图。
x+y+z=1
彩色电视机、彩色显示器、彩色液晶显示器,三基色日 光灯管就是应用该原理而设计制作的。
减法混合
减法混合主要是指的色料的混合。 两色混合后,光度低于两色各自原来的光度,合色愈多, 被吸收的光线愈多,就愈近于黑。所以,调配次数越多,纯 度越差,越是失去它的单纯性和鲜明性。减法混合的三原色 是加法混合的三原色的补色,即:翠绿的补色红(品红)、 蓝紫的补色黄(柠檬黄)、朱红的补色蓝(湖蓝)。
Cu+、Zn2+、Ga3+、Ge4+、As5+、 As3+、Ag+、Cd2+、 In3+、Sn4+、Sb5+、Au+、Hg2+、Tl3+、Pb4+、 Pb2+、Bi5+、 Bi3+
(3)不饱和电子壳阳离子
d和f亚层有不饱和电子,很不稳定。常出现变价、有色、 吸收紫外线等。
Ti、V、Cr、Mn、Fe、Co、Ni、Cu、Ce、Pr、Nd、Eu
?用Na2O代替SiO2,玻璃吸收光波长发生什么变化?
b. 阳离子半径
氧对半径大的阳离子屏蔽不完全,阳离子电场进入 配位场,使q减小,Δ减小,吸收光移向长波。
如 R2O场强相差不大,r占主要地位。 ③配位状态
∵Δ四=4/9 Δ八
∴高配位的吸收带波长较短
如 [CoO6] 吸收光波长550nm
[CoO4] 吸收光波长620nm ④温度
Fe2+ /Fe3+和S2-/SO42-重要 色心浓度=[Fe3+][S2-] 色心浓度越大,颜色越深。
A:原色理论
三原色,就是指这三种色中的任意一色都不能由另外两
种原色混合产生,而其他色可由这三色按照一定的比例混合出 来,色彩学上将这三个独立的色称为三原色。
牛顿用三棱镜将白色阳光分解得到红、橙、黄、绿、青、 蓝、紫七种色光,这七种色光的混合又得白光,因此他认定这 七种色光为原色。后来物理学家大卫·鲁伯特进一步发现染料原 色只是红、黄、蓝三色,其他颜色都可以由这三种颜色混合而 成的。他的这种理论被法国染料学家席弗通过各种染料配合试 验所证实。从此,这种三原色理论被人们所公认。
Li+ 、Na+ 、K+ 、Rb+ 、Cs+ 、Mg2+ 、Ca2+ 、Sr2+ 、 Ba2+ Al3+ 、Sc3+ 、Y3+ 、La3+ 、Si4+ 、Ti4+ 、Ce4+ (2)18及18+2电子构型
结构不如(1)稳定,极化率大,易变形,有变价, 吸收紫外线。本身无色,易被还原为金属态。与阴离子 结合可有色。
基玻璃氧化性或碱性太强则无色(V5+) 钠硼酸盐玻璃中,由于钠和熔制条件不同,可呈
蓝色、青绿、绿色、棕色或无色。
(3)铬 Cr3+绿色 高温较稳定,强还原条件可能全 以3价存在
Cr6+黄色 低温有利于其存在。 铬在硅酸盐中溶解度较小,可用于制铬金星玻璃。
用量 0.2~1%(Cr2O3)
(4)锰 Mn2+ 3d轨道半空,着色弱 Mn3+紫色 ,氧化越强着色越深。
(2)光散射型着色玻璃 金属胶体着色 (3)半导体着色玻璃 硫化物、硒化物着色
二、离子着色 ionic colourate 是否在可见光内发生 选择性吸收,取决于价电子
的跃迁 。
1. 离子按电子层结构分类 (1)惰性气体型阳离子 较稳定,跃迁需较高能量,通常不产生选择性吸收,故 无色、不吸收紫外线。
红色+蓝色=紫色 黄色+红色=橙色 黄色+蓝色=绿色
三种原色颜料的混合,在理论上应该为黑色,实际上是 一种纯度极差的黑浊色,也可以认为是光度极低的深灰色。
如果两种颜色能产生灰色或黑色,这两种色就是互补色。
中性混合
中性混合是基于人的视觉生理特征所产生的视觉色彩 混合,而并不变化色光或发光材料本身,混色效果的亮度既 不增加也不减低,所以称为中性混合。 有两种视觉混合方式: A:颜色旋转混合:
5 3
eq r4 R5
e--电子电荷
r--3d电子离原子核平均距离(离子半径)
q--配位体电荷或电矩(氧作用于中心离子的电场)
R--O2-与中心离子的距离 (4)影响Δ的因素
①着色离子价态
高价离子Δ >低价离子Δ (吸收带处于波长较短区域)
a. 基玻璃组成
酸性玻璃利于低价离子存在;碱性玻璃利于高价离子存在
轨道分成两组:两个高能轨道(eg或dT), 三个低能轨道(t2g或de)
两组轨道能量差:Δ=eg-t2g=10Dq Δ为配位场分裂能 eg=6Dq t2g= -4Dq
b. 四面体配位(4配位) 高能轨道三个dxy dxz dyz 分裂能 Δ四=4/9 Δ八
低能轨道两个dx2-y2 dz2
c. 分裂能公式(八面体)
基玻璃中R2O越多碱性越强,且随半径增大碱性更强。 b. 不同变价离子间的影响
不同变价离子间会发生氧化还原反应。
在玻璃熔制中反应较复杂,不完全按Tress和Weyl的 氧化还原电对数据进行。
c. 熔制工艺 Cr6+(黄绿色)+3e Cr3+(绿色) Mn3+(紫色)+e Mn2+(无色) V3+(绿色)+e V2+(紫色)
钠硼酸盐中为棕色,铅硅酸盐中为棕红色。
用量 3~5%
(5)铁 Fe2+蓝绿色 Fe3+ 3d轨道半充满,着色 弱,通常两种价态同时存在,比例不同 而显不同颜色。
在磷酸盐玻璃还原条件可能全为2价,在红外 有吸收峰,吸热好,透可见光好,可做吸热玻璃。 两价态均强烈吸收紫外线,用于太阳镜和电焊片。
(6)镍 常以Ni2+存在,不变价,着色稳定。 [NiO6]色灰黄,存在于钠硼酸盐玻璃
加法混合
B:混色理论
加法混合是指色光的混合,两种以上的光混合在一起,
光亮度会提高,混合色的光的总亮度等于相混各色光亮度之
和。合色愈多,则光度愈强,愈近于白。色光混合中,三原 色是朱红、翠绿、蓝紫
朱红光+翠绿光=黄色光 翠绿光+蓝紫光=蓝色光 蓝紫光+朱红光=紫红色光
