分析化学 ——中国科学院电工研究所2007年硕士入学考试试题
分析化学 中国科学院大学硕士研究生入学考试试题

中国科学院大学2020年招收攻读硕士学位研究生入学统一考试试题科目名称:分析化学考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
一、单项选择题(每题2分,共40分)1衡量样本平均值的离散程度应采用A变异系数B标准偏差C全距D平均值的标准偏差2下列关于有效数字说法错误的是A 分析化学计算中,倍数、分数关系的有效数字位数可认为没有限制B 有效数字的位数,直接影响测定的相对误差C 有效数字位数越多,表明测量越准确D 在分析工作中实际上能测量到的数字为有效数字3 甲基橙的变色范围为pH = 3.1 ~ 4.4(p K a = 3.4),若用0.1 mol·L-1 NaOH滴定0.1 mol·L-1的HCl,则看到混合色时,[In-]/[HIn]的比值为A 1.0B 2.0C 0.5D 10.04 配置pH = 9.0的缓冲溶液,缓冲体系最好选择A一氯乙酸(p K a = 2.86)~一氯乙酸盐B氨水(p K b = 4.74)~氯化铵C六亚甲基四胺(p K b = 8.85)~盐酸D醋酸(p K a = 4.74)~醋酸盐5 某碱样溶液,以酚酞为指示剂,用盐酸标准溶液滴定至终点时,耗去的体积为V1,继续以甲基橙为指示剂滴定,又耗去盐酸的体积为V2,若V2小于V1,则此碱样溶液是A Na2CO3B NaOH + Na2CO3C Na2CO3 + NaHCO3D NaHCO36 对于不可逆电对而言,实测电势与理论计算值存在一定差异的原因是A 不可逆电对一般为含氧酸,实际电势较难测准B 不可逆电对一般不对称,因此存在差异C 不可逆电对反应速度较慢,无法达到平衡状态D 不可逆电对的氧化态和还原态无法达成动态相互转化7 对于下列氧化还原反应的滴定曲线,化学计量点处于滴定突跃中点的是A 2Fe3+ + Sn2+ = 2Fe2+ + Sn4+B Ce4+ + Fe2+ = Ce3+ + Fe3+C Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2OD I2 + 2S2O32- = 2I- + S4O62-8 如不知所测样品的组分,若要想检验方法有无系统误差,应采取的方法是A 加入回收实验B 人工合成试样C 多次测量D 标准试样9有一瓶看不到明显颜色的溶液,其与分光光度测定有关的正确说法是A 不能进行光度分析B 显色后可进行光度分析C 光度分析灵敏度低D 无法判别是否能进行光度分析10 微量稀土离子可以通过生成CaC2O4来进行共沉淀分离,它属于A 利用生成混晶进行共沉淀分离B 利用形成离子缔合物进行共沉淀分离C 利用生成螯合物进行共沉淀分离D 利用表面吸附作用进行共沉淀分离11 在萃取分离过程中,判断分离难易程度的参数是A 分配系数B 回收率C 分离因子D回收因子12 用含少量Cu2+离子的蒸馏水配制EDTA溶液,于pH = 5.0时,用锌标准溶液标定EDTA溶液的浓度。
中科院有机化学历年考研真题及答案 1985-2006年

中科院有机化学历年考研真题及答案 1985-2006年中科院有机化学历年真题目录年份1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 试题有有有有有有有有有有有有有有有有有有有答案有有有有有有有有有有有有本资料全部来源于网上希望大家能够共享欢迎补充、修订2006.5: . O Cl O G +中国科学院1986 年硕士学位研究生入学考试试题有机化学一,填充题(共 10 分,每个空框 1 分),写出下列合成步骤空框中的化学结构或反应条件(每个空框,可能有几种试剂) 1. Me Me OA B Me Me COOMe Me OC Me Me Me O2. D H N H Me Me Me NH 2I Hg(OAc)2 Me BF 3 Et 2O EtOH COOMe O N F E 155℃,2h 195℃,1.5h JMe Me Me N H HON O O 二,(共 20 分,每题 4 分)用常见试剂,完成下列合成 NHN H1. OHC COOH2.13CO 2 Cl Cl 13Ph C CH3.4.C SOS CHOMe 5. CH 3COCH 2CH 2CH 2COCH 3 Me 三,反应机理(共 12 分,每题 4 分): 1. 反应: PhCH 2Cl OHPhCH 2可能有两种机理,即:SN1 PhCH 2Cl slow PhCH 2H Hfast OH PhCH 2OH SN2 OHC Cl PhCH 2OH + Cl Ph请设计至少两个不同的实验,来确证这一反应是按哪种机理进行的 。
O O +BA (: 2. 解释反应机理:MeO MeCHCl 2Na 2CO 3,DMSO 85℃H O H Cl Me H3. 解释反应机理:OHCMet -BuOK t -BuOHH HO CMeO四,共 8 分,每个空框 2 分。
2007考研 中科院《普通化学》真题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:普通化学(甲)考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
一、选择题:(共42分;其中11,12,18每小题4分;其余每小题2分)1.在电解质的饱和溶液中,加入与原电解质含有共同离子的另外一种( )会使原来电解质的( )下降。
这是关于多相离子平衡的共同离子效应。
(A) 强电解质,溶解度;(B)易溶强电解质,溶解度:(C)电解度,解离度2.下列各个含氧酸中,属于二元酸的是( )。
(A)H 3PO 4; (B )H 3BO 3; (C )H 3PO 2; (D)H 3PO 3 3. 一个电子排布式1s 22s 22p 63s 23p 1 的元素最可能的价态是( )。
(A )+1; (B )+2; (C) +3; (D) -1; (E) -24. 如果NH 4OH 的电离常数为1.8×10-5, 0.1M NH 4OH 溶液中OH - 的浓度是多少(mol/L)?(A) 1.80×10-6 (B) 1.34×10-3 (C) 4.20×10-3 (D) 5.00×10-25.尼龙是哪两种物质的共聚物?(A)尿素和甲醛;(B)苯酚和甲醛;(C)1,6己二胺和己二酸; (D)氯乙烯和乙烯醇6. 假定NH 基呈平面的,并具有三个等价的氢原子,那么成键电子是如何杂化的?+3(A ) sp3; (B ) sp ; (C ) sp2; (D )sd 27. 某一反应在高温下不能自动进行,但在低温下能自动进行.则该反应的和为m r S Δm r H Δ (A) 0,0>Δ<Δm r m r S H ; (B) 0,0>Δ>Δm r m r S H ; (C) 0,0<Δ<Δm r m r S H ;(D)0,0<Δ>Δm r m r S H 8. 在多电子原子中,分别可用下列各组量子数表示相关电子的运动状态。
1997年-1999年中科院《分析化学》考研真题

中国国科学院一九九七年招收硕士学位研究生入学考试试题试题名称:分析化学一,选择题(22分)1,若某矿石中铜的含量约为0.05%,则应采用下面哪种方法测定A,碘量法 B,EDTA置换滴定法 C,比色法 D,用铜试剂沉淀法2,用0.10 M HCl滴定0.10 M NH3 应选用下面何种指示剂A,甲基橙 B,甲基红 C,酚酞 D,百里酚酞3,某一含"OO"型螯合剂,他同Fe3+,Cu2+,Na+形成螯合物稳定性的次序是A,Fe>Cu>Na B,Fe>Na>Cu C,Cu>Na>Fe D,Cu>Fe>Na4,用EDTA作滴定剂滴定时,Fe3+,Cu2+,Ca2+能被准确滴定的最低pH值依次为A,Fe>Cu>CaB,Cu>Ca>Fe C,Ca>Cu>Fe D,Cu>Fe>Cu5,用NaOH滴定某一弱酸HB(Ka=1.0*10-6),现选一指示剂,其ΔpH=0.21,要使滴定误差小与0.1%,则HB的初始浓度应大于A,0.12M B,0.02M C,0.06M D,0.10M6,用10-2M EDTA 滴定10-2M Pb2+溶液,若ΔpM=±0.2,TE=0.1%,则滴定的最高pH 为(已知Pb(OH)2的Ksp=1.2*10-15,logKPbY=18.04)A,6.5 B,7.5 C,8.5 D,9.57,下列电对Fe3+/Fe2+的电位E10,Fe(phen)33+/ Fe(phen)32+的电位E20,Fe(CN)63-/Fe(CN)64-的电位E30的大小顺序为A,E1>E2>E3 B,E2>E3>E1 C,E3>E1>E2 D,E2>E1> E38,用碘量法测定铜合金中铜时,若有Fe3+存在,则对分析结果有什么影响A,偏高 B,偏低 C,无影响 D,不能确定9,以FeSO4溶液滴定0.02000M Ce(SO4)2溶液至等当点时,它们的体积比(VFe(II)/VCe(IV)为0.5000,FeSO4溶液的浓度为A,0.01000M B,0.02000M C,0.03000M D,0.04000M10,在Fe3+,Al3+,Ca2+,Mg2+混合溶液中,用EDTA法测定Fe3+,Al3+,要消除Ca2+,Mg2+的干扰,最简单的方法是A,沉淀分离法 B,控制酸度法 C,络合掩蔽法 D,溶剂萃取法11,用BaSO4重量法测定Ba2+的含量,若结果偏高,可能是A,沉淀包含了BaCl2 B,沉淀剂H2SO4在灼烧时挥发C,沉淀中含有Fe3+等杂质 D,沉淀灼烧时间过长二,填充题(23分)1,定量分析测定中,消除干扰的方法主要有两种,一种是,一种是2,滴定分析通常用于滴定,即被测组份的含量一般在以上3,为了准确测定明矾中铝的含量,以尽可能减少其系统误差,应采用作基准物质来标EDTA.4,若在酸性溶液中用AgNO3滴定Cl-,应采用方式滴定.5,用KMnO4法测定某样品中钙的含量,大量镁存在时,应采用方法来减少镁的沉淀.6,若对某样品的组成不完全清楚,应采用,以此来判断分析过程中有无系统误差.7,HB4O7-的Kb为(已知H2B4O7的Ka1=1.0*10-4,Ka2=1.0*10-9).8,NH2CH2COOH的质子条件为9,对单色指示剂,若指示剂的用量增大,指示剂的变色点会向pH 的方向移动. 10,硼酸是一极弱的酸,但如果于溶液中加入大量的甘油,则可用NaOH准确滴定,这是由于11,对于极弱的酸,可采用下列方法以便准确滴定(1) ,(2) ,(3) .12,用蒸馏法测定铵盐中的氮,通常试样用硫酸消化,然后加,将蒸馏出来,吸收在溶液中.13,对某一分析方法,进行对照实验的目的是为了 .14,小体积沉淀分离法一般是在尽量小的体积和尽量大的浓度,同时有大量没有干扰作用的存在下进行的,由于,所以得到的沉淀的含水量少且比较紧密.三,计算题(35分)1,在100ml pH=10.00的0.05.M EDTA溶液中,加入1g AgCl,问能溶解百分之几(KspAgCl=1.8*10-10,pH=10.00时,logαY(H)=0.45,logKAgY=7.32,AgCl式量:143.32)2,已知Ag+ + e = Ag ;E0=0.80V,Ag2SO3的Ksp=1.5*10-14,计算下列半反应Ag2SO3(s) + 2e = 2Ag + SO32- 的E0.3,在含Zn2+,Ca2+浓度均为0.02000M的pH为10的氨性溶液中,加KCN掩蔽Zn2+,且以同浓度的EDTA溶液滴定Ca2+.若终点时,NH3的浓度c1=0.10M,CN-的浓度c2=0.10M,以甲基百里酚蓝为指示剂,pCaep=5.5,问终点误差有多大(logKZny=16.50,logKCaY=10.69,Zn2+与CN- logβ4=16.7,Zn2+与NH3的logβ1~logβ4分别为2.37,4.81,7.31,9.46.NH3的Kb=1.8*10-5,HCN的Ka=6.2*10-10四,问答题(10分)1,有一试样溶液为强酸性(H+的浓度约为2M),现要在pH=5.0测定试样溶液中的某一组分,问应如何处理才能保证溶液的pH在5.0左右.2,在pH=10.00的氨性溶液中,以铬黑T(EBT)为指示剂,用0.020M EDTA滴定0.020M Ca2+溶液,终点误差高达-1.5%,在不改变现有条件的情况下,如何使滴定终点误差控制在允许的误差范围内五,综合题(10分)试设计采用EDTA络合滴定法,测定Fe3+,Al3+,Ca2+,Mg2+中的Mg2+的简要方案(组分的浓度为2*10-2M)(请写明主要步骤,如酸度,指示剂,掩蔽剂等)(logKFeY=25.1,logKAlY=16.3,logKCaY=10.69,logKMgY=8.70)中国科学院一九九八年招收硕士学位研究生入学考试试题试题名称:分析化学一,选择题:(15分)1,定量化学分析中最难过滤的沉淀类型是:A,凝乳状 B,晶体 C,不可溶的 D,胶凝状 E,同晶的2,下面的酸中哪一种酸最强A,HClO4 B,HF C,H3PO4 D,HCN E,HCl3,计算0.01mol/L氯化钡溶液中的离子强度A,0.03 B,0.04 C,0.01 D,0.025 E,0.0154,有关碳酸盐的误差,如下哪一种叙述是不真实的A,若用甲基橙作指示剂,误差会最大B,若用氢氧化钠作滴定剂,误差会减少C,所配制的氢氧化钠溶液加以保护以防止此类误差D,若装有滴定剂的瓶子配上烧碱石棉剂的保护管,这类误差会减少E,若装有溶液的瓶子的底部有碳酸钠,这类误差会最少5,在实验中,与碱相比,常选择酸作为永久性参考标准.在选择某一酸作为标准溶液时,如下各种因素中哪一种不属考虑范围A,此酸应是高离解的B,此酸应是挥发性的C,此酸的盐应是可溶解的D,此酸应是一强氧化剂E,此酸的溶液应是稳定的6,已知的许多化学反应中,能用作滴定过程而满足必要要求的反应不多.下面所列出的要求中哪一种不能满足滴定的要求A,该反应无副反应B,该反应的平衡常数必须很大C,该反应按一定化学方程式进行D,该反应进行得很慢,以利于观察终点E,应有某些仪器方法以告知分析家停止加入滴定剂7,一溶液含0.01mol/L Ag+和0.01mol/L Ca2+,为选择性沉淀银,应加入哪一种阴离子A,SO42-(Ksp(CaSO4)=4.2*10-5;Ksp(Ag2SO4)=1.2*10-5)B,OH-(Ksp(Ca(OH)2=1.3*10-6;Ksp(AgOH)=2.6*10-8)C,PO43-(Ksp(Ca3(PO4)2=1.3*10-32;Ksp(Ag3PO4)=1.8*10-18)D,如上任何一种E,如上均无8,一溶液含0.10mol/LH2CO3和0.10mol/L NaHCO3,然后加入0.01mol HCl到1L 此溶液中,所得溶液的pH值应是A,6.37 B,6.28 C,5.84 D,4.35 E,2.109,草酸H2C2O4的pKa1=1.22和pKa2=4.19,它的水溶液处在哪一pH值时,HC2O4 -的浓度达到最大值A,1.23 B,4.19 C, 7.55 D,2.17 E,14.0010,用1.00L 1.00mol/L氢氧化钠溶液完全中和50ml硫酸溶液,此硫酸溶液的浓度(mol/L)是A,2.0 B,0.1 C,1.0 D,0.2 E,10二,填空题:(15分)1,系统误差影响分析结果的;偶然误差影响分析结果的;在没有误差的情况下,总体平均值就是 .2,按照有效数字规则,计算下式所得的结果=%100*3000*000.100.52*)55.5*05032.000.20*0500.0(3,NaNH4HPO4溶液的质子条件式是4,六甲基四胺(CH2)6N4的pKb=8.85,它的共轭酸的化学式是;其酸式离解常数pKa= .若以(CH2)6N4与HCl构成一缓冲溶液,它的缓冲范围是pH= ,当缓冲剂(CH2)6N4的浓度c一定时,它的缓冲容量在[(CH2)6N4]:[HCl]= 时最大. 5,于一溶液体系中,某一金属离子M2+与配位体H2Y2-反应生成配合物MY2-,但M2+,H2Y2-和MY2-均发生副反应,其副反应系数分别是αM,αY和αMY,则此配合物的稳定常数KMY与条件稳定常数K'MY间的关系是 .6,用Fe3+滴定Sn2+至50.00%处,溶液的电位为+0.14V;滴定至化学计量点处,溶液的电位为+0.32V.则Fe3+/Fe2+电对的克式量电位是 V;Sn4+/Sn2+电对的克式量电位是V.7,常将各种检测仪器与色谱相连接,当分离的溶质出现在检测器中时而检测之.评估某一检测器性能的指标是 .8,用来测定某一质子的质量及电子的质量并具有照相形式的记录能力的仪器是 .9,原子吸收光谱线宽度受外界影响,主要有变宽和变宽.10,酸性溶液中的Li+,Na+和K+的最佳的分离方法是 .三,计算题:(共70分)1,用一新方法测得铁矿石中的百分含量时,得到如下7个数据:66.29,66.40,66.35,66.61,66.02,66.50和66.42,求出结果的平均值和变异系数(相对标准偏差).若Fe含量的标准值为66.60%,问此新方法是否存在系统误差(置信度为95%). (10分)tα,f值f 4 5 6 7 8 9α=0.10 2.132.021.941.901.861.83α=0.05 2.782.572.452.362.312.262,欲将100ml 0.10mol/LHCl溶液的pH值从1.00增加至4.44时,需加固体醋酸钠CH3COONa多少克(不考虑加入CH3COONa后溶液的体积变化)Mr(CH3COONa)=82.0g/mol;pKa(CH3COOH)=4.74 (5分)3,用0.20mol/L NaOH溶液滴定0.20mol/L HCl溶液(其中含有0.1mol/L NH4Cl).(1)计算化学计量点处的pH值(2)若滴定至pH=7.00,问终点时有百分之几的NH4+被滴定及其滴定误差(NH4+的pKa=9.26). (10分)4,计算在pH=10.00,[NH3]=0.10mol/L的情况下,用0.0200mol/L EDTA溶液滴定0.0200mol/L Zn2+ 溶液时,化学计量点处的pZn和pZn'值.(logKZnY=16.5;pH=10.00时,logαY(H)=2.4;Zn(NH3)1~42+的logβ1~logβ2分别是2.37,4.81,7.31和9.46) (10分)5,称取含有KI试样0.5000g,溶解于水中.用Cl2将I-氧化成IO3-,煮沸除去过量的Cl2后,加入过量KI并酸化,析出的I2耗去0.02082mol/L Na2S2O3溶液21.30ml.计算此试样中KI%.(Mr(KI)=166.0g/mol) (5分)6,重量法测定铁,将Fe(OH)3沉淀灼烧成称量形式Fe2O3的质量测得试样中铁的含量为10.11%.若灼烧过的Fe2O3中含有3.00%的Fe3O4,求试样中铁的真实含量.Mr(Fe)=55.85g/mol,Mr(Fe2O3)=159.69g/mol,Mr(Fe3O4)=231.54g/mol (10分) 7,将15mol氯化银沉淀置于500ml氨水中,已知平衡时,[NH3]=0.50mol/L.计算溶液中的Ag+的浓度.(已知:Ag+-NH3络合物的β1=103.24,β2=107.05,Ksp(AgCl)=1.8*10-10) (5分) 8,用25.00ml 苯萃取一100ml 0.1000mol/L的有机弱酸HA,取水相25.00ml,用0.02000mol/LNaOH溶液滴定,消耗20.00ml.计算该一元弱酸在两相中的分配数KD (8分)9,将Na2HPO4,NaH2PO4和H3PO4各1m mol溶解在10ml 水中,将此溶液注入一Na+型离子交换柱(溶液中呈酸的H+和其它阳离子从柱上交换出Na+)上,再加入100ml 水淋洗交换柱并收集在一烧杯中(1)烧杯中Na+的浓度是多少(2)溶液的pH值是多少(H3PO4之pKa1,pKa2和pKa3分别是2.12,7.20和12.36) (7分)中国科学院一九九九年招收硕士学位研究生入学考试试题试题名称:分析化学(乙)一,选择题(共21分)1,在有过量I-时,碘在水溶液中的存在形式主要是I3-,亦有少量I2,而被有机溶剂萃取的是I2,则分配比D可表示成( ).(O表示有机相,W表示水相)A,D = [I2]O / [I2]W B,D = {[I3-]W + [I2]W} / [I2]OC,D = [I2]W / [I2]O D,D = [I2]O / {[I3-]W + [I2]W}2,在金属离子M和N等浓度的混合液中,以HIn为指示剂,用EDTA标准溶液直接滴定其中的M,若TE≤0.1%, pM=±0.2,则要求( ).A,logKMY-logKNY ≥ 6 B,K'MY Ca3(PO4)2;利用氧化还原反应使弱酸转变为强酸,如H2SO3-->H2SO4;在某些酸性比水更弱的非水介质中滴定12,浓碱NaOH,NH313,检验是否存在系统误差14,盐类,离子的水合程度低三,计算题1,11.7%2,0.392V3,0.048%四,问答题1,HAc的pKa=4.74,采用HAc-NaAc缓冲溶液.向强酸性溶液中加入4M的NaAc. 2,在溶液中加入少量的MgY五,综合题NH4F络合掩蔽Fe3+,Al3+;EDTA滴定Ca2+,Mg2+总量.Ca2+ --> CaC2O4↓,分离单独滴定.中国科学院一九九八年分析化学考研试题参考答案一,选择题AAA DBBDE二,填空题1,准确度,精密度,真实值3,[NH3]+[OH-]+[PO43-]=[H+]+[H2PO4-]+2[H3PO4]4,(CH2)6N4+,5.15,4.15-6.15,2:15,lgK'MY = lgKMY - lgαM - lgαY + lgαMY6,0.68,0.147,桑德尔指数(灵敏度)8,9,多普勒,洛伦兹10,离子交换柱三,计算题1,有2,1.23g3,5.28,0.54%,0.27%4,10.8,5.315,2.45%6,10.12%7,8*10-8(要判断是否全溶)8,219,0.0545mol/L,9.65中国科学院一九九九年分析化学考研试题参考答案一,选择题DAACC AADCD BBBAA CAAAD D二,填空题1,NH3~NH4+溶液作为缓冲液,维持滴定弱碱性环境;NH3作为辅助络合剂,防止Zn2+沉淀2,最低酸度,指示剂3,柱层析分离,纸色谱分离4,直接滴定法,置换滴定法,间接滴定法,返滴定法5,二,加入大量NH4Cl的作用:1)控制溶液的pH值为8~9,2)利用NH4+作抗衡离子,减少氢氧化物沉淀物对其他金属离子的吸附,3)铵盐是一种电解质,可促进胶状沉淀凝聚.6,13.00,16.307,H+ + OH- = H2O8,实际部分,溶液离子强度,理想溶液9,2.0010,K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 7H2O + 3I2,I2 + 2Na2S2O4 = 2NaI + Na2S4O611,偏低,偏高三,计算题1,-0.0017%3,舍,无系统误差4,1.01,3.7*10-10,10-24.685,题目不完整6,13,10.6,2.6%第6题第3小问是一道很典型的题目强碱和弱碱并存,不能用终点误差公式.化学计量点时:[H+]+[HCN]=[OH-],题目是酸滴定碱,所以TE%= [H+]+[HCN]-[OH-])/CHCl若题目是碱滴定酸,则TE%=([碱]-[酸])/C碱,这公式在任何滴定条件下都适用.。
2007 年招收攻读硕士学位研究生入学统一考试试题 科目名称电子

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:电子线路考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
一、填空题(共18小题,每小题2分,共36分)1) 稳定电路输出电压应该采用的反馈组态是 ,稳定输出电流采用的反馈组态是 。
2) 反馈会影响电路的输出电阻,其中电压负反馈会 输出电阻,而电流负反馈会 输出电阻。
3) 放大电路在高频信号作用时放大倍数下降的原因是 存在,而低频信号作用时下降的原因是 存在。
4) 双极性集成运放的输入级多为 电路,中间级多为 电路,输出级多用 输出,偏置电路是 电路。
表1 A B C Y0 0 0 00 0 1 10 1 0 00 1 1 01 0 0 11 0 11 1 1 00 1 1 1 0 5) 差分放大电路有四种接法,分别是 、 、 、 ,其中 接法的共模抑制比KCMR 不为零。
6) 基本共射放大电路在放大区工作的条件是:发射结,其发射极电流Ie 是由 运动形成的;集电极 ,其集电极电流Ic 是由 运动形成的。
7) 十进制数(2537.80078125)10的十六进制表示形式是 。
8) 十进制数5的余3码BCD 编码为 。
9) 逻辑函数的真值表如表1所示,则其最小项之和表示为 (,,)Y F A B C =,最大项之积表示为 。
10) 图1电路实现的是 功能。
11) TTL 门电路组成的逻辑电路如图2所示,F = 。
12) 图3为TTL 门电路组成的微分型 触发器,若其输出脉冲宽度为4W T s μ=,恢复时间为1s μ,则其输出信号最高频率为 KHz 。
13) 对最大幅值为5.1V ,带宽为20MHz 的模拟信号进行单通道A/D 转换,要求模拟信号每变化20mV 能使数字信号的LSB 变化,那么选择A/D 转换芯片的分辨率最少应为 位,转换速度最低为 MHz 。
2007年考研试题及答案A

一、填空题(30分):1. (6分)由晶闸管构成的三相半波可控整流电路,当输入交流电压为t u ωsin 3112=,纯阻性负载且其值为10R =Ω,当控制角45α=时,输出平均电压为 ,输出的功率因数是 。
2.(6分)由晶闸管构成的单相桥式全控整流电路,当输入交流电压为t u ωsin 1412=,负载为反电动势且直流侧串联平波电抗器,已知60V, L=2E R =∞=Ω,,当控制角30α=时,输出平均电压为 ,输出平均电流为 。
3.(3分)缓冲电路( Snubber Circuit ) 的作用是 。
4.(3分)在交流供电系统中,当基波电流为140A I =,各次谐波电流分别为35792A, 1A, 0.5A, 0.2A I I I I ====, 则电流谐波总畸变THD 为 。
5.(3分)在逆变电路中,对于同一桥臂的开关管要采取“先断后通”的方法,也就是死区时间的设定,其目的是 。
6.(6分)单相桥式电压型逆变电路,180导通角,d 560V U =,则输出电压的基波有效值是 ,当只考虑10次以内的谐波电压时,输出电压的有效值是 。
7.(3分)在SPWM (Sinusoidal Pulse Width Modulation )控制的三相逆变电路中,设定的开关管的开关频率是20KHz ,逆变电路输出交流电压的频率为400Hz ,那么SPWM 控制电路中载波频率和调制波频率应分别设置为 和 。
二、简答题(60分):1. (7分)IGBT 在过流及短路过程中,系统如何检测并实施保护的?2. (7分)为什么晶闸管的触发信号通常不使用直流信号? 3. (7分)试说明有关晶闸管和电力晶体管的关断过程?4. (7分)请叙述电力二极管的反向恢复过程,在高频开关电路中,应选择什么型号的二极管?5. (8分)利用晶闸管SCR 构成的简易照明延时开关电路如图1所示,HL 是灯泡,SB 是开关,试分析此电路的工作原理。
中科院2007年生物化学考研真题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:生物化学与分子生物学考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
一、名词解释 (每题4分,共20分)1. 重组修复2. 转座子3. C4途径4. 正前馈作用和正反馈作用5. RNA剪接和可变剪接二、单项选择题 (每题1分,共20分,请在答题纸上标清题号,并将答案写在题号后)1. 下列各项中,不属于细胞代谢的中间产物的是:A. 葡萄糖-6-磷酸B. 丙酮酸C. 胆固醇D. 乙酰辅酶A2. 在真核生物细胞周期的四个时相中,用于准备DNA合成的是:A. M期B. G1期C. S期D. G2期3. 下列各项中,不属于真核生物基因表达转录前水平调节的过程是:A. RNA编辑B. 染色质丢失C. 染色体DNA的修饰和异染色质化D. 基因重排4. 下列各项中,尚未获得诺贝尔奖的是:A. DNA双螺旋模型B. PCR仪的发明C. RNA干扰技术D. 抑癌基因的发现5. 下列事件中,不属于表观遗传调控的是:A. DNA甲基化B. 组蛋白乙酰化C. mRNA 加尾D. RNA干扰基因沉默6. 大肠杆菌中,参与转录终止调控的是:A. TATA boxB. ρ因子C. snoRNAD. RNaseP7. 在正转录调控系统中,调节基因的产物被称为:A. 阻遏蛋白B. 诱导因子C. 激活蛋白D. 增强子8. 既可利用上游启动子,又可利用下游启动子的RNA聚合酶是:A. RNA聚合酶IB. RNA聚合酶IIC. RNA聚合酶IIID. RNA聚合酶IV9. 用来研究蛋白质-蛋白质间相互作用的实验技术是:A. 酵母双杂交技术B. 原位杂交技术C. RACE技术D. SAGE 技术10. 能够引起细胞内蛋白降解的反应是:A. 泛素化B. 去泛素化C. 磷酸化D. 去磷酸化11.双缩脲发应用来测定:A. 肽B. 糖C. RNAD. DNA12. 抗霉素A对呼吸链(电子传递链)抑制的作用点在:A. NADH脱氢酶附近B. 琥珀酸脱氢酶C. 细胞色素氧化酶D. 细胞色素b附近13. 氨基酸在掺入肽链前必须活化,氨基酸的活化部位是:A. 内质网的核糖体B. 可溶的细胞质C. 高尔基体D. 线粒体14. T4 DNA连接酶催化的连接反应需要能量,其能量来源是:A. ATPB. NADC. GTPD. 乙酰CoA15.组蛋白的修饰可引起核小体的解离,这种修饰是:A. 糖基化B. 腺苷化C. 磷酸化D. 乙酰化16.磷酸化酶激酶活性的发挥依赖于:A. 镁离子B. 钙离子C. 氯离子D. 锌离子17.胰岛素的功能单位是:A. 单体B. 二体C. 四体D. 六体18. DNA合成仪合成DNA片段时用的原料是:A. 4种dNTPB. 4种NTPC. 4种dNDPD. 4种脱氧核苷的衍生物19. 蛋白激酶A催化蛋白质上氨基酸残基的磷酸化,它是:A. 丝氨酸残基B. 组氨酸残基C. 酪氨酸残基D. 门冬氨酸残基20.端粒酶是一种蛋白质-RNA复合物,其中RNA起:A. 催化作用B. 延伸作用C. 模板作用D. 引物作用三、判断题 (每题1分,共30分,请在答题纸上标清题号,并将答案写在题号后,其中表述正确的写“对”,表述错误的写“错”)1. 糖酵解作用是葡萄糖在无氧条件下转变为丙酮酸所经历的一系列反应,在此过程中净生成两个ATP分子。
2007年中国科学院研究生院高分子化学与物理考研试题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:高分子化学与物理考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
高分子化学部分一、 名词解释(共10分,每小题2分)1遥爪聚合物2悬浮聚合3聚合物立构规整度4活性聚合反应5. 接枝反应效率二.选择题(每题选一最佳答案,每小题2分,共20分)1.下列烯烃能通过自由基聚合获得高分子量聚合物的是。
a. CH3CH=C(CN)COORb. CH2=CH-CH3c. CF2=CF2d. CH2=C(C6H5)22. 甲基丙烯酸甲酯在25℃进行本体自由基聚合当转化率达到20%时出现了自动加速现象这主要是由于所致。
a. 链段扩散速度增大因而增长速率常数kp值增大b. 长链自由基运动受阻使终止速率常数k值明显减小c. 增长速率常数kp值的增加大于终止速率常数k值的减小d. 时间的延长3. 聚苯乙烯具有的特点。
a. 不透明b. 抗冲性能差c. 加工困难d. 不易着色4. 乳液聚合中,如果选用软脂酸钠(C15H31COONa)为乳化剂,其三相平衡点为62℃则聚合反应应该选择条件下进行。
a. 低于62℃b. 62℃c. 高于62℃5. 茂金属催化剂催化烯烃聚合具有的特点。
a. 多活性中心催化活性高b. 单活性中心聚合产品具有很好的均一性c. 多活性中心催化共聚能力优异d. 单活性中心对极性单体具有较好的催化活性科目名称:高分子化学与物理第1页共4页6. 在适当引发剂存在的条件下,引发下列单体的自由基聚合反应属于非均相聚合的是a. 水相中丙烯腈的溶液聚合b. 苯乙烯的本体聚合c. 二甲基甲酰胺中丙烯腈的溶液聚合d. 苯中苯乙烯的溶液聚合7.以C 4H 9Li 为引发剂分别选用THF 和甲苯为溶剂引发苯乙烯聚合实验发现,在THF 中苯乙烯聚合反应速率要大为了提高甲苯中苯乙烯的聚合速率,可加入a. BF 3b. SnCl 4c. TiCl 4d. 18-冠醚-68. 下列环状单体中容易进行开环聚合的是a.环戊烷b. 四氢呋喃c. 1,4-二氧六环d. 八甲基环四硅氧烷9. 在-78℃条件下以三氟化硼-乙醚引发体系使乙烯基丁基醚聚合最为合适的溶剂是a. 丙酮b. 乙酸乙酯c. 乙醚d. 氯甲烷10. 当线性聚酯化反应进行到95%以后若继续进行反应则会是 a. 分子量分布变窄 b. 聚合度迅速增大c. 反应程度迅速增大d. 产生大量低分子量副产物三、问答题(共25分)1.试述传统自由基聚合反应的主要优点与主要缺点写出一种目前较为成功的活性/可控自由基聚合方法的名称。
2007年中科院福建物质结构研究所无机化学考研试题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:无机化学考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器一、选择题 ( 共20题,每题2分,共40分 )1. 金属锂、钠、钙的氢化物,氮化物,碳化物的相似点是…………………………( ) (A) 都可以和水反应,生成气态产物 (B) 都可以和水反应,生成一种碱性溶液 (C) 在室温条件下,它们都是液体 (D) (A)和(B)2. 与水反应生成两种碱的化合物是…………………………………………………… ( )(A) NCl 3(B) Mg 3N 2 (C) CaO (D) BN3. 根据酸碱质子理论,下列各离子中,既可作酸又可作碱的是………………………( ) (A) H 3O +(B)CO32−(C) (D) [Fe (H 2O)4(OH)2] NH 4+4. 用煤气灯火焰加热硝酸盐时,可分解为金属氧化物、二氧化氮和氧气的是………( ) (A) 硝酸钠 (B) 硝酸锂 (C) 硝酸银 (D) 硝酸铯5. 下列配离子属于反磁性的是…………………………………………………………( )(A) [Mn(CN)6]4− (B) [Cu(en)2]2+ (C) [Fe(CN)6]3−(D) [Co(CN)6]3−6. 已知:H 3PO 4 K 1 =7.1 × 10-3,K 2 = 6.0 × 10-10,K 3 = 4.4 × 10-13 Na 2HPO 4和Na 3PO 4溶解在水中,其物质的量浓度相同,这溶液的[H +]应是……………( ) (A) 7.1 × 10-3 (B) 6.0 × 10-8 (C) 4.3 × 10-10 (D) 4.4 × 10-137. s , p , d , f 各轨道的简并轨道数依次为…………………………………………………( )(A) 1, 2, 3, 4 (B) 1, 3, 5, 7 (C) 1, 2, 4, 6 (D) 2, 4, 6, 88. 试判断下列说法,正确的是……………………………………………………………( )(A) 离子键和共价键相比,作用范围更大 (B) 所有高熔点物质都是离子型的(C) 离子型固体的饱和水溶液都是导电性极其良好的 (D) 阴离子总是比阳离子大9. 25℃,2NO 2(g)N 2O 4(g),K c 与K p (\K )的比值(= 100 kPa )K c /K p 等于…( )\p (A)2980831.01×= 0.0404(B) 8.31 × 25 = 207.8(C) 0.0831 × 298 = 24.8 (D) 0.0821 × 298 = 24.510. 下列反应中释放能量最大的是……………………………………………………… ( ) (A) CH 4(l) + 2O 2(g)CO 2(g) + 2H 2O(g) ⎯→⎯ (B) CH 4(g) + 2O 2(g)CO 2(g) + 2H 2O(g) ⎯→⎯ (C) CH 4(g) + 2O 2(g)CO 2(g) + 2H 2O(l) ⎯→⎯ (D) CH 4(g) +23O 2(g)CO(g) + 2H 2O(l) ⎯→⎯ 11. 含有下列离子的溶液,与Na 2S 溶液反应不生成黑色沉淀的一组是…………………( )(A) Fe 2+,Bi 3+(B) Cd 2+,Zn 2+(C) Fe 3+,Cu 2+(D) Mn 2+,Pb 2+12. 在合成氨反应达到平衡时,有a mol N 2(g),b mol H 2(g),c mol NH 3(g)。
2007年中国科学院无机化学考研试题及答案

)
=F
−
(g)
= 2F(g)
= Na (g) + F (D) Na(g) = Na (g) + e
(B) NaF(s)
+ + −
−
(g)
15. 若两个液态组分混合形成理想溶液,则混合过程的…………………………………( (A) ΔV = 0 ΔH = 0 ΔS = 0 ΔG = 0 (B) ΔV > 0 ΔH < 0 ΔS < 0 ΔG > 0 (C) ΔH = 0 ΔV = 0 ΔS > 0 ΔG < 0 (D) ΔH > 0 ΔV < 0 ΔG< 0 ΔS > 0 16. 将下列四种气体按给定量混合均匀, 其中分压最小的是------------------------------( (B) 3.2 g CH4 (C) 2.8 g CO (D) 19.2 g O2 (A) 0.6 g H2 )
4−
5.
)
(B) [Cu(en)2] (D) [Co(CN)6]3−
2+
6. 已知:H3PO4 K1 = 7.1 × 10-3,K2 = 6.0 × 10-10,K3 = 4.4 × 10-13 Na2HPO4 和 Na3PO4 溶解在水中, 其物质的量浓度相同, 这溶液的[H+]应是…………… ( -3 -8 -10 -13 (A) 7.1 × 10 (B) 6.0 × 10 (C) 4.3 × 10 (D) 4.4 × 10 7. s, p, d, f 各轨道的简并轨道数依次为…………………………………………………( (A) 1, 2, 3, 4 (B) 1, 3, 5, 7 (C) 1, 2, 4, 6 (D) 2, 4, 6, 8 试判断下列说法,正确的是……………………………………………………………( 科目名称:无机化学 第 1 页 共6页
物理化学(乙)——中国科学院电工研究所2007年硕士入学考试试题

物理化学(乙)——中国科学院电工研究所2007年硕士入学考试试题2007年招收攻读硕士学位研究生入学统一考试试题科目名称:物理化学(乙)200092考生须知:课1.本试卷满分为150分,全部考试时间总计180分钟。
共济网2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
彰武3.可以使用无字典存储和编程功能的电子计算器。
同济大学四平路下列一些基本常数供解题时参考:业普朗克常数h = 6.626 × 10-34 J·S;玻兹曼常数kB = 1.381× 10-23 J·K-1;专摩尔气体常数R = 8.314 J·mol-1·K-1;法拉第常数F = 96500 C·mol-1 62 3039一、是非题(每小题1分,共10分)(判断下列各题是否正确,正确用“√”表示,错误用“×”表示)共1. 由理想气体混合物组成的体系属于独立子体系。
2. 若电池反应)()()(21)(212222?+?++=+ClHHHaClaHpClpH的标准电动势为Eθ,则电池反应的标准电动势为2Eθ。
)(2)(2)()(2222?+?++=+ClHHHaClaHpClpH同济3. 反应级数一定是简单的正整数。
同济大学四平路4. 体系的同一状态不能具有不同的体积。
共济网5. 某理想气体进行绝热自由膨胀,其热力学能的变化ΔU = 0, ΔH = 0。
共济6. 在封闭体系内发生任何绝热过程的ΔS一定大于零。
kaoyangj7. 多相多组分系统达到相平衡时,每个组分在各相的化学势相等。
336 260388. 对于一理想溶液,。
μμAA<*课9. )OHHC(H)l,OHHC(H)g,OHHC(H52mvap52mC52mCθθθΔ+Δ=Δ 3362 303910. 粒子的半径大于入射光波长时可观察到丁铎尔效应。
二、选择题(60分)(1-24题为单选题,每小题2分,共48分;25-28题为多选题,每小题3分,共12分)1. “封闭系统恒压过程中系统吸收的热量Qp等于其焓的增量ΔH”,这种说法(A)正确;(B)需加无非体积功的条件;(C)需加可逆过程的条件;(D)需加可逆过程和无非体积功的条件;2. 下列过程中系统的ΔG≠0的是:(A) 水在0℃、常压下结成冰; (B) 水在其正常沸点汽化(C) NH4Cl(s) → NH3(g)+HCl(g)(D)100℃、大气压下液态水向真空蒸发为同温同压下的气态水3. 理想气体从同一始态出发,分别经(1)绝热可逆膨胀,(2)多方膨胀,达到同一终态体积V2,则熵变ΔS(1) 和ΔS(2)之间的关系为(A) ΔS(1) > ΔS(2) (B) ΔS(1) <ΔS(2)(C) ΔS(1) =ΔS(2) (D) ΔS(1)与ΔS(2)无确定关系4. 对于反应物和生成物都是理想气体的化学反应,其△H与△U的关系如何?(A) △H >△U (B) △H<△U (C) △H =△U (D) 不能确定5. 质量分数为0.58%的NaCl水溶液的沸点接近于下列哪个溶液的沸点?(A) mB=0.2 mol·kg-1的蔗糖水溶液; (B) 0.58%的萄糖水溶液(C) mB=0.01 mol·kg-1的葡萄糖水溶液; (D) 0.58%的蔗糖水溶液6. 气体反应CO + H2O=CO2 + H2 ,设各气体皆为实际气体,此反应的和与体系总压有何关系?mrGΔθΔmrG(A) 和皆与体系总压无关(B) 和皆与体系总压有关mrGΔθΔmrGmrGΔθΔmrG(C) 与体系总压有关,与总压无关mrGΔθΔmrG(D) 与体系总压无关,与总压有关mrGΔθΔmrG7. 在732 K时,反应NH4Cl(s)=NH3(g)+HCl(g)的为-20.8 kJ/mol , 为154 kJ/mol, 则反应的为:θΔmrGθΔmrHθΔmrS(A) 239 J·K-1 (B) 0.239 J·K-1 (C) 182 J·K-1 (D) 0.182 J·K-18. 下列说法中,哪一种比较准确?相律可应用于(A) 封闭体系(B) 开放体系(C) 非平衡开放体系(D) 已达平衡的多相开放体系9.CuSO4与水可生成CuSO4·H2O, CuSO4·3H2O, CuSO4·5H2O 三种水合物, 则在一定压力下和CuSO4水溶液及冰共存的含水盐有:(A) 3种(B) 2种(C) 1种(D) 不可能有共存的含水盐10. 下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关:(A) S、G、A、CV (B) U、H、P、CV(C) G、A、H、U (D) S、U、H、G、11. 当熵值S 增大1 J·K-1·mol-1时,体系的微观态数Ω增大的倍数为:(A) 6.02×1023倍(B) exp(6.02×1023)倍(C) exp[(1/1.38) ×1023]倍(D) (1/1.38) ×1023倍12. 破坏臭氧的反应机理为:NO + O3 → NO2 + O2NO2 + O → NO + O2在此反应机理中,NO是(A)总反应的产物(B)总反应的反应物(C)催化剂(D)上述都不是13. 在化学反应动力学中,质量作用定律只适用于(A)反应级数为正整数的反应(B)基元反应(C)恒温、恒容反应(D)理想气体反应14. 在光化反应中, 光所起的主要作用是:(A) 催化作用(B) 增加体系的吉氏自由能(C) 活化反应物分子(D) 增加传递能量的速度15. 对峙反应A + B C + D;加入正催化剂后, 那么:(A) k1增大, k-1增大, k1/ k-1增大(B) k1增大, k-1减小, k1/ k-1增大(C) k1增大, k-1增大, k1/ k-1不变(D)k1增大, k-1增大, k1/ k-1减少16. 下列哪一对电解质溶液,可用界面移动法测量离子迁移数:(A)HCl与CuCl2 (B)HCl与CdSO4(C) HCl 与CuSO4 (D) KOH与CdCl217. 已知18℃时Λm∞ [(1/2)Ba(OH) 2],Λm∞ [(1/2)BaCl2]和Λm∞ [NH4Cl] 分别为0.02288、0.01203和0.01298 S·m·mol,则Λ[NH3·H2O](S·m·mol)为:(A) 0.01841;(B) 0.02193;(C) 0.02383;(D) 0.0368118. 下列叙述不正确的是:(A) 原电池中电势高的极为正极,电势低的极为负极(B) 发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极(C) 电解池中阳极与电源正极相联,阴极与电源负极相联(D) 原电池中正极是阳极,负极是阴极19. 在298K时, 电池Ag|Ag(a)Ag(a)|Ag的电动势E为正值,必有:(A) a>a,Eθ >0 (B) a=a,Eθ >0(C) a<a,Eθ =0 (D) a>a,Eθ =020. 已知φθ (Cd/Cd)=-0.402 V,电流密度为10 A·m-2时,氢在镉电极上的超电势约1V,当以镉为阴极电解CdSO4溶液[(Cd)=1],下列叙述正确的是:(A) 在阴极析出氢气;(B) 在阴极析出镉;(C) 氢和镉同时析出;(D) 当(H+)=1 时在阴极析出氢气21. 0.5 F 的电量通过硫酸铜溶液后,在阴极上质量增加多少克?(铜的原子量为64)(A) 16 (B) 32 (C) 64 (D) 8022. 溶胶的基本特性之一是:(A) 热力学上和动力学上皆属于稳定体系(B) 热力学上和动力学上皆属不稳定体系(C) 热力学上不稳定而动力学上稳定体系(D) 热力学上稳定而动力学上不稳定体系23. 均匀的牛奶是悬浮液,从其中沉淀脂肪和蛋白质的方法是:(A) 加入一些酒精(B) 将牛奶静置(C) 过滤(D) 加入酸24. 将大分子电解质NaR的水溶液用半透膜和水隔开,达到Donnan平衡时,膜外水的pH(A) 大于7 (B) 小于7 (C) 等于7 (D) 不能确定25. 下列判断正确的是:(A) 任一循环过程ΔS体=0,ΔS环=0;(B) 可逆循环过程ΔS体=0,ΔS环=0;(C) 不可逆循环过程ΔS体>0,ΔS环>0,ΔS总>0;(D) 不可逆循环过程ΔS体=0,ΔS环>0,ΔS总>0;(E) 不可逆循环过程ΔS体=0,ΔS环=0,ΔS总=0。
中科院2007考研有机化学真题及答案
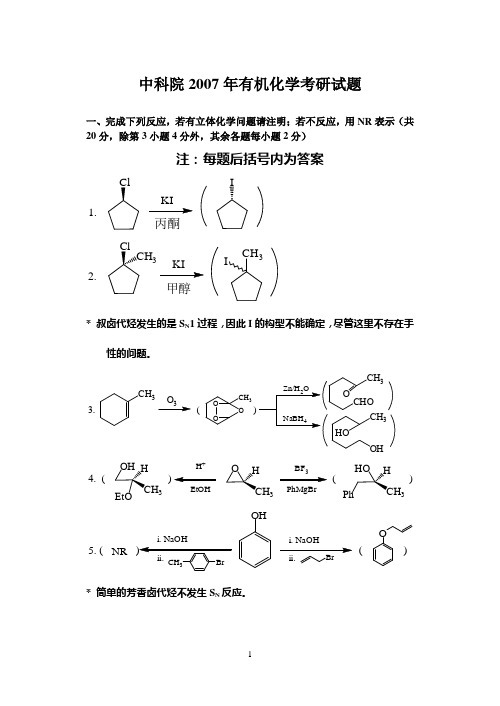
中科院2007年有机化学考研试题一、完成下列反应,若有立体化学问题请注明;若不反应,用NR 表示(共20分,除第3小题4分外,其余各题每小题2分)注:每题后括号内为答案1.丙酮I2.甲醇3CH 3I* 叔卤代烃发生的是S N 1过程,因此I 的构型不能确定,尽管这里不存在手性的问题。
3.()3CH3CH 3OO O334.()()H +EtOHBF PhMgBr3335.(()i.NaOHOHi.NaOHONR* 简单的芳香卤代烃不发生S N 反应。
6.+ClAlCl 37.OH OH CH 3CH 324O8.EtOHO OOEtOO* 逆Dieckmann 缩合。
9.Br 2H 2O二、为下列转变提供所需的试剂,必要时注明用量。
有的转变可能需要不止一步反应,请分别写出每步反应所需的试剂(20分,每小题2分)1.Br解:1 NaCN ; 2 H 3O +或 1 Mg/乙醚;2 CO 2;3 H 3O +2.OHOH O解:1 SOCl 2; 2 LiAlH(t-BuO)3; 3 H 3O + 或1 LiAlH 4;2 H 3O +; 3 CrO 3/Py3.()n -BuOHO-Bu3O解:1 SOCl 2;2 Me 2Cd 或 与过量的MeLi 反应后水解4.()NHOO解:1 NH 2OH/H +;2 H 2SO 4或PCl 5,Beckmann 重排。
5.()HO2O解:NaNO 2/HCl6.PhOPhO()解:1 LDA (1mol );2 MeI ;必须用强碱,否则易导致自身缩合。
7.O OBr解:Br 2(1mol )/HAc8.解:1 B 2H 6;2 H 2O 2/OH -9.()n -Bu2On -Bu CN解:P 2O 5或POCl 310.EtBrEt-NH 2解:1 NaN 3;2 LiAlH 4; 3 H 3O +三、判断题(共28分。
1、2两个小题各5分;3、4两个小题各9分) 1.指定下列各化合物手性中心的绝对构型(R/S )。
中科院、中科大分析化学考研试题及答案汇编

(A)(1)、(2)和(3)
(B)(2)和(3)
(C)(1)、(2)、(3)和(4)
(D)(1)、(2)和(4)
20. 沉淀中包夹沉淀剂时,提高沉淀纯度的有效方法是 (A)稀沉淀剂多次洗涤 (B)陈化 (C)重结晶 (D)蒸馏水多次洗涤
二、填充题(共 30 分)
1. (本题 2 分)配制还原 Fe3+用 15%SnCl2 溶液时,正确的操作是_________。
是
(A)碱性条件下加 KCN 掩蔽 (B)加入硫脲掩蔽 Cu2+,加入二酮肟掩蔽 Ni2+
(C)加 NaOH 掩蔽
(D)在酸性条件下,加入三乙醇胺,再调到碱性
9. 当参与反应的两电对的电子转移数均为 2 时,为使反应完全度不小于 99.9%,两电
对的条件电位至少应大于
(A)0.09V (B)0.18V
6. 下列物质中,可以作为基准物质用来标定 KMnO4 浓度的是
(A)Na2CO3
(B)Na2C2O4 (C)KHC8H4ml 开始,原因是
(A)滴定时从 0.00ml 开始
(B)可减小称量误差
(C)避免体积读数的累积误差 (D)操作方便
8. 用 EDTA 法测定 Ca2+、Mg2+,若溶液中存在少量 Cu2+和 Ni2+离子,消除干扰的方法
分析化学
一、选择题(每小题 2 分,共 40 分)
1. 用部分失水的硼砂(Na2B4O7·10H2O)作基准标定 HCl,再使用此 HCl 作为标准溶
液测定 Na2CO3 含量。则 Na2CO3 测定结果较实际含量
(A)偏高
(B)偏低
(C)无法确定
(D)无影响
2. 在酸碱滴定中,总是选择强酸强碱作为滴定剂的原因是
2007普通化学乙

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:普通化学(乙)考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器 。
一、 选择题(36分,每题2分)1.测量各种温度下0.1M KC2H3O2 溶液的pH值时发现,pH值随温度上升而增加。
据此,下述推论中哪个是正确的?(A)高温下KC2H3O2的溶解度很小;(B)随着温度的升高KC2H3O2蒸发加剧;(C)KC2H3O2水解反应是一个吸热反应;(D)KC2H3O2水解反应是一个放热反应2.如果把醋酸钠固体加到醋酸的稀溶液中,则pH值将:(A)升高;(B)不受影响;(C)下降;(D)先下降后升高;(E)先升高后下降3.下面列出了五种元素原子的电子构型,哪种构型的氧化态之一在水溶液中是无色的?(A) 2 8 18 1; (B) 2 8 14 2; (C) 2 8 16 2; (D) 2 8 18 24.通常当聚合物分子的什么性质较强时,塑料有较高的强度和硬度?(A)多晶型性;(B)无定形性;(C)无规立构性;(D)结晶度5.镧系收缩是指(A)镧系元素的离子半径;(B)镧系元素的核质量;(C)镧系元素的价电子:(D)镧系元素的电负性6.碱金属和卤素生成的化合物具有最可能正确的预测性质是(A)有一个低熔点;(B)难溶于水;(C)在固体中导电;(D)在熔融时导电7. 0.1N NaHCO3的pH值最接近下列哪个值( )。
(A)5.6; (B) 7.0; (C) 8.4; (D) 13.0; (E) 4.08.在实验室中,氢气通过下面哪种化合物管子时最容易被干燥?(A)CaCO3; (B) Ca3(PO4)2; (C) CaCl2; (D) Ca(OH)2; (E) MgCl29.用下列哪种轨道符号表示19K39?(A)1s22s22p62d102f1 (B) 1s22s22p63s23p9 (C) 1s22s22p63s23p6 4p1 (D)1s22s22p63s23p64s110.固体溶于水时,其溶解热与下列哪两种能量的相对值有关?(A) 解离能和电离能;(B)晶格能和振动能;(C)解离能和水合能;(D)晶格能和电离能;(E)晶格能和水合能11.一种化合物含有54.6%的碳,9.1%的氢和36.6%的氧,化合物的实验式(最简单的)为(A)C3H6O; (B) C4H9O2; (C) C4H8O2; (D) C5H9O12. pH = 2的溶液比pH = 6的溶液酸性高多少倍?(A)4倍;(B)12倍;(C)400倍;(D)10000倍13.下列化合物中哪种酸性最强?(A)CH3COOH; (B) CH3CH2OH; (C) CH2ClCOOH; (D) CHCl2COOH; (E) CCl3COOH14. 完全中和30毫升2M 的磷酸需要45毫升的氢氧化锂,氢氧化锂的摩尔浓度为多少?(A)1.3;(B)2.7;(C)5.0;(D)4.015.结晶热在数值上与下列哪一种热相等?(A)生成热;(B)溶解热;(C)蒸发热;(D)熔融热;(E)升华热16.原子的电子构型为1s22s22p63s23p6 3d104s24p5时,它的最可能的价态为: (A)-1;(B)-3;(C)+1;(D)+3;(E)+517.在开发新能源的探索中,氢被认为是一种理想的二级能源.目前认为,最有发展前途的制氢方法是(A) 电解水制氢(B)水煤气制氢;(C)太阳光光解水制氢;(D)硅与苛性钠作用制氢;18.对于电子波动性的正确理解是下面哪些?(A) 物质波;(B)电磁波;(C)机械波;(D)概率波;二、 填空题(50分)1.(6分)高熔点金属是指熔点等于或者高于( )的熔点( K)的金属,这些金属都集中在d区的( )、( )、( )、( )族中。
2007年药大分析化学真题详解

2007年分析化学试题详解1、陈化2、边缘效应3、膜电极5Magnetic anisotropy磁各向异性1、B平均值的置信区间(x tμ=±:一定置信度(概率)下,以平均值为中心,能够包含真值的区间(范围),反映估计的精密度。
置信度越高,置信区间越大。
(1)由单次测量结果估计μ的置信区间:(2)由多次测量的样本平均值估计μ的置信区间:n u x u x xσσμ⋅±=⋅±=(3)由少量测定结果均值估计μ的置信区间n tsx ts x x+=+=μ它表示在一定置信度下,以平均值为中心,包括总体平均值的范围。
这就叫平均值的置信区间。
2、Bσμu x ±=3、C液-固吸附色谱法定义:流动相为液体,固定相是固体吸附剂的色谱法,称为液-固吸附色谱法,简称液-固色谱法。
1.分离机制吸附色谱是被分离的组分分子(溶质分子)与流动相分子争夺吸附剂表面的活性中心,靠溶质分子的吸附系数的差别而分离。
已经介绍吸附系数可用广义分配系数K代替。
因为溶质分子只在吸附剂表面,而不能进入其内部,于是:t=t(1+KS/V) (8·4)式中的S是色谱柱中吸附剂的表面积,其它含义同第5章。
在吸附色谱法中,选择实验条件务必使组分间的分配系数K产生差别,以达到分离的目的。
由于S不易测,因为容量因子k=K·S/V,所以一般都用k代替K讨论问题。
2.★★影响容量因子的因素在色谱柱一定(S与V一定)及柱温一定时,k与溶质及溶剂的性质有关。
在吸附色谱法中,硅胶是最常用的吸附剂,故以硅胶为例讨论。
(1)硅胶与溶质分子的亲合力顺序(容量因子序):饱和烃<芳烃<有机卤化物<硫醚<醚<硝基化合物<酯≈醛≈酮<醇≈胺<砜<亚砜<酰胺<羧酸。
与硅胶亲合力大的溶质,k大,t(或t)大,晚出柱。
(2)溶质的极性:在用硅胶为固定相的液-固色谱法中,常用流动相是以烷烃为底剂加入适当极性调整剂组成的二元或多元溶剂系统。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2007年招收攻读硕士学位研究生入学统一考试试题3362 3039科目名称:分析化学研考生须知:33623 0371.本试卷满分为150分,全部考试时间总计180分钟。
112室2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
同济3.可以使用无字典存储和编程功能的电子计算器。
济一选择题(每题2分,共40分)辅导1 分析SiO2的质量分数得到两个数据:35.01%,35.42%, 按有效数字规则其平均值应表示为共济(A) 35.215%(B) 35.22%(C) 35.2%(D) 35%48号2 下列表述中错误的是33623 037(A) 由于无定形沉淀颗粒小,为防止沉淀穿滤,应选用致密滤纸(慢速) 业(B) 微溶化合物的临界值(Q/S)愈大,则愈不容易均相成核同济(C) 相对过饱和度愈大,分散度愈高辅导(D) 均相成核作用是指构晶离子自发形成晶核辅导3 Fe3+在某有机相与水相的分配比是99,今有含10 mg Fe3+的水溶液,若用等体积该有机溶剂萃取2次,则水相中剩余Fe3+的质量是共(A) 0.03mg (B) 0.01mg 共(C) 0.003mg (D) 0.001mg 3362 30394 在pH为10.0的氨性溶液中, 已计算出αZn(NH3)=104.7, αZn(OH)=102.4, αY(H)=100.5。
则在此条件下lg K'(ZnY)为[已知lg K(ZnY)=16.5] 院(A) 8.9 (B) 11.8 (C) 14.3 (D) 11.3 彰武5 水溶液呈中性是指(A) pH = 7 (B) [H+] = [OH-](C) pH+pOH = 14 (D) pOH = 76 某电解质MA(M2+,A2-)溶液,其浓度c(MA) = 0.10 mol·L-1, 则该溶液的离子强度为(A) 0.10mol·L-1 (B) 0.30 mol·L-1(C) 0.40 mol·L-1 (D) 0.60 mol·L-17 以下情况需要作移液管绝对体积校正的是(A) 称取草酸溶解后定容于100mL容量瓶中,移取25mL以标定NaOH浓度(B) 用移液管移取待测酸用NaOH标准溶液滴定(C) 移取25mL标准HCl溶液于250mL容量瓶,用蒸馏水稀释至标线(D) 称取定量硼砂加水25mL以标定HCl浓度8 以下说法错误的是(A) 朗伯-比尔定律只适于单色光(B) Fe2+-邻二氮菲溶液是红色,应选择红色滤光片(C) 紫外区应选择的光源是氢灯(D) 摩尔吸光系数ε值愈大,说明反应愈灵敏9 用挥发法测定某试样的吸湿水时,结果偏高,可能是由于(A) 加热的温度过低(B) 加热时间不足(C) 试样加热后没有冷到室温就称量(D) 加热后的称量时间过长10 有两组分析数据,要比较它们的精密度有无显著性差异,则应当用(A) F检验(B) t检验(C) u检验(D) Q检验11 pH玻璃电极在使用前一定要在水中浸泡几小时, 目的在于(A) 清洗电极(B) 活化电极(C) 校正电极(D) 除去沾污的杂质12 原子吸收和原子荧光分析的光谱干扰比火焰发射分析法的光谱干扰(A) 多(B)相当(C)不能确定谁多谁少(D)少13 在Fe3+,Al3+,Ca2+,Mg2+混合液中, 用EDTA法测定Fe3+,Al3+含量时, 为了消除Ca2+,Mg2+的干扰, 最简便的方法是(A) 沉淀分离法(B) 控制酸度法(C) 络合掩蔽法(D) 溶剂萃取法14 海水平均含1.08×103μg/g Na+和270 μg/g SO42-,海水平均密度为1.02g/mL, 则海水中Na+和SO42-浓度(mol·L-1)为(已知A r(Na)=23.0, M r(SO42-)=96.1)(A) 4.79×10-5, 2.87×10-6 (B) 1.10×10-3, 2.75×10-4(C) 4.60×10-2, 2.76×10-3 (D) 4.79×10-2, 2.87×10-315 图1~图4是分光光度法中常见的图形,它们分别代表什么曲线(填A、B、C 、D)(1) 图1 __________ A. 工作曲线(2) 图2 __________ B. 吸收曲线(3) 图3 __________ C. 络合比法测定络合物组成(4) 图4 __________ D. 测量结果的相对误差16 用双指示剂法测定可能含有NaOH及各种磷酸盐的混合液。
现取一定体积的该试液,用HCl标准溶液滴定,以酚酞为指示剂,用去HCl 18.02 mL。
然后加入甲基橙指示剂继续滴定至橙色时,又用去20.50mL,则此溶液的组成是(A) Na3PO4 (B) Na2HPO4(C) NaOH+Na3PO4 (D) Na3PO4+Na2HPO417 今欲用H3PO4与Na2HPO4来配制pH = 7.2的缓冲溶液,则H3PO4与Na2HPO4物质的量之比n(H3PO4)∶n(Na2HPO4)应当是(H3PO4的p K a1~p K a3分别是2.12,7.20,12.36)(A) 1:1 (B) 1:2 (C) 1:3 (D) 3:118 pH = 7.00的H3AsO4溶液有关组分平衡浓度的关系应该是(已知H3AsO4 p K a1 = 2.20, p K a2 = 7.00, p K a3 = 11.50)(A) [H3AsO4] = [H2AsO4-] (B) [H2AsO4-] = [HAsO42-](C) [HAsO42-] >[H2AsO4-] (D) [H3AsO4] >[HAsO42-]19 在pH=5.0的六次甲基四胺缓冲溶液中,用EDTA滴定Pb2+,化学计量点后pPb的叙述中,正确的是(A) 与lg K'(PbY)和c(Pb2+)有关(B) 只与lg K'(PbY)有关(C) 只与c(Y)有关(D) 只与c(Pb2+)有关20 已知在1.0 mol·L-1 HCl 中, (Fe3+/Fe2+)= 0.68 V, (Sn4+/Sn2+)= 0.14 V, 计算以ϕϕFe3+滴定Sn2+至99.9%、100%、100.1%时的电位分别为多少?(A) 0.50 V、0.41 V、0.32 V(B) 0.17 V、0.32 V、0.56 V(C) 0.23 V、0.41 V、0.50 V(D) 0.23 V、0.32 V、0.50 V二填空题(每空1分,共29分)1、以下基准物使用前应选择的处理方法是(请填A,B,C,D)(1) Na2CO3_________(2) Na2B4O7·10H2O_________(3) H2C2O4·2H2O_________(4) NaCl_________(A)500℃下灼烧(B)室温下空气干燥(C)置于相对湿度60%下(D)在~300℃灼烧2、重量分析法对称量形式的要求是_____________, ____________ , ______________。
3、在火焰原子吸收分光光度法中,化学计量火焰的特点是________________________________________,富燃火焰的特点是_______________________________________,贫燃火焰的特点是__________________________________。
4、已标定出准确浓度的NaOH溶液,由于保存不当吸收了空气中的少量CO2,如果用此NaOH标准溶液滴定HAc溶液,应使用的指示剂是______________。
由于CO2的影响,HAc的测定结果将____________。
若用它测HCl或NH4Cl混合溶液中的HCl含量,用____________作指示剂,测定结果将____________。
5、实验室为检查某一新方法有无系统误差,通常可采用___________________、__________________和_____________________等进行对照试验。
6、用Fe3+滴定Sn2+,若浓度均增大10倍,则在化学计量点前0.1%时E________,化学计量点时E________,在化学计量点后E________(指增加、减少或不变)。
7、色谱峰越窄,理论塔板数就越____,理论塔板高度就越____,柱效能越____。
8、王水是由______酸和______酸以______比______混合而成,它具有强烈的氧化性,是由于反应生成了______和______。
三计算题(共81分)1 (本题15分)计算0.050 mol·L-1邻苯二甲酸氢钾标准缓冲溶液的pH值(考虑离子强度的影响)。
()41.5,95.2''21==aapKpK2 (本题15分)称取1.250 g 纯一元弱酸HA, 溶于适量水后稀至50.00 mL, 然后用0.1000 mol·L-1 NaOH 溶液进行电位滴定, 从滴定曲线查出滴定至化学计量点时, NaOH溶液用量为37.10 mL。
当滴入7.42 mL NaOH 溶液时,测得pH = 4.30。
计算:(1)一元弱酸HA的摩尔质量; (2)HA的解离常数K a; (3)滴定至化学计量点时溶液的pH。
3 (本题15分)某溶液含Mg2+、Zn2+均为2×10-2 mol·L-1,在pH=10的氨性缓冲溶液中以KCN掩蔽Zn2+,用等浓度的EDTA滴定25mL上述混合溶液中的Mg2+。
若检测终点时的ΔpM=±0.2,TE=±0.1%,求应加入的KCN质量。
( 已知,Zn-CN-的7.8lg,5.16lg==MgYZnYKK7.16lg4=β ,pH=10时45.0lg)(=HYα,HCN离解常数Ka=10-9.21,MKCN=65)4 (本题15分)计算下列反应的条件平衡常数-32-3I2Fe3I2Fe+=+++已知。
当25mL 0.05mol·L-1的Fe3+与25 mL 0.15mol·L-1 I-混合后溶液中残留的Fe3+还有百分之几?如何才能做到定量的测定Fe3+?VVIIFeFe545.0,68.0'3'23//==−−++θθϕϕ5(本题6分)0.001 mol·L-1 Ca(NO3)2与0.001 mol·L-1 (NH4)2C2O4等体积混合,在pH=1.0时,是否有沉淀产生?[p K sp(CaC2O4)=8.64, p K a1(H2C2O4)=1.22, p K a2(H2C2O4)=4.19]6(本题15分)欲测水中钙的含量,于一预先加有过量Hg(NH3) Y2+ 和少量铬黑T(作指示剂)的50mL 氨性试样中,用汞阴极经0.018 A 的恒电流电解 3.5 min 到达终点(以Pt 片为阳极)。
