天然元素丰度表
地球表层化学元素丰度

地球表层化学元素丰度一、丰度的概念:即为该元素在自然体中的丰富程度abundance of elements),是指一种化学元素在某个自然体中的重量占这个自然体总重量的相对份额(如百分数)。
丰度表示方法主要分为重量丰度、原子丰度和相对丰度。
二、定义:同位素在自然界中的丰度,又称天然存在比,指的是该同位素在这种元素的所有天然同位素中所占的比例。
丰度的大小一般以百分数表示;人造同位素的丰度为零。
周期表上所列的原子量实际上是各种同位素按丰度加权的平均值,这是因为各种同位素在自然界中往往分布的比较均匀,取平均值计算比较准确。
一种化学元素在某个自然体中的重量占这个自然体总重量的相对份额(如百分数),称为该元素在自然体中的丰度。
三、研究地球表层化学元素丰度的意义研究元素丰度是研究地球化学基础理论问题的重要素材之一。
宇宙天体是怎样起源的?地球又是如何形成的?地壳与地幔中的主要元素有什么不一样?生命体是怎么产生和演化的?这些研究都离不开地球化学体系中元素丰度分布特征和规律。
元素丰度是每一个地球化学体系的基本数据,可在同一或不同体系中用元素的含量值来进行比较,通过纵向(时间)、横向(空间)上的比较,了解元素动态情况,从而建立起元素集中、分散、迁移活动等一些地球化学概念。
从某种意义上来说,也就是在探索和了解丰度这一课题的过程中,逐渐建立起近代地球化学。
四、发现历史自从1889年F.W.克拉克发表元素在地壳中的平均含量的资料以来,人们已经积累了大量有关陨石、太阳、恒星、星云等各种天体中元素及其同位素分布的资料。
1937年,戈尔德施米特首次绘制出太阳系的元素丰度曲线。
1956年,修斯和尤里根据地球、陨石和太阳的资料绘制出更详细、更准确的元素丰度曲线。
1957年,伯比奇夫妇、福勒和霍伊尔就是以该丰度曲线为基础,提出他们的核合成假说的。
四十年代,人们只知道大多数恒星的化学组成与太阳相似,因而就认为分布在整个宇宙的元素丰度可能是一样的。
课程作业一元素的丰度及分布分配

素,并加以说明。 Rb、Sr、Ga、Ti、Li、Ba、Ge、REE、Pb、Ni、Mn、Sc 四、说明在矿物中不存在下列类质同象置换关系的原因: C4+→Si4+ Cu1+→Na1+ Sc3+→Li1+ 五、为什么在碱性长石中常见钾长石与钠长石的条纹结构,而在斜长石中则不见这种结构? 六、利用晶体场理论研究过渡金属离子进入矿物晶格的基本思路是什么?
三、全部溶解的 CO2 以 H2CO3、HCO-3 和 CO32-三种溶解类型存在,当 pH 为 8.3 时,求各溶 解类型两两比值,并指出何种溶解类型为优势场。相应的反应和平衡常数:
H2CO3
H++HCO-3
K=10-6.4
HCO-3
H++CO23-
K=10-10.3
四、河南某钼矿热液作用期自高温到低温有四个矿化阶段,各阶段主要矿物组合为:1.辉钼 矿—黄铁矿—钾长石—石英组合;2.黄铁矿—辉钼矿—石英组合;3.方铅矿—闪锌矿— 磁黄铁矿—石英组合;4.磁铁矿—辉钼矿—沸石—方解石组合。试分析自热液早阶段— 晚阶段酸碱条件和氧化还原条件的变化趋势。
量多少不同的原因。
(离子半径 RZn2+=0.83Ǻ; RFe2+=0.82Ǻ; RFe3+=0.67Ǻ) 八、在某地表水溶液中,环境氧化还原电位 Eh 环=0.65(V)介质 pH=4,通过计算说明氧化还
原反应:
U4++2H2O—→UO22++4H++2e- (Eh0=0.407) 在上述条件下铀主要以什么价态形式存在?
地壳元素丰度列表

3,880,00 0吨
8.23%
15,000,0 00 吨
5.63%
716,000, 000 吨
112,000,
4.15% 000 吨
(CaO)
2.36%
200,000 吨
2.09% 200 吨
2.33%
350,000 吨
0.56%
99,000 吨
0.14%
磷
P
0.12%
1000
ppm
1000
ppm
Earth's
元素 氧
化学 符号
O
[1]
[2]
46.60% 47.40%
硅
Si
27.72% 27.71%
铝
Al
8.13% 8.20%
铁
Fe
5.00% 4.10%
钙
Ca
3.63% 4.10%
钠
Na
钾
K
镁
Mg
钛
Ti
氢
H
2.83% 2.59% 2.09%
2.30% 2.10% 2.30%
0.44% 0.56% 0.14% N/A
硼
B
痕量
950 ppm (?)
8.7 ppm
10 ppm
1,000,00 0吨
钆
Gd
7.7 ppm 5.2 ppm
6.2 ppm 400 吨
镝
Dy
铪
Hf
铒
Er
镱
Yb
铯
Cs
铍
Be
6 ppm 5.3 ppm 3.8 ppm 3.3 ppm 3 ppm 2.6 ppm
6.2 ppm 3.3 ppm 3.0 ppm 2.8 ppm 1.9 ppm 1.9 ppm
地球元素含量排序表

地球元素含量排序表一般都认为地球的内部有三个同心求层,分别为地壳、地幔以及地核。
其中,地壳指的是地球的表面层,也是我们人类生存和从事各种各样生产活动的场所。
地壳其实是由多组断裂的、很多大小不一的块体所组成的,所以,在它的外部会呈现出各式高低起伏的形态,因而地壳的厚度并不是一致的。
通常,大陆下的地壳平均厚度在35公里左右,而我国的青藏高原的地壳厚度要达到65公里以上,而海洋下的地壳的厚度只有5到10公里。
其实,整个地球的平均半径是6371公里,所以地壳的厚度对于地球的厚度来说仅仅只是薄薄的一层。
地壳中含量排名前十位的元素是:氧(O)、硅(Si)、铝(Al)、铁(Fe)、钙(Ca)、钠(Na)、钾(K)、镁(Mg)、氢(H)、钛(Ti)。
在这其中,含量最多的元素是氧元素,大概占所有元素中的48.6%,再者就是硅元素,占据所有元素中的26.3%。
接下来就是铝、铁、钙、钠、钾、镁,这些占比都要超过1%。
而上述的八种元素占据了地壳化学成分总量的98%以上,剩下还有80多种元素,它们只占地壳化学成分总量的不到2%。
地壳中的前12种元素量的多寡决定了地壳各区域的化学性质和物理性质,地壳中的各种岩石就由它们组成,所以这些元素又被称之为“造岩元素”,也被称为“常量元素”。
而剩下的那么多元素其实在地壳中占据的很少,它们在地壳中的丰度均在0.01%以下,所以被称之为“微量元素”。
事实上,绝大多数的元素,包括我们生活生产当中所需要的很多金属和非金属在内,在地壳中的含量都是比较微小的,就算是那些在地壳中含量比较多的元素,也并不能达到工业生产的要求。
不过,这些化学元素在特定的地址条件下是可以形成天然化合物的,也就是我们所熟知的矿物。
而矿物在地球上的分别就非常广泛了,并且还与我们的生产生活关系密切,是我们人类生产生活的重要物质来源之一。
下面是排名前四的元素的介绍1.氧元素(46.6%)氧元素是地壳中含量最为丰富的元素,它在地壳中占467,100 ppm(百万分之一),或者是46.6%。
元素丰度与克拉克值

原子 序数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 元素 名称 氢 氦 锂 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 元素 符号 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga 华夏壳体A1 系数 × 10n 1.48 6.6 0.8 7.2 2.34 18 4.34 297 1.25 1.6 3.85 2.3 569 212 58 9.53 2.88 17 2.09 85 1.65 1.12 6.72 75 1.13 35 68 13 3 丰度值 (10-6) 1480 6.6 0.8 7.2 2340 18 434000 297 12500 160000 38500 230000 569 212 58 9530 28800 17 2090 85 1650 1120 67200 75 1130 35 68 13 西域壳体A2 系数 × 10n 1.18 28 3.4 8.8 3.99 11 4.57 591 0.99 1.53 3.27 2.26 1.56 63 17 8.89 2.72 3.9 4.48 31 1.78 0.93 6.01 25 1.38 42 79 15 3 丰度值 (10-6) 1180 28 3.4 8.8 3990 11 457000 591 9900 153000 32700 226000 1560 63 17 8890 27200 3.9 4480 31 1780 930 60100 25 1380 42 79 15 藏南壳体A3 系数 × 10n 1.24 26 1.6 6.7 3.09 21 4.58 664 1.23 1.5 3.49 2.36 829 198 56 9.9 3.54 9.8 2.16 52 1.82 0.9 5.82 68 1.17 44 66 14 3 丰度值 (10-6) 1240 26 1.6 6.7 3090 21 458000 664 12300 150000 34900 236000 829 198 56 9900 35400 9.8 2160 52 1820 900 58200 68 1170 44 66 14 中国大陆 岩石圈元 素丰度B 1330 17.6 1.96 7.82 3110 15.3 453000 457 11400 156000 35700 229000 1010 148 40.7 9300 28800 11.6 3100 59.3 1720 1020 63300 51.3 1240 38.8 72.4 14.1 丰度系数(k) k1 A1/B 1.11 0.37 0.78 0.92 0.75 1.18 0.96 0.65 1.10 1.03 1.08 1.00 0.56 1.43 1.41 1.02 1.00 1.47 0.67 1.44 0.96 1.10 1.06 1.47 0.91 0.90 0.94 0.92 k2 A2/B 0.89 1.59 1.73 1.13 1.28 0.72 1.01 1.29 0.87 0.98 0.91 0.99 1.54 0.43 0.42 0.96 0.94 0.35 1.45 0.53 1.03 0.91 0.95 0.49 1.11 1.08 1.09 1.06 k3 A3/B 0.93 1.48 0.80 0.86 0.99 1.37 1.01 1.45 1.08 0.96 0.98 1.03 0.82 1.34 1.37 1.06 1.23 0.58 0.70 0.88 1.06 0.88 0.92 1.33 0.94 1.13 0.91 0.99 丰度系数(k)验算 k1 A1/B 1.11 0.38 0.41 0.92 0.75 1.18 0.96 0.65 1.10 1.03 1.08 1.00 0.56 1.43 1.43 1.02 1.00 1.47 0.67 1.43 0.96 1.10 1.06 1.46 0.91 0.90 0.94 0.92 k2 A2/B 0.89 1.59 1.73 1.13 1.28 0.72 1.01 1.29 0.87 0.98 0.92 0.99 1.54 0.43 0.42 0.96 0.94 0.34 1.45 0.52 1.03 0.91 0.95 0.49 1.11 1.08 1.09 1.06 k3 A3/B 0.93 1.48 0.82 0.86 0.99 1.37 1.01 1.45 1.08 0.96 0.98 1.03 0.82 1.34 1.38 1.06 1.23 0.84 0.70 0.88 1.06 0.88 0.92 1.33 0.94 1.13 0.91 0.99
元素周期表和丰度表
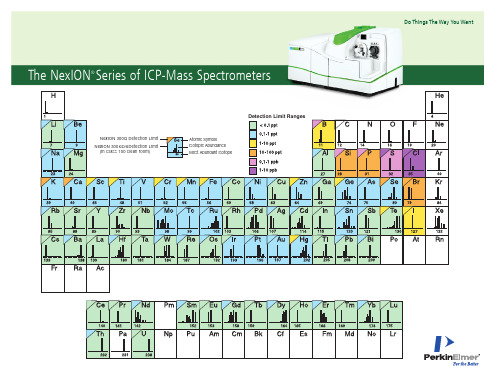
The NexioN Series of iCP-Mass Spectrometers
®
Detection Limit Ranges
NexION 300Q Detection Limit NexION 300XX/D/S Detection Limit XX X (in Class 100 ch U U U
100 100 0.0055 0.7200 99.2745
In In
4.3 95.7
Fe
5.8
Hf Hf Hf Hf Hf Hf
0.162 5.206 18.606 27.297 13.629 35.100
Lu Lu
97.41 2.59
Te
0.096
Ta
0.012
For a complete listing of our global offices, visit /ContactUs
Copyright ©2011, PerkinElmer, inc. All rights reserved. PerkinElmer® is a registered trademark of PerkinElmer, inc. All other trademarks are the property of their respective owners. 008906A_08
W
0.13
“Isotopic Compositions of the Elements 1989,” Pure Appl. Chem., Vol. 63, No. 7, pp. 991-1002, 1991. ©1991 IUPAC.
PerkinElmer, Inc. 940 Winter Street Waltham, MA 02451 USA P: (800) 762-4000 or (+1) 203-925-4602
对比各种地壳元素丰度变化规律

4.地壳化学元素分布规律和分析根据地壳的主要氧化物、稀有金属、成分特征及其百分含量可以总结出如下规律:1.奇偶规律:原子序数为偶数的元素其丰度大大高于相邻原子序数为奇数的丰度。
2..地壳贫铁镁,富铝钾钠。
3.递减规律:原子序数较低的的范围内,元素丰度随原子序数增大呈指数递减。
4.较轻易熔的铝硅酸盐在地壳表层富集,较重的镁铁向深部集中。
地壳15种稀有元素丰度表(10-6)根据上述数据可以总结出规律如下:1 原子系数为偶数的元素丰度大于相邻原子系数为奇数的元素,具有偶数质子数或中子数的核数丰度总是高于奇数质子数或中子数的核数。
2 在稀有元素中,Sm Eu Gd Tb Dy Ho Er Tm Yb Lu随着深度的增加丰度几乎不变,Ce的含量最高,Tm,Lu的含量最低,La Ce Pr Nd的丰度随着深度的增加逐渐减少。
3 稀土元素的分布是不均匀的,原子序数为偶数的元素一般比相邻的原子序数为奇数的元素含量高。
4 大陆地壳稀土元素总量高,相对富轻稀土;大洋地壳稀土元素含量较低,相对富重稀土。
下表给出了地壳元素丰度具体值地壳元素丰度表分析和总结:由上表可见,岩石圈中十余种常量元素占总量的绝大部分,如地壳中Si、O、Al、Fe、Na、K、Ca、Mg、Ti等九种元素占总量的百分之九十九以上,它们是岩石圈成分主体。
元素演化是以元素的赋存介质的变迁实现的。
在地幔对流驱动板块动移并发生岩石循环过程中,地幔物质分异出的岩浆及地壳物质重熔形成的岩浆通过上升,结晶形成岩浆岩,经构造运动隆升至地表或近地表,进入表生环境,遭受风化、剥蚀,搬运到湖、海盆地沈积成岩。
沉积岩再经沉降或俯冲到地壳深处,发生变质或部分重熔而形成新的岩浆,完成一个大旋回。
在大旋回演化过程中,同时还存不同级次的次级旋回。
如沉积岩直接进入风化搬运,变质岩也可不遭受重熔而上升至地表遭受风化、剥蚀等。
外生环境与内生环境的分界一般说来相当于潜水面,之下为还原环境,之上为氧化环境。
[精华]元素的宇宙丰度
![[精华]元素的宇宙丰度](https://img.taocdn.com/s3/m/3ccedaa164ce0508763231126edb6f1aff00719f.png)
元素的宇宙丰度序号元素丰度单位1 H 2.72E+10 atoms/10^6 atoms Si2 He 2.18E+09 atoms/10^6 atoms Si3 Li 59.7 atoms/10^6 atoms Si4 Be 0.78 atoms/10^6 atoms Si5 B 24 atoms/10^6 atoms Si6 C 1.21E+07 atoms/10^6 atoms Si7 N 2.48E+06 atoms/10^6 atoms Si8 O 2.01E+07 atoms/10^6 atoms Si9 F 843 atoms/10^6 atoms Si10 Ne 3.76E+06 atoms/10^6 atoms Si11 Na 5.70E+04 atoms/10^6 atoms Si12 Mg 1.08E+06 atoms/10^6 atoms Si13 Al 8.49E+04 atoms/10^6 atoms Si14 Si 1.00E+06 atoms/10^6 atoms Si15 P 1.04E+04 atoms/10^6 atoms Si16 S 5.15E+05 atoms/10^6 atoms Si17 Cl 5240 atoms/10^6 atoms Si18 Ar 1.04E+05 atoms/10^6 atoms Si19 K 3770 atoms/10^6 atoms Si20 Ca 6.11E+04 atoms/10^6 atoms Si21 Sc 33.8 atoms/10^6 atoms Si22 Ti 2400 atoms/10^6 atoms Si23 V 295 atoms/10^6 atoms Si24 Cr 1.34E+04 atoms/10^6 atoms Si25 Mn 9510 atoms/10^6 atoms Si26 Fe 9.00E+05 atoms/10^6 atoms Si27 Co 2250 atoms/10^6 atoms Si28 Ni 4.93E+04 atoms/10^6 atoms Si29 Cu 514 atoms/10^6 atoms Si30 Zn 1260 atoms/10^6 atoms Si31 Ga 37.8 atoms/10^6 atoms Si32 Ge 118 atoms/10^6 atoms Si33 As 6.79 atoms/10^6 atoms Si34 Se 62.1 atoms/10^6 atoms Si35 Br 11.8 atoms/10^6 atoms Si36 Kr 45.3 atoms/10^6 atoms Si37 Rb 7.09 atoms/10^6 atoms Si38 Sr 23.8 atoms/10^6 atoms Si41 Nb 0.71 atoms/10^6 atoms Si42 Mo 2.52 atoms/10^6 atoms Si44 Ru 1.86 atoms/10^6 atoms Si45 Rh 0.344 atoms/10^6 atoms Si46 Pd 1.39 atoms/10^6 atoms Si47 Ag 0.529 atoms/10^6 atoms Si48 Cd 1.69 atoms/10^6 atoms Si49 In 0.184 atoms/10^6 atoms Si50 Sn 3.82 atoms/10^6 atoms Si51 Sb 0.352 atoms/10^6 atoms Si52 Te 4.91 atoms/10^6 atoms Si53 I 0.9 atoms/10^6 atoms Si54 Xe 4.35 atoms/10^6 atoms Si55 Cs 0.372 atoms/10^6 atoms Si56 Ba 4.36 atoms/10^6 atoms Si57 La 0.448 atoms/10^6 atoms Si58 Ce 1.16 atoms/10^6 atoms Si59 Pr 0.174 atoms/10^6 atoms Si60 Nd 0.836 atoms/10^6 atoms Si62 Sm 0.261 atoms/10^6 atoms Si63 Eu 0.0972 atoms/10^6 atoms Si64 Gd 0.331 atoms/10^6 atoms Si65 Tb 0.0589 atoms/10^6 atoms Si66 Dy 0.389 atoms/10^6 atoms Si67 Ho 0.0875 atoms/10^6 atoms Si68 Er 0.253 atoms/10^6 atoms Si69 Tm 0.0386 atoms/10^6 atoms Si70 Yb 0.243 atoms/10^6 atoms Si71 Lu 0.0369 atoms/10^6 atoms Si72 Hf 0.176 atoms/10^6 atoms Si73 Ta 0.0226 atoms/10^6 atoms Si74 W 0.137 atoms/10^6 atoms Si75 Re 0.0507 atoms/10^6 atoms Si76 Os 0.717 atoms/10^6 atoms Si77 Ir 0.66 atoms/10^6 atoms Si78 Pt 1.37 atoms/10^6 atoms Si79 Au 0.186 atoms/10^6 atoms Si80 Hg 0.52 atoms/10^6 atoms Si83 Bi 0.144 atoms/10^6 atoms Si 90 Th 0.0335 atoms/10^6 atoms Si 92 U0.009atoms/10^6 atoms Si。
镧系稀土元素在地壳中的丰度及同位素

铍 铌 钽 锆 铪
Be Nb Ta Zr Hf
土元素在地壳中的丰度及同位素 在自然界中同位数 138La\139La 136Ce\138Ce\140Ce\142Ce 141Pr 142Nd\143Nd\144Nd\145Nd\146Nd\148Nd\150Nd 145Pm 144Sm\147Sm\148Sm\149Sm\150Sm\152Sm\154Sm 151Eu\153Eu 152Gd\154Gd\155Gd\156Gd\157Gd\158Gd\160Gd 159Tb 156Dy\158Dy\160Dy\161Dy\162Dy\163Dy\164Dy 156Ho 162Er\164Er\166Er\167Er\168Er\170Er 169Tm 168Yb\170Yb\171Yb\172Yb\173Yb\174Yb\176Yb 175Lu\176Lu 89Y
类型 轻稀土 轻稀土 轻稀土 轻稀土 中稀土 中稀土 中稀土 中稀土 中稀土 中稀土 重稀土 重稀土 重稀土 重稀土 重稀土
镧系稀土元素在地壳中的丰度及同位素 元素名称 元素符号 克拉克值(ppm) 能量系数 镧 La 39 0.43-4.01 铈 Ce 43 4.02-7.3 镨 Pr 5.7 4.04-7.33 钕 Nd 26 4.05 钷 Pm \ 4.06 钐 Sm 6.7 4.08 铕 Eu 1.2 1.78-4.09 钆 Gd 6.7 4.09 铽 Tb 1.1 4.11-7.43 镝 Dy 4.1 4.12 钬 Ho 1.4 4.13 铒 Er 2.7 4.14 铥 Tm 0.3 4.15 镱 Yb 2.7 1.82-4.16 镥 Lu 0.8 4.17 钇 Y 24 4.13
类型
元素名称 元素符号 克拉克值(ppm) 锕 Ac 钍 Th 镤 Pa 铀 U 镎 Np 钚 Pu 镅 Am 锔 Cm 锫 Bk 锎 Cf 锿 Es 镄 Fm 钔 Md 锘 No 铹 Lr来自锕系稀土元素资料 能量系数
第二章 化学元素的丰度与分布

第二章化学元素的丰度与分布2.1 元素丰度的概念和表示方法2.1.1丰度和丰度体系自然界一切物体,如宇宙天体、地质体、生物体等都是由化学元素组成的,一种化学元素在某个自然体中的重量占这个自然体的全部化学元素总重量(即自然体的总重量)的相对份额(如百分数),称为该元素在自然体中的丰度。
因此,元素丰度就是化学元素在一定自然体中的相对平均含量。
丰度通常是指元素在较大自然体中的平均含量,如元素的地壳丰度,元素的地球丰度,元素的太阳系丰度等。
如果这个自然体占据一个较小的空间位置时,习惯上称为元素的平均含量。
如花岗岩中元素的平均含量,某矿区中元素的平均含量等。
无论地球化学的研究领域和对象如何发生变化,研究自然体的化学组成,化学反应和化学演化始终是地球化学的基本任务。
其中化学组成又是首当其冲的。
因而自然体的元素丰度研究是地球化学领域极为重要的一个组成部分。
特别是地球化学发展的早期阶段,世界著名的地球化学家,如克拉克,华盛顿,维尔那茨基,费尔斯曼(A.E.Ферсман),以及戈尔德斯密特都曾致力于化学元素丰度的研究。
克拉克一生从事丰度研究达40余年,前后共发表了五版元素丰度的资料。
克拉克被公认为地球化学的最早奠基人之一。
由于条件所限,早期的元素丰度工作主要是指地壳元素丰度,确切地讲是大陆地壳丰度,而且局限在主要元素。
由于当时对地壳结构模型的认识还很模糊,地壳元素丰度的计算比较粗糙。
随着科学技术的发展,一方面从光谱技术探测太阳系和宇宙体的元素丰度,另一方面矿产资源勘测和地质科研实践,提高了对地球、地壳内部构造的认识,积累了大量有用的资料,使得元素丰度的工作向更大尺度和更小尺度两方面的延伸,通过众多地球化学家的共同努力,目前已建立起比较系统的丰度体系,如表2.1所示。
表2.1元素丰度体系**(据黎彤、倪守斌,1990,改编)在这一领域里值得一提的是我国学者黎彤。
他从60年代起,针对国外学者计算丰度中存在的问题,重新计算了地壳元素丰度。
溴天然丰度

溴天然丰度
溴是一种化学元素,其在自然界中的丰度非常稀少。
一般来说,溴在海水中的含量最高,而在陆地上则含量极低,通常只能在海洋生物或者些许的煤炭、盐湖等地方中找到。
溴的天然丰度通常用比例表示,即每10亿个原子中约有几个是溴元素。
全球海水中的溴丰度约为67.3ppb(亿分之67.3),而陆地上的平均溴丰度只有0.3ppb。
溴的天然丰度对于科学研究和工业应用都有着重要的作用。
在环境监测、海洋资源开发、石油开采等领域,需要对溴的丰度进行精准测量和分析,以制定合理的措施和决策。
此外,溴在各种化学反应中也有着广泛的应用,如制造消毒剂、染料、塑料等。
因此,研究溴的天然丰度及其变化规律对于促进科学技术发展和经济社会发展都有着积极的意义。
元素丰度与克拉克值
3 5
3 5
3 5
4 5 4 5
4 5 4 5 3
4 5 4 5
3 4 3 3 3 4 3
3 4 3 3 3 4 3
3 4 3 3 3 4 3
表3
原子 序数 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 元素 名称 锗 砷 硒 溴 氪 铷 锶 钇 锆 铌 钼 锝 钌 铑 钯 银 镉 铟 锡 锑 碲 碘 氙 铯 钡 镧 铈 镨 钕 钷 钐 元素 符号 Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm 华夏壳体A1 丰度值 n 系数 × 10 (10-6) 1.01 1.01 1.46 1.46 0.079 0.079 0.35 0.35 29 174 8.6 78 6.3 1.1 3.29 7.5 4.5 0.05 0.063 0.056 2.98 0.11 0.015 0.034 1 253 12 24 2.8 11 2.2 -3 -4 -3 29 174 8.6 78 6.3 1.1 0.00329 0.00075 0.0045 0.05 0.063 0.056 2.98 0.11 0.015 0.034 1 253 12 24 2.8 11 2.2
西域壳体A2 丰度值 n 系数 × 10 (10-6) 1.18 3 1180 28 3.4 8.8 3.99 11 4.57 591 0.99 1.53 3.27 2.26 1.56 63 17 8.89 2.72 3.9 4.48 31 1.78 0.93 6.01 25 1.38 42 79 15 28 3.4 8.8 3990 11 457000 591 9900 153000 32700 226000 1560 63 17 8890 27200 3.9 4480 31 1780 930 60100 25 1380 42 79 15
地壳及岩石元素丰度

Sc Se Si Sm Sn Sr Ta Tb Th Ti Tl Tm U V W Y Yb Zn Zr
钪 硒
5 0.05 190000 0.5 10 0.018 0.005 300 0.01 0.003 40 0.1
锶
钛 铊
钇 30 30 571571.8
锆
30 3 2.5 3 0.05 0.05 0.05 0.05 230000 291000 260000 323000 5.3 18 9 1.5 N 3 465 200 800 300 1.1 2.1 0.7 3.5 8 2.8 2.5 4 13 18 13800 3500 8000 2300 0.21 1.4 0.5 1.5 0.2 0.6 0.3 1 3 1.8 3.5 250 30 100 0 0.7 1.3 1 1.5 21 20 34 21 20 4 105 130 72 60 140 500 260 200 563044.4 538234.4 542173.2 516660.6
Ag Al As Au B Ba Be Bi Br Ca Cd Ce Cl Co Cr Cs Cu Er Eu F Fe Ga Gd Ge Hf Hg Ho I In K La Li Lu Mg Mn Mo N Na Nb Nd Ni P Pb Pd Pr Rb S Sb
主要岩浆岩元素平均含量PPM(根据涂和费1961、维1962) 中性岩 超基性岩 基性岩 酸性岩 正长岩 闪长岩 花岗岩 0.05 0.1 0.01 0.07 0.05 4500 87600 88000 88500 77000 0.5 2 1.4 2.4 1.5 0.005 0.004 0.00N ? 0.0045 1 6 9 15 15 1 300 1600 650 830 0.2 0.4 1 1.8 5.5 0.001 0.007 ? 0.01 0.01 0.5 3 2.7 4.5 1.7 7000 67200 18000 46500 15800 0.05 0.19 0.13 0.1 镉 4.5 161 100 50 50 520 100 240 200 45 1 10 5 2000 200 2 50 25 0.1 1 0.6 5 铯 20 100 5 35 20 2 7 4 0.01 1 2.8 1.5 100 370 1200 500 800 98500 85600 36700 58500 27000 1.5 18 30 20 20 镓 5 18 9 1 1.5 1 1.5 1.4 锗 0.1 1 11 1 1 0.01 0.09 0.0N 0.08 1 3.3 2 0.01 0.5 0.5 0.3 0.4 0.013 0.22 0.0N 0.26 铟 300 8300 48000 23000 33400 27 70 60 0.5 15 28 20 40 0.6 2.1 1 镥 259000 45000 5800 21800 5600 1500 2000 850 1200 600 0.2 1.4 0.6 0.9 1 6 18 20 32 20 5700 19400 40400 30000 27700 1 20 35 20 20 铌 20 65 46 2000 160 4 55 8 170 1400 800 1600 700 0.1 8 12 15 20 0.12 0.019 15 0.01 钯 4.6 12 2 3 110 100 200 100 300 300 200 400 0.1 0.2 0.N 0.2 0.26
元素同位素自然丰度

元素同位素自然丰度一、引言元素同位素自然丰度是指某种元素的不同同位素在自然界中出现的相对丰度。
同位素是指原子核中质子数相同、中子数不同的核,例如氢的同位素有氢-1、氢-2和氢-3等。
二、同位素的分类根据同位素的质量数(即核中质子数和中子数之和),可以将同位素分为稳定同位素和放射性同位素两类。
1. 稳定同位素稳定同位素是指其核非常稳定,不会自发地发生放射性衰变。
稳定同位素的自然丰度相对较高,常用来进行同位素标记和同位素分析。
例如,氢的稳定同位素有氢-1(质子数为1,中子数为0)、氢-2(质子数为1,中子数为1)和氢-3(质子数为1,中子数为2)。
2. 放射性同位素放射性同位素是指其核不稳定,会自发地发生放射性衰变,释放出粒子或电磁辐射。
放射性同位素的自然丰度相对较低,但由于其放射性特性,常被用于放射性标记和放射治疗等领域。
例如,碳的放射性同位素有碳-14(质子数为6,中子数为8)。
三、同位素的丰度测定同位素的丰度测定是通过质谱仪等仪器设备进行的。
质谱仪能够将样品中的同位素分离并进行定量测定。
1. 质谱仪的工作原理质谱仪主要由离子源、质量分析器和检测器三部分组成。
首先,离子源将样品中的分子或原子转化为带电离子。
然后,质量分析器根据离子的质量对其进行分离。
最后,检测器测量分离后的离子流,并根据离子的数量进行定量分析。
2. 同位素丰度的测定方法同位素丰度的测定方法主要包括质谱法、质量光谱法和同位素稀释法等。
质谱法是最常用的测定方法,它通过质谱仪对样品中的同位素进行分离和测定。
质量光谱法利用同位素的质量差异导致的谱线位移来测定同位素丰度。
同位素稀释法则是以已知同位素丰度的同位素标准物质对待测样品进行稀释,通过测定稀释后的同位素丰度来计算原始样品的同位素丰度。
四、同位素应用同位素在许多领域都有广泛的应用,包括地质学、地球化学、生物学、物理学、环境科学等。
1. 地质学同位素可以用来研究地球的演化过程和地质事件。
