常见物质的颜色
常见化学物质的颜色

常见化学物质的颜色
1.水:无色透明。
水分子是无色的,因此水看起来是无色透明的。
2. 氧气:无色。
氧气分子也是无色的,因此氧气是无色的。
3. 硫酸:无色。
硫酸分子也是无色的,因此硫酸是无色的。
4. 氮气:无色。
氮气分子也是无色的,因此氮气是无色的。
5. 二氧化碳:无色。
二氧化碳分子也是无色的,因此二氧化碳是无色的。
6. 氯气:黄绿色。
氯气分子的电子结构使其吸收蓝色和紫色光,因此它呈现黄绿色。
7. 溴水:橙红色。
溴水分子吸收蓝色光,反射红色和橙色光,因此呈现橙红色。
8. 碘酒:棕红色。
碘酒分子吸收蓝色光,反射红色和棕色光,因此呈现棕红色。
9. 亚硝酸铵:无色或白色。
亚硝酸铵分子无色,但在晶体中,它会散射光线,因此呈现白色。
10. 硝酸:无色或淡黄色。
硝酸分子无色,但在较高浓度下,它会吸收蓝色和紫色光,因此呈现淡黄色。
总之,化学物质的颜色是由其分子结构和电子能级所决定的。
不同的分子结构和能级会导致分子吸收或反射不同波长的光线,从而呈现出不同的颜色。
- 1 -。
初中常见化学物质的颜色

初中常见化学物质的颜色小苏打:白色。
碳酸钙:米白色。
金属钠:银色。
金属铝:灰白色。
氯化钙:白色。
铁粉:灰褐色。
硫酸铜:绿色。
硫酸钠:白色。
铁氰化钾:棕红色。
碳酸钠:白色。
碳酸铵:白色。
硝酸铵:白色。
硫酸钙:白色。
硝酸钙:无色。
硫酸亚铁:红色。
硝酸钠:无色。
硝酸铵:棕红色。
氢氧化钠:白色。
硫酸氢铵:白色。
三氯化硼:米色。
铝粉:银灰色。
氢氧化钙:白色。
硫酸锰:暗棕红色。
氨水:无色。
硝酸铜:蓝绿色。
硫代硫酸钠:无色。
氨基甲酸钠:白色。
氯化钾:白色。
氢氧化铝:白色。
氢氧化镁:白色。
氯化铝:灰白色。
碳酸钾:无色。
硫代亚硫酸钠:无色。
硝酸铁:棕红色。
乳酸钠:白色。
硝酸锌:棕红色。
碳酸铜:棕黑色。
亚铁酸钠:米白色。
碳酸铁:棕褐色。
碳酸锌:棕黑色。
氯化锌:白色。
碳酸氢钠:无色。
碳酸氢钾:无色。
磷酸铵:白色。
氰化钾:白色。
氯化铜:蓝绿色。
金属铜:正红色。
乙醇:无色。
银粉:白色。
氨水溶液:无色。
溴化钠:白色。
硅酸。
化学常见物质颜色

1.黄色:AgI 、Ag 3PO 4、P 4(黄磷)、溴水(黄→橙)、FeS 2、Al 2S 3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加浓硝酸。
淡黄色:S 、Na 2O 2、TNT 、PCl 5、AgBr 、浓HNO 3(混有NO 2)、浓HCl (混有Fe 3+)、(混有NO 2)。
灰黄色:Mg 3N 2棕黄色:FeCl 3溶液、碘水(深黄→褐)。
2.黑色:CuS 、Ag 2S 、Cu 2S 、HgS (黑色或红色)、FeS 、FeO 、Fe 3O 4、MnO 2、CuO 、Ag 2O 、I 2(紫黑色)、Si (灰黑色)、C 、Ag (粉末)、KMnO 4(固体)、石油。
3.绿色:Cu 2(OH)2CO 3、FeSO 4〃7H 2O (浅绿色)、F 2(淡黄绿色)、Cl 2(黄绿色)、氯水(淡黄绿色)。
4.红色:Cu 2O 、Cu 、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、Fe(SCN)2+、Br 2(深红棕)、红磷(暗红)、Br 2的CCl 4溶液(紫红)、苯酚被空气氧化(粉红)。
5.棕色:固体FeCl 3、固体CuCl 2、NO 2(红棕)、Fe 2O 3(红棕)。
6.紫色:KMnO 4溶液、I 2的CCl 4溶液。
7.灰色:As 、Sn 、Fe 3C 。
8.褐色:碘酒、2Fe 2O 3〃3H 2O 、Fe(OH)3(红褐)。
9.蓝色:CuSO 4〃5H 2O 、Cu(OH)2、淀粉遇碘、紫色石蕊试液加碱、Cu 2+的稀溶液。
10.白色:Fe(OH)2、Mg(OH)2、Al(OH)3、AgCl 、BaS04、CaCO 3、BaCO 3其中AgCl 、BaS04不溶于硝酸。
(1)有刺激性气味的气体:HCI、HBr、NH3、SO2、H2S、NO、NO2(2)无色无味的气体:H2、O2、N2、CO2、CO、CH4、C2H2(3)有颜色有刺激性气味的气体:C12、NO2(4)使品红褪色、加热后恢复的是SO2(5)使湿润的红色石蕊试纸变蓝的是NH3(6)使湿润的Pb(Ac)2试纸变黑的是H2S(7)在空气中燃烧呈蓝色的气体有:H2、H2S、CH4、CO(8)能与水反应的是C12、F2、NO2焰色反应钠元素的焰色反应呈黄色钾元素的焰色反应呈紫色。
常见物质的颜色和状态

1. 气体:F2—淡黄绿色、Cl2—黄绿色、NO2—红棕色
中学化学常见物质颜色
2. 纯液体:Br2—深红棕色
3. 溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、
MnO4-(紫色)、Fe(SCN)3(血红色)、氯水(黄绿色)、溴 水(橙色)、碘水(黄色或褐色) 4. 固体 黑色—C、MnOgI(黄色)、 I2(紫黑色)、KMnO4(紫黑色)、Fe2O3 (红棕色) Fe(OH)3(红褐色)、FeSO4·7H2O(绿色)、Cu(紫红色) Cu2O(红色或砖红色)、CuO(黑色)、Cu(OH)2(蓝色) CuSO4·5H2O(蓝色)。
中学化学常见物质俗称 一, 硫酸盐 1.胆矾、蓝矾: CuSO4·5H2O 2.明矾: KAl(SO4)2·12H2O 3.重晶石:BaSO4 二,矿石的主要成分 1. 磁铁矿石:Fe3O4 2. 赤铁矿石:Fe2O3 3. 褐铁矿石:2Fe2O3·3H2O 4. 菱铁矿石:FeCO3 5. 石英、水晶:SiO2 6. 刚玉(蓝宝石、红宝石):Al2O3 7. 黄铁矿、硫铁矿:FeS2 8. 大理石、石灰石、白垩土、 方解石:CaCO3 三,其他无机物 1. 生石灰:CaO 2. 石灰、熟石灰、 消石灰: Ca(OH)2 3. 水玻璃:Na2SiO3 的水溶液 4. 小苏打:NaHCO3 5. 苏打、纯碱:Na2CO3 6. 铁红:Fe2O3 7. 磁性氧化铁:Fe3O4
中学化学中常见物质颜色归纳

中学化学中常见物质颜色归纳一、无色物质纯净水,各种常见的稀酸、稀碱溶液,O2,还应特殊掌握SO3是无色固体等。
二、白色物质1、纯白色:MgO、CaO、P2O5、AgCl、NaOH固体、NaCl粉末等。
2、银白色:Li、Na、K、Rb、Mg、Al、 Hg、Te等。
3、光亮的银白色:纯铁、银镜。
4、苍白色:H2在Cl2中燃烧时的焰色。
5、白烟:氨气分别与氯化氢、溴化氢气体化合生成的微小的氯化铵晶体。
6、白雾:氯化氢、溴化氢气体遇到水蒸气。
7、耀眼的白光:Mg、Al在O2中燃烧时。
三、红色物质1、红色pH在0—3.1时甲基橙溶液;pH在10—14时酚酞溶液;pH在0—5时的石蕊溶液;Cu2O(氧化亚铜),氖气灯光。
2、浅红色:pH在8—10时酚酞溶液。
3、粉红色:氦气灯光。
小部分在空气中氧化后的苯酚。
4、深棕红色:液溴。
5、红棕色:NO2气体,红磷单质,Fe2O3粉末,溴水,Fe(OH)3及胶体。
6、紫红色:锂的焰色。
7、洋红色:Sr的焰色。
8、砖红色:Ca的焰色。
四、黑色物质1、黑色:Fe3O4、 FeO、 FeS、CuS、Cu2S 、Ag2S 、Ag2O、 Ag 的细小颗粒、CuO (氧化铜)、MnO2、活性炭等。
2、紫黑色:单质I2。
3、灰黑色:木炭。
五、灰色物质1、灰色:Se、As、单质及Fe3C等。
2、浅灰色:焦炭。
3、深灰色:石墨。
六、绿色物质1、绿色:Cu的焰色,CuCl2的浓溶液,碱式碳酸铜Cu2(OH)2CO3等。
2、浅绿色:FeSO4溶液等。
3、黄绿色:Cl2单质,Ba的焰色;氯水(淡黄绿色)。
七、紫色物质1、紫色:Rb的焰色,KMnO4溶液,pH在5—8时的石蕊溶液,苯酚溶液中滴加FeCl3溶液等。
2、浅紫色:K的焰色,(透过钴玻璃看)水合Fe3+等。
3、紫蓝色:氩气灯光。
八、黄色物质1、黄色:Na的焰色,Ag3PO4,AgI,FeS2、溴水(黄色→橙色)、pH在4.4—14时的甲基橙溶液、某些蛋白质遇浓硝酸等。
高中化学常见物质颜色

(一)、固体的颜色
1、红色固体:铜,氧化铁,Cu2O
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾,I2
5、淡黄色固体:硫磺,Na2O2、AgBr 、Ag3PO4、AgI、FeS2 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭),FeS,CuS
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
11、红棕色粉末:Fe2O3、红磷
12、白色沉淀:BaSO4、BaCO3、CaCO3、AgCl
13、蓝色沉淀:Cu(OH)2
14、蓝色晶体:CuSO4·5H2O
(二)、液体的颜色
15、无色液体:水,双氧水
16、蓝色溶液:Cu2+
17、浅绿色溶液:Fe2+
18、棕黄色溶液::Fe3+
19、紫红色溶液:MnO4-
20、血红色溶液:[Fe(SCN)]2+
21、橙色溶液:溴水
22、紫色溶液:石蕊溶液
(三)、气体的颜色
23、红棕色气体:Br2、二氧化氮
24、黄绿色气体:氯气、(F2为浅黄绿色)
25、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气。
初中化学常见物质的颜色

初中化学常见物质的颜色初中化学常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,胆矾(蓝矾、五水硫酸铜CuSO4.5H2O)5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液(三)、气体的颜色17、红棕色气体:二氧化氮19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体常见沉淀及颜色红褐色絮状沉淀----Fe(OH)3浅绿色沉淀-----Fe(OH)2蓝色絮状沉淀----Cu(OH)2白色沉淀--- CaCO3,BaCO3,AgCl,BaSO4,(其中BaSO4、AgCl是不溶HNO3的白色沉淀,CaCO3、BaCO3是溶于HNO3 的白色沉淀),Mg(OH)2.淡黄色沉淀(水溶液中)----S微溶于水------Ca(OH)2,CaSO4元素之最1.地壳(人体)中含量最多的非金属元素是氧(O)2.地壳中含量最多的金属元素是铝(Al)3.人体中含量最多的金属元素是钙(Ca)4.形成化合物最多的元素是碳(C)其它1.使带火星木条复燃的气体是O22.使澄清石灰水变浑浊的气体是CO2,但通入CO2后变浑浊的溶液不一定是澄清石灰水,也可以是Ba(OH)2溶液。
3.最简单的有机物是甲烷CH44.天然最硬的物质是金刚石(C)5.吸水后由白变蓝的是无水CuSO46.最常见的液态物质是H2O、相对分子质量最小的氧化物是H2O7.常用的食品干燥剂是生石灰CaO8.常用的食品脱氧剂是Fe粉9.与酸反应有CO2产生的物质是碳酸盐(或NaHCO3)10.与碱反应(研磨)有NH3产生的物质是铵盐(铵态氮肥)11.常温下唯一有氨味的铵态氮肥是NH4HCO3(碳铵)一些常用物质的相对分子质量H2O-18;CO2-44;CaCO3-100;HCl-36.5;H2SO4-98;NaOH-40;Ca(OH)2-74;一些物质的俗称NaOH-烧碱、火碱、苛性钠;Na2CO3-纯碱、苏打;NaHCO3-小苏打;Hg-水银;CO2-干冰;CaO-生石灰;Ca(OH)2-熟石灰、消石灰;CaCO3-石灰石、大理石;CH4-沼气、瓦斯、天然气;C2H5OH-酒精(一)、实验用到的气体要求是比较纯净,除去常见杂质具体方法:①除水蒸气可用:浓流酸、CaCl2固体、碱石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)、生石灰等②除CO2可用:澄清石灰水(可检验出杂质中有无CO2)、NaOH溶液、KOH溶液、碱石灰等③除HCl气体可用:AgNO3溶液(可检验出杂质中有无HCl)、石灰水、NaOH溶液、KOH溶液除气体杂质的原则:用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或者生成新的杂质。
化学中常见物质的颜色

化学中常见物质的颜色红色:Fe2O3 红棕色;Fe(OH)3 红褐色;[Fe(SCN)]2+ 红色(或血红色);Cu2O 红色(或砖红色) ;被氧化的苯酚(即苯醌) 粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH 8~10的溶液中呈浅红色;NO2 红棕色;红磷暗红色;Br2 深棕红色;品红溶液红色;Bi微红色;充氦气、氖气的灯管红色;CoCl2 ·6H2O红色;Cu 紫红色;*甲基橙在pH<3.3的溶液中显红色。
紫色:KMnO4—紫红色;[Fe(C6H5O)6]3— 紫色;I2紫黑色;I2蒸汽紫色;I2 的CCl4溶液紫红色;碘溶于苯或汽油呈紫色或紫红色;充氩气的灯管蓝紫色;石蕊在pH 5~8的溶液中呈紫色。
橙色:溴水橙色;溴溶于有机溶剂中橙色或橙红色;*甲基橙在pH 3.3~4.4 的溶液中呈橙色。
灰色:硒;Fe(OH)2 变成Fe(OH)3 的中间产物灰绿色。
棕色:CuCl2晶体棕黄色;FeCl3晶体棕红色。
黄色:S、AgI、Ag3PO4、Fe3+、不纯硝基苯黄色;Na2O2、三硝基甲苯、AgBr、F2、硝化甘油、NaNO2黄色;尿素白色或淡黄色;*甲基橙在pH>4.4的溶液中呈黄色。
蓝色:Cu2+、Cu(OH)2 、CuSO4·5H2O、Co2O3蓝色;石蕊在pH>8的溶液中呈蓝色;I2遇淀粉变蓝色;液态、固态的氧气淡蓝色;CoCl2 天蓝色。
黑色:木炭、焦炭、黑色火药、MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、Fe3O4黑色;Si 灰黑色;石油黑色或深棕色;煤焦油黑褐色。
绿色:Fe2+浅绿色;Cl2淡黄绿色;CuCl2浓溶液绿色(很浓黄绿色、稀则蓝色) ;碱式碳酸铜绿色。
金色:铯、金。
褐色:Ag2O褐色;溶解了溴的溴苯褐色;碘酒褐色。
常见物质的颜色
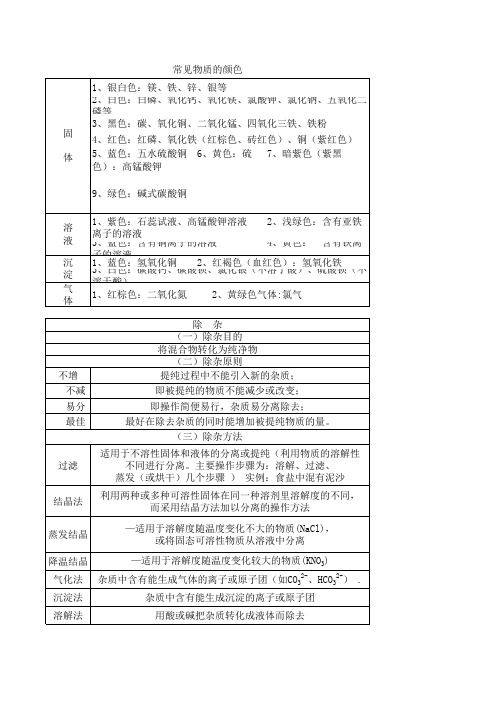
溶解法
用酸或碱把杂质转化成液体而除去
加热法 置换法 吸收法
通过加热(高温)将杂质转化或除去。
用活泼金属置换盐中的不活泼金属元素, 而达到除杂的目的.(置换反应)
常用来除去气体中的杂质. 选择适当 的试剂,与气体中的杂质反应即可达目的.
食品干燥剂 化学用干燥
常见的溶解于 水 常后见温的度溶会解明于 水 常后见温的度溶会解明于 水后温度几乎
常见物质的颜色
1、银白色:镁、铁、锌、银等 2、白色:白磷、氧化钙、氧化镁、氯酸钾、氯化钠、五氧化二 磷等 3、黑色:碳、氧化铜、二氧化锰、四氧化三铁、铁粉 固 4、红色:红磷、氧化铁(红棕色、砖红色)、铜(紫红色)
体 5、蓝色:五水硫酸铜 6、黄色:硫 7、暗紫色(紫黑 色):高锰酸钾
9、绿色:碱式碳酸铜
物质溶解于水后的温度变化 浓硫酸、氧化钙、固体氢氧化钠 硝酸钾固体、氯化铵固体、硝酸铵固体 氯化钠固氧化钙)、氯化钙、硅胶、植物纤维、 高岭土(又叫蒙脱石,是硅铝酸盐)
化学用干燥剂 浓硫酸、氧化钙、固体氢氧化钠、碱石灰
蒸发(或烘干)几个步骤 ) 实例:食盐中混有泥沙
利用两种或多种可溶性固体在同一种溶剂里溶解度的不同, 而采用结晶方法加以分离的操作方法
蒸发结晶
—适用于溶解度随温度变化不大的物质(NaCl), 或将固态可溶性物质从溶液中分离
降温结晶 气化法 沉淀法
—适用于溶解度随温度变化较大的物质(KNO3) 杂质中含有能生成气体的离子或原子团(如CO32-、HCO32-) .
过滤
结晶法
除杂 (一)除杂目的 将混合物转化为纯净物 (二)除杂原则 提纯过程中不能引入新的杂质;
即被提纯的物质不能减少或改变;
化学物质常见颜色总结

化学物质常见颜色总结1.红色:Fe(SCN)3(红色溶液); Cu2O(红色固体); Fe2O3(红棕色固体);红磷(暗红色固体); 液溴(深红棕色); Fe(OH)3(红褐色固体);Cu(紫红色固体); 溴蒸气、NO2(红棕色) 品红溶液(红色);在空气中久置的苯酚(粉红); 石蕊遇酸性溶液(红色); 酚酞遇碱性溶液(红色)。
2.紫色:石蕊在中性溶液中(紫色); Fe3+与苯酚反应产物(紫色); I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色); MnO4-(紫红色溶液) 固态O3(紫黑色钾的焰色反应(紫色) I2蒸气、I2在非极性溶剂中(紫色)3.橙色:溴水(橙色) K2Cr2O7溶液(橙色)4.黄色:AgI(黄色固体); AgBr(淡黄色固体); Ag3PO4(黄色固体); FeS2(黄色固体);Na2O2(淡黄色固体); S(黄色固体); Au(金属光泽黄色固体);I2的水溶液(黄色); 碘酒(黄褐色); 久置的KI溶液(黄色)(被氧化为I2);Na的焰色反应(黄色); TNT(淡黄色针状); 工业浓盐酸(黄色)(含有Fe3+);NaNO2(无色或浅黄色晶体); Fe3+的水溶液(黄色);硝基苯中溶有浓硝酸分解的NO2时(黄色)久置的浓硝酸(黄色)(溶有分解生成的NO2); 浓硝酸粘到皮肤上(天然蛋白质)(显黄色);5.绿色:Cu2(OH)2CO3(绿色固体); Fe2+的水溶液(浅绿色); FeSO4?7H2O(绿矾);K2MnO4(绿色); Cl2、氯水(黄绿色); F2(淡黄绿色);CuCl2的浓溶液(蓝绿色);6.棕色:FeCl3固体(棕黄色); CuCl2固体(棕色)7.蓝色:Cu(OH)2、CuSO4?5H2O、Cu2+在水溶液中(蓝色); 石蕊遇碱性溶液(蓝色);硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰); 一氧化碳在空气中燃烧(蓝色火焰);淀粉遇I2变蓝色; Co2O3(蓝色); O2(液态--淡蓝色);Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色);O3(气态--淡蓝色;液态--深蓝色;固态--紫黑色)。
初中化学-常见物质的颜色

初中化学-常见物质的颜色固体颜色红色固体,铜,氧化铁绿色固体,碱式碳酸铜蓝色固体,氢氧化铜,硫酸铜晶体暗紫色固体,高锰酸钾淡黄色固体,硫黄无色固体,冰,干冰,金刚石银白色固体,银,铁,镁,铝,汞等金属黑色固体,铁粉,木炭,氧化铜,二氧化锰,四氧化三铁(碳黑,活性炭)红褐色固体,氢氧化铁白色固体,氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁一,液体颜色无色液体,水,双氧水蓝色液体,硫酸铜溶液,氧化铜溶液,硝酸铁溶液黄色液体,硫酸铁溶液,氯化铁溶液,硝酸铁溶液浅绿色溶液硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液紫红色溶液,高锰酸钾溶液紫色溶液,石蕊溶液二,气体颜色红棕色气体,二氧化氮黄绿色气体,氯气无色气体,氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体三,化学溶液的酸碱性显酸性的溶液,酸溶液和某些盐溶液(硫酸氢钠,硫酸氢钾等)显碱性的溶液,碱溶液和某些盐溶液(碳酸钠,碳酸氢钠等)显中性的溶液,水和大多数盐溶液四,在空气中的质量变化的1,质量增加的由于吸水而增加的,氢氧化钠固体,氯化钙,氯化镁,浓硫酸跟水反应而增加的,氧化钙,氧化钡,氧化钾,氧化钠,硫酸铜由于跟二氧化碳反应而增加的,氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙2,质量减少的由于挥发而减少的,浓硫酸,浓硝酸,酒精,汽油,浓氨水由于风化而减少的,碳酸钠晶体五,气体检验氧气,带火星小木条放入瓶内,若小木条复燃,则是氧气(验满,放瓶口)氢气,点燃气体,罩干燥小烧杯,观察杯壁是否有水滴,往烧杯倒入澄清石灰水,如不变浑浊,则是氢气(变浑浊则是二氧化碳)二氧化碳,通入澄清石灰水,若变浑浊则是二氧化碳氨气,湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气水蒸气,通入无水硫酸图,若白色固体变蓝,则含水蒸汽四,离子检验氢离子,滴加紫色石蕊试液;加入锌粒五,氢氧根离子,酚酞试液;硫酸铜溶液六,碳酸根离子,稀盐酸和澄清石灰水七,氯离子,硝酸钡溶液和稀硝酸;先滴加稀盐酸再滴加氯化钡铵根离子,氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口铜离子,低价氢氧化钠溶液,若产生蓝色沉淀则是铜离子铁离子,滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子常见物质的颜色①黑色:CuO、Fe3O4、MnO2、炭粉、铁屑②白色:AgCl、BaSO4、CaCO3、BaCO3、无水CuSO4、NaOH固体、Mg(OH)2、KClO3、KCl等。
初三化学各物质颜色

初中化学常见物质的颜色
(一)、固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡黄色固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)、液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)、气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
二、初中化学溶液的酸碱性
1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)
2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)
3、显中性的溶液:水和大多数的盐溶液。
常见物质的颜色

常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
黑色固体:MnO2、CuO、Fe3O4、C粉、铁粉(Fe)活性炭蓝色固体:CuSO4·5H2O(胆矾)、Cu(OH)2(氢氧化铜)、CuCO3(碳酸铜)红色固体:Cu(紫红色)、Fe2O3(红棕色)、红磷:P(暗红色)、Fe(OH)3(红褐色)I2碘(紫红色)黄色固体:硫磺(单质S)绿色固体:碱式碳酸铜(铜绿)[Cu2(OH)2CO3]蓝色溶液:含Cu2+溶液:CuSO4(硫酸铜溶液)、CuCl2(氯化铜溶液)Cu(NO3)2(硝酸铜溶液)黄色溶液:含Fe3+的溶液(棕黄色):FeCl3(氯化铁溶液)、Fe2(SO4)3(硫酸铁溶液)Fe(NO3)3(硝酸铁溶液)浅绿色溶液:含Fe2+的溶液:FeCl2(氯化亚铁)FeSO4(硫酸亚铁)Fe(NO3)2(硝酸亚铁)其他溶液:石蕊试液(紫色)、高锰酸钾溶液(紫红色)无色气体:N2、CO2、CO、O2、H2、CH4有色气体:Cl2(黄绿色)、NO2(红棕色)有刺激性气味的气体:NH3(此气体可使湿润的红色石蕊试纸变蓝色)、SO2、HCl(氯化氢)有臭鸡蛋气味:H2S硫化氢气体的特征:①有刺激性气味的气体:HCl、SO2、NH3②有颜色的气体:Cl2(黄绿色)、NO2(红棕色)③无色无味的气体:O2、H2、N2、CO、CO2。
∙特征反应:∙推断题的解题步骤及突破口的选择:1.解题步骤(1)审题:认真审读原题,弄清文意和图意,理出题给条件,深挖细找.反复推敲。
(2)分析:抓住关键,找准解题的突破口,突破口也称为“题眼”,指的是关键词、特殊现象、物质的特征等等.然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果,(3)解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答。
(4)检验:得出结论后切勿忘记验证。
其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确。
常见物质的颜色

固 体
溶 液 沉 淀 气 体
ቤተ መጻሕፍቲ ባይዱ
常见物质的颜色大全

初中化学常有物质的颜色(一)、固体的颜色1 、红色固体:铜,氧化铁( 铁锈: Fe2O3· xH 2O )2、绿色固体:碱式碳酸铜Cu?(OH)?CO?3、蓝色固体:氢氧化铜,胆矾(蓝矾、五水硫酸铜CuSO4· 5H2O)5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,氧化亚铁(碳黑,活性炭),高锰酸钾(紫黑色)。
9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液(铜离子)13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液(亚铁离子)14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液(铁离子)15 、紫红色溶液:高锰酸钾溶液(高锰酸根离子紫红色,锰酸根离子深绿色钾离子无色)(三)、气体的颜色17、红棕色气体:二氧化氮19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大部分气体常有积淀及颜色红褐色絮状积淀 ----Fe(OH) 3浅绿色积淀-----Fe(OH) 2蓝色絮状积淀 ----Cu(OH) 2白色积淀 --- CaCO 3,BaCO3,AgCl,BaSO4 ,( 此中 BaSO4、AgCl是不溶 HNO3的白色积淀 ,CaCO3、BaCO3是溶于 HNO3的白色沉淀),Mg(OH) 2.淡黄色积淀 ( 水溶液中 )----S微溶于水 ------Ca(OH)2,CaSO4初中化学推测题常用“题眼”概括溶液颜色蓝色:CuSO4、Cu(NO3) 2等含 Cu2+的溶液浅绿色:FeCl2、 Fe(NO3) 2、FeSO2等含 Fe2+的溶液黄色:FeCl3、Fe(NO3) 3、 Fe2 (SO 4) 3等含 Fe3+溶液紫红色: KMnO4溶液火焰颜色淡蓝色: H2、 S(空气中)蓝色:CO、 CH4蓝紫色:S(氧气中)常有气体无色无味:O2、N2、H2、CO、CO2、CH4有刺激性气味:SO2、NH3、HCl常有固体黄色:硫磺( S)暗紫色:高锰酸钾( KMnO4)、碘( I 2)绿色:Cu2 (OH) 2 CO3(铜绿)蓝色积淀:Cu(OH)2红褐色积淀:Fe(OH) 3红色:Cu、赤铁矿、铁锈主要成分 (Fe 2 O3) 、红磷 (P)黑色:Fe3 O4、CuO、MnO2、C粉、 Fe 粉白色积淀(可溶于酸):CaCO3、BaCO3、Mg(OH)2白色积淀(不溶于酸):BaSO4、AgCl元素之最:1.地壳(人体)中含量最多的非金属元素是氧(O)2.地壳中含量最多的金属元素是铝(Al )3.人体中含量最多的金属元素是钙(Ca)4.形成化合物最多的元素是碳(C)其它1.使带火星木条复燃的气体是O22.使澄清石灰水变污浊的气体是CO2,但通入 CO2后变污浊的溶液不必定是澄清石灰水,也能够是Ba(OH)2溶液。
常见物质的颜色的状态

常见物质的颜色的状态
1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)
2、KClO
3、KCl、Na2CO3、N aCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)
2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色
3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色
4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般无色。
(高锰酸钾溶液为紫红色)
5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸) AgCl、BaSO4(也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2 红褐色↓:Fe(OH) 3白色↓:其余碱。
6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)
(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)
▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见物质的颜色、气味
固体:
红色:红磷P、铜Cu、氧化铁Fe2O3;红褐色:氢氧化铁Fe(OH)3;黄色:金Au、硫S
绿色:碱式碳酸铜Cu2(OH)2CO3;紫黑色:高锰酸钾晶体KMnO4;淡蓝色:固态氧O2
蓝色:氢氧化铜Cu(OH)2、硫酸铜晶体CuSO4·5H2O;深灰色:石墨C;灰白色:大多数磷肥
银白色:大多数金属(铁Fe、银Ag、铝Al、锌Zn、镁Mg……)
黑色:木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、
无色:金刚石C、干冰CO2、冰H2O
白色:除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的。
有刺激性气味的固体:碳酸氢铵NH4HCO3
液体:
淡蓝色:液态氧O2;蓝色:含有Cu2+的溶液;浅绿色:含有Fe2+的溶液;黄色:含有Fe3+的溶液;
银白色:汞Hg;我们学过的大多数液体都是无色的。
有特殊气味的液体:乙醇C2H5OH;有刺激性气味的液体:醋酸CH3COOH
气体:
●红棕色气体:二氧化氮NO2
●有毒的气体:一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等
●有刺激性气味的气体:氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等
●我们学过的大多数气体都是无色无味的。
●计入空气污染指数的项目:二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物和臭氧O3等
●能产生温室效应的气体:二氧化碳O2、臭氧O3、甲烷CH4、氟氯代烷等
多功能瓶
下面是多功能瓶的常见用途:
一、洗气瓶(图①)
多功能瓶作为洗气瓶来使用时,气体要从长导管进入,从短导管中出去。
洗气瓶一般用来检验气体(如二氧化碳)、干燥气体(如混有水蒸气的气体)、吸收气体(如二氧化硫)或除去气体中的杂质(如HCl气体等)
●检验气体:检验二氧化碳的试剂是澄清的石灰水。
●干燥气体:试剂一般是浓硫酸。
需要注意的是,浓硫酸不能干燥NH3等碱性气体。
●吸收气体或除去气体中的杂质:
①对于SO2、CO2等气体,可以使用NaOH溶液吸收(最好不用Ca(OH)2溶液,因为Ca(OH)2微溶于水)
②对于混在CO2中的HCl气体,不可以使用NaOH溶液吸收,但可以使用NaHCO3溶液来吸收。
③Cl2可以用NaOH溶液吸收。
二、向上排空气取气瓶(图②)
使用条件:收集的气体的密度大于空气密度(组成气体的分子的相对分子质量大于29),并且气体不与空气中的成分反应。
规则:长管进,短管出。
常见实例:O2、CO2、Cl2、NO2
利用多功能瓶收集有毒或者有污染气体,可以方便地进行尾气处理,以免气体逸出污染空气。
如Cl2可以用②装置收集,再用①装置进行尾气处理。
三、向下排空气取气瓶
使用条件:收集的气体的密度小于空气密度(组成气体的分子的相对分子质量小于29),并且气体不与空气中的成分反应。
规则:短管进,长管出。
常见实例:H2、NH3
四、排水集气瓶
使用条件:①气体不溶或难溶于水;②气体不与水反应;(③对于部分气体来说,密度与空气密度接近,无法用排空气法收集。
)
规则:短管进,长管出。
常见实例:O2、H2、NO
五、排水量气瓶
使用条件:同“四”
规则:短管进,长管出。
如果忽略导管内的水,量筒内水的体积就是进入集气瓶中气体的体积。
除杂
●除杂的原则:①主要成分的质量不能减少(可以增多);②除杂时不能引进新的杂质。
●除去CuO中的C:在氧气流中灼烧(C+O2CO2)。
●除去CO中的CO2:使混合气体通过澄清的石灰水或氢氧化钠溶液
(Ca(OH)2+CO2=CaCO3↓+H2O和2NaOH+CO2=Na2CO3+H2O)。
●除去CO2中的CO:使混合气体通过灼热的氧化铜(CO+CuO Cu+CO2)。
●除去CaO中的CaCO3:高温煅烧(CaCO3CaO+CO2↑)
【注意】不能加稀盐酸,因为CaO能与稀盐酸中的水反应生成Ca(OH)2。
●除去大理石中的杂质:
①高温煅烧大理石或石灰石(CaCO3CaO+CO2↑);
②将反应后的固体放入足量的水中,使其充分溶解,过滤(CaO+H2O=Ca(OH)2);
③通入过量的二氧化碳(Ca(OH)2+CO2=CaCO3↓+H2O);
④过滤。
【注意】如果杂质很难用一般方法除去,可以将主要成分从混合物中分离出来,然后通过反应再变回来。
●除去Cu中少量的Fe:
物理方法——用磁铁反复吸引。
化学方法——滴加稀盐酸或稀硫酸,然后过滤。
【注意】不能加硫酸铜溶液,否则容易导致除杂不彻底。
●除去FeSO4溶液中的CuSO4:①加入铁粉(铁丝);②过滤。
●除去可溶物中的不溶物:①溶解;②过滤;③蒸发结晶。
●除去不溶物中的可溶物:①溶解;②过滤。
●将两种可溶物分离:见“溶液”单元的冷却热饱和溶液法和蒸发溶剂结晶法。
●在溶液中,杂质有盐的时候,可以考虑把盐变成水、气体沉淀。
鉴定
●氧气的鉴定方法:把一根带火星的木条伸入集气瓶中,如果带火星的木条复燃,证明是氧气。
●氢气:点燃,气体会发出淡蓝色火焰。
如果气体较纯,气体将会安静地燃烧,并发出“噗”声;如果气体不纯,
会发出尖锐爆鸣声。
●二氧化碳:把气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,就证明收集的气体是CO2。
●三大可燃性气体的鉴定:点燃,通过无水硫酸铜CuSO4,再通过澄清的石灰水(顺序不能颠倒!)
H2:生成物能使无水硫酸铜变蓝,但不能使澄清石灰水变浑浊。
CO:生成物不能使无水硫酸铜变蓝,但能使澄清的石灰水变浑浊。
CH4:生成物既能使无水硫酸铜变蓝,又能使澄清石灰水变浑浊。
【注意】不可以根据气体燃烧时的火焰颜色来鉴别气体。
●水的鉴定:如果液体能使无水硫酸铜变蓝,说明液体中含有水。
●碳酸根的鉴定:加盐酸,然后将产生的气体通入澄清石灰水。
如果澄清的石灰水变浑浊,说明有碳酸根离子。
●鉴定CaO是否含CaCO3也加盐酸。
●鉴定Cl-:先加入AgNO3溶液,再加入稀硝酸。
如果有沉淀生成,说明含有Cl-。
●鉴定SO42-:先加入Ba(NO3)2溶液,再加入稀硝酸。
如果有沉淀生成,说明含有SO42-。
●鉴定CO32-:加入稀盐酸,将产生的气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,说明含有CO32-。
●鉴定HCO3-:同上。
●鉴定Cu2+:加入NaOH溶液,如果有蓝色沉淀,说明含有Cu2+。
●鉴定Fe3+:加入NaOH溶液,如果有红褐色沉淀,说明含有Fe3+。
●鉴定H+:
①借助石蕊或pH试纸。
如果石蕊变红或用pH试纸测出的pH值小于7,说明含有H+。
②加入碳酸盐(如CaCO3),将产生的气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,说明含有H+。
③加入活泼金属,如果金属表面产生气泡,并且产生一种可燃性气体(点燃之后安静燃烧,发出淡蓝色火
焰。
如果气体不纯,会发出尖锐的爆鸣声),说明含有H+。
④加入Fe2O3(铁锈),如果铁锈逐渐溶解消失,溶液由无色变成黄色,说明含有H+。
⑤加入弱碱,如果弱碱逐渐溶解消失(如果加入Fe(OH)2、Fe(OH)3、Cu(OH)2,溶液的颜色还会发生变化),
说明含有H+。
●鉴定OH-:
①借助石蕊、酚酞或pH试纸。
如果石蕊变蓝、酚酞变红或用pH试纸测出的pH值大于7,说明含有OH-。
②加入CuSO4,如果出现蓝色沉淀,说明含有OH-。
③加入Fe2(SO4)3,如果出现红褐色沉淀,说明含有OH-。
④可以参考“碱的通性”中的第四条,使溶液中有气体或沉淀生成。
●鉴定水:通过白色的硫酸铜,如果硫酸铜变蓝,说明有水(CuSO4 + 5H2O = CuSO4·5H2O)
如果要鉴定多种物质,必须把鉴定水放在第一步。
如果除水,必须放在最后一步。
●鉴定二氧化碳:通入澄清的石灰水中,如果澄清的石灰水变浑浊,说明气体是CO2。
●鉴定一氧化碳:通过灼热的氧化铜,如果黑色粉末逐渐变成红色,并且产生的气体能使澄清的石灰水变浑浊,
说明气体是CO。
●鉴定NH4+:以氯化铵(NH4Cl)为例,
方法一NH4Cl + NaOH = NaCl + NH3↑+ H2O;
方法二把NH4Cl和Ca(OH)2混在一起研磨。
如果闻到刺激性的氨味,或者能使红色的石蕊试纸变蓝,说明是铵态氮肥。
●蛋白质的鉴定:点燃,如果有烧焦羽毛的气味,就说明有蛋白质。
●鉴别聚乙烯塑料和聚氯烯塑料(聚氯烯塑料袋有毒,不能装食品):
点燃后闻气味,有刺激性气味的为聚氯烯塑料。
●鉴别羊毛线和合成纤维线:
物理方法:用力拉,易断的为羊毛线,不易断的为合成纤维线;
化学方法:点燃,产生焦羽毛气味,不易结球的为羊毛线;无气味,易结球的为合成纤维线。
区分与鉴定的区别在于,鉴定是要确定一种物质,而区分只需把物质分辨开。
区分的要求是无论用什么试剂,采取什么方法,现象必须明显。
