物理化学讲义课件04章
《物理化学第4版》第四章4-4 理想液态混合物和理想稀溶液组分的化学势ppt课件

17
由相平衡条件,得 μΒ (l) = μΒ ( g) ①
设蒸气为理想气体
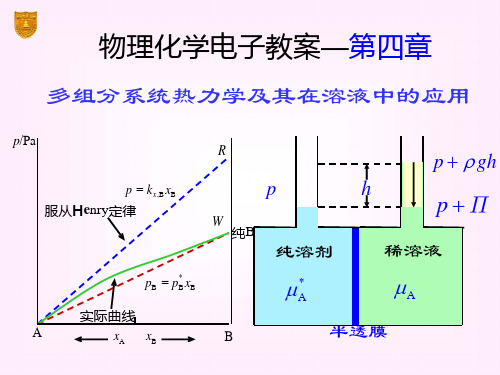
μΒ( g) = μΒ( g ,T) + RTln(pB /p ) ② 理想稀溶液,溶质 B 遵守亨利定律 pB = kx,B xB ( xB0 严格成立) ③
② ③代入①,得
18
B(l) B(g,T) RT ln(kx,B / p) RT ln xB
(2)无混合热效应,即
mixH = 0 ;
(3)混合过程为熵增大的过程,
即 mixS =-RnBlnxB> 0 ;
(4)混合过程可自发进行,是吉布斯函数减少的
过程,即 mixG =RTnBlnxB < 0。
14
三、理想稀溶液中组分的化学势
理想稀溶液的定义:溶剂 A 遵守拉乌 尔定律,溶质 B 遵守亨利定律的稀薄 溶液称为理想稀溶液。
分的分子间作用力相同,可表示为:
fAA=fBB=fAB (2)理想液态混合物中各组分的分
子体积大小几乎相同,可表示为:
VA=VB
6
2 、用拉乌尔定律定义理想液态混合物:
任一组分B在全部组成范围内 (xB=0xB=1)都严格遵守拉乌尔定律, 即pB=pB*xB的混合物称为理想液态混合 物。
7
3、 任一组分B的化学势:
当p p 时, 忽略积分项
B* (l,T , p) B(l,T , p) B(l,T )
所以
B
(l)
B
(l,T
)
RT
ln
xB
11
写为
B
(l)
B
(l)
RT
ln
xB
(0< xB<1)
《物理化学第4版》第四章4-3 拉乌尔定律和亨利定律ppt课件

亨利定律只适用于平衡系统; 对于公式中的 k[%],B 冶金系统广泛应用, 我们称之为百分之一亨利系数。但是,冶 金行业仍称之为亨利系数。
13
三、 拉乌尔定律和亨利定律的应用 1、应用拉乌尔定律测定溶剂的相对蒸 气压下降 2、利用亨利定律求难溶气体的溶解度
3、计算挥发性溶质在平衡气相的组成
14
1、文字叙述:定温下,稀溶液中溶剂的蒸 气压pA等于纯溶剂的蒸气压pA*乘以溶液中 溶剂的摩尔分数xA。 2、数学表达式:
pA pA* xA
2
(1)式中的各量均指平衡状态下的性 质; (2)适用于稀溶液中的溶剂,xA1时 严格适用;一般而言,溶液愈稀愈接近 实际(分压)。
3
(3)对于双组分系统, xA =1 -xB, 则 pA= pA* xA= pA*(1-xB)
1、文字叙述:一定温度 下,微溶气体B在溶液中 的平衡组成xB与该气体在 气相中的平衡分压pB成正 比。即亨利定律。
pB g xB l
7
2、数学表达式:
pB=kx,BxB
式中, xB是挥发性溶质(即所溶解的气 体B) 在溶液中的摩尔分数. pB是平衡时液面上该气体的分压. kx,B 溶质组成用摩尔分数表示时的 亨利系数. 是一个常数,其数值与T、p 及溶剂、溶质的性质有关.
§4-3 拉乌尔定律和亨利定律
研究溶液中组分的热力学, 如化学 势,采用的基本方法仍然是研究与液相 组分呈平衡的气体的化学势. 因此,必须 知道液相组成与平衡气相分压有何关 系?这一关系由两个经验定律来描述.
1
一、拉乌尔定律
(法国化学家F.M.Raoult)
在溶剂中加入非挥发性溶质后,溶剂的 蒸气压降低, 1887年发表了定量关系.
bB (40
南京大学物理化学(第五版)04章_多组分系统热力学
(
Gm p
)T
Vm
对多组分系统,把 Gm 换为 B ,则摩尔体积变为偏
摩尔体积 VB 。
化学势与温度的关系
(
B
T
)
p
,nB
,
nc
[ T
G ( ) ] T , p,nc p,nB ,nc nB
[ nB
G ( T ) p,nB ,nc ]T , p,nc
(S) [ nB ]T , p,nc
nk 0
dnk
k
n1Z1 n2 Z2 nk Zk nBZB B=1
偏摩尔量的加和公式
k
Z= nB ZB
B=1
这就是偏摩尔量的加和公式,说明系统的总 的容量性质等于各组分偏摩尔量的加和。
例如:系统只有两个组分,其物质的量和偏 摩尔体积分别为 n1,V1 和 n2 ,V2 ,则系统的总体积为:
(1)热力学能
设系统中有 1, 2,3, , k 个组分
所含的量分别为 n1, n2, , nk
U U (S,V , n1, n2, , nk )
化学势的定义
U U (S,V , n1, n2, , nk )
其全微分为
dU
U ( S )V ,nB dS
(
U V
)
S
,nB
dV
k U B1 ( nB )S ,V ,nc(cB) dnB
如果转移是在平衡条件下进行,则
dG 0 又
dnB dnB
所以 (B B )dnB 0
化学势在相平衡中的应用
(B B )dnB 0
因为 dnB 0 所以
B B
组分B在α,β两相中,达平衡的条件是该
物理化学电子教案.ppt

上一内容 下一内容 回主目录
返回
2020/11/18
4.1 化学反应的方向和限度
(1) 化学反应的限度 理论上,所有化学反应都是既可以正向进行,也 可以逆向进行,但根据反应限度的不同,实际反应可 以分为单向反应和对峙反应两类。
单向反应:如果一个化学反应的逆向反应的进行 程度很小,可以忽略不计,这种反应通常称为单向反 应。
H2 (g) I2 (g) 2HI(g)
C2H5OH(l) CH 3COOH (l) CH 3COOC 2H5 (l) H2O(l)
上一内容 下一内容 回主目录
返回
2020/11/18
(1) 化学反应的限度
注意:单向反应和对峙反应并不是一成不变的。 当反应条件改变时,单向反应和对峙反应有可能相互 转变。例如
G* GA* GB* nAGm* ,A nBGm* ,B
nA A*
nB
* B
(1 )A*
B*
A*
(
* B
A*
)
由于 A* 和 B* 均为常数,因此 G* vs. 应为一条
直线,如下图中的虚线所示。
上一内容 下一内容 回主目录
返回
2020/11/18
(2) 反应系统的吉布斯自由能
eq
对峙反应:如果一个化学反应的正向反应和逆向 反应都有一定的进行程度,不能忽略,这种反应通常 称为对峙反应。
上一内容 下一内容 回主目录
返回
2020/11/18
(1) 化学反应的限度
单向反应的实例:燃烧反应
常温下:H2
(g)
1 2
O2
(g)
H
2O(l)
对峙反应的实例
N2 (g) 3H2 (g) 2NH 3(g)
物理化学04章_溶液.

Z = ( )T , p ,nc ( c B) B=1 nB
上一内容 下一内容 回主目录
返回
2018/11/11
偏摩尔量的集合公式
按偏摩尔量定义,
Z ZB ( )T , p ,nc ( c B) nB
则
dZ Z1dn1 Z 2 dn2 Z k dnk = Z B dnB
写成一般式有: U n U B B
B
U UB ( )T , p ,nc ( c B) nB H HB ( )T , p ,nc ( c B) nB A AB ( )T , p ,nc ( c B) nB S SB ( )T , p , nc ( c B) nB G GB ( )T , p ,nc ( c B) nB
上一内容
下一内容
回主目录
返回
2018/11/11
4.2
溶液组成的表示法
3.物质的量浓度cB(molarity)
cB
def
nB V
溶质B的物质的量与溶液体积V的比值称为溶 质B的物质的量浓度,或称为溶质B的浓度,单位 是 mol m 3 ,但常用单位是 mol dm 3 。
上一内容
Z n1 Z1 n2 Z2 nk Zk
对Z进行微分 dZ n1dZ1 Z1dn1 nk dZk Zk dnk
1
在等温、等压下某均相体系任一容量性质的全微分为:
dZ Z1dn1 Z2 dn2 Zk dnk
上一内容 下一内容 回主目录
2
返回
2018/11/11
Gibbs-Duhem公式
(1)(2)两式相比,得:
n1dZ1 n2 dZ 2 nk dZ k 0 即
物理化学第四章课件

§4.3
1.纯理想气体的化学势
气体组分的化学势
纯理想气体:μ =GB =Gm (g) B ▲标准状态下的化学势: ▲任意压力下的化学势:μ
*
T
2.理想气体混合物中任一组分的化学势
3.纯真实气体的化学势
▲标准态规定:该温度及标准压பைடு நூலகம்下的假想的纯态理想气体 ▲纯真实气体的化学势:可设计下面途径
结论:在恒温恒压下,当混合物的组成发生微小 变化时,若一组分的偏摩尔量增大,则另一组分 的偏摩尔量必然减小,且增大与减小的比例与混 合物中两组分的摩尔分数(或物质的量)成反比。
6、偏摩尔量之间的函数关系 热力学函数之间存在有一定的函数关系 :
H =U+pV, A =U-TS, G =U+pV-TS=H-TS=A+pV 将这些公式 对混合物中 任一组分B 取偏导数, 各偏摩尔量 之间也有着 同样的关系
★化学势判据 (恒温恒压) ★气体的化学势 ●理想气体
B
B
dnB
<0 自发过程 =0 平衡状态 >0 非自发过程
总结2
纯
混合物 纯
●真实气体 混合物 ★拉乌尔定律 适用条件:理想液态混合物 或理想稀溶液中的溶剂 pA(溶剂)~ xA ★亨利定律 适用条件:稀溶液中的挥发性溶质 pB(溶质)~ xB
dG dG dG
dn B dnB B B
B B
dn B B
B
<0 自发过程 =0 平衡状态
恒温恒压下非体积功等于零的条件下: dG
★
dn B B
B
<0 自发过程 =0 平衡状态 >0 非自发过程
第四章 外源化学物在体内的生物转运

四.分布
毛细血管的构造和血-器官屏障:
1. 血-脑屏障机制(blood-brain barrier,BBB):① 脑组 织中的毛细血管内皮细胞间相互连接很紧密,几无间隙; ② 毛细管周围被星形胶质细胞突紧密包绕;③脑间质液 中蛋白质浓度很低;④脑毛细血管内皮细胞含有ATP-依 赖性转运蛋白。 2. 胎盘屏障(placental barrier): ①母体与胚胎的组织成分存在差别; ②胎盘自身的结构。 3. 其他屏障:血-眼屏障,血-睾屏障等。
精品课件
二.生物膜与生物转运
因主动转运、易化扩散和膜动转运是外源化学物借助载体或 特殊转运系统而发生的跨膜运动,又被特殊转运(special transport)。 对于某些非脂溶性的、分子量较大的、不能通过被动转运方 式转运的环境化学物质。
特 主动转运
殊 转
易化扩散
运 膜动转运
精品课件
二.生物膜与生物转运
精品课件
一.食品中外源化学物的来源
三、污染物——生物学污染物和化学污染物 食品可从多方面受污染—空气、水、土壤及其他的植
物。土壤和水中的天然有毒无机物被植物、禽畜和水生动物吸 收、积累,有的达到可引起人中毒的水平。受污染的饲料喂禽 畜后,可使其肉、蛋、奶含有污染物,这些都属于间接污染。 生长中的农作物或收获后贮放的农产品受微生物侵袭,在适宜 条件下可产生致病内毒素或外毒素。现代农业生产中广泛使用 的农药、生长刺激素等饲料添加剂和抗生素均会使食品含有残 留。食品贮存和包装用的容器和包装材料中含有的化学物质能 迁移到食物上。食品生产工艺过程污染物,运输、住宅、家庭 生活、娱乐活动、教育、医疗以及科研使用的有害化学物质都 有可能直接或间接污染食品,产生健康危害。
精品课件
04第四章+伟晶岩矿床

§3 矿床形成条件
一、温度、压力(深度)
伟晶岩形成的温度范围变化很大,根据伟晶岩矿床的包裹体测温资料统计,绝大多数伟晶岩矿床形成的温度范围在700℃~150℃之间。边缘带的细晶岩形成于700℃~600℃,伟晶岩的主体部分形成于500℃~150℃,晶洞中的矿物形成于150℃±,,稀有元素矿物主要形成于500℃~200℃。在伟晶岩形成的整个过程中,从边缘到中心,矿物的形成温度是逐渐降低的。
在伟晶岩形成的整个过程,结晶首先从边缘开始,早期形成(边缘带),矿物颗粒细小,他形结构;随后形成(外侧带),矿物颗粒增大,以文象结构、自形-半自形结构为主。随着温度降低,矿物不断的晶出,矿物粒度愈来愈大,残余熔浆挥发分不断增多,到晚期形成则以交代结构最为特征。稀有元素化合物由于具较低浓度,因而不可能在早期阶段晶出,往往被挤向伟晶岩体的中部或顶部,在晚期阶段富集起来。
此外地质构造环境对伟晶岩的形态、分异程度。矿化富集程度都有一定影响。在相对稳定的构造环境中形成的伟晶岩形态简单,分带性较好,矿化也较富集,在不稳定构造环境中形成的伟晶岩,一般形态复杂,分带性差,很少富集稀有元素。
五、围岩条件
伟晶岩矿床往往产于区域变质作用比较复杂的地区,所以伟晶岩矿床的围岩往往是各种变质岩(片岩、片麻岩、混合岩)和花岗质岩石等。围岩的物理性质对伟晶岩矿床的形成和分布有一定影响,一般认为块状岩石,没有遭受片理化的岩石最有利于伟晶岩的形成,因这种围岩具有形成不同形状裂隙的性能,有利于形成透镜状,纺缍状的垂直的伟晶岩,如混合岩、花岗岩、石灰岩等。而在片理化后的岩石中则易于形成板状伟晶岩体。而大家已知道前透镜状、柱状形态的伟晶岩有利于稀有元素的富集,而板状伟晶岩体不利于这些成矿元素的富集。
② 交代结构:交代形成的矿物由白云母、钠长石及稀有元素矿物组成,为后期热液交代作用的产物。
物理化学第四章PPT

B K (C RT / P )
二、平衡常数的各种表示法 (2)用摩尔分数表示的平衡常数 K y
PB PyB K
( PyB / P )
B
B
B B (P / P ) yB
B
令 K y yB
B
B
K
B K y (P / P )
' g ' h (P / P ) ( P / P ) G H JP ' ( PA / P )a ( PB' / P )b
r Gm RT ln J P RT ln K
范特霍夫等温方程
一、 理想气体反应的标准平衡常数
r Gm
JP RT ln K
K Jp
$ p
r Gm 0 r Gm 0
CaCO3 (s) CaO(s) CO2 ( g )
三、有纯态凝聚相参加的理想气体反应的 K
r Gm B B 0
B
r Gm CO2 CaO CaCO3 0
B B RT ln( PB / P )
RT ln( P / P )
反应向右自发进行 反应向左自发进行 反应达平衡
K$ p Jp
K Jp
$ p
r Gm 0
一、 理想气体反应的标准平衡常数
例题 有理想气体反应 2H2(g)+O2(g)=2H2O(g),在2000K 时,已知 K=1.55×107。
(1)计算H2和O2分压各为1.00 ×104 Pa,水蒸气分压为1.00 ×105 Pa的混合气中,计算上述反应的△rGm,并判断反应自发 进行的方向; (2)当H2和O2的分压仍然分别为1.00 ×104 Pa时,欲使反应不 能正向自发进行,水蒸气的分压最少需要多大?
《物理化学第4版》第四章4-1 多组分系统组成表示法ppt课件

1. 混合物及溶液的分类
多组分系统
非均相(多相) 均相(单相)
混合物 溶液
1
(i) 对混合物中的各组分不区分为溶 剂及溶质,对各组分均选用同样 的标准态;
(ii) 对溶液中的各组分区分为溶剂 及溶质,并选用不同的标准态加 以研究。
2
按聚集状态不同,
气态混合物如空气;
混合物液态混合物如苯和甲苯;
固态混合物如粘土和沙石。 液态溶液如Mn Fe液态合金;
溶液 固态溶液(固溶体黄铜 青铜等);
3
液态溶液— 简称溶液电非解电质解溶质液溶如 液食 (盐 分水 子溶 溶液液; 如高分子溶液)
非电解质溶液:蔗糖水溶液; 氧O2溶于水; 乙醇水溶液 H2O(l)—— C6H5NH3(l)溶液;
金属溶液: Fe(l)—— Mn(l)溶液; Cu(l)——Zn(l)溶液。
MA
bB
MA
17
def cB nB /V
SI单位:moldm-3
8
五、溶质B的质量摩尔浓度 溶质B的物质的量与溶剂的质量之比。
bB 或mB def nB / mA
用于液态或固态溶液的溶质,也可 以用下式定义:
bB 或mB def nB /(nAM A )
SI 单位:molkg-1 9
由于溶质B的质量摩尔浓度与温度无 关,在热力学处理中比较方便。在电 化学中也主要采用该浓度表示电解质 的浓度。
12
x1 = n1 / (n1 + n2 )= 0.321 mol / (0.321 mol+0.652 mol) = 0.329 b1= n1 /m2 = 0.321 mol / 30.0 10-3 kg = 10.7 molkg-1 w1 = m1 / ( m1+ m2 ) = 25.0 g / (25.0+30.0) g = 0.455
物理化学ppt-PowerPointPresentation

四. 标准平衡常数
标准平衡常数
K
r Gm exp RT
五. 标准摩尔反应吉布斯函数
由标准摩尔生成吉布斯计算标准摩尔吉布斯函 数
r G T B f Gm , B T B
由相关反应的标准摩尔吉布斯函数计算某反应 的标准摩尔吉布斯函数
一. 偏摩尔量和化学势
偏摩尔量 :
X XB dnB n B T , P ,nC , nB
化学势:偏摩尔吉布斯函数
G B n B T , P ,nC , nB
二. 化学反应方向和平衡条件
摩尔反应吉布斯函数:
热力学第一定律对相变过程的应用
化学反应热效应
一. 热力学第一定律
⊿U=Q-W
若系统发生无限小变化时,上式可写成dU=δQ-
δW
它表明系统种发生任何变化过程,系统内能变化 值等于系统吸收的热量减去它对外作的功。
二. 可逆过程与可逆体积功
1. 可逆过程 在膨胀的每一个瞬间,系统内部以及系统与环境 之间都极接近于平衡态,整个过程由一系列无限 接近于平衡的状态构成,这样的过程称为可逆过 程。 2. 可逆体积功
O点是三条线的焦点,称为三相点。在该 点,Φ=3,F=0,说明三相点的温度,压 力均不能任意改变。水的三相点与水的冰 点并不是一回事。三相点实验个的单组分 系统,而通常所说的冰点是暴露在空气中 的冰-水两相平衡系统。
第六章 电化学
电解质溶液的导电机理
摩尔电导率 离子独立运动定律 可逆电池
物理化学讲义_图文_百度文库

实验一燃烧热的测定一、实验目的1. 通过萘的燃烧热测定,了解氧弹量热计各主要部件的作用,掌握燃烧热的测定技术;2. 掌握恒压燃烧热与恒容燃烧热的区别与联系;3. 学会应用图解法校正温度改变值。
二、实验原理燃烧热是指1摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(Qv),其值等于这个过程的内能变化(ΔU)。
在恒压条件下测得的燃烧热称为恒压燃烧热(Qp),它等于这个过程的焓变(ΔH)。
若把参与反应的气体作为理想气体处理,则存在下列关系式:Qp=Qv+∆n⋅RT (1-1)式中,Δn为产物中气体的摩尔数之和与反应物中气体的摩尔数之和的差值;R为气体常数;T为反应的绝对温度。
若测得某物质恒压燃烧热或恒容燃烧热中的任何一个,就可根据式(1-1)计算另外一个。
化学反应的热效应通常是用恒压热效应来表示的,而且习惯上用ΔH表示。
测量化学反应热效应的仪器称为量热计。
本实验采用XRY-1A型数显氧弹式热量计测量萘的燃烧热。
由于氧弹量热计测定物质的燃烧热是在恒容条件下进行的,故为恒容燃烧热。
其原理是将一定量待测物样品在氧弹中完全燃烧时放出的热量使量热计(包括周围介质)的温度升高,通过测定燃烧前、后量热计温度的变化值,就可以计算出样品的燃烧热。
其关系式如下:C∆T=-(mQv+Q点火丝ρ点火丝l点火丝) (1-2)式中,m为标准物质的质量(g);Qv为1g标准物质恒容燃烧放出的热(J·g-1); Q 点火丝= -1.02×10-3kJ·g-1;l点火丝为点火丝的长度(cm);ρ点火丝为单位长度点火丝的质量(g·cm-1),其值为4.00×10-4 g·cm-1;ΔT为样品燃烧前后量热计温度的变化值(K) (需用校正法校正);C为量热计的热容,即量热计每升高1K所需要吸收的热量(J·K-1)。
本实验的标准物质为苯甲酸,它的恒容燃烧热为Qv = -26.43×103 J·g-1。
物理化学04多组分系统热力学

dG=dG( ) +dG()
当恒温恒压,W’=0 时
β相
dG() ()dn()
dG( ) ( )dn( )
dn( ) dn()
dX
X T
p,nB ,nc ,nD
X
dT
p
T ,nB ,nc ,nD
X
dp
nB
T , p,nc ,nD
dnB
X
X
nC
T , p,nB p,nB ,nc
dnD
2021/1/6
偏摩尔量XB的定义为: X B def
X ( nB )T , p,nc
2021/1/6
解:取1kg溶液
nH2O
mH2O M H2O
(1 0.12)1 18.015 103
mol
48.85mol
nAgNO3
mAgNO3 M AgNO3
0.12 1 169.89 103
mol
0.7064mol
xAgNO3
nAgNO3
n n AgNO3
H2O
0.01425
cAgNO3
2021/1/6
由题意:
VA 17.35cm3 / mol
VB 39.01cm3 / mol
由集合公式,混合后:
V nAVA nBVB {0.617.35 0.4 39.01}cm3 26.01cm3
混合前:
VA '
nAM A A
10.84cm3
VB'
nB M B B
16.19cm3
dA SdT pdV BdnB
dA
B
BdnB 0
自发 =平衡
B
(dT 0,dV 0, W ' 0)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
f* C1
若除温度、压力外,还要考虑其他因素(如磁 场、电场、重力场等)的影响,则相律可表示为
f Cn
§4.4 单组分系统的相平衡
单组分系统的两相平衡——Clapeyron方程
外压与蒸气压的关系—— 不活泼气体对液体蒸气压的影响
水的相图 *硫的相图
此处加标题
物理化学课件04章
眼镜小生制作
453
单相
B
等压 等温 p
TB
T/K
pB
373
A'
An
A"
T1
两相
313 D
C
0 0 .2 0 .4 0 .6
H 2 O 质量分数
E 0 .8 1 .0 A
C6H5NH2
pA
xB
B
第四章 相平衡
§4.1 §4.2 §4.3 §4.4 §4.5
§4.6
引言 多相系统平衡的一般条件 相律 单组分系统的相平衡 二组分系统的相图及其应用
相律
对于化学平衡条件,必须是独立的 例如系统中有如下反应:
(1 ) C O H 2 O C O 2 H 2 (2) CO12O2 CO2
1 (3) H22O2 H2O
这三个反应中只有两个是独立的,所以 R=2。
相律
又如,在真空容器中发生如下反应:
2 N H 3 ( g ) N 2 ( g ) 3 H 2 ( g )
个相,需要多少强度变量才能确定系统的状态?
表示每一个相的组成需要的浓度变量为 S 1
表示所有各相组成需要的浓度变量为 Φ(S 1)
加上温度和压力两个变量,则变量总数为
Φ(S1)2
根据化学势相等导出联系浓度变量的方程式数为
S(Φ 1)
相律
根据自由度的定义
f (S 1 ) 2 S ( 1 )
三组分系统的相图及其应用
§4.1 引 言
相平衡是热力学在化学领域中的重要应用之一
研究多相系统的平衡在化学、化工的科研和生产 中有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。
相图(phase diagram) 研究多相系统的状态如何随温度、压力和组成 等强度性质变化而变化,并用图形来表示,这种图 形称为相图。
含了如下四个平衡:
(1) 热平衡 (2) 力学平衡 (3) 相平衡 (4) 化学平衡
(1) 热平衡条件
设系统有, 两个相构成,在系统的组成、
总体积和热力学能均不变的条件下,若有微量热
自 相流入 相,系统总熵变化为
SSS
当系统达平衡时
dSdSdS dS 0 dSdS0
Q
T
Q
T
0
T T
当系统达平衡时,两相的温度相等。
(3) 相平衡条件
设多组分系统中只有 和 两相,并处于平
衡状态。在定温、定压下,
有 d n B 的物质B从 相转移到了 相
根据偏摩尔量加和公式
d G d G B d G B B d n B B d n B
因为 dnB dnB
d G B d n B B d n B (B B ) d n B
同理,可以推广到多相平衡系统。
(2) 压力平衡条件 设系统的总体积为V,在系统的温度、体积 及组成均不变的条件下,
设 相膨胀了 d V 相收缩了 d V
当系统达平衡时 dAdA dA 0
d A p d V p d V 0
dV dV
p p
当系统达平衡时,两相的压力相等。
同理,可以推广到多相平衡系统。
f S2
这是相律的一种表示形式
(1)若化学反应中有R个独立的化学平衡。
(2)系统的强度性质还要满足R′附加条件,例 如浓度限制条件。
相律
则相律表示式为
f(SRR')2
令: C=SRR'
相律为: f C2
C 称为独立组分数 它的数值等于系统中所有物种数 S 减去系统中 独立的化学平衡数 R,再减去各物种间的强度因数 的限制条件R'。
如果已指定某个强度变量,除该变量以外的其 他强度变量数称为条件自由度,用 f * 表示。
例如:指定了压力 指定了压力和温度
f * f 1 f ** f 2
§4.2 多相系统平衡的一般条件
在一个封闭的多相系统中,相与相之间可以有 热的交换、功的传递和物质的交流。
对具有 个相系统的热力学平衡,实际上包
平衡时 dG 0
B B
同理,可以推广到多相平衡系统。
(4) 化学平衡条件 在达到化学平衡时,反应物的化学势等于生
成物的化学势,化学势的代数和可表示为
BB 0
B
对于含 个相的多相平衡系统,这几个平
衡可表示为
T T
p p
B
B
T
p
B
§4.3 相 律
某平衡系统中有 S 种不同的化学物种,有
系统中相的总数称为相数,用 表示。
气体,不论有多少种气体混合,只有一个气相。
液体,按其互溶程度可以组成单相、两相或三 相共存。
固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。
引言
自由度(degree of freedom)
确定平衡系统的状态所必须的独立强度变量的 数目称为自由度,用字母 f 表示。这些强度变量通 常是压力、温度和浓度等。
因为有一个独立的化学反应,所以 R=1 因为两种气体的量保持一定的比例
所以
N 2(g):H 2(g)1:3 R ' 1 , C S R R ' 1
相律
对于浓度限制条件R′,必须是在同一相中几个 物质浓度之间存在的关系,能有一个方程把它们的 化学势联系起来。例如:
C a C O 3 ( s ) C a O ( s ) C O 2 ( g ) CSRR' 3102 因为 CaO(s), CO2(g) 不在同一相中。
超临界状态
单组分系统的相平衡
单组分系统的相数与自由度
C=1
f + = 3
当 = 1 单相 当 = 2 两相平衡
f 2 双变量系统 f 1 单变量系统
当 = 3 三相共存
f 0 无变量系统
单组分系统的自由度最多为2,双变量系统 的相图可用平面图表示。
单组分系统的相平衡
相点 表示某个相状态(如相态、组成、温度等)的 点称为相点。
引言
相律(phase rule)
研究多相平衡系统中,相数、独立组分数与描 述该平衡系统的变数之间的关系。它只能作定性的 描述,而不能给出具体的数值。
相(phase) 系统内部化学组成、物理和化学性质完全均 匀的部分称为相。
相与相之间在指定条件下有明显的界面,在 界面上宏观性质的改变是飞跃式的。
引言
