准静态过程一个过程
准静态过程 功 热量 内能 热力学第一定律 等体过程 等压过程 摩尔热容等温过程和绝热过程

V2 V
Qp
E2
E1
W
等压膨胀过程:气体吸收的热 量,一部分用于内能的增加, 一部分用于对外作功。
p
等 压
p
( p,V2 ,T2 )
2
( p,V1,T1)
1
压
W
缩
o V2
V1 V
Qp
E1
W
E2
等压压缩过程:外界对气体作 的功和内能的减少均转化为热 量放出。
等压过程中,W 与 △E始终同号
Q
m' M
解 1)等温过程
W12 '
RT ln V2 ' V1
2.80104 J
2)氢气为双原子气体
(i 2) i 1.40
T2
T1
(V1 V2
)
1
753K
p
p2
2 T2
p2' T2' T1
Q0
p1
2'
T1
T 常量 1
o V2 V2' V1 10 V1 V
怎么求?
由热力学第一定律
dQT dWT pdV
Q T
WT
p RT
V2 V1
pdV
V
p
p1
1 ( p1,V1,T )
p2
( p2 ,V2 ,T )
2
o V1 dV V2 V
恒
温
谁做功?
热
源
T
QT
WT
V2
V1
RT V
dV
RT
ln V2 V1
RT ln p1
“工程热力学及传热学”教学中关于准静态过程和可逆过程的几点思考-最新作文

“工程热力学及传热学”教学中关于准静态过程和可逆过程的几点思考-最新作文“工程热力学及传热学”教学中关于准静态过程和可逆过程的几点思考Reflections on T eaching Reform about the Course of EngineeringThermodynamics and Heat TransferWU Hequan, LIU Zhihong(College of Automotive and Mechanical Engineering,Changsha University of Science and Technology, Changsha,Hu'nan 410114)Abstract This paper analyzes the relationship and difference between the quasi-static process and reversible process in the course of engineering thermodynamics and heat transfer. It has enhanced the understanding of these concepts,in order to deal with the issues related to thermodynamics better.0 引言“工程热力学与传热学”是汽车服务工程、热能与动力工程等专业的必修课程。
它是研究热能与机械能相互转换及热量传递规律的一门学科。
作为工科类的一门专业基础课,对机械工程专业也有重大意义。
准静态过程和可逆过程是工程热力学中的基本概念,弄清这两个概念在本学科的学习中显得尤为重要。
1 准静态过程1.1 平衡状态在不受外界影响的条件下(重力场除外),如果系统的状态参数不随时间变化,则该系统处于平衡状态。
平衡的本质即无不平衡势,包含以下几个方面:(1)无温差,即无热不平衡势;(2)无压差,即无力不平衡势;(3)无相变,即无相不平衡势;(4)无化学反应,即无化学不平衡势。
准静态热力学过程

准静态热力学过程热力学过程是指物质由一个状态变为另一个状态的过程,而准静态热力学过程是指在此过程中物质的每一个中间状态都可以近似看作平衡态。
这种过程可以用于研究热力学系统的性质与特性,为我们理解物质的热力学行为提供了重要的参考依据。
1. 热力学基本概念回顾在讨论准静态热力学过程之前,我们先回顾一下一些热力学的基本概念:系统、状态、过程、平衡等。
•系统:指将研究对象从周围环境中分离出来研究的部分,可以是封闭系统、开放系统或孤立系统。
•状态:指系统所具有的一组确定的宏观性质的集合,如压力、温度、体积等。
•过程:指系统从一个状态变为另一个状态的演化过程。
•平衡:指热力学系统的某个状态与周围环境没有任何差别,即系统处于静止状态。
2. 准静态过程与非准静态过程的区别在热力学中,准静态过程是指系统的每个中间状态都可以近似看作平衡态的过程。
而非准静态过程则是指系统的中间状态不能近似看作平衡态的过程。
准静态过程与非准静态过程的主要区别在于过程中的热力学状态变化的速度。
在准静态过程中,系统的变化速度非常缓慢,使得系统在每一个中间状态都有足够的时间达到平衡。
而在非准静态过程中,系统的变化速度较快,使得系统无法达到平衡态。
准静态过程的特点包括:•系统内部各点温度、压力等宏观性质基本相等;•系统与外界之间处于无限接近平衡的状态,能够实现最大的功输出。
非准静态过程的特点包括:•系统内部各点温度、压力等宏观性质存在差异;•系统与外界之间存在较大的非平衡状态,能够实现的功输出较小。
对于实际系统,准静态过程是一个理想化的过程,因为真实系统难以达到无限接近平衡的状态,但准静态过程的概念仍然对热力学的研究有重要的指导意义。
3. 热力学第一定律与准静态过程热力学第一定律是能量守恒定律在热力学中的体现。
对于一个封闭系统,在准静态过程中,热力学第一定律可以写作:ΔU=Q−W其中,ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
准静态过程

等温过程 等容过程
等压过程
循环过程
V
二 功(过程量) 宏观运动能量
热运动能量
功是能量传递和转换的量度,它引起系统热运动 状态的变化 . 准静态过程功的计算
dW Fdl pSdl
dW pdV
W V2 pdV V1
注意:作功与过程有关 .
三 热 量(过程量)
通过传热方式传递能量的量度,系统和外界之间
准静态过程 功 热量
一 准静态过程(理想化的过程)
准静态过程:从一个平衡态到另一平衡态所经 过的每一中间状态均可近似当作平衡态的过程 .
砂子 活塞 气体
p
p1 1 ( p1,V1,T1)
p2
பைடு நூலகம்
2 ( p2 ,V2 ,T2 )
o V1 V2 V
准静态过程 Quasi-static process
只有把这种理想而简单的情况搞清楚,才有助 于我们对实际问题 的探讨。下面我们主要研究平衡 态和准静态过程。
程,则: 从 T1
T2 是准静态过程 Quasi-static process
系统T1
如果系统 温度 T1 直接与 热源 T2 接触,最终达到热平衡,则 不是 准静态过程。
T1+△T T1+2△T T1+3△T
P T2
因为状态图中任何一点都表示 系统的一个平衡态,故准静态 过程可以用系统的状态图,如 P-V图(或P-T图,V-T图)中 一条曲线表示,反之亦如此。 o
存在温差而发生的能量传递 .
功与热量的异同 1)过程量:与过程有关;
T1 T2
T1 Q T2
2)等效性:改变系统热运动状态作用相同;
1卡 = 4.18 J , 1 J = 0.24 卡
准静态实验测定材料力学性能的关键步骤

准静态实验测定材料力学性能的关键步骤材料力学性能是材料科学中非常重要的一个研究方向,它涉及到材料的强度、刚度、塑性变形等多个方面。
对于工程应用而言,知晓材料的力学性能是必不可少的。
而准静态实验,则是一种常用的测定材料力学性能的方法之一。
本文将重点讨论准静态实验的关键步骤,并探讨它在材料研究中的意义。
首先,进行准静态实验的第一步是试样的准备。
试样的准备直接影响到实验结果的准确性和可重复性。
试样的形状、尺寸以及制备方法都需要严格控制。
通常情况下,试样的形状可以根据不同实验要求进行选择,常见的有圆柱形、方形等。
试样尺寸的选择要能够代表材料的整体性能,同时要保证在实验过程中不会出现失效。
此外,试样的表面质量也需要注意,应保持光洁度,以避免表面缺陷对实验结果的影响。
接下来是实验装置的搭建。
准静态实验通常需要使用一台拉伸机,该机器具备固定试样并施加加载的功能。
在搭建实验装置时,需要确保试样牢固地固定,以避免在加载过程中产生误差。
另外,实验过程中的加载方式也需要注意。
如果材料的力学性能是各向同性的,通常采用均匀加载。
如果材料具有各向异性,加载时需要根据实际需要进行选择,以保证实验结果的准确性。
在实验过程中,保持准静态状态是非常重要的。
准静态状态是指在加载过程中,试样的变形速度远小于材料的变形速度。
这意味着在实验中需要控制加载速度,使其尽可能慢,以保证试样的变形过程可以近似为静态状态。
这样可以避免动态加载带来的影响,得到更准确的实验结果。
当然,在实际操作中,为了节约时间,慢速加载可能并不可行。
此时,可以通过分析试样的应力-应变曲线,找出一个代表静态响应的阈值,保证在该阈值下进行实验。
最后,准静态实验的结果分析是非常关键的。
通过实验获取的力学性能数据需要经过合理的处理和解读。
在分析数据时,可以利用材料力学模型进行拟合,并计算出各项力学参数。
同时,还应结合理论知识和其他实验结果进行讨论和比较,以验证实验结果的准确性。
准静态过程一个过程

a
d
Q1
b
W
c
V2
o
Q2
V1
V
Q2 Q1 W 或 Q1 Q2 W
从低温热源吸收的热量
外界对工质 所作的净功
致冷系数:
Q2 Q2 e W Q1 Q2
三、卡诺循环
1824 年卡诺(法国工程师 1796-1832 )提出了一 个能体现热机循环基本特征的理想循环。后人称 之为卡诺循环。
正循环过程对应热机,
逆循环过程 对应致冷机。
正循环的特征: P Q 1 一定质量的工质在一次循环 a b 过程中要从高温热源吸热Q1, W 对外作净功W,又向低温热 c d 源放出热量 Q2 。而工质回到 Q2 o V 初态,内能不变。。 V2 V 1
W Q1 Q2 0
净功为循环过程曲线所包围的面积。
Cp
(dQ ) p ,mol dT (dQ ) p ,mol dT
(dQ ) p dE PdV
dE dV P dT dT
C p
对1mol的气体, dE C v dT, PdV RdT
Cp (dQ) p, mol dT i R R Cv R 2
不是全微分
(功,热均为在过程中传递的能 E
或
v
v2
1
Pdv
dQ dE Pdv
Q>0,系统吸收热量;Q<0,系统放出热量;W>0,系统
对外作正功;W<0,系统对外作负功;E>0,系统内能
增加,E<0,系统内能减少。
适用范围:
与过程是否准静态无关。即准静态过程和 非静态过程均适用。但为便于实际计算,要求 初终态为平衡态。
热力学第一定律
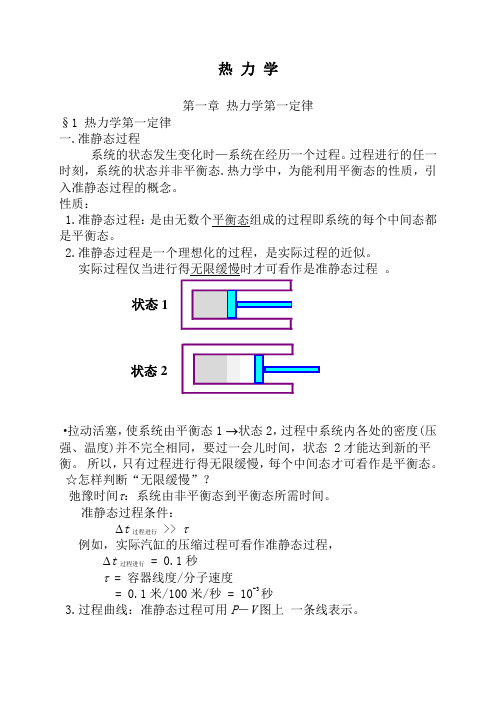
热 力 学第一章 热力学第一定律§1 热力学第一定律 一.准静态过程系统的状态发生变化时—系统在经历一个过程。
过程进行的任一时刻,系统的状态并非平衡态.热力学中,为能利用平衡态的性质,引入准静态过程的概念。
性质:1.准静态过程:是由无数个平衡态组成的过程即系统的每个中间态都是平衡态。
2.准静态过程是一个理想化的过程,是实际过程的近似。
实际过程仅当进行得无限缓慢时才可看作是准静态过程 。
·拉动活塞,使系统由平衡态1 →状态2,过程中系统内各处的密度(压强、温度)并不完全相同,要过一会儿时间,状态 2才能达到新的平衡。
所以,只有过程进行得无限缓慢,每个中间态才可看作是平衡态。
☆怎样判断“无限缓慢”?弛豫时间τ:系统由非平衡态到平衡态所需时间。
准静态过程条件: ∆t 过程进行 >> τ例如,实际汽缸的压缩过程可看作准静态过程, ∆t 过程进行 = 0.1秒τ = 容器线度/分子速度= 0.1米/100米/秒 = 10-3秒3.过程曲线:准静态过程可用P -V 图上 一条线表示。
状态1状态2二.功、内能、热量1.功 ·通过作功可以改变系统的状态。
·机械功(摩擦功、体积功)2.内能·内能包含系统内:(1)分子热运动的能量;(2)分子间势能和分子内的势能;(3)分子内部、原子内部运动的能量; (4)电场能、磁场能等。
·内能是状态的函数*对于一定质量的某种气体,内能一般是T 、V 或P 的函数; *对于理想气体,内能只是温度的函数 E = E (T )*对于刚性理想气体分子, i :自由度; ν :摩尔数 ·通过作功改变系统内能的实质是:分子的有规则运动能量和分子的无规则运动能量的转化和传递。
3.热量·传热也可改变系统的状态,其条件是系统和外界的温度不同。
·传热的微观本质:是分子的无规则运动能量从高温物体向低温物体传递。
new热力学第一定律
A dA PdV
I v1
说明
A= pdV
V1
V2
P
•系统所作的功与系统的始末状态有关, 而且还与路径有关,是一个过程量。
•气体膨胀时,系统对外界作功 气体压缩时,外界对系统作功 系统对外界所作的 •作功是改变系统内能的一种方法 •本质:通过宏观位移来完成的:机械运动→ 功等于pV 图上过 分子热运动 程曲线下面的面积
V2 M i Q R(T2 T1 ) pdV V1 2 理想气体的压强保持不变,p=const
•过程方程:
•内能、功和热量的变化
A
V2
V1 V2 T1 T2
pdV p(V
2
V 1)
•特征:
系统吸收的热量一部分 用来增加系统的内能, 另一部分使系统对外界 作功。
V1
Q p U 2 U1 p(V2 V1 )
为从平衡态破坏到新平 衡态建立所需的时间称 为弛豫时间。
3、准静态过程
如果一个热力学系统过程在始末两平衡态之间所经历的之 中间状态,可以近似当作平衡态,则此过程为准静态过 程。 •准静态过程只有在进行的“无限缓慢”的条件下才可 能实现。 •对于实际过程则要求系统状态发生变化的特征时间远 远大于弛豫时间才可近似看作准静态过程。
又根据PV n C,有P1V1n P2V2n C,所以
A
P2V2nV 21n 1 n
PV1nV11n P2V2 PV1 PV1 P2V2 1 1 1 1 n 1 n n 1
15.3 内能 热力学第一定律
一、内能
热力学系统的能量取决于系统的状 态——内能。 M i
准静态过程定义

准静态过程定义准静态过程是指一种介于静态过程和动态过程之间的特殊过程。
在准静态过程中,系统在某个时期内可以被视为处于静态状态,而在其他时期则表现出动态的行为。
特征准静态过程具有以下特征:1.长时间内保持基本静态状态:在准静态过程中,系统会在一段较长的时间内保持基本静态状态,即系统的状态变化缓慢,不会如动态系统那样频繁变化。
2.细微的不连续性:尽管系统的状态变化缓慢,但在某些时刻会发生细微的不连续性,导致某些属性或指标的突变。
这些不连续性可能是由于外部因素的影响或内部的系统调整引起的。
3.系统响应速度较慢:由于准静态过程的特点,系统的响应速度通常比动态过程慢。
系统在发生变化后需要一定的时间来适应新状态并调整相关参数。
4.时变性:准静态过程在一定时间尺度内可能是稳定的,但随着时间的推移,系统的状态和行为可能发生变化,不再保持静态。
应用领域准静态过程在许多科学领域中都有应用,例如:物理学在物理学中,准静态过程常用于描述系统在平衡状态下经历缓慢变化的过程。
例如,准静态过程可以用来描述气体在恒定温度和压力下的膨胀和压缩过程。
工程学在工程学中,准静态过程常应用于系统控制和优化中。
通过将系统建模为准静态过程,可以通过调整参数和输入来优化系统的性能。
例如,在控制系统中,准静态过程可以用来描述系统对输入信号的响应过程。
生态学生态学中的生态系统也常常被视为准静态过程。
在较长时间尺度上,生态系统的结构和组成可能保持相对稳定。
然而,随着时间的推移和环境变化,生态系统的状态也会发生变化。
经济学在经济学中,准静态过程被用来描述经济系统的长期均衡状态。
经济系统在一段时间内可能会经历周期性的扰动,但在长期均衡状态下,系统的关键指标如价格、供求关系等会保持稳定。
数学描述准静态过程可以通过微分方程或差分方程来描述。
以微分方程为例,假设系统的状态为变量x,时间为t,则准静态过程可以表示为:dx/dt = f(x, t)其中f(x, t)为系统状态变量x和时间t的函数。
准静态过程定义

准静态过程定义准静态过程是指在一个系统中,某些物理量的变化非常缓慢,以至于可以近似地认为它们是恒定的。
这种过程在物理学、化学、工程学等领域中都有广泛的应用。
在本文中,我们将探讨准静态过程的定义、特点、应用以及与其他过程的比较。
一、准静态过程的定义准静态过程是指系统中某些物理量的变化非常缓慢,以至于可以近似地认为它们是恒定的。
这些物理量可以是温度、压力、体积、质量等。
在准静态过程中,系统的状态变化非常缓慢,以至于系统可以被视为处于平衡状态。
因此,准静态过程也被称为“平衡过程”。
二、准静态过程的特点准静态过程具有以下特点:1. 系统处于平衡状态:在准静态过程中,系统的状态变化非常缓慢,以至于系统可以被视为处于平衡状态。
这意味着系统中的各个物理量都是恒定的。
2. 可逆性:准静态过程是可逆的,因为系统在过程中始终处于平衡状态。
这意味着系统可以在任何时候沿着相反的方向进行。
3. 热力学过程:准静态过程是热力学过程的一种,因为它涉及到系统中的物理量的变化。
4. 系统的变化非常缓慢:在准静态过程中,系统的变化非常缓慢,以至于可以近似地认为它们是恒定的。
三、准静态过程的应用准静态过程在物理学、化学、工程学等领域中都有广泛的应用。
以下是一些常见的应用:1. 热力学系统的分析:准静态过程是热力学系统分析的基础。
通过对系统中物理量的变化进行分析,可以得出系统的热力学性质。
2. 工程设计:准静态过程在工程设计中也有广泛的应用。
例如,在设计热交换器时,需要考虑热量的传递过程。
准静态过程可以帮助工程师更好地理解热量传递的过程。
3. 化学反应:准静态过程在化学反应中也有应用。
例如,在研究化学反应的动力学过程时,需要考虑反应速率的变化。
准静态过程可以帮助化学家更好地理解反应速率的变化。
四、准静态过程与其他过程的比较准静态过程与其他过程相比,具有以下特点:1. 与等温过程的比较:等温过程是指系统中温度恒定的过程。
与等温过程相比,准静态过程中的温度变化非常缓慢,以至于可以近似地认为它是恒定的。
热力学中的准静态过程分析

热力学中的准静态过程分析热力学是研究能量转化和传递规律的学科,而准静态过程是热力学中的一种重要过程。
本文将对准静态过程进行深入分析,包括定义、特点、计算方法以及准静态过程与实际过程的关系等方面。
一、准静态过程的定义和特点准静态过程是指在热力学系统内,系统各部分之间相互作用的过程相对缓慢,使得系统在整个过程中保持平衡状态。
准静态过程的特点如下:1. 平衡态:在准静态过程中,系统始终处于平衡态,宏观状态参数(如压强、温度、体积)保持稳定。
2. 可逆性:准静态过程是可逆过程的一种特殊情况,因为在整个过程中不存在不可逆的内部耗散。
3. 无宏观动能变化:由于准静态过程的缓慢性质,系统中的宏观动能变化可以忽略不计。
4. 焓守恒:在准静态过程中,系统的焓守恒,即系统的内能变化等于对外做功。
二、准静态过程的计算方法准静态过程的计算方法可以通过对系统进行控制体积或控制压强两种方式进行。
1. 控制体积的准静态过程计算方法:在这种情况下,系统的体积保持不变,通过控制其它参数(如压强、温度)来完成过程。
可以根据理想气体状态方程等进行计算。
2. 控制压强的准静态过程计算方法:在这种情况下,系统的压强保持不变,通过控制其它参数(如体积、温度)来完成过程。
可以根据理想气体状态方程等进行计算。
三、准静态过程与实际过程的关系准静态过程是理论分析中的一种简化假设,而实际过程往往较为复杂,包含了多种内部耗散和非平衡性。
实际过程与准静态过程之间存在一定的差异。
1. 实际过程的不可逆性:在实际过程中,会出现摩擦、传热不均等不可逆现象,使系统无法达到完全平衡状态。
2. 宏观动能的存在:实际过程中,系统的宏观动能变化较为显著,不能忽略不计。
3. 焓守恒的误差:由于实际过程中的不可逆性,系统的焓守恒并不严格成立,虽然误差较小,但需要在计算中加以考虑。
综上所述,准静态过程是热力学中的一种理论假设,能够帮助我们理解系统内部能量转化和传递的基本规律。
准静态过程

宏观运动能量
功
分子热运动能量
分子热运动能量 热量
分子热运动能量
➢ 热容量 在一定的过程中,当物体的温度升高(或降低)1K
所吸收(或放出)的热量称为物体在该过程中的热容 量,简称热容。
Cx
lim (
T 0
Q T
)ቤተ መጻሕፍቲ ባይዱ
x
(
dQ dT
)
x
摩尔热容:1mol 物质的热容
将摩尔热容的定义应用到等体、等压过程中:
热力学基础
准静态过程 功 热量
一、 准静态过程 热力学过程: 1
2
1
2
准静态过程: 在过程进行的每一时刻,系统所经过的任一
中间状态都无限地接近平衡态。
说明 (1) 准静态过程是一个理想过程; (2) 除一些进行得极快的过程(如爆炸过程)外,大 多数情况下都可以把实际过程看成是准静态过程; 如:实际汽缸的压缩过程可看作准静态过程
定体摩尔热容
dQ
CV ,m
( dT
)V
定压摩尔热容
Cp,m
(
dQ dT
)
p
系统体积由V1增大到 V2,系统对外做功为:
W V2 pdV V1
2、 功的图示法:
p
W V2 pdV 曲线AB下的面积 V1 (1) 曲线AB下的面积即表示系 p
统在AB过程中做的功。
(2) 功是与过程有关的物理量。
例:
p ( p1,V1)
p ( p1,V1)
p
A
dW pdV
B
V1 dV V2 V
( p1,V1)
( p2 ,V2 )
V
( p2 ,V2 )
V
( p2 ,V2 )
8-1准静态过程 8-2热力学第一定律

F = pS
= Fdl = pSdl = pdV
S
p
dl
元功: 元功: dW
一个有限过程: 一个有限过程: V1 → V2 1、定义式:W 定义式:
= ∫ dW = ∫ pdV p
V1
V2
1
b a
2
(适用于任何过程) 适用于任何过程)
2、功的图示: 功的图示: 功的大小等于 p − V 图中 曲线下的面积 曲线下的面积. 面积
W
外界对系统做功-
另一表述形式: 第一类永动机是不可能制成的! 另一表述形式: 第一类永动机是不可能制成的!
上页 下页
Q = ∆E + W
= dE + dW
吸热Q 吸热
无限பைடு நூலகம்的变化过程: 无限小的变化过程:dQ
∆E ր
Vր
做功W 做功
文字表述:系统从外界吸收的热量,一部分使其内能增 文字表述:系统从外界吸收的热量, 另一部分对外做功. 加,另一部分对外做功. 符号规定: 符号规定: Q 系统吸热 + 放热 - 系统对外界做功+
上页 下页
四、准静态过程中的热量 1、热量的计算: 热量的计算:
Q = cm(T2 − T1 )
Q = ν C (T2 − T1 )
QV dQ = C 热容: 摩尔定体热容: 2、热容: 摩尔定体热容: V = lim ∆T → 0 ∆T dT V
dQ 摩尔定压热容: 摩尔定压热容:C p = lim = ∆T → 0 ∆T dT p
o
V1 dV V2
上页 下页
V
等压过程: 等压过程:
W = ∫ pdV = p ∫V dV
V1
热力学中的准静态过程与绝热过程

热力学中的准静态过程与绝热过程热力学是研究能量转换和能量守恒的学科领域,在热力学中,准静态过程与绝热过程是两个重要的概念。
首先,我们来谈谈准静态过程。
准静态过程是指在一个系统中,过程进行的非常缓慢,以至于系统的各个部分都可以被认为处于平衡状态。
在准静态过程中,系统的温度、压力和密度等物理量都可以被准确地测量和控制。
准静态过程的特点之一是在整个过程中系统始终处于平衡状态,没有出现任何不可逆的过程。
这意味着系统的内部能量转化是通过平衡的方式进行的,能量的转移没有产生任何的损失。
另外,准静态过程中还有一个重要的特点就是压强变化的时候,系统内外的压强始终保持一致。
这是因为准静态过程中系统的状态始终处于平衡,而压强的变化会破坏系统的平衡,因此系统会通过反应来调整自己的状态,以恢复平衡。
接下来,我们来看看绝热过程。
绝热过程是指在一个封闭系统中,没有与外界发生热量交换的过程。
在绝热过程中,系统中的热量不发生变化,系统的能量转换只涉及到内部能量和做功这两个方面。
绝热过程的特点之一是系统中没有热量的传递,也就是说系统与外界之间没有热的交换。
由于没有热的传递,绝热过程中的系统温度会发生变化。
当系统对外界做功时,系统的内能会减少,从而导致温度的下降。
当系统从外界吸收功时,系统的内能会增加,导致温度的升高。
绝热过程还有一个重要的特点就是系统的熵始终保持不变。
熵是一个描述系统的无序程度的物理量,系统的熵增加代表系统的无序程度增加,而熵减少则代表系统的有序程度增加。
在绝热过程中,系统没有与外界发生热量交换,熵的变化只与内能和做功有关。
根据熵的定义,可以得出绝热过程中熵不变的结论。
总结一下,在热力学中,准静态过程和绝热过程是两个重要的概念。
准静态过程指的是系统中各个部分都可以被认为处于平衡状态的过程,能量转化是通过平衡的方式进行的;而绝热过程则是指系统与外界没有热量交换的过程,系统的能量转换只涉及内能和做功这两个方面。
这两个概念在热力学中有着重要的意义,对于研究能量转换和能量守恒具有重要的指导作用。
准静态过程概念

准静态过程概念嘿,咱今天就来聊聊准静态过程概念。
你说啥是准静态过程呀?就好像你走路,一步一步稳稳当当的,每一步的变化都很细微,不会突然来个大跳跃,这就有点像准静态过程啦!想象一下啊,一个系统的状态在慢慢地、连续地变化,就像一部电影的慢镜头,一格一格地推进,而不是“唰”地一下就变了。
它是那么的循序渐进,那么的有条不紊。
比如说一个气球在慢慢漏气,气不是一下子全跑光,而是一点一点地减少,这就是一种准静态过程。
在这个过程中,你可以很清楚地观察到每个阶段的变化。
再打个比方,就像你吃蛋糕,不是一口把整个蛋糕吞下去,而是一小口一小口地慢慢品尝,感受每一口的味道变化,这多有意思呀!准静态过程也是这样,让我们能够细致地去了解一个系统的变化过程。
它可不像有些过程,忽上忽下,让人摸不着头脑。
准静态过程就是这么靠谱,这么让人安心。
你想想看,要是所有的过程都跟打了鸡血似的,猛地一下就变了,那我们得多抓狂呀!还好有准静态过程,给我们一种稳稳的幸福。
而且呀,准静态过程在很多领域都很重要呢!在物理学中,它帮助我们更好地理解各种现象和规律。
在工程学里,它让我们能够更精确地设计和操作各种系统。
就好像盖房子,一砖一瓦地慢慢搭建,每一步都做得稳稳当当,这样盖出来的房子才牢固呀!准静态过程不也是这样嘛,一点点地积累,一点点地变化,最后呈现出一个清晰明了的结果。
你说它神奇不神奇?是不是很有意思呀?所以呀,可别小瞧了这个准静态过程概念,它可是有着大用处呢!它就像一个默默耕耘的老牛,一步一个脚印地为我们的科学和生活贡献着力量。
总之呢,准静态过程概念就是这么个奇妙的东西,它让我们的世界变得更加有序,更加可理解。
让我们一起好好感受它的魅力吧!。
准静态过程名词解释

准静态过程名词解释准静态过程是指一种稳态下的活动或物理量,但它们并不完全静止,而是表现出细小的波动存在着某些变化。
在工程学上,准静态过程是指压力、流量、温度、位置和速度等连续变量中具有一定范围内的变化。
这项技术可用于实现对模拟系统的研究,用于模拟实际线路的物理过程。
准静态过程的涉及到的原理是利用普朗克定律,即它可以通过控制变量的变化,使系统处于稳定状态,而无需进行恒定的动力调节。
也就是说,只要控制变量变化得当,就可以使系统保持稳定,而不会发生其他变化。
它为解决一些比较复杂的控制问题提供了一种解决方案。
一般来说,准静态过程的应用是以精细控制变量以实现所需的某种状态为基础的。
它的目的是保持某个变量的变化在一个指定的范围内,而其他变量的变化保持在可忽略的水平。
实现这一目的的方式可以是模拟系统的控制,也可以是通过对变量的调节来实现对系统的控制。
准静态过程在工程学中有着广泛的应用,主要是用来模拟某种复杂的系统,以及控制系统的性能。
它可以用来模拟气体流动、液体流动、振动、热传导和电磁学等过程。
它也可以用来实现自动控制,以达到指定的效果。
例如,在飞机操纵系统中,准静态过程可以用来实现对舵角、推力和机械效应的控制,以达到预定的航迹。
准静态过程还可以用于模拟控制系统的仿真,用于研究系统的性能,评估系统实现理想目标所需的参数,以及调整参数使系统达到理想状态。
准静态过程可以帮助工程师在试验和设计工作中取得更好的效果,因此它已经成为现代工程学的核心技术。
综上所述,准静态过程是一种稳态下的活动或物理量,以及压力、流量、温度、位置、速度等连续变量的变化可以使得系统处于稳定状态。
它的应用广泛,可以用作模拟系统的研究,用于对实际系统进行控制,以及模拟控制系统的仿真,是现代工程学的核心技术。
准静态绝热过程的过程方程

准静态绝热过程的过程方程嘿,大家好,今天我们聊聊一个有趣又略显神秘的话题——准静态绝热过程的过程方程。
听起来高深莫测,其实说白了就是热量传递的一种方式,听起来有点像在给大气做按摩,咳咳,别跑神!准静态过程其实就是在系统的状态变化中,保持一种“稳稳的感觉”,就像你在沙发上坐着,想喝杯水,却又不想起身一样。
就那种微妙的平衡感,变化的同时却又不想被外界干扰。
想象一下,你在一个封闭的气球里,慢慢挤压它,气球的气体压缩得越来越小,但它的温度却并不会因为你用力而一下子变得很高。
就是因为你在这个过程中保持了一种平衡,所以气球里面的气体就像是被你温柔对待的小猫咪,乖乖待着,不会乱叫。
这个时候的气体状态变化就是所谓的准静态绝热过程。
它不会和外界热量交换,乖得让人心疼。
这个过程方程是什么呢?简单来说,有个很经典的方程,叫做“PV^γ = 常数”。
这里的P就是压力,V是体积,而γ(伽马)就是气体的比热比,听起来像个古怪的名字,但其实它就是气体在加热时,所需的能量和气体本身的能力的比值。
这个方程就像是热量传递的一个小法宝,能让我们更好地理解气体的行为。
就像是拿着一个神奇的魔法棒,挥一挥,温度和压力之间的关系就清晰可见。
想象一下,你在做一个美味的煮饭,火候掌握得当,米饭煮得恰到好处。
这个过程里,你加热水,水蒸气开始冒出来。
水分蒸发得越快,压力越大,就像是气球被你一捏,里面的气体在“发怒”。
但要是你不想让它发怒,就得掌握好这个过程,慢慢来,给它点空间,别急。
这个时候,准静态绝热过程就帮助你稳住了这股气势。
有趣的是,在现实生活中,这种过程到处可见,比如在发动机工作时,气体压缩、膨胀的瞬间,就像是一场激烈的拳击比赛,双方你来我往,打得不可开交。
可是,如果让它太激烈,可能就会“气急败坏”,不再是我们想要的平衡了。
这个时候就得运用我们的准静态绝热过程,让一切保持在一个理想状态,顺顺利利。
再比如,想象你在山顶滑雪,风呼呼地吹过来,身体感受到的风压和气温变化得非常快。
准静态热力学过程

准静态热力学过程
准静态热力学过程是一种热力学系统在过程中足够缓慢地向平衡
态变化的过程,过程中系统的宏观性质始终保持稳定。
在这种过程中,系统可以看作是处于一系列平衡态中,并且在每个平衡态中,系统的
宏观性质可以被准确地测量并被描述。
准静态热力学过程通常可以用来对理想气体的热力学特性进行描述,例如,理想气体的等温膨胀过程就可以近似认为是一个准静态热
力学过程。
在这种过程中,压强随着体积的变化而变化,但是系统的
温度始终保持不变,这是因为在每个平衡态中,系统的温度都被维持
在一个固定的值。
因此,在准静态热力学过程中,系统的温度、压强、体积等宏观性质都可以被精确测量和计算。
总之,准静态热力学过程是热力学领域中一种特殊的过程,其中
的变化足够缓慢,以至于系统的宏观性质始终保持稳定。
通过对这种
过程的研究,可以更加深入地理解热力学理论的相关概念和原理。
准静态过程

dQ C ( T T ) CV 热量 Q V V 2 1 dT V
•等压过程:引入等压摩尔热容CP,表示在等压过程 中,1 mol 气体升高单位温度所吸收的热量。
dQ C ( T T ) CP P P 2 1 热量 Q dT P 规定: 系统吸热:Q 系统放热:Q 放 0 吸 0
9
4
三、功
i 微小变化: dE RdT 2
1. 气体系统作功是通过改变气体体积来完成的。
例如:气缸内的气压大于外界大气压,气体膨胀推 动气缸活塞对外作功。 活塞与汽缸无摩擦,当气体作 准静态压缩或膨胀时,外界的压强 Pe必等于此时气体的压强P ,否则 P 系统在有限压差作用下,将失去平 衡,称为非静态过程。 若有摩擦力存在,虽然也可使过程进行的无限缓 慢,但也不是准静态过程。
V 1
V 2
P
2
V1
o
V 1 dV
V2
V
6
注意: 功的大小不仅取决于系 统的始末状态,且与系统 经历的过程有关。 12与11’2两个过程 的始末状态相同,但过程 曲线不同,两条曲线下的 面积不同,则作功也不同。 • 特殊:
P
1
1'
2
o
V1
V2
V
功是过程量
等容过程:A等容=0
等压过程:A等压= P(V2-V1) (不一定是准静态过程)
2
准静态过程只有在进行的 “ 无限缓慢 ” 的条件 下才可能实现。实际过程则要求系统状态发生变化的 特征时间远远大于弛豫时间τ 才可近似看作准静态过 程。 对于一个平衡态,我们可以用状态参量来描述。 作为准静态过程中间状 P A 态的平衡态,具有确定的状 态参量值。 对 于 简 单 系 统 可 用 P —V 图 过程曲线 上的一点来表示这个平衡态 。 B 系统的准静态变化过程可用 P— o V图上的一条曲线表示。 V 非准静态过程不能用状态图上的一条曲线来表示。 准静态过程是一种理想的极限,但作为热力学 的基础,我们要着重讨论它。 3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在热力学中经常讨论的理想气体自由膨胀 程是一个非静态过程。“自由”指气体不受阻力 冲向右边。如图:
准静态过程
理想气体自由膨胀
一个过程,如果任意时刻的中间态都无限 接近于一个平衡态,则此过程为准静态过程。 显然,这种过程只有在进行的 “ 无限缓慢 ” 的 条件下才可能实现。对于实际过程则要求系统 状态发生变化的特征时间远远大于弛豫时间τ 才可近似看作准静态过程。
不是全微分
(功,热均为在过程中传递的能量,即过程量)
如果系统对外作功是通过体积的变化来实现的,则
Q E
或
v
v2
1
Pdv
dQ dE Pdv
Q>0,系统吸收热量;Q<0,系统放出热量;W>0,系统
对外作正功;W<0,系统对外作负功;E>0,系统内能
增加,E<0,系统内能减少。
适用范围:
过程中的每一状态都是平衡态 (Equilibrium state ) 不受外界影响时,系统的宏观性质不随时间改变。
显然作为准静态过程中间状态的平衡态,具 有确定的状态参量值,对于简单系统可用P—V图 上的一点来表示这个平衡态。系统的准静态变化 过程可用P—V图上的一条曲线表示,称之为过程 曲线。这条曲线的方程称为过程方程。准静态过 程是一种理想的极限,但作为热力学的基础,我 们要首先着重讨论它。
过程中的每一状态都是平衡态 (Equilibrium state ) 不受外界影响时,系统的宏观性质不随时间改变。
在热力学中经常讨论的理想气体自由膨胀 程是一个非静态过程。“自由”指气体不受阻力 冲向右边。如图:
准静态过程
理想气体自由膨胀
一个过程,如果任意时刻的中间态都无限 接近于一个平衡态,则此过程为准静态过程。 显然,这种过程只有在进行得 “ 无限缓慢 ” 的 条件下才可能实现。对于实际过程则要求系统 状态发生变化的特征时间远远大于弛豫时间τ 才可近似看作准静态过程。
(功是过程量)
• 特殊:
等容过程:W等容 = 0
W
V2 V1
PdV
等压过程:W等压 = P(V2-V1) (不一定是准静态过程)
准静态过程中热量的计算常用摩尔热容:
(dQ) mol cm dT
摩尔物质吸收的热量
Q
M
C m (T2 T1 )
热容量 c m 和热量 Q 均为过程量
2-2 热力学第一定律 (The first law of thermodynamics)
与过程是否准静态无关。即准静态过程和 非静态过程均适用。但为便于实际计算,要求 初终态为平衡态。
2-3 热力学第一定律对理想气体等值过程的应用
dQ dE dW
一.等容过程 V=恒量,dv=0,dw=pdv=0,
M i (dQ)v dE RdT 2
P
I ( P1 ,V1 , T1 )
II ( P2 ,V2 , T2 )
o
V
三、 准静态过程的功和热量
无摩擦准静态过程,其特点是没有摩擦力,外 界在准静态过程中对系统的作用力,可以用系统本 身的状态参量来表示。
[例] 右图活塞与汽缸无摩擦,当气体作准静态压缩 或膨胀时,外界的压强Pe必等于此时气体的压强P, 否则系统在有限压差作用 dx 下,将失去平衡,称为非 静态过程。若有摩擦力存 P 在,虽然也可使过程进行 S Pe 的“无限缓慢”,但Pe= P.
• 某一过程,系统从外界吸热 Q,对外界做功 W, 系统内能从初始态 E1变为 E2,则由能量守恒:
Q E 2 E1 W
Q E W
规定: 外界对系统做功W>0系统从外界吸热Q>0。
对无限小过程:
dQ dE dW
其中
dE为全微分(E为内状态函数)
dQ与dW仅表示元过程中的无限小改变量,
• 为简化问题,只考虑无摩擦准静态过程的功。
当活塞移动微小位移dx时,外力所作的元功为:
dW Fdx Pe Sdx
在无摩擦准静态过程中:
dx
S
dW PSdx PdV
W
讨论
V2 V1
P
Pe
系统体积由V1变为V2,外界对系统作总功为:
PdV
系统对外作正功; 系统对外作负功;
dv 0, w 0,
dv o, w 0,
dv 0,
பைடு நூலகம்
系统不作功。
• 功的图示:
由积分意义可知,用
V W V PdV
2 1
P
I
b
求出功的大小等于P—V 图
II
P
o
V1
a
上过程曲线P=P(V)下的面积。
V V dV V2
V
比较 a , b下的面积可知,
功的数值不仅与初态和末态有 关,而且还依赖于所经历的中 间状态,功与过程的路径有关。
i 理想气体 : E RT 2
内能的改变只决定于初、末状态而与所经历的过程无关。
二 准静态过程
• 热力学过程
准静态过程
非静态过程
当系统从一个状态到另一个状态变化过程,我们 就说系统在经历一个热力学过程,简称过程。
例:推进活塞压缩汽缸内的气体时,气 体的体积,密度,温 度 或压强都将变化,在过 程中的任意时刻,气体 各部分的密度, 压强, 温度都不完全相同。
第二章 热力学第一定律
2-1 内能
一 内能
功和热量
准静态过程
功和热量(Work, Heat, Internal energy) 的总和,即热力系的内能就是热力系 的热能.
热力系的内能:所有分子热运动的动能和分子间势能
• 做功可以改变系统的状态
• 摩擦升温(机械功)、电加热(电功)
• 功是过程量 作功是系统热能与外界其它形式能量转换的量度,
摩擦功:
dw f r dl
电功: dw
IUdt Udq
系统和外界温度不同,就会传热,或称能量交换,
热量传递可以改变系统的状态。 只对系统传热也能使系统的状态改变,在这一点上传 热和作功是等效的。
热量是过程量, 热量是系统与外界热能转换的量度。 是热力系状态的单值函数。
系统的内能是状态量,
• 非静态过程
显然过程的发生,系统往往由一个平衡状态到 平衡受到破坏,再达到一个新的平衡态。从平衡态 破坏到新平衡态建立所需的时间称为弛豫时间,用
τ表示。实际发生的过程往往进行的较快,(如前
例)在新的平衡态达到之前系统又继续了下一步变 化。这意味着系统在过程中经历了一系列非平衡态,
这种过程为非静态过程。作为中间态的非平衡态通
