双向电泳步骤--标准操作完整版
(完整版)双向电泳原理与流程

GE Healthcare Life Sciences ——实现从发现到功能研究,从体外到体内的突破
GE Healthcare milestones in 2-D electrophoresis
2002
Amersham Biosciences launched Ettan™ DIGE
1991
Pharmacia Biotech introduced Immobiline DryStrip
1973
1978
1982
LKB introduced Immobiline™
1979
Pharmacia Fine Chemicals introduced Pharmalyte™
The first multiple separation system, ISO-DALT, was developed
4/ GE Title or job number /
2/3/2020
Why 2DE?
Only “Proteomics” is the large-scale screening of the proteins of a cell, organism or biological fluid, a process which requires stringently controlled steps of sample preparation, 2-D electrophoresis, image detection and analysis, spot identification, and database searches.
2/3/2020
双向电泳详细操作过程
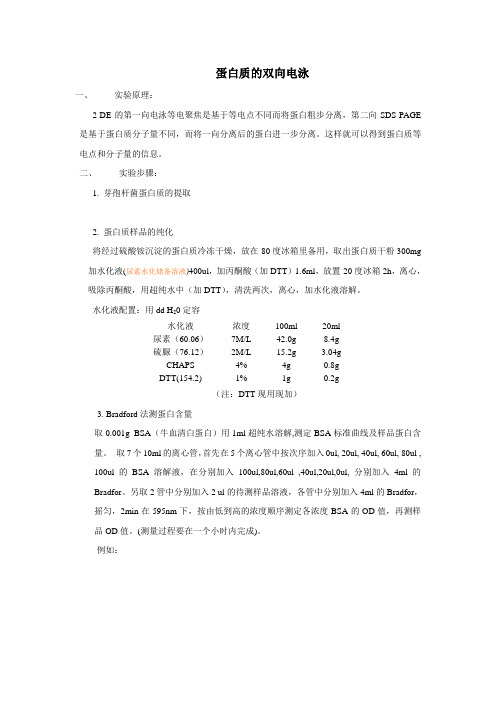
蛋白质的双向电泳一、实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE 是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二、实验步骤:1. 芽孢杆菌蛋白质的提取2. 蛋白质样品的纯化将经过硫酸铵沉淀的蛋白质冷冻干燥,放在-80度冰箱里备用,取出蛋白质干粉300mg 加水化液(尿素水化储备溶液)400ul,加丙酮酸(加DTT)1.6ml,放置-20度冰箱2h,离心,吸除丙酮酸,用超纯水中(加DTT),清洗两次,离心,加水化液溶解。
水化液配置:用dd H20定容水化液浓度100ml 20ml尿素(60.06)7M/L 42.0g 8.4g硫脲(76.12)2M/L 15.2g 3.04gCHAPS 4% 4g 0.8gDTT(154.2) 1% 1g 0.2g(注:DTT现用现加)3. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 20ul, 40ul, 60ul, 80ul , 100ul的BSA溶解液,在分别加入100ul,80ul,60ul ,40ul,20ul,0ul, 分别加入4ml的Bradfor。
另取2管中分别加入2 ul的待测样品溶液,各管中分别加入4ml的Bradfor,摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
例如:标准曲线方程式:Y= aX+b.其中Y为OD值,X为蛋白含量。
a、b通过作图输入数据可知G250的配置:称取G250 固体0.1g加水定容至1L。
使用前滤纸过滤。
比色皿用70%的乙醇保存,待用时用双蒸水冲洗,再用无水乙醇冲洗,双蒸水冲洗,再加入待测样品溶液润洗,然后,加入样品,测定OD值。
聚丙烯酰胺凝胶双向电泳

(8)平衡: 将推出的一条凝胶条放入盛有10ml平衡液的小烧杯中,
浸泡平衡20 min,然后进行第二向电泳. (9)染色:
另一条胶放入固定液中固定1~2 h,用考马斯亮蓝R250 染色1 h,再用脱色液脱色,观察第一向聚焦效果。
第二向电泳--SDS-聚丙烯酰胺凝胶电(SDS-PAGE) 1.溶液配制 (1) 30% Acrylamide第二向储液(500 mL/班) 含29.1% (w/v) acrylamide和0.9% (w/v) N,N'-methylene-bisacrylamide,配制方法同第一向储液。 (2) 10% SDS 称10 g SDS用重蒸水溶解,定容到100 mL, 室温存放。
3\操作步骤 ① 将胶置于150ml 40%甲醇-10%冰醋酸中浸泡,摇动 固定过夜。 ② 取出胶,置于120ml 10%甲醇-5%冰醋酸中浸泡,摇 动固定30min。 ③ 用去离子水将胶浸泡、漂洗,第一、二次,每次间隔 20min。 ④ 去离子水摇动漂洗,第三、四次,每次间隔30min换水 一次。 ⑤ 倾出去离子水,加入5μg/ml的DTT溶液120ml,摇动浸 泡30min。
2.实验步骤 (1)组装夹心式玻璃板、制胶支架底座调水平;
取一块长玻璃板和一块带磨口槽的短玻璃板,将短玻璃 板带磨口槽的一边位于上端与长玻璃相对,两玻璃板之间 的左、右两端各放入一条间隔条,对齐,插入玻璃板固定 夹,将上面的固定螺丝拧紧,将此夹心式玻璃板放入制胶 支架底座,插入凸轮,向内侧推入并旋转180º,夹心式玻 璃板即被固定。
聚丙烯酰胺凝胶双向电泳
(4)加样 待凝胶聚合后,用微量注射器吸去覆盖在胶上的 重蒸水。在每根胶柱上加20~30 µL蛋白质样品溶液,然后 再加入覆盖溶液至管口。
蛋白质双向电泳实验流程

蛋白质双向电泳实验流程一.样品制备1.研磨研磨时间要尽量短,并需及时补充液氮,研磨要充分,同时要保证损失少。
2.重新加入8mltris饱和状态酚(ph8.8)和8ml裂解液,在通风橱内研磨30s。
先加8mltris饱和状态酚,tris饱和状态酚会变为液态,此时需以研磨碓将液态的tris饱和状态酚研磨变成小块。
接着重新加入8ml裂解液,也须要将液态的裂解液研磨变成小块。
等三者搅匀后,将粉末迁移至45mltube。
3.振荡30min。
室温静置,等待tube中液态变为液体后,已经开始震荡。
震荡须要持续30min,每震荡1min,放在冰上加热1min。
4.10000g,4℃,10min。
将酚相(topphase)转移至45mltube。
酚相(topphase)可置于冰上。
酚二者必须就是绿色的,水相必须就是淡黄色的。
5.取6ml的抽提液和6ml饱和酚加入水相,蜗旋振荡30min。
振荡需持续30min,每振荡1min,置于冰上冷却1min。
6.10000g,4℃,10min。
将酚二者(topphase)迁移至45mltube。
7.沉淀酚相。
取一定体积(是酚相的5倍)的0.1m乙酸铵/甲醇溶液(c20℃保存)于酚相(45mltube)。
振荡30s,c20℃培育1h或过夜。
8.冲洗结晶①15min,20,000g,4℃。
弃上清。
②提10ml0.1m乙酸铵/甲醇溶液,用移液器吸打。
c20℃结晶30min。
③15min,20,000g,4℃。
弃上清。
④重新加入10ml乙酸铵/甲醇溶液,用移液器吸打。
c20℃结晶30min。
⑤15min,20,000g,4℃。
弃上清。
⑥提10ml80%丙酮(ice-cold),用移液器吸打。
c20℃结晶30min。
⑦15min,20,000g,4℃。
弃上清。
⑧重新加入10ml80%丙酮(ice-cold),用移液器吸打。
c20℃结晶30min。
⑨15min,20,000g,4℃。
弃上清。
双向凝胶电泳实验方法

双向凝胶电泳实验方法实验方案1.样品制备(Sample preparation)1.1仪器高速离心机1.2试剂NS(制备好的);Citrated human plasma ;溶解缓冲液(9M 尿素,4 , CHAPS,2 , IPG 缓冲液,40 mM DTT,40mM Tris-base) 1.3样品处理方法1).吸取适量的制备好的NS加入到Citrated human plasma 中,在温度为37°下孵化5min。
NS与血浆的加入比例为0.6:8ml。
2)孵化后,将样品高速离心,离心转速为,时间为。
3)除去上清液,将沉淀的纳米球再混悬于0.05M,pH7.4的磷酸缓冲盐中,再次以上次条件离心,本步骤重复三次。
4)将离心后收集到的总蛋白溶解于溶解缓冲液(9M 尿素,4 , CHAPS,2 , IPG 缓冲液,40 mM DTT,40mM Tris-base)。
2.第一相等电聚焦(IEF)2.1固定化 pH 剃度胶条的水化(IPG strip rehydration) 2.1.1仪器IPGphor2.1.2试剂水化液(8 M 尿素,2 % CHAPS,15 mM DTT 和 0.5 % IPG 缓冲液) 水化液需当天新鲜配制2.1.3实验步骤A. 加样品溶涨1).用样品溶解缓冲液(9M 尿素,4 , CHAPS,2 , IPG 缓冲液,40 mM DTT,40mM Tris-base)溶解样品。
蛋白质上样浓度(Q:如何确定上样浓度,)不要超过 10 mg/ml,否则会造成蛋白质的集聚或沉淀。
2).吸取适量(见下表1)含有样品的水化液放入标准型胶条槽中,为确保样品充分进入胶条中,不要加入过量的水化液。
表1 IPG胶条所需水化液体积3).去掉 IPG 胶条的保护膜,胶面朝下,先将 IPG 胶条尖端(阳性端)朝标准型胶条槽的尖端方向放入胶条槽中,慢慢下压胶条,并前后移动,避免生成气泡,最后放下 IPG 胶条平端(阴极),使水化液浸湿整个胶条。
双向电泳操作步骤

双向电泳操作步骤双向电泳操作步骤及相关溶液配置A(实验过程一实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二实验步骤:1. 样品的溶解取纯化后的晶体蛋白3.0mg,加入300ul裂解液(1mg蛋白:100ul裂解液)振荡器上振荡10min左右,共处理一个小时。
其中每隔10,15分钟振荡一次,然后13200rpm离心15min除杂质,取上清分装,每管70ul,—80oC保存。
2. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 5ul,10ul, 15ul, 20ul 的BSA溶解液,另2管中分别加入2 ul的待测样品溶液,再在每管中加入相应体积的双蒸水(总体积为80ul),然后,各管中分别加入4ml的Bradford液(原来配好的Bradford液使用前需再取需要的剂量过滤一遍方能使用),摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
3. 双向电泳第一向---IEF(双向电泳中一律使用超纯水)3.1 水化液的制备称取2.0mg 的DTT,用700ul水化液储液溶解后,加入8ul 0.05, 的溴酚兰,3.5ul(0.5,v/v)IPG buffer (pH 3-10)振荡混匀,13200rpm离心15min 除杂质,取上清。
在含300ug 蛋白(经验值)的样品溶解液中加入水化液,至终体积为340ul,振荡器上振荡混合,13200rpm离心15min除杂质,取上清。
3.2 点样,上胶分两次吸取样品,每次170ul, 按从正极到负极的顺序加入点样槽两侧,再用镊子拨开 Immobiline DryStrip gels (18cm,pH 3—10)胶条,从正极到负极将胶条压入槽中,胶面接触加入的样品。
双向电泳泳实验方案

双向电泳实验方案1.双向电泳总蛋白(培养细胞)提取方法:方案一细胞培养在10cm的培养皿中,待培养至80%左右密度时,细胞用预冷的PBS漂洗3次,加450μl裂解液,细胞刮刀收集,用移液器转移至1.5ml离心管中,反复吹打。
(折合在六孔板中,每孔加裂解液50μl)之后将样品用超声波细胞破碎仪超声处理超声时间为5s,间歇时间为10s,功率为100-120W,超声处理至溶液清澈无粘稠物为止,处理过程在冰浴中进行,超声处理后,4℃、25000g离心1h。
取上清进行蛋白质浓度测量,按实验所需的量分装后-80℃冰箱中保存。
(裂解液成分:8mol/L脲,65mmol/L DDT,4%CHAPS,40mmol/L Tris)方案二1.1试剂(1)抽提缓冲液9mol/L脲 5.4g4%CHAPS 0.4g0.5%IPG缓冲液(PH 3-10)(AP Biotech) 50.0μl50mmol/L DDT 0.077gH2O 加至10ml(2)IPG缓冲液(PH 3-10)(AP Biotech)(3) 磷酸盐缓冲液(PBS),冰冻1.2仪器(1) 细胞刮刀(2)离心机(低温,低速)(3)滤纸(4)冰浴装置(5)超速离心机(低温)(6)漩涡混合器1.3细胞培养的GC-1 spg细胞1.4方法1.从培养皿中转移细胞:用细胞刮刀从培养皿中刮下细胞,用5ml移液器将培养基和细胞转移至15ml离心管中。
2.480g、4℃离心沉淀细胞5min。
3.弃去上清,勿搅动沉淀要点:操作一下步骤时,所有细胞需保持冰冻状态;不离心或震荡时保持细胞在冰上。
4.离心管中加入10ml冰冻PBS,来回吹打重悬细胞。
5.480g、4℃再次离心细胞5min。
6.弃去上清,勿搅动沉淀。
7.重复步骤4-6两次。
8.在最后一次洗涤后,把离心管完全空干,用滤纸将沉淀上残留的PBS吸干。
9.用移液器将抽提缓冲液加到离心管中。
依赖所研究的细胞系来确定抽提缓冲液的体积。
双向电泳操作步骤

3.1 全菌蛋白的制备将细菌接种于DMEM培养基,置于28℃培养箱培养18h。
参照Coelho 等(Coelho et al. 2004)的方法,略有改动。
用Wash buffer(10mmol/L TrisCl pH8.0,5mmol/L 醋酸镁)清洗细胞3次。
离心,细胞沉淀在Lysis Buffer( 7mol/L 尿素,2mol/L硫尿,1% IPG Buffer pH3-10或pH4-7,4% CHAPS,1% DTT,1%蛋白酶抑制剂,1%核酶抑制剂)中悬浮,使其浓度范围在5~10mg/mL。
置于冰上裂解2h。
13000r/min离心1h取上清,-80℃保存。
用2-D clean-up Kit 纯化蛋白,再用2-D Quant Kit测定样本中蛋白浓度。
3. 2 2-D Clean-Up Kit的使用方法(全程小心)蛋白质样本在1.5mL微型离心管中处理,所有步骤均在冰上进行。
1)将体积100μL的蛋白质样本(含1~100μg蛋白质)置于1.5mL微型离心管中。
加入300μL沉淀剂。
振荡或倒置搅匀。
冰浴中(4~5℃)培育15min。
2)加入300μL共沉淀剂,简单振荡混合一下,12000r/min离心5min。
3)将上清液尽量多地倾析或吸出,不要搅散沉淀。
保持沉淀不变,在其上面加入一层40μL共沉淀剂,冰上培育5min。
后离心5min,去上清。
4)往沉淀加入25μL蒸馏水或去离子水。
将管振荡5~10s,这时沉淀应散开,但并未溶解于水中。
在管中加入1mL洗涤缓冲液(在-20℃下至少预冷1h)和5μL洗涤添加剂,振荡直至沉淀完全散开。
-20℃下培育至少30min,每10min振荡20~30s。
5)将离心管以最大速度(至少12000r/min)离心5min。
小心地将上清液移走弃去。
此时应可见白色沉淀,将沉淀简单风干一下(不要超过5min)。
6)用裂解液溶解沉淀,以备第一向IEF电泳。
振荡管子至少30s,在室温下孵育,振荡或用移液管抽吸使之完全溶解。
双向电泳实验操作流程

双向电泳实验操作流程机器型号:GE第一向:等电聚焦(IEF)1.对样品的要求:IEF能否成功主要取决于样品状态和离子强度,一般蛋白制备采用Trin-HCl 为缓冲液,加等渗蔗糖。
根据染色方法和胶条的长度决定上样量,一般是20μg/mL -1mg/mL。
考马斯亮蓝染色较银染需要较大的上样量。
2.IEF准备注意事项:DTT和IPG现用现配,由于DTT是还原剂,长时间放置易氧化,所以可以选择干物质使用。
DTT的作用是和尿素配合打散蛋白质结构,CHAPS为碱性去垢剂,和SDS作用相似,溶解尿素时温度不可超过37℃,因为超过37℃蛋白质会发生氨甲酰化,尽量在生产日期一年内使用。
清洗IEF胶条槽时用专用清洗剂,原液清洗或2%浓度浸泡清洗。
3.上样:胶条使用前20min从冰箱(4℃)中取出。
上样可以采用水化上样或者使用上样杯(先水化,后上样),上样杯上样适用于极性等电点蛋白质,水化12h后,在电泳槽上样。
以水化上样为例:先将250μL样品和水化液(需要当天配制)混合物加到胶条槽里,然后从尖端(阳性端)撕掉保护膜(带IO号),将胶条支持膜向上,胶面向下,用配用镊子夹住平端放入胶条槽中,注意不要产生气泡,用覆盖油覆盖,盖上盖子。
说明:放入胶条槽中的胶条上的字应该顺向能够读出,说明胶条放的对,如果读不出来,说明放反了。
在电脑软件中设置操作参数:水化上样分为被动上样(就是这种浸泡状态维持约16h)和主动上样(加电压30V,大约需要10h)。
上样后即可进行IEF电泳。
注意每种胶条最大的电流不能超过50μA。
一般是30V电压水化12h,然后200V、500V、1000V各1h,最后用8000V电压电泳至结束。
4.胶条的平衡:平衡液制备时先将SDS在加热的条件下溶解于水中,SDS溶解后冷却至20℃左右,在加入尿素充分溶解,然后加甘油混匀成水溶液。
将该水溶液分成两份,每份15mL,分装到两个平衡管中,其中一个管中加DTT,另一个管中加IAA,DTT可以打开蛋白的二硫键,防止在聚焦时形成的氧化导致在第二向拖尾,尿素、甘油可以降低电离效应,使胶条可以很好的转入第二向,IAA可以将去除DTT。
双向电泳操作流程

双向电泳完整操作流程仪器:Eppendorf 冷冻离心机 (Eppendorf)、Beckman Coulter 高速冷冻离心机(Beckman Coulter)、IPGhor 等电聚焦仪(GE Healthcare)、DALT-SIX SDS-PAGE电泳仪(GE Healthcare)、ImageScanner扫描仪(GE Healthcare)、ImageMaster 2D Platinum 7.0分析软件(GE Healthcare)、电子天平、分光光度计、旋涡混和器、PH计、真空冷冻干燥机、液氮、离心管、研钵主要溶液配置:三氯乙酸-丙酮沉淀液:10%三氯乙酸、0.07%巯基乙醇溶于100%丙酮丙酮洗涤液:0.07%巯基乙醇溶于丙酮样品裂解液:9mol/L尿素、4%CHAPS、1%IPG buffer(GE Healthcare)、1%DTT样品水化液:9mol/L尿素、4%CHAPS、1%IPG buffer(GE Healthcare)、1%DTT、少量溴芬兰定量染色液:0.01%(w/v)G250,8.5%磷酸和4.75%乙醇标准蛋白溶液:1mg/ml牛血清蛋白平衡缓冲液1:6mol/L尿素、50mmol/L Tris-HCL(pH=8.8)、30%甘油、2%SDS,1%DTT,痕量溴酚兰平衡缓冲液2:6mol/L尿素、50mmol/L Tris-HCL(pH=8.8)、30%甘油、2%SDS,4%碘乙酰胺,痕量溴酚兰12%SDS-PAGE凝胶溶液:12%丙烯酰胺、0.32%双丙烯酰胺、0.375mol/L Tris-HCL(pH=8.8)、0.1%SDS、0.05%过硫酸铵、0.05%TEMED 电泳缓冲液:25mmol/L Tris、192mmol/L甘氨酸、0.1%SDS封胶液:25mmol/L Tris、192mmol/L甘氨酸、0.1%SDS、0.5%琼脂糖考染固定液:12%(W/V)三氯醋酸考染染色液:0.12%G-250、10%(NH4)2SO4、10% H3PO4、20%甲醇。
双向电泳实验过程及相关溶液配置

双向电泳实验过程及相关溶液配置一、实验过程1、蛋白质干粉的制备(酚抽法)约1g材料置于液氮中研磨,向研钵中加入4ml提取液,待其熔化后,继续研磨数分钟,转移至离心管中(离心管容量依具体情况而定),加入等体积的pH8.0Tris-饱和酚,涡旋,离心(10000r/min,4℃)10min。
取酚层,加入6倍体积0.1mol/L乙酸铵甲醇溶液,-20℃沉淀2h以上。
离心(15000r/min,4)20min,弃上清液,沉淀用-20℃预冷甲醇洗涤1次,再以丙酮(含2%β-巯基乙醇,-20℃预冷)洗涤2次,-20度干燥,所得干粉置-20度保存待用。
2、样品的溶解取蛋白干粉10mg于1.5ml的离心管中,加入200-250ml裂解液(先加100-200ul左右,用小棒研磨后,再逐次加入余量裂解液,冲洗小棒),振荡1min左右,于35℃水浴2.5小时,15000rpm离心15min,取上清液作为实验备用。
3、Bradford法测蛋白含量1)、将牛血清白蛋白(BSA)配成1mg/ml的溶液贮存于4℃冰箱2)、设7个浓度梯度制作标准曲线,每个梯度设3个重复,依下表加入1mg/ml BSA、Lysis buffer、ddHO。
(均使用10ml离心管)2管号 1 2 3 4 5 6 71mg/ml BSA(ul) 0 10 20 30 40 50 60 Lysis buffer(ul) 20 20 20 20 20 20 20 ddHO(ul) 980 970 960 950 940 930 920 2BSA含量(ug) 0 10 20 30 40 50 603)、每管加入5ml Bradford工作液,摇匀,5min后测波长595nm下的吸光值。
测定过程中,每测完1管,比色皿用95%乙醇冲洗后再用蒸馏水冲洗3次,然后取少量下1管的溶液润洗比色皿2次。
关系的标准曲线方程式:4)、制作BSA含量与OD595Y= aX+b.其中Y为 OD值,X为蛋白含量。
双向电泳--标准操作(完整版)

细胞裂解(蛋白质提取)一、试剂配置:PBS配方氯化钠(MW 58.44) 130mM 8g氯化钾(MW 74.5) 2.7mM 0.2g十二水和磷酸氢二钠(MW 358) 10 mM3.63g磷酸二氢钾(MW 136) 2 mM0.24g加水至1L配好后进行高压灭菌。
Washing buffer(500mL)配方Tris(MW 121.1) 10mM 0.605g蔗糖(MW 342) 250mM 42.75g加水溶解,用HCl调pH至7.0后用孔径为0.22µm滤膜过滤(使用1M盐酸略高于2750uL调pH)裂解储液配方(细胞):尿素(MW 60.06) 7M 4.2g硫脲(MW 76.12) 2M 1.52gCHAPS(MW614.89) 4%(W/V)0.4g 加超纯水定容至10mL后经0.22µm一次性滤膜过滤,过滤后分装成20小管,每小管500uL,-20℃冰箱保存。
裂解储液配方(组织):尿素(MW 60.06)5M3g硫脲(MW 76.12) 2M1.52gCHAPS(MW614.89) 2% 0.2gTris(MW 121.1)40mM 0.048g加超纯水定容至10mL后经0.22µm一次性滤膜过滤,过滤后分装成20小管,每小管500uL,-20℃冰箱保存。
裂解液:裂解液储液 100uLIPG buffer(pH可选) 2% 2uLPi 2uLNucLease mix(100×) 1uLPMSF(100mM:20mg/mL) 1mM 1uLDTT(0.411g/mL) 40mM 1.5uLPi:每片使用200uL超纯水溶解后按10 uL分装考马斯亮蓝G-250:考马斯亮蓝G-250 0.01% 100g95%乙醇 4.7% 50mlH3PO4 8.5% 85g 将考马斯亮蓝G-250溶于50ml95%乙醇中,与用水溶解的100ml H3PO4混合后稀释至1000ml,之后使用滤纸过滤。
Bio-rad 双向电泳系统标准操作规程

Bio-rad 双向电泳系统标准操作规程1、目的:正确使用Bio-rad 双向电泳系统,确保Bio-rad 双向电泳系统正常运行。
2、适用范围:Bio-rad 7cm/11cm/17cm双向电泳系统。
3、责任人:双向电泳系统操作人员。
4、程序:4.1、第一向等电聚焦4.1.1、准备工作及注意事项用标配的刷子小心将聚焦盘清洗干净,注意聚焦盘两端的两根电极丝,晾干后备用;根据样品使用合适的水化上样液,对于不同的聚焦盘的上样体积可参考下表:4.1.2、上样4.1.2.1、从冰箱中取-20℃冷冻保存的水化上样缓冲液(不含DTT,不含Bio-Lyte)一小管,置室温溶解,加入合适的DTT与Bio-Lyte,充分混匀。
4.1.2.2、从小管中取出适量水化上样缓冲液与样品充分混匀。
4.1.2.3、取出-20℃冷冻保存的IPG预制胶条,室温中放置10分钟。
4.1.2.4、沿着聚焦盘或水化盘中槽的边缘至左而右线性加入样品。
在槽两端各1cm左右不要加样,中间的样品液一定要连贯。
注意:不要产生气泡。
否则影响到胶条中蛋白质的分布。
4.1.2.5、当所有的蛋白质样品都已经加入到聚焦盘或水化盘中后,用镊子轻轻的去除预制IPG胶条上的保护层。
4.1.2.6、分清胶条的正负极,轻轻地将IPG胶条胶面朝下置于聚焦盘或水化盘中样品溶液上,使得胶条的正极(标有+)对应于聚焦盘的正极。
确保胶条与电极紧密接触。
不要使样品溶液弄到胶条背面的塑料支撑膜上,因为这些溶液不会被胶条吸收。
同样还要注意不使胶条下面的溶液产生气泡。
如果已经产生气泡,用镊子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶到胶条以外。
4.1.2.7、在每根胶条上覆盖1-3ml矿物油,防止胶条水化过程中液体的蒸发。
需缓慢的加入矿物油,沿着胶条,使矿物油一滴一滴慢慢加在塑料支撑膜上。
4.1.2.8、对好正、负极,盖上盖子。
设置等电聚焦程序。
4.1.3、设置程序4.1.3.1、打开电源;4.1.3.2、根据情况选择水化(REHYDRATION),预设的程序(PRESET METHOD),储存的程序(STORED METHOD),新的程序(NEW METHOD);4.1.3.3、如果只需要水化,选择水化(REHYDRATION)选项,在接下来的界面选择主动水化或者被动水化、水化温度、水化时间;4.1.3.4、如果需要跑完整的程序,选择新的程序(NEW METHOD), 在接下来的界面选择是否水化,并设置相应的等电聚焦程序,设置完成后,在最后的界面选择总的胶条数、限电流和聚焦温度,然后开始运行程序。
双向电泳的原理及步骤

双向电泳的原理及步骤
双向电泳是一种分离蛋白质的方法,基于蛋白质在电场中的电荷和大小的不同进行分离。
以下是双向电泳的原理及步骤:
原理:
双向电泳是将蛋白质样品首先进行等电聚焦,然后再进行垂直于等电聚焦方向的SDS-PAGE电泳,从而获得更高的分离效率。
等电聚焦可以将蛋白质按照等电点的不同进行分离,而SDS-PAGE电泳可以将蛋白质按照分子量的大小进行分离。
通过这两个步骤的组合,可以更加准确地分离出蛋白质。
步骤:
1. 等电聚焦:将蛋白质样品加入到等电聚焦电极中,该电极包含有一系列等电点缓冲液。
在等电聚焦过程中,电极会产生一个电场,该电场会将带有不同电荷的蛋白质分子朝向不同方向移动,最终在等电点处停留。
这样可以将蛋白质按照等电点的不同进行分离。
2. SDS-PAGE电泳:在等电聚焦完成后,将电极旋转90度,使其与等电聚焦电极垂直。
然后将电极中的蛋白质样品注入到SDS-PAGE凝胶中,并进行电泳。
在SDS-PAGE电泳中,蛋白质会在电场中移动,但由于SDS的存在,蛋白质会被完全线性化。
这样可以将蛋白质按照分子量的大小进行分离。
3. 结果分析:通过电泳分离,可以得到一系列不同的蛋白质带,每个带代表一个蛋白质。
通过比对蛋白质带的大小和位置,可以鉴定蛋白质的分子量和等电点,从而确定蛋白质的特征。
双向电泳实验流程

双向电泳实验流程样品制备( Sample preparation ) 固相预制胶条的水化( IPG strip rehydration ) 第一向等电聚焦( IEF)胶条的平衡( IPG strip equilibration )第二向SDS-PAG电泳(SDS-PAGE electrophresis )凝胶的染色及检测( Detection/Staining )PDQuest软件分析(Software analysis )质谱鉴定( Protein identification )目录第一章实验材料1.1 IPG 预制胶条及载体两性电解质1.2 蛋白质定量试剂盒及其试剂1.3 蛋白样品制备试剂盒及其试剂1.4 化学试剂1.5 蛋白质Marker1.6 染色试剂1.7 注意事项第二章SDS-PAGE 聚丙烯酰胺凝胶电泳2. 1 溶液的配制2. 2 SDS-PAGE 凝胶的配制2. 3 操作方法2. 4 注意事项ATy -_*双向电泳3. 1 溶液配制3. 2 操作步骤3. 3 注意事项附录1 双向电泳完整的操作步骤附录2 聚丙烯酰胺凝胶电泳凝胶的配置附录3 细胞样品的一般处理步骤附录4组织样品的一般处理步骤第一章实验材料1.1 IPG 预制胶条及载体两性电解质Bio-Rad公司),-20 C冰箱保存,每包12根一)IPG 预制胶条(美国项目规格货号原价(元)IPG 预制胶条pH 3-10 ,7 cm 163-2000 799 IPG 预制胶条pH 3-10 ,7 cm ,nonlinear (NL)163-2002 799 IPG 预制胶条pH 4-7 ,7 cm 163-2001 799 IPG 预制胶条pH 3-6 ,7 cm 163-2003 799 IPG 预制胶条pH 5-8 ,7 cm 163-2004 799 IPG 预制胶条pH 7-10 ,7 cm 163-2005 799 IPG 预制胶条pH 3.9-5.1 ,7cm 163-2028 799 IPG 预制胶条pH 4.7-5.9 ,7cm 163-2029 799 IPG 预制胶条pH 5.5-6.7 ,7cm 163-2030 799 IPG 预制胶条pH 6.3-8.3 ,7cm 163-2031 799 IPG 预制胶条pH 3-10 ,11cm 163-2014 957 IPG 预制胶条pH 3-10 ,11cm,nonlinear (NL)163-2016 957 IPG 预制胶条pH 4-7 ,11cm 163-2015 957 IPG 预制胶条pH 3-6 ,11cm 163-2017 957 IPG 预制胶条pH 5-8 ,11cm 163-2018 957 IPG 预制胶条pH 7-10 ,11cm 163-2019 957 IPG 预制胶条pH 3.9-5.1 ,11cm 163-2024 957 IPG 预制胶条pH 4.7-5.9 ,11cm 163-2025 957 IPG 预制胶条pH 5.5-6.7 ,11cm 163-2026 957 IPG 预制胶条pH 6.3-8.3 ,11cm 163-2027 957 IPG 预制胶条pH 3-10 ,17cm 163-2007 1079 IPG 预制胶条pH 3-10 ,17 cm ,nonlinear (NL )163-2009 1079 IPG 预制胶条pH 4-7 ,17cm 163-2008 1079 IPG 预制胶条pH 3-6 ,17cm 163-2010 1079 IPG 预制胶条pH 5-8 ,17cm 163-2011 1079 IPG 预制胶条pH 7-10 ,17cm 163-2012 1079 IPG 预制胶条pH 3.9-5.1 ,17cm 163-2020 1079IPG 预制胶条pH 4.7-5.9 ,17cm 163-2021 1079 IPG 预制胶条pH 5.5-6.7 ,17cm 163-2022 1079 IPG 预制胶条pH 6.3-8.3 ,17cm 163-2023 1079 IPG 预制胶条pH 3-10 ,18cm 163-2032 1079 IPG 预制胶条pH 3-10 ,18cm,nonlinear (NL )163-2033 1079 IPG 预制胶条pH 4-7 ,18cm 163-2034 1079 IPG 预制胶条pH 3-6 ,18cm 163-2035 1079 IPG 预制胶条pH 5-8 ,18cm 163-2036 1079 IPG 预制胶条pH 7-10 ,18cm 163-2037 1079 IPG 预制胶条pH 3.9-5.1 ,18cm 163-2038 1079 IPG 预制胶条pH 4.7-5.9 ,18cm 163-2039 1079 IPG 预制胶条pH 5.5-6.7 ,18cm 163-2040 1079 IPG 预制胶条pH 6.3-8.3 ,18cm 163-2041 1079 IPG 预制胶条pH 3-10 ,24cm 163-2042 1292 IPG 预制胶条pH 3-10 ,24cm,nonlinear (NL )163-2043 1292 IPG 预制胶条pH 4-7 ,24cm 163-2044 1292 IPG 预制胶条pH 3-6 ,24cm 163-2045 1292 IPG 预制胶条pH 5-8 ,24cm 163-2046 1292 IPG 预制胶条pH 7-10 ,24cm 163-2047 1292 IPG 预制胶条pH 3.9-5.1 ,24cm 163-2048 1292 IPG 预制胶条pH 4.7-5.9 ,24cm 163-2049 1292 IPG 预制胶条pH 5.5-6.7 ,24cm 163-2050 1292 IPG 预制胶条pH 6.3-8.3 ,24cm 163-2051 1292(二)载体两性电解质(美国Bio-Rad公司),4C冰箱保存项目货号原价(元)Bio-Lyte 3/10 Ampholyte ,40%,10ml 163-1112 1704 Bio-Lyte 3/10 Ampholyte ,40%,25ml 163-1113 2463 Bio-Lyte 3/5 Ampholyte ,20%,10ml 163-1132 3275 Bio-Lyte 4/6 Ampholyte ,40%,10ml 163-1142 3713 Bio-Lyte 4/6 Ampholyte ,40%,25ml 163-1143 9287 Bio-Lyte 5/7 Ampholyte ,40%,10ml 163-1152 2984 Bio-Lyte 5/7 Ampholyte ,40%,25ml 163-1153 7540 Bio-Lyte 6/8 Ampholyte ,40%,10ml 163-1162 3569 Bio-Lyte 6/8 Ampholyte ,40%,25ml 163-1163 8187Bio-Lyte 7/9 Ampholyte,40%,10ml 163-1172 3479 Bio-Lyte 8/10 Ampholyte ,20%,10ml 163-1182 1912Bio-Lyte 5/8Ampholyte,40%,10ml 163-1192 3275Bio-Lyte 5/8Ampholyte,40%,25ml 163-1193 8114(三)等电聚焦上样缓冲液(美国Bio-Rad 公司),4C冰箱保存项目货号原价(元)100x ReadyStrip Buffer , for pH 7-10 IPG Strips , 1ml 163-2093 744Bio-Lyte 3/10 Ampholyte , 100x, 1ml 163-2094 396100x ReadyStrip Buffer ,for pH 6.8-8.3 IPG Strips ,1ml 163-2095566 100x ReadyStrip Buffer ,for pH 5.5-6.7 IPG Strips ,1ml 163-2096 774100x ReadyStrip Buffer ,for pH 4.7-5.9 IPG Strips ,1ml 163-2097 545100x ReadyStrip Buffer ,for pH 3.5-5.1 IPG Strips ,1ml 163-20985921.2 蛋白质定量试剂盒及其试剂项目货号报价(元)Protein Assay Kit I , bovine 丫-globulin standard 500-0001 919Protein Assay Kit II ,BSA standard 500-0002 919Protein Standard I, bovine 丫-globulin , 1 bottle 500-0005429 Protein Assay Dye Reagent Concentrate,450ml 500-0006 690Protein Standard II,bovine serum albumin,1 bottle 500-0007 365Quick Start Protein Assay Kit I ,Bradford 法500-0201 934De Protein Assay Kit I , bovine 丫-globulin standard 500-0111 2281 De Protein Assay Kit n, BSA standard 500-0112 2281 RC DC Protein Assay Kit I , 丫-globulin , Lowry 法500-0121 3183 RC DC Protein Assay Kit II , BSA standard , Lowry 法500-0122 31831.3 蛋白样品制备试剂盒及其试剂项目Ready-Prep 2-D Cleanup KitReadyPrep Sequential Extraction Kit Tributylphosphine (TBP ),200mM ,0.6ml ReadyPrep Sequential Extraction Kit Reagent 1货号原价(元)163-2130 2533163-2100 2969163-2101 539 1vial 163-2102 1116ReadyPrep Sequential Extraction Kit Reagent 2 ,1vial 163-2103 909 ReadyPrep Sequential Extraction Kit Reagent 3 ,1vial 163-2104 646 ReadyPrep 2-D Starter Kit 163-2105 3250 ReadyPrep 2-D Starter Kit Rehydration/Sample Buffer 163-2106 331 ReadyPrep Starter Kit Equilibration Buffer I ,with DTT 163-2107 508 ReadyPrep Starter Kit Equilibration BufferII 163-2108 498E.coli Protein Sample ,lyophilized ,2.7mg 163-2110 446ReadyPrep Overlay Agarose,50ml 163-2111 287 ProteoMiner Protein Enrichment SmallCapacity Kit 163-3006 3699 ProteoMiner Protein Enrichment Large-Capacity Kit 163-2007 5618 Aurum Serum Protein Mini Kit 732-6701 1513 Aurum Affi-Gel Blue Mini Columns 732-6708 1873 ReadyPrep Protein Extraction Kit (Cytoplasmic/Nuclear) 163-2089 4919 ReadyPrep Protein Extraction Kit (Membrane I) 163-2088 4919 ReadyPrep Protein Extraction Kit (Membrane II) 163-2084 2986 ReadyPrep Protein Extraction Kit (Signal) 163-2087 28151.4 化学试剂项目尿素Urea,250g 尿素Urea,1kgAG 501-X8 (D)Mixed Bed ResinCHAPS ,1gTriton X-100 ,500mlDTT (Dithiothreitol ),1gDTT (Dithiothreitol ),5g Tributylphosphine ( TBP ),200mM ,0.6ml 碘乙酰胺Iodoacetamide,30g 溴酚蓝( Bromophenol Blue ),10g 矿物油( Mineral Oil ),500ml SDS,100gSDS,1kg Tris ,500g Tris ,1kg 低熔点琼脂糖,25g 甘氨酸,1kg 货号161-0730161-0731142-6425161-0460161-0407161-0610161-0611163-2101163-2109161-0404163-2129161-0301161-0302161-0716161-0719161-3111161-0718原价(元)22268527713904212917315391429501298368199181311511360713甘氨酸,2kg 161-0724 1671 丙烯酰胺(Acrylamide ), 99.9% , 500g 161-0101 919 丙烯酰胺(Acrylamide ), 99.9% , 2kg 161-0103 3411 丙烯酰胺(Acrylamide ), 99.9% , 1kg 161-0107 1870 丙烯酰胺(Acrylamide ), 99.9% , 5kg 161-0108 8514 甲叉双丙烯酰胺(Bis), 5g 161-0200 294 PDA (Piperazine Diacrylamide ), 10g 161-0202 1902 PDA (Piperazine Diacrylamide ), 50g 161-0203 17361 过硫酸氨(Ammonium Persulfate ), 10g 161-0700 155 过硫酸氨(Ammonium Persulfate ),100g 161-0754 1153 TEMED,5ml 161-0800 207 TEMED,50ml 161-0801 485 甘油Sigma硫尿Sigma1. 5 蛋白质标准品Marker项目货号原价(元)Unstained SDS-PAGE Standards,high range,200 'l 161-0303 689 Unstained SDS-PAGE Standards,low range,200'l 161-0304 689 Unstained SDS-PAGE Standards,broad range,200'l 161-0317 884 Polypeptide SDS-PAGE Standards,200._l 161-0326 692 Prestained SDS-PAGE Standards, high range,500^1 161-0309 689 Prestained SDS-PAGE Standards, low range,500^1 161-0305 689 Prestained SDS-PAGE Standards, broad range,500^1 161-0318 800 Precision Plus Std Unstained,1ml 161-0363 1168 Precision Plus Std Dual Color,500ul 161-0374 1080 2-D SDS-PAGE Standards,500 J 161-0320 1457 IEF Standards,pl range 4.45-9.6,250^1 161-0310 16211. 6染色试剂项目Coomassie Brilliant Blue R-250 , 10gCoomassie Brilliant Blue G-250 , 10gCoomassie Brilliant Blue R-250 Staining Solutions Kit Coomassie Brilliant Blue R-250 Staining Solutions ,货号原价(元)161-0400 413161-0406 670161-0435 1440 1L 161-0436 464Coomassie Brilliant Blue R-250 Staining Solutions ,4 X 1L 161-0437 1856 Coomassie Brilliant Blue R-250 Destaining Solutions ,1L 161-0438 488Coomassie Brilliant Blue R-250 Destaining Solutions ,4X 1L 161-0439 1952 Bio-Safe Coomassie Stain ,1L 161-0786 878 Bio-Safe Coomassie Stain ,5L 161-0787 3493 SYPRO Ruby Protein Gel Stain ,200ml 170-3126 2226 SYPRO Ruby Protein Gel Stain ,1L 170-3125 5725 SYPRO Ruby Protein Gel Stain ,5L 170-3138 16744Silver Stain Kit 161-0443 3933 Silver Stain Plus Kit (质谱兼容)161-0449 28541.7 注意事项1. 双向电泳中所用的化学试剂纯度要高,至少为分析级,尽量选用进口试剂。
双向电泳步骤--标准操作完整版

细胞裂解(蛋白质提取)一、试剂配置:PBS配方PBS缓冲液一般作为溶剂氯化钠(MW 58.44) 130mM 8g氯化钾(MW 74.5) 2.7mM 0.2g十二水和磷酸氢二钠(MW 358) 10 mM 3.63g磷酸二氢钾(MW 136) 2 mM 0.24g加水至1L配好后进行高压灭菌。
Washing buffer(500mL)配方Tris(MW 121.1) 10mM 0.605g蔗糖(MW 342) 250mM 42.75g加水溶解,用HCl调pH至7.0后用孔径为0.22µm滤膜过滤(使用1M盐酸略高于2750uL调pH)裂解储液配方(细胞):尿素(MW 60.06) 7M 4.2g硫脲(MW 76.12) 2M 1.52gCHAPS(MW614.89) 4%(W/V)0.4g 加超纯水定容至10mL后经0.22µm一次性滤膜过滤,过滤后分装成20小管,每小管500uL,-20℃冰箱保存。
裂解储液配方(组织):尿素(MW 60.06) 5M 3g硫脲(MW 76.12) 2M 1.52gCHAPS(MW614.89) 2% 0.2gTris(MW 121.1) 40mM 0.048g加超纯水定容至10mL后经0.22µm一次性滤膜过滤,过滤后分装成20小管,每小管500uL,-20℃冰箱保存。
裂解液:裂解液储液 100uLIPG buffer(pH可选) 2% 2uLPi 2uLNucLease mix(100×) 1uLPMSF(100mM:20mg/mL) 1mM 1uLDTT(0.411g/mL) 40mM 1.5uLPi:每片使用200uL超纯水溶解后按10 uL分装考马斯亮蓝G-250:考马斯亮蓝G-250在游离状态下呈红色,最大光吸收在465nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm波长下有最大光吸收。
其光吸收值与蛋白质含量成正比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细胞裂解(蛋白质提取)一、试剂配置:PBS配方氯化钠(MW 58.44) 130mM 8g氯化钾(MW 74.5) 2.7mM 0.2g十二水和磷酸氢二钠(MW 358) 10 mM3.63g磷酸二氢钾(MW 136) 2 mM0.24g加水至1L配好后进行高压灭菌。
Washing buffer(500mL)配方Tris(MW 121.1) 10mM 0.605g蔗糖(MW 342) 250mM 42.75g加水溶解,用HCl调pH至7.0后用孔径为0.22µm滤膜过滤(使用1M盐酸略高于2750uL调pH)裂解储液配方(细胞):尿素(MW 60.06) 7M 4.2g硫脲(MW 76.12) 2M 1.52gCHAPS(MW614.89) 4%(W/V)0.4g 加超纯水定容至10mL后经0.22µm一次性滤膜过滤,过滤后分装成20小管,每小管500uL,-20℃冰箱保存。
裂解储液配方(组织):尿素(MW 60.06)5M3g硫脲(MW 76.12) 2M1.52gCHAPS(MW614.89) 2% 0.2gTris(MW 121.1)40mM 0.048g加超纯水定容至10mL后经0.22µm一次性滤膜过滤,过滤后分装成20小管,每小管500uL,-20℃冰箱保存。
裂解液:裂解液储液 100uLIPG buffer(pH可选) 2% 2uLPi 2uLNucLease mix(100×) 1uLPMSF(100mM:20mg/mL) 1mM 1uLDTT(0.411g/mL) 40mM 1.5uLPi:每片使用200uL超纯水溶解后按10 uL分装考马斯亮蓝G-250:考马斯亮蓝G-250 0.01% 100g95%乙醇 4.7% 50mlH3PO4 8.5% 85g 将考马斯亮蓝G-250溶于50ml95%乙醇中,与用水溶解的100mlH3PO4混合后稀释至1000ml,之后使用滤纸过滤。
二、实验准备:1、准备冰盒,细胞裂解过程均在冰盒内进行(4℃);2、准备4℃离心机,开机降温,保证温度下降至4℃;3、取出置于-20℃保存的试剂,需冰上融化,最后取出细胞样品。
三、样品制备:(一)细胞细胞裂解准备:1、收集细胞,使用大于500g转速离心5min;2、弃去上清,使用washing buffer重悬细胞沉淀,震摇待细胞完全打散后,继续用大于500g转速离心5min;3、重复步骤2两次,并使用转速2000rpm离心5min,弃上清。
细胞可置于-80冰箱保存数周,或使用裂解液裂解。
细胞裂解:1、配置裂解液:注意先不要加入DTT。
临用前加入PMSF后,立即将细胞裂解液加入待裂解的细胞中。
2、加入裂解液的细胞置于冰盒内,每隔5-7min取出,于漩涡振荡器上震摇数秒,并再次放于冰盒中,保证细胞裂解时的温度为4℃。
3、裂解15-20min后加入DTT。
4、裂解完成后,置于4℃离心机中,以最大转速13200rpm离心30min,取上清,弃沉淀。
上清所含提取的蛋白。
5、使用bradford法测定提取蛋白浓度。
(二)、组织:组织裂解准备:1、提取动物组织。
提取时务必保证组织的纯度,尽量减少组织混杂,尤其注意血液的混入。
2、使用washing buffer冲洗组织2-3遍,洗净组织的血液、体液、和其他影响实验结果的残留成分。
3、准备研钵,洗净并且烘干,准备适量的组织裂解液,准备充足的液氮,石英砂适量。
组织裂解:1、配置裂解液:注意先不要加入DTT、 PMSF。
2、将适量石英砂加入到研钵中,加入液氮冷却。
3、将组织放入装有液氮的研钵中,研磨组织,在研磨过程中保证样品在低温状态下。
4、研磨完成后将样品及石英砂收集到离心管中,在裂解液中迅速加入PMSF,混匀后将裂解液加入含有样品的离心管中。
保持4℃,震荡混匀,每隔5-7min取出,于漩涡振荡器上震摇数秒,并再次放于冰盒中。
5、裂解15-20min后加入DTT。
6、使用2000g离心10min,吸取上清即为所提取的蛋白,下层石英砂及组织碎片则丢弃。
将上清使用13200g转速离心,弃去沉淀。
(三)、血清:血清样品可直接用于双向电泳实验。
但样品中含有大量的IgG和白蛋白,需要使用试剂盒去除。
四、试剂说明:裂解液成分:溶液中还原剂的含量不要超过20mM。
尿素/硫脲:变性剂,中性促溶剂,促进样品溶解,破坏氢键等次级结构,使所有离子基团暴露在溶液里。
硫脲可以促进膜蛋白的溶解。
尿素在30℃以上容易降解,降解产物异氰酸盐可使样本中蛋白质甲氨酰化,对蛋白质进行修饰,造成等电点改变,形成人为地“斑点串”。
CHAPS:两性表面活性剂,CHAPS是一种非变性的zwitterionic 去垢剂、蛋白质裂解液,用于增溶膜蛋白和裂解蛋白-蛋白之间的相互作用。
CHAPS是两性离子去垢剂,分子结构中具有一个胆酸和硫代甜菜碱。
在紫外区的低吸光性成为用紫外方法检测膜蛋白的首选去垢剂,CMC值均为8 mM。
常用于于双向电泳等实验。
原理:CHAPS保护蛋白质的天然状态,可溶解膜蛋白,从而互作用。
透析可除去。
SDS:(FW 288.38)离子型去垢剂,裂解力强,基本可以把细胞完全破坏掉。
并且使蛋白变性失活。
不得与强氧化剂混合。
它也可以用于核酸抽提操作中破坏细胞壁及裂解核酸蛋白复合物。
NP-40:乙基苯基聚乙二醇(Nonidet P40;)很温和的非离子型去垢剂,1%浓度的基本可以破坏掉胞膜,而对核膜破坏的作用弱,结合特定的buffer可以获得胞浆蛋白。
与蛋白结合力强,用于防止物质分子疏水间相互作用,确保蛋白的充分溶解和结构稳定。
尤其用于膜蛋白的非变性条件下的溶解。
TritonX-100:聚乙二醇辛基苯基醚,一种非离子型表面活性剂,能溶解脂质,以增加抗体对细胞膜的通透性。
1%的Triton X-100常用于漂洗组织标本,0.3%的Triton X-100则常用于稀释血清,配制BSA等。
能力介于NP-40和SDS之间,偏向于NP-40,在保护蛋白活性方面有一定作用。
EDTA:变性剂和稳定剂,通过螯合金属离子有效抑制蛋白酶的活性。
DTT:二硫苏糖醇,还原剂,储液配置:0.4g/mL。
使用浓度约为40mM。
防止蛋白通过巯基氧化聚合,增加蛋白的可溶性。
DTE:二硫赤酰糖醇,与DTT近似,也做还原剂。
ASB14: Amidosulfobetaine 14,TBP:tri-Butyl-Phosphate磷酸三丁酯、三丁基膦,有毒,具有较低的表面张力,难溶于水,常用作消泡剂。
非巯基还原剂,使用浓度为2mM,但溶解性有限,在溶液中不稳定,在样品制备时需DTT联合使用。
脱氧胆酸钠:Sodium deoxycholate,中度变性剂和蛋白溶解剂。
SB3-10:硫代甜菜碱10,诱食剂,甲基供给剂。
DeStreak试剂和DeStreak水化溶液:将蛋白质巯基转变为稳定地二硫化物基团,防止发生非特异性氧化反应,有效减少蛋白质在电泳过程中因再氧化而发生的拖尾,特别是pH7-11的范围内(碱性蛋白质)。
PMSF:苯甲基磺酰氟,储液配置(100mM):20mg/mL,在水中易失活,使用异丙醇或DMSO配置。
强大的不可逆蛋白酶抑制剂,抑制丝氨酸水解酶和一些半胱氨酸水解酶以及含有巯基的蛋白酶,使用浓度为1mM。
浓度测定:核酸酶(Nuclease mix):核酸酶的构成是由牛胰腺Dnase 和Rnase以及维持最佳核酸酶活性所必须的各种辅助因子组成。
核酸酶受EDTA的干扰,使用核酸酶时避免加入EDTA。
可与蛋白酶抑制剂(PI)同时使用,但要注意必须选择无EDTA的蛋白酶抑制剂。
(注意:核酸酶试剂组为悬浮液,使用前务必震荡混匀后分装。
)考马斯亮蓝:Coomassie brilliant blue.考马斯亮蓝G-250(Coomassie brilliant blue G-250)比考马斯亮蓝R250多二个甲基。
MW=854;λmax=590―610nm。
测定蛋白质含量属于染料结合法的一种。
考马斯亮蓝G-250在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm波长下有最大光吸收。
其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。
蛋白质与考马斯亮蓝G-250结合在2min左右的时间内达到平衡,完成反应十分迅速;其结合物在室温下1h内保持稳定。
灵敏度比Lowry 法还高4倍,染色灵敏度不如R250,但比氨基黑高3倍。
优点在于它在三氯乙酸中不溶而成胶体,能选择地染色蛋白而几乎无本底色。
所以常用于需要重复性好和稳定的染色,适于作定量分析。
可测定微克级蛋白质含量,测定蛋白质浓度范围为0~1 000μg/mL。
该方法用于大多数蛋白质的定量是比较精确的,但不适用于小分子碱性多肽的定量。
去污剂的浓度超过0.2%影响测定结果。
如TritonX-100、SDS、NP-40等。
考马斯亮蓝和皮肤中蛋白质通过范德华力结合,反应快速,并且稳定,无法用普通试剂洗掉。
待一两周左右,皮屑细胞自然衰老脱落即可无碍。
考马斯亮蓝R250与蛋白质反应虽然比较缓慢,但是可以被洗脱下去,所以可以用来对电泳条带染色。
R250较敏感,做定量实验用,染胶效果较好.染色后为红蓝色。
染色灵敏度比氨基黑高5倍。
尤其适用于SDS电泳微量蛋白质染色。
但蛋白质浓度超出一定范围时,对高浓度蛋白的染色不符合Beer定律,用作定量分析时要注意这点。
此方法优点:干扰物质少,K+、Na+、Mg2+离子、Tris缓冲液、糖和蔗糖、甘油、巯基乙醇、EDTA等均不干扰此测定法。
此法的缺点是:(1)由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同,因此Bradford法用于不同蛋白质测定时有较大的偏差,在制作标准曲线时通常选用 g—球蛋白为标准蛋白质,以减少这方面的偏差。
(2)仍有一些物质干扰此法的测定,主要的干扰物质有:去污剂、 Triton X-100、十二烷基硫酸钠(SDS)和0.1N的NaOH。
(如同0.1N的酸干扰Lowary法一样)。
(3)标准曲线也有轻微的非线性,因而不能用Beer定律进行计算,而只能用标准曲线来测定未知蛋白质的浓度。
蛋白质纯化一、目的:蛋白质纯化的目的在于去除样品蛋白中的盐、糖以及一些大分子杂质,杂质的存在严重影响双向电泳的结果。
二、方法:本实验室蛋白质常用的除杂方法主要有丙酮沉淀、TCA-丙酮沉淀、2D-cLeanup-kit处理。
丙酮沉淀:加入3-4倍体积的-20℃保存的丙酮沉淀大于1小时。
沉淀结束后使用13200rpm转速离心10min,去上清,将ep管置于冰上晾干5min,后用水化液溶解。
TCA-丙酮沉淀:使用含有10%TCA的丙酮溶液(100mL丙酮加入10gTCA(三氯乙酸),也可加入0.07%的DTT),沉淀方法与丙酮沉淀类似。
