真空采血管抽取顺序
真空采血管抽取顺序

*******医院真空采血管抽取顺序说明
真空采血管分普通管、抗凝管两大类;抗凝管又根据抗凝剂不同分为枸橼酸钠管、乙二胺四
乙酸二钾盐或二钠盐(EDTA-K
2或EDTA-Na
2
)管、肝素管等。
等检
精心整理
精心整理
精心整理
精心整理
精心整理
精心整理
精心整理
采血顺序:(口诀:血培养先得,蓝黄(红)绿紫黑。
)
血培养蓝头管红(黄)头管绿头管紫头管黑头管
血流便停止,采完血后必须按要求颠倒混匀,使添加剂
精心整理
与血液充分混合,但不可剧烈晃动以免造成标本溶血;
采集手册》及外送服务项目
精心整理
手册。
精心整理。
真空采血管正确的抽血顺序

真空采血管正确的抽血顺序
检验科冯衍红
现在我院基本上普及了方便安全的真空采血管,取代了以前的注射器采血,但却并非每个人都清楚正确的采血顺序。
根据卫生行业标准WS/T225-2002《临床化学检验血液标本的收集与处理》中规定
如果一次采血要采取几个标本时,应推荐以下顺序采血:
a、血培养管;
b、无添加剂管;
c、凝血试验管;
d、有添加剂的管(不同添加剂管按以下顺序采血:1、枸橼酸盐管;2、肝素管;3、EDTA管;4、草酸盐/氟化物管)。
2003 美国(CLSI)标准
第一:血培养管
第二:血凝管
第三:血清管
第四:肝素管
第五:EDTA
第六:糖酵解抑制剂
这里有几个原则要注意:
1应该是无菌要求优先考虑,所以血培养采血应该最先采。
因为血培养标本的采集要求严格无菌,并且注意避免外界因素的污染,而各种真空采血管并不是严格无菌的,如果先将血液采集到真空采血管中,针头存在被污染的风险,再采集血培养的标本时就可能将标本污染,从而影响血培养结果。
2有添加剂的不能污染无添加剂的,所以无添加剂的红头管排在其他含添加剂的管子前面。
3含添加剂的也要区分,添加剂成分对其他试验影响大的排在后面,其顺序为不能影响后面的实验,凝血功能检测要求较高,故蓝头管排在前面。
特别强调一点:目前我院未使用红头管(无任何添加剂),各个临床科室领到的橘红色管子,里面添加了促凝剂。
一定要等所有项目采集完毕以后才能使用。
真空采血管的分类及应用及采血顺序

4.绿色头盖管(肝素抗凝管)
含有肝素钠或肝素锂的采血管, 肝素是一种含有硫酸基团的粘 多糖,带有强大的负电荷,具 有加强抗凝血酶III灭活丝氨酸 蛋白酶的作用,从而阻止凝血 酶的形成,并有阻止血小板聚 集等多种抗凝作用。肝素管一 般用于急诊生化、TORCH、 血流变的检测,检验血标本中 的钠离子时,不能使用肝素钠 管,以免影响检测结果。也不 能用于白细胞计数和分类,因 肝素会引起白细胞聚集。
注意事项:采血顺序
• 按顺序采血的目的在于防止添加剂携带污染造成 的结果错误
血培养采血管 凝血采血管
血清采血管
肝素采血管
EDTA采血管 葡萄糖酵解抑 制剂
血培养瓶
血凝管 血沉管
SST血清 血清管 分离胶管
PST血浆 血浆管 分离胶管
血常规管
单次静脉穿刺采集多管血样的采血顺序
血糖管
采血顺序错误:影响凝血分析
阻止凝血酶形 成,阻止血小 板聚集,阻止 血液凝固
颠倒混匀6—8次 血 与Ca+2结合成
液与抗凝剂比例4:1
螯合物,阻止
血液凝固
不能用于其他化学检查 防止血糖降解
急诊生化、 TORCH、血 流变的检测
血沉
葡萄糖,糖耐 量,乙醇浓度
1、红色盖头管(无添加剂的干燥真空 管)
采血管内壁均匀涂有防止 挂壁的药剂(硅油)。它 利用血液自然凝固的原理 使血液凝固,等血清自然 析出后,离心使用。主要 用于血清生化(肝功、肾 功、心肌酶、淀粉酶等)、 电解质(血清钾、钠、氯、 钙、磷等)、甲状腺功能、 药物检测、艾滋病检测、 肿瘤标志物、血清免疫学。
7. 血沉管
用于多种品牌血沉仪。由 于采血量少,管内负压较 小,抽血时间相对稍长, 应耐心等待直至血液停止 流入采血管后混匀5-8次, 使抗凝剂和血液充分混匀, 抗凝剂与血液比例为1:4。 不恰当的混匀会造成溶血、 凝血或血泡,影响检测结 果。
真空采血管分类、抽血顺序及颜色含义!
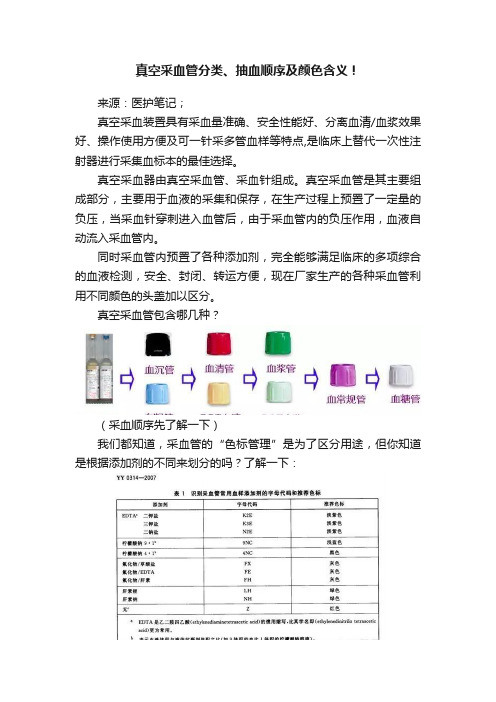
真空采血管分类、抽血顺序及颜色含义!来源:医护笔记;真空采血装置具有采血量准确、安全性能好、分离血清/血浆效果好、操作使用方便及可一针采多管血样等特点,是临床上替代一次性注射器进行采集血标本的最佳选择。
真空采血器由真空采血管、采血针组成。
真空采血管是其主要组成部分,主要用于血液的采集和保存,在生产过程上预置了一定量的负压,当采血针穿刺进入血管后,由于采血管内的负压作用,血液自动流入采血管内。
同时采血管内预置了各种添加剂,完全能够满足临床的多项综合的血液检测,安全、封闭、转运方便,现在厂家生产的各种采血管利用不同颜色的头盖加以区分。
真空采血管包含哪几种?(采血顺序先了解一下)我们都知道,采血管的“色标管理”是为了区分用途,但你知道是根据添加剂的不同来划分的吗?了解一下:(图片来源:丁香园)真空采血管的抽血顺序一直存在很大的争议,到底是红帽管先抽还是蓝帽管先抽?笔者整理出相关资料供大家参考,如有不同之处,欢迎大家在文末留言讨论。
真空采血管抽血顺序,到底哪个先哪个后?笔者查阅人卫版护理教科书《基础护理学》、人卫版《临床检验基础》、北京协和医院参考CLSI(H3-A6)制定静脉血推荐采集顺序、美国CLSI(美国临床及实验室标准化委员会)H3-A6均有不同的标准。
人卫版护理教科书《基础护理学》采血顺序先抽血培养→抗凝管→干燥试管。
人卫版《临床检验基础》分玻璃采血管和塑料采血管用玻璃采血管、多管采集血液标本时的顺序:血培养管→无抗凝剂血清管→枸椽酸钠抗凝管→其他抗凝剂管用塑料采血管:血培养(黄色)→枸椽酸钠抗凝管(蓝色) →加或未加促凝剂或分离胶的血清管→加或未加分离胶的肝素管(绿色) →EDTA抗凝管(紫色) →加葡萄糖分解抑制剂管(灰色)•从人卫版这本最新教材中可以看到多管采血时要分清真空采血管的材料是玻璃(医用的硼硅玻璃)或者塑料(PET-聚对苯二甲酸乙二醇酯)。
由于玻璃管在安全性能上存有很大隐患,使用特种塑料PET 试管替代玻璃管成为一种趋势,而且塑料拥有运输便捷,防摔的特点也是比玻璃管更胜一筹,由于PET 试管有着良好的疏水性,很大程度上加大了真空管的生产难度。
【小结】真空采血管的采血顺序

【小结】真空采血管的采血顺序【文件一】WS/T 225-2002 临床化学检验血液标本的收集与处理来源:/wjw/s9492/201212/34007.shtml该文件的详细内容可查阅:【卫生行业标准】临床化学检验血液标本的收集与处理(WS/T 225-2002)以下是该标准提供的“多项标本采集的采血顺序”:4.5 多项标本采集的采血顺序,即我国推荐的采血顺序,概括如下:血培养管→ 无添加剂管→ 凝血管→ 枸橼酸盐管→ 肝素管→ EDTA管→ 草酸钙/氟化物管(血糖管)然而,含有分离胶和(或)促凝剂的采血试管在采血顺序中的位置如何?WS/T 225-2002并没有提及,这令人迷惑不解——该文件中往后的章节确实提到了含有分离胶和(或)促凝剂的采血试管;与该行标相关的行标WS/T 224,无论是老版的WS/T 224-2002,还是新版的WS/T 224-2018,也都列出添加剂为分离胶和(或)促凝剂的采血试管。
小编认为这点令人遗憾。
新版本的《WS/T 224-2018 真空采血管的性能验证》请参阅:【卫生行业标准】真空采血管的性能验证(WS/T 224-2018)老版本的《WS/T 224-2002 真空采血管及其添加剂》请参阅:【卫生行业标准】真空采血管(及其添加剂)与采血顺序【文件二】《中国临床实验室血液标本分析前标准共识》的有关内容以下内容来自本材料:《WS/T 225-2002 临床化学检验血液标本的收集与处理》距今已经17年,比较陈旧了。
而该“共识”出版至今也才5年多。
表3-1续表“共识”推荐的采血顺序,概括如下:血培养管→ 无添加剂管→ 凝血管→ 血沉管→ 促凝管→ 血清分离管→ 肝素管→ 血浆肝素管→ EDTA管→ 草酸钾/氟化物管或氟化钠/EDTA管(血糖管)值得一提的是,本材料推荐的是直针穿刺采血:【文件三】《WHO采血指南:血液标本采集的最佳操作》的有关内容以下内容来自本材料:PS:为什么小编给出的文件名是《WHO采血指南:血液标本采集的最佳操作》?因为本文件所讲的内容远不止静脉采血。
再谈真空采血管抽血顺序的问题_蜗牛

再谈真空采血管抽血顺序的问题在检验工作中,对于一次采血多管血液分配的顺序一直有一些争议,针对这个问题,在丁香园网站,还有一篇专门针性的文章《7家争言:真空采血管的抽血顺序到底哪个先哪个后》,作者是遵义医学院第五附属(珠海)医院的钟泽填。
文章很全面的搜集了不同教材中的不同标准。
以这篇文章为基础,我想再做一下补充和说明。
我们先分别来看一下不同的教材在这个问题上的说法。
圈里的字可能比较模糊,说明一下。
按照箭头顺序分别是:血培养瓶/管→红头管→浅蓝头管→黑头管→緑头管→紫头管→灰头管→金黄头管。
人卫版教材比较详细,特意区分了真空采血管的材料是玻璃(医用的硼硅玻璃)还是塑料(PET-聚对苯二甲酸乙二醇酯)。
由于玻璃管在安全性能上存有隐患,使用特种塑料PET试管替代玻璃管成为一种趋势,而且塑料拥有运输便捷,防摔的特点也是比玻璃管更胜一筹,由于 PET 试管有着良好的疏水性,很大程度上加大了真空管的生产难度。
二、人卫版《临床基础检验学技术》(全国高等学校医学检验专业第六轮暨医学检验技术专业第一轮规划教材)这个顺序也是BD公司(世界上最大的生产和销售医疗设备,医疗系统和试剂的医疗技术公司之一)推荐的采血顺序。
三、《全国临床检验操作规程》(第四版)这里有个“凝血项管”,注意不要和“凝血管(也叫“血清管”,不含抗凝剂)”混淆了。
凝血项管是指凝血项目检查的管,一般情况下指的就是含枸橼酸钠的蓝头管。
护理学对这个问题没有深入细致的说明,只保证了基本的原则。
五、卫生部行业标准你发现卫生部的行业标准其实就是把《临床基础检验技术》中的第2个和第3个“圈儿”换一下顺序。
六、日本标准日本标准推荐的采血管顺序:1.培养血液用采血;2.采集血清用采血;3.柠檬酸采血;4.肝素采血;5.EDTA 采七、美国 CLSI(美国临床及实验室标准化委员会)标准H3-A6 2003 美国(CLSI)标准推荐的采血管顺序:1.血培养管;2.血凝管;3.血清管;4.肝素管;5.EDTA 管;6.糖酵解抑制剂管。
真空管采血

• 止血带的正确使用方法
• 在穿刺点以上约3-4英寸(*2.54cm)的位置扎紧止 血带 • 如果在对静脉选择定位时需要使用止血带, 推荐在 再次使用前应保证至少间隔2分钟 • 推荐在使用止血带1分钟内进行穿刺,一旦血液流入 采血管就应该撤去止血带。
• 当使用止血带时,病人不要进行松紧拳头的动作
• 戴手套
• 准备好采血器具
手套、压脉带、 正确型号的采血管、采血针、 持针器以及其他需要的物品
• 选择最佳穿刺部位
前臂中静脉是穿刺的第一选择, 粗大而好固定,疼痛轻微不会造成溶血;
静脉穿刺的不当部位: 切除乳房该侧部位;水肿部位; 血肿;有疤痕部位; 超出任何种类IV线的部位
• 头皮针穿刺程序
去除头皮针后端的护套, 旋转拧入持针器
• 人为因素导致的溶血
1.消毒用酒精未干即开始采血,酒精进入血标本,导致溶血; 2.进针不准,针尖在静脉中探来探去,造成第一管溶血; 3.从血肿的静脉中采血,血肿中的组织液致RC破裂; 4.采血量不足,造成添加剂浓度过高,因渗透压过高而溶血; 5. 采血时没有直至真空管内负压耗竭、血流中断就拔下针头; 6.没有摘下针头就将血液推入管内,RC在细小的针头内受挤压而破裂; 7.从注射器内推入血液时用力过猛,RC在外力挤压下破裂而溶血; 8.颠倒混匀时过分振荡或混匀次数过频过多; 9.离心前,用竹签剥离血块或纤维蛋白丝时用力过猛,致RC破碎; 10.离心机内温度过高或过低,RC脆性加大,离心时RC破碎。
枸橼酸钠(蓝/黑): 血凝试验/血沉 EDTA盐(紫): 血常规及其他全血试验 肝素盐(绿): 快速血浆生化与血流变 氟化钠复合抗凝剂(灰): 血糖试验 抗凝剂(红): 普通生化免疫与血库试验
无分离胶
有添加剂
采血管的正确采血顺序

采血管的正确采血顺序 Document number:PBGCG-0857-BTDO-0089-PTT1998
真空采血管是近几年应用于临床的检验采血新产品,其操作简便、干净安全、抗凝剂比例准确可靠,正为各医院普遍应用。
关于采血管的采血顺序大到全国重点医院,小到城镇民营体检中心,甚至在省级医院的某病房,都存在采血顺序不正确,那些小的医疗机构就更难以规范了,有的医疗单位就因为这“小事情”而引发了不少争议。
采血管采血顺序不规范对检验结果的影响有人做了统计:第一管采集血常规管(紫色)出现了血小板增高者占%,改为第二管采集,血小板增高者降至%,而且增高者与临床相符,正确采集血液标本是获得准确、可靠的实验结果的前提,也体现医疗机构的规范性,所以有必要“小题大做”,把国家标准和国际标准搬出来规范各医疗机构。
各种真空采血管头盖的颜色均为国际通用标准,根据中华人民共和国卫生部医政司《全国临床检验操作规程》、卫生行业WS/T225-2002标准、和美国临床实验室标准化协会CLSI(NCCLS)H3-A5标准、推荐多管采血采集顺序:凝血管(蓝色)→血常规管(紫色)→血沉(褐色)→生化管(红、黄),需要强调的是:血常规管无论如何都要在第二管采集,是与凝血机制有关,有血液培养时血常规为第三管,因为血培养标本的采集要求严格无菌,所以血培养管采血为第一管,所有采血管采完血后都要轻微颠倒1-7次,不能振摇。
只有真正重视分析前的质量控制,才能保证检验结果的准确、可靠。
真空采血管采血法标准操作程序

真空采血管采血法标准操作程序【目的】指导正确的真空采血管采血法。
【该SOP变动程序】本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报请专业组长及科主任签字后生效。
【实验器材】1、一次性真空采血管及采血针。
2、消毒碘伏或75%酒精。
3、其他压脉带、垫枕、消毒棉签、利器盒等。
【操作程序】1、受检者取坐位,前臂水平伸直置于桌面枕垫上,选择容易固定、明显可见的肘前静脉或手背静脉。
2、有碘酊自所选静脉穿刺处从内向、顺时针方向消毒皮肤,待干。
3、在穿刺点上方约6cm处系紧压脉带,嘱受检者紧握拳头,使静脉充盈显露。
4、拔出双向采血针的护套,以左手固定受检者前臂,右手拇指和示指持穿刺针,沿静脉走向使针头与皮肤成30°角,快速刺入皮肤,然后成5°角向前刺破静脉壁进入静脉腔,见回血后将刺塞针端直接刺穿真空采血管盖中央的胶塞中,血液自动流入试管内,如需多管血样将刺塞端拔出,刺入另一真空采血管即可。
5、达到采血量后,松压脉带,嘱受检者松拳,拔除刺塞端的采血管。
将消毒棉签压住穿刺孔,立即拔除穿刺针,嘱受检者继续按压针孔数分钟,将采血针去除放入利器盒。
6、抗凝管需立即轻轻颠倒混匀。
7、如一次采血要求几个标本时,应按以下顺序:血培养管、无抗凝剂管(黄色帽)、凝血象管(蓝色帽)、抗凝剂管(紫色帽、黑色帽)。
8、严格执行“一人一针一管一垫一带”,防止交叉感染,每操作一个患者后用洁肤柔进行手消毒,再操作下一个患者。
【注意事项】1、带乳胶套的刺塞端须从真空采血管的胶塞中心垂直穿刺。
乳胶套能防止拔除采血试管后继续流血污染周围,因此不可取下乳胶套。
2、使用前勿松动一次性真空采血管盖塞,以防采血量不准。
真空采血管采血顺序建议真空采血管采血顺序建议
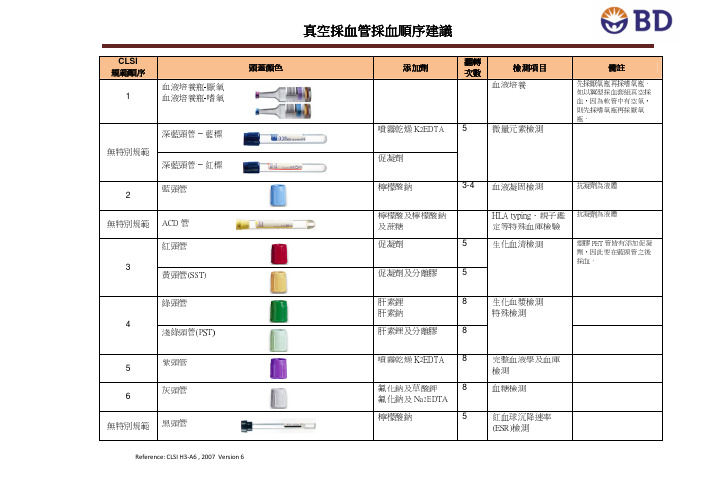
真空採血管採血順序建議
Reference: CLSI H3-A6 , 2007 Version 6
CLSI 規範順序
頭蓋顏色頭蓋顏色
添加劑
翻轉
次數次數 檢測項目檢測項目 備註備註
1
血液培養瓶-厭氧 血液培養瓶-嗜氧
血液培養
先採厭氧瓶再採嗜氧瓶。
如以翼型採血套組真空採血,因為軟管中有空氣,則先採嗜氧瓶再採厭氧瓶。
無特別規範
深藍頭管 – 藍標
噴霧乾燥K 2EDTA 5 微量元素檢測
深藍頭管 – 紅標
促凝劑 2 藍頭管
檸檬酸鈉 3-4 血液凝固檢測 抗凝劑為液體
無特別規範
ACD 管 檸檬酸及檸檬酸鈉及蔗糖 HLA typing、親子鑑定等特殊血庫檢驗 抗凝劑為液體
3
紅頭管
促凝劑
5 生化血清檢測
塑膠PET 管皆有添加促凝劑,因此要在藍頭管之後採血。
黃頭管(SST) 促凝劑及分離膠 5 4
綠頭管
肝素鋰 肝素鈉 8 生化血漿檢測 特殊檢測
淺綠頭管(PST) 肝素鋰及分離膠 8
5
紫頭管 噴霧乾燥K 2EDTA 8 完整血液學及血庫檢測
6 灰頭管
氟化鈉及草酸鉀 氟化鈉及Na 2EDTA 8 血糖檢測
無特別規範
黑頭管
檸檬酸鈉
5
紅血球沉降速率(ESR)檢測。
真空采血管抽血顺序的原理

真空采血管抽血顺序的原理
真空采血管抽血顺序的原理是基于压力差和颜色编码。
真空采血管的一端是封闭的,在抽血时,插入患者的静脉后解封,采血管内部的负压能够吸引血液自动进入管中。
真空采血管中的负压是由管内的长颈容器中所包含的一种化学物质(多是草酸钠)产生的,在抽血时草酸钠与空气反应,产生二氧化碳,在容器中形成负压。
真空采血管按照不同的颜色进行编码,每种颜色代表了不同的添加剂和抗凝剂,用于特定类型的血液分析。
不同的添加剂可以保护血液成分免受外界污染,并帮助血液保持在正确的状态进行化学分析。
根据需要进行的不同血液检测项目,医生或护士可以选择适当颜色的真空采血管进行抽血。
基于真空原理的采血系统可以实现自动吸取血液,不需要额外施加压力,减少了手动采血过程中对患者的刺激和伤害,同时也能保证采血量和质量的准确性。
真空采血管抽血顺序的编码和使用,保证了抽取血液样本的科学性和可靠性。
真空采血管的抽血顺序

真空采血管的抽血顺序材料真空采血管的材质:采血管多为普通玻璃管和塑料管。
普通玻璃管由于pH值较大,容易引起溶血,而拉管工艺制作的玻璃试管线性沟密布,深浅粗细无常导致细胞挂壁。
塑料真空采血管使用PET塑料,PET塑料管具有:质量轻,便于运输;管壁破损机率极小,标本在运输,离心及试验过程发生泄漏的可能性极小;使用后可直接高压灭菌或焚烧销毁等优点。
好的试管管内壁在注塑时经过特殊的处理,能有效降低血细胞与管壁的粘合度,减少纤维蛋白丝的产生。
添加剂添加剂包括:抗凝剂、促凝剂、缓冲剂、保护剂、内壁处理剂、管口处理剂、分离胶等。
其品种、性能、浓度直接影响血样的性状和检测结果。
常用的有如下几种:1、生化类(1)无添加剂管(红帽):主要用于血清生化(肝功、肾功、心肌酶、淀粉酶等)、电解质(血清钾、钠、氯、钙、磷等)、甲状腺功能、药物检测、艾滋病检测、肿瘤标志物、血清免疫学。
(2)促凝管(桔红帽)一般用于急诊生化。
(3)分离胶管(黄帽)主要用于血清生化(肝功、肾功、心肌酶、淀粉酶等)、电解质(血清钾、钠、氯、钙、磷等)、甲状腺功能、药物检测、艾滋病检测、肿瘤标志物、PCR、TORCH、血清免疫学检测等。
2、抗凝类(1)肝素管(绿帽):适用于做红细胞渗透脆性试验、血气、血浆渗透量、红细胞压积、血沉及普通生化测定。
(2)血常规管(紫帽):用于一般血液学(血常规)检查及血氨检测。
不能用于血凝、微量元素检查。
(3)血凝管(蓝帽):用于纤溶系统(凝血酶原时间、凝血酶时间、活化部分凝血酶时间、纤维蛋白原)。
(4)血沉管(黑帽):一般用于血沉检测。
(5)血糖管(灰色):广泛应用于血糖、糖耐量、红细胞电泳、抗碱血红蛋白、糖溶血等项目的检查。
真空采血管的抽血顺序到底哪个先哪个后?推荐抽血顺序:规范抽血顺序目的是为了保证标本采集质量,减少不同试管间的相互影响。
根据卫生行业标准WS/T225-2002《临床化学检验血液标本的收集与处理》中规定和经验,建议真空采血管采血顺序如下:1、采血针采血顺序血培养瓶(厌氧优先)→无添加剂管(红色,金黄色管)→凝血试管(蓝色)→其它有抗凝剂管(黑-绿-紫-灰)。
真空管采血标准步骤

真空管采血标准步骤1)孕妇准备:采血前应向患者耐心解释,以消除疑虑和恐惧心理。
如个别患者进针时或采血后发生眩晕,应让其平卧休息,找医生进行处理。
2) 检查采血针:静脉采血前要仔细检查包装袋是否漏气,是否在有效期内,针头是否安装牢固,所用针头应锐利、光滑。
3) 核对编码:核对采样包内所有编码是否一致。
4) 消毒双手:七步洗手法5) 消毒:在穿刺点上方6-10cm处扎止血带,先用30g/L碘酊棉签自所选静脉穿刺处从内向外、顺时针方向消毒皮肤,待碘酊挥发后,再用75%乙醇棉签以同样方法拭去碘迹。
6) 采.:左手持干净无菌棉签,大拇指、食指和中指参与绷紧皮肤,右手持针沿静脉走向使针头与皮肤成30°角斜行快速刺人皮肤,然后以5°角向前穿破静脉壁进人静脉腔。
见回血后,将针头顺势探人少许,以免采血时针头滑出;但不可用力深刺,以免造成血肿。
穿刺成功后,右手小指随机适当固定针柄,同时右手大拇指和食指松开并持采血针尾针斜插入真空采血管,采血量为10ml时,松止血带;采血结束,用棉签顺着血管方向轻压穿刺点,快速拔针。
7) 标.混.:轻轻上下颠倒混匀8-10次(很.要),使血液与抗凝剂充分接触。
注意事项1. 抽血时拔掉采血针上连接采血管帽处的橡皮管(CF管的管帽较厚,有些采血针橡皮管不拔掉很难穿透CF管的管帽)2. 抽血时防倒流:CF管含有化学保护剂,使用时谨防化学保护剂倒流!以下操作能防止倒流的发生:--采血时,病人或孕妇的手臂应朝下。
--握住采血管,始终保持采血管的管盖朝上。
--采血时,管内的化学物禁止与管盖或采血针的针尖接触3. 抽血时防止溶血:真空管的负压相对较大,采血初始,血液流入管底速度快,红细胞相互撞击可致破裂,可能造成溶血。
因此可在采集血标本时,倾斜双向采血针采血管的针头,使其靠近采血管侧壁,血液沿管壁缓缓流下,避免红细胞直接撞击造成破裂;4. 样本量不得超过标本管指定容量,过多过少都不可以;(该黑头管的10ML线为黑色皇冠样的图标处,最好采血时等里面负压自然停后再拔针,抽完后目测下标本量大约在9ML以上就算合格,不需要另外再往里面打血,切记不可以直接用注射器往标本管里面注血);5混匀时动作轻柔,不可剧烈震荡。
真空负压采血管的正确使用

真空负压采血管的正确使用一概述真空负压静脉采集血标本是近年来采用的一种新方法,此方法简便易行,使医患双方最大程度避免感染。
1.使用材料:一次性采血针和真空负压采血管。
根据采血化验项目选用不同标记的真空负压采血管采血。
采血原理:负压真空自动抽吸。
2.操作方法:认真核对病人及化验单,向病人解释清楚,取得病人合作。
对神志不清的病人需家属协助固定其抽血部位(常选肘部静脉),扎止血带,消毒,持一次性采血针(前针头)以15~30℃角穿刺静脉,见回血后将采血针尾端(后针头)插入真空管胶塞内,血液自动流入负压管中,真空负压穿刺成功。
在抽各种血标本时,应注意轻轻摇动抗凝管,避免强力振动引起溶血。
在每次换管时,不要用力过猛,以免将采血针拔出血管外。
抽血完毕时,松开止血带,同时反折采血针软管,用消毒棉签压住针眼,拔针,松开采血针软管反折处,待采血针及软管内血液全部进入真空管后,拔出后针头,分离真空管及采血针。
3二临床常用检验项目的标本采集的具体要求(一)血常规检验标本一般用EDTA-2K(EDTA-K2-2H2O)1.5~2.2mg/ml抗凝(EDTA抗凝管)采血。
采血注意事项为:1. 采血后立即上下颠倒混匀(5-10次,不可用力震荡);2. 应按抗凝管刻度准确采血至2ml;3. 采血后应尽快送检(需显微镜观察形态的标本采血后应及时推片固定,因为超过2h WBC形态会发生改变)。
(二)红细胞沉降率(血沉, ESR)测定标本静脉采集枸橼酸钠抗凝血(枸橼酸钠抗凝管采血)。
注意事项:1.采血后立即上下颠倒混合5-10次;2.单独采1管血,准确采血至2ml(抗凝剂:全血 = 1 :4);3.采血后应尽快送检(必须2h内检测)。
(三)凝血检测( PT、APTT 、 TT 、 FBG 、 D—二聚体)标本静脉采集抗凝血(最好真空负压系统采血),抗凝剂用枸橼酸钠(109mmol/L,即32.06g/L,抗凝剂:全血 =1:9)。
采血注意事项:1.空腹采静脉血(餐后脂血影响检测结果,使因子Ⅶ活化,导致PT 延长);2.采血时患者应保持平静状态30min以上(剧烈活动可使因子Ⅷ活化,APTT明显缩短);3.应单独1管血;4.必须准确采血至刻度线2.0ml;5.采血后应立即上下颠倒混匀5-10次,不可有凝块;6.采血后应尽快送检(必须2h内检测)。
一次性真空采血管的使用

一次性真空采血管的使用常识一次性真空采血管已经在临床中得到了广泛的应用,对于医护人员来说,使用它进行静脉抽血方便准确而且减少了血液感染,对于患者来说大大减少了反复穿刺的痛苦。
虽然已被广泛使用,但对于很多医护人员来说,关于一次性真空采血管的常识依然陌生,我将在这里做一简要总结,希望能帮助大家对这一小小的管子有进一步的认识。
一、一次性真空采血管的种类及各自的特性红色(血清试验管)没有添加剂制备标本类型是血清采血量:3-5mL桔黄(分离粒子管)含有促凝剂制备标本类型是血清与上面的红色管相比,管中多了促凝剂和分离粒子,离心后形成屏障,防止细胞内成分释放到血清中红色和橘红色都是用于血清血清生化试验:肝功、血糖、血脂、无机离子、血清蛋白,各种酶类测定;血清学试验:免疫球蛋白、补体、免疫复合物、C反应蛋白、自身抗体、肿瘤免疫、各种病毒检测及血库血糖试验采血量:3-5Ml蓝色(血凝试验管)抗凝剂是%枸橼酸钠制备标本类型是全血采血量:主要用于高铁血红蛋白还原试验、凝血因子纠正试验、凝血四项、D-二聚体测定等血液凝固试验抗凝剂与采血量要准确,采血时应注意采足血量,以保证检验结果的准确性,采血后应立即颠倒混匀5-8次。
紫色(血常规试验管)含有抗凝剂EDTA- 乙二胺四乙酸及其盐乙二胺四乙酸是一种氨基多羧基酸,可以有效地鳌合血液中的钙离子,鳌合钙会将钙从反应点移走将阻止和终止内源性或外源性凝血过程,从而防止血液凝固,与其他抗凝剂比较而言,其对血球的凝集及血细胞的形态影响较小,故通常使用EDTA盐(2K、3K、2Na)作为抗凝剂。
制备标本类型是全血用于一般血液学检查,不能用于血凝、微量元素及PCR检查。
全血红/白细胞、血小板、嗜酸性粒细胞、网织红细胞计数、白细胞分类计数,血红蛋白、红细胞比积、出血时间、凝血时间测定。
抗凝剂与采血量要准确。
采血量:1-2mL黑色(血沉试验管)抗凝剂是%枸橼酸钠制备标本类型是全血一般用于血沉检测,抗凝剂比例过于偏高时,血液被稀释,可使血沉加快。
采血管的正确采血顺序

真空采血管是近几年应用于临床的检验采血新产品,其操作简便、干净安全、抗凝剂比例准确可靠,正为各医院普遍应用。
关于采血管的采血顺序大到全国重点医院,小到城镇民营体检中心,甚至在省级医院的某病房,都存在采血顺序不正确,那些小的医疗机构就更难以规范了,有的医疗单位就因为这“小事情”而引发了不少争议。
采血管采血顺序不规范对检验结果的影响有人做了统计:第一管采集血常规管(紫色)出现了血小板增高者占17.5%,改为第二管采集,血小板增高者降至4.7%,而且增高者与临床相符,正确采集血液标本是获得准确、可靠的实验结果的前提,也体现医疗机构的规范性,所以有必要“小题大做”,把国家标准和国际标准搬出来规范各医疗机构。
各种真空采血管头盖的颜色均为国际通用标准,根据中华人民共和国卫生部医政司《全国临床检验操作规程》、卫生行业WS/T225-2002标准、和美国临床实验室标准化协会CLSI(NCCLS)H3-A5标准、推荐多管采血采集顺序:凝血管(蓝色)→血常规管(紫色)→血沉(褐色)→生化管(红、黄),需要强调的是:血常规管无论如何都要在第二管采集,是与凝血机制有关,有血液培养时血常规为第三管,因为血培养标本的采集要求严格无菌,所以血培养管采血为第一管,所有采血管采完血后都要轻微颠倒1-7次,不能振摇。
只有真正重视分析前的质量控制,才能保证检验结果的准确、可靠。
(学习的目的是增长知识,提高能力,相信一分耕耘一分收获,努力就一定可以获得应有的回报)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
真空采血管抽取顺序
真空采血管分普通管、抗凝管两大类;抗凝管又根据抗凝剂不同分为枸橼酸钠管、乙二胺四乙酸二钾盐或二钠盐(EDTA-K2或EDTA-Na2)管、肝素管等。
普通管:红帽管,带分离胶,用于生化、免疫等检查中无需抗凝的项目检测。
抗凝管:(1)枸橼酸钠:黑帽管用于血沉检查;蓝帽管用于血凝检查。
(2)肝素抗凝:绿帽管,用于血粘度检查。
(3)乙二胺四乙酸(EDTA):紫帽管,用于血常规、糖化血红蛋白、BNP、HLA-B27等检查。
采血顺序:
血培养蓝头管红头管绿头管紫头管
黑头管
注意事项:
(1)静脉穿刺前,必须让消毒部位风干;
(2)抽血至管内真空耗尽,血流便停止,采完血后必须按要求颠倒混匀,使添加
剂与血液充分混合,但不可剧烈晃动以免造成标本溶血;
(3)血量尽量抽足,否则会因标本与添加剂比例不当或仪器自动进样时标本吸取
不足而导致错误结果;
(4)避免在输液同侧采取血样,以免血液被稀释。
