药物合成反应 第五章 重排反应
Hofmann降解(重排)反应及应用

环丙胺的合成
异丙醇
环丙胺是合成环丙沙星等多种高效抗菌药物的重 要中间体,广泛应用于精细化工产品的合成。
对氨基苯甲酸的合成
对氨基苯甲酸是重要的医药和染料中间体, 也用于制备各种醋类和防晒剂等,主要由 对硝基苯甲酸还原制得。
2-硝基-3-氯苯胺的合成
2-硝基-3-氯苯胺是合成药物及精细化学品 的重要中间体,已有的文献是用2-硝基-3氯苯甲酸和叠氮化钠合成的,但叠氮化钠n降解反应
Hofmann降解反应是一个具有广泛应用的 反应,反应一般条件比较温和,产率较高, 副产物较少,因此在有机合成中获得日益 广泛的应用。
酰胺的Hofmann降解反应
氮上无取代基的酰胺与次氯酸钠或次溴酸 钠的碱溶液作用时,脱去羰基生成伯胺, 在反应中使碳链减少一个碳原子,这是霍 夫曼所发现制胺的一个方法,通常称为霍 夫曼降解反应。
反应机理
注意
• 在霍夫曼酰胺降解反应中,重排反应过程 中一定要控制低温,温度控制在零度左右 对反应较为有利,温度太高可造成重排反 应中间产物异氰酸酯不稳定而影响下一步 反应,且温度过高会使次卤酸钠分解,降 低反应速率,温度太低则又使反应速度较 慢,反应时间增长。
应用
N-乙基乙二胺的合成
N-乙基乙二胺是合成许多药物的重要中间体。 如高效、广谱、低毒的抗生素药物氧哌嗪青霉 素、哌拉西林、头孢拉腙、头孢哌酮等的基本 合成原料之一就是N-乙基乙二胺。工艺合理、 污染少、产品质量高的合成路线十分重要。
Fries重排反应

Fries 重排反应摘要:本文从Fries 重排反应的定义、机理、催化条件方面对该反应做了简单的论述,并介绍了该重排反应在有机合成中的应用。
关键字:Fries 重排;机理;条件;应用Fries 重排反应是酚酯在Friedel-Crafts 反应的催化剂或路易斯酸催化下酰基从氧原子上迁移至苯环的邻位或对位,生成邻羟基芳酮和对羟基芳酮的重排反应。
重排可以在硝基苯、硝基甲烷等溶剂中进行,也可以不用溶剂直接加热进行,用硝基苯作溶剂能加速反应[1]。
1.反应的机理Fries 重排的反应机理还不十分清楚。
影响比较大且被广泛接受的机理是该重排属于芳香族亲电重排,迁移基作为亲电试剂进攻芳环,主要得到邻位和对位产物。
催化剂(如AlCl 3)先与酚酯形成络合物,络合物形成后,酚酯溶液呈黄绿色,如果在温度不超过20℃时,立刻进行水解,可定量地得回原来的酚酯。
但在有氢氯酸存在时,能防止水解。
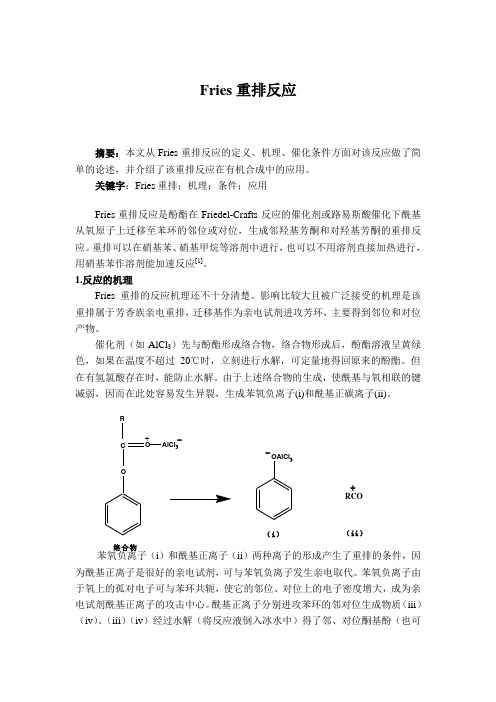
由于上述络合物的生成,使酰基与氧相联的键减弱,因而在此处容易发生异裂,生成苯氧负离子(i)和酰基正碳离子(ii)。
苯氧负离子(i )和酰基正离子(ii )两种离子的形成产生了重排的条件,因为酰基正离子是很好的亲电试剂,可与苯氧负离子发生亲电取代。
苯氧负离子由于氧上的孤对电子可与苯环共轭,使它的邻位、对位上的电子密度增大,成为亲电试剂酰基正离子的攻击中心。
酰基正离子分别进攻苯环的邻对位生成物质(iii )(iv )。
(iii )(iv )经过水解(将反应液倒入冰水中)得了邻、对位酮基酚(也可O C R O +AlCl 3-OAlCl 3- RCO+络合物(i )(ii )叫酚酮)混合产物。
2.反应的条件[2]在反应中,催化剂的选择及反应温度对反应速度、收率、芳酮异构体的比例有很大影响。
2.1 酚酯结构由Fries 重排反应机理,酰基正离子作为亲电试剂,与苯氧负离子发生亲电取代,提高苯氧负离子的电子云密度有利反应的进行。
因此酚酯上苯环带有供电子基有利于重排反应,而吸电子基的存在使芳环钝化,不利于Fries 重排反应。
药物合成反应_第五章_重排反应

重 排
1
(CH3)3C-CH2OH
③烯烃+氢离子
-H2O H+
(CH3)3C-CH2
Wagner-Meerwein
(CH3)3C-CH=CH 2 +
Ag
(CH3)3C-CH-CH3
OCH3
H3C
Cl
④重氮盐放氮 H3C C CH2Cl (CH3)3 C-CH 3NH2 CH 3
重排的顺序:
∨
∨
CH3 CH3
CH2 CH2
莰烯
CH2
TsOH C6H6 H3C
CH3
CH3
CH3
CH2
CH3
CH3
反应机理:
重 排
1
Pinacol
邻二醇类化合物在酸催化下,失去一分子水重排生成醛或酮的反应,称为Pinacol重排。
反应机理:
R1
R2 R3 H C C R4 OHOH
R1
R2 R3 R3 1,2-迁移 C C R4 R1 C C R4 - H OH OHR2
O O OR Br Br Br Br O O O OR
重 排
4
Wolff/Arndt-Eistert
α-重氮酮在银、银盐或铜存在条件下,或用光照射或热分解都消除氮分子而重排为烯酮,
生成的烯酮进一步与羟基或胺类化合物作用得到酯类、酰胺或羧酸的反应称为Wolff重排。
反应机理:
R' C C N N O R
Ph CH3 Ph
Ph CH3 Ph C C CH3
Ac2O/ZnCl2
CH3 C O C Ph
CH3 Ph C O C Ph CH3
C
C
CH3
有机化学中的加成反应和重排反应

有机化学中的加成反应和重排反应在有机化学领域中,加成反应和重排反应是两种重要的反应类型。
它们在有机合成中具有广泛的应用,并对化学品的制备和功能发挥起着关键作用。
本文将详细介绍有机化学中的加成反应和重排反应的原理、机制和应用。
一、加成反应加成反应是指两个或多个分子的化学键断裂,并且新的化学键形成,形成一个较大的分子。
加成反应是有机合成中最基本和最常见的反应类型之一,广泛应用于药物合成、材料制备以及天然产物的合成等领域。
1. 加成反应的机理加成反应可以分为电子亲和性加成和亲核性加成两类。
(1) 电子亲和性加成电子亲和性加成是指一个亲电试剂与一个亲核试剂之间的反应。
亲电试剂通常是具有较高的电子亲和性,如羰基化合物和亚硝酸酯等;亲核试剂通常是具有孤对电子的化学物质,如胺类化合物、卤化物和亚乙醇等。
电子亲和性加成的机理通常经历三个步骤:亲电试剂接近亲核试剂,发生化学键的断裂与形成,生成新的化学物质。
该反应过程中,亲电试剂接受一对电子,亲核试剂提供一对电子,从而形成较稳定的产物。
(2) 亲核性加成亲核性加成是指一个亲核试剂与一个亲电试剂之间的反应。
亲核试剂通常是具有孤对电子或富电子的化学物质,如胺类化合物、有机锂化合物和烯烃等;亲电试剂通常是具有部分正电荷的化学物质,如卤化物、酮类和烯烃等。
亲核性加成的机理通常经历两个步骤:亲核试剂攻击亲电试剂,发生化学键的断裂与形成,生成新的化学物质。
在该反应过程中,亲电试剂失去一对电子,亲核试剂提供一对电子,从而形成较稳定的产物。
2. 加成反应的应用加成反应在有机合成中具有广泛的应用。
以下是一些常见的加成反应及其应用:(1) 羟醛加成反应:通过亲电性的羟醛或酮与亲核试剂反应,生成稳定的醇化合物。
该反应在药物合成和功能分子的构建中起着关键作用。
(2) 二级胺加成反应:通过亲核性的二级胺与亲电试剂反应,生成胺化合物。
该反应在医药领域中广泛用于制备各类有机胺类化合物。
(3) 还原剂加成反应:通过还原剂的亲电性和亲核性的反应,将亲电试剂还原为相应的醇、酮或胺化合物。
药物合成反应(全)

O
O
C2H5 C2H5
NH ONa
HCl
C2H5
NH
C2H5
NH O
NH
O
O
盐酸普鲁卡因(ProcaineHydrochloride)的合成
➢ 盐酸普鲁卡因为局部麻醉药,作用强,毒性低 ➢ 临床上主要用于浸润、脊椎及传导麻醉 ➢ 化学名为对氨基苯甲酸2-二乙胺基乙酯盐酸盐 ➢ 化学结构式为:
H2N
化学选择性 化学选择性
区域选择性
化学选择性
我国抗癌药物紫杉醇合成成功
文章来源: 健康报
第四军医大学化学教研室张生勇教授课题组经过9年攻关, 在国内首次利用手性催化技术合成出抗癌药物紫杉醇。
紫杉醇和多烯紫杉醇是高效、低毒、广谱的抗癌药,广 泛用于治疗乳腺癌、卵巢癌、子宫癌等妇科肿瘤,对于某些 晚期肿瘤也有明显疗效。
Br2 CH3 COOH
P
O BrCH2 C-Br
X
溴乙酰溴
Br2 PCl3
BrCH2COOH
NH3 NH2-CH2COOH
第三节 醇、醚的卤素置换反应
一、醇的卤素置换反应
1 与HX反应 HI﹥HBr﹥HCl﹥HF 叔﹥仲﹥伯
2 与氯化亚砜、氯化砜的反应
S O2Cl
o C2O H H P y
o C2C H l
1S,2S (+)
仅1R,2R(-)型有抗菌活性, 临床使用
合成路线如下
O2N
Br2 , C6H5Cl COCH3
O2N
COCH2Br (CH2)6N4 , C6H5Cl O2N
COCH2Br(CH2)6N4
C2H5OH HCl , H2O O2N
(CH3CO)2O COCH2NH2 . HCl CH3COONa O2N
药物合成反应》课程教学大纲

[教学目的及要求]
[了解]
1. 了解卤化反应的定义。
2. 卤素对烯烃的加成。
3. 卤代反应新试剂。
[熟悉]
1. 药物合成反应课程教授内容
2. 熟悉其它官能团化合物的卤置换反应
[掌握]
1.不饱和烃卤加成反应的立体化学及常用的卤化剂。
2.烃类、羰基化合物的卤取代反应的特点、反应类型及立体化学。
3.醇、酚、醚及羧酸的卤置换反应中常用的卤化剂、反应条件及应用特点。
[教学内容]
卤化反应:
1.不饱和烃的卤加成反应
2. 烃类的卤取代反应
3. 羰基化合物的卤取代反应
4. 醇、酚和醚的卤置换反应
5. 羧酸的卤置换反应
6. 其他官能团化合物的卤置换反应
[教学重点]
2. 氮原子上的酰化反应
3. 碳原子上的酰化反应
4. 有机金属化合物在C-酰化中的应用
[教学重点]
1.酰化反应的机理及常用酰化剂类型。
2.醇、酚羟基及氨基保护中常用的保护基以及在药物合成中保护基对选择性反应的重要性。
[教学难点]
1. 反应条件对酰化反应的影响
0.5
第七节
胺的氧化反应
0.3
第八节
其他氧化发应
0.2
第七章
还原反应
6 Βιβλιοθήκη 第一节 还原反应机理
1.5
第二节
不饱和烃的还原
1.5
第三节
羰基的还原反应。
1.0
第四节
羧酸及其衍生物的还原反应
[教学目的及要求]
1.了解烃化反应的定义、类型及其在药物合成中的重要性。
药物合成反应第五章 重排反应

重排反应中键的裂解和形成方式: 异裂(离子型) 均裂(游离基型) 环状过渡态(σ键迁移型)
离子型重排反应: 1.阴离子型重排(亲核重排)
C— A— Y Z -Y C— A Z C— A — Z
2.阳离子型重排(亲电重排)
X— B— C Y -Y X— B— C B— C X
3.游离基型重排反应: 重排反应中间体呈游离基状态
O
O COEt
*
5 0%
COEt
+ *
5 0%
*
O Ar X R
M eO Ar M eO H
OR X
-X
-
OAr R
O M eO Ar R
-
R Ar C O 2M e
M eO H
R Ar C O 2M e
• 碳负离子缺少共振稳定时 • 卤代酮羰基无可烯醇化的氢时 • 二卤代酮时
五 、Wolff(沃尔夫)重排 和Arndt-Eistert (阿恩特-埃斯特尔特)
例:
C 2H 5 C C 2H 5 Br CONH2 N a O Br H 2O
C 2H 5 C 2H 5 C O
(3)构型保持
Ph H2 H * C O N H B r 2 /N a O H C C 2 CH3 Ph H2 H * C C NH2 CH3
(4)当酰胺分子的适当位置有羟基、氨基存在时, 可以分子内成环。
HO HNO2
CH2 O
O HBr Cl C Ph C H Ph
A g N O 2 /E tO H Cl
O C
H C
Ph Ph
HO
Ph SPh
O Ph
HO O
CH3 Ph
Ph
O CH3
药物合成考试题及答案

第一章卤化反应试题一.填空题;每空2分共20分1.2Cl和2Br与烯烃加成属于亲电亲电or亲核加成反应,其过渡态可能有两种形式:①桥型卤正离子②开放式碳正离子2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用浓HCl 或 HCl 气体;而伯醇常用LUCas进行氯置换反应;3.双键上有苯基取代时,同向加成产物增多{增多,减少,不变},烯烃与卤素反应以对向加成机理为主;4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为HI>HBr>HCl烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为RCH=CH2>CH2=CH2>CH2=CHCl5写出此反应的反应条件----------------- NBS/CCl hv,4hPh3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题;10分1.下列反应正确的是BA.B.C.(CH 3)3HC H 2C HCl (CH 3)3C C H CH 3ClD.Ph 3C CH CH 22CCl 4/r,t.48h3CHC Br CH 2Br2.下列哪些反应属于SN1亲核取代历程 A A .(CH 3)2CHBr +H 2O(CH 3)2CHOH +HBrB .CH 2I +CH 2CNNaCN+NaIC. NH 3+CH 3CH 2ICH 3CH 3NH 4+ID.CH 3CH(OH)CHCICH 3+CH 3C H OC H CH 3CH 3ONa3.下列说法正确的是AA 、次卤酸新鲜制备后立即使用.B 、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C 、次卤酸酯为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D 、最常用的次卤酸酯: 次氯酸叔丁酯 CH33COCl 是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是DA.RCOOH RCOCl + H 3PO 3PCl 3B.RCOOH RCOCl + SO 2 + HCl SOCl 2C.N HCOOHN HCOOC 2H 5C 2H 5OH, H 2SO 4D.5、N-溴代乙酰胺的简称是C A 、NSB B 、NBA C 、NBS D 、NCS三.补充下列反应方程式40分1OEtO t -BuOCl / EtOH-55~0℃OEtOCl OEt .2.CH 3(CH 2)2CH 2CH=CHCH 3NBS / (PhCO)2O 24CH 3(CH 2)2CHCH=CHCH 3Br3.4. 5. 6. 7. 8. 9. 10.四.简答题20分1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物;BrNO 2BrHNO 3 / H 2SO 4BrBrC.H2CH2COCH3参考答案:酸、碱催化羰基α-卤代机理如下:对于酸催化α-卤代反应,在α-位引入吸电子基卤素后,烯醇化受到阻滞,进一步卤化反应相对比较困难;对于碱催化情况下α-位吸电子基有利于α-氢脱去而促进反应五.设计题10分1.设计合理简易路线合成下列药物中间体:参考答案:综合试题一选择题10题,每题3分,共30分1 卤代烃为烃化试剂,当烃基相同时不同卤代烃的活性次序是DA RCl<RF<RBr<RIB RF < RBr < RI < RClC RF > RCl > RBr > RID RF <RCl < RBr < RI2烃化反应是用烃基取代有机分子中的氢原子,在下列各有机物中,常用的被烃化物有D1醇 2酚 3胺类 4活性亚甲基 5芳烃A125 B345 C1234 D123453不可以作为醇的氧烃化反应烃化剂的是C4 .以下四种亚甲基化合物活性顺序正确的是B5 下列关于环氧乙烷为烃化剂的羟乙基化反应的说法中,正确的是CA酸催化为双分子亲核取代B碱催化为单分子亲核取代C酸催化,取代反应发生在取代较多的碳原子上D碱催化,取代反应发生在取代较多的碳原子上6 下列关于活性亚甲基化合物引入烃基的次序的说法,正确的是A1如果引入两个伯烃基,应先引入大的基团2如果引入两个伯烃基,应先引入小的基团3如果引入一个伯烃基和一个仲烃基,应先引入伯烃基4如果引入一个伯烃基和一个仲烃基,应先引入仲烃基A 13 B24 C14 D237 卤代烃与环六甲基四胺反应的季铵盐,然后水解得到伯胺,此反应成为BA Williamson反应B Delepine 反应C Gabriel反应D Ullmann反应8 下列各物质都属于相转移催化剂的一项是Ca 二氧六环b三乙基苄基溴化铵c冠醚d甲苯e非环多胺类 f NBSA aceB bdfC bceD adf9 NH3与下列哪种有机物反应最易进行B10 下列有关说法,正确的是 A1乌尔曼反应合成不对称二苯胺2傅科烃基化反应是碳负离子对芳环的亲核进攻3常用路易斯酸作为傅科烃基化反应的催化剂,活性顺序是Acl3>FeCl3>SnCl4>TiCl4>EnCl2 4最常用的烃化剂为卤代烃和硫酸酯类 A 13 B 24 C 12 D 34二 完成下列反应15题,每空2分,共30分1 2 3 4 5 6 7 8 9 10+NClClOCH 3N ClNHOCH 3Et 2N(CH 2)3CHCH 3CH 3Et 2N(CH 2)3CH 2NH 2PhOH 110℃, 4h11 12 13 14 15三 机理题2题,共12分1 在酸催化下,环氧乙烷为烃化剂的反应的机理属于单分子亲核取代,试写出其过程;2 活性亚甲基C-烃基化反应属于SN2机理,以乙酰乙酸乙酯与1-溴丁烷反应为例,写出其过程;四 合成题 2题,共22分1 以2ClF乙酰乙酸乙酯为原料合成非甾体抗炎药舒林酸中间体3—4—氟苯基—2—甲基丙酸;2 以1,4—二溴戊烷为原料,利用Gabriel 反应合成抗疟药伯胺喹还原反应一.选择题;1. 以下哪种物质的还原活性最高 BA.酯B.酰卤C.酸酐D.羧酸2.还原反应HOOC(CH2)4COOEt2BH3/THF ℃,10h—————— ACH24COOEt CH24CH2OH CH2CH2OH CH24CHO3.下列还原剂能将C OOH 还原成—CH 2OH 的是AA LiAlH 4B LiBH 4C NaBH 4D KBH 4 4. 下列反应正确的是BANO 2NH 2HCl/TolNH 2NH 2BCNKBH /PdCl/MeOHr.t.CH 2NH 2CNO 2COOHNH 2CH 2OHDCl CO(CH 3)2ClCH 25. 下列反应完全正确的是A A、CNO 2OCH 3CHCH 3OHNO 2B、CH EtOHNO 2COCHOHCH3NO 2C、COCH 3CH 3CHNH 2D、COORNO 2CH 2OH6、下列不同官能团氢化反应难易顺序正确的是ACORCOHRR-NO 2R-NH 2C CR'CCR R'A 、;B 、;C 、;D 、;7. 以下选项中,化合物CNNO 2在C 2H 6的温和条件下反应的产物是C ,在Fe 粉中的反应产物是 A ;A B C D8.下列物质不适用于Clemmemsen 还原的是CA.OHCO CH 3B.CHCHCOOC 2H 5C. O CHOD. H3CCCOOC2H5O.下列物质不适用于黄鸣龙法的是BA. H3C CCOOC2H5OB.COC. N COCH3D. OCH2CCH3O9.用Brich还原法还原CH2CH3得到的产物是AA. CH2CH3B.CH2CH3C. CH2CH3D.CH2CH310.用还原CH3CH2COOC2H5得到的是C 二.填空题;1、 黄鸣龙还原反应所需的环境是 碱性 酸性,碱性2、将下列酰胺的还原速度由大到小排列为:1a N,N-二取代酰胺b 未取代的酰胺c N-单取代酰胺 a>c>b 2、 a 脂肪族酰胺 b 芳香族酰胺 a>b3、α-取代环己酮还原时,若取代基R 的体积增大,产物中 顺 顺,反式异构体的含量增加;4、下列a BH 3、b BH 3 n-BuCH 2CH 2BH 2、c n-BuCH 2CH 22BH 三种物质的还原性顺序为: a>b>c5、羧酸被BH 3/THF 还原得到的最终产物为 醇 醇,烷 二.完成下列反应; 1.CH 2CH 3H 3CO主要产物2.CON(CH 3)2ClCHO3. 4.CH 3CH=CHCHOCH 3CH=CHCH 2OH5.H 3COH 3COH 3COCOCl硫H 3COH 3COH 3COCHO6.NO 2CCH 3ONO 2CHCH 3OH7.COCH 3HCOONH H 3CNH 28.COCH 2CH 2Ph PhCH 2CH 2CH 2COOH9.NO 2CON(CH 3)2NO 2CH 2N(CH 3)2B 2H 6 / THF10.O 2NC HNOH O 2N CH 2NH 2B 2H 6/(CH 3OCH 2CH 2)2O三.以给定原料合成目标产物.1.COOHCOCOOHCOOH2NC OClO 2NCOO 2NH 2NC HOH2. 由NCH 2CH 2CH 2NH 2OO3.答案:4. 写出由制备CH 2CH 2CH 3NO 2的反应路径酰化反应考试题一. 选择题本题共有六小题,每小题3分,共18分1. 氧原子的酰化反应中常用的酰化试剂不包括 C ;A.羧酸B.酸酐C.醇D.酰胺2.酰化剂的烃基中有芳基取代时, 可以发生分子内的酰化得到环酮, 其反应难易与形成环的大小有关,下列排列顺序正确的是 B ;A .六元环>七元环>五元环B .六元环>五元环>七元环C .五元环>七元环>六元环D .七元环>六元环>五元环3. 醇的酰化常采用羧酸酯为酰化剂,下列不属于羧酸酯的是A.羧酸硫酸酯B.羧酸吡啶酯C. 羧酸三硝基苯D. 羧酸异丙烯酯4.在和乙酸酐的反应中,以三氟化硼为催化剂,则反应产物是A. B.C. D.三者都有5. 6.下列物质最易发生酰化反应的是_C _;A 、RCOORB 、 RCORC 、 RCOXD 、 RCO 2O二.填空题本题共有六小题,每小题3分,共18分1. 醇的O-酰化一般规律是_醇易于反应,_醇次之,_醇最难酰化;伯,仲,叔2. 氧原子上的酰化反应又称__;酯化反应3. 扑热息痛的合成,乙酰基化反应; 4.5. 6.CH 2OHHONH 2OH CH 3C O O CCH 3O( )C OClNH 2C OClNHCOCH 2Cl三.完成下列方程式本题共六个小题,每小题4分,共24分1. 2. 3. 4.5. 6.四.写出下列反应机理本题共两个小题,每题10分,共20分 1..完成反应式并简述机理:原理: 答案:2.请写出羧酸与醇反应生成酯的反应机理通式;答:五.完成下列合成反应本题共两个小题,每小题10分,共20分1.以甲苯为起始原料合成 α-氰基-α-苯基乙酸乙酯其他无机原料任选,有机原料不大于5个碳:参考答案:2 O H O C H 2 C 6 H 51:1氨 苄 西 林 中 间 体COCH 3COCH 3ClCl 2Fe or FeCl 3CH 3COCl32.以水杨酸和对氨基酚为原料,合成解热镇痛药贝诺酯的中间体即:第六章 氧化反应试题 一、填空题1、硝酸铈铵是一种很好的氧化试剂,它的化学式是 NH 42CeNO 362、铬酸是一种重要的氧化试剂,浓溶液中铬酸主要以 的形式存在,稀溶液中以 为主,铬酸的酸酐是 ;重铬酸根 铬酸 三氧化铬3、1,2-二醇用 氧化可得顺式邻二醇,1,3-二醇用 氧化可得β-酮醇. 过碘酸 碳酸银4. 补全反应C CH 3CH 3CH CH 2CH 2CH 3SeO 2AcOH,此反应遵循MnO 2选择性氧化的哪一规则HCH 2CH 2CH 3HOH 2CH 3C首先氧化双键取代基较多一边的烯丙位烃基,并且总是以E-烯丙基醇或醛为主; 二、选择题1、下列哪种物质不可使 OH氧化成C OOHA. 铬酸B. 高锰酸钾C. 二氧化锰D.硝酸 2、已知反应产物有RCHO,HCO 2H 反应物与HIO 4 的用量之比为1:2的关系,则反应物的分子式可能为A: B: C: D: 3、下列氧化物只能将醇氧化成醛而不能氧化成羧酸的是py 24、下列物质烯键环氧化速率的先后顺序为OHCOOHHONH 2ONHCOCH 3OCOCH 3CO①Br② CH 3CH 3 ③④CH 3A. ①②③④B. ④③①②C. ②④③①D. ①③④②5、下列能将CH 2CH 3氧化成酯的是A .KMnO 4/NaOH 100%AcOH C. CAN/HNO 36、环烷氧化反应中烃的碳氢键反应活性的顺序A.叔>仲>伯B.伯>仲>叔C.叔>伯>仲D.仲>伯>叔7、反应CH 2CH 2OHHOH 2CMnO2回流的产物是A .CH 2CHOHOH 2CB. CH 2CH 2OHOHCC. CH 2CHOOHCD. A 和B8、用过氧酸氧化得到的主要产物是A BCCOOH COOHDCAACB ABB三、完成下列反应方程式 1、1____ CH 3CH 3CANCAN0高温____2、3、4、CO NO 25、2Zn/H O+6、PhO OMe7、PhO NO 28、CAN/HNO 3____三、综合题1.用不超过5个碳的有机物合成OHC OHCOCOOCH 3COOCH 3;提示:OO OO +2、以为原料合成C 2H 5O第五章 重排反应试题组长:侯婷组成员:蔡进,鲍艳丽,段凉星,陈乾乾,龚曾豪,郭莘莘,何龙,黄军涛,金杨巧,李传龙,李雪,李娜 一、填空题每空2分,共30分1、按反应机理重排反应可分为_________、_________、____________; 亲核重排,亲电重排、自由基重排2、若取代基不相同,则一般在重排反应中何种取代基迁移取决于___________和_____________; 取代基迁移能力的大小,碳正离子的稳定性3、.重排可以制备多一个碳的羧酸___________重排可以制备少一个碳的羧酸___________①Wolf 重排,②Arndt-Eistert 重排③Benkman 重排,④Hofmann 重排②,④4、霍夫曼重排反应时,当酰胺的 a 碳有手性,重排后构型_________变,不变5、叶立德指的是一类在________原子上有_______电荷的中性分子; 相邻,相反6、写出Beckmann 重排的催化剂,质子酸_______,非质子酸____________;每空两个以上即可质子酸H+ ,H2SO4 , HCl, H3PO4非质子酸PCl5, SOCl2, TsCl, AlCl37、 醛肟或酮肟在酸性催化下重排生成取代酰胺时,一般处于肟羟基____位的基因易于迁移反 8、电化学诱导Hofmann 重排是近期的新方法,其特点是在___________条件下,在不同____ 组成的新溶剂系统中反应,顺利得到重排产物; 中性温和 醇二、选择题每题2分,共10分 1、(CH 3)3C-CH 2Cl(CH 3)3C-CH 2Ag (AgNO 3)CH=CHCOCH 3CHO+ CH 3COCH 3NaOH以上四个方程式分别属于AA wangner_meerwein, banger_villiger,beckman, FavorskiiB wangner_meerwein, beckman, banger_villiger, FavorskiiC beckman banger_villiger wangner_meerwein, CurtiusD banger_villiger beckman wangner_meerwein ,Curtius.2、在Beckman重排反应中酸催化剂的作用为CA.防止异构化B.活化与氮相连的碳上的迁移集团,利于集团迁移C.使肟羟基转变成活性离去基团,利于氮-氧键断裂D.加速重排3、Curtius 反应中先加热后水解的终产物是C4、Wangner-Meerwein重排是醇或卤代烃等在酸催化下生成碳正离子而发生的重排,则按迁移能力从小到大顺序排列下列迁移基团AA①④⑧②③⑤⑦⑥B①④⑧⑤⑦⑥②③C②③⑤⑥⑦①④⑧D②③⑤⑦⑥①④⑧5、频那醇重排中,下列基团的迁移能力排列正确的是C①含推电子取代基的芳环、②含吸电子取代基的芳环③苯基④含间、对位推电子基的芳环⑤含邻位推电子取代基的芳环A①>②>③, ④>⑤B①>②>③, ⑤>④C①>③>②, ④>⑤D①>③>②, ⑤>④三、写出下列反应产物每题3分,共30分1、CCH3CH2ClH3CAg+H3C C CHCH32、OH OHO0.2mol/L SnCl4 / CH(OMe)33、OHCH2NH2NaNO2/HH3CH3C4、OCH 3OCH 3CONH 2OCH 3OCH 3NH 25、O O HOCOOH KOH/H 2O6、OClNaOH, H 2OCOOH7、8、OCH3NHOCH 39、CH 3CH 2OCH 3RLiCHOHH 3C H 3C10、CCH 3O OCO CH 3653四、解释机理第一题5分,第二题10分1、C OH 3C NH 2NH 2解释:2、解释下面反应机理,为什么产物是上面的,而不是下面的别写出上面反应式的反应机理解释:重排反应主要取决于羟基失去后,所生成碳正离子的稳定性;在该反应中,并非甲基的迁移能力比苯基大,而是与两苯基共轭的碳正离子较于两甲基共轭的碳正离子稳定,致使两烃基的脱去机会不均等,因而只有甲基迁移; 反应机理:五、综合题第一题,每空1分,共5分;第二题5分,第三题10分1、芝麻酚,O O又名3,4-亚甲二氧基苯酚,是芝麻油的重要的香气成分,也是芝麻油重要的品质稳定剂;芝麻酚具有非常将的抗氧化能力,常用于食品、医药的抗氧化剂,同时它更是合成抗高血压药物、心血管药物的重要的起始原料,同时也是农药胡椒基丁基醚的原料;目前芝麻酚在国际上非常紧俏,尤其是药物合成领域的需求量很大;以下为芝麻酚的一种合成方法,完成下列题目;1 请写出1、2 有机物的结构简式2写出反应一、反应二的反应类型重排反应标明是哪种重排 3写出反应条件中A 代表的试剂的化学式12酰化反应 Bayer-Villiger 重排反应 32、用适当方法完成OCH 3扑热息痛Beckmann 重排:3、试用OCH 3 及其他无机原料合成OCH 3()2C OH COOH 利用重排反应第一步OCH 3(CH 3)2NCHO, POCl 3CHO OCH 3或 第二步第三步。
第五章-重排反应

二、 Pinacol重排
(邻二醇或邻二官能团合成醛酮的方法)
药 学 院 药 物 合 成 反 应
定义:在酸催化下,邻二叔醇失去一分子水, 重排成醛或酮的反应称Pinacol重排。
R1发生1,2-迁移
1
2
1
2
邻二醇
羰基类化合物
13
二、 Pinacol重排
反应机理:
(☆☆☆☆☆)
邻二醇
不对称的质子化酮
RCONH2 + NaOBr R N C O H2O RNH2
机理:
R C NH2 O OH Br2 R C NHBr O R N C O
R C N Br O
• 供电性R速度快于 吸电性R • 重排后R保留原来 手性
40
H2O/OH
RNH2 + CO3
2
36
15
二、 Pinacol重排 2、影响因素
i. 碳正离子稳定性的影响
ii. 立体化学因素的影响
iii.迁移基团迁移能力的影响
iv.反应条件的影响
16
i. 碳正离子稳定性的影响
关键:不对称连二醇类化合物重排的方向决定于羟基失去后,所 生成碳正离子的稳定性,通常与基团迁移能力的大小无关 。
不对称的邻二醇
OH COOH O
29
4)Favorski 卤化酮重排 法沃尔斯基重排
(☆☆☆)
定义: -卤代酮在亲核碱(NaOH, RONa等)条件下,发生重排,α-基团迁移到 卤素位置,得到羧酸盐、酯或酰胺的反应称为Favorski卤化酮重排反应。
R EtONa/EtOH O C X C CH3 NaOH R R C COOEt α-卤代酮的反应 COOH
药物合成反应(全) PPT

H2N
COOCH2CH2N(C2H5)2 . HCl
二氢吡啶钙离子拮抗剂的合成
➢ 具有很强的扩血管作用,适用于冠脉痉挛、高血压、 心肌梗死等症。
➢ 本品化学名为1,4-二氢-2,6-二甲基-4-2-硝基苯基)-吡
啶-3,5-二羧酸二乙酯
NO2
➢ 化学结构式为:
CH 3CH 2OOC
COOCH 2CH 3
药物合成反应(全) PPT
药物合成反应教学内容
绪论 第1章 卤化反应 第2章 烃化反应 第3章 缩合反应 第4章 氧化反应 第5章 还原反应 第6章 重排反应 第7章 官能团保护反应 第8章 药物合成反应路线设计
Chapter 1 概论
水杨酰苯胺(Salicylanilide)的合成
➢ 水杨酸类解热镇痛药 ➢ 用于发热、头痛、神经痛、关节痛及活动性风湿症 ➢ 作用较阿司匹林强,副作用小 ➢ 化学名为邻羟基苯甲酰苯胺 ➢ 化学结构式为:
巴比妥(Barbital)的合成
➢ 巴比妥为长时间作用的催眠药。 ➢ 主要用于神经过度兴奋、狂躁或忧虑引起的失眠。 ➢ 学名为5,5-二乙基巴比妥酸,化学结构式为:
O
C2H 5 C2H 5
O
NH O
NH
合成路线如下
H2C
COOC2H5
COOC2H5+C2H5Br
C2H5ONa
C2H5 C2H5
C
CONH
OH
合成路线如下:
OH
OH
COOH
+
PCl3
OH COO
OH COO
NH2
+
CONH OH
苯妥英钠(PHenytoin Sodium)的合成
《药物合成反应(闻韧主编第三版)》人名反应整理(新)

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
Fries重排反应
Fries 重排反应摘要:本文从Fries 重排反应的定义、机理、催化条件方面对该反应做了简单的论述,并介绍了该重排反应在有机合成中的应用。
关键字:Fries 重排;机理;条件;应用Fries 重排反应是酚酯在Friedel-Crafts 反应的催化剂或路易斯酸催化下酰基从氧原子上迁移至苯环的邻位或对位,生成邻羟基芳酮和对羟基芳酮的重排反应。
重排可以在硝基苯、硝基甲烷等溶剂中进行,也可以不用溶剂直接加热进行,用硝基苯作溶剂能加速反应[1]。
1.反应的机理Fries 重排的反应机理还不十分清楚。
影响比较大且被广泛接受的机理是该重排属于芳香族亲电重排,迁移基作为亲电试剂进攻芳环,主要得到邻位和对位产物。
催化剂(如AlCl 3)先与酚酯形成络合物,络合物形成后,酚酯溶液呈黄绿色,如果在温度不超过20℃时,立刻进行水解,可定量地得回原来的酚酯。
但在有氢氯酸存在时,能防止水解。
由于上述络合物的生成,使酰基与氧相联的键减弱,因而在此处容易发生异裂,生成苯氧负离子(i)和酰基正碳离子(ii)。
苯氧负离子(i )和酰基正离子(ii )两种离子的形成产生了重排的条件,因为酰基正离子是很好的亲电试剂,可与苯氧负离子发生亲电取代。
苯氧负离子由于氧上的孤对电子可与苯环共轭,使它的邻位、对位上的电子密度增大,成为亲电试剂酰基正离子的攻击中心。
酰基正离子分别进攻苯环的邻对位生成物质(iii )(iv )。
(iii )(iv )经过水解(将反应液倒入冰水中)得了邻、对位酮基酚(也可O C R O +AlCl 3-OAlCl 3- RCO+络合物(i )(ii )叫酚酮)混合产物。
2.反应的条件[2]在反应中,催化剂的选择及反应温度对反应速度、收率、芳酮异构体的比例有很大影响。
2.1 酚酯结构由Fries 重排反应机理,酰基正离子作为亲电试剂,与苯氧负离子发生亲电取代,提高苯氧负离子的电子云密度有利反应的进行。
因此酚酯上苯环带有供电子基有利于重排反应,而吸电子基的存在使芳环钝化,不利于Fries 重排反应。
药物合成反应复习题

第一章卤化反应1 卤化反应在有机合成中的应用?为什么常用一些卤代物作为反应中间体?2 归纳下常用的氯化剂、溴化剂都有哪些?它们的主要理化性质及应用范围?3 根据反应历程的不同,讨论一下卤化反应的类型、机理及对反应的影响。
(1)卤素对双键的离子型加成(2)芳香环上的取代(3)方向化合物侧链上的取代(4)卤化氢对醇羟基的置换(5)NBS 的取代反应4 比较X2、HX 、HOX 对双键的离子型加成反应的机理又何异同点。
怎样判断加成方向5 在-OH 得置换反应中各种卤化剂各有何特点?他们的应用范围如何?6 预测Br2/CCl4 于下列各种烯烃进行溴化反应的相对速度的次序。
CH2=CH2 (CH3)2C=CH2 HOOC-CH=CH-COOH (CH3)2C=C(CH3)2 CH3CH2=CH2 CH2=CH-CN7 对比下列反应的条件有何不同?结合反应机理加以说明:H3C CH2 CH 2Br(1)H3C CH CH 2H3C CHBr CH 3CH 3Cl CH 3(2)CH 2ClRH 2C CH CH 2(3) R H 2C CH CH 2BrRH 2C C CH 2OH8 下列反应选用何种氯化剂为好?说明原因。
(1) H3C C CH CH3 H3CC CH CH 2BrCH 3 CH 3(2)H3 C HC CH COOH H3C HC CH COCl(3) HO (CH 2 )6 OH IH2C(CH 2)4 CH 2 OH(4) H3CCO C H 2CH 2 COOH H3 CCO CH2CHCOBrBr(5) H3 CO CH2 OHH3CO CH 2 ClH2C C (CH 2 )6 COOHCl(6)H2 C HC (CH 2)6 COOHBr H2C (CH 2)6 COOHCOOHCOOHCOCl(7)Cl Cl HO OHNCl Cl NNCOClHO OHN9 完成下列反应,写出主要的试剂及反应条件:OHOH(1)COOH COClCH 3 CF3(2)(3) CH3COOHFXH2COOH(4) O COOH O I10 完成下列反应,写出其主要生成物(1) H3C C CHCH3Ca(OCl) 2/HOAc/H 2OH3C(2)HC CH2NBS/H 2O(3) CH3 C CH 2HBr/Bz2O2(4) OH 48%HBr(5) C H 2CH=CHCH2CH=CHBrCH 2=CH-COO-CH-CH 2 1molBr2/CCl4(CH 3)2C=CHCH 2CH=CH 2第二章烃化反应一烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?二用卤代烃对氨基和羟基的烃化反应各有何特点?烃化剂及被烃化物的结构对反应有何影响?三用于制备较纯的伯胺的方法有那几种?四举例说明“还原烃化”、“羟乙基化”的机理、特点及反应中的注意事项。
Favorskii重排反应

反应举例
1994年,H. Takeshita等人利用Diels-Alder环加成、Favorskii重排和[2π+2π]光环加成等关键性步骤 完成了六环笼状化合物hexacyclo[6.4.2.02,7.03,11.06,10.09,12]tetradecene的全合成。 桥头α-卤代酮 的Favorskii重排以88%的产率制备得到相应的桥头羧酸。接着,将酸转化为相应的过氧化叔丁酯,随后将其光环 化。最后一步是将过氧化叔丁酯在对二异丙基苯中在150°C下加热2小时来去除桥头羧酸官能团。
1971年,Wenkert, E.等人发现,不仅是α-卤代酮可以发生Favorskii重排反应,β-卤代酮经过一个四元 环中间体重排也可以发生类似于Favorskii重排反应,他们将其称为同型Favorskii重排反应(Homo-Favorskii rearrangement)。
反应内容
定义
反应特征
反应机理
Favorskii重排反应的反应机理为:首先在氯原子另一侧形成烯醇负离子,负离子进攻另一侧的碳原子,氯 离子离去,形成一个环丙酮中间体。受亲核试剂进攻,羰基打开,打开三元环,得到羧基邻位的碳负离子,最后 获得一个质子得到产物。
Favorskiபைடு நூலகம்重排反应机理
意义价值
Favorskii重排反应提供了一种制备多支链羧酸及其衍生物的重要方法,也可以通过该反应进行缩环反应, 制备出比α卤代环酮少一个碳的环状羧酸衍生物。该反应产率通常较高,由于经过环状中间体结构,化学选择性 和立体选择性均较高,在有机合成,药物研发,新材料制备方面有着广阔的应用。 例如,甾体激素类药物氢化 可的松的合成,其中一步关键性的步骤就涉及到Favorskii重排反应。
第五章 有机药物合成路线设计

(2)切断,连接和重排
A.切断(disconnection,简称dis):是人 为地将某化学键断裂,从而将目标分子骨架 拆分为两个或两个以上合成碎片的一种转化 方法。 dis “切断”通常以符号( )表示。
CN dis CH2 CN
+
CH2 CH2
B.连接(connection,简称con):是把目 标分子中两个适当的碳原子连接起来,使之 形成新的化学键,获得便于进一步拆分的合 成元的方法。 con “连接”通常以符号( )表示,如:
CHO CHO
con
C.重排(rearrangement,简称rearr):是 按重排反应的反方向将目标分子拆开或重新 组装,以简化目标分子的方法。 rearr 通常以符号( )表示,如:
OH O rearr NH N
(3)官能团转化:
是在不改变目标分子骨架的前提下变换官能 团的类型或位置,以此来简化目标分子。一 般有下面3种方式: A 官能团互换(functional group interconversion,简称FGI)是指在反合成分析 中,只涉及官能团的变化而没有碳骨架的改 变的切断。如
1.醇及其衍生物的单基团切断
(1)1,1–C–C切断 1,1–C–C切断是指与官能团相连的碳(1位) 进行C–C切断。 TM1
H3C 2 CH3 1 HO CH3 1 , 1 -C-C
CH2
H3C = H3C MgBr O H3C CH3
H3C H3C
H3C
+
CH3 =
+
C HO
CH3
O OEt C- O
OEt
重排反应——精选推荐

重排反应7 重排反应重排反应指同⼀分⼦内,某⼀原⼦或基团从⼀个原⼦迁移到另⼀个原⼦形成新的分⼦的反应。
利⽤重排常常可以合成⽤其它⽅法难以合成的物质。
其反应机理不外乎亲核、亲电和⾃由基⼏种。
按其迁移的⽅式⼤致可分为从碳原⼦到碳原⼦的重排、从碳原⼦到杂原⼦的重排以及从杂原⼦到碳原⼦的重排等⼏种。
7.1从碳原⼦到碳原⼦的重排从碳原⼦到碳原⼦的重排使碳⾻架发⽣变化。
其中典型的重排包括亲核1,2-重排和亲电1,2-重排。
前者包括Wagner-Meerwein重排和Pinacol重排;后者包括Wolf和Arndt-Eistert重排等。
7.1.1Wagner-Meerwein重排在质⼦酸或Lewis酸催化下形成的碳正离⼦中,烷基、芳基或氢从正离⼦相邻的碳原⼦上迁移到正离⼦上的反应,称为Wagner-Meerwein重排。
⽣成更稳定的碳正离⼦或产物成为重排的动⼒。
反应⽰例:双环⼆烯酮重排为四氢萘酚。
⽤质⼦酸处理某些环外烯烃可致重排。
7.1.2 Pinacol重排酸催化下,邻⼆醇脱⽔重排为醛或酮的反应称为Pinacol重排。
(1)四取代邻⼆醇的重排如果四个取代基相同,得单⼀产物。
如果是对称的邻⼆醇,产物分配主要取决于迁移基团的迁移能⼒。
迁移能⼒可能与亲核能⼒正相关。
⼀般⽽⾔,芳基>烷基>氢。
对位供电⼦基取代的芳基>未取代的芳基>邻位取代的芳基(空间障碍)。
如果是不对称的邻⼆醇,产物分配主要取决于形成的碳正离⼦的稳定性,与迁移基团的迁移能⼒关系不⼤。
不对称Pinacol重排的选择性不是太好,常常得到混合物,在药物合成上的意义不太⼤。
(2)三取代邻⼆醇的重排对于三取代的邻⼆醇,其中的叔碳上形成的碳正离⼦较稳定,所以⼀般是仲碳上的基团(或氢原⼦)迁移。
如果需要叔碳上的基团迁移,可采⽤衍⽣物法在碱性条件下重排。
(3)脂环上的邻⼆醇重排羟基位于脂环上的邻⼆醇的重排常导致脂环结构的变化。
螺环的形成:羟基共环的情形:如上,对于羟基共环的情形,总是处在离去的羟基反式的基团迁移,这在⼀定程度上说明Pinacol重排可按分⼦内SN2机理进⾏。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• (2) the R1 group has to be able to stabilize carbanions, so it is often an electronwithdrawing group;
反应机理
O R-C-R'
+
H+
OH
OH R-C-R'
+
-H
+
OH R-C-R' O-OCR" O
R-C-R'
O R"COO-HR R' C O NhomakorabeaO
H O
R´重排 O-O键断裂 -H+
O R-C-OR'
O
C R"
-R´´COO- ,
R3C- > R2CH- ,
>
CH 2
>
>RCH2- > CH3-
3. 从杂原子到碳原子的重排
Examples
Arndt-Eistert synthesis • 1. 反应通式
• 2. 反应机理
• 3. 应用特点 • 羧酸同系化C+1
第三节 碳原子到杂原子重排
一、Beckmann重排
OH
• 1. 反应通式
H+ O R´-C-NHR
R' C=N R
酮肟在酸性催化剂的作用下重排成酰胺 的反应称为贝克曼重排。
(5)拜耳-魏立格氧化重排
O RCR' + CH3COOOH
常用的过酸有: (1)一般过酸 + 无机强酸(H2SO4) (2)强酸的过酸 :CF3COOOH (3)一般酸 + 一定浓度的过氧化氢(产生的过酸立即反应)
CH3COOC2H5 40o C
O RCOR' + CH3COOH
酮类化合物被过酸氧化,与羰基直接相连的碳链断裂,插入一个 氧形成酯的反应称为拜耳-魏立格(Baeyer-Villiger)氧化重排。
(1)Claisen重排 (2)Cope重排 (3)Fischer吲哚合成
分子重排反应 分子重排反应就是化学键的断裂和形成 发生在同一分子中,引起组成分子的原子的 配置方式发生改变,从而形成组成相同、结 构不同的新分子的反应。 重排反应中键的断裂和形成的方式有异 裂、均裂和环状过渡态三种。
第一节 重排反应机理
> CH2=CH
> R2CH > CH3
• (3)胺类化合物的Wagner-Meerwein重排
CH3
CH3 C CH3 CH2NH2
HNO2 - N2
CH3
CH3 C CH3 CH2
CH3
C CH3
CH2CH3
H2O -H
CH3
OH C CH2CH3 CH3
2013-7-14
CH2OH
OH
CH2NH2
CH3
Product
CH3
CH3 C CHPh CH3 Br
SN1
CH3
CH3 C CHPh CH3
CH3 C CHPh CH3 CH3
Stable cation
Product
Migratory order of the migration groups
CH3O > R3C
2013-7-14
>
> Cl >H
• (4) R2 and R3 groups of ammonium salts cannot contain a hydrogen at their βposition, since the Hofmann elimination may compete;
• (5) when the migrating group has a stereocenter, it is transferred with retention of configuration at the migrating terminus;
• 4.应用特点 • (1)醇类的Wagner-Meerwein重排
CH3 CH3 C CH2OH CH3
CH3
CH3 C CH3 CH2
H+
CH3
CH3 C CH2OH2 CH3
CH3
H2O
CH3
C
CH
More stable
CH3 H
Cl
Cl
CH3 C CH3
-H
2013-7-14
CH2CH3
Addition of a nucleophile
• 2. 反应机理
• 3. 应用特点 • (1)制备C-1伯胺
• (2) 因亲核剂不同而产物各异
(3) Curtius Rearrangement
Example
(4) Schmidt Rearrangement
(5) Lossen Rearrangement
Example
HNO2
CH2
- N2
H2O -H
+
CH2
-H
+
NH2
HNO2
- N2
2013-7-14
?
二、Pinacol Rearrangement
• 1. 反应通式
X = Cl, Br, I, SR, OTs, OMs, N2+
• 2. 反应机理
• 3. 影响因素 • (1)碳正离子的稳定性 • the product is usually formed via the most stable carbocation intermediate when the glycol substrate is unsymmetrical;
RO
ROH Ph
O
PhCH2 CH2COOR
• 4. 应用特点 • 由卤代酮制备羧酸衍生物
五、 Wolff重排及Arndt-Eistert反应
• 1. 反应通式 Wolff rearrangement
• 2. 反应机理
• 3. 影响因素 • (1) the reaction can be initiated thermally, photolytically, or by transition metal catalysis; • (2) freshly prepared silver(I)oxide or silver(I)benzoate are best suited for the reaction; • (3) if the migrating group has a stereocenter, the stereochemistry remains unchanged (net retention of configuration) after the migration;
2. 碳原子到杂原子重排
(1)Beckmann重排 (2)Hoffman重排 (3)Curtius重排 (4)Schmidt重排 (5)Bayer-Villiger反应
重排反应
3. 杂原子到碳原子重排
(1)Stevens重排 (2)Sommelet-Hauser重排 (3)Wittig重排
4. s键迁移重排
General fetures
• (3) depending on the nature of R1, the acidity of the adjacent C-H bond varies so the type of base used for the deprotonation must be chosen accordingly;
• (2)立体化学因素
(3) besides protic acids, Lewis acids (e.g., BF3· OEt2, TMSOTf) are also used; various conformational effects and neighboring group participation in cyclic systems are complicating factors.
(4)迁移能力及推广的重排 • ①. H>Ph>3º >1º >2º
• ②.
• ③.
三、二苯乙醇酸重排
• 1. 反应通式
α-二酮在浓碱作用下发生重排,生成安息 香酸的重排反应称为二苯乙醇酸重排。
• 2. 反应机理
• 3. 影响因素 • (1)用苛性碱得到羟基酸,用醇盐则生成 酯;
• (2)环状二酮生成环状羟基酸
• (2)溶剂的影响 • 用极性小或非极性的非质子溶剂,PCl5催 化可防止异构化
• 当溶剂中含有亲核性化合物、分子内含有 亲核性官能团、溶剂本身为亲核性化合物 ,碳正离子与其结合而得不到酰胺
• 也可用此制备苯并咪唑衍生物
• 4. 应用特点 • 立体专一性
二、Hofmann重排
• 1. 反应通式
Stevens重排
R1 = EWG = Ar, heteroaryl, COR, COOR, CN; Y= CH2, CHR, NH; R4 = CH3, alkyl, allyl, benzyl,CH2COAr base: NaH, KH, RLi, ArLi, RONa, ROK
General fetures
2013-7-14
第一节 碳原子到碳原子重排
一、Wagner-Meerwein重排
•1. 反应通式
• 2. 反应机理
• 3. 影响因素 • (1)碳正离子形成方式:卤代烃与Lewis 酸作用、醇与酸作用、烯烃质子化、胺与 亚硝酸作用。 • (2)the stereochemistry of themigrating group is retained, which is in accordance of the Woodward-Hofmann rules.
