物理化学实验-表面张力
物理化学中的表面张力和界面现象的研究

物理化学中的表面张力和界面现象的研究物理化学作为一门交叉性很强的学科,涉及到了很多不同领域的知识。
表面张力和界面现象是物理化学中的一个重要研究领域,它们与分子结构、能量变化以及物质传输等方面有着密切的联系,掌握了它们的规律,可以更好地理解物质的性质和行为。
本篇文章将从介绍表面张力和界面现象的现象和定义开始,然后阐述影响其变化的因素以及研究方法,最后讨论其在生产和应用中的价值。
一、表面张力和界面现象的现象和定义表面张力是液体在固体表面或另一液体表面上自发形成的、压力减小的趋势,并且他与平衡面的垂直切线所张成的角度被称为表面张力角。
表面张力能够使液体形成固定的表面形态,例如水珠或液滴等。
表面张力也是液体共存状态下差异的能量,可以用物理量表征,通常以液体表面的面积来表示。
界面现象则是指两种介质之间的界面区域,这两种介质可以是两种不同的液体、一种气体与一种液体,或者一种固体和一种液体。
在这些界面区域中,分子间的相互作用力会发生变化,从而导致了不同的物理和化学现象,例如吸附、扩散、反应和珠子等。
界面现象的研究需要考虑其各种各样的因素,如外界温度、压力、物质间的相互作用力、分子结构等。
二、影响表面张力和界面现象的因素表面张力的大小受到很多因素的影响。
第一,表面张力与分子间力量的大小有关。
分子之间的吸引力使得他们倾向于在液体表面紧密排列,这就形成了表面张力。
分子间的吸引力与几何构型也有关,线状分子之间的相互作用力会使表面张力增加。
第二,表面张力还与温度有关。
高温下,分子的速度增加将使它们不容易在液体表面上紧密排列,并且会减小表面张力。
第三,表面张力还受到其他物理和化学过程的影响,如分子溶解,表面能的改变,纳米颗粒分散等。
与表面张力一样,界面现象的性质也取决于多个因素。
不同物质之间的相互作用力不同,因此会导致不同的反应。
当两种物质之间的相互作用力相等时,称之为协同作用力,此时形成的界面稳定度高,反应速度变慢。
另外,界面现象也取决于温度和压力等因素,这些因素往往会改变分子间相互作用力的性质,因此可以影响分子的行为和化学反应的速度。
物理化学实验报告:最大泡压法测定溶液表面张力

物理化学实验报告:最大泡压法测定溶液表面张力最大泡压法测定溶液的表面张力I、目的要求1、了解表面张力的性质、表面自由能的意义以及表面张力和吸附的关系2、掌握用最大气泡压法测定表面张力的原理和技术。
3、测定不同浓度乙醇水溶液的表面张力,计算表面吸附量和乙醇分子的横截面积U、实验原理1、表面自由能从热力学观点来看,液体表面缩小是一个自发过程,这是使体系总自由能减小的过程,欲使液体产生新的表面ΔA,就需对其做功,其大小应与ΔA成正比:—W= σ? A(1)它表示液体表面自动缩小趋势的大小,σ称为比表面自由能,其量纲为Jm-2。
因其量纲又可以写成N?m—1 ,所以σ还可称为表面张力。
其量值与溶液的成分、溶质的浓度、温度及表面气氛等因素有关。
2、溶液的表面吸附根据能量最低原理,溶质能降低溶剂的表面张力时,表面层中溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,它在表面层中的浓度比在内部的浓度低,这种表面浓度与内部浓度不同的现象叫做溶液的表面吸附。
在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度之间的关系遵守吉布斯(GibbS)吸附方程:C d ▽RT ( dc式中:Γ为溶质在气一液界面上的吸附量(2)(单位为mol m-2);RT ( dc式中:Γ为溶质在气一液界面上的吸附量(2)(单位为mol m-2); T为热力学温度(K);C(―)T > 0时,Γ V C称为负吸附。
dc当(d(―)T > 0时,Γ V C称为负吸附。
dcdc前者表明加入溶质使液体表面张力下降,此类物质叫表面活性物质;后者表明加入溶质使液体表面张力升高,此类物质叫非表面活性物质。
本实验测定正吸附情况。
3、饱和吸附量和溶质分子的横截面积在一定的温度下,吸附量Γ与浓度在一定的温度下,吸附量Γ与浓度C之间的关系,可用Langmuir吸附等温式表示(3)(3)4、表面张力的测定方法——最大泡压法 1GB=当毛细管下端端面与被测液体液面相切时,液体沿毛细管上升。
物理化学-实验三十二:最大泡压法测定溶液的表面张力

实验三十二 液体表面张力的测定一、实验目的1. 测定不同浓度的乙醇水溶液的表面张力,计算表面吸附量和乙醇分子的横载面积。
2. 了解表面张力的性质及表面张力和表面吸附量的关系3. 掌握最大泡压法测定溶液表面张力和表面吸附量的原理和技术。
二、原理液相与气相之间的界面层可看作是介乎液体与气体性质的第三相。
界面层分子受液体内部分子的吸引力远大于外部蒸气分子对它的吸引力,致使表面层分子受到向内的拉力使表面积趋于最小(球形),以达到受力平衡。
揭示表面层这一特征的方法很多, 最常用的为表面张力(surface tension, 用γ表示),或可定义为单位表面吉布斯自由能(surface Gibbs free energy ,用G ∆表示)。
液体的表面张力与温度、纯度等因素有关。
温度愈高,表面张力愈小;纯度发生变化时,表面张力也相应发生变化,其变化的大小决定于溶质的本性和加入量的多少。
根据能量最低原理,若溶液质能降低溶剂的表面张力,则表面层溶质的浓度应比溶液内部的浓度大;如果所加溶质能使溶剂的表面张力增加,那么,表面层溶液质的浓度应比内部低,这种现象为溶液的表面吸附,用吉布斯(Gibbs)公式表示:P T CRT C ,)(∂∂-=Γγ 式中,Γ为表面吸附量(mol ⋅m -2);γ为表面张力(J ⋅m -2);T 为绝对温度(K);C 为溶液浓度(mol ⋅L -1);P T C ,)(∂∂γ 表示在一定温度下表面张力随浓度的变化率。
P T C,)(∂∂γ<0,Γ>0,溶质能增加溶剂的表面张力,溶液表面层的浓度大于内部的浓度,称为正吸附作用。
P T C,)(∂∂γ>0,Γ<0,溶质能增加溶剂的表面张力,溶液表面层的 浓度小于内部的浓度,称为负吸附作用。
可见,通过测定溶液的浓度随表面张力的变化关系可以求得不同浓度下溶液的表面吸附量。
吸附量与浓度之间的关系可以用Langmuir 等温吸附方程式表示:KCKC+Γ=Γ∞1式中,Γ表示吸附量,通常指单位质量吸附剂上吸附溶质的摩尔数;∞Γ表示饱和吸附量;C 表示吸附平衡时溶液的浓度;K 为常数。
物理化学-表面张力及表面吸附量的测定-175
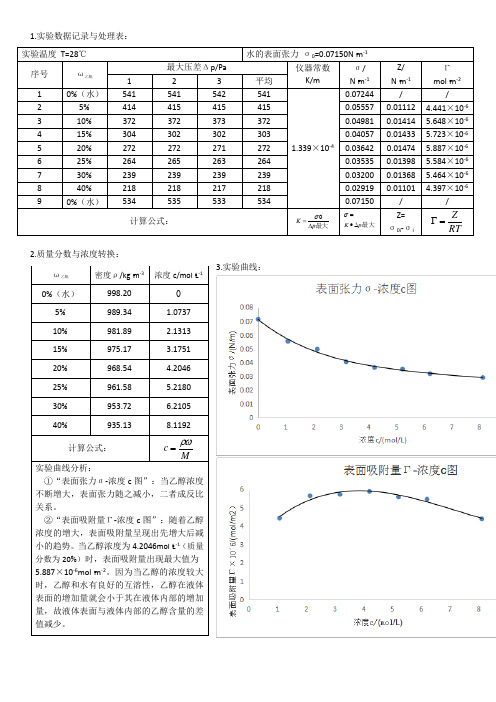
1.实验数据记录与处理表:2.质量分数与浓度转换:3.实验曲线:实验温度 T=28℃ 水的表面张力 σ0=0.07150N ▪m -1序号 ω乙醇 最大压差Δp/Pa仪器常数K/mσ/ N ▪m -1 Z/ N ▪m -1 Γmol ▪m -2 1 2 3 平均 1 0%(水) 541 541 542 541 1.339×10-40.07244 //2 5% 414 415 415 415 0.05557 0.01112 4.441×10-63 10% 372 372 373 372 0.04981 0.01414 5.648×10-6 4 15% 304 302 302 303 0.040570.01433 5.723×10-6 5 20% 272 272 271 272 0.03642 0.014745.887×10-66 25% 264 265 263 264 0.03535 0.01398 5.584×10-67 30% 239 239 239 239 0.03200 0.01368 5.464×10-6 8 40% 218 218 217 218 0.02919 0.01101 4.397×10-6 90%(水)5345355335340.07150/ /计算公式:最大p K ∆=σ最大p K ∆•=σZ= σ0i -σiRTZ=Γ ω乙醇 密度ρ/kg ▪m -3浓度c/mol ▪L -10%(水) 998.20 05% 989.34 1.0737 10% 981.89 2.1313 15% 975.17 3.1751 20% 968.54 4.2046 25% 961.58 5.2180 30% 953.72 6.2105 40%935.138.1192计算公式:Mc ρω=实验曲线分析:①“表面张力σ-浓度c 图”:当乙醇浓度不断增大,表面张力随之减小,二者成反比关系。
物理化学中的表面张力现象研究

物理化学中的表面张力现象研究表面张力是物理化学中一个重要的研究领域,它涉及到液体表面的力学性质,是许多重要现象的基础。
本文将介绍表面张力的基本概念、表征方法、影响因素以及其在实际应用中的应用。
一、表面张力的基本概念表面张力是指液体表面对内部分子的吸引力形成的张力,是液体表面物理上的一种特殊现象。
例如,水在平静的平面上形成的球形,其中就包含了水分子表面张力的影响。
表面张力的单位是能量/长度(J/m),它与液体分子间作用力有关。
表面张力可以分成两种,一个是液体与空气之间的表面张力,另一个是液体与固体之间的表面张力。
液体与空气之间的表面张力是表面自由能的一部分,而液体与固体之间的表面张力决定了液体在固体表面上的浸润性。
表面张力可以通过不同的表征方法来测量。
二、表面张力的表征方法测量表面张力有各种各样的方法,其中一些比较简单易行。
例如,测量液滴或气泡的大小并计算表面张力。
还有许多更精密的技术,如拉曼光谱、核磁共振等。
这些方法中,最常用的是静态测量和动态测量。
静态测量是指采用单个液滴或气泡的大小来测量表面张力。
这可以通过测量液滴或气泡的直径来完成。
例如,如果我们有一个水珠,我们可以使用一个显微镜来测量它的直径。
通过对一系列不同大小的水珠进行测量,我们可以计算出水的表面张力。
动态测量是指通过在表面进行一些动态实验来测量液面的表面张力。
其中的一个例子是二元液体的振荡方法。
这种方法需要用到一个空气静电电机来使液面振动,并通过测量液滴的振幅和频率来计算表面张力。
三、影响表面张力的因素表面张力受到很多因素的影响,其中包括表面温度、表面活性剂的存在、液体的物理化学性质等。
表面温度会影响表面张力,以及液体表面的几何形状。
通常情况下,液体温度越高,表面张力就越低。
这是由于温度对表面张力的分子吸引力有直接的影响。
表面活性剂的存在也会对表面张力产生显著的影响。
这些化学物质会在液面上聚集,改变液面自由能并降低表面张力。
液体的物理化学性质也会影响表面张力。
物理化学实验- 最大气泡法测定溶液的表面张力
g
表面分子:受到向内拉力,液体有自
动收缩表面而呈球形的趋势.
l
如果把一个分子由内部迁移到表面,就需要对抗拉力 而做功。在温度、压力和组成都恒定时,可逆地使表 面增加ΔS所需对体系做的功,叫表面功,可表示为:
-A=ΔG=σΔS
σ称为表面自由能,单位为J/m2。若把σ看作为作用在界 面上每单位长度边缘上的力,通常称为表面张力。
思考题
1.用最大气泡法测定表面张力时为什么要读最大压力差? •2.如果毛细管末端插入溶液中进行测量行吗?为什么? •3.本实验中为什么要读取最大压力差?
3. 调节恒温为25oC。
▪ 4.仪器常数测定
先以蒸馏水作为待测液测定其仪器常数。方法是将干燥的毛 细管垂直地插到使毛细管的端点刚好与水面相切,打开滴液 漏斗,控制滴液速度,使毛细管逸出的气泡,速度约为5s~ 10s1个。从精密数字压差计读取最大读数。可读三次,取其 平均值。通过手册 查出实验温度时水的表面张力,利用公
仪器与试剂
表面张力测定仪 一套 阿贝折射仪 一台 精密数字压差计 一台 烧杯 滴管 乙醇 去离子水
毛细管 支管试管
滴液漏斗
低真空测压 仪
实验步骤
1.安装仪器:洗净仪器并按图装置。对需干燥的仪器作 干燥处理。
2.配置乙醇溶液: 分别配制0%,20%, 40%, 60%, 80%,乙醇溶液各 50mL。
式K= / p1 求出仪器常数K。
▪ 5.待测样品表面张力的测定:用待测溶液洗净试管和毛 细管,加入适量样品于试管中,按照仪器常数测定的方法,
测定不同待测样品的p计算其表面张力。
▪ 6.乙醇溶液的折光率测定:用每个样品测出p后,随即
用滴管吸取该溶液滴置于棱镜上,用阿贝折光仪测其折光 率nD查工作曲线得各样品的准确浓度。
物理化学实验报告-溶液表面张力的测定及等温吸附(2)

p最大 = p大气 − p系统 = ∆p
毛细管内气体压力必须高于大试管内液面上压力的附加压力以克服气泡的表面张力,此附加压力∆p与 表面张力γ成正比,与气泡的曲率半径R成反比,其关系式为:
2γ ∆p = R
如果毛细管半径很小,则形成的气泡基本上是球形的。随着气泡的形成曲率半径逐渐变小,直到形成
装
半球形。这时曲率半径R与毛细管内半径r相等,曲率半径达到最小值。
数字式微压差测量仪当表面张力仪的活塞使水缓慢下滴而减小系统压力这样毛细管内液面上受到一个比试管中液面上大的压力当此压力差在毛细管尖端产生的作用力稍大于毛细管管口液体的表面张力时气泡就从毛细管口逸出这一最大压力差可由数字式微压差测量仪测出
1.精密恒温水槽;2.带有毛细管的表面张力仪; 3.滴液漏斗;4.数字式微压差测量仪
答:实验中,气泡的速度对实验数据有很大的影响。速度过快,会使数据变大。因此,保持相同的气泡速
度对于实验的成败有很大的关系。而实验装置中,随着滴液漏斗中水的不断流出,滴液的速度会减慢,装
置的此处有待改进。另外,毛细管的竖直以及毛细管进入液面的深度,对于测定结果都有一定的影响,实
装
验中应该注意。实验的数据处理也是很关键的一步,对测量结果有较大影响。
=
71.97 280.7
=
0.2564
mN
∙
m−1
∙
Pa−1
2. 求出各浓度正丁醇溶液的表面张力。
γ溶液 = K∆p溶液
表 1 正丁醇溶液表面张力的测定数据记录表
c mol ∙ L−1
0
0.02 0.04 0.06 0.09 0.12 0.16 0.2 0.24
∆pm1 Pa ∆pm2 Pa ∆pm3 Pa ∆pm Pa γ mN ∙ m−1
物理化学实验报告-溶液中的吸附作用和表面张力的测定实验报告

实验十二溶液中的吸附作用和表面张力的测定摘要:本实验采用最大气泡压力法测定了液体表面张力,通过对不同浓度下正丙醇溶液的表面张力研究其和浓度之间的关系。
初步探讨了表面张力的性质、表面能的意义以及表面张力和吸附作用的关系。
关键词:吸附作用、表面张力、最大气泡法The measurement of the adsorption effect andsurface tensionAbstract:In this experiment, according to Gibbs formula and Langmuir equal-temperature equation, we apply the biggest bladder pressure method to research the relationship between the amount of absorption and the consistency of a substance in the solution besides the surface tension. The phenomenon show that the consistency of a substance in the surface of the solution is different from that inside is called absorption.Keyword:Surface tension, The biggest bubble pressure method, Absorption effect1. 序言物体表面的分子和内部的分子所处的境况不同,因此能量也不同,表面张力就是内部分子对表面分子的作用力,它是液体的重要属性之一,与所处的温度、压力、液体的组成共存的另一面的组成等因素都有关。
对于溶液,由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面自由能。
物理化学中的表面张力研究

物理化学中的表面张力研究表面张力是物理化学领域的一个重要概念,它是一个液体分子团在气液或液液界面上所表现的一种自发性的性质,可以用来描述液体表面分子间的相互作用力。
表面张力的研究对于许多实际应用具有重要意义,如液滴形态稳定性、液滴合并和分裂、泡沫的稳定性、液体扩展和吸附的特性等等。
表面张力是很多物理和化学现象的基础。
它是由于液体表面上的分子间相互作用力的不平衡所产生的。
表面张力是液体表面分子的内聚力和对外作用力之间的平衡状态。
在纯水表面,由于水分子间的氢键作用力,表面上的水分子会紧密地排列在一起形成一层水膜。
这层水膜对周围环境有一定的张力,使水膜尽量缩小表面面积。
在液体表面任何液体分子,都会被表面上的液体分子吸引,从而形成一层分子膜,这个膜就是所说的表面张力,它的大小决定了液体表面的稳定性。
表面张力可以通过各种方法测量,其中最常用的方法是用自由垂直管法。
自由垂直管法是通过铂铱制成的一根带有三段毛细管的管子,在管子一端开口的位置带有底部宽口和内胆,内部充满液体。
在测量前,将整个测量系统洗净并填充液体,并且使管子与水平面垂直,底部宽口的液面要比管子的液面高约10毫米。
这样,水的表面张力和毛细管相互平衡,从而可以得到水的表面张力值。
表面张力在科学研究和工业生产中都具有重要的应用。
在科学研究方面,比如微流控液滴的生成和控制及液滴的稳定性研究中,表面张力是非常重要的因素。
在工业生产中,液体表面张力也发挥着巨大的作用。
一些化学工程和物理学工程中液体界面的应用都离不开对表面张力的研究,如喷雾器、泡沫剂、泡沫塑料等。
总之,表面张力是物理化学领域中一个非常重要的概念,不仅在学术和工业研究中起着重要的作用,也有着广泛的实际应用。
它的研究不仅有助于深入理解物理化学领域的一些基本现象,同时也为新产品开发和技术改良提供了重要的基础理论。
物理化学实验表面张力实验报告

物理化学实验表面张力实验报告5.实验数据记录及(分析)讨论(1)数据记录(“0”为蒸馏水,“1-8”为正丁醇溶液)溶液浓度最大压力差溶液浓度最大压力差溶液浓度最大压力差序序序C/(mol/L) ΔP/(Pa) C/(mol/L) ΔP/(Pa) C/(mol/L) ΔP/(Pa) 号号号平均值平均值平均值读数读数读数581 442 352 0 — 3 0.10 6 0.25 582 583 443 442.3 352 352582 442 352平均值平均值平均值读数读数读数536 409 332 1 0.02 4 0.15 7 0.30 535 535 409 409 333 332.6534 409 333平均值平均值平均值读数读数读数495 381 319 2 0.05 5 0.20 8 0.35 494.3 380.6 318 494 381 318494 380 317 实验时温度为25?C(2)数据处理由附表中查得25?C时水的表面张力是71.97mN/m 其中实验测得水的最大压力差是582Pa-3-4 得毛细管常数K=71.97*10^/582=0.00012366=1.2366*10c,,,,P,-,, RT,c ,,T σ=KΔP序号 1 2 3 4 5 6 7 8溶液浓度 0.02 0.05 0.1 0.15 0.2 0.25 0.3 0.35 C/(mol/L)最大压力差535 494.3 442.3 409 380.6 352 332.6 318 ΔP/(Pa)表面张力 0.06615 0.06112 0.05469 0.05057 0.04706 0.04352 0.04112 0.03932 σ/(J/m2)溶液浓度,,,, Г C/Г ,,,cC/(mol/L) ,,T-6 -0.2511 9871.84 0.05 5.0649*10^-6-0.2108 11759.10 0.10 8.5040*10^-5 -0.1764 14052.26 0.15 1.0674*10^-5-0.1705 14538.52 0.20 1.3756*10^-5 -0.1580 15688.72 0.25 1.5935*10^-5-0.1167 21240.95 0.30 1.4123*10^-5 ,,直线斜率k为39498,得=1/k=2.5318*10^~-523-20 ,正丁醇分子的横截面积S=1/(N)=1/(2.5318*10^*6.02*10^)=6.56*10^,(3)实验分析a. 实验过程中,温度的变化对表面张力造成影响较大,可以用恒温装置解决。
物理化学中表面张力的测量方法与应用

物理化学中表面张力的测量方法与应用表面张力,简单来说就是某种物质的表面呈现出的微观力学特性,它是交界处分子之间相互作用力的产物。
在物理化学领域,表面张力是一个十分重要的研究对象,因为它与很多物质的性质密切相关。
例如,液体表面张力的大小可以影响它的稳定性、光泽度、流动性以及在涂料、油漆、化妆品等各种工业领域的应用。
本文将介绍物理化学中表面张力的测量方法和应用。
一、环法测量法环法测量法是分析液体表面张力的一种古老但常用的测量方式。
其基本思想是根据液体静止在异形环表面的原理来测量液体的表面张力。
环法测量法需要一定的实验技巧和精度,通常需要进行多次测量求平均值,然后计算液体的表面张力。
二、降相压法测量法降相压法是现代物理化学中应用比较广泛的测量表面张力的方法之一。
该方法通过实验中降低液体与大气的接触面积,从而使液体表面发生凸起现象,通过对凸起高度测量来确定液体的表面张力。
这种方法较为准确,且操作相对简单,可以应用于多种液体的表面张力测量。
三、应用由于表面张力能够反映液体中分子间相互作用的强弱,常常被应用于多种领域的研究。
例如,测量液体表面张力可以用于估算大气湿度、优化化工加工参数以及开发新型液体表面技术等领域。
在医学和生物学领域,测量表面张力也具有很大的作用。
例如,在研究细胞膜时,表面张力的改变往往能够影响细胞膜的形状、钙离子的通道以及细胞内多种代谢过程。
此外,许多家用品和日化用品中也运用了表面张力的原理。
例如,洗衣液、洗碗液等清洁用品中含有高表面活性剂含量的成分,以减小水面张力来更好地清洁杂质和污渍。
此外,在食品和饮料生产中,通过调整添加剂的种类和浓度等可以控制产品的表面张力以达到理想的性质。
总之,表面张力的测量方法和应用十分的广泛。
这种物理现象的研究和应用已经深入到了物理化学领域以及生活的各个方面,其研究仍在不断深入和扩展。
表面张力的测定

大学化学实验II实验报告——物理化学实验学院:化学和化工学院专业:班级:姓名实验日期实验时间学号指导教师实验项目名称表面张力的测定实验目的1.掌握最大泡压法测定液体表面的方法,了解表面张力测定的因素。
2.测定不同浓度正丁醇溶液的表面张力,计算吸附量,并由表面张力的实验数据求分子的表面积。
实验原理表面张力是液体的重要性质之一,它是因表面层分子受力不均衡所引起的。
如液体和其蒸气构成的系统:液体内部的分子和周围分子间的作用力是球形对称的,可以彼此抵消,合力为零,而表面层分子处于力场不对称的环境中,液体内部分子对它的作用力远大于液面上蒸气分子对它的作用力,从而使它受到指向液体内部的拉力作用,故液体都有自动缩小表面积的趋势。
从热力学观点来看,液体表面缩小是使系统总吉布斯函数减小的一个自发过程,如欲使液体产生新的表面ΔA,就需对其做功,其大小应和ΔA成正比:ΔG =W′= γΔA (1)比例系数γ从能量的角度被称为比表面吉布斯函数,即为恒温恒压下形成1m2新表面所需的可逆功,其单位为J•m-2。
从物理学力的角度看,γ可被理解为沿着表面、和表面相切、垂直作用于单位长度相界面线段上的表面紧缩力,即表面张力,其单位是N•m-1。
在定温下纯液体的表面张力为定值,当加入溶质形成溶液时,表面张力发生变化,其变化的大小决定于溶质的性质和加入量的多少。
根据能量最低原理,溶质能降低溶剂的表面张力时,表面层中溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,它在表面层中的浓度比在内部的浓度低,这种表面浓度和内部浓度不同的现象叫做溶液的表面吸附。
在指定的温度和压力下,溶质的吸附量和溶液的表面张力及溶液的浓度之间的关系遵守吉布斯(Gibbs)吸附方程:PTcRTc,⎪⎭⎫⎝⎛∂∂-=Γγ(2)式中,Г为溶质在表面层的吸附量;γ为表面张力;c为吸附达到平衡时溶质的浓度。
引起溶剂表面张力显著降低的物质叫表面活性物质,Г>0,即产生正吸附的物质;反之称为表面惰性物质,Г<0,即产生负吸附的物质。
物理化学实验报告讲义溶液表面张力及吸附分子横截面积的测定

实验33 溶液表面张力及吸附分子横截面积的测定预习要求1. 液体表面张力的概念。
2. 溶质对溶液表面张力的影响的类型。
3. 测定表面张力在恒温槽中进行的原因。
4. 思考本实验中测标准样品的表面张力的目的。
实验目的1. 学习用最大气泡压力法测定溶液的表面张力。
2. 了解吉布斯方程在溶液表面吸附中的实验应用。
3. 了解溶液表面吸附分子的横截面积的测量方法。
实验原理1.表面张力σ与溶液表面的过剩物质的量Γ表面张力,也称为比表面自由能,即单位表面积的表面分子比体相分子多余的能量。
表面张力是液体的重要特性之一,与温度、压力、组成和共存的另一相有关。
纯液体的体相与表面相的组成相同,因此在温度、压力不变时,纯液体降低表面张力的唯一途径是尽量缩小表面积。
而对溶液,溶质的种类和浓度都会影响表面张力。
溶质对溶液表面张力的影响有三种情况:①溶质浓度增加引起溶液表面张力增大;②溶质浓度增加引起溶液表面张力减小;③少量溶质使溶液的表面张力急剧减小,当达到某一临界浓度时,溶液的表面张力几乎不变,见图3-20。
根据能量最低原则,能降低溶液表面张力的物质,其在表面相的浓度必然大于在体相的浓度,否则反之。
这种表面相的浓度与体相浓度不同的现象,叫“吸附”。
在指定的温度和压力下,定量地描述这一规律的方程是Gibbs 等温吸附方程:()c RT c ΓTd d σ-= (3-35) 式中,Γ 为表面过剩物质的量(mol·m -2)。
对某些溶液(如电解质溶液),式中的浓度c 要用活度a 代换。
当(d σ/d c )T >0,Γ<0,称为负吸附(图3-20曲线①);当(d σ/d c )T <0,Γ>0,称为正吸附(曲线②③)。
本实验研究正吸附的情况。
只要获得了溶液表面张力随溶质浓度的变化曲线,就可用微分法得到某一浓度下的(d σ/d c )T,然后依据式(3-35)得到表面过剩物质的量Γ。
2.饱和表面过剩物质的量与吸附分子的横截面积在一定温度下,若溶质在溶液表面是单分子层吸附,则表面过剩物质的量Γ与溶液浓度之间的关系可由Langmuir 等温式表示:Kc1Kc ΓΓ+=∞ (3-36) Γ∞ 为饱和表面过剩物质的量,K 为经验常数,与溶质的性质有关。
物理化学中的表面张力理论及实验

物理化学中的表面张力理论及实验在物理化学中,表面张力是一个非常重要的概念。
它描述的是液体表面各点之间存在的纵向相互作用力,也就是液体表面对外施加的垂直于表面的张力。
表面张力在很多领域中都是一个至关重要的参数,如液体的流动规律、波浪的传播、泡沫的形成、涂料的涂布等,因此综合实验和理论基础研究表面张力十分必要。
表面张力的理论计算主要基于两个因素,一是表面分子数密度,二是表面分子间相互作用力。
一般理论推导时会假设表面分子和体内分子的性质相同,从而可以得到表面张力与分子形状、大小和可替代性等有关的重要理论公式。
其中最著名的就是杨-拉普拉斯方程,它是计算液体表面张力的一个重要理论公式,它描述了一个圆形液滴表面张力与液滴半径和液体和外界介质之间的表面张力和体积张力之间的关系。
实验上,表面张力是通过测量附着于平衡液体表面的一个小物体(如金属环)所受到的引力来测量的。
由此可以求出表面张力。
把表面活性剂分子引入液面会改变其表面张力,对其进行定量测定即可确定其表面活性剂浓度。
表面张力的实验应用十分广泛。
例如,在制药工业中,通过测量药物的表面张力可以确定药物分子在肺部的吸附能力,从而确定药物的最佳给药方式和剂量。
在油漆和涂料工业中,了解涂层表面张力的变化可以确定涂层的与基材的附着性能。
在生物学领域中,通过测量细胞膜的表面张力可以研究细胞接触和交互行为,了解细胞机制。
表面张力的研究也有很多挑战。
例如,表面张力在不同形态、不同化学组成的液体中的变化情况,以及在液体中添加表面活性剂或其他添加剂后表面张力的变化。
这些都需要涉及到比较繁琐的理论推导和实验测量。
同时,表面张力的实验测量可能还会受到环境因素的影响,自然条件和测量方法误差等。
总之,表面张力理论和实验研究仍然是化学、生物学等领域的一个重要研究领域。
深入研究表面张力的基本特性和变化规律,可以为液体流动规律、波浪的传播、涂料的涂布技术等各领域的发展提供更加深入的理论和实验基础。
表面张力实验报告

表面张力实验报告表面张力是液体中分子间相互作用力的一种体现,是液体与外界之间的一种现象。
本实验主要通过测量液体中的表面张力来对其进行研究。
实验方法:1. 实验仪器与材料- 表面张力测量仪器:包括腊固定架、测力计、外围配件等。
- 实验液体:可以选择水、酒精等。
2. 实验步骤- 准备工作:搭建表面张力测量仪器,确保测力计的水平。
- 设置初始读数:将测力计调零,使读数为零。
- 测量撤离力:将测力计固定在架子上,将液体样品注入平台上的圆形竖直槽内,使一部分液体的表面与圆形槽底形成相等的两个半圆,读取测力计上的力的读数,这个力即为撤离力。
- 测量粘附力:将一个小片玻璃板轻轻压在液体表面上,然后以与表面垂直的方向慢慢将其抬离液体表面,当液体跟着板子一同离开液面时,停止抬离,这时读取测力计上的力的读数,这个力即为粘附力。
3. 数据处理与分析- 计算表面张力:表面张力的计算公式为 T = (P1 - P2) / 2πR ,其中P1为半圆面上的力,P2为板离开液体的力,R为半圆半径。
- 比较不同液体的表面张力:可以选择不同液体进行实验,并进行比较分析,找出液体表面张力的规律。
实验结果与讨论:根据实验测得的数据,可以进行表面张力的计算与比较。
比较不同液体的表面张力,可以得出一些结论与讨论,如:- 一般情况下,有机溶剂的表面张力要小于水。
- 随着温度的升高,液体的表面张力会下降。
- 表面张力与液体的种类、纯度、温度有关。
实验结论:通过本实验,我们验证了液体的表面张力存在并且能够通过实验测量得到。
不同液体的表面张力存在一定差异,并且液体的表面张力与温度有关。
此外,实验结果还表明,在撤离力和粘附力方面,水的表面张力较大,而有机溶剂的表面张力相对较小。
参考文献:1. 《物理化学实验》,祝万福,高等教育出版社,2004年。
2. 《表面张力实验报告范文》, 李晓华,教育科技信息,2017年。
3. 《表面张力实验研究》,陈红波,化学通报,2010年第9期。
《物化实验报告范本》溶液表面张力的测定

溶液表面张力的测定——最大气泡法周阳 2009030009 生94实验日期:2011年4月16日星期六 提交报告日期:2011年4月23日星期六助教老师:张老师 同组实验同学:曹逸涵1 引言1.1 实验目的1. 用最大气泡法测定不同浓度正丁醇溶液的表面张力。
2. 利用吉布斯公式计算不同浓度下正丁醇溶液的吸附量,进而求出正丁醇分子截面积和饱和吸附分子层厚度。
3. 学会镜面法作切线的方法。
1.2 实验原理1.2.1 表面张力分子在表面层内比在液体内部有较大的势能,这势能就是表面自由能。
在恒温、恒压及组成不变的条件下,使表面积可逆地增加dA ,体系自由能的增量dG 应等于环境对体系所做的表面功−δw ′即dG =−δw ′=γdA (1)式中γ为比例常数,称为比表面自由能,其量纲为J ·m ‐2。
因其量纲又可以写成N /m, 所以γ还可称为表面张力1.2.2 溶液的表面吸附溶质能引起溶剂表面张力的变化,在一定的温度和压力下,吉布斯用热力学的方法推导出了溶液表面吸附量与溶液的表面张力和溶液浓度之间的关系,即Tdc d RT c ⎟⎠⎞⎜⎝⎛−=Γγ (2) 式中Γ为表面吸附量(mol ·m ‐2), γ为溶液的表面张力(J ·m ‐2),T 为热力学温度(K ),c 为溶液的浓度(mol ·dm ‐3),R 为气体常数。
由吉布斯吸附等温式可看出,只要测得某—温度下不同浓度溶液的表面张力,以γ~ c 作图,在γ~c 的曲线上作不同浓度下的切线,可获得不同浓度所对应的斜率Tdc d ⎟⎠⎞⎜⎝⎛γ,将斜率代入(2)式中,即可求出不同浓度时气一液界面上的吸附量Γ。
1.2.3 饱和吸附量和溶质分子的横截面积在一定的温度下,吸附量Γ与浓度c 之间的关系,可用Langmuir 吸附等温式表示KcKc+Γ=Γ∞1 (3)式中Γ∞ 为饱和吸附量,K 为经验常数,其值与溶质的表面活性大小有关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、实验原理
液体表面层分子和内部(本体)分子受力情况 不同。内部分子受到周围液体分子的作用力相互 抵消,合力为零。而表面层分子受到液体和气相 分子的引力,合力指向液体内部,要使液体内部 分子移到表面层(使液体的表面积增大),就必 须克服此吸引力作工。
二、实验原理
本实验利用最大气泡法测定液体的表面张力。 将毛细管端面与液面相切,液面即沿毛细管上升, 打开抽气瓶活塞让水缓慢流下,使毛细管内溶液 受到的压力比样品管中液面的稍大,气泡就从毛 细管口逸出。这一压差可由的测定
一、实验目的
1、测定不同浓度正丁醇(乙醇)水溶液的表面张 力; 2、了解表面张力的性质,表面自由能的意义及表 面张力和吸附的关系; 3、由表面张力—浓度曲线(σ—c曲线)求界面上 吸附量和正丁醇分子的横截面积S; 4、掌握最大气泡法测定表面张力的原理和技术。
四、数据记录与处理
(1)按下表将所得数据记入下表:
浓度(mol/L) P最大(Pa)
(2)利用公式计算毛细管常数 (3)由正丁醇溶液的实验数据计算各溶液的表面张力, 并作σ—C曲线。 (4)由σ—C曲线分别求出各浓度的值。
(5)利用Gibbs吸附等温式计算出各浓度下的Γ, 将Γ及由3、4式算出的各项结果列表:
三、实验步骤
1、分别配制浓度为0.01、0.02、0.05、0.10、0.15、 0.20、0.25、0.30、0.35mol/L的正丁醇溶液100mL。 2、将仪器仔细洗涤干净,调节恒温槽温度为25℃。 3、样品管中装入蒸馏水,使液面与毛细管端面向切, 注意保持毛细管与液面垂直。 4、打开抽气瓶活塞,让水缓慢流下,使毛细管中气泡 逸出速度为5—10秒/个。 5、纪录压力计最大值,重复二次,求出P最大1平均值。 6、同法测定各浓度下正丁醇水溶液的P最大2值。
浓度 (mol/L) P最大(Pa) σ(N/m) d σ/dc Γ(mol/m) C/Γ
dσ dσ dC
(6)作C/Γ~C图,应得一直线,由直线斜率求 出Γ∞; (7)计算正丁醇分子的横截面积S0。(文献值 19.5A2)
五、思考题
1、表面张力仪的清洁与否对所测数据有何影响? 2、测定不同浓度溶液的表面张力时应注意什么? 3、安装仪器时为什么要使毛细管与液面垂直,且管 口端面刚好与液面向切? 4、实验时,为什么溶液浓度以由稀至浓测定为宜? 5、测定中能否应用加压的方法来鼓泡?
