氨氮对水体的影响
水体监测中氨氮测定的影响因素分析

水体监测中氨氮测定的影响因素分析水体中的氨氮是指水中存在的氨和氨离子的总和,氨氮的测定是水体监测中常用的一个指标。
氨氮的测定结果不仅能够反映水体中的污染程度,还能够判断水体中的富营养化程度。
下面将从不同方面分析氨氮测定的影响因素。
1. pH值:pH值是水体中氨氮测定过程中的一个重要因素。
氨氮的测定通常是通过蒸发浓缩法和碱性气体分析法进行的,这两种方法在不同的pH条件下对氨氮的反应速率有所不同。
在酸性条件下,氨氮的挥发速率较慢,测定结果偏低;在碱性条件下,氨氮的挥发速率较快,测定结果偏高。
在进行氨氮测定时,需要调整样品的pH值,一般在碱性条件下进行测定。
2.温度:温度是影响氨氮测定分析结果的重要因素。
通常情况下,样品的温度越高,氨氮的挥发速率越快,测定结果偏高;相反,样品的温度越低,氨氮的挥发速率越慢,测定结果偏低。
在进行氨氮测定时,需要控制样品的温度,通常是在100℃左右进行。
3.时间:时间是影响氨氮测定结果的重要因素之一。
通常情况下,氨氮的挥发速率随着时间的延长而增加,因此在进行氨氮测定时,需要控制反应时间,一般为1-2小时。
也需要注意测定结束后,及时停止反应,否则过长的反应时间会使挥发的氨氮重新溶解在水中,导致测定结果偏低。
5.干扰物质:水体中存在的其他有机物和无机物会对氨氮的测定结果产生干扰。
苯酚、硫化物和还原物质等都可以与氨氮发生反应,降低测定结果的准确性。
在进行氨氮测定时,需要进行样品预处理,去除干扰物质,以获得准确的测定结果。
氨氮测定的影响因素主要包括pH值、温度、时间、样品容量和干扰物质等。
在进行氨氮测定时,需要注意控制这些因素,以获得准确可靠的测定结果,从而为水体监测和环境保护工作提供科学依据。
什么是氨氮,氨氮的检测方法有哪些?

什么是氨氮,氨氮的检测方法有哪些?氨氮的定义氨氮指的是水中可溶解的氨化物离解出的游离氨和铵离子氮的总和,它常用来评估废水和自然水体中氨化物的浓度。
氨氮是水体中紧要的有机污染物之一,假如不适时处理和排放,会对水环境、生态系统造成很大的危害。
氨氮的来源氨氮的紧要来源包括:1.生活污水:人和动物的排泄物中都含有氨化物,而这些排泄物会被排入下水道,进而进入污水处理厂。
2.工业废水:很多工业过程中会产生含氨的废水,如压缩空气机、炼钢厂、造纸厂等。
3.农业污染:化肥和农药中含有氮元素,这些氮元素会被土壤吸取并散发至水体中。
氨氮的检测方法氨氮的检测方法有很多,以下是常见的几种方法:直接测定法直接测定法是通过对水样中的氨氮进行直接测定来判定其浓度。
该方法紧要分为两种类型:1.Nessler法:这种方法利用红、黄色复合物的形成来测定水中的氨氮。
首先,在水中添加KOH和K2S2O8,使水中的氨化物全部转化为NH3、然后,将水中逐滴添加Nessler试剂,直至水变为黄色为止。
依据沉淀颜色的深浅可以判定水中氨氮的浓度。
2.蒸发法:该方法利用氨氮比有机氮在水中更简单挥发的特性进行测定。
首先将水样蒸发至干燥并加热,使其中的氨氮全部转化为氨气。
然后,将氨气通入酸溶液中反应,用滴定法测定其浓度。
比色法比色法是利用化学试剂与水样中氨化物的反应来测定氨氮浓度的方法。
常用的试剂有叔丁基酚、磷钼酸铵等。
电化学法电化学法是通过检测电信号的变化来测定水样中的氨氮浓度。
该方法可以分为两种类型:1.电导法:利用水中电导率与溶液中离子浓度之间的关系,通过测量水中电导率的变化来判定其中氨氮的浓度。
2.气体敏感电极法:该方法常用的电极有银/银氯化物电极、铂电极、锡电极等。
利用敏感电极与气体间的电位变化来测量氨氮的浓度。
总结氨氮是一种紧要的指标,用来判定水体中氨化物的浓度。
氨氮浓度过高会导致水体中氨化物过剩,引起水质污染。
目前,常用的氨氮检测方法有直接测定法、比色法和电化学法等。
鱼类的适宜养殖水体氨氮控制与处理

鱼类的适宜养殖水体氨氮控制与处理鱼类养殖是一种重要的水产养殖方式,而水体中的氨氮含量对鱼类的生长和健康有着重要的影响。
本文将讨论鱼类养殖中适宜的水体氨氮控制与处理方法,以确保鱼类的良好生长环境。
一、氨氮对鱼类养殖的影响氨氮主要由鱼类的代谢产物、鱼饵残留物和鱼粪尿等无机氮化合物生成。
当氨氮超过一定浓度时,会对鱼类产生毒性作用,影响其正常生理功能。
高浓度的氨氮会导致鱼类呼吸困难、免疫力下降、食欲不振等严重问题,甚至造成死亡。
二、适宜养殖水体氨氮的控制方法1. 水质管理合理的水质管理是控制鱼类养殖水体氨氮的关键。
首先,要保持水体的循环,增加溶解氧含量,促进氨氮的氧化和转化。
其次,定期抽排底泥,避免底泥中过多的氨氮污染水质。
最后,控制饲料投喂量,避免过多的氨氮产生。
2. 生物过滤系统生物过滤系统是一种常用的水体氨氮控制方法。
通过利用硝化菌降解氨氮,将其转化为亚硝酸盐和硝酸盐,从而减少水体中的有毒氨氮浓度。
这种方式需要在养殖池中增加适量的生物过滤器,提供良好的生物附着面积,为硝化菌提供理想的生长环境。
3. 水体曝气处理水体曝气处理是一种简单有效的氨氮控制方法。
通过加强水体中的氧气供应,促进水中的氨氮氧化为亚硝酸盐和硝酸盐。
可以使用曝气装置或喷嘴等设备,提供充足的氧气供应,并增加水体的流动性,加强氮气转化的效果。
三、高氨氮水体的处理方法当鱼类养殖水体中出现高浓度的氨氮时,需要采取相应的处理方法,以避免对鱼类造成更大的伤害。
1. 增加水体循环对于高氨氮水体,首要的处理方法是增加水体的循环,提高氧气供应量,加速氨氮的氧化转化。
可以通过增加水泵或水循环设备来实现。
同时,也要避免过度饲喂,减少氨氮的产生。
2. 水质调节剂的使用适量使用水质调节剂是处理高氨氮水体的一种有效方法。
良好的水质调节剂可以中和水体中过高的氨氮浓度,使其转化为无害物质。
在选择水质调节剂时,应根据具体情况选择,避免使用对鱼类有毒性或副作用的产品。
氨氮对养鱼的危害、预防、解决方案

解读水中杀手“氨”养鱼要先养水,而养水的核心是培养硝化菌来分解水中的毒素。
水中毒素一般是指氨和亚硝酸盐,它们都属于剧毒,可以造成鱼的慢性中毒或者急性死亡。
这两种毒素被称为水中的第一杀手,只需要极少量就会造成鱼的暴毙。
鱼是病从鳃入,氨和亚硝酸盐的慢性中毒会破坏鱼体组织的免疫系统,降低抵抗力。
第一节“氨”一、氨的产生途径:1、鱼的呼吸:鱼通过腮部可以直接将体内产生的氨排出体外。
2、鱼的尿液:鱼的尿液中含有氨。
3、有机物被异营菌分解后的代谢产物:鱼的粪便、残饵、死鱼等有机物被异营菌分解后,其代谢产物为氨,这是氨的主要来源。
二、氨的危害:氨对鱼类的毒害反映非常强,在很低的浓度下即可使许多鱼类产生中毒症状,甚至死亡。
氨对鱼类的毒害情形根据浓度和鱼类的不同会有所差异,大致情况如下:在较低浓度下:鱼类可以忍受一段时间,但长此以往会慢性中毒。
氨会干预鱼类渗透调节系统,破坏鱼鳃的粘膜层,减低血红素携带氧气能力。
鱼类慢性中毒症状表现有:常在水面喘气,鳃转为紫色或暗红,比较容易瞌睡,食欲不振,老停留在缸底不活动,鱼鳍或体表出现异常血丝等。
在低浓度下:氨会和其他疾病一同加速鱼类死亡。
在略高浓度下:会直接破会鱼类皮肤和肠道粘膜,造成体表和内部器官出血,同时伤害大脑和中枢神经系统,鱼类会因急性中毒迅速死亡。
三、氨的中毒机理:毒素通过鱼的呼吸作用,由鳃进入血液,会使其丧失输氧能力,出现组织缺氧,窒息而死。
四、氨中毒的症状:鱼出现窜游现象,并时而出现下沉、侧卧、痉挛等症状。
呼吸急促,大口挣扎,死前眼球突出。
鳃盖部分张开,鳃丝呈紫红色或紫黑色。
鱼鳍舒展,根基出血,体色变浅,体表粘液增多。
打开腹腔,血液不凝,血色发暗,紫而不红,肝脾肾的颜色呈紫色。
五、氨的存在形式:水中的氨有两种不同的形式:一种是分子形态存在的“氨”(NH3);另一种是以离子形态存在的“铵”(NH4+)。
氨有剧毒,铵无毒。
一般氨测试所测的是氨和铵的总浓度,有时候测试出总浓度非常高,但鱼却很健康,这是因为水中铵的比例大,而有毒的氨(NH3)的百分比很小的原因。
禽畜养殖污染对水环境的影响

禽畜养殖污染对水环境的影响范文:随着人口的增长和经济的发展,禽畜养殖业在全球范围内扮演着重要角色。
然而,由于不合理的养殖方式和管理不善,禽畜养殖也带来了一系列环境问题,其中水环境污染是最重要的之一。
本文将深入探讨禽畜养殖污染对水环境的影响,并提供解决该问题的步骤和方法。
一、养殖废弃物对水质的污染1. 养殖废弃物的产生:禽畜养殖过程中,动物粪便、尿液和饲料残渣等废弃物大量排放。
2. 废弃物中的污染物:禽畜排泄物中含有大量氨氮、硫化物、重金属等有害物质,以及细菌、病毒等微生物。
3. 废弃物的处理和排放:很多养殖场没有合理的废物处理系统,导致废弃物直接进入河流、湖泊和地下水,引起水质恶化。
二、废水排放对水体健康的威胁1. 养殖废水的含有物质:禽畜场排放的废水中含有养殖动物的粪便、尿液、饲料残渣以及饲料添加剂等。
2. 化学物质的危害:废水中的重金属、农药残留和抗生素等化学物质对水体生态和水生生物健康造成严重威胁。
3. 养殖废水的传播途径:废水通过河流或地下渗漏进入湖泊和地下水,扩大了污染的范围。
三、氨氮的排放对水环境的影响1. 氨氮的危害:禽畜粪便中产生的大量氨氮会导致水体富营养化,引起水中藻类大量繁殖,形成赤潮等水体生态失衡现象。
2. 藻类水华引发的问题:藻类水华会耗尽水中的氧气,造成水体寡氧化,对鱼类和其他水生生物造成严重威胁,甚至引起大量死亡。
3. 氨氮的控制方法:加强禽畜养殖场的管理,改善饲养方式,减少氨氮的排放。
解决禽畜养殖污染对水环境的方法:1. 加强监管措施:政府应加强对禽畜养殖场的监管,制定严格的环保标准和法规,对不合格的养殖场进行处罚和整改。
2. 推广环境友好养殖技术:鼓励养殖场采用生态循环农业技术,如养殖废弃物资源化利用、沼气发电和水质净化技术等,减少废弃物对环境的负面影响。
3. 提高养殖管理水平:加强养殖场的技术培训,提高养殖人员的专业素质,推广科学合理的饲养方式和废物处理方法。
4. 跨行业合作与溯源体系:加强养殖业与相关行业的合作,建立健全的监管体系和溯源体系,从源头上控制水环境污染。
污水处理中氨氮超标对人类健康有何风险

污水处理中氨氮超标对人类健康有何风险污水处理是保护环境、维护人类健康的重要环节之一。
然而,当污水处理过程中出现氨氮超标时,可能会对人类健康产生一定的风险。
本文将就氨氮超标对人类健康的潜在风险展开探讨。
一、氨氮超标的来源氨氮主要来自于人类日常生活、工农业生产等活动中产生的废水。
例如,生活污水中含有大量的尿液,而尿液中正是氨氮的主要成分之一;农业活动中的施肥也可能导致土壤中氨氮含量升高;部分工业过程中产生的废水含有氨氮等。
二、氨氮超标对人类健康的风险1. 对水体生态系统的影响氨氮超标会进入水体中,对水生生物产生直接或间接的危害。
过量的氨氮会降低水体中的溶解氧含量,导致水生生物窒息、死亡。
此外,氨氮的存在也可能导致水体富营养化、水藻过度繁殖,引发蓝藻等有害藻类的暴发,对水生生态系统造成破坏。
2. 对人体健康的潜在风险氨氮超标的废水如果未经适当处理,排入自然水体中,可能会对人体健康造成一定的风险。
尤其是在饮用水的净化过程中,高浓度的氨氮可能对人体健康带来潜在威胁。
据研究表明,长期摄入含氨氮超标的饮用水,可能会对人体的肝脏、肾脏、中枢神经系统等造成损害,甚至引发肝硬化、脑损伤等疾病。
三、防范和控制氨氮超标的措施为了防范和控制氨氮超标对人类健康的潜在风险,以下几方面措施可供参考:1. 加强废水处理工艺优化在污水处理过程中,应采用适当的技术手段,如物理处理、生物处理等,以确保废水中的氨氮含量在合理的范围内。
同时,对于含氨氮较高的废水源头,可采取分流处理的方式,降低氨氮的负荷。
2. 推广水资源的高效利用通过加强节水意识,提高水资源的利用效率,减少废水的排放,有助于减少氨氮的超标情况发生。
3. 强化监管和法律法规的完善加强对废水排放的监管力度,建立健全的法律法规体系,提高违规排水行为的成本,以维护废水处理的正常运行和人类健康的安全。
4. 加强宣传教育通过加强公众对氨氮超标风险的认知,推动广大民众积极参与到废水处理和环境保护中来,共同构建生态友好型社会。
氨氮对水产养殖的危害及防治措施

为 了防止养 殖水 体氨 氮含量 过 高 ,除了定 期检 测水
中氨的指标 外 ,还要注意 : ( 1 )加换新 水 。适 时加注新 水 或换去部分老水 ,是最 直接 、经济而快捷有效的办法 ; ( 2 )增氧 。高 温季节晴 天中午开启增 氧机 曝气 ; ( 3 )生
六 氨氮控制指 标
的皮 、胃、肠道 的粘膜 ,造成 渗透 调节失调 ,引起 体表和 血呈 红色 ,最 为明显 ,其次是臀鳍基部前端 、眼眶外缘 、 内部器官 充血 ,表现 出与 出血性 败血症相似 的症状 ,造成 鳃盖边缘和 口腔 充血呈红色 ;体色变浅 ,体表 粘液增多 , 鱼类大批死亡 。 鳃 丝呈 紫色 。解剖 腹腔 可见 血色 发暗 ,紫 而不 红 ,肝 、
发生。在养殖水域存 在的有害物质 中 ,氨氮 比亚硝酸盐和 多 ,透 明度低 ,一般 在3 0 c m以下 ;二是水质 老化 ,没有 硫 化氢等对水产养殖 的危害事故更频 发 ,带来的经济损 失
更 巨大 ,氨氮 已成为养殖鱼类 的隐性杀手 。
一
,
氨氮的危害
四 氨氮中毒症状
由于氨对水产动物 的毒 害依 其浓度不 同而不 同,氨氮
1 . 慢 性 中毒 症 状
白天有浮头现象 ,采取增 氧措施 效果不明显 ;易发鱼
进入鱼 体 ,损伤鳃表 皮细胞 ,使血液和组织 中氨的浓度升 病 ,即使对症 治疗但效果很差 ,即使 鱼病 治疗 好后很快又
高 ,降低血液的载氧 能力 ,使鱼呼吸 困难 ,食 欲减退 ,影 复发 ,病鱼死亡较快 。
氨 氮 在 养 殖 水 体 中 以 两 种 形 式 存 在 :一 种 是 氨
强 的毒 害性 ;另一种是铵 ( NH ),又叫离子态氨 ,对水 产动物 无毒 。由于氨具有 较高的脂溶性 ,能通 过鳃和皮膜
氨氮的危害及防治措施

水产养殖中氨氮的危害及防治措施衢江区水利局王俏俏随着工业污染排放、畜禽养殖业污水排放、生活污水排放、水产养殖中过量投喂饲料行为等,淡水养殖水体中氨氮超标致使水生生物中毒死亡的的事情频繁发生,给养殖户带来极大的经济损失。
一、水体中氨氮的积累和危害池塘养鱼水体中的总氨氮一般以两种形式即非离子氨(NH3)和铵离子(NH4+)存在,在pH值小于7时,水中的氨几乎都以NH4+的形式存在,在pH大于11时,则几乎都以NH3的形式存在,温度升高,NH3的比例增大。
氨氮对水生生物的危害主要是指非离子氨的危害,非离子氨进入水生生物体内后,对酶水解反应和膜稳定性产生明显影响,表现出呼吸困难、不摄食、抵抗力下降、惊厥、昏迷等现象,甚至导致水生生物大批死亡。
另外,在生物体内富集的高浓度氨氮可转化为亚硝酸盐后对生物体产生危害,而亚硝酸盐又是强氧化剂,不仅会使生物体中毒,它还有致癌作用。
二、氨氮超标的防治措施根据《渔业水质标准》,水产养殖生产中,应将氨的浓度控制在0.02mg/L以下。
目前,可以从以下三个方面降低水体中氨氮的含量,防治氨氮中毒。
(一)科学进行养殖生产1、做好清淤工作,经常换水,保持水体新鲜。
2、饲料过量投喂是造成氨氮污染的主要原因之一,因此要减少饵料系数,提高饲料使用率,减少养殖生物的粪便排泄量。
3、用盐酸或醋酸调节PH值,降低PH值至7.0以下,降低氨氮毒性,再用沸石粉、麦饭石等吸附剂去除水体中的氨氮。
(二)利用微藻减少水体中的氨氮微藻是一种单细胞藻类,以水为电子供体,以光能作为能源,利用氮、磷等营养物质合成有机质。
能吸收水体中的氨氮并将其转换合成氨基酸等含氮物质,是水生生物的天然饵料。
微藻还能产生大量的氧气,水体中充足的氧气能促进亚硝酸盐向硝酸盐的转化,同时可减少水体因缺氧而形成的恶臭气味,改善水体生态环境,抑制和减轻氨氮对鱼类的毒害作用,提高鱼类食欲和饲料利用率,促进鱼类生长发育。
(三)利用微生物制剂减少水体中的氨氮微生物制剂是从天然环境中筛选出来的微生物菌体经培养、繁殖后制成的含有大量有益菌的活性菌制剂。
ii类水质标准 氨氮 总磷 化学需氧量 五日生化需氧量

ii类水质标准氨氮总磷化学需氧量五日
生化需氧量
ii类水质标准是指用于评价河流、湖泊等地表水水质的一种标准。
该标准针对不同的水质参数如氨氮、总磷、化学需氧量(COD)和五日生化需氧量(BOD5)进行了规定。
以下是对这些参数的详细解释:
1. 氨氮
氨氮是水体中存在的一种氮的形态,其含量过高会引起生活和工业用水的有毒有害性。
ii类水质标准规定水体中氨氮的容许浓度为
1.5mg/L以下,超过这个限制则会被归为劣V类水体。
2. 总磷
总磷是水体中的主要营养元素之一,但是其过量的释放会产生大量有害藻类,导致水环境的恶化。
因此,ii类水质标准规定水体中总磷的容许浓度为0.2mg/L以下,否则会被归为劣V类水体。
3. 化学需氧量(COD)
化学需氧量是衡量水体中有机污染物的一项重要指标,其值越高说明水体中污染物含量越多。
ii类水质标准规定水体中COD的容许浓度为15mg/L以下。
4. 五日生化需氧量(BOD5)
BOD5是指在5天内有机污染物被水中细胞所吸附、降解、氧耗的量,反映水质的生物降解能力。
ii类水质标准规定水体中BOD5的容许浓度
为3mg/L以下。
综上所述,ii类水质标准是用于评估水体水质的重要标准之一,对氨氮、总磷、COD和BOD5这些参数进行了详细的规定。
对于水体中这些
指标的浓度超过规定的限制,会被归类为较低质量等级的水体。
因此,保护水体的水质和环境,减少水体中有害物质的排放非常重要。
氨氮排放标准

氨氮排放标准氨氮是指水中存在的以氨态氮形式存在的氮元素的总量。
氨氮是水体中的一种污染物,过多的氨氮排放会对水体环境造成严重的污染,影响水质和水生生物的生存。
因此,各国都制定了相应的氨氮排放标准,以控制氨氮的排放,保护水环境。
在中国,国家环境保护标准对氨氮排放做出了明确规定。
根据《水和废水监测分析方法》(GB/T 7479-2002)和《城镇污水处理厂污染物排放标准》(GB18918-2002)的相关规定,不同类型的污水处理厂对氨氮的排放标准也有所不同。
一般来说,城镇污水处理厂应当严格控制氨氮的排放。
对于一般污水处理厂,氨氮的日均排放标准为25mg/L,最大允许排放浓度为50mg/L;对于规模较大、处理能力较强的污水处理厂,氨氮的日均排放标准为15mg/L,最大允许排放浓度为30mg/L。
此外,对于特定的重点污染区域,还可能会有更为严格的氨氮排放标准。
为了确保污水处理厂达到氨氮排放标准,需要采取一系列的措施。
首先,污水处理厂应当加强对进水的预处理,采取有效的脱氮措施,减少进水中氨氮的含量。
其次,污水处理厂的运行管理也至关重要,需要严格控制好污泥的回流比例,避免氨氮在处理过程中的二次污染。
此外,还可以考虑采用生物膜工艺、生物接触氧化法等先进的污水处理技术,提高氨氮的去除效率。
除了污水处理厂外,工业企业、畜禽养殖场等也是氨氮排放的重要来源。
针对这些排放源,也需要制定相应的氨氮排放标准,并加强监管和治理工作,确保氨氮排放不超标。
总的来说,氨氮是水体的重要污染物之一,严格控制氨氮的排放对于保护水环境至关重要。
各国都应当制定相应的氨氮排放标准,并加强对污水处理厂、工业企业等排放源的监管,共同保护好我们的水环境。
氨氮,硝酸盐氮,亚硝酸盐氮,总氮关系

氨氮,硝酸盐氮,亚硝酸盐氮,总氮关系氨氮、硝酸盐氮、亚硝酸盐氮以及总氮都是与氮元素相关的指标,用于评估水体或土壤中氮的污染程度,从而指导环境保护和污染治理工作。
在水体中,氮营养盐的污染是一种常见的问题,不仅会导致水体富营养化和蓝藻水华等问题,还会对水生态系统造成严重的破坏。
氨氮是指水中游离态氨(NH3)和铵态氮(NH4+)的总和。
游离态氨是一种弱碱性物质,易溶于水,具有刺激性气味。
在水中存在的氨氮主要来自废水排放、畜禽养殖、农业运营和废弃物处理等源头。
氨氮的含量高低可以反映水体中的氮污染程度,当氨氮浓度超过一定限值时,会对水生态系统产生毒性和刺激作用。
硝酸盐氮是指水中硝酸根离子(NO3-)的含量。
硝酸盐氮主要来自农业化肥的使用、废水排放、农田冲刷等源头。
硝酸盐氮的浓度增加通常与农业活动和人类的生活水平提高密切相关。
硝酸盐氮对水体的富营养化和蓝藻水华等问题有重要影响,同时也是地下水和饮用水中的主要污染源之一。
亚硝酸盐氮是指水中亚硝酸根离子(NO2-)的含量。
亚硝酸盐氮的产生通常是在氨氮经过硝化反应后再经过还原反应得到的产物。
亚硝酸盐氮的存在主要与废水处理、土壤中的微生物作用有关。
亚硝酸盐氮含量的增加可能与水体中富营养化的程度和废水排放有关。
亚硝酸盐氮具有毒性,对水生生物有害。
总氮是指水体中氨氮、硝酸盐氮、亚硝酸盐氮三者的总和。
总氮是评估水体氮污染水平的综合指标,能够反映水体中氮污染的整体情况,是判断水体富营养化程度的重要参数。
氨氮、硝酸盐氮和亚硝酸盐氮之间存在一定的转化关系,主要是氨氮和亚硝酸盐氮在细菌作用下先后发生硝化和还原反应。
硝化是指氨氮先被硝化细菌氧化成亚硝酸盐氮,然后再被亚硝化细菌氧化成硝酸盐氮的过程。
还原是指亚硝酸盐氮被还原细菌还原成氨氮的过程。
硝化和还原反应在自然界中是一个动态平衡的过程,受到温度、pH值、氧含量、有机物的影响。
综上所述,氨氮、硝酸盐氮、亚硝酸盐氮和总氮都是水体中重要的氮含量指标,它们可以用来评估水体氮污染程度和富营养化的程度,为保护水环境和进行污染治理提供依据。
浅谈氨氮和亚硝酸盐对金鱼的危害

氨氮和亚硝酸盐的危害对于我们循环水养殖的水体来说,水中的主要危害鱼类健康的物质是氨氮和亚硝酸盐。
在过滤系统尚未建立,或尚未成熟,或运转异常时,这两种物质的存在很让我们烦心。
氨氮对鱼的致死浓度在0.2-2.0㎎/L,小于0.2㎎/L时,会使鱼类的内部器官发生病变、坏死及组织溃烂。
当氨氮中的非离子氨达到0.01-0.02㎎/L时,易破坏鱼鳃的粘膜层,降低血红素携带氧的能力,使鱼类生长缓慢。
当非离子氨浓度达到0.02-0.05㎎/L时,会引发多种疾病,增加死亡;达到0.05-0.2㎎/L时,会破坏养殖鱼类的皮、胃、肠道粘膜,进一步引起内部器官和体表出血;达到0.2-0.5㎎/L时,会引起鱼类急性中毒死亡。
水中亚硝酸盐含量在0 .1㎎/L时,鱼体血液中的血红蛋白变成高铁血红蛋白,使血液变成巧克力色,也就是养殖上常说的“褐血病”,使血红蛋白的输氧能力下降,鳃肿胀,摄食减少,生长缓慢,疾病增多。
当浓度达到2.5㎎/L时,鱼体呈中毒状态,呼吸作用下降,体能衰弱,最后暴发疾病而死亡。
氨氮是指水中以游离氨(NH3)和铵离子(NH4+)形式存在的氮。
鱼的粪便中含氮有机物很不稳定,容易分解成氨。
因此,水中氨氮含量增高时指以氨或铵离子形式存在的化合氨。
平时我们测量的是氨氮含量是氨(NH3)和铵离子(NH4+)的总和,其中,铵离子(NH4+)是无毒的,而氨(NH3)对爱鱼是剧毒的,当PH与温度较低时,大部份氨氮以铵离子(NH4+)的形式存在,而当PH值与温度升高后,则会有更多的氨氮以剧毒性的氨(NH3)存在,并呈倍数增长。
因此,当PH值与温度升高后,在同样氨氮含量情况下,更容易造成鱼氨氮中毒,当鱼氨氮中毒后,可以通过降低池水的PH值来减少氨(NH3)的比例。
附一张在不同PH值与温度下有毒氨(NH3)在总氨氮中所占比例图,与鱼友分享,做到心中有数,防止氨中毒。
国家渔业用水要求有毒氨(NH3)含量小于0.02mg/L,实际养殖中很难达到,一般不超过0.2m/L就可以了。
氨氮对水体的影响

氨氮对水体的影响
氨氮是指水中以游离氨 NH3和 NH4+形式存在的氮,两者的组成比取决于水的pH值和水温。
当pH值偏高时,游离氨的比例较高;反之,铵盐的比例高。
氨氮是环境水体污染的一项重要指标,其氧化过程会造成水体中溶解氧浓度降低,导致水体发黑发臭,水质下降,对水生动植物的生存造成影响。
当水体氨氮浓度较高时,会导致水体富营养化,进而造成一系列的严重后果。
水体中的分子氨浓度过高时会使鱼虾产生毒血症,长期的氨氮偏高则将影响鱼虾的生长繁殖,严重性的将中毒至死亡。
地表水水质影响指标科普
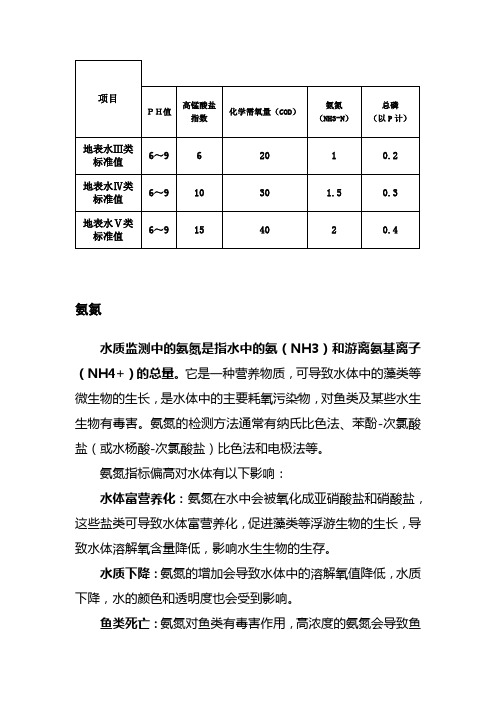
氨氮水质监测中的氨氮是指水中的氨(NH3)和游离氨基离子(NH4+)的总量。
它是一种营养物质,可导致水体中的藻类等微生物的生长,是水体中的主要耗氧污染物,对鱼类及某些水生生物有毒害。
氨氮的检测方法通常有纳氏比色法、苯酚-次氯酸盐(或水杨酸-次氯酸盐)比色法和电极法等。
氨氮指标偏高对水体有以下影响:水体富营养化:氨氮在水中会被氧化成亚硝酸盐和硝酸盐,这些盐类可导致水体富营养化,促进藻类等浮游生物的生长,导致水体溶解氧含量降低,影响水生生物的生存。
水质下降:氨氮的增加会导致水体中的溶解氧值降低,水质下降,水的颜色和透明度也会受到影响。
鱼类死亡:氨氮对鱼类有毒害作用,高浓度的氨氮会导致鱼对人体健康的影响:长期接触高浓度的氨氮水体会引起眼、鼻、喉等部位的刺激感,以及支气管炎、肺炎、肺气肿、中枢神经系统紊乱等症状。
因此,需要加强对水体中氨氮的监测和治理,以保护水体和人类健康。
化学需氧量(COD)水质监测中的化学需氧量(COD)是指在一定条件下,水中的还原性物质在外加的强氧化剂的作用下,被氧化分解时所消耗氧化剂的数量,以氧的mg/L表示。
化学需氧量反映了水中受还原性物质污染的程度,这些物质包括有机物、亚硝酸盐、亚铁盐、硫化物等。
但一般水及废水中无机还原性物质的数量相对不大,而被有机物污染是很普遍的,因此,COD可作为有机物质相对含量的一项综合性指标。
化学需氧量指标偏高对水体有如下影响:水体有机物污染:化学需氧量反映了水中受还原性物质污染的程度,尤其是受有机物污染的程度。
当化学需氧量偏高时,说明水体中有机物含量较高,水体受到有机物的污染,水质变差,影响水体的自然净化过程。
水体自净能力下降:化学需氧量偏高会导致水体中的溶解氧大量被消耗,水体的自净能力减弱,水质恶化,容易导致水生生生态系统破坏:化学需氧量偏高会对水生态系统造成破坏,影响水生生物的生存和繁殖,破坏水生态平衡。
人类健康影响:如果有人饮用了这样的水源,会大量的吸入各种危害物,沉积在人体之内,导致人体出现畸形、突变等情况,严重危害人类健康。
温度和氨氮浓度对水体N2O释放的影响

中国环境科学 2019,39(1):330~335 China Environmental Science 温度和氨氮浓度对水体N2O释放的影响路俊玲,陈慧萍,肖琳*(南京大学环境学院,污染控制与资源化国家重点实验室,江苏南京 210023)摘要:氧化亚氮的释放已经成为了一个全球性的环境问题,水体中N2O的释放量会随着氮含量的增加而增加.本文通过微宇宙系统的构建,分析氮的转化过程和氮转化基因的变化,并结合结构方程模型分析了温度、氨氮含量对水体N2O释放的贡献.研究结果发现氨氧化古菌和反硝化细菌丰度均与N2O 释放呈正相关,表明水体中的硝化和反硝化作用都会造成N2O的释放.氨氮浓度的升高并不直接促进N2O的释放,而温度和通过硝化作用产生的硝态氮对N2O的释放有促进作用.此外,硝化速率通过促进亚硝态氮和反硝化菌的丰度而间接地促进N2O的释放.关键词:氧化亚氮;温度;硝化;反硝化;结构方程模型中图分类号:X524 文献标识码:A 文章编号:1000-6923(2019)01-0330-06Coupling effect of temperature and ammonia on N2O emission in surface water. LU Jun-ling, CHEN Hui-ping, XIAO Lin*(State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023, China). China Environmental Science, 2019,39(1):330~335Abstract:The increase of nitrous oxide emission has become a worldwide problem. The emission of nitrous oxide from water body increased with the increase of N inputs. Our stud y analyzed the roles of temperature and ammonia in N2O emission through quantification of nitrogen transformation and related functional genes. The results showed that the abundance of ammonia oxidizing archaea and denitrifiers positively correlated to N2O emission in water. Structural equation model revealed ammonia content had no d irect effect on N2O emission, however, high temperature and nitrification d irectly accelerated the release of N2O. In ad d ition, nitrification process also increased the release of N2O indirectly through promoting abundance of denitrifiers and nitrite content.Key words:nitrous oxide;temperature;nitrification;denitrification;structural equation mode化肥的大量使用和污水的无序排放,造成大量的氮素进入水体,不仅加剧了水体富营养化,也成为N2O的重要释放源[1-3]. N2O作为重要的温室气体[4],其温室效应是CO2的298倍,并且能造成臭氧层的破坏,引起臭氧层空洞[5-7].已经有研究证实在氮含量高的河道[8]、湖泊等水体都有较高的N2O释放[9].在缺氧和厌氧条件下,N2O的产生主要由反硝化过程驱动,而近年来研究发现氨氧化细菌(AOB)和氨氧化古菌(AOA)也能产生N2O[10-11]. AOB和AOA主要通过3种途径产生N2O:一是通过氨单加氧酶在氧化氨的过程中N2O作为副产物产生[12];二是AOB可以通过羟胺脱氢酶直接将氨氧化过程中产生的羟胺(NH2OH)氧化为N2O[13];此外,AOB含有nirK基因,还能够在缺氧条件下通过硝化菌的反硝化作用将NO2-还原为NO和N2O[14-15].虽然目前已有大量研究表明在土壤中硝化反应对N2O的释放发挥重要的作用[16-19],但关于水体中硝化作用对N2O释放的贡献还不清楚.富营养化湖泊中硝化反应速率受到氨氮浓度和温度的影响,过高的游离氨浓度会抑制亚硝酸氧化细菌活性,导致N2O的积累[20].而温度对硝化和反硝化作用均有重要影响[21],并且AOA和AOB对温度的响应各有不同[22].如温度的升高可以直接促进氨氧化菌的增殖和潜在硝化能力[23],而冬季低温条件下氨氧化菌因为有较多的氧供给及较少的竞争作用比夏季的丰度更高[24].温度和氨氮如何通过影响硝化、反硝化过程,从而影响N2O的产生,目前尚不清晰.本文通过构建微宇宙系统,研究氨氮浓度和温度对水体中氮的转化、N2O释放过程的影响;通过构建结构方程模型,区分硝化、反硝化过程对N2O释放的贡献及其对环境因子的响应.这对更全面地认识和指导富营养化水体修复措施的实施,减少温室气体N2O的排放具有重要意义.1材料与方法1.1试验设计收稿日期:2018-06-19基金项目:国家水体污染控制与治理科技重大专项(2017ZX07204002) * 责任作者, 教授, xiaolin@1期路俊玲等:温度和氨氮浓度对水体N 2O 释放的影响 331微宇宙试验,通过在实验室模拟不同的生态系统进行研究,既能够保持生态系统的复杂性,又使结果具有可重复性,在生态学研究中被广泛应用[25].本次研究于2017年6月在太湖(30°58′14.37′′N, 120°8′16.40′′E)采集水样,冰袋低温保存立即运回实验室.取3L 水样置于5L 的加塞广口玻璃缸中,构建微宇宙系统[26].微宇宙系统设2个氨氮浓度,分别为不添加和添加NH 4Cl 至氨氮终浓度为30mg/L.分别于5,15及25℃下黑暗静置培养,防止藻类的生长.在试验开始的第1,3,5,10,15,20和25d 定期采集水样,用于理化性质和定量PCR 分析.每组试验3个平行. 1.2 水样理化性质分析总氮(TN),氨氮(NH 4+),硝态氮(NO 3-)和亚硝态氮(NO 2-)、总有机碳(TOC)测定均采用文献中的方法[27].NH 4+净转化速率(NATR)和NO 3-净转化速率(NNR)的计算分别采用公式(1)和公式(2)进行:NATR=n x n c c x +− (1) NNR=n n x c c x+− (2) 式中:C n+x 为(n+x) d 的NH 4+或NO 3-浓度(mg/L),C n 为第(n ) d 的NH 4+或NO 3-浓度(mg/L),x 为天数(d).1.3 N 2O 的采集和测定每次采样时用注射器采集5mL 顶空气体,转移到3mL 的密闭玻璃瓶中用于分析N 2O 的产生量.N 2O 的浓度采用Agliet7890B 气相色谱仪测定,检测器为电子捕获器(ECD).检测条件为:柱温55℃、后检测器(ECD)温度300℃,载气为高纯氮气,流速为30mL/min,燃气为氢气,流速为45mL/min [28]. 1.4 DNA 的提取和实时荧光定量PCR(qPCR)DNA 的提取和qPCR 参照文献的方法进行[29]. qPCR 采用20μL 反应体系进行:10µL SYBR ® Premix Ex Taq™(Takara), 100nM 引物, 1.5µL 模板DNA.细菌和古菌的amoA 基因分别采用amoA1F/amoA2R, Arch–amoAF/Arch–amoAR 引物进行扩增,反应条件为:94℃ 2min;94℃ 20s,57℃ 30s (AOB) 或55℃ 30s (AOA),40个循环.反硝化基因nirS 的扩增采用引物cd3af/r3cd,反应条件为:94℃ 2min;94℃ 30s, 57℃ 45s,72℃ 45s,40个循环.1.5 统计分析和结构方程模型分析水体理化指标和qPCR 数据进行One–Way ANOV A 分析,平均数的比较采用Fisher’s L SD 检测.生物和环境因子间的关系进行Pearson 相关性分析,并通过结构方程模型分析环境因子对氮转化过程、相关功能微生物和N 2O 释放的直接和间接影响[30].以上统计分析均在IBM SPSS 22.0(SPSS Inc.,美国)中进行. 2 结果与分析 2.1 不同氨氮浓度和温度条件下氮转化及N 2O 的释放在无外源氮添加的情况下,体系中的氨氮主要来源于有机氮降解,在3个温度下氨氮浓度都很低.不同温度下对照组氨氮的净转化速率在0.06~ 0.11mg NH 4+-N/(L ⋅d)范围内波动,组间没有显著性差异(图1,2),表明在低氨氮情况下,温度对氨氮的转化没有显著性影响.图1 NH 4+-N(a), TN(b), NO 3--N(c)在不同氨氮浓度和温度条件下的变化Fig.1 The profiles of NH 4+-N(a), TN(b), NO 3--N(c) under different ammonia concentration and temperature332 中 国 环 境 科 学 39卷速率[m g N O 3--N /(L ⋅d )]图2 氨氮净转化速率(NATR) (a)和硝态氮净转化速率(NNR) (b) Fig.2 The net transformation rate of NH 4+-N(a) and NO 3--N(b)在低氨氮情况下,在5℃时,最终有2.72mg/L 的硝态氮产生,其净产生速率与氨氮的转化速率基本相同(0.1mg NO 3--N/(L ⋅d),说明硝化作用在氮的转化中占据优势.在15℃和25℃时,分别只有7%和3%的氮氮减少量被转化为硝态氮,同时硝态氮的净产生速率也只占氨氮转化的18%和15%(图2),表明温度的升高促进了反硝化作用的进行并使体系中总氮降低.图3 不同氨氮浓度和温度下N 2O 的产生 Fig.3 Production of N 2O under different ammoniaconcentration and temperature在有高氨氮添加时,氨氮浓度在所有处理组中都持续下降,表明即使在低温下氨氮也能够被快速转化(图1).同时,氨氮的转化速率在25℃时达到最高,表明高氨氮情况下氨氮的转化速率与温度呈正相关.在15℃时,NO 3-的产生速率约为氨氮转化速率的60%,在25d 时,超过90%的氨氮被转化为硝态氮,表明此时硝化作用仍占主要作用.在25℃时,体系中氨氮浓度的减少(28.86mg/L)与总氮的减少(20.30mg/L)和硝态氮的生成量(8.45mg/L)之和呈化学剂量平衡,说明耦合了硝化作用的反硝化过程在氮的转化过程中占主要作用.N 2O 的产生在培养开始时即可以在所有体系中检测到.N 2O 的产生量在未添加氨氮的体系中较低.在添加了高浓度氨氮的体系中,5℃条件下N 2O 的产生量也显著低于15和25℃的处理.在15和25℃条件下,从第5d 起N 2O 的产生量即明显高于对照,其中25℃时N 2O 的产生速率和产生量显著高于15℃. 2.2 氨氧化(amoA )和亚硝酸盐还原酶(nirS )基因丰度的动态变化如图4所示,在全部微宇宙体系中,氨氧化菌的amoA 和反硝化菌的nirS 基因丰度都随着时间而增加.AOA 的amoA 基因丰度大约比AOB 的amoA 基因高一个数量级(图4),表明AOA 是水体中主要的氨氧化菌.相比于对照,在5和25℃时AOA 的amoA 基因拷贝数随着氮的添加而降低,在15℃时添加铵盐促进了AOA 的生长.与氨氧化菌相比,低温对反硝化菌增殖的抑制作用更为显著.在5和15℃条件下,25d 时,未添加氨氮的对照组中nirS 的拷贝数仅较起始拷贝数增加了20%和30%.但在25℃条件下,添加氨氮的处理组中nirS 的拷贝数则迅速增加,表明此时反硝化菌具有较高的代谢活性.1期路俊玲等:温度和氨氮浓度对水体N 2O 释放的影响 333图4 amoA 基因(a 、b)及nirS (c)基因丰度变化 Fig.4 Variance of amoA and nirS gene abundance2.3 温度、氨氮浓度对氮转化过程及N 2O 释放的影响通过person 相关性分析发现,N 2O 的释放与温度、NO 2-和NO 3-浓度、PNR 以及AOA -amoA 、AOB -amoA 和nirS (表1)呈显著正相关.但氨氮和总氮浓度都与N 2O 的释放无显著相关.表1 生物和环境因子与N2O 释放的相关性分析Table 1 Correlation analysis of biotic and abiotic factor with N 2O emission因子 温度 NH 4+-N TN NO 3--N NO 2--N N 2O AOA AOB nirS PNR 温度 1NH 4+-N -0.1 1 TN -0.1 0.9** 1 NO 3--N 0.3 -0.1 0.2 1 NO 2--N 0.4* 0.1 0.3 0.7** 1N 2O 0.3*-0.1 0.2 0.9**0.6**1AOA 0.2 -0.2 0.1 0.7** 0.2 0.8** 1AOB 0.2 -0.2 0.0 0.5**0.1 0.6**0.8**1nirS0.4* -0.1 0.2 0.8** 0.4* 0.9** 0.8** 0.7** 1PNR 0 -0.2 0.0 0.6** 0.3 0.5** 0.7** 0.7** 0.5** 1图5 影响N 2O 产生因子的SEM 分析 Fig.5 SEM analysis of N 2O production图中所标均具有显著性作用,实线代表正向促进作用,虚线代表抑制作用.线的粗细代表作用强度的大小进一步通过SEM 分析了温度和氨氮浓度对氮转化过程、N 2O 释放的直接和间接影响,所构建的结构方程模型能够解释90%的N 2O 释放的影响(r 2=0.90).SEM 结果表明NO 3-(λ=0.767, P <0.001)和温度(λ=0.136, P <0.05)显著提高N 2O 的释放,但NH 4+对N 2O 的释放没有直接作用(图5).NH 4+显著促进nirS (λ=0.251, P <0.05)和NO 2-(λ=0.277, P <0.01)的量,而nirS (λ=0.493, P <0.001)和NO 2-(λ=0.433, P <0.001)与NO 3-呈显著正相关.此外,AOA 对nirS (λ=0.651, P <0.001)和PNR(λ=0.748, P <0.001)有强烈的促进作用.3 讨论氮的生物可利用性及温度是影响氮转化的两334 中国环境科学 39卷大重要因素.结构方程模型分析的结果表明,温度的升高能直接促进N2O的释放,而高氨氮主要是通过加快硝化速率,缩短硝化反应时间,从而加速N2O的释放.高氨氮体系中,N2O的释放在体系中很快开始,并且即使在以硝化作用为主的体系中,N2O依然能够大量产生,这表明在水体中硝化作用可以是产生N2O的主要途径.在未添加氨氮的处理组中也检测到了N2O的释放,说明有机氮经矿化作用后所产生的NH4+也能通过硝化作用增加N2O的释放.在25℃和高氨氮情况下,20d以后体系中的氮以硝态氮形式存在,并且氮转化过程以反硝化作用为主,表明反硝化作用也在N2O的产生中发挥重要作用.温度影响着氮转化细菌的生长以及酶的活性,同时也会影响N2O从水体中释放的传质阻力,这些因素造成了在低温(5℃)条件下N2O的产生量较低.在本研究的微宇宙试验中,反硝化过程并不占优势.在低温条件下,nirS的丰度也增长缓慢,表明低温抑制了反硝化细菌的活性和生长.但与前人报道[24]类似,5℃的低温并未对AOA和AOB的增长造成显著性抑制.N2O 的释放与NO2-和NO3-浓度呈现显著的正相关关系,这也表明在NO2-和NO3-生成的过程中伴随着N2O 的释放[16].但随着氨氧化的进行,体系中的DO逐渐被消耗造成缺氧或厌氧环境,这时反硝化作用的发生也将导致大量N2O的释放.沉积物中通过反硝化作用产生N2O已经引起了重视[2].相比于沉积物而言,湖泊、河流等水体中上覆水的体量更大,直接接受外源的氮输入,并且在N2O的释放过程中受到的传质阻力更小而更容易释放.本文的研究结果表明,除了反硝化作用,水体中的硝化作用也会产生N2O,并且随着温度和氨氮浓度的升高,N2O的释放量也随之增加.温度的升高可以直接促进N2O的释放.氨氮浓度的升高虽然并不直接作用于N2O的释放,但其一方面可以通过促进硝化作用的进行而增加N2O的释放;同时,硝化作用所产生的NO2-和NO3-又可以通过耦合反硝化过程间接促进N2O的产生.结构方程模型分析结果表明,温度和氨氮浓度的升高均能促进N2O的释放,并且进一步区分了硝化、反硝化在N2O释放过程中的贡献,这使得我们对温度及不同形态的氮素对N2O释放风险的影响有了更全面的认识.因此,富营养化水体治理过程中,不仅要控制以硝酸盐为主的反硝化过程,更要加强对氨氮等其它各种形式氮素的控制,这对于有效降低N2O的产生,减少温室气体的排放具有重要意义.4结论4.1水体中硝化、反硝化作用的增加均能促进N2O 的释放.4.2温度的升高可以直接促进水体中N2O的释放,而氨氮浓度的升高主要通过提高硝化反应速率,加速N2O的产生.参考文献:[1] Wang H, Yang L, Wang W, et al. Nitrous oxide (N2O) fluxes and theirrelationships with water-sediment characteristics in a hyper-eutrophic shallow lake, China [J]. Journal of Geophysical Research : Biogeosciences, 2007,112(G1):129-137.[2] Liu W, Wang Z, Zhang Q, et al. Sediment denitrification and nitrousoxide production in Chinese plateau lakes with varying watershed land uses [J]. Biogeochemistry, 2015,123(3):379-390.[3] Marzadri A, Dee M M, Tonina D, et al. Role of surface and subsurfaceprocesses in scaling N2O emissions along riverine networks [J].Proceedings of the National Academy of Sciences, 2017,114(17): 4330-4335.[4] Wan S, Ward T L, Altosaar I. Strategy and tactics of disarming GHG atthe source: N2O reductase crops [J]. Trends in Biotechnology, 2012, 30(8):410-415.[5] Ravishankara A R, Daniel J S, Portmann R W. Nitrous oxide (N2O):the dominant ozone-depleting substance emitted in the 21st century [J].Science, 2009,326(5949):123-125.[6] 郭树芳,齐玉春,董云社,等.滴灌对农田土壤CO2和N2O产生与排放的影响研究进展 [J]. 中国环境科学, 2014,34(11):2757-2763.Guo S, Qi Y, Dong Y, et al. Response of production and emission of CO2 and N2O of agricultural soil to drip irrigation [J]. China Environmental Science, 2014,34(11):2757-2763.[7] M yhre G, Shindell D, Breon F M, et al. Anthropogenic and naturalradiative forcing [J]. Climate Change, 2013,423:658-740.[8] M cM ahon P B, Dennehy K F. N2O Emissions from a Nitrogen-Enriched River [J]. Environmental Science & Technology, 1999,33(1): 21-25.[9] Seitzinger S P, Kroeze C. Global distribution of nitrous oxideproduction and N inputs in freshwater and coastal marine ecosystems [J]. Global Biogeochemical Cycles, 1998,12(1):93-113.[10] Wrage N, Lauf J, del Prado A, et al. Distinguishing sources of N2O inEuropean grasslands by stable isotope analysis [J]. Rapid Communications in Mass Spectrometry, 2014,18(11):1201-1207. [11] Philippot L, Hallin S, Schloter M. Ecology of denitrifying prokaryotesin agricultural soil [J]. Advances in Agronomy, 2007,96:249–305. [12] Hink L, Lycus P, Gubry-Rangin C, et al. Kinetics of NH3-oxidation,NO-turnover, N2O-production and electron flow during oxygen depletion in model bacterial and archaeal ammonia oxidisers [J].1期路俊玲等:温度和氨氮浓度对水体N2O释放的影响 335Environmental Microbiology, 2017,19(12):4882-4896.[13] White C J, Lehnert N. Is there a pathway for N2O production fromhydroxylamine oxidoreductase in ammonia-oxidizing bacteria [J].Proceedings of the National Academy of Sciences, 2016,113(51): 14474-14476.[14] Shaw L J, Nicol G W, Smith Z, et al. Nitrosospira spp. can producenitrous oxide via a nitrifier denitrification pathway [J]. Environmental Microbiology, 2006,8(2):214–222.[15] Shi X, Hu H W, Zhubarker X, et al. Nitrifier-induced denitrification isan important source of soil nitrous oxide and can be inhibited by a nitrification inhibitor 3,4-dimethylpyrazole phosphate (DM PP) [J].Environmental Microbiology, 2017,19(12):4851-4865.[16] Hink L, Nicol G W, Prosser J I. Archaea produce lower yields of N2Othan bacteria during aerobic ammonia oxidation in soil [J].Environmental Microbiology, 2017,19(12):4829-4837.[17] Baggs E M. A review of stable isotope techniques for N2O sourcepartitioning in soils: recent progress, remaining challenges and future considerations [J]. Rapid Communications in M ass Spectrometry, 2008,22(11):1664-1672.[18] Wrage N, Velthof G L, Beusichem M L V, et al. Role of nitrifierdenitrification in the production of nitrous oxide [J]. Soil Biology & Biochemistry, 2001,33(12):1723-1732.[19] Davidson E A. Pulses of nitric oxide and nitrous oxide flux followingwetting of dry soil: An assessment of probable sources and importance relative to annual fluxes [J]. Ecological Bulletins, 1992,42(42):149- 155.[20] Chen G, Cao X, Song C, et al. Adverse Effects of Ammonia onNitrification Process: the Case of Chinese Shallow Freshwater Lakes [J]. Water, Air & Soil Pollution, 2010,210(1-4):297-306.[21] Bachand P A M, Horne A J. Denitrification in constructed free-watersurface wetlands: II. Effects of vegetation and temperature [J].Ecological Engineering, 1999,14(1/2):17-32.[22] Zeng J, Zhao D, Yu Z, et al. Temperature Responses of Ammonia-Oxidizing Prokaryotes in Freshwater Sediment M icrocosms [J]. Plos One, 2014,9(6):e100653. [23] Stark J M. M odeling the temperature response of nitrification [J].Biogeochemistry, 1996,35(3):433-445.[24] Christman G D, Cottrell M T, Popp B N, et al. Abundance, Diversity,and Activity of Ammonia-Oxidizing Prokaryotes in the Coastal Arctic Ocean in Summer and Winter [J]. Applied & Environmental Microbiology, 2011,77(6):2026-2034.[25] 杜秀英,竺乃恺,夏希娟,等.微宇宙理论及其在生态毒理学研究中的应用 [J]. 生态学报, 2001,21(10):1726-1733.Du X, Zhu N, Xia X, et al. The theory of microcosm and its application in ecotoxicology [J]. Acta Ecologica Sinica, 2001,21(10): 1726-1733.[26] 黄伟,朱旭宇,曾江宁,等.氮磷比对东海浮游植物群落生长影响的微宇宙实验 [J]. 环境科学, 2012,33(6):1832-1838.Huang W, Zhu X, Zeng J, et al. M icrocosm Experiments on the influence of different N/P ratios on phytoplankton community growth in the East China Sea. Environmental Science, 2012,33(6):1832-1838.[27] 国家环境保护总局.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002:236-284.National Environmental Bureau. Methods for the analysis of water and wastewater. Chinese Environmental Science Press, Beijing, 2002:236- 284.[28] 邢丽贞,郑德瑞,孔进,等.高氨氮废水短程硝化过程中N2O释放试验研究 [J]. 环境科学学报, 2016,36(4):1260-1265.Xing L, Zheng D, Kong J, et al. N2O emission during short-cut nitrification of high ammonium containing wastewater [J]. Acta Scientiae Circumstantiae, 2016,36(4):1260-1265.[29] Peng Y, Liu L, Jiang L, et al. The roles of cyanobacterial bloom innitrogen removal [J]. Science of the Total Environment, 2017,609: 297-303.[30] Arhonditsis G B, Stow C A, Steinberg L J, et al. Exploring ecologicalpatterns with structural equation modeling and Bayesian analysis [J].Ecological Modelling, 2006,192(3):385-409.作者简介:路俊玲(1994-),女,山东青岛人,南京大学硕士研究生,主要研究方向为环境微生物学.发表论文2篇.。
污水中氨水与氨氮关系

污水中氨水与氨氮关系1. 引言污水中氨水和氨氮是两个关键的指标,用于评估水体质量和污染程度。
氨水主要是指溶解在水中的氨气,而氨氮是指水中总氨的含量。
本文将深入探讨氨水与氨氮之间的关系,并介绍其在环境保护和污水处理中的重要性。
2. 污水中的氨水来源氨水主要来自于人类和动物的排泄物、工业废水、农业活动以及自然界的气体释放等。
在城市污水中,主要的氨水来源是卫生间、厨房和工业废水。
3. 污水处理中的氨氮去除氨氮的存在对水体生态系统和生物多样性产生了负面影响,因此在污水处理过程中需要去除。
下面介绍一些常用的氨氮去除方法:•生物法:通过采用好氧/厌氧处理系统,利用微生物将氨氮转化为无害物质。
其中,好氧条件下的硝化过程将氨氮氧化成硝酸盐,而厌氧条件下的反硝化过程将硝酸盐还原为氮气释放出去。
•物理法:物理方法主要是利用吸附剂、膜分离和离子交换等技术来去除氨氮。
吸附剂通常是经过特殊处理的固体填料,可以吸附污水中的氨氮分子。
膜分离则是通过特殊的过滤膜,使氨氮无法通过膜孔而达到去除的效果。
离子交换则是利用树脂吸附剂来去除水中的氨氮。
•化学法:利用化学药剂来沉淀或氧化氨氮,从而达到去除的目的。
常见的方式有氯化铁、氯气和臭氧等。
4. 氨水与氨氮的关系氨水和氨氮是密切相关的,其关系可以通过化学反应来说明。
在水中,氨氮呈两性离子的形式存在,即NH4+和NH3。
氨氮的总浓度可以通过测量总氨气(NH3和NH4+)的浓度来确定。
氨氮与氨水的关系可以用以下化学平衡反应来表示:NH3 + H2O ↔ NH4+ + OH-在碱性溶液中,氨氮主要以氨气的形式存在,而在酸性溶液中则主要以铵离子(NH4+)的形式存在。
5. 氨氮监测与控制准确监测和控制污水中的氨氮含量对于环境保护和污水处理至关重要。
常见的氨氮监测方法包括分光光度法、电化学法和化学分析法等。
在污水处理厂中,可以通过调节处理系统中的氧气供应、曝气时间和pH值等参数来控制氨氮的浓度。
生活污水氨氮

生活污水氨氮
生活污水中的氨氮污染一直是环境保护的重要问题。
随着城市化进程的加快和
人口数量的增加,生活污水中的氨氮排放量也在不断增加,给环境和人类健康带来了严重的威胁。
生活污水中的氨氮主要来自于人类生活和工业生产过程中的废水排放。
氨氮是
一种有毒有害的物质,它会对水体生态环境造成严重破坏。
高浓度的氨氮会导致水体富营养化,引发藻类大量繁殖,从而影响水质,破坏水生态系统的平衡,对水生生物造成危害。
除此之外,生活污水中的氨氮还会对人类健康造成威胁。
氨氮在水中会与氯消
毒剂发生反应,产生致癌物质亚硝胺,长期饮用含有亚硝胺的水会增加患癌症的风险。
因此,生活污水中的氨氮污染不仅对环境造成危害,也对人类健康构成威胁。
为了减少生活污水中的氨氮排放,我们需要采取一系列有效的措施。
首先,加
强生活污水处理设施的建设和改造,提高污水处理的效率,减少氨氮的排放。
其次,加强对生活污水中氨氮的监测和管理,严格控制氨氮的排放标准,严厉打击违法排放行为。
最后,加强对公众的环保意识教育,提倡绿色生活方式,减少生活污水的产生,从根本上减少氨氮的排放。
生活污水中的氨氮污染是一个严重的环境问题,需要社会各界的共同努力来解决。
只有大家齐心协力,才能保护好我们的环境,保障人类的健康。
希望在不久的将来,我们能够看到生活污水中的氨氮排放得到有效控制,水环境变得更加清洁,人们的生活质量得到提高。
总氮与氨氮的关系

总氮与氨氮的关系
总氮与氨氮是水质检测中常常使用的两个指标。
总氮是指水体中所有形态的氮元素的总量,包括无机氮、有机氮和氨氮等;而氨氮则是总氮中的一种形态,是指水体中以氨的形式呈现的无机氮成分。
总氮与氨氮的关系如下:
1. 总氮与氨氮在水体中的含量和比例是不确定的,因为它们的含量受到多种因素的影响,如水体的 pH 值、温度、溶解氧、有机物质的分解等。
2. 氨氮是总氮的一种形态,因此,总氮一定包括氨氮。
在水环境中,氨氮是最容易被微生物降解的一种无机氮,所以氨氮的浓度通常低于其他形态的无机氮。
3. 总氮和氨氮的检测都有不同的方法和标准。
在水质监测中,通常使用的检测方法包括Kjeldahl法和UV分光光度法。
检测标准也因不同国家和地区而异。
4. 总氮和氨氮对水体的影响也有一定的差异。
总氮主要反映水体中营养物质的总量,而氨氮则是反映水体中生物活性的指标,高浓度的氨氮会直接毒害水生生物。
总之,总氮和氨氮是水质检测中常用的指标,它们的含量和比例对水体的稳定平衡和水生生物的寿命都有重要影响。
河道水体氨氮浓度标准

河道水体氨氮浓度标准河道水体中的氨氮浓度是衡量水体污染程度的重要指标之一。
氨氮是指水体中溶解态氨和游离态氨所共同组成的总氨含量。
氨氮的来源主要包括农业排放、工业废水排放和生活污水排放等。
高浓度的氨氮会对水体生态环境和人类健康造成严重危害,因此对河道水体中的氨氮浓度进行监测和控制是非常必要的。
我国相关标准对河道水体中的氨氮浓度进行了严格规定。
根据《环境质量标准》(GB 3838-2002)中的规定,河道水体中的氨氮浓度标准为 1.0mg/L。
这个标准的制定是基于对水体生态环境和人类健康的保护考虑,旨在控制水体中的氨氮浓度,减少对水生生物和人类的危害。
那么,为什么要控制河道水体中的氨氮浓度呢?首先,高浓度的氨氮会对水生生物造成直接毒害。
氨氮会与水中的溶解氧结合,形成对鱼类和其他水生生物有害的亚硝酸盐。
亚硝酸盐会影响鱼类的呼吸和生长,甚至导致鱼类死亡。
此外,氨氮还会促进水藻的生长,导致水体富营养化,进而引发水华等问题。
高浓度的氨氮对人类健康也存在一定风险。
氨氮在水中会与有机物反应生成一些对人体有害的亚硝胺类物质。
长期饮用高氨氮浓度的水会增加人体患上癌症的风险。
此外,氨氮还会引起水体异味和变色,降低水质,影响人们的用水体验。
为了控制河道水体中的氨氮浓度,各地采取了一系列的措施。
首先,加强废水处理工作是降低氨氮浓度的关键。
农业、工业和生活废水中含有大量的氨氮,通过科学有效的处理工艺,可以将氨氮含量降低到规定的标准以下。
其次,加强农业面源污染的治理也是非常重要的。
农业生产中的农药和化肥使用过量会导致土壤和水体中的氨氮含量升高,因此要加强对农业面源污染的监管和管理。
此外,加强环保宣传教育,提高公众的环保意识和水资源保护意识,也是减少氨氮污染的重要手段。
河道水体中的氨氮浓度标准是保护水生生物和人类健康的重要依据。
我们应该加强对河道水体中氨氮浓度的监测和控制,通过加强废水处理、治理农业面源污染和提高公众环保意识等措施,降低水体中的氨氮浓度,保护水环境和人民健康。
浅谈氨氮和亚硝酸盐对金鱼的危害

氨氮和亚硝酸盐的危害对于我们循环水养殖的水体来说,水中的主要危害鱼类健康的物质是氨氮和亚硝酸盐。
在过滤系统尚未建立,或尚未成熟,或运转异常时,这两种物质的存在很让我们烦心。
氨氮对鱼的致死浓度在0。
2-2.0㎎/L,小于0.2㎎/L时,会使鱼类的内部器官发生病变、坏死及组织溃烂。
当氨氮中的非离子氨达到0。
01-0.02㎎/L时,易破坏鱼鳃的粘膜层,降低血红素携带氧的能力,使鱼类生长缓慢。
当非离子氨浓度达到0.02-0。
05㎎/L时,会引发多种疾病,增加死亡;达到0。
05-0.2㎎/L时,会破坏养殖鱼类的皮、胃、肠道粘膜,进一步引起内部器官和体表出血;达到0.2-0.5㎎/L 时,会引起鱼类急性中毒死亡。
水中亚硝酸盐含量在0 .1㎎/L时,鱼体血液中的血红蛋白变成高铁血红蛋白,使血液变成巧克力色,也就是养殖上常说的“褐血病",使血红蛋白的输氧能力下降,鳃肿胀,摄食减少,生长缓慢,疾病增多。
当浓度达到2。
5㎎/L时,鱼体呈中毒状态,呼吸作用下降,体能衰弱,最后暴发疾病而死亡。
氨氮是指水中以游离氨(NH3)和铵离子(NH4+)形式存在的氮。
鱼的粪便中含氮有机物很不稳定,容易分解成氨。
因此,水中氨氮含量增高时指以氨或铵离子形式存在的化合氨. 平时我们测量的是氨氮含量是氨(NH3)和铵离子(NH4+)的总和,其中,铵离子(NH4+)是无毒的,而氨(NH3)对爱鱼是剧毒的,当PH与温度较低时,大部份氨氮以铵离子(NH4+)的形式存在,而当PH值与温度升高后,则会有更多的氨氮以剧毒性的氨(NH3)存在,并呈倍数增长。
因此,当PH值与温度升高后,在同样氨氮含量情况下,更容易造成鱼氨氮中毒,当鱼氨氮中毒后,可以通过降低池水的PH值来减少氨(NH3)的比例。
附一张在不同PH值与温度下有毒氨(NH3)在总氨氮中所占比例图,与鱼友分享,做到心中有数,防止氨中毒。
国家渔业用水要求有毒氨(NH3)含量小于0。
02mg/L,实际养殖中很难达到,一般不超过0。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨氮对水体的影响
氨氮是指水中以游离氨(NH3)和铵离子(NH4+)形式存在的氮,两者的组成比取决于水的pH值和水温。
当pH值偏高时,游离氨的比例较高;反之,铵盐的比例高。
氨氮是环境水体污染的一项重要指标,其氧化过程会造成水体中溶解氧浓度降低,导致水体发黑发臭,水质下降,对水生动植物的生存造成影响。
当水体氨氮浓度较高时,会导致水体富营养化,进而造成一系列的严重后果。
水体中的分子氨浓度过高时会使鱼虾产生毒血症,长期的氨氮偏高则将影响鱼虾的生长繁殖,严重性的将中毒至死亡。

