高中化学基础知识网络图-高中化学重要知识点详细总结
高中化学知识结构网络图

高中化学知识结构网络图高中化学知识结构网络图化学基本概念和基本理论元素与化合物有机化学基础化学计算化学实验化学工业知识化学基本概念和基本理论物质的分类组成原子的粒子间的关系核电荷数(Z)=核内质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)元素周期律与周期表化学键与分子结构晶体类型与性质晶体类型性质比较离子晶体分子晶体原子晶体金属晶体结构组成粒子阴、阳离子分子原子金属阳离子和自由电子粒子间作用离子键范德华力共价键金属键物理性质熔沸点较高低很高有高有低硬度硬而脆小大有大有小、有延展性溶解性易溶于极性溶剂,难溶于非极性溶剂极性分子易溶于极性溶剂不溶于任何溶剂难溶(钠等与水反应)导电性晶体不导电;能溶于水的其水溶液导电;熔化导电晶体不导电,溶于水后能电离的,其水溶液可导电;熔化不导电不良(半导体Si)良导体(导电传热)典型实例NaCl、NaOHNa2O、CaCO3干冰、白磷冰、硫磺金刚石、SiO2晶体硅、SiCNa、Mg、AlFe、Cu、Zn化学反应类型离子反应氧化还原反应的有关概念的相互关系化学反应中的能量变化溶液与胶体化学反应速率化学平衡弱电解质的电离平衡溶液的酸碱性盐类的水解酸碱中和滴定元素与化合物钠及其化合物电化学碱金属氯及其化合物卤素氧族元素硅及其化合物硫的重要化合物材料碳及其化合物氮族元素氨氮和磷硝酸镁和铝铁及其化合物铜及其化合物有机化学基础烃不饱和链烃芳香烃分类通式结构特点化学性质物理性质同分异构烷烃C n H2n+2(n≥1)①C-C单键②链烃①与卤素取代反应(光照) ②燃烧③裂化反应一般随分子中碳原子数的增多,沸点升高,液态时密度增大。
气态碳原子数为1~4。
不溶于水,液态烃密度比水的小碳链异构烯烃C n H2n(n≥2)①含一个C≡C键②链烃①与卤素、H:、H2O等发生加成反应②加聚反应③氧化反应:燃烧,被KMnO4酸性溶液氧化碳链异构位置异构炔烃C n H2n-2(n≥2)①含一个C≡C键②链烃①加成反应②氧化反应:燃烧,被KMnO4酸性溶液氧化碳链异构位置异构苯及其同系C n H2n-6(n≥6)①含一个苯环②侧链为烷烃基①取代反应:卤代、硝化、磺化②加成反应③氧化反应:燃烧,苯的同系物能被KMnO4酸性溶液氧化简单的同系物常温下为液态;不溶于水,密度比水的小侧链大小及相对位置产生的异构物烃的衍生物代表物质转化关系烃的衍生物结构、通式、化学性质鉴别类别官能团结构特点通式化学性质卤代烃-X(卤素原子)C-X键在一定条件下断裂C n H2n+1O2(饱和一元)(1)NaOH水溶液加热,取代反应(2)NaOH醇溶液加热,消去反应醇-OH(羟基)(1)—OH与烃基直接相连(2)—OH上氢原子活泼C n H2n+2O2(饱和一元)(1)取代:脱水成醚,醇钠,醇与羧酸成酯,卤化成卤代烃(2)氧化成醛(—CH2OH) (3)消去成烯醛(1)醛基上有碳氧双键(2)醛基只能连在烃基链端C n H2n O2(饱和一元)(1)加成:加H2成醇(2)氧化:成羧酸羧(1)—COOH可电离出H+(2)—COOH难加成C n H2n O(饱和一元)(1)酸性:具有酸的通性(2)酯化:可看作取代酯,R 必须是烃基C n H2n O2(饱和一元)水解成醇和羧酸酚(1)羟基与苯环直接相连(2)—OH上的H比醇活泼(3)苯环上的H比苯活泼(1)易取代:与溴水生成2,4,6-三溴苯酚(2)显酸性(3)显色:遇Fe3+变紫色糖类类别葡萄糖蔗糖淀粉纤维素分子式(C6H12O6)(C12H22O11)(C6H10O5)(C6H10O5)结构特点多羟基醛分子中无醛基,非还原性糖由几百到几千个葡萄糖单元构成的天然高分子化合物由几千个葡萄糖单元构成的天然高分子化合物主要性质白色晶体,溶于水有甜味。
高一化学所有知识点归纳总结图片

高一化学所有知识点归纳总结图片【注意】本文所列知识点仅适用于高中一年级的化学学习内容,涵盖了相关的基础概念、实验原理、化学方程式等,配以适当的图片示意,方便加深理解与记忆。
下面将按照化学课程的顺序进行知识点的归纳总结。
【1. 原子结构与元素周期表】图片1:原子结构示意图(包括原子核、质子、中子、电子)图片2:元素周期表(包括元素符号、元素周期、族、周期的特点)【2. 化学键与分子结构】图片3:离子键的形成示意图图片4:共价键(单、双、三键)的形成示意图图片5:分子结构示意图(包括线性、角形、平面、四面体等分子形状)【3. 化学反应与化学方程式】图片6:化学反应的示意图(包括反应物、生成物、反应条件等)图片7:化学方程式的书写与平衡示例【4. 物质的量与化学计量】图片8:摩尔的概念与计算示例图片9:化学计量问题的解题步骤与实例【5. 气体与气体反应】图片10:气体分子速率与碰撞示意图图片11:理想气体状态方程的推导过程【6. 溶液与溶剂】图片12:溶液的组成示意图图片13:常见饱和溶解度图表【7. 酸碱与盐】图片14:酸、碱、中性物质的示意图图片15:酸碱中和反应原理与指示剂作用示例【8. 化学反应速率与平衡】图片16:反应速率示意图(含浓度、温度、催化剂等因素的影响)图片17:化学反应平衡示意图(含正向反应、反向反应、平衡常数等)【9. 电解质与电化学】图片18:电解质与非电解质示意图图片19:电化学池示意图(包括阴阳极、电解质溶液、电子流动等)【10. 氧化还原与电化学反应】图片20:氧化还原反应原理图示图片21:电化学反应(包括电池、电解槽)的示意图和应用实例以上图片仅为归纳总结化学知识点时的示意图,具体内容还需根据课本、教师指导进行详细学习和理解。
通过图片的形式呈现,可以更好地帮助理解和记忆化学知识点,以实现对相关知识的掌握与应用。
希望以上内容对您的学习有所帮助。
(完整)高中化学知识结构图
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
高中化学知识点总结完整

高中化学知识点总结完整一、基本概念与原理1. 物质的分类- 纯净物:由单一种类的分子或原子组成,具有固定的性质。
- 混合物:由两种或两种以上不同物质混合而成,各组成部分保持原有性质。
2. 物质的量- 摩尔(mol):物质的量的单位,1摩尔代表6.022×10^23个基本单位。
- 阿伏伽德罗定律:在相同温度和压力下,相同体积的气体含有相同数量的分子。
3. 化学反应- 化学方程式:用化学符号表示化学反应的过程。
- 反应物与生成物:参与反应的物质称为反应物,反应后生成的物质称为生成物。
- 守恒定律:质量守恒、电荷守恒、能量守恒。
4. 溶液与浓度- 溶液:一种或几种物质以分子或离子形式分散在另一种物质中形成的均一混合物。
- 浓度:表示溶液中溶质的含量,常用单位有摩尔/升(mol/L)和质量/升(g/L)。
5. 酸碱理论- 布朗斯特-劳里酸碱理论:酸是质子(H+)的给予者,碱是质子的接受者。
- pH值:表示溶液酸碱性的量度,pH=-log[H+]。
二、元素化学1. 周期表- 元素周期表:按照原子序数排列所有已知元素的表格。
- 主族元素:周期表中第1族至第2族和第13族至第18族的元素。
- 过渡元素:周期表中第3族至第12族的元素。
2. 元素的性质- 金属与非金属:金属具有良好的导电性和延展性,非金属通常不导电。
- 半金属:具有金属和非金属特性的元素,如硅和锗。
3. 重要元素及其化合物- 氧、氢、碳、氮、硫、磷、氯、钠、钾等元素及其化合物的性质和反应。
三、化学键与分子结构1. 化学键- 离子键:正负离子间的静电吸引力。
- 共价键:两个原子共享一对电子形成的键。
- 金属键:金属原子间的电子共享形成的键。
2. 分子结构- 分子的几何形状:分子中原子的空间排列。
- 杂化轨道理论:解释分子几何形状的理论。
3. 晶体结构- 晶体:具有规则几何形状和固定熔点的固体。
- 晶格:晶体内部原子、离子或分子的排列方式。
高中化学基础知识网络图完整版
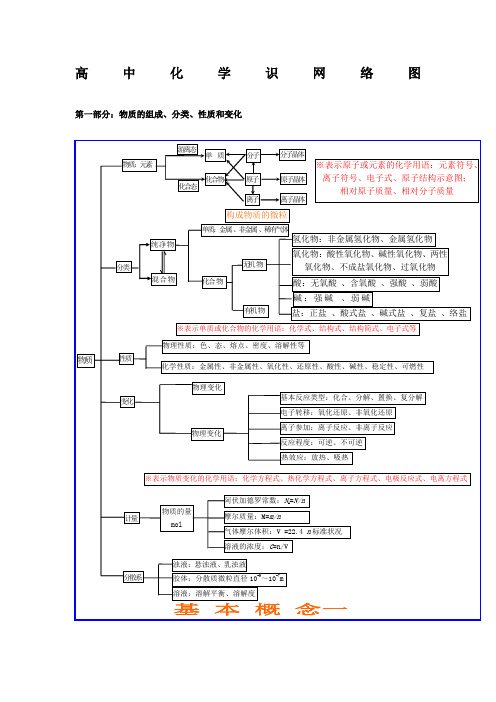
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论物质结构、化学反应速率、化学平衡、电解质溶液第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸官能团:—NH 2和—COOH高分子化合物链烃脂肪烃环烃饱和链烃 烷烃:C n H 2n+2n ≥1R —CH 3不饱和链烃 烯烃:C n H 2n n ≥2 R —CH=CH 2二烯烃:C n H 2n-2n ≥4R —CH=CH —CH=CH 2 炔烃:C n H 2n-2n ≥2 R —C ≡CH环烷烃C n H 2n n ≥3芳香烃苯和苯的同系物C n H 2n-6n ≥6天然高分子:橡胶聚异戊二烯、多糖、蛋白质R卤代烃官能团:—X :饱和一卤代烃C n H 2n+1Xn ≥1R —X 醇 官能团:—OH :饱和一元醇C n H 2n+1OHn ≥1R —OH 醚 C n H 2n+2O n ≥2R —O —R 酚苯酚官能团:—OHC n H 2n-6O n ≥2OH羧酸 官能团:—COOH :饱和一元羧酸 C n H 2n+1O 2 n ≥1R —COOH醛 官能团:—CHOC n H 2n O n ≥1R —CHO 酮 官能团:—CO —C n H 2n O n ≥3R —CO —R ’酯 官能团:—COO —R :饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 n ≥2R —COOR ’ 硝基化合物官能团—NO 2R —NO 2 胺官能团—NH 2R —NH 2单糖:葡萄糖、果糖C 6H 12O 6互为同分异构二糖:蔗糖、麦芽糖C 12H 22O 11互为同分异构 多糖:淀粉、纤维素C 6H 12O 6n n 值不同合成高分子合成塑料合成橡胶 合成纤维有机化合物。
高一化学必修一思维导图,全册知识点分享

高一化学必修一思维导图,全册知识点分享发布时间: 2022-9-20 | 标签:化学必修一思维导图高一化学必修一思维导图高中化学必修一应该如何画好高一化学必修一思维导图呢?刚刚进入高一的同学们,面对难度倍增的化学知识可真是头大。
高中化学确实不简单,因此知犀为大家整理了一份高一化学必修一思维导图,同学们可以借助导图,从宏观上理清必修一整本书的脉络结构以及一些重难点知识。
知识点再多再杂,也能完全理顺!现在就一起来看一下高一化学必修一思维导图吧~高一化学必修一思维导图(1)大纲高一化学必修书共分六章。
分别是:第一章关于实验化学,第二章关于化学物质及其变化,第三章关于金属及其化合物,第四章关于非金属及其化合物。
高一化学必修一思维导图(2)第一章:从实验学化学第一章是化学实验的入门知识。
学生应了解常用仪器的识别和使用,掌握基本的实验操作,防止实验事故的发生。
高一化学必修一思维导图(3)第二章:物质的分类本节要求学生简单地根据物质的成分进行分类,并掌握常用的分类方法。
高一化学必修一思维导图(4)第二章:离子反应本节内容主要是掌握离子方程式的书写。
高一化学必修一思维导图(5)第二章:氧化还原反应本节要求掌握氧化还原反应的概念,从化学价态变化的分类标准理解氧化还原反应的特点。
高一化学必修一思维导图(6)第三章:金属的化学性质在这一节中,首先给出金属的简要概述,其次已知钠和铝与氧的反应,最后了解金属与酸和水的反应。
高一化学必修一思维导图(7)第三章:钠及其化合物这部分的内容是重点内容。
学生需要认识到钠是一种典型的活性金属元素,从钠的物理性质、化学性质、化合物及相关计算等方面综合控制钠。
高一化学必修一思维导图(8)第三章:铝及其化合物学习铝也是从它的物理性质,化学性质,化合物以及相关的计算。
高一化学必修一思维导图(9)第三章:铁及其化合物学习铁,首先需要对铁的物理化学性质有一个初步的了解,其次是了解铁的氧化物和氢氧化物,最后通过实验学会区分铁盐和盐铁盐。
高中元素化合物部分重要化学方程式(带网络图)

高中元素化合物部分知识网络及重要化学方程式1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Na和H2O的反应:2Na+2H2O===2Na++2OH-+H2↑②Na和CH3COOH的反应:2Na+2CH3COOH===2CH3COO-+2Na++H2↑③Na2O2和H2O的反应:2Na2O2+2H2O===4Na++4OH-+O2↑④Na2O2和CO2的反应:2Na2O2+2CO2=== 2Na2CO3+O2⑤NaH和水的反应:NaH+H2O===Na++OH-+H2↑⑥向NaOH溶液中通入过量CO2:OH-+CO2===HCO-3⑦向Na2CO3溶液中通入过量CO2:CO2-3+CO2+H2O===2HCO-3⑧将Na2CO3和Ca(HCO3)2混合:CO2-3+Ca2+===CaCO3↓⑨将NaHCO3溶液和NaOH溶液等物质的量混合:HCO-3+OH-===CO2-3+H2O⑩将NaHCO3溶液与澄清石灰水等物质的量混合:HCO-3+Ca2++OH-===CaCO3↓+H2O⑪将NaHCO3溶液与少量澄清石灰水混合:2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O⑫向饱和Na2CO3溶液中通入过量CO2气体2Na++CO2-3+CO2+H2O===2NaHCO3↓2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Al和NaOH溶液的反应:2Al+2OH-+2H2O===2AlO-2+3H2↑②Al(OH)3和NaOH溶液的反应:Al(OH)3+OH-===AlO-2+2H2O③Al(OH)3和盐酸的反应:Al(OH)3+3H+===Al3++3H2O④Al2O3和NaOH的反应:Al2O3+2OH-===2AlO-2+H2O⑤Al2O3和盐酸的反应:Al2O3+6H+===2Al3++3H2O⑥NaAlO2和少量盐酸的反应:AlO-2+H++H2O === Al(OH)3↓⑦NaAlO2和过量盐酸的反应:AlO-2+4H+===Al3++2H2O⑧向NaAlO2溶液中通入过量CO2气体:AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3⑨将NaAlO2与NaHCO3混合:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3⑩将NaAlO2与AlCl3溶液混合:3AlO-2+Al3++6H2O===4Al(OH)3↓⑪向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-===AlO-2+2H2O⑫向AlCl3溶液加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH+4⑬将AlCl3溶液与NaHCO3溶液混合:Al3++3HCO-3===Al(OH)3↓+3CO2↑3.铁及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
高中化学知识点总结含知识框架图

必修1知识点1 认识化学科学考点1 化学科学考点2 物理变化与化学变化考点3 化学反应基本类型知识点2 物质的量及其计算考点1 物质的量考点2 气体摩尔体积考点3 阿伏加德罗定律及推论知识点3 常用仪器和基本操作考点1 常用仪器形状、名称和使用考点2 化学实验基本操作知识点4 化学实验安全常识考点1 药品的安全存放考点2 化学实验安全常识和操作知识点5 配制一定物质的量浓度的溶液考点1 一定物质的量浓度的配制考点2 配制一定物质的量浓度误差分析考点3 物质的量浓度与溶质质量分数的换算知识点6 常见物质的检验、分离和提纯考点1 常见气体、离子的检验考点2 物质分离和提纯知识点7 化学实验设计考点1 化学实验方案设计的基本要求考点2 物质检验的实验设计知识点8 分散系考点1 胶体的性质及应用考点2 有关溶解度的计算知识点9 离子反应考点1 电解质与电离考点2 离子方程式的书写及正误判断考点3 离子共存知识点10 氧化还原反应考点1 氧化还原反应的概念考点2 氧化性、还原性强弱的判断考点3 氧化还原反应的规律考点4 氧化还原反应方程式的配平考点5 氧化还原反应的计算知识点11 钠及其化合物考点1 钠考点2 氧化钠与过氧化钠考点3 碳酸钠与碳酸氢钠考点4 碱金属元素知识点12 镁及其化合物考点1 镁及其化合物考点2 海水中提取镁知识点13 铝及其化合物考点1 铝考点2 铝的化合物考点3 铝的冶炼知识点14 铁及其化合物考点1 铁考点2 铁的冶炼考点3 铁的化合物知识点15 铜及其化合物考点1 铜及其冶炼考点2 铜的化合物知识点16 氯及其化合物考点1 氯气的性质考点2 氯气的制法考点3 卤素知识点17 氮及其化合物考点1 氮气的性质及用途考点2 氮的氧化物的性质考点3 氨气的性质及制法考点4 铵盐的性质考点5 硝酸的性质知识点18 硫及其化合物考点1 硫的存在及性质考点2 硫的氧化物考点3 硫酸的性质考点4 硫酸的工业制备知识点19 硅及其化合物考点1 硅的性质及制法考点2 二氧化硅和硅酸盐性质考点3 硅酸盐工业必修2知识点1 物质结构基础考点1 原子结构考点2 元素周期律考点3 元素周期表考点4 化学键知识点2 化学能与热能考点1 反应热考点2 燃烧热和中和热考点3 热化学方程式考点4 盖斯定律知识点3 化学能与电能考点1 原电池工作原理考点2 常见的化学电源考点3 金属的腐蚀与防护考点4 电能转化为化学能——电解知识点4 化学反应速率和限度考点1 化学反应速率考点2 影响化学反应速率的因素考点3 化学反应限度与化学平衡知识点5 有机物基础知识考点1 有机物的结构特点和性质考点2 同系物和同分异构体知识点6 烃的分类考点1 甲烷的结构和性质考点2 烷烃的结构和性质考点3 乙烯和烯烃考点4 苯及其同系物知识点7 化石燃料的综合利用考点1 石油的炼制考点2 煤的综合利用知识点8 烃的衍生物的分类考点1 乙醇的结构和性质考点2 乙酸的结构与性质考点3 酯和油脂的结构与性质考点4 糖类的结构与性质考点5 蛋白质的结构与性质知识点9 有机高分子材料考点1 有机高分子化合物考点2 三大合成材料知识点10 资源的综合利用和环境保护考点1 自然资源的开发和利用考点2 环境污染及保护选修1 化学与生活知识点1 化学与健康考点1 糖类考点2 油脂考点3 氨基酸与蛋白质考点4 维生素和微量元素考点5 饮食中食物及食品添加剂考点6 常见药物的成分及疗效知识点2 生活中的材料考点1 金属与合金考点2 金属的腐蚀和防护考点3 玻璃、陶瓷和水泥考点4 塑料、纤维和橡胶知识点3 化学与环境保护考点1 大气污染及治理考点2 水污染及其污水处理考点3 土壤污染与垃圾资源化选修2 化学与技术知识点1 化学与资源开发利用考点1 接触法制硫酸考点2 纯碱的生产考点3 化石燃料的综合利用考点4 海水的综合利用知识点2 化学与材料的制造、应用考点1 金属材料考点2 无机非金属材料考点3 高分子化合物与材料知识点3 化学与工农业生产考点1 获取洁净的水考点2 人工固氮技术——合成氨考点3 化肥与农药考点4 精细化学品选修3 物质结构与性质知识点1 原子结构与元素的性质考点1 原子结构的构造原理考点2 原子结构与元素的性质知识点2 化学键与物质的性质考点1 共价键考点2 分子的立体结构知识点3 分子间作用力与物质的性质考点1 键的极性与分子的极性考点2 分子间作用力知识点4 晶体类型考点1 分子晶体与原子晶体考点2 金属晶体考点3 离子晶体选修4 化学反应原理知识点1 化学反应的热效应考点1 化学反应的焓变考点2 热化学方程式考点3 盖斯定律考点4 反应焓变与标准摩尔生成焓知识点2 原电池原理及其应用考点1 原电池的工作原理考点2 化学电源考点3 金属的腐蚀及防护知识点3 电解的原理及其应用考点1 电解的工作原理考点2 电解的应用——电镀、电解精炼、电冶金考点3 氯碱工业知识点4 化学反应速率和化学平衡考点1 化学反应速率考点2 影响化学反应速率的因素考点3 化学反应进行的方向考点4 化学平衡考点5 影响化学平衡的因素考点6 合成氨的适宜条件及选择依据知识点5 溶液中的离子平衡考点1 弱电解质的电离考点2 水的电离和溶液的酸碱性考点3 盐类水解的规律考点4 盐类水解的应用考点5 沉淀溶解平衡选修5 有机化学基础知识点1 有机化合物的组成与结构考点1 有机化合物的分类考点2 同分异构体考点3 有机化合物的命名考点4 有机物常用分离、提纯的方法考点5 有机物分子式的确定知识点2 烃的性质考点1 烷烃考点2 烯烃考点3 炔烃考点4 芳香烃知识点3 烃的衍生物的性质考点1 卤代烃考点2 乙醇和醇类考点3 苯酚和酚类考点4 乙醛和醛类考点5 羧酸和酯考点6 有机合成知识点4 糖类、氨基酸和蛋白质考点1 糖类考点2 蛋白质和核酸知识点5 合成高分子化合物考点1 合成高分子化合物的基本方法考点2 高分子材料选修6 实验化学知识点1 化学实验基础考点1 物质的分离和提纯考点2 物质的检验与鉴别考点3 物质的制备和合成方法考点4 中和滴定法测定食醋中的醋酸的含量知识点2 化学实验探索考点1 常见性质实验方案的设计考点2 化学实验设计与评价高中化学知识框架一、化学基本概念和基本理论(一)物质的分类(二)组成原子的粒子间的关系核电荷数(Z)=核内质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)(三)元素周期律与周期表(四)化学键与分子结构(五)晶体类型与性质(六)化学反应类型(七)氧化还原反应的有关概念的相互关系(口诀:升失氧化还原剂,降得还原氧化剂)(八)离子反应(九)化学反应中的能量变化(十)溶液与胶体(十一)化学反应速率(十二)化学平衡1、化学平衡化学平衡常数的计算:对于可逆化学反应m A+n B⇋pC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:在书写平衡常数表达式时,要注意以下问题:②化学平衡常数表达式与化学方程式的书写方式有关。
高中化学知识导图

书中还摘录了一些化学史上的经典实验和发现,如门捷列夫的元素周期表、居 里夫人的放射性研究等。这些经典案例不仅丰富了我们的化学知识,还激发了 我们对科学探索的热情。
值得一提的是,书中还提供了大量的练习题和解题技巧。这些练习题涵盖了高 中化学的各个方面,有助于我们巩固所学知识,提高解题能力。解题技巧的分 享也让我们在解题过程中更加得心应手。
《高中化学知识导图》这本书是一本极具价值的学习资料。它不仅为我提供了 全面、系统的化学知识,还以其独特的思维导图形式,激发了我对化学学习的 热情。我相信,有了这本书的帮助,我能够更好地理解和掌握化学知识,为未 来的学习和生活打下坚实的基础。
目录分析
《高中化学知识导图》是一本旨在帮助学生系统掌握高中化学知识结构的辅导 书籍。通过目录的分析,我们可以一窥其内容的深度和广度,以及该书如何运 用知识导图的方式帮助学生建立化学知识体系。
内容摘帮助学生更好地理解和掌握。同时,本 书还提供了大量的例题和练习题,帮助学生巩固所学知识,提高解题能力。 本书还介绍了高中化学学习中常用的解题方法和技巧,包括化学计算、实验操作、数据分析等方 面的内容。通过思维导图的形式,将解题步骤和思维过程进行可视化呈现,帮助学生形成科学的 解题思路和方法。 在书的最后部分,本书提供了高中化学的复习指南和提高建议。通过思维导图的方式,帮助学生 梳理知识脉络,明确复习重点和方向。本书还提供了一些拓展知识和学习资源,帮助学生进一步 提高化学学科素养和综合能力。 《高中化学知识导图》这本书通过思维导图的形式,将高中化学的核心知识点和逻辑关系进行了 系统的梳理和呈现。
《高中化学知识导图》的目录结构清晰、逻辑严谨,充分体现了知识导图的学 习理念。通过对目录的分析,我们可以看到该书对于高中化学知识的系统整合 和深度挖掘,以及对于学生如何高效学习化学的指导。这样的目录设计,无疑 会对学生的学习起到积极的促进作用。
(人教版)高中化学必修一章节思维导图集

(人教版隔中化学必修一苹节思维导图集(人教版)化学必修一章节复习思维导图集(人教版隔中化学必修一苹节思维导图集"虑归禽国体和液体的泯台体11头除去液体中不溶性IS体。
(前、删、诫璃棒、強杯〉不紆蜕拌・有雄B品体时就应血疝•余热蒸发至干•顾防迅热而迸硒壬把稀沁5含际漏g干,①液体体稅©加热方式歸度计水说球位置©冷却師水流方向©陆液体累沸1-化字实3木方法蒸谓<利用弗卓不叵陥去液体温台物中瞼擇岌或不慄发的金底<?®rgiw.、泗菇灯・温阳•冷蓝官•怯液楚•<锂形财》棊BR剤:原涓竅中的泪剤互不相:审g>则滔旗的滔解度夷远大于原溶剤■ g>裘易于挥股O鯉利用沼质在互不相洽的洛利里洛斛度的不冋•用一种泪剖把^痕从它与月一落於所测的浴滋里提取出来的幔作•主要仪器:分液帚耳分取5叱轉S上口吗------ <把互不相淄的初种濒休分开削抿作,与萃取趾合fife用的物殆的量实际上表示含片一定数目較子的集体物质的EB的单位标准协况STP 座尔戒里Moc禾H标淮夭气压吓4 mol任问韧灰含的細嗽目那是6.02肚02九伽d任何物辰毀燮是在数低上相对欣虽伯帯气你摩尔你枳Vm imolff何气体的标淮状况下的体初邯约为2241网伏加待罗定徉(由PV-nRT^ail同温同压下同体敦的住何气体有同分子菽初质M瞒更m m=M«n n=mfM M=m/n标淮状況气体体积v v=n«vm n^VJVm vm=v/n物质餉粉子對H N-NAxn n -N/NA NA-N/nJ物欣的里浓ISCB与濬质的欣里分埶3k汨液稀押观徉C《浓〉Q/《浓〉-C《嵇)*V(tt)2化学计現蠶实验中的应用咲物联的里为中心"浓敗厂逊中頤含郴nm林颐麵弊填第用托盘天平《或里冏〉、曲杯、玻璃祷、昔里疏、哌头昵函制一走物底的里沬度的溶液主要步猱:⑴计算G)称圮(如忌液体就用漓定世里取)①滔解(少更水・抗拌•注怠:令却〉⑷转液(脊虽頑要先檢漏•瑛菇棒引流〉⑸先滦(洗涤液一并倍移到咨里航中〉⑹际扭⑺宝吝⑻捉匀G孟田瓯卜XRfRPainRl玮a 6玄I9UX卜口右初I召炜(人教版隔中化学必修一苹节思维导图集3OS化合眩娜恥7游肚斟翘gggg巫U郦鮒—不皑咖■理单分衆離胡鞠M单特塹砸鎭輔丰皱单质单氏二、苗磁黴生粽件苗方肘jij丁苗处瞬輔:性蟻分縣二、分額軀分类⑴細类3"化阴师轴迤加NaO吒強脑師胡棚麴悯®6®嫌菇钱魯丹戯呦帼0吒雜育红鹉断滋加KSCN;隸出恥1*1色! f矽耐潴©tONaOK谢直舫绥j憨购磯轨舱级QK£C怔縣测酚駄酬血I色畫刑蝶(瞬腿却般勅1HCI无腮.帥B3血溯祕于勵睫鞍Ch加I •辭墙并酮N03師HNO3碱育不潘干碣E酥斜0肉艳诉敵&、耙無彻阚瞬子8漑屈后协少數谧押几砌片诫劑玮醐協铀(N02)一、顾碗魏念磁应潞甌单腺義腳輸和釧推.聪子、(铀八枚还原、发扭阪应趨匝•純5二财純關丫 --------------- ------------------------------------------------------一还輔矽补潮汕失电孑、(個八師化、匙轍反鹹《化带_ • - _ _. _ … .一一一一化飯広不一定是轲城原负宓-綃棘缴曲比合離轎帧自湖洲反应才霹烦褪庄[朋廳不-報轲拡販宓-繍輛鉤m飯齟髀馬諭般融才騙临簸庄空輕丄胡踰-定題畑麵夏朋蚯一定不是氨化西融S7.73%««够加I与二輸铀融誓名(游h小腐)幽陳(碑1痫側)」曲気气申融(抽P2=2Na2O> \ -、銀畀金辎融舰磺申除(血+02咖3202) f ;―从仏金裁化制擴苗俣师---------------- 2、谶旳瀾觀*臊翱*.翔的站询与熾融(2阳 + 2H2O = 3hOH*H2)筋金辭枚(干励土双)二錄顷机蝴融丿三、隣翻师脇越]心物魅對化抄肚牌蝴朗耒竝附Z合细擁2、几殛脏靴合协二、路軽北纲三、賂重要比纳诡醍滋W飙肌是聽鈕靛f耽翎砥创S申熾狀熾埶魏搦飜毎湖a靑加髦1解麟細球朽Ca越色際辟邛Cu瑕腑韵黔-黝帧麵誌化的申碗前:化删牖靴除、靴味醱化戋及舷用仃師伽不苗棚石水甌\ 5ME一十(刼畑朋翊:化扶2、黝諒㈱$ ---------------------------------------- 彌莎「肆般臓就二倉化區舵态 石朿的昌佐皱枪 物理和化学性能 与氢氟親勺反应氨在自建畀空磚在与强阙勺反应;硅麼的性贞 氛气3玻现和徧认 篠版的应用 辻酸腋体的制肛田琏、氧、金传元弄组成的化台物的总称结构复杂化学盾起宝 炭筲甲的运删雀闽钠.水沼複佰称朮城瑪二 5^ 纯诚、石加石、石英熔和制得 玻找 輕陽盐产品 魁土 S 石融石融 > 再加入石吉 水淀 験化莊(佰祢金沏砂〉 確钢」 连橡脸分子蘇(拾硅谧)单质琏有品沐和元定前两种物理性质三、硅虫质化学性质・弓豆敦化钠反应良好的半导体林料氨的校理性质—、冕工止乱艺殆耘1、无机非金国射料的圭曲毛3 -.師和或的氧化物/氮气的枷連性底 五气勻金匡的丘应| 一、詹茨的苗錄色气惋•颌气—— ------------- ---------2、冨集在縛水中曲元素话厂------------- 尊氟气与丰鈿的反应•氢气杀苗;原理氟加、注桁蒂、猱白液、瀝白粉二、我窑子笛総验僅用祜骸困落克,并用溶5«翊瞬干扰离子大台污染物谦的迭炮 二冠化谥戒理性质 一、二氧化琏和三毎化磽二氧化&祸財< 反应二筑化躺猱白性 二氧化违伸 气反应 三氧化磕租水反应 三範化说獅性氧代枷反应 三氧化硫和址阪应 陨代氢t 旗及其吉性 一至化藏户生I 一氧化豆与筆气反应二、二氧化誌一虽北氮」二氧化敝物理性质二笔化觅与木反范曲二甲盼年燧料。
高一化学s知识点总结思维导图

高一化学s知识点总结思维导图高一化学知识点总结思维导图化学是一门研究物质组成、结构、性质、变化以及它们之间的相互关系的科学。
在高中化学学习中,我们需要掌握许多知识点,这些知识点相互联系,构成了一个庞大的知识网络。
为了更好地总结和理清这些知识点之间的关系,我们可以使用思维导图的方式来进行思考和学习。
思维导图是一种以图形化的方式呈现信息的方法,可以帮助我们更好地理解和记忆知识点。
下面是一个按照高一化学课程内容设计的思维导图。
一、物质的分类1. 纯物质与混合物的区别2. 纯物质的分类:元素和化合物3. 混合物的分类:均匀混合物和非均匀混合物二、原子结构与元素周期表1. 原子结构:质子、中子、电子2. 元素的概念与特征3. 元素周期表的组成和排列规律4. 元素周期表中的各种信息:原子序数、原子量、化学符号等三、化学键与化合物1. 化学键的类型:离子键、共价键、金属键2. 化合物的命名规则:一氧化碳、氯化钠等3. 化合物的分类:无机化合物和有机化合物四、化学方程式与化学反应1. 化学方程式的组成部分:反应物、生成物、反应条件等2. 化学方程式的平衡与配平3. 化学反应的类型:酸碱中和反应、氧化还原反应、置换反应等五、溶液与溶解度1. 溶液的组成与特征:溶质和溶剂的概念2. 溶解度的概念与影响因素:温度、压力等3. 饱和溶液与过饱和溶液的区别六、酸碱中和反应1. 酸和碱的定义与性质:酸性溶液、碱性溶液和中性溶液2. 酸碱指示剂与pH值的测定3. 酸碱中和反应的应用:制备盐、酸雨等七、氧化还原反应1. 氧化还原反应的定义和特征2. 氧化剂和还原剂的概念与性质3. 氧化还原反应的应用:电池、金属的腐蚀等八、物质的量与化学计量1. 相对原子质量与相对分子质量的计算2. 物质的量与摩尔的概念:摩尔质量、摩尔体积等3. 化学计量与化学方程式的关系九、热化学1. 热量的传递方式与单位2. 热化学方程式与热反应3. 热量计算与热效应:焓变、反应焓等以上仅是高一化学课程内容的一小部分,通过这种思维导图的方式,我们可以更加清晰地了解知识点之间的关系,有助于我们更好地理解和记忆化学知识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
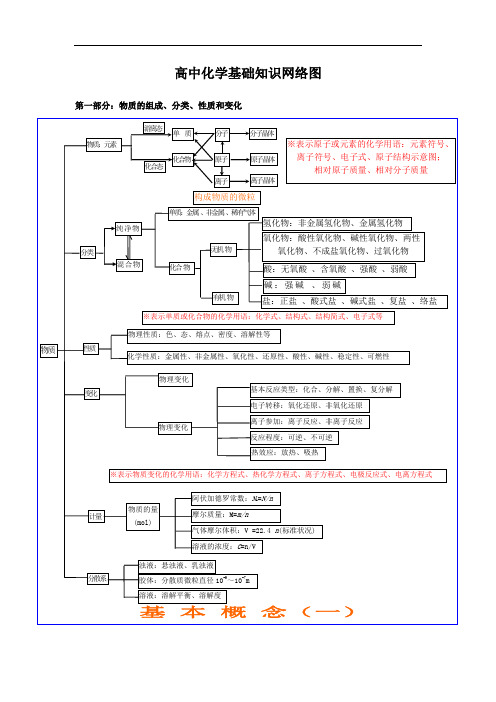
高中化学基础知识网络图-高中化学重要知识点详细总结高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化—碱:强碱、弱碱※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化 基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式阿伏加德罗常数: N =N/n念(一)浊液:悬浊液、乳浊液胶体:分散质微粒直径 10〜10 m溶液:溶解平衡、溶解度分散系!■物质:元素化合态■单■质T■分子晶体离子晶体※表示原子或元素的化学用语:元素符号、 离子符号、电子式、原子结构示意图; 相对原子质量、相对分子质量构成物质的微粒单质:金 属、非金属、稀有气体纯净物'物氢化物:非金属氢化物、金属氢化物 氧化物:酸性氧化物、碱性氧化物、两性 氧化物、不成盐氧化物、过氧化物 酸:无氧酸、含氧酸、强酸、弱酸 有机物盐:正盐、酸式盐、碱式盐、复盐、络盐物质变化I 物理变化离子参加:离子反应、非离子反应 反应程度:可逆、不可逆 计量物质的量(mol)气体摩尔体积: V =22.4 n (标准状况)溶液的浓度: C =n/V*化合物分子离子化合物L摩尔质量:M=rn/n高中化学基础知识网络图-高中化学重要知识点详细总结色、态、味 金属性、非金属性 溶解度、熔点、沸点 氧化性、还原性 密度、硬度、导电性酸性、碱性 游离态导热性、塑性稳定性、可燃性■+化合物•单质物理性三质化学,性质L 化合物~i 金 -I 非金属 -稀有气体大多数有机物稀有气体分子晶体分 酸 —j子气态及挥发性物质化合态 原子晶体 性r物丿 贡变化无机物不成盐氧化物酸性 碱性 两性特殊「I 成盐氧化物-1氧化物|」金属氢化物-I 非金属氢化物石墨(混合晶体) 金属晶体 微观大多数盐 离子晶体 碱性氧化物 部分过氧化物 潮解、分馏升华、萃取物理变化溶解、盐析风化、干馏裂化、裂解~r 酸1—1化学变化1有机、无机含氧酸、无氧酸 强酸、弱酸止盐酸式盐碱式盐 复盐;络盐可溶碱、难容碱混合物 化合、分解、置换、复分解 氧化还原;非氧化还原 一分子、离子念(二)「可逆、不可逆高中化学基础知识网络图-高中化学重要知识点详细总结第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液) 性质变化 :兀素规律一*兀素周期律 元素周期律寵量最低原理实质1^层最多容纳22个核外电子排布周期性决定元素性质的周期性—元素周期律编制W元素周期表表的结构-表示方法亦外层不超过18个十<外层不超过8个「分子间作用力范德华力、影响物理性质运动状态・特殊性•电子云分子的极性12 一一=n非 极 性 分 子|离子晶体原子结构周期表位置818 1832B nBIABI 山>:族族族主副W On=3=45 6 一一=n 一分子的形成化学键— —X共价键罔子键盖属®r比(介化合协禺子化合物盖属单质及合金丄晶体类型原子晶体分子晶体金屈晶体比嶷—^一类型―离子晶体 原子晶体 分子晶体构成晶体微粒 阴、阳离子 原子 分子 形成晶体作用力离子键 共价键 范德华力物理生贡熔沸点 较咼 很高 低 : 硬度硬而脆大小 导电性 熔融~日占 不良水溶液.导电绝缘体(半导体)不良 传热性 不良 不良 不良 延展性 不良不良不良 —溶解性易溶于极性溶剂不溶于任何溶剂 相似相溶 典型实例NaCI , KBr单质:金刚石、SiC 、Si 、SiO 2单质:出、02 化合物:冰、干冰表示方法 :V A = △ "/△ t 单位:mol/L • s (min 或 h )同一反应选用不同的物质表示速率,数值可能不同 各物质表示的速率比 等于该反应方程式的系数比是平均速率,均取正值持点计算化学反应速率和化学平衡化学反应内因(主)反应物的结构、性质 外因(辅)浓度 压强温度 催化剂 化学平衡可逆反应其他条件光、超声波、激光、放射线…化学平衡、化学反应速率化学平衡建立的条 件: V g =v 逆^ 0 化学平衡的特征 (平衡标志的判断)'影响化学平衡因素浓度压强 温度平衡移动原理(勒沙特列原理)—'影响因素 ,应用条件改变,平衡状态改变动 变比盒j 装置原电池电解池能量转换(实质)化学能T电能(两极分别发生氧化还原反应产生电流)电能T化学能(在电流作用下两极分别发生氧化还原反应)装置特点外电路无电源;两极为活泼性不同(或其中之一为能导电的非金属)的金属外电路必须有直流电源;两极材料均能导电即可电极名称负极(―)——较活泼正极(+ )较不活泼阴极一一连接电源负极阳极一一连接电源正极电子流向负极(一)*正极(+ )电源负极事阴极电源正极-e阳极电极反应负极:M —ne化化M n+活泼金属失去电子被氧化、被溶解、被腐蚀。
正极:2H++ 2e还母H2 T (酸性电解质溶液)或M n++ n齐M (不活泼金属的盐溶液)H2O + 02+ 4e~4OH(中性、弱酸性条件下的吸氧腐蚀)阴极:2H++ 2畀H2 f或M n++ne还原M 惰性电极(石墨或铂)R n—ne- R(例2CI-—2e ©2 f)或4OH— 4e—H2O + 02 f金属电极做阳极,电极本身被氧化氧化n+M —ne- M 强电解质(完全电离)AB A-+B-化合物弱电解质、部分电离电离平衡AB —A-+B-电离度的定义(电离度a =已电离的弱电解质分子数弱电解质的分子总数X 100%)电离度平衡的移动原理非电解质能的转换:化学能与电化学能V蓄电池,电源—|干电池]—|高能电池—氯碱工业(电解饱和食盐水)电镀电解精练(精练铜)——电冶炼金属(冶炼铝)电解质溶液发生条件离子反应高中化学基础知识网络图-高中化学重要知识点详细总结第三部分:元素化合物转化关系金属部分:按照单质—•氧化物 一、氢氧化物 一'•盐为线索进行搜罗寻找关系Mg 3N2+SO 2Cu 2S 'Cu NH 3H 2OuO ------- * Cu(OH) 2 ------- HNO3 或 H 2SO 4(浓[Cu(NH 3)4]2+Mg(OH) MgOMgX?—^NaOHFe(SCN )3CU2CuS H Na 2S C U 2+(NO 3-、SO42-)H +NaOHCO 、 Al 、HH +非金属:按照化合价寻找各类物质,主要有氢化 物、单质、氧化物、含氧酸、及其盐CH 3CI tCI *CuCS 4 _____PCI 3、PCI5 + NaCIO * ____ Q_HCIO ---------------Ca(CIO )2 ”.一CH 2CICH 2CI +AgBr■BT 2CI 2 * HCII ■NaIFeCb 匚 CO 2I ___ k NaCII 1 CuCI 2■ H2U _ CH 2=CHCI第四部分:有机化学2醇(官能团:一0H):饱和一元醇C n H 2n+i OH(n > 1)R—OH有机抓住官能团的性质有机化合物C n H2n+2O (n >2)R —0—R烃的衍生物_____ 酚(苯酚)(官能团:一OH)C n H2n-6O (n >2)醛 (官能团:一CHO) C n H2n O (n A1)R —CHO■■ OH酮 (官能团:一CO—) C n H2n O (n > 3)R—CO—R'_____ 羧酸(官能团:一COOH):饱和一元羧酸C n H2n+i O2 (n> 1)R—COOH_____ 酯(官能团:一COO—R):饱和一元羧酸和饱和一元醇形成的酯C n H2n O2 (n>2)R—COOR'_____ 硝基化合物(官能团一NO2)R—NO2胺(官能团一NH2)R —NH2单糖:葡萄糖、果糖二糖:蔗糖、麦芽糖多糖:淀粉、纤维素C6H12O6(互为同分异构)C12 H22O ll(互为同分异构)(C6H12O6)n (n 值不同)蛋白质:多肽、氨基酸(官能团:一NH2和—COOH)—天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质高分子化合物合成高分子一合成塑料__ 合成橡胶合成纤维。
