肝癌小鼠造模实验方法
小鼠肝癌模型的建立及PTP1B表达的研究

小鼠肝癌模型的建立及PTP1B表达的研究肝癌是目前世界上最常见的癌症之一,而小鼠肝癌模型是研究肝癌病理生理学、分子遗传学等方面的重要工具。
本文将介绍小鼠肝癌模型的建立过程及PTP1B表达的研究。
1. 小鼠肝癌模型的建立小鼠肝癌模型可以通过许多方法进行建立,其中最常用的是化学诱导法、基因改造法和放射性物质诱导法。
本文将着重介绍化学诱导法建立小鼠肝癌模型的过程。
首先,选择适合的小鼠品系进行实验,一般选择C57BL/6J品系的雄性小鼠。
然后,通过口服或注射的方式给小鼠灌服化学致癌物质二甲基亚硝胺(DMN)、二乙二酸氮氫鈉(DEN)或对二氯苯胺(2-AAF)等化学物质,导致肝脏发生损伤和炎症反应,进而促进肝癌的发生。
此后,可根据肝癌的形态特征、肿瘤大小和数量、肿瘤组织学特征等指标对小鼠进行肝癌诊断。
2. PTP1B表达的研究PTP1B是一种酪氨酸磷酸酶,在正常情况下具有负调控胰岛素和胰高血糖素信号通路的作用。
PTP1B在多种人类肿瘤中发挥着重要的作用,如乳腺癌、前列腺癌和肝癌等。
因此,对PTP1B在肝癌发生发展中的作用进行深入研究具有重要意义。
通过小鼠肝癌模型可以获得不同发展阶段的肝癌组织标本,可用于研究PTP1B的表达情况。
目前主要采用免疫组织化学、Western blot、实时荧光定量PCR等技术手段进行测定。
研究结果显示,肝癌组织中PTP1B的表达显著升高,与肝癌细胞增殖和转移相关。
另外,PTP1B抑制剂等新型治疗手段的出现为治疗肝癌带来了新的机遇。
通过对PTP1B的研究,不仅可以深入了解肝癌的发生发展过程,还可以为肝癌的治疗提供新思路和策略。
总之,小鼠肝癌模型的建立和PTP1B表达的研究对于肝癌相关研究具有重要的意义。
未来还需要进一步加强肝癌发生机制和新型治疗手段的研究,为肝癌的预防和治疗提供更有效的手段。
肿瘤小鼠造模方法

肿瘤小鼠造模方法
肿瘤小鼠造模是研究肿瘤发生、发展和治疗的重要实验手段之一。
以下是常用的肿瘤小鼠造模方法:
1. 肿瘤细胞移植法:将肿瘤细胞直接注射到小鼠体内,使其形成肿瘤。
这种方法适用于研究肿瘤细胞的生物学特性和药物治疗等方面。
2. 基因工程小鼠法:使用基因工程技术,通过改变小鼠体内的基因表达来诱导肿瘤的发生。
例如,可以通过敲除或过表达某个关键基因来模拟人类肿瘤的发生机制。
3. 化学致癌法:通过给予小鼠致癌物质,如化学药物、化学物质等来引发肿瘤的发生。
这种方法适用于研究致癌物质的致癌机制以及药物预防和治疗的效果。
4. 放射性致癌法:通过给予小鼠辐射来诱发肿瘤的发生。
这种方法适用于研究放射线致癌的机制和辐射防护措施。
以上是常用的肿瘤小鼠造模方法,具体选择哪种方法要根据研究的目的和实验条件来决定。
在进行肿瘤小鼠造模实验时,需要严格遵守伦理规范和动物保护法律法规,并确保实验过程中小鼠的福利和安全。
肝功能损伤小鼠模型制备方法

可以参考以下步骤来制备肝功能损伤小鼠模型:
实验动物选择:选择SPF级Balb/c小鼠,雄性,周龄为4w~6w,体重为20g-22g。
实验分组:实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组。
建模方法:建立小鼠慢性肝损伤模型。
具体方法为腹腔注射20%CCL4油溶液(5ml/kg),一周2次,连续注射12周。
在12周末次给药3d后,腹腔注射D-Gal(1g/kg)、LPS(10ug/kg)。
干预给药:分别给药TSA(Trichostatin A),正丁酸钠,NF-κB抑制剂(PDTC)等。
模型评价:待小鼠清醒后放回饲养室饲养,密切关注小鼠的状态及生存状况并做好记录。
在建模完成后,处死各组小鼠,取血并分离血清用于生化检测;取肝组织、肠组织进行病理检测。
生化指标包括ALT、AST;取肝组织时,经固定、脱水、包埋后,制石蜡切片;取肠组织进行HE染色。
BALB/c小鼠原位移植肝癌模型的建立及鉴定

q Ac t a Ac a d Me d We i f a n g V o 1 . 3 7 No . 1 2 0 1 5
肝癌模 型是 目前肝 癌实 验研 究最理 想 的动物 模 型 。但 原位 移植 手术 操作 难度 大 , 有 很 多技术 难题 需要 攻克 , 因此 本课 题组 经 反复 实 验 和 改进 , 建 立 了一 种 简 单有 效 的小 鼠原位 移植 肝 癌 模 型 , 为 肝 癌 的研 究 提 供 了有
术后 1只小 鼠麻醉 未苏 醒死亡 , 其 他均 于 当天苏 醒 , 第
2天 活动正 常 。2周 后 , 人 道 主义 处 死 小 鼠 , 解 剖 取 出
肝脏 , 肉眼可见 有乳 白色瘤 结节 形成 ( 图3 ) , 除 1只未
见 明显 肿瘤 外 , 其它 小 鼠均有肿 瘤 发生 , 小 鼠存 活 率和
常肝 组 织标本 用 1 0 % 中性 甲醛 固定 2 d后做 病 理 学 检 色, 光 学显微 镜下 观察 。
2 实 验 结 果
1 . 1 材料
B A L B / c小 鼠 , 雄性 , 4~6周 龄 , 体重 2 0 g
左右 , S P F级 , 购 自山 东 大学 动 物 中心 , 动 物 合格 证 号 为0 0 1 4 6 5 4, 实验 和饲 养 条 件 严 格 按 照 S P F动 物 的规 范要 求 ; H 2 2细 胞 , 本 室 常规 保 存 , 传 代 培 养 。D ME M 培 养基 及 1 6 4 0培 养 基 购 自 G I B C O公 司 , 胎 牛 血 清 购 自杭州 四季青 生 物制 品研 究 所 。 1 0 %水 合 氯 醛 、 注 射 器、 剪刀、 镊子 、 美翼牌 可 吸收 P G A无 菌 缝合 线 及爱 惜 康 的慕 丝 非 吸 收性 缝 线 购 自潍 坊 市 人 民医 院。 1 0 1  ̄ 1
小鼠肝癌原位移植模型的建立及其意义的研究

小鼠肝癌原位移植模型的建立及其意义的研究项亮亮;侯杰;王婕;焦成斌【摘要】目的:探讨用肝癌H22细胞建立小鼠肝癌原位移植模型.方法:将肝癌H22细胞注入小鼠腹腔内,建立异位移植模型;抽取腹水中癌细胞接种于小鼠肝实质内,建立原位移植模型.结果:移植后10d可扪及肿瘤生长,模型成功率94.4%;晚期自发转移率79.4%,腹水产生率35.3%,无自发消退;移植瘤保持甲胎蛋白(AFP)、异常凝血酶原(DCP)高分泌及γ-氨基酰转氨酶(γ~GT)同工酶阳性的特点;模型平均自然生存期28d.结论:小鼠肝癌原位模型成功率高,易于制作,生物学特征符合模拟人类肝癌在体内发生发展的全过程,可成为今后人类研究肝癌的重要动物模型.【期刊名称】《黑龙江医药科学》【年(卷),期】2015(038)006【总页数】2页(P48-49)【关键词】肝癌;H22细胞;原位移植模型;小鼠【作者】项亮亮;侯杰;王婕;焦成斌【作者单位】佳木斯大学附属第一医院普外二科,黑龙江佳木斯154003;佳木斯大学附属第一医院普外二科,黑龙江佳木斯154003;佳木斯大学附属第一医院普外二科,黑龙江佳木斯154003;佳木斯大学附属第一医院普外二科,黑龙江佳木斯154003【正文语种】中文【中图分类】R735.7肝癌是世界范围内常见的恶性肿瘤之一,因其发病率高、恶性程度高、死亡率高,素有“癌中之王”的称号[1]。
目前已有大量研究为肝癌临床的治疗提供基础依据,而肝癌动物模型一直是肝癌临床与基础研究工作的重要工具。
目前有关人肿瘤转移模型大多是用裸大鼠、裸小鼠,动物肿瘤则多数是用Wistar或SD大鼠建立的,而用小鼠建立原位肿瘤移植模型国内外报道较少。
小鼠作为一种更经济,易饲养,易获得的实验研究载体,在发挥其普遍应用性方面有着重大的作用。
小鼠肝癌原位移植模型作为一种新型的动物模型是否能更好地模拟人肝癌在体内发生、发展、侵袭及转移的过程,本实验将研究报道如下。
肝癌动物模型建立的方法

#综 述#肝癌动物模型建立的方法徐玉音,陈 莉收稿日期:2010-06-17基金项目:南通市科技局应用研究项目(2009060)作者单位:南通大学医学院病理教研室,南通 226001作者简介:徐玉音,女,在读硕士研究生。
E-m ai:l xuyuyi n27@yahoo .cn陈 莉,女,教授,硕士生导师,通讯作者。
E -m ai :l b l 1@ntu 摘要:肝细胞癌是一种常见的恶性肿瘤,尽管近年来采用分子生物学技术研究肝癌的发生,但仍缺乏对肝癌发病机制的确切认识。
随着人们对肝癌动物模型研究的不断深入,逐渐建立了自发型、诱发性、移植性及转基因动物肝癌模型。
因为这些模型很好地模拟了人类肝癌,可以用于肝癌的生理、细胞和分子等发病机制方面的研究,也可用于肝癌治疗药物的筛选以及基因治疗的探索。
本文讨论一些有条件地、选择性诱导肝癌模型的情况,重点关注与人类肝癌关系最密切的肝癌动物模型,并对动物模型的临床应用进展进行简要介绍。
关键词:肝肿瘤;动物模型;转基因;转基因动物中图分类号:R 73517;R-33 文献标识码:A 文章编号:1001-7399(2011)02-0405-05人类疾病动物模型是指医学研究中建立的具有人类疾病模拟表现的动物实验对象和相关材料,可分为自发瘤模型、诱发模型、移植模型和转基因动物模型等。
实验动物模型与其模拟的人类肿瘤在分子、组织学以及生物学特性方面有许多共同性,可以用于肿瘤发病机制研究、肿瘤治疗药物的筛选以及肿瘤的基因治疗。
本文对肝癌动物模型的建立及其临床应用进展予以综述,以供研究者根据各自研究的目的、实验室的条件等在建立合适的肝癌动物模型时参考。
1 自发性肝癌动物模型自发性肝癌动物模型是指实验动物未经任何有意识的人工处理,在自然状况下所发生的肝癌。
实验动物多选用近交系小鼠,由于实验动物种属、品系的不同,肿瘤发生类型和发病率有很大差异。
14月龄以上的C3H f 系雄鼠、C3H 系雄鼠和C3H e 雄鼠的发生率分别为72%、85%和80%[1]。
人肝癌裸鼠皮下-肝原位移植瘤模型的建立实验具体步骤及方法

人肝癌裸鼠皮下-肝原位移植瘤模型的建立实验具体步骤及方法先用组织学完整的新鲜人肝癌组织接种于裸鼠皮下,形成皮下移植瘤,然后用此移植瘤组织再接种于裸鼠肝内,建立肝原位移植瘤模型(间接肝原位移植瘤模型),并将其与直接肝原位移植瘤模型、皮下移植瘤模型和腹腔内移植瘤模型作比较。
一、间接肝原位移植瘤模型的制备1. 用新鲜的肝癌外科手术切除标本(来自长海医院,患者为1名47岁男性,病理诊断:肝左叶肝细胞癌,粗梁型,Ⅱ级),在Hanks液中,去除坏死组织和非癌组织后切成1~2 mm3小块。
2. 取2块瘤组织,在离体40 min内用粗针头植入裸鼠腰背部皮下,待皮下移植瘤长到直径约1 cm时切取肿瘤,在Hanks液中,去除坏死组织后切成1~2 mm3小块,裸鼠用戊巴比妥钠腹腔麻醉后,行左上腹横切口,暴露肝脏。
3. 取上述2块瘤组织,在离体40 min内用粗针头植入裸鼠肝右叶深部实质内,全层关腹。
二、直接肝原位移植瘤模型的制备1. 同一例新鲜肝癌手术切除标本,处理方法同皮下移植,裸鼠处理同间接肝原位移植,取2块瘤组织,在离体40 min内用粗针头直接植入裸鼠肝右叶深部实质内。
2. 皮下移植瘤模型和腹腔内移植瘤模型的制备。
三、病理检查和相关指标检测1. 解剖和组织学检查(1)所有裸鼠接种后,分组分笼饲养,自由进食,每天观察1~2次。
(2)当裸鼠处于全身衰竭状态时处死并作大体解剖,对接种瘤和转移瘤分别进行观察、测量,记录肿瘤侵袭和转移情况,重要器官(主要为肝和肺)经10%中性甲醛固定后,常规石蜡制片,光学显微镜检查。
2. 周围血甲胎蛋白(AFP)检测处死前,均采用摘眼球采血的方法获得血液,用生化法检测AFP的分泌量。
3. 瘤细胞DNA含量分析留取部分移植瘤标本采用流式细胞术进行DNA含量分析。
注意事项目前,肝癌的复发和转移仍然是其术后长期存活的主要障碍。
为了研究肿瘤的转移机制,建立接近于人体的肿瘤动物模型显得尤为重要。
H22昆明鼠肝癌原位模型的建立

鼠 中有 9 5只造模成功 , 2 2只小鼠 出现肝癌右叶转移。结论 : H 2 2昆明 鼠肝癌原住模 型成功率 高, 成本低 , 值得推 广 , 是非 常理
想 的研 究 肝 癌 的 实验 动 物 模 型 。
关 键 词 :H 2 2 ; 肝癌 ; 原位模型 ; 动 物 实验
中图分类号 : R 7 3 5 . 7 文献 标 识 码 : A 文章编 号 : 1 0 0 8— 0 1 0 4 ( 2 0 1 5 ) 0 1— 0 0 7 8— 0 2
肝膈 面实 质 内 , 退 出针 头 , 轻压针眼, 取 灼 红 的铁 丝
展、 侵袭 及转 移 的过程 , 具有 极 高 的基 础及 临 床应用 价值 , 尤其值 得 提 出的是在 本实 验造 模过 程 中 , 笔者 充 分发 挥 了肿瘤 外科 的优 势 , 采 用无 瘤操 作原 则 , 有 效 的避 免肿 瘤 细胞 逃 逸及 种植 , 与 以往 的各 种 造模
方法 比较 , 有效 的避 免 了肿 瘤 细 道 , 以 防止 肿 瘤 细胞 逃 逸 , 发 生 腹 腔种 植 , 将肝 左 叶轻 轻 送 回腹 腔 , 查 无 活 动 性 出血 , 取 1号丝 线 分 别 缝 合 腹 白线 及 皮 肤 , 再 次消毒 , 术 毕。
・
7 8・
黑龙江医药科学 2 0 1 5年 2月第 3 8卷第 1期
H 2 2昆 明 鼠肝 癌 原位 模 型 的建 立①
侯 杰, 罗 兰, 焦成 斌 , 杨彦 民 , 何其 勇 , 张 晓丽 , 刘伟 新
( 佳 木斯 大学附属 第一 医院普外二科 , 黑龙江 佳 木斯 1 5 4 0 0 3 )
白色 , 质硬 , 造模 成功 , 成瘤率为 9 5 % 。病 理 学 观察
肿瘤小鼠造模方法

肿瘤小鼠造模方法肿瘤小鼠模型是研究肿瘤发展、治疗和预防的重要工具。
通过模拟人类肿瘤的形成和发展过程,可以更好地了解肿瘤的病理生理特征,并为肿瘤的早期诊断和治疗提供有益的信息。
下面我们将介绍几种常用的肿瘤小鼠造模方法。
1. 异种移植模型异种移植模型是最常用的肿瘤小鼠模型。
它通过将人类肿瘤细胞或肿瘤组织移植到小鼠体内形成肿瘤。
该方法可以用于研究肿瘤的生长、转移、侵袭和药物敏感性等方面。
在异种移植模型中,首先需要获取人类肿瘤细胞或肿瘤组织样本。
常用的来源包括人类肿瘤细胞株、肿瘤切片、肿瘤移植瘤等。
然后,将这些样本注射到小鼠体内,通常是通过皮下注射、腹腔注射或静脉注射的方式。
注射后,观察肿瘤的生长情况,定期测量肿瘤体积,并进行影像学检测以评估肿瘤的进展和治疗效果。
2. 转基因小鼠模型转基因小鼠模型是通过改变小鼠基因组中的特定基因,使其表达或缺失某种特定基因,从而模拟人类特定基因异常引起的肿瘤。
这种模型常用于研究特定基因对肿瘤发生和发展的影响。
转基因小鼠模型的制备通常分为两个步骤:基因敲除和基因敲入。
基因敲除是指将目标基因从小鼠基因组中彻底删除,而基因敲入是指将目标基因导入小鼠基因组中,使其表达或缺失。
基因敲除通常采用胚胎干细胞技术。
首先,通过体外培养的方法获得小鼠胚胎干细胞,然后,通过基因编辑技术,将目标基因从胚胎干细胞基因组中删除。
最后,将这些基因敲除的胚胎干细胞注入到小鼠的早期胚胎中,使其发育成为具有目标基因敲除的小鼠。
基因敲入通常采用质粒转染、病毒载体转染或基因修复等方法。
通过以上方法,将目标基因导入小鼠的基因组中,使其表达或缺失。
这种模型的制备过程比较复杂,需要专业的实验条件和技术支持。
3. 化学诱导模型化学诱导模型是通过给予小鼠特定的诱癌物,如化学物质或药物,来诱发肿瘤的形成。
这种模型可以模拟某些环境因素或生理机制与肿瘤发生的关系。
在化学诱导模型中,首先选择合适的诱癌物,如DMBA(二甲基苯并[a]芘)、DEN(二乙胺)等。
如何进行小鼠肿瘤模型的建立及鉴定

如何进行小鼠肿瘤模型的建立及鉴定小鼠肿瘤模型的建立及鉴定是癌症研究中非常重要的一步,可以用于研究肿瘤的发生机制、治疗策略以及评估新的抗癌药物。
下面将详细介绍小鼠肿瘤模型的建立及鉴定的方法并提供一些实用的技巧。
肿瘤模型建立的方法主要包括人工移植方法、化学物质诱导方法和遗传工程方法。
一、人工移植方法:1.将人类肿瘤细胞、移植物肿瘤组织或细胞株移植到小鼠体内,可以通过裸鼠或免疫缺陷小鼠模型建立人类肿瘤模型。
当细胞或组织取出并经过相关处理后,通过给小鼠注射或将其移植到小鼠体内,研究人类肿瘤的生长和发展。
2.移植人体肿瘤片段。
3.使用免疫缺陷小鼠模型,如裸鼠、严重联合免疫缺陷小鼠等,可以接受外源组织移植而不会引发排斥反应。
二、化学物质诱导方法:1.化学物质诱导肿瘤模型是通过给予小鼠致癌物质或诱导剂来诱发肿瘤发生。
2.应遵循相关伦理原则使用易获得且时间成本低的致癌物质。
3.诱导剂可通过各种途径给予小鼠,如口服、皮下注射、腹腔注射等。
4.对于使用化学物质诱导的肿瘤模型,需要在给药期间和给药后对小鼠进行定期观察和血液检测,以评估肿瘤的发生和发展情况。
三、遗传工程方法:1.遗传工程方法可利用转基因技术将特定肿瘤相关基因引入小鼠体内,例如,通过敲除或激活肿瘤抑制基因或癌基因等,产生特定类型的肿瘤模型。
2.通过基因敲除、敲入或点突变技术,可改变小鼠体内特定基因的表达水平,以模拟人类肿瘤的发生和发展。
确定小鼠肿瘤模型建立成功后1.观察和检测小鼠是否出现明显的肿瘤体积增大和质地变硬等症状。
2.定期观察小鼠的体重变化,以评估肿瘤对小鼠健康状况的影响。
3.使用体重表、肿瘤质量表等测量工具定期测量肿瘤体积,以评估肿瘤生长速度。
4.进行组织学检测,通过活体组织活检或解剖后进行病理学检测,以确定肿瘤种类和分级。
5.对肿瘤样本进行免疫组织化学染色、分子生物学检测等,以确定肿瘤的分子特征。
总结:建立和鉴定小鼠肿瘤模型是一项复杂的工作,需要专业的知识和技术支持。
两种方法建立小鼠原位肝癌模型的比较

两种方法建立小鼠原位肝癌模型的比较摘要】目的比较建立小鼠原位肝癌模型的两种方法的优劣。
方法分别采用肝脏原位注射细胞法和尾静脉高压水流动力学注射法建立小鼠原位肝癌模型,对两组小鼠肝脏的成瘤情况进行比较。
结果两组小鼠均能在短期内成瘤,且成瘤率高。
结论尾静脉高压水流动力学注射法比原位注射细胞法更容易操作,小鼠存活率高,肝脏成瘤更均匀。
【关键词】原位肝癌模型高压水流动力学注射【中图分类号】R73-3 【文献标识码】A 【文章编号】2095-1752(2013)14-0382-02原发性肝细胞肝癌是我国乃至全球范围内的研究热点,而原位肝癌小鼠模型是进行原发性肝细胞肝癌基础研究和临床研究的重要工具。
目前原位肝癌模型主要采用化学诱导法(DEN),但是该方法建立模型成瘤的时间比较长,大概需要6-8个月,导致研究的周期很长。
本文尝试了两种比较快速地建立小鼠原位肝癌模型的方法--肝脏原位注射细胞法和尾静脉高压水流动力学注射法,并对这两种方法建立的小鼠模型进行了比较。
1 实验材料及方法1.1 实验动物与试剂C57BL/6小鼠7-8周,雄性,20只,购自上海斯莱克实验动物有限公司。
Hepa1-6细胞株购自中科院上海细胞库。
DMEM高糖培养基,胎牛血清,购自上海英潍捷基公司。
水合氯醛、碘伏购自国药集团。
注射器,手术器械、缝合线、针领自苏州大学材料供应中心。
1.2 方法1.2.1 细胞悬液制备 Hepa 1-6在37℃、5 % CO2 的细胞培养箱中培养,取对数生长期细胞,0.25%胰蛋白酶消化后,收集于15mL离心管中,用PBS调整细胞悬液浓度至5×107/mL用于原位注射细胞法,每只小鼠注射20uL。
用PBS调整细胞悬液浓度至5×105/mL 用于尾静脉高压水流动力学注射法每只小鼠注射2mL。
1.2.2 小鼠分组 20只7-8周龄的C57BL/6雄性小鼠分为2组,第1组10只进行肝脏原位注射细胞建立模型,第2组10只采用尾静脉高压水流动力学注射的方法建立模型。
DEN制备小鼠原发肝癌模型方式比较
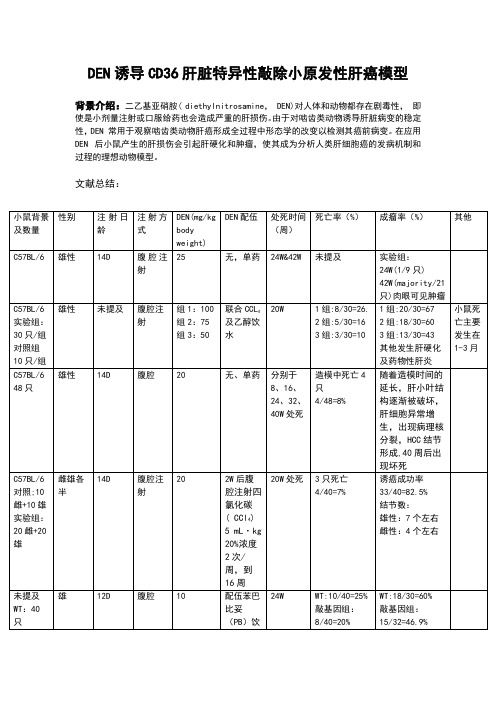
20W处死
3只死亡
4/40=7%
诱癌成功率33/40=82.5%
结节数:
雄性:7个左右
雌性:4个左右
未提及
WT:40只
敲基因组:40只
雄
12D
腹腔
10
配伍苯巴比妥(PB)饮水
24W
WT:10/40=25%
敲基因组:8/40=20%
WT:18/30=60%
敲基因组:15/32=46.9%
文献总结:
小鼠背景及数量
性别
注射日龄
注射方式
DEN(mg/kg body weight)
DEN配伍
处死时间(周)
死亡率(%)
成瘤率(%)
其他
C57BL/6
雄性
14D
腹腔注射
25
无,单药
24W&42W
未提及
实验组:
24W(1/9只)42W(majority/21只)肉眼可见肿瘤
C57BL/6
实验组:30只/组
腹腔
20
无、单药
分别于8、16、24、32、40W处死
造模中死亡4只
4/48=8%
随着造模时间的延长,肝小叶结构逐渐被破坏, 肝细胞异常增生,出现病理核分裂,HCC结节形成,40周后出现坏死
C57BL/6
对照;10雌+10雄
实验组:20雌+20雄
雌雄各半
14D
腹腔注射
20
2W后腹腔注射四氯化碳( CCl4) 5 mL·kg 20%浓度
C57BL/6
雄
14D
腹腔
40
无,单药
40W
未提及
WT组诱癌成功率约:90%
DEN制备小鼠原发肝癌模型方式比较

背景介绍:二乙基亚硝胺( diethylnitrosamine,DEN)对人体和动物都存在剧毒性, 即使是小剂量注射或口服给药也会造成严重的肝损伤。由于对啮齿类动物诱导肝脏病变的稳定性,DEN 常用于观察啮齿类动物肝癌形成全过程中形态学的改变以检测其癌前病变。在应用 DEN后小鼠产生的肝损伤会引起肝硬化和肿瘤,使其成为分析人类肝细胞癌的发病机制和过程的理想动物模型。
C57BL/6
雄
14D
腹腔
40
无,单药
40W
未提及
WT组诱癌成功率约:90%
2次/周,到16周
20W处死
3只死亡
4/40=7%
诱癌成功率33/40=82.5%
结节数:
雄性:7个左右
雌性:4个左右
未提及
WT:40只
敲基因组:40只
雄
12D
腹腔
10
配苯巴比妥(PB)饮水
24W
WT:10/40=25%
敲基因组:8/40=20%
WT:18/30=60%
敲基因组:15/32=46.9%
对照组10只/组
雄性
未提及
腹腔注射
组1:100
组2:75
组3:50
联合CCL4及乙醇饮水
20W
1组:8/30=26.
2组:5/30=16
3组:3/30=10
1组:20/30=67
2组:18/30=60
3组:13/30=43
其他发生肝硬化及药物性肝炎
小鼠死亡主要发生在1-3月
C57BL/6
48只
雄性
14D
腹腔
20
无、单药
分别于8、16、24、32、40W处死
动物肿瘤造模实验方案

动物肿瘤造模实验方案
动物肿瘤造模实验是一种常用的动物实验方法,用于研究肿瘤的发生、生长、转移和治疗方案。
下面是一个可能的动物肿瘤造模实验方案:
1. 选择动物模型:常用的动物模型包括小鼠、大鼠和兔子等。
根据研究目的和肿瘤类型选择合适的动物模型。
2. 选择肿瘤细胞系:常用的肿瘤细胞包括人源性肿瘤细胞系和动物源性肿瘤细胞系。
根据研究目的和肿瘤类型选择合适的肿瘤细胞系。
3. 准备肿瘤细胞:将肿瘤细胞培养至合适浓度,并用生理盐水或其它合适的载体悬浮。
4. 动物模型建立:将肿瘤细胞注射到动物体内建立肿瘤模型。
常用的注射方式包括皮下、脾脏或其他器官内注射。
5. 观察肿瘤生长:观察肿瘤模型的生长情况,包括肿瘤体积、肿瘤质地、肿瘤血液供应等。
6. 取样分析:在不同时间点取样,对肿瘤模型进行分析,包括病理学检查、免疫组化分析、分子生物学检测等。
7. 肿瘤治疗试验:根据研究目的,对肿瘤模型进行治疗试验,可以采用化疗、放疗、免疫治疗或其它治疗方法。
8. 结果分析:根据实验结果进行数据分析和统计,并对实验结果进行解读和讨论。
需要注意的是,动物实验需要遵守伦理规范和相关法律法规,确保实验过程的合法性和道德性,并尽量减少对动物的伤害和痛苦。
在进行动物肿瘤造模实验时,应严格按照相关实验规范进行操作,并有专业实验人员进行监督和管理。
小鼠肿瘤模型的建立方法及评价手段

小鼠肿瘤模型的建立方法及评价手段小鼠肿瘤模型的建立方法及评价手段癌症是当今世界范围内的一种重大疾病,而且其影响范围越来越广泛,与此同时,由于癌症的病发机制尚不完全明确,因此对于防治癌症的研究和探索主要依靠动物模型研究。
小鼠肿瘤模型是目前研究肿瘤发病机制和癌症治疗的重要手段,在注射人类肿瘤细胞后,小鼠可呈现人体肿瘤组织细胞移植的特性。
相对于人体肿瘤实验和传统的肿瘤细胞培养,小鼠肿瘤模型的优异之处在于能够创造肿瘤微环境,仿真人体肿瘤的生长和转移过程,以提高癌症的治疗效果。
本文将详细介绍小鼠肿瘤模型的建立方法以及常见的评价手段。
一、小鼠肿瘤模型的建立方法1.1 人体肿瘤细胞移植模型人体肿瘤细胞移植模型以人类肿瘤细胞在裸鼠或小鼠体内移植后的肿瘤实体为基础,分为无血液供应的固体肿瘤模型和有血液供应的血液源性肿瘤模型两种。
在移植人类肿瘤细胞时,要确保细胞的活力和数量,同时条件控制的严谨性也是建立模型成功的关键。
以草甸欧豆荚腺癌细胞(A549)为例,在室温下用胰蛋白酶消化并在热水浴中加温25分钟,离心后取上清液,将细胞恢复在人工营养的体外环境中培养至稳定生长。
然后注射生长正常的A549细胞到裸鼠的皮下尽处,便成为一个人体肿瘤细胞移植模型。
1.2 化学诱导肿瘤模型化学诱导肿瘤模型是通过注射某些化学物质来诱导荷尔蒙依赖性肿瘤,可以有效地模拟荷尔蒙依赖性肿瘤的发病原因及其恶化过程。
在采用二甲基亚硝胺(DMN)诱导大鼠膀胱癌时,过程如下:将DMN溶于苏木精中,经过研磨混合后注射大鼠,每次剂量控制在4-25mg/kg,2个月后检查其膀胱肿瘤的形成情况。
化学物质注射后,不同的化学物质会引起不同部位的肿瘤,如DMN会引起膀胱癌。
1.3 基因敲除技术建立小鼠肿瘤模型目前最为先进的小鼠肿瘤模型是通过基因敲除技术构建。
通过选择与癌症相关的基因,并在小鼠体内干扰其功能,从而让小鼠形成癌症。
其中胰岛素样生长因子1受体(IGF-1R)是一种与人类肿瘤密切相关的基因,在建立小鼠肿瘤模型时被广泛用于其基因干扰的研究。
215501275_小鼠原发性肝癌模型的建立

小鼠原发性肝癌模型的建立王靳 1,李雪莹2,易进科3,赵蓓玲4,黄慧敏1,魏 英1△(1.湖北医药学院附属国药东风总医院实验中心,十堰442008;2.湖北医药学院附属国药东风总医院病理科,十堰442008;3.湖北医药学院附属国药东风总医院康复科,十堰442008;4.湖北医药学院第二临床学院,十堰442008)【摘要】 目的:采用三种造模方法建立小鼠原发性肝癌模型,并进行比较,寻找更优化的造模方法。
方法:15日龄C3H/HeN雄性小鼠40只,随机分为Ⅰ Ⅳ组,每组10只。
Ⅰ组:不予任何处理;Ⅱ组:腹腔注射25mg/kg的二乙基亚硝胺(DEN)一次;Ⅲ组:腹腔注射100mg/kg的DEN一次;Ⅳ组:腹腔注射25mg/kg的DEN一次,42日龄时再次腹腔注射100mg/kg的DEN一次。
统计各组小鼠的死亡率。
造模第18周,麻醉后眼球取血,断颈处死后打开腹腔取肝脏,观察各组肝脏外观、癌结节数目及肝脏肿瘤发生率,HE染色观察肝脏组织病理学变化,并检测血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)的浓度。
结果:造模第18周,与Ⅰ组相比,Ⅱ Ⅳ组小鼠血清中的ALT、AST浓度均显著升高(P<0.05);Ⅲ组和Ⅳ组存活小鼠癌结节数目,肿瘤发生率显著增加(P<0.05)。
造模第18周时,Ⅰ组和Ⅱ组无小鼠死亡,肝癌发生率为0%;Ⅲ组和Ⅳ组存活小鼠肝癌发生率均为100%,但Ⅲ组小鼠死亡率高达50%,Ⅳ组仅为20%。
结论:C3H/HeN雄性小鼠15日龄时腹腔注射25mg/kg的DEN一次,第42日龄时再次腹腔注射100mg/kg的DEN一次,可成功建立小鼠肝癌模型,周期短且死亡率较低,是建立原发性肝癌模型较为理想的方法。
【关键词】 原发性肝癌;C3H/HeN小鼠;二乙基亚硝胺;谷丙转氨酶;谷草转氨酶【中图分类号】R332 【文献标识码】A 【文章编号】1000 6834(2022)06 820 004【DOI】10.12047/j.cjap.6367.2022.149EstablishmentofprimarylivercancermodelinmiceWANGJin jin1,LIXue ying2,YIJin ke3,ZHAOBei ling4,HUANGHui min1,WEIYing1△(1.ExperimentCenterofMedicine,SinopharmDongfengGeneralHospital,HubeiUniversityofMedicine,Shiyan442008;2.DepartmentofPathology,SinopharmDongfengGeneralHospital,HubeiUniversityofMedicine,Shiyan442008;3.DepartmentofRehabilitation,SinopharmDongfengGeneralHospital,HubeiUniversityofMedicine,Shiyan442008;4.TheSecondClinicalCollege,HubeiUniversityofMedicine,Shiyan442008,China)【ABSTRACT】Objective:Threemodelingmethodswereusedtoestablishamouseprimarylivercancermodel,andcomparedthemtofindamoreoptimalmodelingmethod.Methods:Forty15 day oldC3H/HeNmalemicewererandomlydividedintogroupsI IV,10miceineachgroup.GroupⅠwerenottreated;GroupⅡwereintraperitoneallyinjectedwith25mg/kgdiethylnitrosamine(DEN)once;GroupⅢwereintraperitoneallyinjectedwith100mg/kgDENonce;GroupⅣwereintraperitoneallyinjectedwith25mg/kgDENonceandfollowedbyanotherintraperitonealinjectionof100mg/kgDENat42daysofage.Themortalityofmiceineachgroupwasanalyzed.Atthe18thweekofmodeling,bloodwascollectedfromeyeballsafteranesthesia,andliverwastakenfromabdominalcavityafterneckwasbroken.Theappearanceofliver,thenumberofcancernodulesandtheincidenceoflivertumorwereobserved.ThehistopathologicalchangesofliverwereobservedbyHEstaining.Theserumlevelsofalanineaminotransferase(ALT)andaspartateaminotransferase(AST)weredetected.Results:Atthe18thweekofmodeling,comparedwiththegroupI,serumlevelsofALTandASTingroupsII IVwereincreasedsignificantly(P<0.05);Thenumberofcancernodulesandtheincidenceoftumorsinthesurvi vingmiceofgroupsIIIandIVwerealsoincreasedsignificantly(P<0.05).Atthe18thweekofmodeling,nomicediedinbothgroupsIandII,andtheincidenceoflivercancerwas0%;TheincidenceoflivercancerinsurvivingmiceinbothgroupsIIIandIVwas100%,butthemortalityrateofmiceingroupIIIwasashighas50%,andthatingroupIVwasonly20%.Conclusion:C3H/HeNmalemicecansuccessfullyestablishamouselivercancermodelbyintraperitonealinjectionof25mg/kgofDENonceattheageof15daysandanotherintraperitonealinjectionof100mg/kgofDENonceattheageof42dayswithshortcycleandlowmortality,whichisanidealmethodtoestablishaprimarylivercancermodel.【KEYWORDS】 primarylivercancer; C3H/HeNmice; diethylnitrosamine; alaninetransaminase; aspartateaminotrans ferase028ChinJApplPhysiol,2022,38(6)Copyright ©博看网. All Rights Reserved. 【基金项目】湖北省自然科学基金(2019CFB429);十堰市科技基金(21Y74);湖北省卫健委项目(WJ2021F054);湖北医药学院2021年大学生创新创业训练计划项目(X202110929020);国药东风总医院院内立项(2021Q6)【收稿日期】2022 10 14【修回日期】2022 11 25 △【通讯作者】Tel:0719 8272534;E mail:57729968@qq.com 原发性肝癌(hepatocellularcarcinoma,HCC)是严重威胁人类健康的恶性肿瘤,尽管目前诊断和治疗技术有所改进,但5年生存率仍较低。
DEN制备小鼠原发肝癌模型方式比较

对照组10只/组
雄性
未提及
腹腔注射
组1:100
组2:75
组3:50
联合CCL4及乙醇饮水
20W
:8/30=26.
2组:5/30=16
3组:3/30=10
1组:20/30=67
2组:18/30=60
3组:13/30=43
其他发生肝硬化及药物性肝炎
小鼠死亡主要发生在1-3月
C57BL/6
48只
雄性
14D
2次/周,到16周
20W处死
3只死亡
4/40=7%
诱癌成功率33/40=82.5%
结节数:
雄性:7个左右
雌性:4个左右
未提及
WT:40只
敲基因组:40只
雄
12D
腹腔
10
配伍苯巴比妥(PB)饮水
24W
WT:10/40=25%
敲基因组:8/40=20%
WT:18/30=60%
敲基因组:15/32=46.9%
腹腔
20
无、单药
分别于8、16、24、32、40W处死
造模中死亡4只
4/48=8%
随着造模时间的延长,肝小叶结构逐渐被破坏, 肝细胞异常增生,出现病理核分裂,HCC结节形成,40周后出现坏死
C57BL/6
小鼠肝癌模型治疗方案
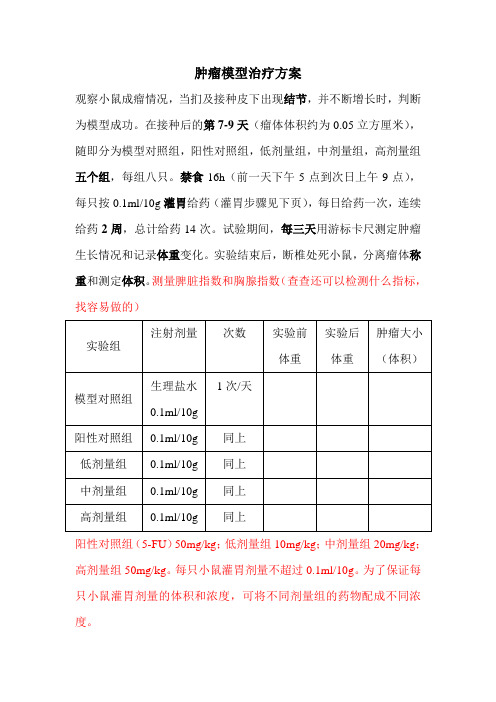
肿瘤模型治疗方案观察小鼠成瘤情况,当扪及接种皮下出现结节,并不断增长时,判断为模型成功。
在接种后的第7-9天(瘤体体积约为0.05立方厘米),随即分为模型对照组,阳性对照组,低剂量组,中剂量组,高剂量组五个组,每组八只。
禁食16h(前一天下午5点到次日上午9点),每只按0.1ml/10g灌胃给药(灌胃步骤见下页),每日给药一次,连续给药2周,总计给药14次。
试验期间,每三天用游标卡尺测定肿瘤生长情况和记录体重变化。
实验结束后,断椎处死小鼠,分离瘤体称重和测定体积。
测量脾脏指数和胸腺指数(查查还可以检测什么指标,找容易做的)实验组注射剂量次数实验前体重实验后体重肿瘤大小(体积)模型对照组生理盐水0.1ml/10g1次/天阳性对照组0.1ml/10g 同上低剂量组0.1ml/10g 同上中剂量组0.1ml/10g 同上高剂量组0.1ml/10g 同上阳性对照组(5-FU)50mg/kg;低剂量组10mg/kg;中剂量组20mg/kg;高剂量组50mg/kg。
每只小鼠灌胃剂量不超过0.1ml/10g。
为了保证每只小鼠灌胃剂量的体积和浓度,可将不同剂量组的药物配成不同浓度。
结果:肿瘤体积计算公式:V=ab^2/2(V为体积,a为最长直径,b为最短直径)。
抑瘤率为:(对照组平均瘤重—实验组平均瘤重)∕对照组平均瘤重×100%。
总结:1.预测通过三个不同剂量组治疗后的肿瘤重量与对照组肿瘤重量有明显差异,说明黑麦酮酸D对于肝癌细胞有抑制作用;2.同时三个剂量组之间的差值说明黑麦酮酸D呈现剂量依赖性增强的特点,即一定范围内,用量越高,疗效越好;3.剂量组与阳性对照组之间的差值,可以反映出哪种药物治疗效果更好。
小鼠灌胃方法需要关注两点:一是要保持小鼠的头部和颈部成一直线,方便灌胃针头进入,二是动作要轻柔,从口角进入,防止损失食道。
灌胃具体操作过程如下:1. 抓住小鼠,使其头、颈和身体呈一直线。
抓小鼠的动作很简单,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肝癌小鼠造模实验方法
(1)肿瘤细胞悬液的制备小鼠肿瘤细胞用小鼠腹腔培养,然后抽取腹水,是
取得大量肿瘤细胞最便捷的方法。
具体操作如下:将肿瘤细胞株复苏后,接种于babl/c(昆明小鼠)腹腔,培养8-10天后,接种小鼠的腹腔内长出含肿瘤细胞的腹水,选择腹水饱满的小鼠,在超净台内于无菌条件下消毒小鼠腹部,用注射器抽取淡腹水为瘤源,放入无菌容器内,加入无菌生理盐水稀释瘤液,小心摇匀,并置冰水上保存。
若用多只动物做瘤源时,则应混合腹水。
(腹水应为淡黄色浓稠液体,若为深黄色或红色则应弃去不用。
)
(2)肿瘤细胞计数取少量腹水,放置于干试管内,用生理盐水稀释100倍,用
枪头吸取少许腹水,滴于载玻片上,推片,镜下观察细胞形态:细胞为圆形,胞浆均匀,透
明,折光性好,分布均匀。
并于镜下进行细胞分类计数,其中肿瘤细胞数应≥95%。
7mL,在小鼠右侧腋下(右侧腋窝(3)肿瘤细胞接种腹水用无菌生理盐水调整细胞浓度为1*10
6个瘤细胞)(5*106)?。
全程严格无菌操作,皮下?)常规接种H22瘤液0.2mL/只(含2*10
40min内完成。
(4)分组与给药昆明小鼠用上法造模,造模后再将腹水瘤小鼠按体重分层,随
机分为阳性对照组(CTX)、青蒿素各剂量组(150mg/kg、300mg/kg)、青蒿琥酯P0组(60mg /kg)、青蒿琥酯ip组(60mg/kg)、青蒿醇提物和青蒿水提物各剂量组
(1000mg/kg、4000mg/kg)和模型对照组(Model),每组各lO只小鼠。
造模24h后,阳性对照组(CTX)20mg/kg和青蒿琥酯ip组(60mg/kg),腹腔注射0.2mL/只,每天1次,连续lOd:其它组灌胃给药,灌服溶液0.4mL/只,每天1次,连续lOd。
模型对照组仅予等量CMC-Na 溶液,连续lOd。
平均每只小鼠每天给等量鼠料,每周换垫料2次,每日换新鲜水1次。
记录各小鼠死亡的时间。
其他问题:
检测药物对肿瘤的抑制作用,给药时间怎么确定?
1、造模后第二天给药
2、肿瘤长出一定体积后在给药。
