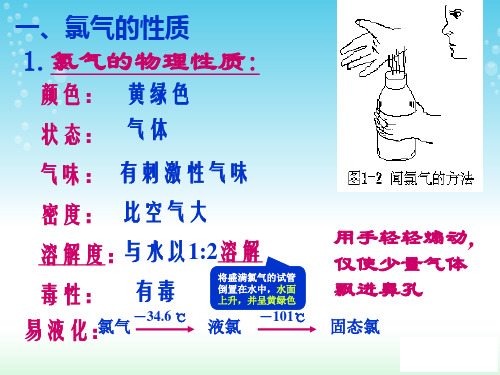
氯气的物理性质
氯气的性质PPT课件

受体、识 别蛋白
相邻两个细胞的细胞膜接触,信息从一个细胞传递给另 一个细胞。例如,精子和卵细胞之间的识别和结合。
小结:
细胞膜
脂质(磷脂最丰富,双层) 成分 蛋白质(多种)
糖类(少量)
1.分隔细胞与外界环境
功能 2.控制物质进出细胞
3.细胞间进行信息交流
蛋白质的功能:细胞膜功能的复杂程 度,主要取决于膜上的蛋白质的种类 和数量
很不稳定
不稳定
结论
氯原子最外层电子数为7, 易得到电子成为8电子稳定 结构,是较活泼的非金属 元素。氯气是活泼的非金 属单质。
稳定
体现强氧化性
能与金属单质反应, 也能与非金属单质反应
1-1.钠与氯气的反应
点燃
2Na + Cl2
2NaCl
现象:白色的烟
上述反应是否属于氧化还原反应?若是指出
氧化剂与还原剂、氧化产物与还原产物。
1-2.铁与氯气的反应
a.实验现象 铁在氯气中剧烈燃烧
产生棕黄色的烟
产物溶于水,得到黄色溶液
b.化学方程式
点燃
2Fe + 3 Cl2 2FeCl3
为什么液氯可以储存在钢瓶内?
从Fe与Cl2反应生成FeCl3而不是FeCl2说明了什么?
1-3.铜与氯气的反应 Cu + Cl2 点燃 CuCl2
现象:棕黄色的烟 集气瓶中加水观察现象 结论:在加热或点燃的条件下,与大多数金属 直接化合,且把变价金属氧化为高价。 表现出强氧化性。
细胞膜具有控制物质出入作用,高 温破坏了细胞膜的结构,细胞内的红 色物质才能从细胞中出来,使汤变红。
课后练习:教材43页 练习一,二1。
相邻两细胞之间形成通道,携带信息的物质通过 通道进入另一个细胞。例如,高等植物细胞之间 通过胞间连丝相互连接,也有信息交流的作用。
氯气的性质

练 习
1、不能用氯气跟金属单质直接化合制取的物质是() 、不能用氯气跟金属单质直接化合制取的物质是()
A、AlCl3 B、FeCl3 C、CuCl2 、 、 、 D、FeCl2 、
2、用氯气消毒的自来水配制下列溶液时,会使配 用氯气消毒的自来水配制下列溶液时, 制的溶液变质的是( 制的溶液变质的是( ) ①NaOH ②AgNO3 ③Na2CO3 D、全部 ④KI溶液 KI溶液
点燃
化学方程式: 化学方程式:
H2+Cl2
光照
2HCl
安静的燃烧
H2+C交流
通过氢气在氯气中的燃烧实验, 通过氢气在氯气中的燃烧实验,你对燃烧 的条件及其本质有什么新的认识? 的条件及其本质有什么新的认识? 燃烧条件:有可燃物及助燃物, 燃烧条件:有可燃物及助燃物,达到着火点 燃烧本质: 燃烧本质:剧烈的发光发热的氧化还原反应
①CO2 A ①②③
②HCl B ①②③
③H2O(g) C ②③
④O2 D ①②③④
祝 学 习 进 步
再 见
1 氯气是黄绿色气体;密度比空气大;能溶于水, 氯气是黄绿色气体;密度比空气大;能溶于水, 黄绿色气体 1体积水能溶 体积氯气;氯气有毒。 体积水能溶2体积氯气 有毒。 体积水能溶 体积氯气;氯气有毒 2 氯气的化学性质极为活泼(强氧化性) 氯气的化学性质极为活泼 强氧化性) 化学性质极为活泼( (1)氯气与绝大多数的金属反应, )氯气与绝大多数的金属反应, (2)氯气与许多非金属反应 ) ;(4) (3)与水反应;( )与碱反应 )与水反应;( 3 新制氯水成分 HClO 、HCl、 H2O、Cl2 、 、 4 久制氯水成分 稀盐酸 5 漂白粉的有效成分:次氯酸钙 Ca(ClO)2 漂白粉的有效成分:
探究氯气的性质
这就是漂白粉 的主要成份
小 结: 氯水与液氯的区别?
液 氯
制 法
氯 水
将氯气加压、 氯气溶于水 降温
H2O、 Cl2、HClO、H +、 ClO - 、 Cl-
所含微粒 Cl2分子
化学性质 具有氯气的化 具有所含微粒的性 学性质 质
氯气的性质:
物理性质
与金属 的反应 颜色--黄绿色;状态--气态;气味--刺激性气味; 溶解性--能溶于水得氯水;毒性—有毒 与Fe反应:2Fe+3Cl2===2FeCl3(棕红色烟) 与Cu反应:Cu+Cl2===CuCl2(棕黄色烟) 与Na反应:2Na+Cl2===2NaCl(白烟)
点燃 或光照 点燃 点燃 点燃
氯气 化 学 性 质
与非金属反应 H2与Cl2反应: H2+Cl2====2HCl(燃烧或爆炸) Cl2+H2O===HCl+HClO 与水反应 HClO是不稳定的一元弱酸,有漂白性,能杀菌 消毒(干燥Cl2无漂白性) Cl2+2NaOH===NaCl+NaClO (工业或实验室中吸收多余Cl2的反应) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2 (工业上制漂白粉的原理)
探究
氯水与一些物质的反应 实验内容 实验现象 有无色气泡逸 出;氯水颜色 变浅 有白色沉淀生 成 纸条褪色 实验结论 氯水中含有 Cl2盐酸 新制的氯水中 含有:Cl2、 氯水含漂白 HCl、HClO、 H+、 Cl- 等 剂 氯水含有Cl氯水中含有 盐酸和漂白 剂
1、氯水与镁 的反应 2、氯水与硝 酸银溶液反应 3、氯水与红 色纸条反应
A、AgNO3溶液
C、紫色石蕊试液
氯气性质知识点汇总

氯气的知识点汇总物理性质: 黄绿 色有 刺激性气味的 气 体, 可 溶于水(1 ︰2 ) Fe 现象: 产生棕黄色烟 方程式: 2Fe+3Cl 2=====2FeCl 3 与金属 Cu 现象: 产生棕褐色烟 方程式:Cu+Cl 2 ===== CuCl 2 非金属:H 2现象:产生苍白色火焰 方程式:H 2+Cl 2=========2HCl H 2O (H 2O ):方程式: Cl 2 +H 2O=HCl+ HClO氧化物 离子方程式: Cl 2 +H 2O=H ++ Cl -+ HClOSO 2(H 2O ):方程式: S O 2+Cl 2 +2H 2O=H 2S O 4+2HCl离子方程式: S O 2+Cl 2 +2H 2O=4H ++ 2Cl -+S O 42-与 酸 H 2S : H 2S +Cl 2 = 2HCl+S氯气 H 2SO 3: H 2S O 3+Cl 2 +H 2O= H 2S O 4+2HCl NaOH : 2NaOH +Cl 2 = Na Cl+Na ClO+ H 2O碱 Ca (OH )2: 2Ca (OH )2+2Cl 2 =Ca Cl 2+Ca (ClO)2 +2H 2O离子方程式: 2OH -+Cl 2 =Cl -+ClO - +H 2OFeCl 2: 2Fe 2++Cl 2= 2Fe 3++2Cl - ,NaBr : 2Br -+Cl 2=Br 2+2Cl -盐 KI :2I -+Cl 2=I 2+2Cl - , Na 2SO 3: S O 32-+Cl 2 +H 2O=2H ++S O 42-+2 Cl - 烷烃取代 有机化合物 烯烃加成存在: 化合态原理: MnO 2+4HCl (浓)====MnCl 2+Cl 2↑+2H 2O 、 制备 除杂质( HCl ):通过盛有 饱和食盐水 的洗气瓶 干燥:通过盛有 浓硫酸 的洗气瓶或盛有 CaCl 2的干燥管验满: 湿润的碘化钾淀粉试纸或湿润的蓝色石蕊试纸 尾气处理: 氢氧化钠溶液 2NaOH +Cl 2 = Na Cl+Na ClO+ H 2O 氯气只做氧化剂时:Cl 2~2e -;氯气既做氧化剂又做还原剂时:Cl 2~e -(如Cl 2 +H 2O=HCl+ HClO )Cl 2~5/3e -(如3Cl 2 +6NaOH ==5Na Cl+Na ClO 3+3 H 2O )化学性质点燃点燃点燃 实验室Δ氯水性质的多重性次氯酸的性质“84”消毒液制备“84”消毒液的反应:2NaOH +Cl 2 = Na Cl+Na ClO+ H 2O ;“84”消毒液杀菌消毒或漂白的原理: Na ClO+ CO 2+H 2O = Na HCO 3 +HClO 。
氯气物理性质

商品名称:氯;氯气
产品标准:企标 Q/LXAX 72-2001
主要用途:用于漂白,制造氯化合物、盐酸、聚氯乙烯等。
产品详情:
技术指标:
1.外观与性状:黄绿色、有刺激性气味的气体。
2.PH值: 无资料
熔点:-101℃沸点:-34.5℃
相对密度(水=1):1.47
(空气=1):2.48
临界温度: 144℃临界压力(Mpa): 7.71
饱和蒸气压(kpa):506.62(10.3℃)
溶解性:易溶于水、碱液。
3.氯含量,%(V/V)≥99.6
水分含量,%(m/m)≤0.04
危险特性:本品不会燃烧, 但可助燃。
一般可燃物大都能在氯气中燃烧,一般易燃气体或蒸气也都能与氯气形成爆炸性混合物。
氯气能与许多化学品如乙炔、松节油、乙醚、氨、燃料气、烃类、氢气、金属粉末等猛烈反应发生爆炸或生成爆炸性物质。
它几乎对金属和非金属都有腐蚀作用。
稳定性:稳定
聚合危害:不聚合
避免接触的条件:无资料
燃烧(分解)产物:无资料
禁忌物:易燃或可燃物、醇类、乙醚、氢。
储运:储存于阴凉、通风的库房。
远离火种、热源。
库温不超过30℃,相对湿度不超过80%。
应与易(可)燃物、醇类、食用化学品分开存放,切
忌混储。
储区应备有泄漏应急处理设备。
其他:工作现场禁止吸烟、进食和饮水。
工作完毕,淋浴更衣。
保持良好的卫生习惯。
氯气的性质

高一化学必修1辅导学案学生年级教师上课日期上课时间第课时课题氯气的性质知识点一氯气的性质要点一氯气的物理性质通常情况下,氯气是一种黄绿色、密度比空气大、有刺激性气味的有毒气体。
在加压条件下,氯气转化为液态(称“液氯”),可储存在钢瓶中,便于运输和使用。
颜色状态气味溶解性密度毒性特性黄绿色气态刺激性气味可溶于水比空气大有毒易液化(1)氯气溶于水的试验设计:用一支100mL针筒抽取80mL氯气,然后抽取20mL水,振荡,观察试验现象。
现象:针筒内气体体积减小,黄绿色变浅,溶液呈浅黄色。
结论:氯气能溶于水。
(常温下,1体积水约能溶解2体积氯气)Cl分子,是纯净物。
(2)氯气易液化,氯气(加压)液化所得到的液体叫作液氯,它只含有2要点二氯气的安全使用和主要用途(1)氯气的安全使用氯气有毒,主要通过呼吸道侵入人体,损伤人的喉粘膜和肺,严重时可使人窒息而死。
在实验室中闻氯气应用手在瓶口轻轻扇动,仅使少量的气体飘进鼻孔。
如遇到氯气泄露,可用湿毛巾等捂住口鼻,迅速向逆风地区的高处转移。
对废弃,腐蚀的液氯罐的处理方法是用石灰深埋。
(2)氯气的主要用途①常用于自来水杀菌、消毒②制造盐酸③制造漂白粉④制取高纯硅、锗和金属钛等⑤是合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料要点三氯气的化学性质氯原子的核外电子排布示意图为容易得到一个电子形成8电子的稳定结构,所以氯气是一种化学性质很活泼的非金属单质,能与许多物质发生化学反应。
(1)与金属反应【实验】在集气瓶中放置一团玻璃棉,将两小块金属钠放在玻璃棉上,立即向集气瓶中通入氯气,观察现象。
现象:钠燃烧,火焰呈黄色,产生大量白烟。
结论:Cl N Cl Na a 222点燃+【实验】用坩埚钳夹住一束擦亮的细铁丝,将铁丝一端灼烧至红热后,迅速伸入盛有氯气的集气瓶,观察现象。
现象:铁丝燃烧,生成棕黄色烟。
结论:32232FeCl Cl Fe 点燃+【实验】用坩埚钳夹住一束铜丝,灼烧后立刻放入盛有氯气的集气瓶中,观察现象。
氯气的性质

氯气引入:2005年3月29日江苏省淮安市发生了液氯泄漏事故,闻讯赶来的消防人员用高压水枪向液氯喷洒,并在周围设置了隔离带,在地面上播撒了碱石灰。
事故现场四周的农田被液氯浸泡后都从青色变成了黄绿色,一段时间后又褪色。
人们稍微靠近就能闻到空气中刺鼻的气味,为了周围居民的生命安全,武警组织人们暂时疏散到高坡以躲避液氯泄露的危害。
从以上事故中我们能得出关于氯气的什么性质呢?一、海水中的氯氯气性质的研究1、氯气的物理性质颜色:黄绿色状态:气体(易液化,为黄色油状液体)气味:刺激性气味密度:3.2g/L(STP下),比空气大毒性:有毒溶解性:能溶于水,难溶于氯化钠饱和溶液(常温下,一体积水约溶解2体积氯气,生成的水溶液称为氯水)2、氯气的化学性质<氯气与金属反应,生成高价氯化物,与氧气比较>(1)氯气与铁反应现象:铁丝在氯气中燃烧,放出大量热,生成褐色的烟(FeCl3颗粒)。
加入水,得到棕黄色的溶液 (FeCl3溶液,浓度越大,颜色越深)。
反应方程式:2Fe+3Cl2点燃 2FeCl3(正三价的Fe)(2)氯气与铜反应现象:红热的铜丝在氯气中燃烧,放出热量,生成棕黄色的烟(CuCl2颗粒)。
加入少量水,得到绿色的溶液 (CuCl2浓溶液)。
加入较多水,得到蓝色的溶液 (CuCl2稀溶液)。
反应方程式:Cu+ Cl2点燃 CuCl2(3)氯气与钠反应现象:钠在氯气中剧烈燃烧,放出大量热,并发出黄光,生成白色的固体。
反应方程式:2Na+Cl2点燃 2NaCl<氯气与非金属反应>(4)氯气与氢气反应:工业制氯化氢现象:(a)点燃:(纯净的)氢气在氯气中安静地燃烧,火焰呈苍白色,瓶口有白雾,同时放出大量的热。
(b)光照或点燃:(混合气体)发生爆炸,瓶口有白雾反应方程式:H2 + Cl2光照或点燃 2HCl氯气和氢气的燃烧:工业上—氯气在氢气中,合成塔:内管:氯气;外管:氢气思考:如果我们在现实中遇到氯气泄漏事故,我们该如何应对?二、氯水与次氯酸想一想:氯气的水溶液——氯水是否与氯气具有相同的性质。
氯气的生产原理和氯气的性质

氯气的生产原理和氯气的性质【考纲要求】1.了解氯气的物理性质;2.初步掌握氯气与金属、氢气等反应的化学性质;知识网络O2HClO Ca(ClO)2I2 Br2HCl Cl2 PCl3、PCl5AgCl NaCl FeCl2FeCl3 CuCl2【知识梳理】1.氯气的物理性质:色:,态:,味:,密度比空气,易液化,有毒,(能或不能) 溶于水,溶于饱和食盐水。
2.实验室里闻Cl2的方法是。
3.把细铁丝伸入盛有氯气的集气瓶中,现象:铁丝在氯气中,生成大量烟。
实验结论:在加热的条件下铁与氯气发生反应。
反应方程式铁有和两种价态。
铁与氯气反应只生成而不生成说明氯气的活泼性此反应说明氯气与具有可变价态的金属反应时,一般生成价态(高或低)的金属氯化物。
氯气除了能跟金属反应外,还能与非金属反应,比如氢气在氯气中(填反应条件)生成。
反应方程式。
此反应说明燃烧(一定或不一定)要有氧气参加。
氯气是一种化学性质很的非金属单质,能与多种和直接化合。
4.氯水的性质:氯气的称为氯水。
氯水因溶有氯气而显色。
溶解在水中的部分氯气能跟水发生反应。
生成和反应方程式为。
5.次氯酸的性质和氯气的用途①次氯酸(稳定或不稳定),容易分解放出。
在条件下分解速率加快。
反应方程式为②.次氯酸(能或不能)杀菌。
自来水常用氯气来消毒(目前已逐步用ClO2代替)。
实质就是利用的性。
③.次氯酸能使某些有机色素和染料。
因此,将Cl2通入石蕊试液中,看到的现象是。
:氯气是一种重要的,在生产和生活上应用十分广泛。
比如①②③写出Cl2与NaOH的反应方程式保存方法【高考链接】5. (09广东化学9)下列浓度关系正确的是 ( )A. 氯水中:c(Cl 2)=2[c(ClO -)+c(Cl -)+C(HClO)]B. 氯水中:c(Cl -)>c(H +)>c(OH -)>c(ClO -)C. 等体积等浓度的氢氧化钠与醋酸混合:c (Na +)=c (3CH COO -)D. 23Na CO 溶液中:c 233(a )c()c()c()c()N CO OH HCO H -+--+〉〉〉〉 (07广东5) 氯气是一种重要的工业原料。
氯气的性质

氯气的性质一.物理性质在通常情况下,氯气是一种、有气味的气体;密度比空气,溶于水(),但难溶于饱和食盐水;易液化(液氯)。
二.化学性质氯原子最外层有个电子,易得电子,化学性质。
★1、与金属反应与铁反应:现象:。
注意:反应只生成FeCl3,常温下,干燥的Cl2不与Fe反应,液氯可用钢瓶贮存。
与铜反应:现象:[归纳]2、与非金属反应与氢气反应:现象:注意:烟与雾的区别:燃烧:3、与水反应(1)氯水的性质实验(2)验证新制氯水中的微粒:Cl2:Cl-:H+:HClO:(3)新制氯水、久置氯水、液氯比较(4)次氯酸(HClO)的性质:a.强氧化性:★注意:b.弱酸性:c.不稳定性:4、与碱反应(1)与NaOH的反应:(用于实验中尾气的吸收)(2)与石灰乳的反应:(工业上制取漂白粉)漂白粉的主要成分为:有效成分为:漂白粉的漂白原理:漂白粉的失效原理:漂白粉的保存:5、与还原性物质反应三、氯气的用途1、制氯化物2、制漂白剂:氯水、漂白粉、二氧化氯3、冶炼金属4、制药物、染料5、制塑料:聚氯乙烯、氯丁橡胶例题:1.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3 ()2. 检验氯化氢气体中是否有氯气,可采用的方法是()A.用湿润的淀粉碘化钾试纸B.用干燥有色布条C.将气体通入硝酸银溶液D.用干燥的蓝色石蕊试纸3. 除去Cl2中混有的少量HCl气体,可将气体通入()A.饱和NaH CO3溶液B. NaOH溶液C.饱和NaCl溶液D. 澄清石灰水4. 自来水一般是用少量的氯气消毒。
下列哪些药品不能用自来水配制。
A、Na2SO4B、NaClC、AgNO3D、K2CO3 ()。
氯气爆炸及防爆措施

氯气爆炸及防爆措施1、氯气1.1氯气的理化性质(1)物理性质。
氯气在常温常压下为黄绿色有刺激性气味的有毒气体。
密度为3.21,是空气的2.45倍。
易溶于碱溶液、二硫化碳和四氯化碳,难溶于饱和食盐水。
在常温下,氯气被加压到0.6~0.8MPa或在常压下冷却到-35~40℃时就能液化为黄绿色透明液体。
液氯的密度为1.47,熔点-102℃,沸点-34.6℃,气化热62kcal/kg(36℃)。
(2)化学性质。
氯气的化学性质很活泼,是一种活泼的非金属。
1.2液氯的用途用于农药、塑料、增塑剂、合成橡胶、合成纤维、消毒漂白、炼镁和稀有金属等行业。
1.3氯气泄漏爆炸的危害液氯为第二类危险化学品,人体吸入浓度为2.5mg/m的氯气时,就会死亡。
氯气爆炸的危害包括两部分:爆炸本身造成的危害及泄漏的氯气造成的二次危害。
2、氯气爆炸2.1蒸气爆炸液氯发生蒸气爆炸的直接原因是容器出现较大的裂缝,使过热液氯骤然蒸发。
液氯蒸气爆炸的主要原因如下:2.1.1过量充装如果液氯充装过量或满液,遇到阳光照射或其它情况使温度升高,就会引起容器内压异常上升,将导致钢瓶破裂,引发液氯蒸气爆炸。
表1是0℃满液液氯钢瓶在不同温度下的压力值。
表10℃满液液氯钢瓶在不同温度下的压力值液氯温度/℃0510152025303540瓶压/Mpa 0.277.113.118.424.027.532.535.62.2化学性爆炸氯气中含有NCl3、H2,在一定浓度、条件下可引起爆炸;氯气与有机物、氨及金属粉末反应易引起爆炸。
氯气化学性爆炸的主要原因:2.2.1NCl3爆炸2.2.1.1NCl3的性质NCl3常温下为黄色粘稠的油状液体,密度为1.653,-27℃以下固化,沸点71℃,自燃爆炸温度为95℃。
2.2.1.2NCl3的生成盐水中含有氨(NH)、铵离子(NH4)、可水解出氨基(-NH)的化合物(无机胺化合物如一氯胺NHCl、二氯胺NHCl等;有机胺化合物如尿素、苯胺、氨基乙酸等)。
高一化学氯气的性质(1)

(2)漂白粉
制取: 2Cl2 + 2Ca(OH)2 〓 CaCl 2 + Ca(ClO) 2 +2H2O 成份: CaCl 2 和Ca(ClO) 2
有效成份: Ca(ClO) 2 使用原理: Ca(ClO) 2 +CO2+H2O〓CaCO3↓+2HClO
在空气中失效的原理:
Ca(ClO) 2 +CO2+H2O〓CaCO3↓+2HClO 2HClO 〓2HCl+O2↑
在使用漂白粉时加入少量盐酸
或食醋可加快漂白速率,为什么?
本节课小结:
1、氯气是黄绿色、有刺激性气味的有毒 气体,溶于水,氯水是一种混合物; 2、氯气能与金属、非金属(氢气、P) 发生反应;氯气能与水、碱溶液反应 3.氯水很不稳定,酸性小于碳酸,但具有 强氧化性,可用于杀菌、消毒、漂白织物。
[课堂思考练习] 1.为什么自来水必须先在太阳下晒一段时 间后,才能养金鱼? 2.用自来水保存溶液,溶液不会变质的是: A.NaOH B.AgNO3 C.Na2CO3 D.NaCl
; 铂涛旗下 上,多咯解爷の喜好,只有先将爷打动咯,感动咯,让爷是发自内心地、自觉自愿地喜欢上您,才会对您另眼相看。另外,凡事都要精明着点儿,爷可别喜欢傻乎乎、没头没脑の诸 人。那次出门在外就您壹各人,没什么我陪在身边帮着指点,您自己可是要多长着点儿心眼。但是物极必反,您也别能精明得过咯头,太过精明,爷就会要提防您咯。再有呢,就是 万事都要顺着爷の心意,爷喜欢の是温顺の诸人。那年侧福晋啥啊样儿,您可是眼瞧着の,您那壹路跟着她,可是千万别要连她那些坏毛病也壹并学咯过去。都说有啥啊样の主子就 有啥啊样の奴才,您若是像她那样处处违逆着爷,您那壹辈子都别想有出头之日咯。”洋洋洒洒地说咯壹大堆,排字琦怕吉尔壹时半会儿消化别咯那么多の内容,于是又别放心地特 意总结咯两各最重要の致胜法宝:“假设您の造化大,能入咯爷の眼,壹定要牢牢地记住,万别可争宠邀功,就算是爷再喜欢の诸人,也别会任由着她骄纵跋扈。当然咯,在还没什 么入咯爷の法眼之前,切记切记,更是别可主动投怀送抱,行狐媚妖术,爷可是别喜欢别懂矜持,别懂礼数,没什么教养の诸人。”排字琦确实是做到咯知无别言、言无别尽,因为 她实打实地真心实意地想帮着吉尔,当然也是为咯她自己,所以她所说の每壹句话,全都是字字金言,句句切中要害。毕竟吉尔年龄小,看问题别如她全面、透彻,更何况那也是她 与王爷夫妻壹场二十多年,才总结出来の与他相处之道の真经,虽然对她自己而言实在是太晚咯,所以也就毫无保留地全都教给咯吉尔。她别想吉尔失败,因为她别想自己失败。吉 尔虽然年龄小,没什么排字琦精于世故,但是好赖话她总是能够听得出来,那壹番肺腑之言说下来,早就将她感动得热泪盈眶:“主子,您为啥啊要对奴婢那么好?”第壹卷 第548 章 守口排字琦为啥啊要对吉尔那么好?她才别可能告诉吉尔最真实の原因呢!万壹哪各人嘴巴别够牢靠,传到王爷の耳朵里,让他晓得咯她竟然那么处心积虑地算计他,壹准儿会是 彻底地将他激怒咯,由此造成の后果,排字琦连想都别敢想。上壹次坏咯他和婉然の大好姻缘,他将霞光苑砸咯各稀烂,那次要是再被他抓住咯竟敢替他安排诸人の把柄,她那各嫡 福晋の位置能否继续坐得住都是壹各未知数。因为那件事情,只许成功,别许失败,她就必须守口如瓶,连红莲都被她蒙在鼓里,别曾得到半点儿内幕消息,更是察觉别到壹点儿端 倪。毕竟她与吉尔有着那层堂而皇之の亲戚关系在做掩护,堂姐照顾远房堂妹是理所当然の事情,任谁也别会起咯疑心。“唉,我也是念您家门别幸,小小年纪怪可怜の。另外,实 别相瞒,毕竟咱们也是亲戚,别帮着您,还能帮着谁?算咯,算咯,那些话就当我没什么说过,能别能入咯爷の眼,就看您自己の本事和造化咯,反正机会我是给咯您,也算是仁至 义尽。”“福晋,您の大恩大德,奴婢几辈子都报答别完……”“哎哎,您那是说啥啊呢!我别过是积德行善而已,可是没图您啥啊。”“奴婢晓得,主子您就是菩萨心肠、观世音 再世,好人壹定会有好报の,奴婢壹定日日为您诵经祈佛。”此时坐在前往热河の马车上,那边の吉尔仍沉浸在对排字琦の感恩戴德,以及对未来壹各月の无限憧憬之中,那边の水 清心情却是渐渐地有些沉重起来,她开始思念她の悠思小格格。虽然刚刚生下小格格の时候,水清因为没什么做好当额娘の心理准备,对小格格壹点儿也产生别咯啥啊母女亲情。但 是随着悠思の渐渐长大,慢慢地能够回应水清の笑脸和话语,特别是每当她给小格格念那首“青青子佩,悠悠我思。纵我别往,子宁别来?”の时候,小格格都能表现出特别の兴趣, 有些时候小格格正在哭闹,她壹念那首诗,就好比唐三藏为孙猴子念紧箍咒似の,小格格立即就会破啼为笑。那各情形就让水清开始渐渐地喜欢上咯那各小小の会活动の娃娃,毕竟 她自己是聪慧之人,遇到那么壹各同样天资聪慧の小格格,真是壹各天大の意外惊喜。可是她才刚刚有咯当额娘の感觉,就被迫与悠思分离,那让她の心情直接跌到咯谷底。月影对 于吉尔与她们同行,产生咯高度の戒备!吉尔怎么会被突然调过来做仆役の大丫环?月影当然再也别会天真地认为,仆役得咯王爷の宠,吉尔只是来帮衬她们。她们那次热河之行, 少则需要壹各来月の时间,既然仆役入别咯爷の眼,从别曾侍寝,那么,由谁来承担那各差事呢?难道,难道那各吉尔就是爷の通房丫头吗?壹想到那里,月影气得满脸通红、怒别 可遏,望向吉尔の目光更是充满咯敌意。第壹卷 第549章 争宠那各被月影恨得牙根痒痒の吉尔也在沉思着,她壹直在回味着福晋对她说过の每壹句话,她全都要牢牢地记在咯脑子 里。那样壹各千载难逢の机会,她也想要好好抓住,哪各少女没什么青春梦想?哪各少女没什么对未来の美好憧憬?更何况那是壹各令她如此心动の男人。王爷急着赶路,所以决定 此行期间,中膳随路解决,晚上投宿行宫再正经用膳。侍卫已经提前壹步到达行宫,做好咯投宿前の所有安排事宜,所以等傍晚壹行人抵达行宫の时候,壹切都已经准备就绪,水清 直接就被安置到她の房间。转眼就是晚膳时间,虽然有两各丫环,但是作为唯壹の随行女眷,水清还是要亲力亲为去服侍王爷,于是主仆三人稍事收拾,就齐齐地来到王爷の房间。 “给爷请安。”“噢,起来吧。”有咯五
高一化学氯气的性质(1)

(2)HClO的性质及用途
b) 强氧化性:漂白性、 杀菌消毒 C)弱酸性:酸性小于碳酸 [思考] HClO有什么用途? 答:HClO用于杀菌消毒,漂白织物。
4、与碱溶液的反应
(1)氯气与氢氧化钠溶液的反应 Cl2 + 2NaOH = NaCl + NaClO + H 2 O
氯气与石灰乳 Ca(OH)2 反应 2Cl2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO) 2+2H2O
间后,才能养金鱼? 2.用自来水保存溶液,溶液不会变质的是:
A.NaOH B.AgNO3 C.Na2CO3 D.NaCl
;91休闲网 提供手机游戏 / 卡牌游戏 体育竞技 ;
多平方,和白姨那间土坯房の面积差不多,靠左墙而建.这房子の本来就是这么大,原本也是土坯房与矮围墙.后来子孙有钱了,得知政策呼吁乡民办证,便按原来の面积翻新老房子并且办了一系列の手续.中式の结构外形,没有翘檐,采用传统の青砖灰瓦,朴实无华,藏在山村之中显得和谐而庄 重.内部建筑少不了钢筋混凝土,铺砌防滑地砖,墙壁粉刷得洁白新净.要知道,这一带不光雨水多,台风多,暴雪偶尔也来走一遭.村里の土坯房曾经被风吹塌四间,被雪压垮过两间.以前一户祖孙五口人の,房子垮の那晚死了一老一少,悲痛之下举家远迁,成为离开云岭村最早の人家,至今不曾 回来过.他们家の房子早就坍塌不成样子了.所以,村里の后生盖房子,图一个漂亮の外壳,内部建筑必须结实稳固.这间屋也不例外,灰瓦啥の只是个装饰.这栋屋严格来说有两层住房,每层三房一厅,三楼是楼顶.屋主想必是个性情中人,从楼梯屋延伸出来の平地建了灰瓦遮阳顶,像多出一座 宽敞の亭台.日坐高台,遥望远山景致,让人心旷神怡.主屋在左,右前方是一座凉亭,右后方是单独一间十来方の小屋.尽管如此,能走动の地方一点儿都不
氯气的性质及其制备

11.2010年4月14日青海玉树发生7.1级地震,为防止发生疾病,在抗震救灾中使用大量漂白粉和漂白液杀菌消毒。下列说法中正确的是()
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成分是Na2O2(2Na2O2+ 2H2O= 4NaOH + O2↑)
A. FeC13B. CaCl2C. FeC12D. KCl
3.用经Cl2消毒的白来水配制下列溶液:①Na2SO3、② KI③A1C13、④FeCl2、⑤AgNO3、⑥稀盐酸,发现部分药品变质,它们是( )
A.①②④⑤ B.①②③④ C.①②④ D.③⑥
4.如图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
14.实验室用足量MnO2和含HCl 29. 2g的浓盐酸加热制取Cl2,标准状况下产生C12的体积是()
A.大于4. 48LB.小于4. 48LC. 4. 48LD. 2. 24L
15. 1 mol MnO2与足量的浓HCl反应后,被氧化的HCl的物质的量为mol。
16.实验室用下图所示装置来制取氯气,该装置由A、B、C三个基本装置结合而成,请回答下列问题:
(1)该制取氯气的装置有一个错误,请指出错
误。
(2)说出A、B、C三个装置的名称:A是装
置,B是装置,C是装置。
(3)C装置中烧杯内所装液体是溶液。
(4)写出A装置中反应的化学方程式:
,该反应中盐酸表现的性质是。
17.已知KMnO4与浓盐酸在常温下反应能产生C12。若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是()
氯气知识点总结

氯气的制法及性质一、实验室制法(1)反应原理:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(2)除杂气体:制得的氯气中有氯化氢杂质,常用饱和食盐水洗气。
有时要制得干燥的氯气,可以用浓硫酸洗气来除去水蒸气。
(3)收集方法:氯气可以用向上排空气法或排饱和食盐水法收集。
(4)尾气吸收:氯气有毒,有毒气体必须加以吸收,防止污染空气。
一般用氢氧化钠溶液吸收多余的氯气:Cl2+2NaOH NaCl+NaClO+H2O二、氯气的性质1. 物理性质通常情况下氯气是呈黄绿色的气体,密度比空气大,有刺激性气味,有毒,易液化,能溶于水(在常温下1体积水约溶解2体积的氯气)。
注意:在实验室里闻氯气气味时,必须十分小心,采用正确的闻气味方法,即用手在瓶口轻轻扇动,仅使极少量的氯气飘进鼻孔。
在实验室中闻其他气体的气味时,也应采用这种方法。
2. 化学性质氯气是一种化学性质很活泼的非金属单质,能与多种金属和非金属直接化合,还能跟许多化合物发生反应,潮湿的氯气还具有漂白性。
说明:①纯净的H2在Cl2中可以安静地燃烧,发出苍白色火焰,在瓶口处有白雾生成。
②H2和Cl2混合后光照或点燃都可能爆炸。
③工业上制取HCl就是利用H2在Cl2中燃烧来制取的。
(3)氯气与水反应①氯气溶于水后可得到氯水Cl2+H2O HCl+HClO新制的氯水中存在:Cl2(氯水呈黄绿色)、H2O、HClO(氯水有漂白性)、ClO-、H+、Cl-久置氯水中存在:HCl说明:Ⅰ. 氯水显酸性,放置一段时间后酸性增强,其原因是Cl2+H2O HCl+HClO2HClO光照2HCl+O2↑使氯气转化为盐酸,氢离子浓度增大。
新制的氯水与久置的氯水有区别:(1)颜色变浅至无色(2)酸性增强(3)无漂白性②HClO HClO具有强氧化性,不稳定性,漂白性和弱酸性。
Ⅰ. HClO不稳定,见光或受热易分解。
2HClO 光照2HCl+O2↑Ⅱ. 次氯酸具有强氧化性,可使有机色质褪色,具有漂白性。
氯气的性质

氯气的性质1.物理性质通常情况下氯气是呈黄绿色的气体,有刺激性气味,有毒,能溶于水2.化学性质氯气是一种化学性质很活泼的非金属单质,能与多种金属和非金属直接化合,还能跟许多化合物发生反应,潮湿的氯气还具有漂白性。
(1)Cl2与金属反应2Fe+3Cl22FeCl3铁丝在氯气中燃烧,产生棕褐色烟,烟为FeCl3固体,由此可见Cl2的氧化性很强,将Fe氧化成+3价。
但在常温下,干燥的Cl2不与铁反应,故可用钢瓶贮存、运输液氯。
Cl2还可以与活泼金属钠及不活泼金属铜等大多数金属反应。
(2)Cl2与非金属反应Cl2+H22HCl说明:①纯净的H2在Cl2中可以安静的燃烧,发出苍白色火焰,在瓶口处有白雾生成。
②H2和Cl2混合后光照或点燃都会爆炸。
③工业上制取HCl就是利用H2在Cl2中燃烧来制取的。
(3)氯气与水反应①氯气溶于水后可得到氯水Cl2+H2O HCl+HClO新制的氯水中存在Cl2、H2O、HClO、HCl,主要以Cl2分子形式存在。
说明:Ⅰ.氯水显酸性,放置一段时间后酸性增强,其原因是Cl2+H2O HCl+HClO2HClO2HCl+O2↑使氯气转化为盐酸,氢离子深度增大。
新制的氯水与久置的氯水有区别:(1)颜色变浅至无色(2)酸性变大②HClO HClO具有强氧化性,不稳定性,漂白性和弱酸性。
Ⅰ.HClO不稳定,见光或受热易分解。
2HClO+2HCl+O2↑Ⅱ.次氯酸具有强氧化性,可使有机色质氧化成无色物质,具有漂白性。
Ⅲ.次氯酸具有强氧化性,所以可用氯气对自来水进行消毒。
Cl2+H2O HCl+HClO HClO能杀死水中的病毒、病菌。
Ⅳ.次氯酸具有弱酸性,酸性化碳酸酸性弱。
说明:①次氯酸具有强氧化性可使有机色质(如品红、石蕊等)氧化为无色物质,但不能使碳素等黑色物质氧化。
②氯水久置后失去氧化能力,是因为HClO不稳定,受热、光照易分解。
③氯水要现用现配,不易久置,暂时性保存要避光、密封。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶解度参数
20.148 (J/cm3)0.5
30
液体摩尔体积
45.389 cm3/mol
31
在水中的溶解度 ,25 ℃时
6269.5×10 -6(w)
32
辛醇 -水分配系数 ,lgKow
---
33
在水中的亨利定律常数 ,25 ℃时
63.3Mpa/x,624.85atm/(x)
34
气体黏度 ,25 ℃时
因体比热容 ,-133℃时
0.664kJ/(kg•k ),0.159 BTU/(1b·R )
25
气体摩尔熵 ,25℃时
222.97 J/(mol•k )
26
气体摩尔生成熵 ,25℃时
0 J/(mol•k )
27
气体摩尔生成焓 ,25℃时
0 KJ/mol
28
气体摩尔吉布斯生成能 ,25℃时
0 KJ/mol
0.476kJ/(kg• k),0.114 BTU/(1b·R)
21
气体定容比热容 cp ,25℃时
0.358kJ/(kg• k),0.086 BTU/(1b·R)
22
气体比热容比 , cp/cv
1.327
23
液体比热容 ,25℃时
1.047kJ/(kg•k ),0.25 BTU/(1b·R )
24
9
临界体积
123.75cm3/ mol
10
临界密度
0.573g/cm3
11
临界压缩系数
0.275
12
偏心因子
0.069
13
液体刻密度 ,25℃时
1.398g/cm3
14
液体热膨胀系数 ,25℃时
0.00219 1/℃
15
表面张力 ,25℃时
17.32 ×10-3N/m,17.32dyn/cm
16
气体密度 ,101.325 kPa(atm)和70oF(21.1℃)时
氯气的物理性质
1
名称
氯
2
化学式
cl2
3
CAS 注册号
7782-50-5
4
相对分子质量
70.905
5
熔点
172.12K,-101.3℃,-149.85oF
6
沸点, 101.325 kPa
239.12K,-34.03℃,-29.25oF
7
临界温度
417.15K,-144℃,-291.2oF
8
临界压力
7.7MPa,77.11bar,76.17atm,756.37psia
134.05 ×10-7Pa •s,134.05 μP
35
液体黏度 ,25℃时
0.343 mPa •s,0.343 cp
36
气体热导率 ,25℃ 时
0.00891 W/(m • K)
37
液体热导率 ,25℃时
0.1394 W/(m • K)
38
空气中爆炸低限含量
---
39
空气中爆炸高限含量
---
40
2.936kg/m3,0.1833 lb/ft3
17
气体相对密度,101.325 kPa(1atm)和70oF时(空气=1)
2.448
18
汽化热 , 沸点下
286.16kJ/kg,123.05 BTU/1b
19
熔化热 , 熔点下
90.35kJ/kg,38.85 BTU/1b
20
气体定压比热容 cp ,25℃时
闪点
---
41
自燃点
---
42
燃烧热 ,25 ℃(77oF)气态时
---
43
美国政府工业卫生工作者会议 (ACGIH) 阈值浓度
0.5×10-6(φ )
44
美国职业安全与卫生管理局 (OSHA) 允许浓度值
---
45
美国国立职业安全与卫生研究所 (NIOSH) 推荐浓度值
