环境化学复习资料
环境化学复习资料(仅供参考_请注意核对)

环境工程化学复习第二章一、影响大气污染物迁移的因素1、风和大气湍流的影响;2、天气形势和地理地势的影响;(1)、海陆风;(2)、城郊风;(3)、山谷风、二、自由基也称游离基,是指由于共价键均裂而生成的带有未成对电子的碎片。
大气中常见的自由基如:HO·,HO2·,RO,RO2·,RC (O)O2三、与大气污染有直接关系的重要的光化学过程1、氧分子和氮分子的光解2、臭氧的光解3、NO2的光解4、亚硝酸和硝酸的光解5、二氧化硫对光的吸收6、甲醛的光解7、卤代烃的光解四、降水的化学组成无机物:土壤衍生物离子Al3+,Ca2+,Mg2+,Fe3+,Mn2+和硅酸盐等;海洋盐类离子Na+,Cl-,Br-,SO42-,HCO3-及少量K+,Mg2+,Ca2+,I-和PO43+;气体转化物SO42-,NO3-,NH4+,Cl-和H+;人为排放源As,Cd,Cr,Co,Cu,Pb,Mn,Mo,Ni,V,Zn,Ag,Sn和Hg等化合物。
五、酸雨的化学组成酸雨现象是大气化学过程和大气物理过程的综合效应。
酸雨中含有多种无机酸和有机酸,其中绝大部分是硫酸和硝酸,多数情况下以硫酸为主。
从污染源排放出来的SO2和NOx是形成酸雨的主要起始物,其形成过程为SO2+[O] →SO3SO3+H2O→H2SO4SO2+H2O→H2SO3H2SO3+[O] →H2SO4NO+[O] →NO22NO2+H2O→HNO3+HNO2式中:[O]——各种氧化剂六、影响酸雨形成的因素1、酸性污染物的排放及其转化条件2、大气中的NH33、颗粒物酸度及其缓冲能力4、天气形势的影响七、大气颗粒物的化学组成1、无机颗粒物(1)硫酸及硫酸盐颗粒物(2)硝酸及硝酸盐颗粒物2、有机颗粒物P126第四章农药的类型农药进入土壤的途径1)农药以颗粒剂形式施入土壤2)农药以种子处理剂进入土壤3)农药喷施被作物截获和散落到土壤4、农药在土壤环境中的扩散行为。
环境化学复习

第二章大气环境化学1、大气层的结构 Layers of the Atmosphere(英文)A、对流层troposphere对流层是大气的最底层,其厚度在赤道附近为16—18km;在中纬度地区为10—12km,两极附近为8—9km。
最显著特点是气温随海拔高度的增加而降低,大约每上升100m,温度降低0.6度。
另一个特点是密度大,大气总质量的3/4以上集中在对流层。
B、平流层stratosphere从对流层顶到海拔高度约为50km的大气层。
特点:①空气没有对流运动,平流运动占显著优势。
②空气比对流层稀薄得多,水汽、尘埃的含量甚微,很少出现天气现象③在高15—60km内,有约20km的一层臭氧层The Ozone Layer。
O2→O•+O•、O•+O2→O3、O3→O•+O2、O3+O•→2O2是臭氧光解的过程。
平流层温度随海拔高度的增加而增加。
C、中间层mesosphere从平流层顶到80km高度的大气层。
空气较稀薄,由于臭氧层消失,温度随海拔高度的增加而迅速降低。
D、热层(电离层)thermosphere从80km到约500km的大气层。
大气温度随海拔高度的增加而迅速增加。
2.大气中的主要污染物含硫化合物;含氮化合物;含碳化合物;含卤素化合物2、辐射逆温层Radiation inversion对流层大气的重要热源是来自地面的长波辐射,故离地面越近气温越高;离地面越远气温越低。
随高度升高气温的降低率称为大气垂直递减率:Γ=-dT/dz T—热力学温度K, z—高度当Γ=0 时,称为等温气层;当Γ<0 时,称为逆温气层。
这时气层稳定性强,对大气的垂直运动的发展起着阻碍作用。
根据逆温形成的过程不同,可分为两种:近地面层的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温;自由大气的逆温:乱流逆温、下沉逆温、锋面逆温气块在大气中的稳定度与大气垂直递减率(Γ)和干绝热垂直递减率(Γd)两者有关。
若Γ<Γd,表明大气是稳定的;若Γ>Γd,大气是不稳定;若Γ=Γd,大气处于平衡状态。
(完整word版)环境化学考试全套复习资料(戴树桂版)

第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占__80%—90%_。
2、环境化学研究的对象是: 环境污染物 .3、环境中污染物的迁移主要有机械、物理—化学和生物迁移三种方式.4、人为污染源可分为_工业_、__农业_、__交通_、和__生活_。
5、如按环境变化的性质划分,环境效应可分为环境物理、环境化学、环境生物三种。
二、选择题1、属于环境化学效应的是AA热岛效应B温室效应C土壤的盐碱化D噪声2、五十年代日本出现的痛痛病是由___A _污染水体后引起的A CdB HgC PbD As3、五十年代日本出现的水俣病是由_B__污染水体后引起的A CdB HgC PbD As三、问答题1、举例说明环境效应分为哪几类?2、举例简述污染物在环境各圈的迁移转化过程.第二章大气环境化学一、填空题1、写出下列物质的光离解反应方程式:(1)NO2+ hν NO + O(2)HNO2 + hν HO + NO 或HNO2 + hν H + NO2(3)HNO3 + hν HO + NO2(4)H2CO + hν H + HCO 或H2CO + hν H2+ CO (5)CH3X + hν CH3+ X2、大气中的NO2可以转化成HNO3、NO3和HNO3等物质。
3、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
4、乙烯在大气中与O3的反应机理如下:CH2(O3)CH2O3 + CH2 == CH2H2CO+H2COO5、大气颗粒物的去除与颗粒物的粒度、化学组成和性质有关,去除方式有干沉降和湿沉降两种。
6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln—1 + ClCl + O3O2 + ClOClO +O O2 + Cl7、当今世界上最引人瞩目的几个环境问题中的____温室效应_____、___臭氧层破坏_______、光化学烟雾___等是由大气污染所引起的.8、大气颗粒物的三模态为__爱根核模__、__积聚模___、_粗粒子模__.9、大气中最重要的自由基为HO__。
环境化学期末复习资料
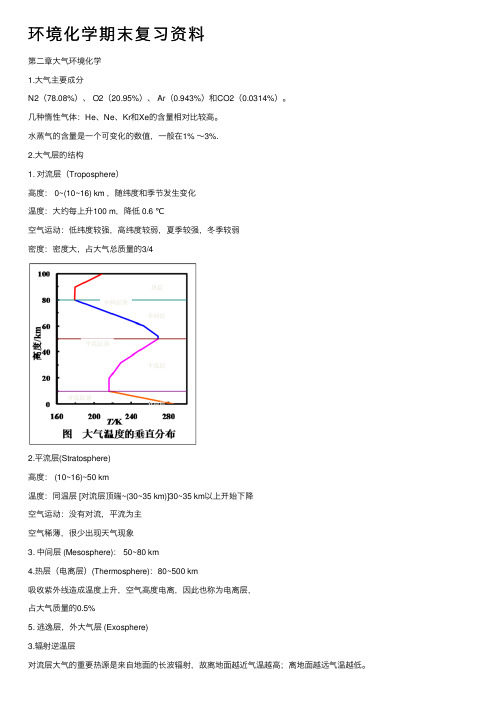
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。
《环境化学》综合复习资料

《环境化学》综合复习资料一、填空题⒈由可见光(400nm<λ<780nm)引起光化学离解的物质键能是(c=3.0×108m/s,h=6.626×10-34J.s/光量子)153.5kJ/mol < E < 299.3kJ/mol 。
⒉N2O 是无色气体,是清洁空气的组分,也是低层大气中含量最高的含氮化合物;矿物燃料燃烧过程中所产生的NO X以NO 为主,通常占90%以上。
植物摄取氮的主要形态是NH4+和NO3-。
⒊将下列物质:乙烯、正丁烯、正丁烷和丁二烯,按照光化学反应活性大小依次排列为丁二烯> 正丁烯> 乙烯> 正丁烷。
⒋大气颗粒物依照表面积与粒径分布的关系得到了三种不同类型的粒度模,分别是爱根核模、积聚模和粗粒子模,并用来解释大气颗粒物的来源与归宿。
其中爱根核模主要来源于燃烧过程所产生的一次颗粒物,以及气体分子通过化学反应均相成核而生成的二次颗粒物。
⒌由电介质促成的聚集称作凝聚,而由聚合物促成的聚集称作絮凝;根据DLVO理论把范德华吸引力和扩散双电层排斥力考虑为仅有的作用因素。
⒍水中有机污染物一般通过吸附作用、挥发作用、水解作用、光解作用和生物富集和生物降解等过程进行迁移转化。
⒎污染物由土壤向植物体内的迁移主要包括被动迁移和主动迁移两种方式;植物摄取氮的主要形态是NH4+和NO3-。
⒏土壤的固磷作用可通过化学沉淀、土壤固相表面交换吸附作用、闭蓄作用以及生物固定作用完成。
⒐砷的甲基化在厌氧菌作用下主要产生二甲基胂,而好氧的甲基化反应则产生三甲基胂;当土壤处于淹水还原状态时,砷对植物的危害增大;与无机砷相比,有机砷的毒性减少。
(后2个空填“增大”或“减少”)⒑表面活性剂的生物降解机理主要是烷基链上甲基氧化(或ω氧化)、 氧化、芳香族化合物的氧化和脱磺化过程。
二、单项选择题1.下列属于环境物理效应的是 A 。
A.温室效应B.土壤盐碱化C.光化学烟雾D.酸雨2.关于HO·说法不正确的是 B 。
环境化学复习资料

思考题:什么是环境化学?环境化学有哪些分支学科?大气环境化学:1、大气的主要层次是如何划分的,空气污染问题主要发生层是哪一层?臭氧主要集中在哪一层?2、大气中主要污染物有哪5类?含硫化合物含氮化合物含碳化合物含卤素化合物颗粒物3、硫燃烧产生二氧化硫的方程式?4、二氧化碳增加的危害?5、影响大气中污染物迁移的主要因素?风和大气湍流的影响天气形势和地理地势的影响6、什么是最大混合层高度?逆温较重时,最大混合层高度是增大还是减小?最大混合层高度的季节特征是什么?受热气块不断上升,直到其温度与周围温度相等,气块与周围大气达到中性平衡,气块停止上升。
这个高度就是最大混合高度减小冬季平均值最大混合层高度最小,夏初最大。
7、什么是光化学反应?分子,原子,自由基和离子吸收光子而发生的化学反应,分为初级和次级过程8、什么是自由基,自由基和离子有何区别?由于共价键均裂而生成带有未成对电子得碎片9、大气中重要自由基有哪些?HO·H02·R·烷基RO·烷氧基RO2·过氧烷基10、HO·在清洁大气和污染大气中的主要来源?清洁大气中O3的光解:O3+hv →O·+NO O·+H2O→2HO·11、大气中气态HNO3的主要来源是什么?12、什么是光化学烟雾,空气中有哪些污染物存在时易发生光化学烟雾?一般发生在什么时段?有何危害?13、什么是硫酸型烟雾污染?一般发生在哪个时段?光化学污染与硫酸型烟雾的主要区别?14、酸雨的概念?降水酸度主要来自那些物质?我国的酸雨主要是哪种类型?降水中对环境影响较大的离子有哪些?15、什么是大气颗粒物?什么是气溶胶粒子?水环境化学:1、简述天然水中的主要离子组成以及这些离子对天然水的酸度、碱度、硬度、矿化度的贡献?2、求氧在1.0130×105Pa、25℃,水中饱和溶解度?水在25℃时,蒸汽压0.03167×105Pa,干空气中氧含量为20.95%。
《环境化学》复习资料

《环境化学》复习资料1、过氧乙酰基硝酸酯(PAN)的生成1.乙醛光解产生乙酸基2.乙酰基与空气中O2结合形成过氧乙酰基.3.过氧乙酰基与No2化合生成PANps:PAN具有热不稳定性,遇热会分解而回到过氧乙.基和NO2,因而PAN的分解和合成之间存在着平衡.2、温室效应、气体概念大气中的co2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称为温室效应,能够引起温室效应的气体,称为温室气体.3、大气颗粒物消除方式并解释/(机制)①干沉降指颗粒物在重力作用下沉降或与其他物体碰撞后发生的沉降。
机制i通重力对颗粒物作用,使其降落在土、水等物体上 ii 粒径小于0.1um 靠布朗运动扩散相互碰撞成较大颗粒随大气湍流到地面去除。
②湿沉降.指通过阵雨,降雪等使颗粒物从大气中去除.机制 i 雨除:半径小于1um ii 冲刷:半径大于4um4、水中无机物的迁移转化方式:沉淀一溶解、氧化还原、配合作用、胶体形成、吸附一解吸.5、水环境中颗粒物的吸附作用.①表面吸附:胶体具有巨大的比表面和表面能..物理吸附②离子交换吸附:静电作用,胶体每吸附一部分阳离子,同时也放出等量其他阳离子,属于物理化学吸附,不受温度影响,可逆反应③专属吸附:除化学键外,尚有加强的憎水键、范德华力、氢键在起作用.在中性表面甚至在与吸附离子带相同电荷符号的表面也可吸~6、沉积物中重金属诱发适当的因素盐浓度升高。
氧化还原条件变化。
降低ph。
增加水中配合剂的含量7、腐殖质分为腐殖酸(不碱可酸)、富里酸(可可)、腐黑物(不不)8、光解过程分三类:直接光解、敏化光解、氧化反应敏化光解:水体中存在的天然物质腐殖质被阳光激发,又将其激发态的能量转移给化合物而导致的分解。
9、有机物在土壤中的吸着在在两种机理(只适用于非离子型农药)1.分配作用:即在水溶液中,土壤有机质对有机物的溶解作用.而且在溶质的整个溶解范围内,吸附等温线都是线性的,与表面吸附位无关,只与有机物的溶解度相关(因而放出热量小)2.吸附作用:即在非极性的有机溶剂中.即在非极性有机溶剂中,土壤、矿物质对有机物表面的吸附作用或干土壤矿物质对有机物…作用.10、生物降解作用→两种代谢模式区别①生长代谢:许多有毒物质可以像天然有机污染物作为微生物的生长基质:作为微生物唯碳源有滞后期②共代谢:某些有机污染物不能作为微生物的唯一碳源和能源,必须有另外的化合物存在提供微生物碳源和能源时,该有机物才能被降解.这是共代谢无滞后期11、重金属在土壤一植物体系中的迁移及其机制,从三大类(土壤、植物、重金属分析) 1.土壤理化性质:~PH越低,H+越多,活动性越强,加大了土壤中重金属向生物体迁移的数量.~土壤质地黏重,对重金属的吸附力强,降低了重金属的迁移转化能力~土壤中有机质含量高.对重金属吸附力强.降低了重金属转化能力.~还原条件下能力弱、氧化条件下能力强。
环境化学复习资料

1我国酸雨中关键性离子组分中,作为酸性指标的是SO42—-的是Ca2+ 和NH4+。
由于SO42-在阴离子中含量高,称为硫酸型酸雨。
酸雨形成必须具备的4个条件是:污染源条件、大气中的气态碱性物质浓度较低、大气中颗粒物的酸碱度及其缓冲能力和天气形式的影响。
酸性降水是指通过降水,如雨、雪雾冰雹等将大气中的酸性物质迁移到地面的过程,也称湿沉降。
确定酸雨pH界限的依据:国际上把pH为5.6作为判断酸雨的界限。
依据以下过程得出:在未污染大气中,可溶于水且含量比较大的酸性气体是CO2,所以只把CO2作为影响天然降水pH的因素,根据CO2的全球大气浓度330ml/m3与纯水的平衡,计算结果是pH=5.6。
2氧亏:水体中饱和溶解氧浓度与实际溶解氧浓度之差。
3热岛效应:因燃料的燃烧而放出大量热量,再加街道和建筑群辐射的热量,使城市气温高于周围地带4.有机污染物迁移转化的途径主要有吸附/分配/挥发/水解/光解作用、生物富集、生物降解作用.5. 对流层中,气温随高度增加而降低,每升高100 m,气温降低0.6(或0.65)℃,原因是大气主要依靠地面发射的长波辐射而增温,离地面越远气温越低。
大气层中的对流层,平均厚度为12km,仅是大气厚度的1%、但是大气总质量的75%,几乎所有的水蒸气集中在此层。
6 Whitby等人依据大气颗粒物的表面积与粒径的分布关系将大气颗粒物依粒径从小到大依次表示为爱根核模、积聚模和粗粒子模三种模结构7大气污染化学中所说的氮氧化合物通常主要指NO和NO2,用NOx表示,它们的主要人为来源是矿物燃料的燃烧,城市大气中的NOx主要来自汽车尾气和一些固定排放源。
与大气污染有直接关系的重要的光化学过程:氧分子和氮分子/臭氧/NO2/亚硝酸和硝酸/甲醛/卤代烃的光解及SO2对光的吸收8光化学烟雾:含有氮氧化物和碳氢化物等一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物,如O3、醛、PAN、H2O2,这种由一次污染和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾。
环境化学复习资料

名词解释1.环境化学研究的内容:(1)有害物质在环境介质中存在的浓度水平和形态;(2)潜在有害物质的来源,以及它们在个别环境介质中和不同介质间的环境化学行为;(3)有害物质对环境和生态系统以及人体健康产生效应的机制和风险性;(4)有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
2.土壤的活性酸度:由土壤溶液中的H+所引起的酸度,是土壤溶液的直接反应,又称有效酸度,通常用PH表示。
3.光化学烟雾:含有氮氧化物和碳氢化合物等一次污染物的大气,在阳光的照射下发生光化学反应而产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象称为光化学烟雾。
4.生物富集:生物通过非吞食方式,从周围环境(水、土壤、大气)蓄积某种元素或难降解的物质,是其在机体内浓度超过周围环境中浓度的现象。
5.绿色化学:就是研究利用一套原理在化学产品的设计,开发和加工生产过程中减少或消除使用或产生对人类健康和环境有害物质的科学。
6.土壤盐基饱和度:在土壤交换性阳离子中盐基离子所占的百分数称为土壤盐基饱和度。
简答题1.举例说明有毒有机污染物在环境中发生还原反应的主要类型。
1)可你脱氢酶加氢还原(方程式P330)2)硝基还原酶还原3)偶氮还原酶还原4)还原脱氯霉还原2.何谓温室效应和温室气体?大气中的CO2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称为温室效应。
温室气体指大气层中能够吸收和重新放出红外辐射的自然的和认为的气体。
大气中温室气体包括水气、二氧化碳(CO2)、甲烷(CH4)、氧化亚氮(N2O)、臭氧(O3)、氟利昂。
3.水中颗粒物聚集的方式有哪些?1)压缩双电层凝聚2)专属吸附凝聚3)胶体相互凝聚4)“边对面”絮凝5) 第二极小值絮凝6)聚合物粘结架桥絮凝7)无机高分子的絮凝8)絮团卷扫絮凝9)颗粒层吸附絮凝10) 生物絮凝4.土壤中重金属向植物迁移的主要方式及影响因素有哪些?(P280)土壤中重金属向植物迁移的主要方式为跨膜吸收,影响因素主要有土壤的理化性质(其主要包括pH、土壤质地、土壤的氧化还原电位、土壤中有机质的含量等。
环境化学复习资料(参考)

环境化学复习主要内容绪论部分1环境化学定义及主要研究内容:环境化学:是一门研究环境介质中化学物质存在、行为、效应以及减少或消除其环境影响的科学。
其以环境问题为研究对象、以解决环境问题为目标,是环境科学的核心组成部分。
环境化学主要内容包括:✓环境介质中有害化学物质的存在水平和形态;✓污染物来源及其在环境介质的环境化学行为;✓污染物生态效应和人类健康效应风险和产生机制;✓缓解和消除污染物环境影响以及预防污染物危害的方法和途径。
2现代环境化学研究的特点体现在以下几个方面:✓研究体系复杂;✓环境样品量微;✓从微观的原子、分子水平来阐明宏观的环境问题,从深层的机制去理解和解决问题。
;✓综合性强,涉及多学科领域3、污染物的迁移方式:机械迁移、物理-化学迁移、生物迁移4、迁移:污染物在环境中所发生的空间位移及其所引起的富集、分散和消失的过程。
5、转化:污染物在环境中通过物理、化学或生物的作用改变存在形态或转变为另一种物质的过程。
(物质性质的变化)大气环境化学1、影响大气污染物迁移的因素:(1)、风和湍流。
风:污染物向下风向的扩散;湍流:向各个方向的扩散;浓度梯度:质量向低浓度的扩散(2)、天气形势和地理地势产生的逆温现象:山谷风、海陆风、城郊风(3)、污染源本身的特性(温度、浓度、化学稳定性)2、大气中HO∙和HO2∙的来源:(1)HO∙的来源清洁大气:O3的光解是OH的重要来源:O3+hv →O ∙+O2O ∙+H2O →2HO ∙污染大气:HNO2+hv →HO ∙+ NOH2O2+hv →2HO ∙(2)HO2∙的来源:醛的光解,尤其是甲醛;H2CO +hv →H ∙+HCO ∙H ∙+O2+M →HO2∙+MHCO ∙+O2→HO2∙+CO任何光解过程只要产生H 或HCO 自由基的,都可以与O2结合而导致HO2。
亚硝酸酯的光解:CH3ONO +hv →CH3O ∙+NOCH3O ∙+O2 →HO2∙+H2COH2O2的光解:H2O2+hv →2HO ∙HO ∙+H2O2 →H2O ∙+HO23、(1)光化学烟雾:氮氧化物和碳氢化合物等一次污染物在阳光照射下发生光化学反应并产生二次污染物,此过程形成的混合烟雾污染现象即为光化学烟雾。
环境化学复习资料

环境化学复习资料12、13级环境化学讲课稿(十一)〈1次课〉环境化学总复习共讲了八章:第一章绪论,两节:环境化学、环境污染物。
主要概念:环境化学、环境污染物、优先污染物、迁移、转化。
知识要点:1.环境化学的任务主要研究有害化学物质在环境介质中的存在、化学特性、行为、效应及其控制的化学原理和方法。
内容主要涉及:有害物质在环境介质中存在的浓度水平和形态;潜在有害物质的来源,在个别环境介质中不同介质间的化学行为;有害物质对环境、生态系统、人体健康产生效应的机制和风险性;有害物质已造成影响的缓解、消除、防止产生危害的方法和途径。
2.特点有①从原子、分子水平研究宏观的环境现象与变化的化学机制、防治途径;②环境是一个多因素的开放体系,变量多、条件复杂,许多化学原理和方法不易直接运用;③化学污染物在环境中的含量很低;④样品组成比较复杂,会发生存在形态的变化;⑤污染物分布广泛,迁移转化速度快,在不同时空条件下有明显的动态变化。
3.发展动向有①环境分析化学突出联用仪器技术、连续自动分析和遥感分析;②与人生活和健康密切的酸沉降、臭氧耗损、全球气候变暖等重要问题;③污染控制发展绿色化学。
4.环境污染物的类别。
按人类社会活动不同功能产生的污染物分为工业、农业、交通运输、生活四方面。
按化学可分九类:元素、无机物、有机化合物和烃类、金属或准金属有机化合物、含氧有机化合物、有机氮化物、有机卤化物、有机硫化合物、有机磷化合物。
当前世界最关注的是持久性有机污染物,具有致突变、致癌变、致畸变作用化学污染物,环境内分泌干扰物。
第二章大气环境化学,四节:大气的组成及其主要污染物、大气中污染物的迁移、大气中污染物的转化、大气颗粒物。
主要概念:污染物在大气中的迁移、转化、逆温(辐射逆温、下沉逆温)、最大混合层高度、自由基、稳定性、活性、光化学反应、光化学烟雾、硫酸烟雾、温室效应、温室气体、大气颗粒物。
2知识要点:1.地表大气平均压力101.3kPa,相当于1.034g/cm的空气,随距地表高度的增加逐渐稀薄,质量的99.9%集中在50km以下。
环境化学复习资料

1.迁移转化的区别。
答:污染物在环境中所发生的空间位移及其所引起的富集、分散和消失的过程谓之污染物的迁移。
污染物在环境中的迁移主要有机械迁移,物理-化学迁移和生物迁移三种方式。
而污染物的转化是指污染物在环境中通过物理、化学或生物的作用改变存在形态或转变为另一种物质的过程。
污染物可通过蒸发、渗透、凝聚、吸附和放射性元素蜕变等物理过程实现转化;可通过光化学氧化、氧化还原、配位和螯合、水解等化学作用实现转化;也可通过生物的吸收、代谢等生物作用实现转化。
2.两种烟雾答:两种烟雾为光化学烟雾(洛杉矶型烟雾),硫酸烟雾型烟雾(伦敦型烟雾)光化学烟雾也称洛杉矶型烟雾含有氮氧化物和碳氢化合物等第一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物,这种由第一次污染物和第二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾.光化学烟雾形成的条件是大气中有氮氧化物和碳氢化合物存在,大气温度较低,而且有强的阳光照射.这样在大气中就会发生一系列复杂的化学反应,生成一些二次污染物。
光化学烟雾的污染物为:碳氢化合物、NO x、O3、PAN、醛类、汽油、煤气、石油等。
常出现在夏、秋两季,常出现在温度较高(24℃以上),湿度较低,日光强,臭氧浓度高的白天,对眼和呼吸道有强刺激作用,严重时会导致死亡。
对光化学烟雾有以下控制对策:(1)控制反应活性高的有机物的排放有机物反应活性表示某有机物反应生成产物的能力。
碳氢化合物是光化学烟雾形成过程中必不可少的重要组分。
因此,控制那些反应活性高的有机物的排放,能有效地控制光化学烟雾的形成和发展。
(2)控制臭氧的浓度硫酸烟雾型污染硫酸烟雾也称伦敦型烟雾,它主要是由于燃煤而排放出来的SO2,颗粒物以及由SO2氧化所形成的硫酸盐颗粒物所造成的大气污染现象。
这种污染多发生在冬季,气温较低(4℃以下),湿度较高、日光较弱和臭氧浓度较低的气象条件下。
对呼吸道有刺激作用,严重时可导致死亡。
硫酸烟雾型污染物,从化学上看是属于还原性混合物,故称此烟雾为还原烟雾。
环境化学-专业课复习资料

环境化学-专业课复习资料FpgFpg一、名词解释1、环境污染:指の是由于人为因素使环境构成或状态发生变化,使环境因素下降,从而扰乱和破坏了生态系统和人们の正常生活和生产条件。
2、环境污染物:指进入环境后,使环境の正常组成和性质发生直接或间接有害于人类の变化物质。
3、环境效应:自然生产或人类の生产和生活活动造成の环境污染或生态破坏从而导致环境系统の结构和功能发生变化。
4.、大气污染の汇:排放の大气污染物通过干沉降,湿沉降,地表吸收及化学反应等去除の途径或过程。
称大气污染の汇。
5、酸沉降:指大气中の酸性物质通过降水,如雨,雪,雾,冰雹等迁移到地表(湿沉降)或酸性物质在气流の作用下直接迁移到地表(干沉降)の过程。
6、自由基反应:凡是在反应中有自由基产生或者是由自由基诱发の反应均称之为~~~~~。
7、水体:在水体污染化学中,水体指河流、湖泊、沼泽、水库、地下水、冰川、海洋贮水の总称。
8、天然水の决定电位:若某个单体系の含量比其他体系高の多,则此时该单体系电位几乎等于混合复杂体系のPE ,称之为~~~。
9、分配系数(Kp ):当有机物在固~液俩相中の分配达到平衡时,有机化合物在固相沉积物和水中の含量之比。
Kp=Cs/Cw10、敏化光解(又称间接光解或敏化反应):既是一种化合物直接吸收光能并将过剩の能量转移给另一种化合物,导致后者发生分解反应の过程。
11、生长代谢:许多有机污染物可以像天然有机化合物那样作为微生物の基质,既可以为微生物の生长提供c 源,也可以提供能源,从而使其自身得以降解。
12、共代谢:有些有机污染物不能作为微生物唯一の碳源与能源,不能单独被分解,必须有另外の化合物存在为微生物提供碳源或能源时,该有机物才能被降解。
13、水体自净:指受污染の水体由于物理、化学、生物学等方面の作用,使污染物の浓度逐渐降低,经过一段时间后恢复到污染前の状态。
14、土壤环境背景值:指未受污染(特别是人为污染)影响下の土壤环境本身の化学元素或化学物质の组成及其基线含量(最初含量)。
环境化学重点复习资料

环境化学重点复习资料1、痛痛病是由Cd 镉污染水体后引起的。
2、水俣病是由Hg 汞污染水体后引起的。
3、米糠油事件是由多氯联苯引起的。
4、当今人类面临的环境问题有:大气污染、臭氧层破坏、酸雨侵蚀、水资源污染、土地荒漠化、绿色屏障锐减、垃圾大量积存、物种濒危、人口激增、温室效应、海洋污染。
5、世界环境日6月5日。
6、2014世界环境日主题提高你的呼声,而不是海平面。
7、2014世界环境日中国主题是向污染宣战。
8、天然水中的主要离子为Ca2+、Na+、Mg2+、K+、Cl-、SO42- 、HCO3- 、NO3-。
9、河水中阴、阳离子的含量顺序Ca2+<Na+<Mg2+,HC03- <S042- <Cl-。
10、腐殖质中:不溶于NaOH的部分称胡敏酸,可溶于NaOH但不溶于酸的部分称为腐植酸,既溶于碱又溶于酸的部分称为富里酸。
11、沉积物中的腐殖质可根据其在碱和酸溶液中的溶解度将其划分为三类腐植酸、胡敏酸、富里酸。
12、一般情况下,当水体DO<5mg/L,各类浮游生物不能生存;DO<4.0 mg/L时,鱼类会死亡;DO<2mg/L,水体发臭。
13、碱度:是指水中能与强酸发生中和作用的全部物质,亦即能接受质子H+的物质总量。
(组成物质)强碱、弱碱、强碱弱酸盐。
总碱度=[HCO3-]+2[CO32-]+[OH-]-[H+] 酚酞碱度=[CO32-]+[OH-]-[H2CO3*]-[H+]苛性碱度=[OH-]-[HCO3-]-2[H2CO3*]-[H+]14、酸度:是指水中能与强碱发生中和反应的全部物质,亦即放出H+或经过水解产生H+的物质的总量。
(组成物质)强酸、弱酸、强酸弱碱盐。
总酸度=[H+] +[HCO3-]+2[H2CO3*]-[OH-] CO2酸度=[H+]+[H2CO3*]-[CO32-]-[OH-] 无机酸度=[H+]-[HCO3-]-2[CO32-]-[OH-]15、在碳酸水体中加入碳酸盐,该水体:总酸度不变,总碱度增大,无机酸度减少,酚酞碱度增大,CO2酸度减少,苛性碱度不变。
环境化学复习.doc

1•环境问题是在工业化过程中产生的,具体原因包括污染物排放和过度开发__________________ ;2.可持续发展的战略思想是经济、社会和环境保护协调发展,其核心思想是:经济发展不能超过资源和环境的 __________ ;3在大气对流层中污染物易随空气发生垂直对流运动,在平流层中污染物易随地球自转发生水平运动;4.逆温层不利于污染物的传输。
5.当r<rd吋,大气处于稳定状态。
6.大气中重要自由基产牛于光离解。
7. _____________________________________________ 由若干个苯环稠和在一起的化合物称为____________________________________________ 多环芳炷____________ ;8 •在有氮氧化物和碳氢化合物存在于大气中时可能发生光化学烟雾,该反应机制为: 自由基引发、口由基转化和增殖、自由基氧化NO 、链终止;9.平流层中的臭氧层能够吸收紫外线从而保护生物,维持生态平衡;10.洛杉矶烟雾也称为 ____________ o11•伦敦烟雾也称为_________ 硫酸型烟雾____________ o12.当降水的pH值_________ 时,称为酸雨。
13.可吸入粒子是指粒径< 10um 的颗粒物;14.PAN是指大气中的过氧乙酰硝酸酯污染物;15.水中异养牛物利用自养牛物产牛的有机物为能源及材料构成牛命体;16 •导致痛痛病的污染物是__________ Cd ____________ ;17.导致水俣病的污染物是___________ o18.腐殖质分子中含有多元环状结构,其上联接有・OH -COOH -CHO等官能团;19.非离子型有机物可通过溶解作用分配到土壤有机质中;20.pH值在4・5至8. 3之间时,水中碳酸的主要形态分别为____________ 、H2CO3 _________ 、HCO/ ___________ ;21.水中无机污染物的迁移转化方式有吸附、凝聚絮凝、溶解沉淀、配 __________ 、氧化还原;22.水中有机污染物的迁移转化方式有 ________ 、水解、光解_________ 、挥发、生物降解;23.pE值低表示环境为有机碳性环境。
环境化学复习资料

环境化学复习资料《环境化学》综合复习资料一、填空题1.污染物在环境中的迁移主要有、和三种方式。
2. 、、以及,是目前世界上公认的主要环境问题。
3.大气的温度随地面的高度而变化,这构成了大气分层的基础。
大气圈按高度自下而上分成、、和。
4.大气颗粒物有三种重要的表面性质:、和。
大气颗粒物在雨滴形成的过程就属。
5.研究酸雨必须进行雨水样品的化学分析,通常分析的主要阳离子有;阴离子有。
6.用一个强碱标准溶液滴水样,以酚酞作为指示剂,此时所得的结果称为,其化学反应计量式为。
7.水中颗粒物的吸附作用可分为、和;其中属于物理吸附的是。
8.当向天然水体中加入有机物后可得到一氧下垂曲线。
碳元素在清洁区和腐败区内的分解产物分别是和。
9.当向天然水体中加入有机物后可得到一氧下垂曲线,它把河流分为相应的几个区段,在清洁区内决定电位物质是;在腐败区内决定电位物质是。
10.腐殖质的组成非常复杂,根据它在溶液中的溶解度不同划分为、和三类。
11.天然水P E越小,提供电子倾向,水中污染物还原态相对浓度。
12.有机污染物一般通过、、、和等过程进行迁移转化。
13.典型土壤随深度呈现不同的层次,是生物最活跃的一层,有机质大部分在这一层,金属离子和粘土颗粒在此层中被淋溶得最显著。
14.岩石的化学风化分为三个历程,即、和。
15.汞及其化合物的挥发程度与化合物的形态及、、等因素密切相关。
无机汞化合物挥发度最大的是,最小的是。
16.砷的甲基化在厌氧菌作用下主要产生,在水溶液中继续氧化成为;而汞的甲基化在厌氧菌作用下主要产生;与无机砷相比,有机砷的毒性。
17. 是金属甲基化过程中甲基基团的重要生物来源。
砷的甲基化在厌氧菌作用下主要产生,在水溶液中继续氧化成为;而好氧的甲基化反应则产生,在水溶液中继续氧化成为,它可与巯基发生的应。
18.日本西部地区发生的米糠油中毒事件是由引起的,而该物质目前唯一的处理方法是。
痛痛病是由于长期食用含量高的稻米引起的中毒。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、绪论(一)选择题1、五十年代日本出现的痛痛病是由______污染水体后引起的。
a) Cd b)Hg c)Pb d)As2、五十年代日本出现的水俣病是由______污染水体后引起的。
a) Cd b)Hg c)Pb d)As3、黄河含沙量达______kg/m3,为世界之最。
a) 13 b)73 c)27 d)374、联合国已将每年的______定为“世界水日”,提醒人们注意水资源的开发、管理和保护。
a) 4.22 b)3.28 c)3.22d)6.22(二)填空题1、世界环境日为__6月5日______。
2、人为污染源可分为_工业污染源_、_农业污染源_、___交通运输污染源__、和__生活污染源__。
3、Cu、Zn共存时,往往能产生____________作用。
4、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占________。
5、环境中污染物的迁移主要有富集、分散和消失三种方式。
6一般情况下Se对Hg2+能产生作用。
(三)问答题1、当前人类生存面临的主要环境问题有哪些?全球气候变暖、臭氧层的耗损与破坏、生物多样性减少、酸雨蔓延、森林锐减、土地荒漠化、大气污染、水污染、海洋污染、危险性废物越境转移、二、大气污染化学(一)选择题1、酸雨是指pH ______的雨、雪或其它形式的降水。
a) <6.0 b) <7.0 c) <5.6 d) <5.02、辐射一定时间产生的______量可以衡量光化学烟雾的严重程度。
a) O3 b) NO2c) 碳氢化合物d) SO23、大气逆温现象主要出现在______。
a) 寒冷的夜间 b) 多云的冬季c) 寒冷而晴朗的冬天d) 寒冷而晴朗的夜间4、大气中微粒浓度为50 μg/m3时,大气能见度约为_____Km。
a) 15 b) 12 c) 24 d)405、大气中还原态气体(如H2S)主要被______氧化。
a) O2b) OH c) O3d)高价金属离子6、当天顶角Z______为时,到达地面的太阳光最强。
a) 90o b) 0o c) 45o d) 180o7、根据Whittby的三模态模型,粒径小于_____um的粒子称为爱根核模。
a) 0.05 b) 0.1 c) 1 d) 28、SO2的液相氧化有多种途径,其中______的效果最好。
a) O3氧化b) 催化氧化c) H2O2氧化d) 非催化氧化9、催化剂对SO2氧化有影响,下列四种物质中______的催化效果最好。
a) NaCl b) CuSO4c) MnCl2d) MnSO410、气溶胶中粒径________um的颗粒,称为飘尘。
a) >10 b) <5 c) >15 d) <10(二)填空题1、当今世界上最引人瞩目的几个环境问题_________、__________、__________等是由大气污染所引起的。
2、许多大气污染事件都与逆温现象有关,逆温可分为________、________、________。
3、气团的稳定性与________和________两个因素有关。
4、SO2的催化氧化速度与________、________和________有关。
5、大气中最重要的自由基为。
6、燃烧过程中NO的生成量主要与________和________有关。
7、能引起温室效应的气体主要有______、______、______、______。
8、CFC-11和Halon1211的分子式分别为_________和_________。
9、大气的扩散能力主要受__________和__________的影响。
10、按污染成因分,气溶胶可分为__________和__________。
11、根据温度垂直分布可将大气圈分为对流层、平流层、________、热层和逃逸层。
12、伦敦烟雾事件是由_____________ 和_____________引起的。
13、大气中CH4主要来自________、________、_________的排放。
14、富集因子法可以推断气溶胶污染源,如(EF)地壳>10,则表示待查元素i________。
15、降水中主要阴离子有______、______、______、______。
16、对流层和平流层中较为重要的反应有_______________、_________________、________________。
(三)问答题1、试述酸雨的主要成分、成因及危害,写出有关化学反应式。
2、试述光化学烟雾的特征、形成条件,请以CH3CH=CHCH3为例,参考下面的光化学烟雾形成示意图,写出光化学烟雾形成的有关反应式。
3、为什么排放到大气中的CFCs能破坏臭氧层,写出有关化学反应式。
4、简要叙述用富集因子法判断气溶胶粒子污染来源的基本原理、方法(步骤)。
5、试述大气中CO2等气体浓度上升,引起温室效应的原因。
6、试述酸雨的主要成分、形成机理;阐述重庆地区酸雨频率高,而北京酸雨频率低的原因。
7、试比较伦敦烟雾和洛杉矶光化学烟雾的区别。
三、水污染化学(一)选择题1、海水中Hg2+主要以_______的形式存在。
a) Hg(OH)2 , HgCl2b) HgCl2 , HgCl3-c) HgCl42-d) HgCl3- , HgCl42-2、某一氧化还原体系的标准电极电位为0.80,其pE o为______。
a) 13.50 b) 13.35 c) 13.05 d) 12.803、一般情况下,当水体DO______时,鱼类会死亡。
a) >8.0mg/L b) <4.0 mg/L c) >0 d) >4.0 mg/L4、若水体的pE值高,有利于下列_______ 组在水体中迁移。
a) Fe、Mn b) Cr、Fe c) Cr、Mn d) Cr、V5、当前最简单,也较流行的是将金属划分为溶解态和颗粒态,溶解态是能通过______um孔径滤膜的部分。
a) 0.54 b) 0.22 c) 0.45 d) 0.506、河水中阴、阳离子的含量顺序为______。
a) Na+>Mg2+>Ca2+HCO3->SO42->Cl-b) Ca2+>Na+>Mg2+HCO3->SO42->Cl-c) Na+>Ca2+>Mg2+ Cl->HCO3->SO42-d) Na+>Mg2+>Ca2+ Cl->SO42->HCO3-7、某一氧化还原体系的标准电极电位为0.771,其pE o为______。
a) 13.50 b) 13.35 c) 13.05 d) 12.808、某一水体的BOD20为100 ppm,其BOD5约为__________。
a)40 b) 50 c) 35 d) 709、水体中溶解氧对石油降解影响很大,估计1升油类氧化需消耗______m3海水中的溶解氧。
a) 200 b) 400 c) 600 d) 50010、下列各种形态的汞化物,毒性最大的是______。
a) Hg(CH3)2b) HgO c) Hg d) Hg2Cl2(二)填空题1、环境中某一重金属的毒性与其_______ 、___________ 和_____________ 有关。
2、腐殖质中不溶于NaOH的部分称为___________,可溶于NaOH的部分称为___________,既溶于碱又溶于酸的部分称为_________。
3、一般认为,但浓度较高时,金属离子与腐殖质的反应以________为主,当金属离子浓度低时,则以__________为主。
4、正常水体中其决定电位作用的物质是___________。
5、20℃时,需氧有机物经过____天,才能完成第一阶段的生化氧化。
6、当水体pH处于中性或碱性条件下,汞的甲基化产物是________。
7、_______、________和_________常衡量水体富营养化的指标。
8、亨利常数大于________atm•mol-1•m-3的有机物,在浅而流速较快的河流中有显著的解吸速率。
9、Cu-Zn金属对能还原六六六,在反应中Zn起______作用,而Cu则起_______作用。
10、水体的自净作用可分为________、__________和__________.11、碳水化合物生化水解的最终产物为_________,在氧气充足时,能进一步分解为________。
12、影响胶体微粒聚沉的因素有_________、___________、_________、水体pH及流动状况,带相反电荷颗粒间的相互作用。
13、当水体pH处于偏酸性条件下,汞的甲基化产物主要是_________。
14、溶解态金属的形态可通过_____________、_______________两种途径进行研究。
15、适用于水体颗粒物对污染物吸附的等温式有_______________、________________两种方程。
其中_______________可求饱和吸附量16、有机物的辛醇-水分配系数常用___________表示。
17、_________、_________、__________常用作水体自净的指标。
(三)问答题1、重金属污染的特点是什么?举例说明水体中金属迁移转化的影响因素。
2、某冶炼厂含铅废水经处理后排入河水中,测得排污口附近河水中铅的含量为0.4~0.5mg/L,而在下游500米处河水中铅含量仅为3~4μg/L,请解释其原因。
3、试述水体中有机污染物的迁移转化途径。
4、根据Streeter—phelps定律,计算20℃和29℃时,水体中需氧有机物分解掉50%所需的时间(已知,k20℃=0.1);计算结果说明什么?5、根据Streeter—phelps定律,计算14℃时,水体中需氧有机物分解掉50%、70%所需的时间(已知,k20℃=0.1)。
6、试述水体中汞甲基化的途径及影响因素,写出有关反应式。
7、为什么水体pH较低时,鱼体内积累的甲基汞含量较高?8、试解释用BOD5、COD Cr评价水环境质量时会掩盖有毒有害有机物污染的风险。
四、土壤污染化学(一)选择题1、腐植质胶体是非晶态的无定形物质,有巨大的比表面,其范围为________。
a) 350-900m2/g b) 650-800m2/g c) 100-200m2/g d) 15-30m2/g(二)填空题1、在旱地土壤中,镉的主要存在形式是___________。
2、土壤是由气、液、固三相组成的,其中固相可分为________、________ ,两者占土壤总量的________。
3、重金属在土壤--植物系统中的迁移过程与重金属的________、及土壤的类型、_________、_________有关。
